-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPOZDNÍ FUNKČNÍ A MORFOLOGICKÉ NÁLEZY PO OTRAVĚ METYLALKOHOLEM.
Autoři: J. Lešták 1; P. Diblík 2; S. Zacharov 3; M. Fůs 1; M. Kynčl 1; Jaroslav Tintěra 1; J.. Heissigerová 2
Působiště autorů: Oční klinika JL Fakulty biomedicínského inženýrství ČVUT v Praze 1; Oční klinika Lékařské fakulty Univerzity Karlovy a Všeobecné Fakultní nemocnice v Praze 2; Toxikologické informační středisko, Klinika pracovního lékařství, 1. LF UK a VFN v Praze 3
Vyšlo v časopise: Čes. a slov. Oftal., 76, 2020, No. 6, p. 278-285
Kategorie: Kazuistika
doi: https://doi.org/10.31348/2020/39Souhrn
Cíle: Cílem práce bylo stanovit morfologický a funkční nález ve zrakové dráze u nemocného po prodělané otravě metanolem.
Kazuistika a metody vyšetření: U pacienta (muž, 38 let), který prodělal otravu metylalkoholem před osmi lety (2012), byly kromě standardního očního vyšetření provedeny následující testy: vyšetření zorného pole – centrální test 0–30° na perimetru Medmont M700, analýze vrstvy nervových vláken (RNFL), Ganglion cell complex (GCC) a peripapilární vessel density (VD) využitím přístroje Avanti RTVue XR, dále pak vyšetření pattern elektroretinogramu (PERG) a pattern zrakových vyvolaných odpovědí (PVEP) - dle metodiky ISCEV na přístroji Roland Consult instrument) a vyšetření magnetickou rezonanci (MRI) na přístroji Philips Achieva Dstream 3 T.
Výsledky: Největší změny byly prokázány v RNFL a VD. PERG rovněž poukázalo na poškození axonů gangliových buněk sítnice. Na levém oku, ve srovnání s kontralaterálním (odpovědi v normě), byl zaznamenán i pokles kmitu N35-P50 a P50-N95, VEP byly oboustranně výrazně snížené, vlevo až nevýbavné. Prodloužení latence P100 nebylo zaznamenáno. Funkční MR prokázala oboustranné výrazné snížení voxelové aktivity s větším poklesem vlevo. Na MR byly postmalatické změny dorzálních částí putamen. Šíře zrakového nervu i chiasmatu byla normální.
Závěr: Výsledky prokázali asymetrické poškození hlavně RNFL i korových ústředí v mozku. Velké patologické změny jsme registrovali ve VD, které jsou nejspíše zodpovědné i za prohlubování exkavace a další úbytek nervových vláken gangliových buněk sítnice, které zatím v literatuře nebyly popsány. Dle těchto nálezů můžeme uvažovat o přímém poškození nervových struktur a cév toxickými produkty metabolizmu metanolu v akutním stadiu. V dalším období pak jejich reparačními procesy.
Klíčová slova:
otrava metanolem – zorné pole – OCT – vessel density – elektrofyziologická vyšetření – magnetická rezonance
Úvod
Otrava metanolem je život ohrožující stav, který u přeživších způsobuje toxickou neuropatii zrakového nervu s možnými dlouhodobými zrakovými následky. Že se nejedná o vzácnou příhodu v zemi, kde není zakázáno požívání alkoholických nápojů je zřejmé. Proto nalézáme na toto téma práce i v našem periodiku. První pochází od Votočkové, která u 44 letého pacienta 24 hodin po požití metylalkoholu popisuje ztuhlé zornice, které byly ve střední mydriáze, přední segment byl jinak v normě. Na pozadí setřelé hranice papil a sotva znatelně zamlžené krajiny kolem zadního pólu. Vizus byl prsty na 3 m. Co se týče ostatních orgánů popisuje v dotčené práci drobné hemorhagie též na meningách a mozku, který byl edematózní. Cituje také práci Picka a Bielschovského, kteří v roce 1912 podali první popisy změn ve vrstvě gangliových buněk sítnice. Proti těmto změnám jsou léze optického nervu jen nepatrné, trakty a další dráha již poškozena není [1].
Druhá práce je od Cigánka a spol., kteří popsali zrakové funkce u 18 vojáků přeživších otravu metylalkoholem. U devíti byly změny v zorných polích, i přes hodnoty 1,0 zrakové ostrosti. U těchto nemocných byla provedena fluorescenční angiografie. V arteriovenózní fázi bylo patrné prosakování kontrastní látky z okrajů terče zrakového nervu i v jeho okolí, které přetrvávalo do venózní fáze. Cévy byly při přestupu přes okraj terče lehce nadzdviženy. Elektroretinografické nálezy na zábleskový podnět prokázaly pokles vlny a ve 100 % a vlny b ve 33 %. Ve zrakově vyvolaných odpovědích (VEP) na reverzační podnět byly změny latence jen ve 22 %. V patogenezi změn autoři uvažují o možné cirkulační poruše [2].
Další práce je rovněž od domácích autorů, ale její výsledky byly zveřejněny v zahraničním periodiku. Popisují 42 nemocných, které sledovali od 5 do 50 měsíců od otravy metylalkoholem. Změny ve vrstvě nervových vláken (RNFL) pozorovali ve 33 % případů a jejich progresi pak zaznamenali ve 24 %. Změny latence P1 kmitu VEP zaznamenali u 18/42 pravých očích a u 21/42 levých očích. Abnormální amplituda N1-P1 byla pozorována u 10/42. Signifikantní asociace byla přítomna mezi chronickou neurodegenerací sítnice, progredující ztrátou zrakových funkcí a nekrotickými lézemi v mozku. Zlepšení konduktivity zrakového nervu bylo pozorováno u více než 80 % pacientů, avšak amplituda evokovaného potenciálu měla tendenci k dalšímu poklesu v průběhu 4 let sledování [3].
Kazuistika a metody vyšetření
V květnu 2020 byl vyšetřen 38 letý muž, který byl v září 2012 léčen pro akutní otravu metanolem po požití přibližně 250 ml pančovaného rumu. Doba konzumace nápoje trvala 2-3 hodiny, alkohol byl konzumován bez jídla, pacient pil pouze kolu. Po 16 hodinách se objevily první příznaky otravy (kolísavá porucha vízu, pacient udává, že „všechno bylo bílé, barvy skoro nerozlišoval“). První kontakt s lékařem proběhl za 36 hodin po konzumaci alkoholu. Pacient byl vyšetřen na interním a neurologickém odděleních, kromě poruchy vízu udával bolesti v celém těle, břišní křeče, bolest hlavy a dušnost. Při vyšetření byl agitovaný, neklidný, proto byl aplikován apaurin. Provedeno CT mozku s negativním nálezem. Výsledky toxikologického vyšetření krevního séra prokázaly těžkou otravu metanolem: koncentrace metanolu v séru 2779 mg/l (toxická koncentrace 200 mg/l), koncentrace kyseliny mravenčí 898 mg/l, etanol v séru nedetekovatelný. Pacient byl převezen na oddělení intenzivní péče, během převozu dostal 80 ml 40% roztoku etanolu aplikovaného přes nasogastrickou sondu. Pro prohlubující se poruchu vědomí byla provedena orotracheální intubace a zavedena umělá plicní ventilace, byl podán midazolam 10 mg a succinylcholin 100 mg i.v. Při příjmu na oddělení byl již v kómatu (Glasgow Coma Scale 3 body), hemodynamicky stabilní (MAP nad 80 mmHg bez noradrenalinu). Vstupní laboratorní hodnoty odpovídaly stavu těžké metabolické acidózy (pH arteriální krve 6,71, bikarbonát 4,3 mM/l, deficit bází 38 mM/l, aniontové okno 55 mM/l, sérový laktát 11,4 mM/l), stresové hyperglykemie (18,4 mM/l) a akutnímu renálnímu selhání (kreatinin v séru – 175 uM/l). Pacientovi byl podán bikarbonát ke korekci acidémie (celkem 950 ml 8,4% roztoku NaHCO3), Leukovorin k substituci folátu a aplikován antidotum fomepizol (inhibitor ADH) v dávce 1 g každé 4 hodiny (celkově 5 g). Za hodinu po příjmu na oddělení byl pacient napojen na intermitentní hemodialýzu s maximální rychlostí průtoků (rychlost průtoku dialyzátu 30 l/hod., rychlost průtoku krve 250 ml/min), která trvala 10 hodin. Po dialýze byla kontrolní hladina kyseliny mravenčí negativní, koncentrace metanolu již 233 mg/l, po normalizaci vnitřního prostředí pokračovala další terapie etanolem nitrožilně. V průběhu hospitalizace na oddělení intenzivní péče došlo k rozvoji aspirační pneumonie vpravo, proto byl nasazen Augmentin a metronidazol i.v. Kultivačně byl zjištěn haemophilus influenzae masivně a provedena změna medikace na ampicilin a sulbactam. Další komplikací v průběhu léčby byl rozvoj deliria na kombinaci neuroleptik. Celková doba hospitalizace na oddělení intenzivní péče byla 6 dní, po které byl pacient přeložen na standardní interní oddělení. Při hospitalizaci na interním oddělení udával pacient poruchu vízu charakteru tmavé skvrny při pohledu na tváře, černé fleky v zorném poli, zamlžené vidění na obou očích, více vlevo, pálení obou očí. Závěr očního konzilia zněl: subjektivní poruchy vízu, více vlevo, vizus do dálky vpravo v normě, vlevo snížen o 1 řádek, vizus do blízka bez korekce v normě bilaterálně. Perimetr nelze hodnotit pro nízkou validitu vyšetření. Nález na sítnici v rámci fyziologie bilaterálně. Po 7 denní hospitalizaci na interním oddělení byl pacient propuštěn do domácího léčení.
Anamnesticky pacient udával v minulosti abusus marihuany a pervitinu, kouření a abusus alkoholu (přibližně 1 litr rumu týdně). Z vedlejších onemocnění měl pacient arteriální hypertenzi na terapii beta-blokátorem, smíšenou hyperlipidemii (koncentrace cholesterolu 6,1 mM/l, lipidů 4,8 mM/l), hyperurikemii (koncentrace kyseliny močové 474 uM/l), chronickou hepatopatii zřejmě alkoholické etiologie (GGT 2,94 µkat/l). Pacient byl dále dispenzarizován a vyšetřován v pravidelných intervalech v letech 2013-2018.
Výsledky následného vyšetření za 10 měsíců po otravě: V: 1,0 naturálně, J.č. 1 naturálně. Paralelní, hybnost volná, izokorie, optická media čirá, na fundu papily temporálně bledé a ohraničené. Sítnice bez patologického nálezu. Globální RNFL pokleslo od prvního vyšetření oboustranně o 3 µm. Vyšetření PVEP vykázalo po stimulaci levého oka mírné prodloužení latence P100 na 118 ms. Vpravo byl nález v normě.
Na magnetické rezonanci mozku měl pacient symetrická ložiska v putamen zvýšeného signálu v T2W, sníženého v T1W beze změn po aplikaci KL, bez známek krvácení.
Za 4 roky po otravě byla zraková ostrost 1,0 naturálně. Na pozadí vpravo je terč zrakového nervu temporálně bledý, vlevo je bledý. RNFL se od posledního vyšetření nemění. Progresi neprokazuje ani perimetrické vyšetření. Zrakové evokované potenciály se normalizovaly. Vyšetření MR již na 3T přístroji odhalila, že nekróza v oblasti putamen je částečně hemoragická.
Za 6 let po otravě byl V: 1,0 naturálně. Na pozadí jsou papily oboustranně bledé s c/d= 0,5. V perimetru a ani v RNFL nezjišťujeme progresi. PVEP prokazuje vpravo normální nález, vlevo nález hraniční.
Kontrolní MR vyšetření mozku potvrzuje symetrické léze putamen oboustranně, které odpovídají nekróze, mírné známky hemoragie. Ve srovnání s minulým vyšetřením není patrná progrese rozsahu nálezu.
Pacient měl normální sérové koncentrace vitaminů B12 v průběhu celé doby sledování (234 – 264 ng/l), vitaminu B1 (48 – 73 µg/l), a TSH (2,8-4,7 mIU/l).
Kromě očního jsme provedli i vyšetření barvocitu pomocí Ishiharových pseudoisochromatických tabulek (Kanehara and co. Japan). Zorné pole jsme vyšetřili rychlým prahovým programem v rozsahu 0-30 stupňú na přístroji Medmont M700 (Medmont International Pty Ltd Australia). Vrstvu vláken (RNFL), Ganglion cell complex (GCC) a peripapilární vessel density (VD) na přístroji Avanti RTVue XR (Optovue, USA). Vyšetření pattern elektroretinogramu (PERG) a pattern zrakově vyvolaných odpovědí (PVEP) bylo provedeno podle metodiky ISCEV na přístroji Roland Consult instrument (SRN). Rozdílem od doporučené metodiky ISCEV byla vzdálenost oka od stimulační plochy (místo doporučených 50 cm byla v našem případě 30 cm).
Strukturální a funkční MR byla provedeno na systému Philips Achieva DStream 3 Tesla Verze sw. 5.6.11. Vyšetření funkční magnetickou rezonancí (fMR) proběhlo dle naší metodiky [4].
Výsledky vyšetření
Zevní oční nález byl normální, včetně zornicových reakcí. Přední segment obou očí i optická média byla v normě. Na pozadí byly terče zrakového nervu atrofické s ostrými hranicemi a exkavací 0,7 respektive 0,8. Centrální krajina byla v normě, bez foveolárního reflexu. Nález na cévách byl normální, stejně tak i zbytek sítnice. Vizus: 1,0 bez korekce. J.č. 1,0 rovněž bez korekce oboustranně. Nitrooční tlak (NOT) 18,9 respektive 18,5 mmHg (dle Ocular Response Analyser). Achromatopsie. Zorné pole s výraznými defekty v centrální části, hlavně vlevo se během doby (od 10/2012 do 5/2020) nezměnilo. Poslední nálezy ukazuje obrázek 1. OCTA prokázalo výrazné snížení VD jak v celém obraze (39,5 %, resp. 35,5 %) tak peripapilárně (40,2 % respektive 34,4 %). Pokles jsme zaznamenali peripapilárně i v RNFL (59 µm respektive 51 µm). Viz obrázek 2. Podobné snížení RNFL a GCC v makule ukazuje i obrázek 3.
Obr. 1. Perimetr v rozsahu 0-30 stupňů. Nahoře pravé, dole levé zorné pole 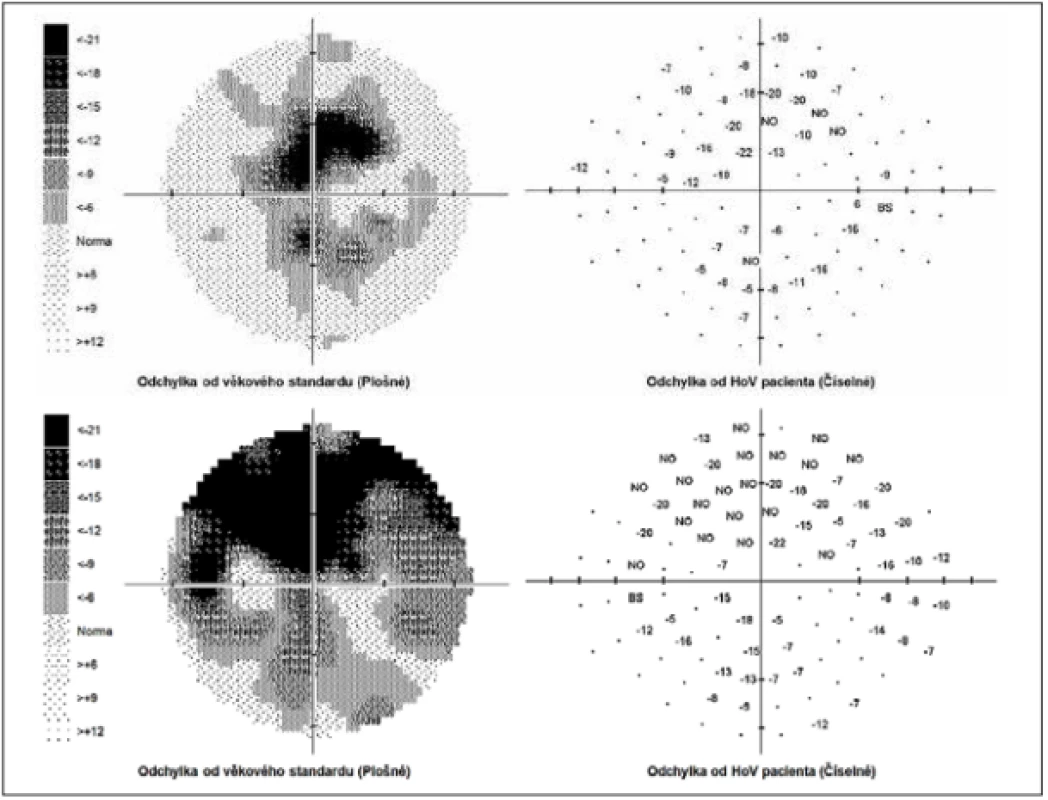
Obr. 2. Tloušťka vrstvy nervových vláken (RNFL) a vessel density (VD). Nahoře pravé oko, dole levé oko. 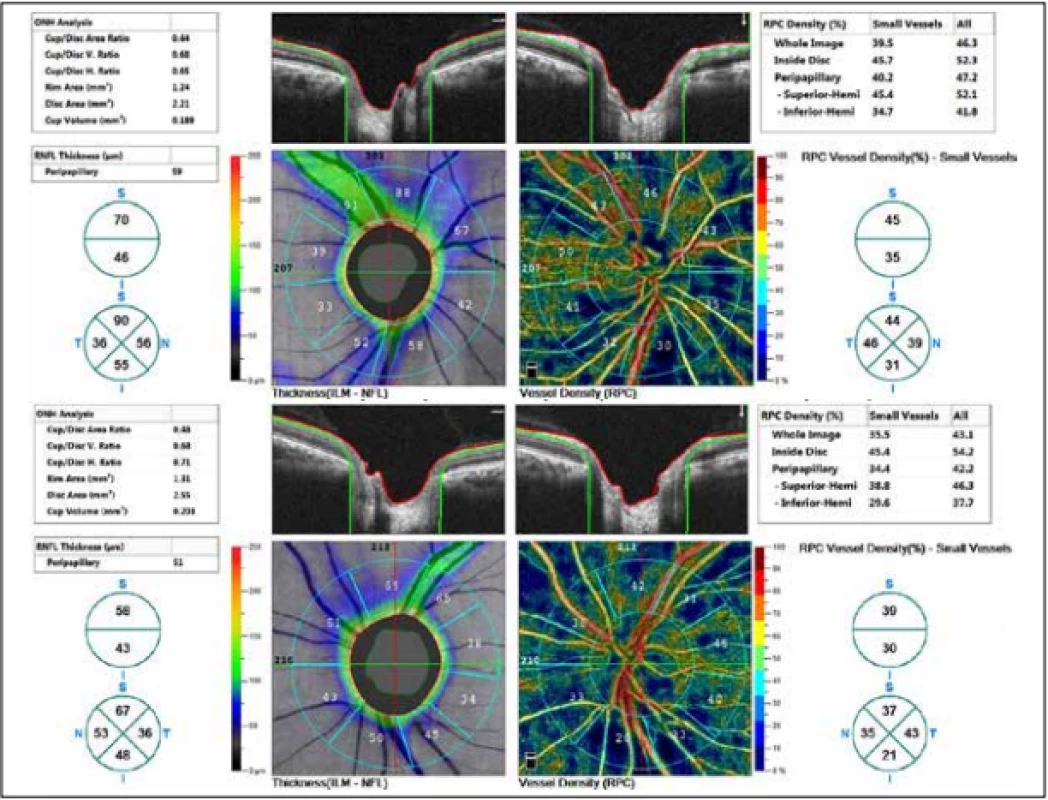
Obr. 3. Ganglion cell komplex (GCC), vrstva nervových vláken (RNFL) a hlava terče zrakového nervu (ONH). Nahoře pravé oko, dole levé oko. 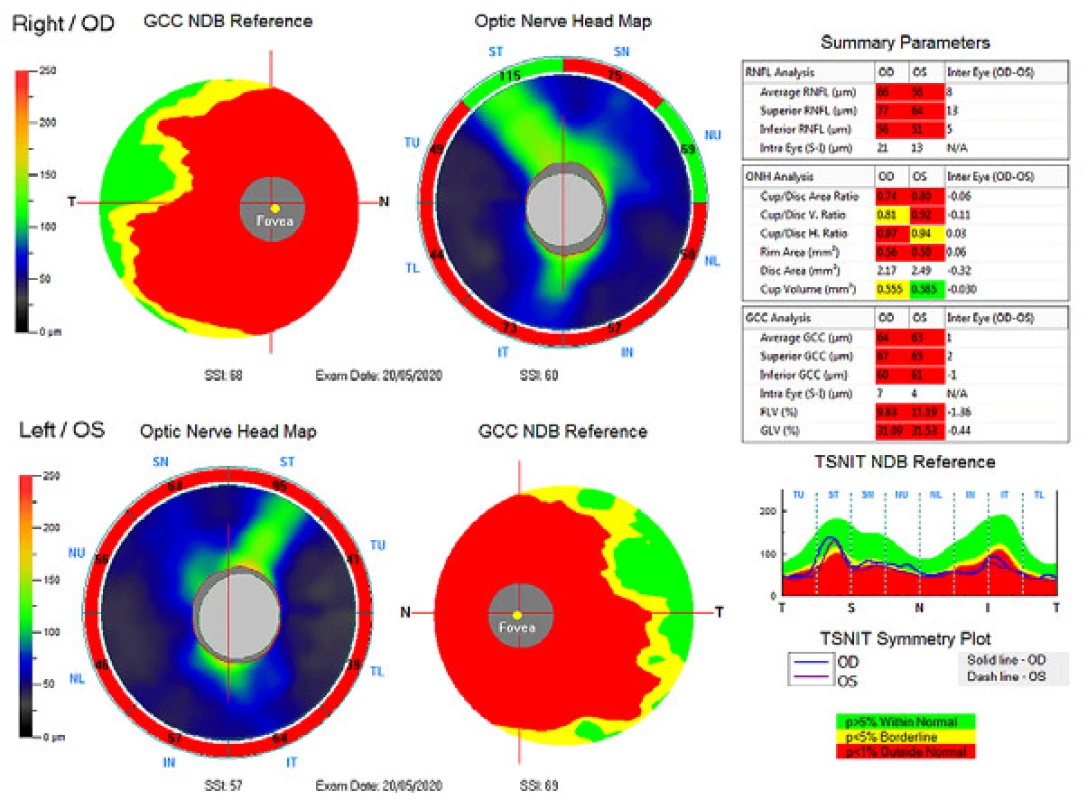
Elektrofyziologické vyšetření – PERG prokázalo vpravo normální odpověď ale prodloužení latence N95 na 100,7 ms, vlevo normální odpověď ale ve srovnání s pravým okem sníženou o 40 %. Podobně jako vpravo bylo i na levém oku prodloužení latence N95 na 100,7 ms. Amplitudy PVEP byly oboustranně výrazně sníženy, přičemž větší pokles byl na levé straně. Latence kmitu P100 nebyla prodloužena.
Vyšetření magnetickou rezonancí prokázalo postmalatické změny dorzálních částí putamen oboustranně s malou perifokální gliózou jako změny charakteru toxické leukoencefalopatie (v rámci změn po otravě metylalkoholem). Bez známek intrakraniálního krvácení, bez depozit hemosiedrinu v mozkové tkáni, bez obrazu akutní ischemie mozku. Šíře optických nervů a pochev optických nervů laterolaterálně 1 cm za dorzální konturou bulbu v mezích normy. Šíře nucleus geniculatum laterale oboustranně s lehkým zmenšením rozměrů oproti normě. Šíře chiasmatu v normě, bez zřetelné signálové alterace, bez expanze [5].
Funkční MR jsme zjistili po stimulaci pravého oka 465 voxelů, levého 388 (normální hodnoty po stimulaci pravého oka 7508+-2018, levého 7340+-2775) [6].
Diskuse
Metanol patří mezi látky s vysokou toxicitou intermediárních metabolitů. U člověka a primátů je metanol oxidován zejména v játrech enzymem alkoholdehydrogenázou (ADH) na formaldehyd a dále aldehyddehydrogenázou (ALDH) na kyselinu mravenčí [7,8,9,10,11].
Formaldehyd se v krvi neakumuluje, protože jeho konverze na kyselinu mravenčí je velmi rychlá, s poločasem 1-2 minuty [12,13].
Kyselina mravenčí inhibuje cytochrom c oxidázu v mitochondriích (Ki~6 mmol/l) a tím vyvolává buněčnou hypoxii doprovázenou nahromaděním laktátu a poklesem ATP v buňkách [14,15,16,17,18].
Kumulace kyseliny mravenčí a později i kyseliny mléčné vede k rozvoji těžké metabolické acidózy [19,20,21].
Existuje přímá korelace mezi koncentrací kyseliny mravenčí v séru a úmrtností na otravu metanolem [22]. Nejcitlivější k cytotoxickému účinku mravenčanu jsou neurony oční sítnice, axony zrakového nervu a neurony bazálních ganglií mozku [23].
Eells a spol. zjistili, že koncentrace kyseliny mravenčí v očních tkaních potkanů, zejména v sítnici a ve sklivci, byla o 50 % vyšší než v mozku z důvodu pomalejší oxidace [24,25]. Rozvoj těžké metabolické acidózy potencuje účinek kyseliny mravenčí na centrální nervový systém (CNS), protože usnadňuje její přechod hematoencefalickou bariérou, což vede k edému mozku a poškození (nekrózy, krvácení) v oblasti putamen, nucleus pallidus a subkortikální bílé hmoty [26,27,28,29].
Poruchy vízu se projevují mlhavým viděním, poruchou barevného vidění, popřípadě světelnými záblesky a pocity oslnění, nebo naopak „zhasínáním“ a skotomy [30,31,32,33,34].
Na očním pozadí bývá přítomna hyperémie a edém v oblasti terče zrakového nervu [35,36,37].
Hyperémie může být výsledkem i vasodilatačního efektu metanolu a to nejen na úrovni sítnice, ale i mozku [38].
Retinální gangliové buňky a jejich axony, které tvoří zrakový nerv, jsou velmi citlivé k histotoxické hypoxii způsobené inhibicí mitochondriální cytochrom c oxidázy, protože mají vyšší energetické nároky a relativně nižší počet mitochondrií [39,40,41].
Nicméně, biochemické a morfologické změny způsobené toxickým účinkem kyseliny mravenčí jsou přítomny i v jiných typech buněk: ve fotoreceptorech, v Müllerových buňkách aj. [42,43,44].
Příznaky postižení zraku u pacientů s akutní otravou metanolem se projevují s určitou latencí 8-48 hodin. Doba latence závisí na množství požitého metanolu, poměru etanolu a metanolu v toxickém nápoji a jiných faktorech [45,46,47].
V řadě případů dochází v průběhu několika týdnů k plnému uzdravení, k normalizaci nálezu na očním pozadí i k normalizaci zrakových funkcí [35,48,49].
Avšak dlouhodobé poškození zraku může přetrvávat u 10-30 % přeživších osob [37,46,50,51,52,53,54].
I když náš pacient měl zrakovou ostrost v normě, zaznamenali jsme u něj těžké změny v perimetru, které byly od prvního vyšetření v roce 2012 téměř beze změn a achromatopsii.
Dlouhodobé následky otravy na zrakový analyzátor zahrnují zúžení zorného pole, skotomy, snížení ostrosti zraku a kontrastní citlivosti, poruchy barvocitu až kompletní slepotu.
V retrospektivní studii Galvez-Ruiz et al. [46,50], z 50 pacientů vyšetřených po odeznění akutní optické neuropatie, byla u 22 osob přítomna exkavace terče zrakového nervu. Všichni pacienti ze souboru měli známky atrofie očního nervu a defekty zorného pole. Autoři studie dospěli k závěru, že exkavace po akutní otravě metanolem může mít vyšší prevalenci, než se předpokládalo. Exkavace terče je projevem toxického účinku kyseliny mravenčí na axony a gliální buňky v prelaminární, laminární a retrolaminární oblasti.
I náš pacient měl osm let od akutního poškození exkavace terčů 0,7, resp. 0,8. Její prohlubování není jen výsledkem akutního přímého úbytku axonů gangliových buněk sítnice [55], ale dlouhodobým působením glutamátu na VD. Dokladem toho není jen výrazný úbytek VD u našeho pacienta ale i experimentální průkaz vlivu glutamátu na kapiláry sítnice [56]. Poškození myelinového obalu zrakového nervu bylo popsáno ve studii Sharpe (1982) u čtyř pacientů zemřelých na akutní otravu metanolem. Sharpe pozoroval demyelinizaci retrolaminární časti zrakového nervu bez přerušení axonů [41].
Při akutní toxické neuropatii vede otok myelinového obalu ke kompresi axonů a poruše konduktivity nebo úplnému bloku [57].
Akutní demyelinizace zrakového nervu způsobená přímým toxickým účinkem kyseliny mravenčí může vést k axonální degeneraci v důsledku ztráty trofické podpory ze strany myelinu a přerušení normální interakce axonů s myelinem [41,57].
Poškození myelinového obalu axonů zrakového nervu mohlo proběhnout jen v akutním stadiu otravy. Prodloužení latence P100 zrakového evokovaného potenciálu bylo zaznamenáno při kontrolním vyšetření pacienta za 10 měsíců po dimisi z nemocnice. V následujících letech, došlo k normalizaci nálezu. Při vyšetření v roce 2020, jsme v naší kasuistice již nezaznamenali žádné známky demyelinizace bílé hmoty mozku.
Vliv metanolu na sítnicové potenciály zkoumali u zvířecího modelu Lee a spol. a Garner a spol., kteří zjistili na ERG nižší amplitudu vlny b [58,59].
Podobné změny v ERG zaznamenali Cigánek a spol. i u 9 nemocných po požití metanolu, kteří měli změny v zorných polích. Zjistili ve 30 % snížení amplitudy vlny b. Vlna a byla snížena ve 100 % případů [2].
U našeho pacienta PERG vyšetření prokázalo na levém oku nižší odpověď fotoreceptorů, středních sítnicových struktur i gangliových buněk (ve srovnání s pravým okem byl pokles o 40 %). Vpravo byl nález normální. Oboustranně byla ale prodloužena latence kmitu N95 (na 102, resp. 107 ms), která ukazuje na poškození axonů gangliových buněk sítnice.
Prodloužená latence VEP odráží stupeň demyelinizace jednotlivých axonů nervus opticus (rozsah demyelinizovaných oblastí) a následující zkrácení latence poskytuje informace o procesu remyelinizace [60].
U našeho pacienta byly amplitudy VEP vpravo sníženy o 50 %, vlevo byla odpověď téměř nevýbavná. Prodloužení latence P100 bylo zaznamenáno pouze při prvním vyšetření po dimisi, v následujících letech a v době posledního vyšetření jsme tuto alteraci již nezaznamenali.
Akutní toxická neuropatie nervus opticus může vést k axonální degeneraci, jak v důsledku přímého účinku kyseliny mravenčí, tak i nepřímo, v důsledku myelinoklastického efektu [41,45].
Poškození RNFL jsme prokázali jak peripapilárně (pomocí OCTA), tak na papile, ale i v oblasti makuly. Což bylo verifikováno výrazným poklesem amplitud VEP a prodlouženou latencí N95 PERG.
V případě akutní toxické neuropatie způsobené kyselinou mravenčí však histotoxická hypoxie může indukovat spuštění řady biochemických a geneticky podmíněných mechanismů vedoucích po odeznění akutní otravy k neuronální apoptóze [61].
Alteraci gangliových buněk sítnice jsme u našeho nemocného prokázali pomocí PERG jen na levém oku. Výrazné snížení voxelové aktivity zrakové kůry si vysvětlujeme hlavně přímým toxickým poškozením metanolu.
Bilaterální nekróza bazálních ganglií, zejména putamen, a hemoragické léze subkortikální bílé hmoty jsou typickými nálezy na CT nebo MRI mozku u pacientů přeživších těžkou otravu metanolem [62,63,64,65,66,67].
Mezi jiné, měně časté nálezy, patří nekrotické změny a hemoragické léze v globus pallidus, nucleus caudatus, v thalamu, mozečku a mozkovém kmeni [68,69,70,71,72,73].
I náš pacient měl při vyšetření magnetickou rezonancí postmalatické změny dorzálních částí putamen oboustranně.
Výsledky fMR u nemocných po otravě metanolem nejsou z literatury dostupné. Náš pacient vykazoval výrazně nižší voxelovou aktivitu (v závislosti na funkčních i morfologických změnách) na zrakové paradigma. Nejspíše došlo k poškození gangliových buněk i zrakové kůry metabolity metanolu. Menší průměr CGL ukazuje na alteraci i této subkortikální zrakové struktury.
Závěr
V této kazuistice jsme u pacienta po osmi letech od požití metanolu nezjistili v mozku pomocí MR žádné změny typické pro demyelinizační onemocnění. Nezjistili jsme ani změny ve velikosti (šíři) zrakových nervů či chiasmatu. Zmenšené bylo CGL. Výrazný pokles voxelové aktivity jsme zaznamenali při vyšetření fMR v závislosti na změnách v zorných polích. Elektroretinografické vyšetření (PERG) prokázalo normální nález na obou očích. Na levém oku ale byla odpověď 60 % pravého oka. Odpověď axonů gangliových buněk byla oboustranně alterována. VEP neprokázaly demyelinizaci zrakové dráhy, ale její těžké poškození.
Velké patologické změny jsme registrovali ve VD, které jsou nejspíše zodpovědné i za prohlubování exkavace a další úbytek nervových vláken gangliových buněk sítnice, které zatím v literatuře nebyly popsány.
Dle těchto nálezů můžeme uvažovat o přímém poškození nervových struktur a cév toxickými produkty metabolizmu metanolu v akutním stadiu. V dalším období pak jejich reparačními procesy [74].
Čestné prohlášení
Autoři prohlašují, že vznik a téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou. Práce nebyla zadána jinému časopisu ani jinde otištěna.
Do redakce doručeno dne: 23.7.2020
Přijato k publikaci dne: 26.10.2020
doc. MUDr. Ján Lešták, CSc, MSc, MBA, LLA, DBA, FEBO, FAOG
Oční klinika JL Fakulty biomedicínského inženýrství ČVUT v Praze, V Hůrkách 1296/10, 158 00 Praha 5 – Nové Butovice
tel: +420 602 336 770
e-mail: lestak@seznam.cz
Zdroje
1. Votočková J. Novější terapie otrav methyalkoholem. [Newer therapies for methyl alcohol poisoning]. Cesk. Oftalmol. 1954;10 : 404-409. Czech.
2. Cigánek L, Vladyková J, Svěrák J, Peregrin J, Ernest J. Oční nálezy při hromadné otravě metylalkoholem. [Ocular findings in a mass poisoning with methyl alcohol]. Cesk Oftalmol. 1986;42 : 56-65. Czech.
3. Nurieva O, Diblik P, Kuthan P. et al. Progressive chronic retinal axonal loss following acute methanol-induced optic neuropathy: four-year prospective cohort study. Am J Ophthalmol. 2018;191 : 100-115.
4. Lešták J, Tintěra J. Funkční magnetická rezonance u vybraných očních onemocnění. [Functional Magnetic Resonance Imaging in Selected Eye Diseases]. Cesk Slov Oftalmol. 2015;71 : 127-133. Czech.
5. Lešták J, Kynčl M, Svatá Z, Rozsíval P. Lateral Geniculate Nucleus in Hypertensive and Normotensive Glaucoma. J Clin Exp Ophthalmol. 2013;4 : 269. doi:10.4172/2155-9570.1000269)
6. Lestak J, Tintera J, Rozsival P. Fmri and Ocular Dominance. IJSR – International journal of scientific research. 2014;3 : 293-296.
7. Eells JT, McMartin KE, Black K, Virayotha V, Tisdell RH, Tephly TR. Formaldehyde poisoning. Rapid metabolism to formic acid. JAMA. 1981a;246 : 1237-1238.
8. Eells JT, Makar AB, Noker PE, Tephly TR. Methanol poisoning and formate oxidation in nitrous oxide-treated rats. J Pharmacol Exp Ther. 1981b;217 : 57-61.
9. Jacobsen D, Jansen H, Wiik-Larsen E, Bredesen JE, Halvorsen S. Studies on Methanol Poisoning. Acta Med Scand. 1982;212 : 5-10.
10. McMartin KE, Makar AB, Martin G, Palese M, Tephly TR. Methanol poisoning. I. The role of formic acid in the development of metabolic acidosis in the monkey and the reversal by 4-methylpyrazole. Biochem Med. 1975;13 : 319-333.
11. McMartin KE, Martinamat G, Makar AB, Tephly TR. Methanol poisoning. Role of formate metabolism in monkey. J Pharmacol Exp Ther. 1977;201 : 564-572.
12. McMartin KE, Martin-Amat G, Noker PE, Tephly TR. Lack of a role for formaldehyde in methanol poisoning in the monkey. Biochem Pharmacol. 1979;28 : 645-649.
13. McMartin KE, Ambre JJ, Tephly TR. Methanol poisoning in human subjects. Role for formic acid accumulation in the metabolic acidosis. Am J Med. 1980;68 : 414-418.
14. Cook RJ, Champion KM, Giometti CS. Methanol toxicity and formate oxidation in NEUT2 mice. Arch Biochem Biophys. 2001;393 : 192-198.
15. Erecinska M, Wilson DF. Inhibitors of cytochrome c oxidase. Pharmacol Ther. 1980;8 : 1-20.
16. Seme MT, Summerfelt P, Neitz J, Eells JT, Henry MM. Differential recovery of retinal function after mitochondrial inhibition by methanol intoxication. Invest Ophthalmol Vis Sci. 2001;42 : 834-841.
17. Drangsholt E, Vangstad M, Zakharov S, Hovda KE, Jacobsen D. The hypothesis of circulus hypoxicus and its clinical relevance in patients with methanol poisoning - an observational study of 35 patients. Basic Clin Pharmacol Toxicol. 2018;123 : 749-755.
18. Tong TG. The alcohols. Crit Care Q. 1982;4 : 75-85.
19. Aabakken L, Johansen KS, Rydningen EB, Bredesen JE, Ovrebo S, Jacobsen D. Osmolal and anion gaps in patients admitted to an emergency medical department. Hum Exp Toxicol. 1994;13 : 131-134.
20. Smith SR, Smith SJ, Buckley BM. Combined formate and lactate acidosis in methanol poisoning. Lancet. 1981;2 : 1295-1296.
21. Smith I, Kumar P, Molloy S, et al. Base excess and lactate as prognostic indicators for patients admitted to intensive care. Intensive Care Med. 2001;27 : 74-83.
22. Brent J, McMartin K, Phillips S, Aaron C, Kulig K. Fomepizole for the treatment of methanol poisoning. N Engl J Med. 2001;344 : 424–429.
23. Sivilotti ML, Burns MJ, Aaron CK, McMartin KE, Brent J. Reversal of severe methanol-induced visual impairment: no evidence of retinal toxicity due to fomepizole. J Toxicol Clin Toxicol. 2001;39 : 627-631.
24. Eells JT, Salzman MM, Lewandowski MF, Murray TG. Formate-induced alterations in retinal function in methanol-intoxicated rats. Toxicol Appl Pharmacol. 1996;140 : 58-69.
25. Eells JT, Henry MM, Lewandowski MF, Seme MT, Murray TG. Development and characterization of a rodent model of methanol-induced retinal and optic nerve toxicity. Neurotoxicology. 2000;21 : 321-330.
26. Blanco M, Casado R, Vázquez F, Pumar JM. CT and MR imaging findings in methanol intoxication. Am J Neuroradiol. 2006;27 : 452-454.
27. Feany, MB, Anthony DC, Frosch MP, Zane W, De Girolami U. August 2000: two cases with necrosis and hemorrhage in the putamen and white matter. Brain Pathol. 2001;11 : 121-122.
28. Gaul HP, Wallace CJ, Auer RN, Fong TC. MR findings in methanol intoxication. Am J Neuroradiol. 1995;16 : 1783-1786.
29. Zakharov S, Kurcova I, Navratil T, Salek T, Pelclova D. Is the measurement of serum formate concentration useful in the diagnostics of acute methanol poisoning? A prospective study of 38 patients. Basic Clin Pharmacol Toxicol. 2015;116 : 445–451.
30. Hovda KE, Hunderi OH, Tafjord AB, Dunlop O, Rudberg N, Jacobsen D. Methanol outbreak in Norway 2002–2004: epidemiology, clinical features and prognostic signs. J Intern Med. 2005a;258 : 181-190.
31. Hovda KE, Urdal P, Jacobsen D. Increased serum formate in the diagnosis of methanol poisoning. J Anal Toxicol. 2005b;29 : 586-588.
32. Coulter CV, Isbister GK, Duffull SB. The pharmacokinetics of methanol in the presence of ethanol: a case study. Clin Pharmacokinet. 2011a;50 : 245-251.
33. Coulter CV, Farquhar SE, McSherry CM, Isbister GK, Duffull SB. Methanol and ethylene glycol acute poisonings - predictors of mortality. Clin Toxicol. 2011b;49 : 900-906.
34. Kraut JA. Diagnosis of toxic alcohols: limitations of present methods. Clin Toxicol. 2015; 53 : 589-595.
35. Desai T, Sudhalkar A, Vyas U, Khamar B. Methanol poisoning: predictors of visual outcomes. JAMA Ophthalmol. 2013;131 : 358-364.
36. Hassanian-Moghaddam H, Pajoumand A, Dadgar SM, Shadnia Sh. Prognostic factors in methanol poisoning. Hum Exp Toxicol. 2007;26 : 583-586.
37. Sanaei-Zadeh H. Is high-dose intravenous steroid effective on preserving vision in acute methanol poisoning? Optom Vis Sci. 2012;89 : 244.
38. Hayasaka Y, Hayasaka S, Nagaki Y. Ocular Changes After Intravitreal Injection of Methanol, Formaldehyde, or Formate in Rabbits. Pharmacol Toxicol. 2001;89 : 74-78.
39. Carelli V, Ross-Cisneros FN, Sadun AA. Mitochondrial dysfunction as a cause of optic neuropathies. Prog Retin Eye Res. 2004;23 : 53-89.
40. Nicholls P. The effect of formate on cytochrome aa3 and on electron transport in the intact respiratory chain. Biochim Biophys Acta. 1976;430 : 13-29.
41. Sharpe JA, Hostovsky M, Bilbao JM, Rewcastle NB. Methanol optic neuropathy - a histopathological study. Neurology. 1982;32 : 1093-1100.
42. Garner CD, Lee EW, Louisferdinand RT. Muller cell involvement in methanol-induced retinal toxicity. Toxicol Appl Pharmacol. 1995;130 : 101-107.
43. Seme MT, Summerfelt P, Henry MM, Neitz J, Eells JT. Formate-induced inhibition of photoreceptor function in methanol intoxication. J Pharmacol Exp Ther. 1999;289 : 361-370.
44. Treichel JL, Henry MA, Skumatz CMB, Eells JT, Burke JM. Formate, the toxic metabolite of methanol, in cultured ocular cells. Neurotoxicology. 2003;24 : 825-834.
45. Barceloux DG, Bond GR, Krenzelok EP, Cooper H, Vale JA. American Academy of Clinical Toxicology practice guidelines on the treatment of methanol poisoning. J Toxicol Clin Toxicol, 2002; 40(4): 415-446.
46. Galvez-Ruiz A, Elkhamary SM, Asghar N, Bosley TM. Visual and neurologic sequelae of methanol poisoning in Saudi Arabia. Saudi Med J. 2015a;36 : 568-574.
47. Zakharov S, Pelclova D, Urban P, et al. Long-term visual damage after acute methanol poisonings: longitudinal cross-sectional study in 50 patients. Clinical Toxicology. 2015;53 : 884-892.
48. Sanaei-Zadeh H, Zamani N, Shadnia S. Outcomes of visual disturbances after methanol poisoning. Clin Toxicol. 2011;49 : 102-107.
49. Sharma R, Marasini S, Sharma AK, Shrestha JK, Nepal BP. Methanol poisoning: ocular and neurological manifestations. Optom Vis Sci. 2012;89 : 178-182.
50. Galvez-Ruiz A, Elkhamary SM, Asghar N, Bosley TM. Cupping of the optic disk after methanol poisoning. Br J Ophthalmol. 2015b;99 : 1220-1223.
51. Hovda KE, Hunderi OH, Tafjord AB, Dunlop O, Rudberg N, Jacobsen D. Methanol outbreak in Norway 2002–2004: epidemiology, clinical features and prognostic signs. J Intern Med. 2005a;258 : 181-190.
52. Naraqi S, Dethlefs RF, Slobodniuk RA, Sairere JS. An outbreak of acute methyl alcohol intoxication. Aust N Z J Med. 1979;9 : 65-68.
53. Paasma R, Hovda KE, Jacobsen D. Methanol poisoning and long term sequelae - a six years follow-up after a large methanol outbreak. BMC Clin Pharmacol. 2009;9 : 5; doi: 10.1186/1472-6904-9-5.
54. Sanaei-Zadeh H. Is high-dose intravenous steroid effective on preserving vision in acute methanol poisoning? Optom Vis Sci. 2012;89 : 244.
55. Hayreh SS. Pathogenesis of cupping of the optic disc. Br J Ophthalmol. 1974;58 : 863-876.
56. Tsuda Y, Nakahara T, Ueda K, Mori A, Sakamoto K, Ishii K: Effect of nafamostat on N-methyl-D-aspartate-induced retinal neuronal and capillary degeneration in rats. Biol Pharm Bull. 2012;35 : 2209-2213.
57. Hantson P, de Tourtchaninoff M, Simoens G, et al. Evoked potentials investigation of visual dysfunction after methanol poisoning. Crit Care Med. 1999;27 : 2707-2715.
58. Lee EW, Garner CD, Terzo TS. A Rat Model Manifesting Methanol-Induced Visual Dysfunction Suitable for Both Acute and Long-Term Exposure Studies. Toxicol Appl Pharmacol. 1994;128 : 199-206.
59. Garner CD, Lee EW, Terzo TS, Louis-Ferdinand RT. Role of Retinal Metabolism in Methanol-Induced Retinal Toxicity. J Toxicol Environ Health. 1995;44 : 43-56.doi: 10.1080/15287399509531942.
60. Jones SJ, Brusa A. Neurophysiological evidence for long-term repair of MS lesions: implications for axon protection. J Neurol Sci. 2003;206 : 193–198.
61. Banasiak KJ, Xia Y, Haddad GG. Mechanisms underlying hypoxia-induced neuronal apoptosis. Prog Neurobiol. 2000;62 : 215-249.
62. Jain N, Himanshu D, Verma SP, Parihar A. Methanol poisoning: characteristic MRI findings. Ann Saudi Med. 2013;33 : 68-69.
63. Halavaara J, Valanne L, Setala K. Neuroimaging supports the clinical diagnosis of metanol poisoning. Neuroradiology. 2002 : 44 : 924-928.
64. Taheri MS, Moghaddam HH, Moharamzad Y, Dadgari S, Nahvi V. The value of brain CT findings in acute methanol toxicity. Eur J Radiol. 2010;73 : 211-214.
65. Thirunavukkarasu S, Nair PP, Wadwekar V. Acute bilateral putaminal haemorrhagic necrosis in methanol poisoning. BMJ Case Rep. 2013 Nov 8. doi: 10.1136/bcr-2013-201026.
66. Vaneckova M, Zakharov S, Klempir J, et al. Methanol Intoxication on Magnetic Resonance Imaging. Cesk Slov Neurol N. 2014;77/110 : 235-239.
67. Vaneckova M, Zakharov S, Klempir J, et al. Imaging findings after methanol intoxication (cohort of 46 patients). Neuro Endocrinol Letters. 2015;36 : 737–744.
68. Bhatia R, Kumar M, Garg A, Nanda A. Putaminal necrosis due to methanol toxicity. Pract Neurol. 2008 : 8:386-387.
69. Chiò A, Herrero Hernandez E, Mora G, Valentini C, Discalzi G, Pira E. Motor neuron disease and optic neuropathy after acute exposure to a methanol-containing solvent mixture. Amyotroph Lateral Scler Other Motor Neuron Disord. 2004;5 : 188-191.
70. Karayel F, Turan AA, Sav A, Pakis I, Akyildiz EU, Ersoy G. Methanol intoxication: pathological changes of central nervous system (17 cases). Am J Forensic Med Pathol. 2010; 31 : 34-36.
71. Lee SM, Moon JM, Chun BJ, Song KH. Unusual intracranial hemorrhage in severe methanol intoxication. Am J Emerg Med. 2015;33 : 1717.e1-2.
72. Sefidbakht S, Rasekhi AR, Kamali K, et al. Methanol poisoning: acute MR and CT findings in nine patients. Neuroradiology. 2007 : 49 : 427-435.
73. Server A, Hovda KE, Nakstad PH, Jacobsen D, Dullerud R, Haakonsen M. Conventional and diffusion-weighted MRI in the evaluation of methanol poisoning. Acta Radiol. 2003;44 : 691-695.
74. Lešták J. Neurotransmission in visual analyser and bionic eye. Cesk Slov Oftalmol. 2020;76: in press
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2020 Číslo 6- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- Stillova choroba: vzácné a závažné systémové onemocnění
- Citikolin jako užitečný pomocník v léčbě diabetické retinopatie a glaukomu
- Jak působí benzalkonium chlorid a prostaglandiny na epitelové buňky Meibomových žláz?
- Diagnostický algoritmus při podezření na syndrom periodické horečky
-
Všechny články tohoto čísla
- BIOPSIE UVEÁLNÍHO MELANOMU PŘEHLED
- ZRAKOVÉ FUNKCE PO IMPLANTACI MONOFOKÁLNÍCH NITROOČNÍCH ČOČEK ACRYSOF
- Evaluation of Patients Presenting to the Ophthalmology Department of a Tertiary Hospital for Nonemergency Reasons During the Covid-19 Pandemic
- ZMENENÉ ZRAKOVÉ FUNKCIE A KVALITA ŽIVOTA U SENIOROV S DIABETICKOU RETINOPATIOU
- MŮŽE OTEVŘENÉ FORAMEN OVALE OVLIVNIT ZRAKOVÉ FUNKCE?
- POZDNÍ FUNKČNÍ A MORFOLOGICKÉ NÁLEZY PO OTRAVĚ METYLALKOHOLEM.
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- MŮŽE OTEVŘENÉ FORAMEN OVALE OVLIVNIT ZRAKOVÉ FUNKCE?
- ZRAKOVÉ FUNKCE PO IMPLANTACI MONOFOKÁLNÍCH NITROOČNÍCH ČOČEK ACRYSOF
- POZDNÍ FUNKČNÍ A MORFOLOGICKÉ NÁLEZY PO OTRAVĚ METYLALKOHOLEM.
- BIOPSIE UVEÁLNÍHO MELANOMU PŘEHLED
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



