-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chlamydia pneumoniae v etiologii keratoconjunctivitis sicca u dospělých pacientů (pilotní studie)
Chlamydia Pneumoniae in the Etiology of the Keratoconjunctivitis Sicca in Adult Patients (a Pilot Study)
Aim:
In the pilot study the authors refer to the possible connection between the appearance of keratoconjunctivitis sicca (KCS) and Chlamydia pneumoniae (CP) infection.Materials and methods:
At the Department of Ophthalmology, 10 adult patients older than 45 years were followed up during the period of 5.5–7 years, where in the chronic folicular conjunctivitis caused by CP, the KCS was revealed as the same time.Methods:
The chlamydial infection diagnosis was established due to the positivity to the familiar (anti-LPS) and species (anti-CP) immunoglobulins (IgG, IgM, and IgA) and to the conjunctival impression specimen, using the indirect immunofluorescence of specific monoclonal antibodies. The patients were treated by means of systemically administered macrolide antibiotics Azithromycine. After the termination of the treatment, the signs of the clinical inflammation of the conjunctival inflammation subsided but the KCS problems remained. After 6 years, the control examinations of the familiar and species antibodies of the CP were performed and the clinical findings of the KCS and its treatment were evaluated.Results:
The decrease of the antibody levels was proved and objective findings and subjective symptoms of KCS in all patients subsided. Altogether 7 patients were without clinical signs of the KCS and without regular application of local artificial tears treatment. At the same time, in two thirds of the patients, the levels of the antibodies decreased or remained unchanged. In the last three patients, the signs of the dry eye decreased, but they didn’t disappeared permanently. These patients had to apply artificial tears several times a day. The suspect signs of this serologically active infection persisted despite the antibodies levels’ decrease.Conclusion:
This pilot study until now didn’t confirm the direct dependence between the KCS and CP, but it didn’t exclude it as well.Key words:
keratoconjunctivitis, Chlamydia pneumoniae.
Autoři: J. Krásný; D. Hrubá 1; M. Netuková; V. Kodat; J. Tomášová Borovanská
Působiště autorů: Oční klinika FN Královské Vinohrady, Praha, přednosta prof. MUDr. P. Kuchynka, CSc. ; Vidia-Diagnostica, s. r. o., Praha 1
Vyšlo v časopise: Čes. a slov. Oftal., 65, 2009, No. 3, p. 102-106
Souhrn
Cíl:
V pilotní studii autoři poukázali na možnou souvislost mezi vznikem keratoconjunctivitis sicca (KCS) a infekcí Chlamydia pneumonie (CP).Materiál:
Na oftalmologické klinice bylo ve sledování 5,5 až 7 let 10 dospělých pacientů ve věku nad 45 let, kdy při chronické folikulární konjunktivitidě vyvolané CP byla současně odhalena KCS.Metodika:
Diagnóza chlamydiové infekce byla stanovena na základě pozitivity chlamydiových rodových (anti-LPS) a druhových (anti-CP) IgG, IgM, IgA) a spojivkových otiskových preparátů metodou nepřímé imunoflurescence pomocí specifických monoklonálních protilátek. Pacienti byli léčeni celkově podávaným makrolidovým antibiotikem Azitromycinem. Po ukončení léčby ustoupily klinické příznaky konjunktiválního zánětu, ale přetrvávaly obtíže KCS. S odstupem 6 let bylo provedeno kontrolní vyšetření rodových a druhových protilátek CP a současně posouzen klinický obraz KCS a její léčba.Výsledky:
Byl prokázán pokles hladin protilátek i ústup objektivního nálezu a subjektivních obtíží při KCS u všech nemocných. Celkem 7 pacientů bylo bez klinických příznaků KCS a bez pravidelné lokální léčby lubrikancií. Současně byl zaznamenám u 2/3 pacientů pokles hladin protilátek či sérologický nález byl beze změn. U zbývajících 3 nemocných příznaky suchého oka se zmírnily, ale trvale neustoupily. Museli si několikrát denně aplikovat umělé slzy. Přetrvávaly suspektní známky sérologicky aktivní infekce i přes pokles hladin protilátek.Závěr:
Tato pilotní studie zatím jednoznačně nepotvrdila přímou souvislost mezi KCS a CP, ale zároveň ji nevyloučila.Klíčová slova:
keratoconjunctivitis sica, Chlamydia pneumoniaeÚvod
Chlamydie patří k nejrozšířenějším mikroorganismům v lidské, ale i zvířecí říši. Jejich výskyt je kosmopolitní a zařazují se mezi gram-negativní obligátní intracelulární bakterie. Pro člověka z hlediska vzniku možných onemocnění jsou důležité zejména dva primárně lidské patogeny, a to Chlamydia trachomatis a Chlamydia pneumoniae (dále CP) [15].
Klinické projevy infekcí CP jsou vázány především na horní a dolní dýchací cesty, přesto první izoláty tohoto agens pocházejí z oční lokalizace. Jeden z prvních kmenů byl izolován na Tchaj-wanu v roce 1965 z oční spojivky dítěte v rámci vakcinační studie trachomu [8]. Od té doby se znalosti na základě rozsáhlé výzkumné činnosti o tomto druhu chlamydie nesmírně rozšířily a jeho definitivní identifikace jako samostatného druhu se datuje až na počátek 90. let minulého století [17]. K primoinfekci dochází nejčastěji v době školní docházky, kdy akutní infekce může přejít do chronické formy [25]. Stále probíhá výzkum vztahu CP k dalším onemocněním respiračního traktu: astma bronchiale [5], chronická obstrukční plicní choroba (CHOPD) [11], bronchopulmonální karcinom [16], sarkoidóza [21]. Výzkumy se zabývají také otázkami možného vlivu infekce CP na aterosklerózu [10], infarkt myokardu [22] nebo myokarditidu [28]. Také některá onemocnění CNS mají koincidenci s CP [13], např. roztroušená skleróza [26] a Alzheimerova choroba [2]. Další oblastí patologického působení CP jsou artritidy [24].
O možnosti CP etiologie konjunktivitid se začalo uvažovat před dvaceti pěti lety na základě pozorování folikulární konjunktivitidy bez známek keratitidy [9]. V současné době se řadí do skupiny chronických folikulárních konjunktivitid, ke které patří obraz minimální mukopurulentní sekrece [7]. Po celkové léčbě vlastního folikulárního zánětu makrolidovými antibiotiky byly zaznamenány přetrvávající obtíže charakteru keratoconjunctivitis sicca (dále KCS) [14].
Vlastní studie
V březnu 2008 jsme provedli kontrolní klinické a sérologické vyšetření současně u 10 dospělých pacientů (8 žen a 2 muži) ve věku 45 až 71 let (medián 60 let). Jejich dlouhodobé sledování navazovalo na předchozí studii z období února 2001 až září 2002 (tab. 1), tedy 1,5 roku. Tehdy jsme u 10 dospělých pacientů starších 45 let odhalili jako příčinu chronické folikulární konjunktivitidy CP jednak na základě diagnostiky otiskových preparátů na sklíčku metodou nepřímé imunofluorescence pomocí specifických monoklonálních protilátek (Medac, Germany). Současné sérologické vyšetření zahrnovalo detekci anti-LPS protilátek (rodově specifických) IgG, IgA, IgM protilátek (Medac, Germany) a anti-CP protilátek (druhově specifických) IgG, IgA, IgM protilátek (FOCUS technologies, USA). Za pozitivitu se bral nález CP na spojivce či kombinace minimálně dvou pozitivních nálezů v sérologii v jednotlivých třídách IgA, IgM (tab. 2). Všichni nemocní jako hlavní obtíže v době prvotní diagnózy udávali pálení, řezání či pocit cizího tělíska v očích. Současné svědění či tlak v očích nebo světloplachost byl dalším doprovodným jevem u 40 % pacientů. U většiny postižených (80 %) byla tato subjektivní symptomatologie provázena obtěžujícím slzením či hlenovitou sekrecí z očí. Obtíže pacientů těchto dospělých pacientů byly většinou dlouhodobé, příznaky byly pozorovány půl roku až 10 let, v průměru 2,25 roku. Vždy byla přítomna hyperémie spojivek v různém rozsahu. Zduření dolní přechodné řasy provázel zánět v 80 %, často se zvýšenou vinutostí cév. Folikulární přestavba dolní tarzální spojivky byla bledší barvy než hyperemicky zbarvená okolní tkáň a byla pozorována u pacientů s trvání nemoci déle než tři roky (tab. 1). U jednoho muže sestavy s krátkodobou anamnézou bylo již zachyceno jizvení spojivky (pacient č. 1) v oblasti dolního fornixu. Až na 71letého muže (pacient č. 8) jsme v sestavě neprokázali souvislost očního zánětu s jinou celkovou chorobou, především Sjögrenovým syndromem. U tohoto nejstaršího pacienta souboru se jednalo o dlouhodobou chronickou bronchitidu léčenou opakovaně antibiotiky včetně makrolidů, pro podezření na mykoplazmatickou infekci vzhledem ke svému klinickém průběhu se podobala také projevům CP. Obě možné etiologie v té době nebyly laboratorně potvrzeny.
Tab. 1. Hodnocení příznaků KCS (ŘP – řezání, pálení, pocit cizího tělíska, Sv – světloplachost, ST – svědění a pocit tlaku, Se – sekrece, Hyp – hyperémie, PrF – prosáknutí fornixu, VCF – vinutost cév ve fornixu, Fol – přítomnost folikulů, časové údaje jsou uváděny v rocích) 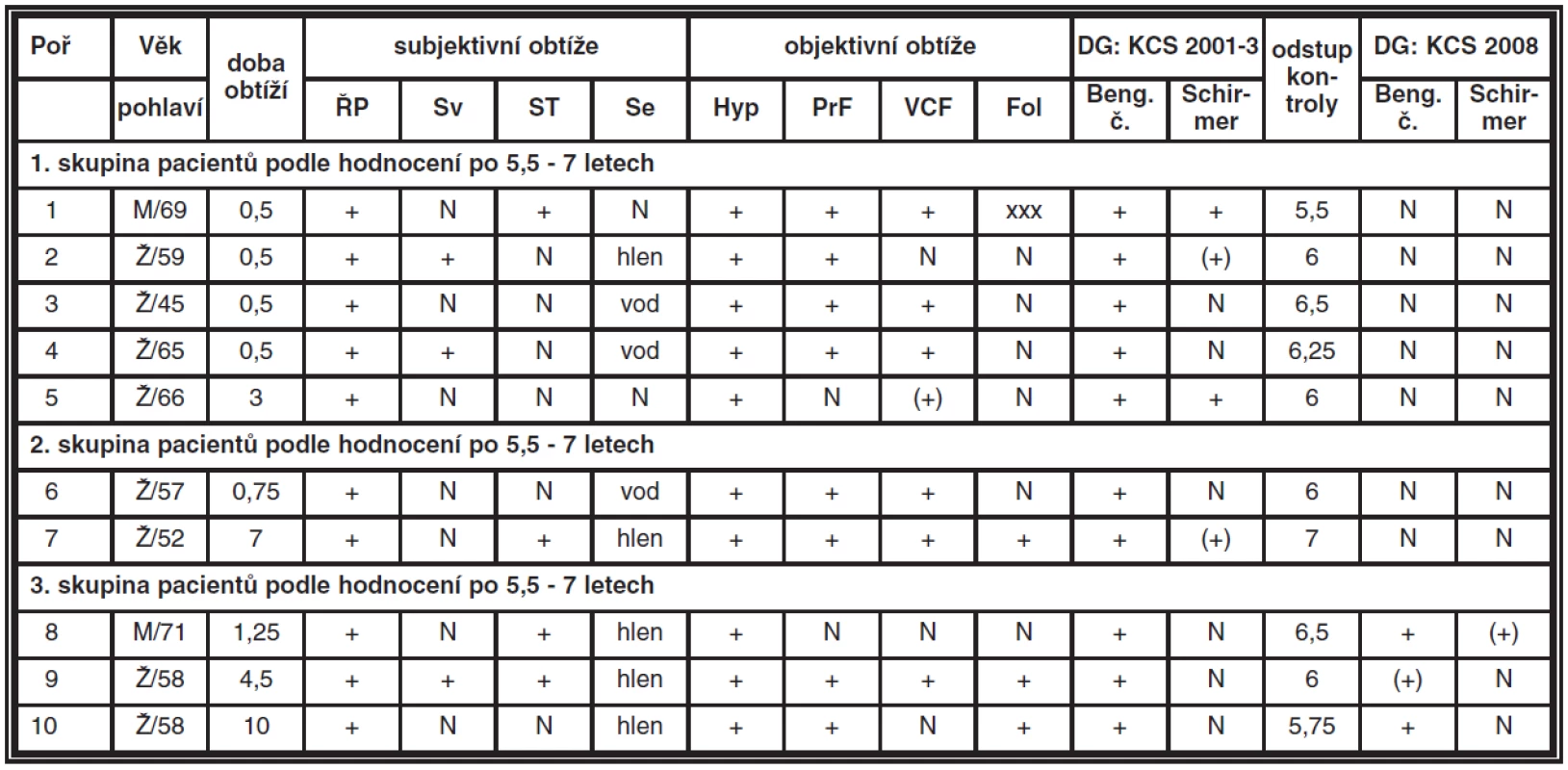
Folikulární zánět jsme léčili celkově podávaným makrolidovým antibiotikem Azithromycinem v dávce 500 mg denně pod dobu 12 až 14 dní. U všech postižených byl kontrolní stěr ze spojivky po léčbě opakovaně negativní. U většiny sledovaných se sérologický nález dlouhodobě neměnil i po devíti měsících po ukončení léčby. Pouze u dvou z nich jsme zaznamenali vymizení hraničních hodnot specifických anti-CP protilátek IgA. U těchto nemocných byl současně prokázán suspektní nález CP ve stěrech ze spojivky (pacienti č. 2 a 10). Léčbou byl redukován nález prosáknutí dolního fornixu spojený s ústupem patologické sekrece. Subjektivní obtíže (řezaní, pálení či pocit cizího tělíska) provázené nepravidelnou a přechodnou hyperémií bulbární i tarzální spojivky přetrvávaly. Vzhledem k udávaným obtížím jsme provedli u pacientů vyšetření Schirmerovým testem, který nebyl jasně průkazný vzhledem k předchozí sekreci s vodnatou složkou při folikulárním zánětu. Spojivku jsme také obarvili bengálskou červení s absolutní pozitivitou průkazu KCS u všech 10 nemocných léčených původně jen pro folikulární konjunktivitidu. Pacientům jsme nasadili lubrikancia, nejčastěji karbomery, které si museli aplikovat několikrát denně. Pro zklidnění spojivky v období výrazné hyperémie jsme léčbu doplnili o přechodně aplikovaný fluorometholon. Všech 10 pacientů sice udávalo subjektivně pocit zlepšení, úplný ústup obtíží potvrdily ve výše uvedeném období pouze tři ženy s krátkodobou půlroční anamnézou zánětu, ale při lokální léčbě lubrikancii (pacientky č. 2, 3, 4).
V dalších období nemocní přicházeli na kontroly nepravidelně podle obtíží a potřeby předpisů léků, neboť u některých se spontánně zmírňovaly subjektivní obtíže KCS s postupující dobou od celkové léčby makrolidovými antibiotiky. Komplexním a jednorázovým vyšetřením jsme chtěli zhodnotit výsledek léčby z klinického i laboratorního hlediska po 5,5 až 7 letech (medián 6 let) po ukončení léčby makrolidy.
Klinické oční vyšetření zahrnovalo klasické vyšetření na štěrbinové lampě s kontrolní fotodokumentací. Při porovnání současného nálezu a fotodokumentace v průměru před šesti lety jsme zjistili vymizení vinutosti cév v rámci původního prosáknutí dolního fornixu, např. pacientka č. 6. (obr. 1 a, b), ale také zmírnění jizevnaté reakce u pacienta č. 1 (obr. 2 a, b). Hyperémie byla přítomná u 2 pacientů ze 3 postižených s trvale přetrvávajícími subjektivními příznaky KCS, kteří jsou nucení pravidelně aplikovat lubrikancia. Jednalo se o nemocného, v jehož anamnéze byla chronická bronchitida, u které nebylo možno vyloučit CP etiologii. U dvou nemocných se pohybovala doba obtíží před stanovením diagnózy a zahájením léčby mezi 7 až 10 lety (viz tab. 1).
Obr. 1a. Hyperémie, prosáknutí s vinutostí cév dolního fornixu před léčbou Cp 
Obr. 1b. Ústup nálezu po 6 letech od ukončení léčby CP makrolidy 
Obr. 2a. Jizevnaté změny spojivky v dolním fornixu před léčbou CP 
Obr. 2b. Zmírnění příznaků jizvení po léčbě CP s odstupem 5,5 roku 
Obarvení spojivky bengálskou červení prokázalo ulpívání barviva jen u dvou postižených, u další nemocné nebylo jednoznačné. Schirmerův test byl pozitivní jen jedenkrát (tab. 1). Break-up-time či test s barvením fluoresceinem jsme k hodnocení nevyužili vzhledem k jednorázovému vyšetření pacientů a protože nebyl použit ani v minulém sledování.
Pět jedinců původně léčených pro folikulární konjunktivitidu a následnou či současně přítomnou KCS, což již zpětně nemůžeme rozlišit, je bez klinických příznaků a subjektivních obtíží. Nejsou nuceni aplikovat substituční terapii k dosažení stabilizace slzného filmu. Další dvě nemocné nemají klinické příznaky včetně detekčních testů. Aplikují umělé slzy nepravidelně pro občas se objevující subjektivní obtíže pálení a řezaní očí. Zde nelze vyloučit určitou psychickou nadstavbu po dlouhodobě trvajícím očním zánětu.
Změny hladin protilátek z prvého období a kontrolního vyšetření po 5,5–7 letech je znázorněn šipkami (tab. 2), není-li u výsledku šipka, nález protilátek byl stejný jako v předchozím vyšetření. U rodových (anti-LPS) protilátek dochází během let k minimálnímu pohybu (ať už ve smyslu zvýšení či snížení). Výraznější pohyb jsme zaznamenali u druhových anti-CP protilátek:
Tab. 2. Porovnání dynamiky protilátek CP u 10 pacientů s KCS před léčbou a po 6 letech (+ – značí aktivitu protilátek, N – negativní nález, šipky směr aktivity) 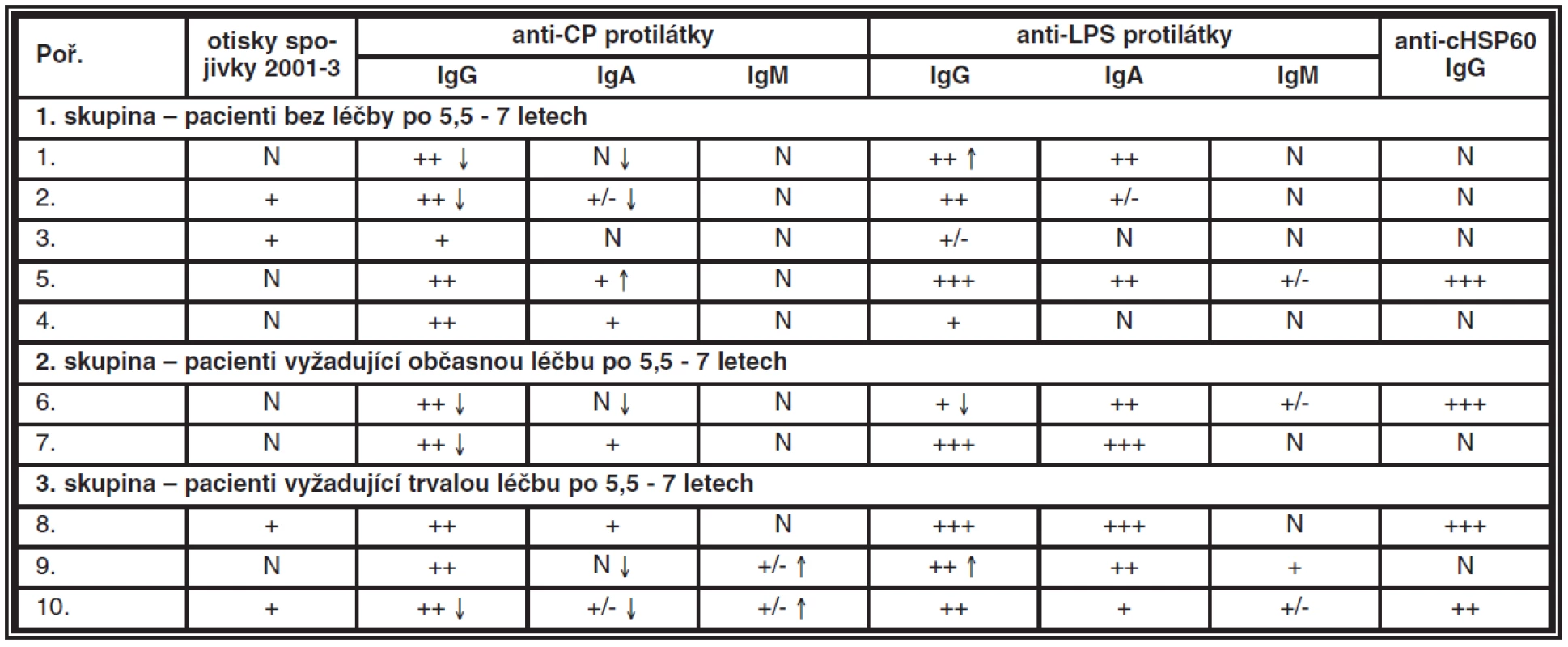
1. a 2. skupina – pacienti s výrazným zlepšením projevů KCS jsme zaznamenali u 4 pacientů pokles protilátek (IgG a/nebo IgA), u 2 pacientů byl nález beze změn, u jednoho pacienta nastalo k mírnému zvýšení anti-CP IgA.
3. skupina – u dvou ze tří pacientů, kteří vyžadují trvalou léčbu také poklesly protilátky anti–CP třídy IgG a/nebo IgA, ale naznačen byl vzestup IgM.
V této malé skupině (pilotní studie) byl vyšetřen anti-cHSP60 IgG (heat shock protein), který se jeví se jako perspektivní sér ologický marker pro perzistentní chronické infekce CP v tomto případě při KCS. Ve skupině pacientů bez léčby či s občasnou léčbou byl pozitivní pouze u jedné třetiny, zatímco ve skupině pacientů s trvalou léčbou KCS u dvou třetin. V prvém období jsme tento test ještě neprováděli.
Diskuse
Podstatou KCS je postižení slzné žlázy, která mění složení a produkci slz. Příčinou je přestavba slzné žlázy lymfoproliferací. KCS může být samostatným onemocněním nebo provází Sjögrenův syndrom jako jeden ze základních symptomů, či je pouze doprovodným, ne vždy přítomným příznakem u dalších autoimunitních onemocnění, především jsou to systémová onemocnění pojivové tkáně. V současné době se jich uvádí již patnáct [19]. Podle WHO je příznaky suchého oka postiženo 6 % dospělé populace. U Sjögrenova syndromu se zvažuje možnost hlavně virové etiologie – především ve spojení s Ebsteinovým-Barrové virem (EBV), dalšími viry jsou cytomegalovirus (CMV), virus vyvolávající parotitidu a některé enteroviry [20]. KCS byla pozorována už u dětí s infekcí EBV [18] a také u HIV pozitivních pacientů s KSC [29]. KCS byla pozorována u chronické hepatitidy typu C [20]. KCS jsme diagnostikovali u dospělých pacientů starších 45 let, hlavně u žen, s chronickou folikulární konjunktivitidou, léčenou celkově makrolidovými antibiotiky, kde jsme prokázali 75% pozitivitu IgM a IgA CP protilátek [14], jejich následující pokles by mohl potvrzovat CP jako etiologického činitele. Vznik KCS by se zde mohl rovněž vysvětlit poškozením slzné žlázy a slzných žlázek spojivky několikaletým chronickým zánětem CP etiologie.
V diagnostice těchto pacientů s KCS po zánětlivém onemocnění CP etiologie se nám lépe osvědčuje detekce barvením bengálskou červení s interpretací podle van Bijstervelda 3 až 9 bodů na spojivce [27] než klasický Schirmerův test, kde za pozitivní nález se hodnotí sekrece slz pod 10 mm [23].
Infekce CP se pravděpodobně šíří kapénkami, popsán byl nárůst incidence onemocnění z 0,3 % na 22 % v průběhu zimní epidemie v Seatlu [1] či epidemie pneumonií způsobených CP v uzavřených vojenských kolektivech [12]. CP může dlouhodobě přežívat v organismu v makrofázích, které mohou být vektorem jejich šíření v organismu [30]. S variabilními výsledky byla DNA CP prokázána v periferních leukocytech u pacientů s ICHS [3] a v aterosklerotických plátech [4]. Tento mechanismus se může podílet při postižení slzné žlázy.
Interpretace sérologických nálezů u chronicky nemocných pacientů není vždy jednoznačná, neboť 60–80 % dospělé populace vykazuje sérologicky potvrzenou promořenost, pro kterou svědčí hladiny IgG protilátek proti CP. Z tohoto důvodu je při hodnocení sérologických nálezů důležité sledovat titry IgA a IgM protilátek svědčící pro probíhající infekci. Sledování sérologických markerů jako ukazatele úspěšnosti léčby je problematické, neboť hladiny statisticky významně klesají pomalu. V tomto směru panuje stále poměrně mnoho nejasností [6], dosud není k dispozici uspokojivá definice perzistentní nebo chronické infekce CP pomocí sérologických markerů. Pozitivita IgM a IgA protilátek klesla z 81 % před léčbou na 71 % po devíti měsících [14]. Z tohoto důvodu je nutné opakovat odběry u sledovaných pacientů s prokázanou CP pozitivitou ve třídách IgM a IgA s odstupem nejméně 6 měsíců, případně i jednoho roku. Pro zhodnocení významu sérologické odpovědi u pacientů s KCS je třeba dlouhodobého sledování větší skupiny pacientů, doplněného o detekci DNA CP ze spojivkových stěrů.
Závěr
Případné potvrzení CP v etiopatogenezi KCS rozšíří poznatky o této chorobě a nových možnostech její léčby. Toto je stručná anotace nového výzkumného projektu IGA MZ ČR NS 10016/4 v oboru 08: „Mikrobiologie a epidemiologie“ zahájeného v letošním roce. Navazuje na tuto pilotní studii, která vycházela z poznatků předchozího projektu IGA MZ ČR NI/6811 ukončeného před šesti lety. Na 16. výročním sjezdu ČOS ve Špindlerově Mlýně v loňském roce jsme již referovali o možnosti odeslat dospělé pacienty starší 45 let s výše uvedenou klinickou symptomatologií k podrobnému klinickému, laboratornímu vyšetření a následné léčby. Výzkumný projekt nám nyní umožní komplexní vyšetření, které přesahuje rámec možností zdravotní péče poskytované zdravotními pojišťovnami.
MUDr. Jan Krásný
Oční klinika FNKV
100 34 Praha 10, Šrobárova 50
krasny@fnkv.cz
Zdroje
1. Aldus, M.R., Grayston, J.T., Waring, S. et al.: Seroepidemiology of Chlamydia pneumoniae TWAR Infection in Seattle Families. J. Infect. Dis., 166, 1992 : 646 – 49.
2. Balin, B.J., Gerard, H.C., Arking, E.J. et al.: Identification and Localization of C. Pneumoniae in the Alzheimeręs Brain. Med. Microbiol. Immunol., 187, 1998 : 23 – 42.
3. Blasi, F., Boman, J., Esposito, G. et al.: Chlamydia pneumoniae DNA Detection in Peripheral Blood Mononuclear Cells is Predictive of Vascular Infection. J. Infect. Dis., 180, 1999 : 2074–76.
4. Blasti, F., Fagetti, L., Allegra, L.: Chlamydia pneumoniae Detection in Atherosclerotic Plaque in Italy. J. Infect. Dis., 181, 2000, suppl. 3 : 444–446.
5. Cunningham, A.F., Johnston, S.L., Julious, S.A. et al.: Chronic Chlamydia pneumoniae Infection and Asthma Exacerbations in Children. Eur. Respir., J. 11, 1998 : 345–349
6. Dowel, V. et al.: Standardizing Chlamydia pneumoniae Assays: Recommendations from the Centers for Disease Control and Prevention (USA) and the Laboratory Centre for Disease Control (Canada). Clinical Infectious Diseases, 33, 2001 : 492–503.
7. Dawson, Ch.R., Schachter, J., Stephens, R.D.: Chlamydial Keratoconjunctivitis. In: Pepose, J.S., Holland, N.G., Wihelmus, K.R.: Ocular Infection & Immunity. Mosby, St. Louis, 1995, pp. 818–829.
8. Dwzer, R., Treharne, J.D., Jones, B.R. et al.: Chlamydial Infection: Results of Microimmunofluorescence tests for the Detection of Type-specific Antibody in Certain Chlamydia Infection. Br. J. Vener. Dis., 48, 1972 : 452–459.
9. Forsey, T., Darougar, S.: Acute Conjunctivitis Caused by an Atypical Chlamydia Strain 10L 207. Br. J. Ophthalmol., 68, 1984 : 408.
10. Grayton, J.T.: Design of Future Intervention Studies for Chlamydia pneumoniae in Atherosclerosis. Am. Heart J., 138, 1999, 5 Pt 2:S556–S557.
11. Hahn, D.L.: Chlamydia pneumoniae, Asthma and CHOPD: What Is the Evidence? Annals of Allergy, Asthma & Immunol. 83, 1999 : 271–288.
12. Kleemola, M., Saikku, P., Visakorpi, R. et al.: Epidemics of Pneumonia Cause by TWAR, a New Chlamydia Organism, in Military Trainees in Finland. J. Infect. Dis., 157, 1988 : 230–236.
13. Koskiniemi, M., Gencay, M., Salonen, O. et al.: Chlamydia pneumoniae Associated with Central Nervous System Infections. Eur. Neurol., 36, 1996 : 160–163.
14. Krásný, J., Borovanská, J., Hrubá, D.: Chlamydia pneumoniae – etiologie folikulární konjunktivitidy a následné keratokonjunktivitis sicca u dospělých pacientů. Čes. a slov. Oftal., 59, 2003 : 325–333.
15. Krásný, J., Hrubá, D., Tomášová-Borovanská, J.: Chlamydiové infekce oka. In : Rozsíval, P. (Ed).: Moderní trendy v oftalmologii, Praha, Galen, 2005, s. 177–203.
16. Laurila, A.L., Anttila, T., Laara, E. et al.: Serological Evidence of an Association between Chlamydia pneumoniae Infection and Lung Cancer. Int. J. Cancer., 74, 1997 : 31–34.
17. Lietman, T., Brooks, D., Moncada, J. et al.: Chronic Follicular Conjunctivitis Associated with Chlamydia psittaci and Chlamydia pneumoniae. Clin. Infect. Dis., 26, 1998 : 1335–40.
18. Merayo-Lloves, J., Baltatzis, S., Foster, C.S.: Epstein-Barr Virus Dacryoadenitis Resulting in Keratoconjunctivitis Sicca in a Child. Am. J. Ophthalmol. 132, 2001 : 922–923.
19. Pflugfelder, S.C., Beuerman, R.W.: Dry Eye and Ocular Surfare Disorders. New York, M. Dekker, 2004, p. 428.
20. Pflugfelder, S.C., Whitcher, J.P., Troy, E.D.: Sjogren Syndrome. In: Pepose, J.S., Holland, N.G., Wihelmus, K.R. (Ed): Ocular Infection & Immunity. St. Louis, Mosby, 1995, pp. 313–33.
21. Puolakkainen, M., Campbell, L.A., Kuo, C.C. et. al.: Serogical Response to Chlamydia pneumoniae in Patients with Sarcoidosis. J. Infection 33, 1996 : 199–205.
22. Ridker, P.R., Kundsin, R.B., Stampfer, M.J. et al.: Prospective Study of Chlamydia pneumoniae IgG Seropositivity and Risk of Future Myocardial Infraction. Circulation, 99, 1999 : 1161–64.
23. Schirmer, O.: Studies zur Physiologie und Pathologie der Tranenabsonderung und Tranenabfuhr. Graefes Arch. Clin. Exp. Ophthalmol., 56, 1903 : 47–60.
24. Schumacher, H.R. Jr., Gerad, H.C., Arayssi, T.K. et al.: Lower Prevalence of C. pneumoniae DNA compared with C. trachomatis DNA in Synovial Tissue of Arthritis Pacients. Arthritis Rheum., 42, 1992 : 1889–93.
25. Sodja, J.: Sérologický přehled chlamydiových protilátek. Zprávy CEM, 1998, č.7, s. 34 – 36.
26. Sriram, S., Mitchel, W., Stratton, C.: Multiple Sclerosis Associated with C. Pneumoniae Infection of the CNS. Neurology 50, 1998 : 571–572.
27. van Bijsterveld, O.: Diagnostic Test in the Sicca Syndrome. Arch. Ophthalmol., 82, 1969 : 10–14.
28. Weslen, L., Pahlson, C., Lindquist, O. et al.: An Increase in Sudden Unexpected Cardiac Deaths Among Young Swedish Orienteers During 1979-1992. E. Heart., J. 17, 1996 : 902–10.
29. Willoughby, C.E., Barker, K., Kaye, S.B. et al.: Epstein-Barr Virus in the Tear Film in Sjorgen’s Syndrome and HIV Infection. J. Med. Virol., 68, 2002 : 378–383.
30. Wu, L., Skinner, S.J., Lambie, N. et al.: Immunohistochemical Staining for C. pneumoniae is Increased in Lung Tissue from Subject with Chronic Obstructive Pulmonary Disease. Am. J. Respir. Crit. Care Med., 162, 2000 : 1148–51.
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2009 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Familiární středomořská horečka
- Kontaktní dermatitida očních víček
-
Všechny články tohoto čísla
- Chlamydia pneumoniae v etiologii keratoconjunctivitis sicca u dospělých pacientů (pilotní studie)
- Ranibizumab (Lucentis) v léčbě věkem podmíněné makulární degenerace
- Akutní uzávěr centrální sítnicové arterie (CRAO) v obraze optické koherentní tomografie (OCT3)
- Drenážní implantáty v chirurgii dětského glaukomu
- Změny v tloušťce nervových vláken u non-arteritické formy AION na OCT
- Analýza prognostických faktorů anatomického a funkčního výsledku operace idiopatické makulární díry
- Informovanost a kvalita života pacientů s glaukomem
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ranibizumab (Lucentis) v léčbě věkem podmíněné makulární degenerace
- Akutní uzávěr centrální sítnicové arterie (CRAO) v obraze optické koherentní tomografie (OCT3)
- Změny v tloušťce nervových vláken u non-arteritické formy AION na OCT
- Informovanost a kvalita života pacientů s glaukomem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



