-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaproLékaře.cz / Odborné časopisy / Česká a slovenská neurologie a neurochirurgie / 2020 - Supplementum 2Pneumologická péče o pacienty se spinální svalovou atrofií
Pulmonary management of spinal muscular atrophy
Spinal muscular atrophy (SMA) has an impact on respiratory complications that are dependent on the severity of the loss of muscle function. Individuals with SMA type I or II typically develop respiratory muscle weakness, with progressive respiratory failure in most severe forms. Ineffective cough is a result of inspiratory and more expiratory muscle weakness and contributes to repeated respiratory infections. In some patients, gradual progression results in sleep-disordered breathing. Over the last decade, there has been increasing evidence of improvements in the natural history of all the SMA types. Even in the most severe form, there has been an increase insurvival and quality of life as a result of a more proactive approach, following the introduction of non-invasive ventilation and cough assist devices. The approval of the first drug for SMA in December 2016 and promising early results from other clinical trials have changed the perspective of physicians and families dramatically, especially in SMA type I. The mainstay of care is amultidisciplinary team, where a pneumologist and a respiratory physiotherapist play an important role. The variability in clinical care between medical centers has resulted in Consensus Statement for Standards of Care. Here we present a modified version of these standards.
Autoři: T. Doušová 1; J. Plešková 2; A. Chmelařová 2
Působiště autorů: Pediatrická klinika 2. LF UK a FN Motol 1; Klinika rehabilitace a tělovýchovného lékařství 2. LF UK a FN Motol 2
Vyšlo v časopise: Cesk Slov Neurol N 2020; 83/116(Supplementum 2): 35-40
doi: https://doi.org/10.48095/cccsnn20202S35Souhrn
Výskyt respiračních komplikací je u pacientů se spinální muskulární atrofií (SMA) do velké míry určen ztrátou funkce svalstva. Postižení dýchacích svalů je typické zejména pro pacienty se SMA I a II, kteří jsou v nejtěžších případech ohroženi rozvojem respirační insuficience. Na vzniku opakovaných respiračních infekcí se podílí neefektivní kašel, který je výsledkem slabosti nádechových a zejména výdechových svalů. U části pacientů může docházet k poruchám dýchání ve vazbě na spánek. Přirozený průběh onemocnění SMA se v poslední dekádě mění. Důsledkem proaktivního přístupu v léčbě je prodloužení délky a zlepšení kvality života pacientů včetně nejtěžších forem onemocnění. V tomto ohledu přinášejí změnu přístroje zvyšující efektivitu kašle nebo zajišťující neinvazivní ventilační podporu. Zcela zásadní jsou však nové možnosti léčby, které se objevily po schválení prvního léčebného preparátu pro SMA v prosinci 2016. Slibné výsledky ostatních probíhajících studií změnily perspektivu lékařů a rodin pacientů, zejména u dětí se SMA typu I. Základem péče je multidisciplinární tým, v němž má své nezastupitelné místo pneumolog a respirační fyzioterapeut. Odlišné klinické praxe v centrech pečujících o pacienty se SMA vedly ke vzniku standardů péče, jejichž modifikovanou verzi předkládáme jako doporučený postup.
Úvod
Spinální svalové atrofie (SMA) představují klinicky heterogenní skupinu onemocnění charakterizovanou degenerací míšních alfa motoneuronů. Nejčastější je proximální forma s vazbou na mutaci v genu SMN1, která zahrnuje spektrum fenotypů zařazených podle věku manifestace onemocnění a maxima dosažených motorických dovedností do klinických skupin (SMA 0–IV, tab. 1). U proximální formy vede progresivní svalová slabost ke ztrátě schopnosti samostatné chůze a sedu, u těžších forem k rozvoji respirační insuficience s nutností umělé plicní ventilace [1].
Tab. 1. Klasifikace SMA 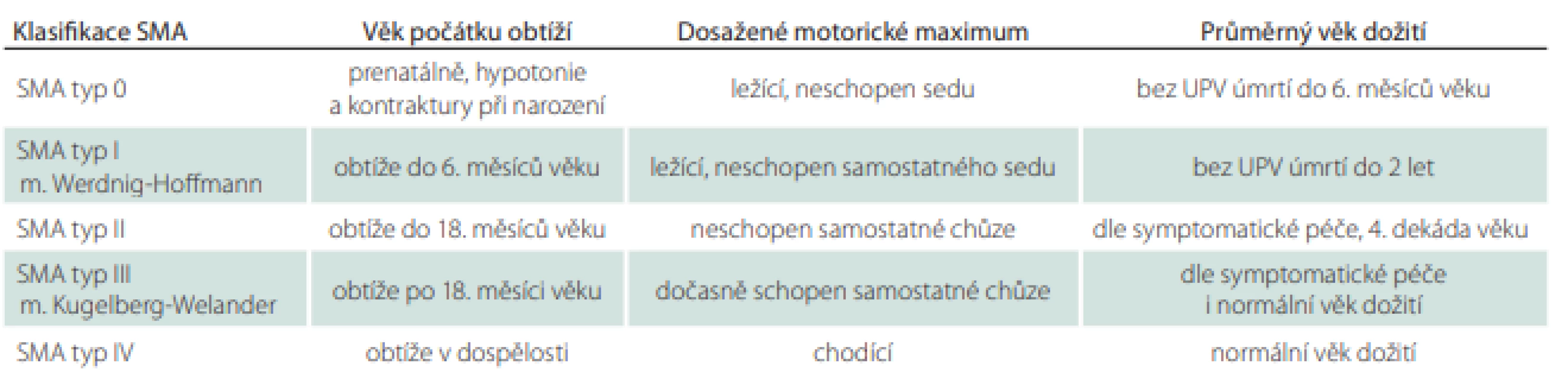
SMA – spinální svalová atrofie; UPV – umělá plicní ventilace Postižení dýchacího svalstva je typické zejména pro pacienty se SMA typu I a II, u kterých dochází k rozvoji slabosti nádechových i výdechových svalů. U jedinců se SMA typu I se navíc může rozvinout slabost bulbárního svalstva vedoucí k poruše polykání s opakovanými aspiracemi do dýchacích cest.
Relativně zachovalá funkce bránice v kontrastu s významnou slabostí mezižeberního svalstva vede v prvním roce života ke vzniku deformity hrudníku (bell-shaped chest – zvonovitý hrudník a pectus excavatum – vpáčený hrudník). Narušená funkce dýchacích svalů dále vede k:
- nedostatečnému vývoji hrudní stěny a plic;
- narušení kašle, jehož nízká efektivita působí nedostatečné odstranění sekretu z dýchacích cest;
- opakovaným respiračním infekcím, které zhoršují svalovou slabost a vedou ke vzniku chronických změn plicního parenchymu (zejména atelektáz);
- noční hypoventilaci;
- poruchám dýchání ve vazbě na REM a postupně i non-REM spánek;
- zhoršení kondice pacienta.
V poslední dekádě došlo ke zlepšení přirozeného průběhu onemocnění pacientů všech typů SMA, kdy i pacienti s nejzávažnější formou dosahují lepší kvality a délky života. Jedná se o důsledek začlenění přístrojů, které zvyšují efektivitu kašle a zajišťují neinvazivní ventilační podporu do standardů péče. Zcela zásadní bylo schválení prvního léčebného preparátu nusinersen (Spinraza, Biogen, Baar, Švýcarsko) pro pacienty se SMA v prosinci 2016 [2]. Slibné výsledky dalších probíhajících studií změnily perspektivu lékařů i rodin pacientů, zejména dětí se SMA I, u nichž projevy chronické respirační nedostatečnosti vedly k jejich časnému úmrtí. Základním předpokladem úspěšné péče o pacienty se SMA je v dnešní době multidisciplinární tým, jehož součástí je mimo jiné pneumolog a respirační fyzioterapeut. Různé klinické praxe v menších i větších centrech pečujících o pacienty se SMA vedly v roce 2007 k vydání prvních standardů péče a následně v roce 2018 k jejich aktualizaci [3].
Pneumologická péče
Zhodnocení klinického stavu
Základem je fyzikální vyšetření (tab. 2).
Tab. 2. Klinické zhodnocení, intervence a plán péče pacienta se spinální svalovou atrofií. 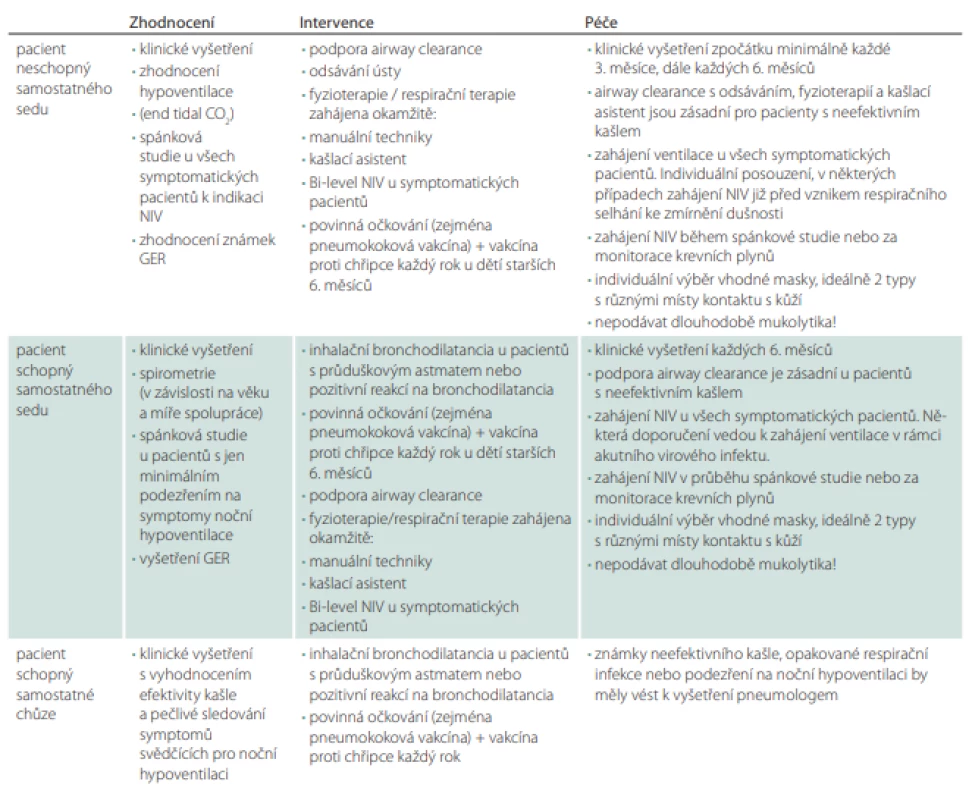
GER – gastroezofageální refl ux; NIV – neinvazivní ventilace Měření saturací pulsním oxymetrem je velmi užitečná pomůcka zejména u pacientů se SMA typu I a II, u kterých jsou projevy respirační nedostatečnosti modifikovány generalizovanou svalovou slabostí. U dítěte se SMA I může cyanóza předcházet objektivní známky ztíženého dýchání jako např. zvýšení dechové frekvence (děti s významnou svalovou slabostí jsou často v počátcích respiračního infektu tachykardické). Náhlý pokles saturace u bdělého pacienta se SMA pod 95 % může značit přítomnost atelektázy nebo obstrukce dýchacích cest hlenovou zátkou. Pokles saturace pod 95 % u spícího pacienta by měl vést k podezření na noční hypoventilaci nebo obstrukci dýchacích cest hlenem.
Skríning respirační nedostatečnosti by měl kromě měření pulsním oxymetrem zahrnovat i kapnografii – end tidal CO2 (EtCO2) nebo měření transkutánního CO2 (TcCO2) v bdělém stavu a spánkovou studii (polysomnografii) v případech, kdy je podezření na noční hypoventilaci. Provedení spánkové studie je doporučeno vždy při podezření na poruchu dýchání ve spánku nebo respirační selhání s následnou potřebou zahájení neinvazivní ventilační podpory (non invasive ventilation; NIV) [4]. Zejména u starších pacientů je třeba cíleně pátrat po symptomech spánkové apnoe nebo hypoventilace (chrápání, časté noční buzení, bolesti hlavy, noční pocení, nadměrná spavost a únava v průběhu dne).
Pacienti schopní spolupráce, tj. děti přibližně ve věku od 4 let, by měli při každé klinické kontrole absolvovat spirometrické vyšetření. V rámci vyšetření hodnotíme zejména dosaženou vitální kapacitu (vital capacity; VC) plic (pokles hodnot pod cca 40 % normy by měl vést k podezření na možnou noční hypoventilaci) [5], která s progresí onemocnění v průběhu života klesá. Tvar křivky průtok/ objem charakterizuje pomalý výdech se sníženým vrcholových výdechovým průtokem. Výjimkou mohou být pacienti se SMA III, kteří mají často normální hodnoty plicních funkcí. Dalším sledovaným je parametrem je FEV1 (objem vzduchu vydechnutý usilovným výdechem za 1 sekundu), jehož snížené hodnoty mohou prokázat případnou přidruženou obstrukční ventilační poruchu (např. průduškové astma).
Pro objektivizaci síly nádechových a výdechových svalů využíváme hodnocení maximálního inspiračního a exspiračního tlaku. Jedná se o nejčastěji využívané parametry pro měření síly dýchacích svalů u pacientů s podezřením na jejich slabost [6]. Stanovují se měřením tlaku v horních dýchacích cestách skrze ústa, případně průdušnici u intubovaných nebo tracheostomovaných pacientů. Měření se obvykle provádí vsedě během maximálního nádechového, případně výdechového úsilí.
Při hodnocení maximálního inspiračního tlaku jsou pacienti vyzváni, aby vydechli na úroveň reziduálního objemu a poté provedli maximální inspirační úsilí, a to udrželi po dobu 1–2 s.
Maximální exspirační tlak lze měřit z úrovně celkové plicní kapacity nebo z úrovně funkční reziduální kapacity. Pacienti provádějí maximální výdechové úsilí a udržují ho po dobu 1–2 s. Manévr by se měl opakovat 3–8×, pro analýzu se použije nejvyšší zaznamenaná hodnota. Existuje přímý vztah mezi objemem plic a sílou výdechových svalů, proto výsledky vyhodnocované z úrovně celkové plicní kapacity mají vyšší hodnoty než hodnoty získané z měření z úrovně funkční reziduální kapacity.
Mobilizace sekretu a očista dýchacích cest
Přístup k pacientům je v posledních letech proaktivní, se snahou o zahájení airway clearance technik a neinvazivní ventilace již v počátku onemocnění. Podstatné je včas zaučit v airway clearance technikách pacienta a jeho rodinu, nejlépe před nástupem prvního respiračního infektu. K zácviku asistované airway clearance by měl být k dispozici respirační fyzioterapeut. Podle celkového stavu pacienta, síly jeho dýchacích svalů a schopnosti efektivní expektorace využíváme různé techniky pro podporu očisty dýchacích cest. S přihlédnutím ke klinickému stavu pacienta můžeme pacienty se SMA rozdělit do tří skupin: pacient neschopný samostatného sedu, pacient schopný samostatného sedu a pacient schopný samostatné chůze.
Pacient neschopný samostatného sedu
U těchto pacientů je metodou volby pro podporu airway clearance manuální fyzioterapie kombinovaná s použitím mechanického insuflátoru-exsuflátoru (CoughAssist, Philips, Amsterdam, Nizozemsko). Jakmile nejsou účinné běžně využívané techniky respirační fyzioterapie, je nezbytné do terapie zařadit přístrojovou podporu kašle za pomocí přístroje CoughAssist. Jeho použití by mělo předcházet zhodnocení efektivity kašle [4]. Mechanická odsávačka s odsávací cévkou je další běžnou součástí vybavení pro ležící pacienty a měla by být použita při každé známce neefektivního kašle.
Pacient schopný samostatného sedu
Stejně jako u skupiny 1 je k podpoře airway clearance nejvhodnější kombinace manuální fyzioterapie s přístrojovou podporou kašle za pomocí přístroje CoughAssist. Pacienti se zachovanou schopností samostatného sedu mají vyšší svalovou sílu dýchacích svalů, proto lze u této skupiny pro podporu mobilizace sekretu z periferních do centrálních dýchacích cest použít i techniky respirační fyzioterapie využívající oscilačního (např. PARI O-PEP, shaker, RC-Cornet, acapella) či kontinuálního přetlaku v dýchacích cestách (Threshold PEP, TheraPEP, Pari S Systém) [7]. Další možností jsou pak aktivní dechové techniky, které využíváme u spolupracujících pacientů (autogenní drenáž, aktivní cyklus dechových technik). Tyto techniky vedou ke změně průtoku vzduchu v dýchacích cestách, což má za následek lepší mobilizaci sekretu z dýchacích cest.
Pacient schopný samostatné chůze
Pacienti se zachovanou schopností samostatné chůze mají často normální hodnoty plicních funkcí. I u těchto pacientů je nezbytné pečlivé hodnocení efektivity kašle zejména v období respiračních infektů. Důležitá je monitorace příznaků noční hypoventilace a spánkové apnoe. U této skupiny nejsou nutná preventivní opatření, pacienti jsou přesto náchylnější ke vzniku respiračních infekcí, aspirací nebo zhoršené očistě dýchacích cest.
Mechanická insuflace, exsuflace
Mechanická insuflace-exsuflace je metodou asistovaného kašle, která napomáhá odstranění sekretu z dýchacích cest pacienta dodáním pozitivního tlaku (insuflace) následovaného náhlým přepnutím do negativních hodnot (exsuflace). Pro efektivní expektoraci je u dospělých jedinců během výdechové fáze kašle nutné dosáhnout PCF alespoň 160 l/ min. U zdravých dospělých a dětí starších 12 let se tato hodnota pohybuje mezi 360 a 1 200 l/ min, u mladších dětí se mění v závislosti na pohlaví, věku a výšce. Dojde-li ke snížení PCF pod 120 l/ min, je pacient ohrožen stagnací bronchiálního sekretu a tvorbou hlenových zátek s rozvojem atelektáz. Asistovaný kašel je kritickým bodem respirační péče o pacienty se SMA a může představovat jedinou možnost, jak sekret z dýchacích cest efektivně odstranit [8]. Nastavené tlaky by měly být dostatečně vysoké k mobilizaci sekretu (nádechové a výdechové tlaky minimálně 30, ideálně až 40 cm H2O) [9]. Přesné hodnoty tlaků jsou však nastavovány respiračním fyzioterapeutem a odvíjí se od síly dýchacích svalů, spolupráce a věku dítěte.
U pacientů se SMA I a II doporučujeme provádět airway clearance s přístrojem CoughAssist 2–3× denně pokud je dítě v klinicky dobrém stavu. Při infektu je zapotřebí přístroj používat častěji, dle potřeby a klinického stavu pacienta. Rodiny by měly obdržet písemný plán terapie k domácímu použití.
V rámci jedné terapeutické jednotky doporučujeme následující postup:
- 5–7 dechů s přístrojem CoughAssist následovaných pauzou, opakovat 3× po sobě;
- následně v případě nutnosti odsát sputum z úst či tracheostomické kanyly.
U pacientů se SMA III se na podporu airway clearance soustředíme zejména po operačních výkonech a při těžším průběhu akutního respiračního onemocnění.
Nádechové trenažéry
Postižení dýchacích svalů u pacientů se SMA vede k jejich postupné atrofizaci se vznikem kontraktur. Následkem je omezení pohybů hrudního koše a případně vznik deformit hrudníku, což vede k postupnému snižování VC. Proto je u vybraných pacientů vhodné do respirační péče zařadit taktéž trénink nádechových svalů. K tomuto účelu využíváme následující nádechové trenažéry: Coach 2500, Coach 4000, CliniFlo, TriFlo, PowerBreath a Treshold IMT [7].
Nastavení dechových trenažérů, přístroje CoughAssist a četnost jejich použití je vhodné konzultovat s respiračním fyzioterapeutem specializovaným na danou problematiku.
Podpora dýchání
Podporu dýchání představuje a) neinvazivní ventilace nejčastěji s dvojúrovňovou tlakovou podporou (bilevel positive airway pressure; Bi-PAP) nebo b) mechanický ventilátor a invazivní ventilace cestou tracheostomie.
Neinvazivní ventilace
Neinvazivní ventilační podpora by měla být zahájena u všech symptomatických kojenců a imobilních pacientů před nástupem příznaků svědčících pro respirační nedostatečnost [10,11]. Obvyklé indikace k zahájení NIV v domácím prostředí jsou hypoventilace nebo obstrukční spánková apnoe. Dalšími indikacemi jsou rekurentní pneumonie a atelektázy, pooperační péče, deformity hrudní stěny a respirační selhání během akutního respiračního infektu. Virové respirační infekty prohlubují slabost dýchacích svalů a zvyšují sekreci hlenu. V rámci pooperačních komplikací se setkáváme s obstrukcí horních cest dýchacích, hypoventilací i vznikem atelektáz, které zvyšují riziko respiračního selhání. Je prokázáno, že NIV má u pacientů se SMA I vliv na vznik deformity hrudníku a současně zlepšuje vývoj plicní tkáně [12].
Krátkodobé cíle NIV jsou:
- zmírnění symptomů dušnosti;
- zlepšení nebo úprava výměny krevních plynů;
- zajištění komfortu s dobrou synchronizací pacienta s ventilátorem;
- minimalizace rizik a odvrácení intubace.
Dlouhodobé cíle NIV jsou:
- zlepšení celkové doby spánku;
- zlepšení celkové kvality spánku;
- zlepšení celkového funkčního stavu;
- maximalizace kvality a délky života.
Mechanizmy vedoucí k pozitivnímu účinku mechanické podpory dýchání jsou nižší dechová práce spojená s úlevou dýchacím svalům, reverze mikroatelektáz a úprava primárního nastavení centra pro oxid uhličitý v CNS.
Léčba kontinuálním pozitivním přetlakem
Léčba kontinuálním pozitivním přetlakem by neměla být k léčbě chronického respiračního selhání využívána. Dočasně ji lze zahájit k udržení funkční reziduální kapacity u menších pacientů neschopných synchronizace s ventilátorem v NIV nastavení, kteří nevykazují známky hyperkapnie. Léčba kontinuálním pozitivním přetlakem může zhoršovat únavu dýchacích svalů u pacientů se SMA, není proto rutinně doporučována.
Léčba dvojúrovňovou tlakovou podporou
Neinvazivní ventilaci je u pacientů se SMA třeba zahajovat s ohledem na respirační patofyziologii. Jedinci se SMA udržují dostatečnou minutovou ventilaci na úkor zvýšení dechové frekvence s malými dechovými objemy. Vzhledem ke slabosti dýchacích svalů je zde riziko, že pacient nebude schopen sám spouštět přístroj k NIV. Proto je doporučeno nastavení se záložní dechovou frekvencí s možností Bi-PAP při spontánním časovaném módu (ST mode). Tyto přístroje mají možnost nastavení inspiračního tlaku, exspiračního tlaku, dechové frekvence, inspiračního času a času stoupání tlaku (raise time). Bach et al [5] prokázali, že jedinci se SMA I užívající dvojúrovňovou ventilační podporu s rozdílem nádechového a výdechového tlaku alespoň 10 cm H2O byli po 5. roce věku méně hospitalizováni a současně lépe tolerovali léčbu NIV po celou dobu užívání v porovnání s dětmi, které měly zavedenou tracheostomii a léčbu invazivní mechanickou ventilací. Z tohoto důvodu doporučujeme nastavení dostatečného inspiračního tlaku k dosažení adekvátní ventilace a co nejnižšího možného exspiračního tlaku k usnadnění pasivního výdechu při velmi malých dechových objemech. U nejslabších jedinců vede nastavení dostatečně vysoké dechové frekvence ke zmírnění dechového úsilí a k odpočinku dýchacích svalů. Maximální dechové frekvence jsou obvykle kolem 30 dechů za minutu, což je o něco málo méně, nežli obvyklá dechová frekvence kojence se SMA I. Inspirační čas (doba nádechu) by měl být nastaven s ohledem na věk pacienta a jeho dechovou frekvenci. Raise time (čas do dosažení maximálního nádechového tlaku) by měl být nastaven s ohledem na komfort pacienta.
Výběr velikosti a typu masky zkušeným lékařem je podmínkou úspěšného nastavení NIV. K zahájení léčby doporučujeme nosní masku, masku s jiným rozhraním pak ke střídaní (zejména z důvodu prevence otlaků v místech kontaktu s kůží). Při dlouhodobém užívání masky může dojít k iritaci kůže a hypoplazii středočarových obličejových struktur. Distenze žaludku a zvracení jsou další možné nežádoucí komplikace, které mohou vyústit v aspiraci, aspirační pneumonii a potenciálně až v náhlé úmrtí pacienta.
Invazivní ventilace
Tracheostomie a invazivní ventilace jsou léčebnou metodou u pacientů, kde selhalo nastavení NIV. Toto rozhodnutí by mělo být pečlivě zváženo po důkladném rozhovoru s rodinou v kontextu klinického stavu a prognózy pacienta.
Invazivní ventilace je nejvíce kontroverzní (resp. byla nejvíce kontroverzní do schválení prvních léčebných přípravků vedoucích ke zlepšení funkčního stavu) zejména v případě pacientů se SMA I. U pacientů se SMA jiného typu není zavedení tracheostomie primárně indikováno. U dětí se SMA I může být indikací nestabilita stavu při použití NIV, zvýšená kolapsibilita dýchacích cest nebo netolerance NIV pacientem. Je nutné mít na paměti, že zavedení tracheostomie vede k nemožnosti vokalizace a často k plné dependenci pacienta na ventilační podpoře [5].
Medikace
Pro pacienty se SMA, kteří vykazují příznaky průduškového astmatu, jsou k dispozici bronchodilatancia event. kombinované preparáty s inhalačními kortikosteroidy.
Efektivita dlouhodobé aplikace mukolytik v nebulizaci (3 nebo 7% solného roztoku) za účelem zlepšení airway clearance zatím nebyla jednoznačně prokázána. Naopak, déle než nezbytně nutné užívání hypertonického roztoku soli může vést k vodnatění a následnému hromadění přirozeného sekretu dýchacích cest.
Glykopyrolát lze u vybraných pacientů s velkou obezřetností využít ke zmírnění produkce slin. Dávku je však potřeba nastavit tak, aby nedošlo k vysušování sliznic dutiny ústní. Vůči aplikacím botulotoxinu do slinných žláz, stejně tak jako vůči využití jiných metod vedoucích ke snížení produkce slin (skopolaminové náplasti), doposud neexistuje jednoznačný konsenzus. V praxi se užívají po individuálním zhodnocení.
Očkovací látku Palivizumab lze jako prevenci infekce respiračním syncytiálním virem aplikovat dle regionálních zvyklostí v prvních 24 měsících života. Očkování proti chřipce se doporučuje u všech dětí starších 6 měsíců.
U všech pacientů se SMA je vhodné pátrat po příznacích gastroesofageálního refluxu a v indikovaných případech jeho projevy léčit. Algoritmus respirační péče u pacientů se SMA shrnuje obr. 1.
Obr. 1. Algoritmus respirační péče pacienta se spinální svalovou atrofií.
Fig. 1. Respiratory management algorithm in patient with spinal muscular atrophy.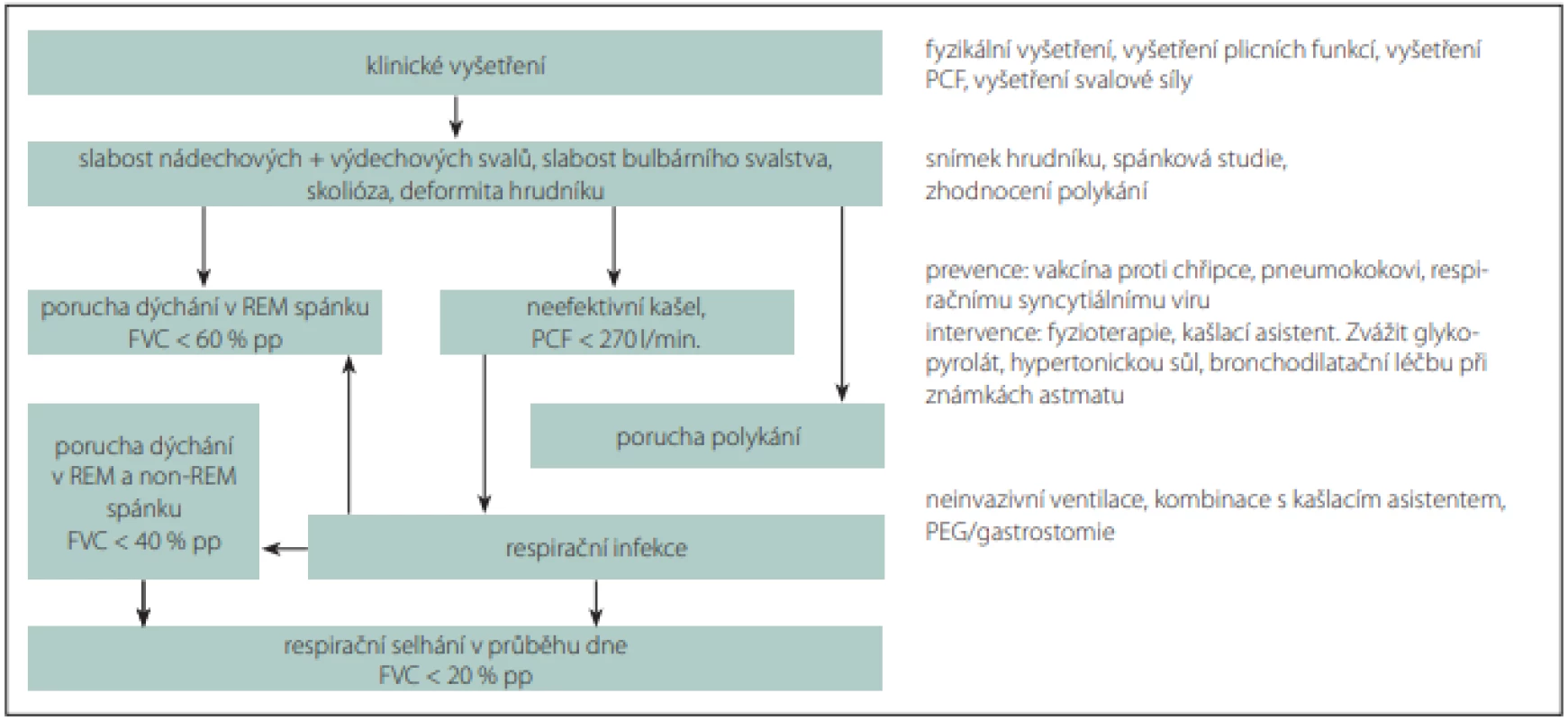
FVC – usilovná vitální kapacita; PCF – vrcholový průtok při kašli
FVC – forced vital capacity; PCF – peak cough flowRedakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MU Dr. Tereza Doušová
Pediatrická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: tereza.dousova@fnmotol.cz
Zdroje
1. Kolb SJ, Kissel JT. Spinal muscular atrophy: a timely review. Arch Neurol 2011; 68(8): 979–984. doi: 10.1001/ archneurol.2011.74.
2. Finkel RS, Chiriboga CA, Vajsar J et al. Treatment of infantile-onset spinal muscular atrophy with nusinersen: a phase 2, open-label, dose-escalation study. Lancet 2016; 388(10063): 3017–3026. doi: 10.1016/ S0140-6736(16)31408-8.
3. Finkel RS, Mercuri E, Meyer OH et al. Diagnosis and management of spinal muscular atrophy: Part 2: Pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord 2018; 28(3): 197–207. doi: 10.1016/ j.nmd.2017.11.004.
4. Hull J. British Thoracic Society guideline for respiratory management of children with neuromuscular weakness: commentary. Thorax 2012; 67(7): 654–655. doi: 10.1136/ thoraxjnl-2012-202043.
5. Bach JR, Baird JS, Plosky D et al. Spinal muscular atrophy type 1: Management and outcomes. Pediatr Pulmonol 2002; 34(1): 16–22. doi: 10.1002/ ppul.10110.
6. Caruso P, Albuquerque AL, Santana PV et al. Diagnostic methods to assess inspiratory and expiratory muscle strength. J Bras Pneumol 2015; 41(2): 110–123. doi: 10.1590/ s1806-37132015000004474.
7. Abusamra R, Ross Russell R. Management of respiratory disease in children with muscular weakness. Paediatr Child Heal (United Kingdom) 2015; 25(11): 515–521. doi: 10.1016/ j.paed.2015.06.011.
8. Neumannová K, Doušová T, Sedlák V et al. Dopo-ručený postup České pneumologické a ftizeologickéspolečnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist. Cesk a Slov Neurol N 2017; 80/ 113(4): 480–484. doi: 10.14735/ amcsnn2017480.
9. Schroth MK. Special considerations in the respiratory management of spinal muscular atrophy. Pediatrics 2009; 123 (Suppl 4): S245–S249. doi: 10.1542/ peds.2008-2952K.
10. Petrone A, Pavone M, Testa MB et al. Noninvasive ventilation in children with spinal muscular atrophy types 1 and 2. Am J Phys Med Rehabil 2007; 86(3): 216–221. doi: 10.1097/ PHM.0b013e31802ef774.
11. Ward S, Chatwin M, Heather S et al. Randomised controlled trial of non-invasive ventilation (NIV) for nocturnal hypoventilation in neuromuscular and chest wall disease patients with daytime normocapnia. Thorax 2005; 60(12): 1019–1024. doi: 10.1136/ thx.2004.037424.
12. Bach JR, Bianchi C. Prevention of pectus excavatum for children with spinal muscular atrophy type 1. Am J Phys Med Rehabil 2003; 82(10): 815–819. doi: 10.1097/ 01.PHM.0000083669.22483.04.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Editorial
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2020 Číslo Supplementum 2- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Generalizovaná úzkostná porucha, její diagnostika a léčba
-
Všechny články tohoto čísla
- Klinický obraz spinální muskulární atrofie u dospělých pacientů
- Genetika spinální muskulární atrofie
- Léčba spinální svalové atrofie
- Hodnotící škály a testy pro dětské pacienty se spinální muskulární atrofií
- Možnosti funkčního pohybového vyšetření dospělých pacientů se spinální svalovou atrofií
- Rehabilitace u spinální muskulární atrofie
- Pneumologická péče o pacienty se spinální svalovou atrofií
- Editorial
- Spondylochirurgická péče o pacienty se SMA
- Pacientská organizace Smáci, z.s. sdružující pacienty se spinální svalovou atrofií
- Léčba dospělých s 5q SMA v České republice
- Diagnostický algoritmus spinální muskulární atrofie
- Role neurologa v multidisciplinární péči o pacienty se spinální muskulární atrofií
- Klinický obraz spinální svalové atrofie v dětském věku
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klinický obraz spinální muskulární atrofie u dospělých pacientů
- Genetika spinální muskulární atrofie
- Léčba spinální svalové atrofie
- Rehabilitace u spinální muskulární atrofie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



