-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Syntéza a HPLC enantioseparácia nových derivátov 3-alkoxy-4-hydroxyfenylalkanónov typu potenciálnych α/β-blokátorov
Synthesis and HPLC enantioseparation of novel derivatives of 3-alkoxy-4-hydroxyphenylalkanones of a potential α/β-blocker type
The present paper reports the synthesis of a series of seven compounds with a hetero aminopropanol chain. The compounds were prepared by the conversion of 3-alkoxy-4-hydroxyphenyl alkanones with 2-chloromethyl oxirane and subsequent reaction of the products with heterocyclic amines (pyrrolidine, azepane, 4-methylpiperazine and 2-methoxyphenyl piperazine). The target compounds were synthesized in the form of racemates. The purity of the products was confirmed by thin layer chromatography and their IR, UV-VIS and 1H-NMR spectra were recorded. Enantioseparation of the racemic products was accomplished by HPLC on a Chiralpak AD chiral chromatographic column with tris(3,5-dimethylphenyl)carbamate as the chiral selector. The efficiency of enantioseparation was determined in relation to the composition of the mobile phase (hexane : ethanol : methanol : ethylethanamine) and to the structure of the prepared compounds. Baseline separation was achieved with all compounds using mobile phases A (78 : 11 : 11 : 0,1 v/v/v/v) and B (80 : 10 : 10 : 0,1 v/v/v/v),
with selectivity factor ranging from 1.07 to 1.42 and resolution from 0.76 to 5.47. The mobile phase containing a higher amount of hexane did not allow for successful enantioseparation of the piperazine derivatives.Keywords:
3-alkoxy-4-hydroxyphenylalkanones – beta-blockers – enantioseparation – HPLC – Chiralpak AD
Autoři: Ružena Čižmáriková; Ladislav Habala; Jindra Valentová; Dana Šmátralová
Působiště autorů: Katedra chemickej teórie liečiv, Farmaceutická fakulta UK, Bratislava, SR
Vyšlo v časopise: Čes. slov. Farm., 2021; 70, 51-58
Kategorie: Původní práce
doi: https://doi.org/10.5817/CSF2021-2-51Souhrn
V predkladanej práci bola reakciou 3-alkoxy-4-hydroxyfenylalkanónov s 2-chlórmetyloxiránom a v nasledujúcom stupni s heterocyklickými amínmi (pyrolidínom, azepánom, 4-metylpiperazínom a 2-metoxyfenylpiperazínom) syntetizovaná séria siedmych derivátov s heteroaminopropanolovým reťazcom. Uvedené zlúčeniny boli pripravené vo forme racemátov. Čistota pripravených látok bola potvrdená chromatografiou na tenkej vrstve a boli u nich zmerané UV, IČ a 1H NMR spektrá. Enantioseparácia bola uskutočnená pomocou HPLC na chirálnej kolóne Chiralpak AD založenej na tris(3,5-dimetylfenyl)karbamáte. Účinnosť enantioseparácie bola sledovaná v závislosti od zloženia mobilnej fázy (hexán : etanol : metanol : etyletánamín) a od štruktúry pripravených látok. Enantiosepáracia na základnú líniu sa dosiahla u všetkých látok v mobilných fázach A (78 : 11 : 11 : 0,1 v/v/v/v) a B (80 : 10 : 10 : 0,1 v/v/v/v), s faktorom selektivity v rozmedzí 1,07 – 1,42 a rozlíšením v rozmedzí 0,76 – 5,47. V mobilnej fáze so zvýšeným obsahom hexánu nedochádzalo k enantioseparácii piperazínových derivátov.
Klíčová slova:
3-alkoxy-4-hydroxyfenylalkanóny – beta-blokátory – enantioseparácia – HPLC – Chiralpak AD
Úvod
Racemické deriváty s arylaminopropanolovým reťazcom je možné pripraviť niekoľkými metódami vo viacerých reakčných stupňoch. Najčastejší postup spočíva v reakcii prítomnej fenolickej skupiny s 2-chlórmetyl-
oxiránom a v nasledujúcom stupni v otvorení oxiránového cyklu pomocou príslušného amínu1). Z ďalších postupov je možné použiť otvorenie oxiránového cyklu pomocou kyseliny bromovodíkovej za vzniku 3-aryloxy-1-bróm-propán-2-olov s nasledujúcou reakciou s príslušnými amínmi2). U nových derivátov propranololu sa použili reakcie s benzoylchloridom, pyridínium chlórchromátom a n-butylchloridom pomocou esterifikácie, oxidácie, redukcie a alkylácie3).Pripravené zlúčeniny typu aryloxyaminopropanolov majú v svojej štruktúre stereogénne centrum a existujú ako (R) a (S)-enantioméry, ktoré sa líšia svojimi farmakologickými a farmakokinetickými vlastnosťami4).
Enantiomérne čisté zlúčeniny aryloxyaminopropanolového typu sa syntetizujú pomocou stereoselektívnej reakcie prítomnej fenolickej skupiny príslušných zlúčenín s rôznymi chirálnymi prekurzormi, ako sú (R) a (S)-chlórmetyloxirány, (S)-glycidoltozylát, (S) - alebo (R)-2,3-O-isopropylidénglyceroltozylát, E-(2S,3S)-3-trimetylsilylglycidol a (S)-3-terc-butyl-5-fenyl-oxazolidín-5-ylmetanol. Mnohé z týchto chirálnych medziproduktov je možné pripraviť z prírodných látok, ako je D-manitol a kyselina L-askorbová5, 6). Syntézu beta-blokátorov, ako sú betaxolol, metoprolol, sotalol a timolol, je možné uskutočniť použitím asymetrickej syntézy, vrátane bioenzymatických metód7).
V skupine aryloxyaminopropanolov enantioselektívne rozdelenie jednotlivých racemátov je možné docieliť pomocou rôznych analytických metód, ako sú HPLC, GC, CE, z ktorých najväčšie zastúpenie má HPLC s použitím priamej a nepriamej metódy. Pri priamej metóde sa používa chirálny selektor buď v stacionárnej, alebo v mobilnej fáze. Pri nepriamej metóde dochádza k derivatizácii látok pomocou chirálnych činidiel a následnej separácii na klasických nechirálnych kolónach.
Pri priamej separácii ide o rozdielnu interakciu látky s povrchom chirálnej stacionárnej fázy za vzniku prechodných diastereoizomérov. Delenie ovplyvňuje zloženie mobilnej fázy, veľkosť kolóny, teplota a iné faktory. U beta-blokátorov aryloxyaminopropanolového typu bola použitá HPLC s využitím rôznych chirálnych kolón na báze β-cyklodextrínov8), na kolónach Pikloveho typu9, 10), na báze proteínov (sérový albumín, α1-kyslý glykoproteín, ovomukoid)11, 12), crown - éterov13, 14), makrocyklických antibiotík (teikoplanin, vankomycín)15–17) a polysacharidov (karbamáty celulózy a amylózy)18–20) .
Experimentálna časť
Syntéza
(4-hydroxy-3-chlórmetylfenyl)alkanóny a (3-alkoxymetyl-4-hydroxyfenyl)alkanóny boli pripravené podľa metód21, 22). [4-(3-heteroamino-2-hydroxypropoxy)fenyl] alkanóny boli pripravené metódou23) tak, ako je zobrazené v schéme 1.
Schéma 1. Syntéza cieľových zlúčenín 
(4-hydroxy-3-chlórmetyl-4-hydroxyfenyl)alkanón21, 22)
Do sulfonačnej banky opatrenej mechanickým miešadlom, kontaktným teplomerom a lievikom sa k zmesi 0,15 mol 4-hydroxyfenylalkanónu pridá 90 cm3 koncentrovanej kyseliny chlorovodíkovej. Teplota sa udržuje pri 45 – 50 °C a v priebehu 30 minút sa do reakčnej zmesi pridáva 0,15 mol paraformaldehydu a reakčná zmes sa pri danej teplote mieša 4,5 hodiny. Vypadnutý tuhý produkt sa odsaje, premyje vodou a kryštalizuje z benzénu alebo etylacetátu. T.t. 132 – 135 °C, výťažok 75 %.
1-[4-(hydroxy)-3-(chlórmetyl)fenyl]etanón
1H NMR (CD3OD): δ 2,53 (s, 3H, CH3); 4,68 (s, 2H, CH2); 6,86 – 6,89 (d, J = 8,7 Hz, 1H, Ar-H5); 7,83 – 7,86 (dd, J = 2,4, J = 11,1 Hz, 1H, Ar-H6); 7,98 (s, 1H, Ar-H2).
1-[4-(hydroxy)-3-(chlórmetyl)fenyl]propán-1-ón
1H NMR (CD3OD): δ 1,10 – 1,15 (t, J = 7,1 Hz, 3H, CH3); 2,53 – 2,57 (q, J = 7,2 Hz, 2H, CH2CH3); 4,68 (s, 2H, CH2Cl); 6,85 – 6,89 (d, J = 9,4, 1H, Ar-H5); 7,82 – 7,85 (dd, J = 2,4, J = 11,2 Hz, 1H, Ar-H6); 7,99 (s, 1H, Ar-H2).
(3-alkoxymetyl-4-hydroxyfenyl)alkanóny20, 21)
Do sulfonačnej banky opatrenej mechanickým miešadlom, kontaktným teplomerom sa k 0,12 mol (4-hydroxy-3-chlórmetyl-4-hydroxyfenyl)alkanónu pridá 100 cm3 suchého alkoholu (metanol, propán-1-ol, bután-1-ol). Pri teplote 40 – 50 °C sa k reakčnej zmesi v priebehu 1 hodiny pridáva 19,2 g (0,23 mol) hydrogénuhličitanu sodného. Po oddestilovaní alkoholu sa olejovitý zvyšok kryštalizuje z hexánu alebo cyklohexánu.
Spektrálne charakteristiky sú uvedené v prácach21, 22).
1-[3-(alkoxymetyl)-4-(2,3-epoxypropoxy)fenyl]alkanóny
V trojhrdlovej banke opatrenej miešadlom, zábrusným teplomerom a chladičom sa nechá reagovať 4 hodiny pri teplote 50 – 55 °C zmes 0,15 mol 1-(3-alkoxymetyl--4-hydroxyfenyl)alkanónu, 0,17 mol epichlórhydrínu a suspenzie 0,16 mol 85 % KOH. Reakciou vzniknutý KCl sa odsaje a epichlórhydrín sa oddestiluje za zníženého tlaku. Zvyšok po destilácii sa vyextrahuje do dietyléteru alebo etylacetátu a pridá sa ako sušidlo MgSO4. Po odfiltrovaní sušidla a oddestilovaní dietyléteru alebo etylacetátu sa olejový zvyšok použije v ďalšom reakčnom stupni.
1-[3-(alkoxymetyl)-4-(3-heteroamino-2-hydroxypropoxy)fenyl]alkanóny
Vo varnej banke opatrenej spätným chladičom sa v prostredí alkoholu zahrieva 0,08 mol [3-(alkoxymetyl)-4-(2,3-epoxypropoxy)fenyl]alkanónu a 0,16 mol heteroamínu (pyrolidín, azepán, 4-metylpiperazín a 2-metoxyfenylpiperazín) 2 – 4 hodiny pri teplote 30 °C a potom ešte 4 – 5 hodín za varu. Pri syntéze bázy substituovanej metoxyfenylpiperazínom sa ako alkohol použil propán-1-ol, ktorý má vyššiu teplotu varu ako etanol. Po ukončení zahrievania sa etanol, resp. propán-1-ol, oddestiluje a ku zvyšku po destilácii sa pridá voda. Produkt sa extrahuje do etylacetátu a vysuší sa nad K2CO3. Finálna látka získaná vo forme bázy sa po oddestilovaní etylacetátu kryštalizuje z vhodného rozpúšťadla (hexánu, cyklohexánu). Príprava soli sa uskutoční tým, že do éterického roztoku bázy sa pridáva éterický roztok bezvodej kyseliny fumarovej až do kvantitatívneho vyzrážania soli, ktoré je indikované ukončením tvorby zákalu. Vyzrážaná soľ v pomere báza : kyselina 2 : 1 sa prekryštalizuje z etylacetátu alebo propán-1-olu.
Teplota topenia syntetizovaných látok bola stanovená pomocou Koflerovho bloku (HMK, Franz Küstner, Nemecko) a je nekorigovaná. Čistota pripravených zlúčenín bola overená chromatografiou na tenkej vrstve (TLC) za použitia silikagélových platničiek Silufol® UV 254 (Merck) a dvoch mobilných fáz – etylacetát/etyletánamín 9/1 v/v a u látok III, V–VII propán-1-ol/etyl-
etánamín 9,5/0,5 v/v.Na detekciu pod UV svetlom bol použitý prístroj Spectroline CM-10 (Sigma-Aldrich, St. Louis, Missouri, USA).
Infračervené spektrá boli namerané reflexnou technikou s ATR nástavcom s ZnSe kryštálmi na spektrofotometri Nicolet 6700 (Thermo Scientific, Waltham, Massachusetts, USA). Ultrafialové spektrá boli merané spektrofotometrom GENESYS 10S v oblasti vlnových dĺžok 200 – 400 nm. Koncentrácie meraných roztokov báz a solí pripravených aryloxyaminopropanolov v metanole boli približne 0,2 mol · m–3.
1H-NMR spektrá boli namerané na prístroji Varian Gemini 2000 Spectrometer (Varian Inc., Palo Alto, USA) s pracovnou frekvenciou 300 MHz pre 1H NMR. Ako vnútorný štandard bol použitý tetrametylsilán. Na rozpustenie vzoriek boli použité deuterované rozpúšťadlá: chloroform, metanol, DMSO, voda. Chemické posuny sú vyjadrené v ppm (Δ). Multiplicita signálov je vyjadrená ako: s – singlet, d – dublet, dd – dublet dubletu,
t – triplet, q – kvartet, m – multiplet.Elementárna analýza bola nameraná na prístroji FLASH 2000 Organic Elemental Analyzer (Thermo Scientific, Waltham, Massachusetts, USA).
Separácia látok na kolóne s polysacharidovou stacionárnou fázou bola uskutočnená na HPLC systéme AGILENT 1200 (Agilent Technologies, Santa Clara, California, USA) – autosampler, kvartérna pumpa, odplyňovač, DAD detektor, programová analýza dát softvérom Agilent ChemStation pre LC systém. Ako stacionárna fáza bola použitá chirálna amylózová fáza Chiralpak AD (0,46 × 25cm) 5 μm. Mobilná fáza bola zmesou hexánu, etanolu, metanolu a etyletánamínu v rôznom pomere. Látky boli zriedené metanolom na približnú koncentráciu 0,1 mg · ml–1. HPLC rozpúšťadlá boli získané od firmy Merck (Darmstadt, Nemecko).
Podmienky chromatografickej analýzy
Chirálna stacionárna fáza: tris(3,5-dimetylfenylkarbamát)amylóza (Chiralpak AD)
Mobilné fázy: hexán : etanol : metanol : etyletán-
amín v pomere:78 : 11 : 11 : 0,1 v/v/v/v
80 : 10 : 10 : 0,1 v/v/v/v
85 : 7,5 : 7,5 : 0,1 v/v/v/v
95 : 2,5 : 2,5 : 0,1 v/v/v/v
Prietok mobilnej fázy: 0,8 ml/min
Teplota kolóny: 25 °C
Dávkovaný objem: 20 μl
Detekcia: DAD detektor pri vlnovej dĺžke 265 nm
± 8 nmStanovené chromatografické parametre:
retenčný čas: t1 , t2 kapacitné faktory: k1 = (t1 – t0) / t0
faktor selektivity: α = k2 / k1 k2 = (t2 – t0) / t0
rozlišovací faktor: Rs = 2 (t2 – t1) / (w1+w2)
šírka píku: w1, w2
I. (2RS)-bis-{1-[3-(4-acetyl-2-butoxymetylfenoxy)-2-
-hydroxypropyl]pyrolidínium}fumarátVýťažok: 68 %; m.p. 124 –125 °C (etylacetát); RF: 0,62; IČ (cm–1): 3414 (νOH), 1700 (νC=O), 1601 (νC=C),1264 (νArOalk); UV (CH3OH, ε v m2 · mol–1): λ1 222 log ε1 3,57, λ2 272 log ε2 3,59; 1H-NMR (CDCl3): δ 0,93 (t, J = 7,4 Hz 3H, CH3 alk4), 1,41 – 1,46 (m, 2H, CH2 alk3), 1,56 – 1,64 (m, 2H, CH2 alk2), 2,06 – 2,11 (m, 4H, 2×CH2pyr.3,4), 2,56 (s, 3H, COCH3), 3,41 (m, 6H, CH2N, 2×CH2pyr.2,5), 3,54 (t, J = 7,4 Hz, 2H, CH2 alk1), 4,54 (s, 2H, Ar-CH2O), 6,66 (s,
2H, CHfum), 6,84 (d, J = 8,9 Hz, 1H, Ar-H6), 7,80 – 7,86 (d, J = 9,3 Hz 1H, Ar-H3), 7,95 – 7,98 (dd, J = 9,4, 1,4 Hz, 1H, Ar-H5); fumarát C44H66O12N2, Mr 815,02; Anal. vypočítané %C 64,84 %H 8,16 %N 3,44 nájdené %C 64,53 %H 8,02 %N 3,22.II. (2RS)-bis-{1-[3-(4-acetyl-2-butoxymetylfenoxy)-2-
-hydroxypropyl] azepánium}fumarátVýťazok: 71 %; m.p. 84 – 87 °C (etylacetát); RF: 0,69; IČ (cm–1): 3427 (νOH), 1672 (νC=O), 1601 (νC=C), 1264 (νArOalk); UV (CH3OH, ε v m2 · mol-1): λ1 220 log ε1 3,24, λ2 270 log ε2 3,21; 1H-NMR (CDCl3): δ 0,93 (t, J = 7,4 Hz 3H, CH3 alk4), 1,42 – 1,47 (m, 2H, CH2 alk3), 1,57 – 1,65 (m, 2H, CH2 alk2), 2,06 – 2,11 (m, 6H, 3×CH2azepam3,4,5), 2,56 (s, 3H, COCH3), 3,41 (m, 6H, CH2N, 2×CH2azepam2,6), 3,54 (t, J = 7,5 Hz 2H, CH3 alk1), 4,54 (s, 2H, Ar-CH2O), 6,65 (s, 2H, CHfum), 6,85 (d, J = 8,9 Hz 1H, Ar H6), 7,84 (d, J = 9,3 Hz 1H, Ar-H3), 7,94 (dd, J = 9,5, 1,5 Hz 1H, Ar-H5); fumarát C48H74O12N2, Mr 871,14; Anal. vypočítané %C 66,18 %H 8,56 %N 3,22 nájdené %C 66,05 %H 8,32 N% 3,10.
Výťažok: 76 %; m.p. 128 – 130 °C (etylacetát); RF: 0,32; IČ (cm–1): 3492 (νOH), 1662 (νC=O), 1602 (νC=C), 1260 (νArOalk); UV (CH3OH, ε v m2 · mol–1): λ1 206 log ε1 3,67, λ2 274 log ε2 3,22;
1H NMR (CDCl3): δ 0,95 (t, J = 7,3 Hz, 3H, CH3 alk3), 1,61 – 1,68 (m, 2H, CH3 alk2), 2,22 (s, 3H, CH3-Npip), 2,66 (s, 3H, CH3-CO), 2,84 (m, 4H, CH2 piper3,5), 3,53 (t, J = 7,5 Hz, 3H, CH3 alk1), 4,15 (m, 4H, CH2 piper 2,6) 4,16 (m, 2H, Ar-O-CH2), 4,28 (m, 1H, CH-OH), 3,63 (m, 2H, CH2-Npip), 6,55 (s, 2H, CHfum), 7,27 (d, J = 9,3 Hz, 1H, Ar-H4), 7,47 (s, 1H, Ar-H2), 7,49 (t, J = 7,5 Hz 1H, Ar-H6), 7,64 (d, J = 8,7 Hz, 1H, Ar-H5); fumarát C44H68N2O12, Mr 844,48; Anal. vypočítané %C 62,54 %H 8,11 %N 6,63 nájdené %C 62,33 %H 8,41 %N 6,51.IV. (2RS)-bis -{1-[3-(2-metoxyme-4-propanoylfenoxy)-2-
-hydroxypropyl]pyrolidínium}fumarátVýťažok: 66 %; m.p. 110 – 113 °C (etylacetát); RF: 0,64; IČ (cm–1): 3438 (νOH), 1678 (νC=O), 1602 (νC=C), 1256 (νArOalk); UV (CH3OH, ε v m2 · mol–1): λ1 220 log ε1 3,19, λ2 270 log ε2 3,20; 1H NMR (DMSO-d6): δ 1,17 (t, J = 7,5 Hz, 3H, COCH2CH3), 2,05 – 2,09 (m, 4H, CH2 pyr3,4), 3,01 (q, J = 7,1 Hz, 2H, COCH2CH3), 3,29 – 3,11 (m, 6H, NCH2, CH2 pyr 2,5), 3,57 (s, 3H, OCH3), 4,12 (d, J = 7,3 Hz, 2H, OCH2CH), 4,33 – 4,35 (m, 1H, OCH2CH), 4,60 (s, 2H, ArCH2), 6,66 (s, 2H, CHfum), 7,07 (d, J = 9,2 Hz, 1H, Ar-H5), 7,95 – 8,01 (m, 2H, Ar-H2,6); fumarát C40H58N2O12, Mr 758,89; Anal. vypočítané %C 63,31 %H 7,70 %N 3,63 nájdené %C 63,05 %H 7,42 N% 3,40.
V. (2RS)-bis-{1-[3-(2-metoxymetyl-4-propanoylfenoxy)-2-
-hydroxypropyl]-4-metylpiperazínium}fumarátVýťažok: 68 %; m.p. 173 – 174 °C; RF: 0,34; IČ (cm–1): 3338 (νOH), 1678 (νC=O), 1603 (νC=C), 1267 (νArOalk); UV (CH3OH, ε v m2 · mol–1): λ1 220 log ε1 3,67, λ2 270 log ε2 3,20; 1H NMR (CDCl3): δ 1,17 (t, J = 7,5 Hz, 3H, COCH2CH3), 2,22 (s, 3H, CH3-Npip), 3,93 (q, J = 7,1 Hz, 2H, COCH2CH3), 2,84 (m, 4H, CH2 pip 3,5), 3,56 (s, 3H, OCH3), 3,63 (m, 2H, CH2-Npip), 4,15 (m, 4H,CH2 pip2,6), 4,16 – 4,28 (m, 3H, CH2CHOH), 4,54 (s, 2H, ArCH2), 6,55 (s, 2H, CHfum), 7,27 (d, J = 9,0 Hz, 1H, Ar-H4), 7,47 (s, 1H, Ar-H2), 7,49 (t, J = 7,5 Hz, 1H, Ar-H6), 7,64 (d, J = 9,1 Hz 1H, Ar-H5); fumarát C42H64O12N4, Mr 816,46; Anal. vypočítané %C 61,75 %H 7,90 %N 6,86 nájdené %C 61,42 %H 7,71 %N 6,62.
VI. (2RS)-bis-{1-[3-(2-metoxymetyl-4-propanoylfenoxy)-2-
-hydroxypropyl]-4-(2-metoxyfenyl)piperazínium}fumarátVýťažok: 69 %; m.p. 163 – 165 °C (propán-2-ol); RF: 0,50; IČ (cm–1): 3491 (νOH), 1677 (νC=O), 1601 (νC=C), 1241 (νArOalk); UV (CH3OH, ε v m2 · mol–1): λ1 206 log ε1 3,61, λ2 268 log ε2 3,30; 1H NMR (DMSO-d6): δ 1,18 (t, 7,4 Hz, 3H, COCH2CH3), 2,94 (q, J =7,0 Hz, 2H, COCH2CH3), 2,60 – 2,95 (m, 10H, CH2N, CH2 pip2,3,5,6), 3,47 (s, 3H, CH2OCH3), 3,78 (s, 3H, ArOCH3), 4,01 – 4,12 (m, 3H, CH2CHOH), 4,52 (s, 2H, ArCH2), 6,50 (s, 2H, CHfum), 6,86 – 6,97 (m, 4H, pip-Ar), 6,88 – 6,93 (m, 5H, ArH3’, ArH4’, ArH5’, ArH6’, ArH6), 7,12 (d, J = 9,3 Hz, 1H, ArH5), 7,89 – 7,92 (m, 2H, ArH2,6), 7,91 – 7,96 (m, 1H, ArH2); fumarát C54H76O14N4, Mr 1005,22; Anal. vypočítané %C 66,52 %H 7,62 %N 5,57 nájdené %C 66,42 %H 7,51 %N 5,68.
VII. (2RS)-bis-{1-[3-(4-propanoyl-2-propoxymetylfenoxy)-
-2-hydroxypropyl]-4-(2-metoxyfenyl)piperazínium}fumarátVýťažok: 72 %; m.p. 163 – 165 °C (propán-2-ol); RF: 0,54; IČ (cm–1): 3444 (νOH), 1681 (νC=O), 1601 (νC=C), 1236 (νArOalk); UV (CH3OH, ε v m2 · mol–1): λ1 206 log ε1 3,68, λ2 270 log ε2 3,30; 1H NMR (DMSO-d6): δ 0,95 (t, J = 7,3 Hz, 3H, CH3 alk3), 1,61 – 1,68 (m, 2H, CH3 alk2), 1,21 (t, 3H, J = 7,1 Hz, COCH2CH3), 2,90 – 2,97 (m, 2H, COCH2CH3), 2,66 – 2,91 (m, 10H, CH2N, pip2,3,5,6 H), 3,18 (s, 3H, CH2OCH3, 3,53 (t, J = 7,5 Hz, 2H, CH3 alk1), 3,70 (s, 3H, ArO-CH3), 4,02 – 4,08 (m, 3H, CH2CHOH), 4,55 (s, 2H, ArCH2), 6,88 – 6,93 (m, 5H, ArH3’, ArH4’, ArH5’, ArH6’, ArH6), 7,12 (d, J = 9,0 Hz, 1H, ArH5), 7,91 – 7,96 (m, 2H, ArH2,6); fumarát C58H80O14N2, Mr 1057,30; Anal. vypočítané %C 65,89 %H 7,63 %N 5,30 nájdené %C 65,69 %H 7,33 %N 5,60.
Obr. 1. Chromatografický záznam: (1) látky I na CHIRALPAC AD v mobilnej fáze C, (2) látky II na CHIRALPAC AD v mobilnej fáze D, (3) látky III na CHIRALPAC AD v mobilnej fáze C, (4) látky IV na CHIRALPAC AD v mobilnej fáze C, (5) látky V na CHIRALPAC AD v mobilnej fáze C, (6) látky VI na CHIRALPAC AD v mobilnej fáze B, (7) látky VII na CHIRALPAC AD v mobilnej fáze C 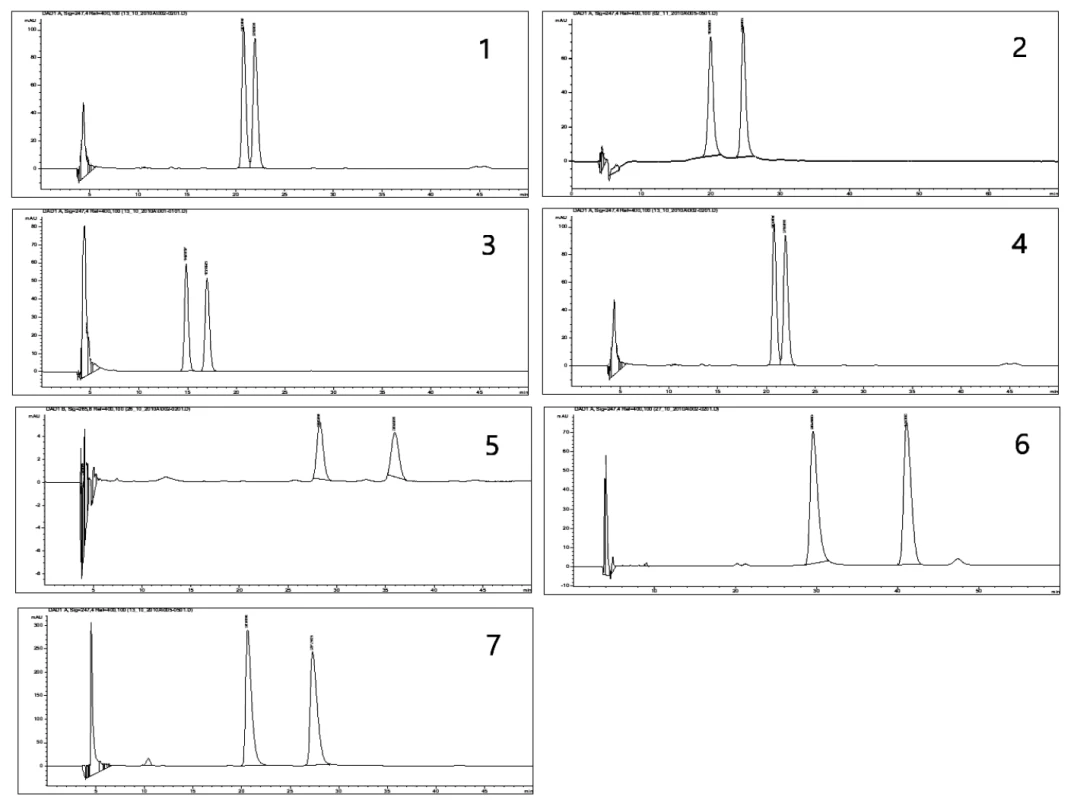
Výsledky a diskusia
Látky I–VII (viď schéma 1) boli pripravené overenou 5-stupňovou syntézou zo 4-hydroxyfenylalkanónov. Ich chlórmetyláciou s paraformaldehydom a kyselinou chlorovodíkovou pripravené (4-hydroxy-3-chlórmetylfenyl)alkanóny s príslušným alkoholom (metanolom, propán-1-olom a bután-1-olom) poskytujú (3-alkoxymetyl-4-hydroxyfenyl)alkanóny. Tieto sú hlavnými medziproduktami na naviazanie aminopropanolového reťazca reakciou s 2-chlórmetyloxiránom a v nasledujúcom stupni s príslušným amínom (pyridínom, azepánom, 4-metylpiperazínom a 2-metoxyfenylpiperazínom).
Získané bázy vo forme viskózneho oleja s kyselinou fumarovou poskytovali fumaráty ako biele kryštalické látky v pomere báza : kyselina fumarová 2 : 1 a s výťažkom v rozmedzí 60 – 70 %. Ich čistota bola kontrolovaná chromatografiou na tenkej vrstve s mobilnou fázou etylacetát/etyletánamín, resp. propán-1-ol/etyletánamín. U pripravených fumarátov boli zmerané IČ, UV, a NMR spektrá. V IČ spektrách boli identifikované charakteristické pásy valenčných vibrácií pre funkčné skupiny: νas (OH) 3414 – 3492 cm–1; ν (C=O) 1662 – 1681 cm–1; ν (C=C)ar 1601 – 1603 cm–1; 1236 – 1267 cm–1.
Tab. 2. Chromatografické parametre pri podmienkach A, B, C, D 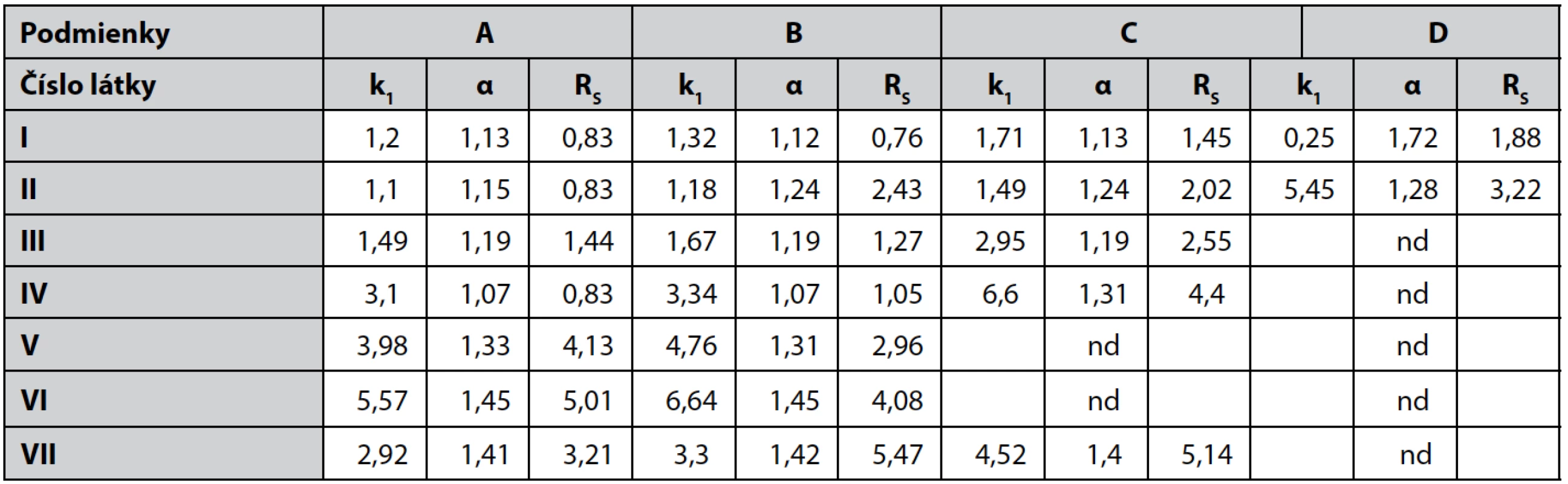
nd – nedeliteľná V UV spektrách pripravených zlúčenín sú prítomné dve absorpčné maximá, pri vlnových dĺžkach v rozmedzí 206 – 222 nm a 262 – 274 nm, s log ε = 3,19 – 3,68, zodpovedajúce π – π*-prechodom.
V 1H-NMR spektrách pre vodíky metylénovej skupiny substituovaného alkoxymetylu (metoxy, propoxy a butoxy) singletové signály s posunom okolo 4,5 ppm. Vodíky propán-2-olového reťazca sú v spektrách prítomné ako multipletové signály s posunmi okolo 4,0 (ArOCH2), 4,3 (CH) a 2,4 až 2,5 ppm (CH2N). Metoxy skupina naviazaná na aromatický kruh, 2-metoxyfenylpiperazínový substituent je v spektrách prítomná ako singlet s posunom okolo 3,8 ppm. Piperazínové vodíky sú prítomné ako multipletové signály s posunmi 2,7 – 2,8 ppm. Interakčné konštanty tripletu a kvartetu propionylovej skupiny sú v zhode s konštantami v propiofenóne24). V NMR spektrách dokazuje pomer báza : kyselina fumarová 2 : 1 dianión kyseliny fumarovej prítomný ako singlet s posunom 6,66 ppm, podobný singletu kyseliny fumarovej25). Substitúciou jedného vodíka v kyseline fumarovej, akým je napr. monoetylfumarát, sa trans vodíky prejavujú ako dublet26).
Signály vodíkov na aromatickom jadre sú v oblasti 6,7 – 8,0 ppm. Interakčné konštanty aromatických vodíkov korešpondujú s konštantami trisubstituovaných benzénových derivátov27) ako aj s konštantami iných betablokátorov28).
Aryloxyaminopropanoly obsahujú vo svojej molekule chirálne centrum na strednom uhlíku propán-2-olového spojovacieho reťazca, čo spôsobuje existenciu dvoch enantiomérnych foriem R a S. V interakcii s chirálnym prostredím, ktorým je aj ľudský organizmus (prítomnosť D-sacharidov a L-aminokyselín), tieto enantioméry môžu vykazovať rozdielnu farmakologickú, farmakokinetickú aktivitu a môžu mať aj rozdielnu toxicitu. Na podobnom princípe je založená aj priama separácia látok na chirálnej kolóne. Ide o rozdielnu interakciu látky s povrchom chirálnej stationárnej fázy za vzniku prechodných diastereoizomérov. V práci použitá polysacharidová Chiralpak AD obsahuje tris(3,5--dimetylfenylkarbamát) amylózy, ktorý sa pripravuje reakciou hydroxylových skupín amylózy s príslušnými izokyanátmi. Vonkajšia strana vzniknutej kavity je pokrytá hydrofóbnymi fenylmi a vnútorná strana je vyplnená karbamátovými zvyškami, s ktorými analyt tvorí vodíkové väzby. Separačná účinnosť je podporená aj tvorbou inklúznych komplexov a π – π*-interakcií aromatických skupín separovaného racemátu a fenylamidu. Tento typ chirálnej kolóny bol použitý v predchádzajúcich prácach aj na semipreparatívne rozdelenie zlúčenín s izopropylom a terc-butylom na bázickom reťazci. U separovanej zlúčeniny pomocou CD bolo zistené, že izomér R sa eluuje pred S-enantiomérom29).
Použité mobilné fázy boli zložené zo 70 – 90 % hexánu, doplnené zmesou metanolu a etanolu v rôznych pomeroch s malým prídavkom etyletánamínu, ktorý zabezpečuje lepšiu separáciu bez chvostovania píkov (mobilné fázy A – D). Prítomnosť alkoholov v mobilnej fáze napomáha lepšej enantioseparácii, ovplyvňuje tvorbu vodíkových väzieb a tým aj interakciu s kolónou.
Použitou chirálnou kolónou dochádza k rozdeleniu všetkých zlúčenín I–VII (tab. 1, obr. 1) v mobilných fázach A (78 : 11 : 11 : 0,1 v/v/v/v) a B (80 : 10 : 10 : 0,1 v/v/v/v) s faktorom selektivity v rozmedzí 1,07 – 1,42 a rozlišovacím faktorom v rozmedzí 0,76 – 5,47. V mobilnej fáze C dochádzalo k rozdeleniu látok s výnimkou V a VI s metoxymetylovou skupinou a piperazínom v bázickej časti. Rozmedzie α bolo 1,13 – 1,40 a Rs 1,45 – 5,14. Zvýšením množstva hexánu v mobilnej fáze D sa rozdelili iba zlúčeniny I a II s pyrolidínom a azepánom až na základnú líniu. Zlúčeniny s objemnejšími heterocyklami u látok III–VII neboli rozdelené, čo poukazuje v týchto mobilných fázach na stérické tienenie stereogénneho centra.
Štúdiom tejto separácie sa potvrdilo, že u takéhoto typu zlúčenín je vhodnejší tento typ chirálneho selektora pred chirálnymi kolónami založenými na báze makrocyklických antibiotík (vankomycínu, teikoplanínu a cyklodextrínu, v ktorých dochádzalo k rozdeleniu zlúčenín s rozvetveným alkylom na bázickom dusíku30).
Aryloxyaminopropanoly sú v klinickej praxi najviac používané kvôli ich β-adrenolytickému účinku. Obmenou štruktúry v hydrofilnej časti, kde je naviazaný heterocyklický amín, prevažuje účinok na α/β receptory31–34) a mnohé deriváty so zabudovaným piperazínom vykazujú antimikróbnu35) aktivitu a sú potenciálnymi antihypertenzívami36).
Stret záujmov: žiaden.
R. Čižmáriková • Ing. Ladislav Habala • J. Valentová • D. Šmátralová
Farmaceutická fakulta UK
Katedra chemickej teórie liečiv
Odbojárov 10, 832 32 Bratislava, SR
e-mail: habala@fpharm.uniba.sk
Zdroje
- Čižmáriková R., Borovanský A., Kozlovský J., Béderová E., Dingová A. 4-(3-Alkylamino-2-hydroxypropoxy)-3-(alkoxymethyl)acetophenones. Collect. Czech. Chem. Commun. 1985; 50, 2289–2298.
- Čižmáriková R., Račanská E., Hroboňová K., Lehotay J., Ághová Z., Halešová D. Synthesis, pharmacological activity and chromatographic separation of some novel potential β-blockers of the aryloxyaminopropanol type. Pharmazie 2003; 58, 237–241.
- Tran V. A., Tran N. H. T., Bach L. G., Nguyen T. D., Nguyen T. T., Nguyen T. T., Nguyen T. A. N., Vo T. K., Vo T. T. T., Le V. T. Facile synthesis of propranolol and novel derivatives. J. Chem. 2020; 2020, art. no. 9597426.
- Čižmáriková R., Habala L., Markuliak M., Valentová J. Survey of pharmacological activity and pharmacokinetics of selected β-adrenergic blockers in regard to their stereochemistry. Appl. Sci. 2019; 9, 625.
- Čižmáriková R., Valentová J., Hutt A. J., Sedláková S. Blokátory β-adrenergických receptorov – skupina chirálnych liečiv. Stereoselektívna syntéza β-blokátorov. Čes. slov. Farm. 2005; 54, 201–206.
- Agustian J., Kamaruddin A. H., Bhatia S. Single enantiomeric β-blockers – the existing technology. Process Biochem. 2010; 45, 1587–1604.
- Saddique F. A., Zahoor A. F., Yousaf M., Irfan M., Ahmad M., Mansha A., Khan Z. A., Naqvi S. A. R. Synthetic approaches towards the synthesis of beta-blockers (betaxolol, metoprolol, sotalol, and timolol). Turk. J. Chem. 2016; 40, 193–224.
- Muntean D. L., Hancu G., Hajnal K., Rusu A., Ciurba A. Cyclodextrine screening for the chiral separation of beta-blocker derivatives. Rev. Chim. 2015; 66, 1019–1023.
- Yang Y., Wang Y., Bao Z., Yang Q., Zhang Z., Ren Q. Progress in the enantioseparation of β-blockers by chromatographic methods. Molecules 2021; 26, 468.
- Pirkle W. H., Lee W. J. Separation of the enantiomers of β-blockers using brush type chiral stationary phase derived from conformationally rigid α-amino β-lactam. Bull. Korean Chem. Soc. 2010; 31, 620–623.
- Barbato F., Carpentiero C., Grumetto L., La Rotonda M. I. Enantioselective retention of β-blocking agents on human serum albumin and α1-acid glycoprotein HPLC columns: Relationships with different scales of lipophilicity. Eur. J. Pharm. Sci. 2009; 38, 472–478.
- Imre S., Ormenişan A., Tero-Vescan A., Muntean D. L., Vari C. E. HPLC enantioseparation of β-blockers on ovomucoid stationary phase. J. Chromatogr. Sci. 2016; 54, 1578–1583.
- Adhikari S., Lee W. Chiral separation using chiral crown ethers as chiral selectors in chirotechnology. J. Pharm. Investig. 2018; 48, 225–231.
- Hyun M. H. Development of HPLC chiral stationary phases based on (+)-(18-crown-6)-2,3,11,12-tetracarboxylic acid and their applications. Chirality 2015; 27, 576–588.
- George N., Herz M., Aboul-Enein H. Y., Shihata L., Hanafi R. Surface design of enantiomeric HPLC separation on vancomycin and teicoplanin-based stationary phases, a tool for chiral recognition of model β-blockers. J. Chromatogr. Sci. 2019; 57, 485–494.
- Pocrnić M., Ansorge M., Dovhunová M., Habinovec I., Tesařová E., Galić N. Chiral separation of beta-blockers by high-performance liquid chromatography and determination of bisoprolol enantiomers in surface waters. Arh. Hig. Rada Toksikol. 2020; 71, 56–62.
- Xu B. J., Zhang D. T., Shen B. C., Xu X. Z. Enantioseparation of seven amino alcohols on teicoplanin chiral column. Chinese J. Anal. Chem. 2007; 35, 55–60.
- Li M., Jiang Z., Di X., Song Y. Enantiomeric separation of six beta-adrenergic blockers on Chiralpak IB column and identification of chiral recognition mechanisms by molecular docking techni-que. Biomed. Chromatogr. 2020; 34, e4803.
- Kalíková K., Martínková M., Schmid M. G., Tesařová E. Cellulose tris-(3,5-dimethylphenylcarbamate)-based chiral stationary phase for the enantioseparation of drugs in supercritical fluid chromatography: comparison with HPLC. J. Sep. Sci. 2018; 41, 1471–1478.
- Mosiashvili L., Chankvetadze L., Farkas T., Chankvetadze B. On the effect of basic and acidic additives on the separation of the enantiomers of some basic drugs with polysaccharide-based chiral selectors and polar organic mobile phases. J. Chromatogr. A 2013; 1317, 167–174.
- Čižmáriková R., Polakovičová M., Mišíková E. Synthesis, physicochemical properties, and conformational studies of (3-alkoxymethyl-4-hydroxyphenyl)ethanones. Chem. Pap. 2002; 56, 256–260.
- Čižmáriková R., Markuliak M., Habala L., Valentová J., Bílková A. Synthesis, antimicrobial and antiradical activity of (3-alkoxymethyl-4-hydroxyphenyl)propan-1-ones intermediates of biological active compounds. Eur. Pharm. J. 2020; (v tlači).
- Čižmáriková R., Némethy A., Valentová J., Hroboňová K., Bruchatá K. Synthesis and HPLC enantioseparation of derivatives of the 3-hydroxyphenylethanone. Acta Fac. Pharm. Univ. Comen. 2012; 59, 15–27.
- ChemicalBook: Propiophenone (93-55-0) 1H NMR. https://www.chemicalbook.com/spectrumen_93-55-0_1hnmr.htm
- ChemicalBook: Fumaric acid (110-17-8) 1H NMR. https://www.chemicalbook.com/SpectrumEN_110-17-8_1HNMR.htm
- ChemicalBook: Monoethyl fumarate (2459-05-4) 1H NMR. https://www.chemicalbook.com/SpectrumEN_2459-05-4_1HNMR.htm
- Milata M., Sedľa P., Brezová V., Gatial A., Kováčik V., Miglierini M., Stankovský Š., Šima J. Aplikovaná molekulová spektroskopia. Slovenská technická univerzita Bratislava 2008; 76.
- Zielinsky-Pisklak M. A., Pisklak D. M., Wawer I. 1H and 13C NMR characteristics of β-blockers. Magn. Reson. Chem. 2011; 49, 284–290.
- Valentová J., Čižmáriková R., Bui T. T. T., Drake A. F., Hutt A. J. Enantiomeric resolution of novel aryloxyaminopropanol derivatives with β-adrenoceptor antagonist activity on a derivatised amylose chiral stationary phase. Chromatography 2003; 58, 733–740.
- Hroboňová K., Lehotay J., Čižmáriková R., Armstrong D. W. Study of mechanism of enantioseparation. Part I. Chiral analysis of alkylaminoderivatives of aryloxypropanols by HPLC using macrocyclic antibiotics as chiral selectors. J. Liq. Chromatogr. 2001; 24, 2225–2238.
- Huang J. J., Huang Y. J., Zhu L., Yuan M., Huang L. Design, synthesis and α1-adrenoceptor blocking activity of new arylpiperazines containing acetophenone substituents. Pharmazie 2014; 69, 578–584.
- Némethy A., Vavrinec P., Vavrincová-Yaghi D., Čepcová D., Mišúth S., Kráľová E., Čižmáriková R., Račanská E. Synthesis and biological evaluation of new combined α/β-adrenergic blockers. Arch. Pharm. 2017; 350, e201600394.
- Huang J. J., Zhang Z. H., He F., Liu X. W., Xu X. J., Dai L. J., Liu Q. M., Yuan M. Novel naftopidil derivatives containing methyl phenylacetate and their blocking effects on α1D/1A-adrenoreceptor subtypes. Bioorg. Med. Chem. Lett. 2018; 28, 547–551.
- Čižmáriková R., Némethy A., Habala L., Račanská E., Valentová J., Hroboňová K. Synthesis, pharmacological activity and chromatographic enantioseparation of new heterocyclic compounds of the aryloxyaminopropanol type derived from 4-hydroxyphenylalkanones. Monatsh. Chem. 2018; 149, 969–976.
- Malík I., Csöllei J., Jampílek J., Stanzel L., Zadražilová I., Hošek J., Pospíšilová Š., Čížek A., Coffey A., O’Mahony J. The structure–antimicrobial activity relationships of a promising class of the compounds containing the N-arylpiperazine scaffold. Molecules 2016; 21, 1274–1299.
- Cecchetti V., Schiaffella F., Tabarrini O., Fravolini A. (1,4-benzothiazinyloxy)alkyl piperazine derivatives as potential antihypertensive agents. Bioorg. Med. Chem. Lett. 2000; 10, 465–468.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2021 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Příčiny a intervence medikačního pochybení ve zdravotnických zařízeních
- Syntéza a HPLC enantioseparácia nových derivátov 3-alkoxy-4-hydroxyfenylalkanónov typu potenciálnych α/β-blokátorov
- Studium anabolické aktivity suchých extraktů listů a oddenků Iris hungarica na modelu hydrokortizonem navozeného katabolismu bílkovin
- Vývoj formulace antistresových pastilek připravených lisováním s využitím frakčního faktoriálního designu Latin cube a přístupu ANOVA
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Příčiny a intervence medikačního pochybení ve zdravotnických zařízeních
- Vývoj formulace antistresových pastilek připravených lisováním s využitím frakčního faktoriálního designu Latin cube a přístupu ANOVA
- Syntéza a HPLC enantioseparácia nových derivátov 3-alkoxy-4-hydroxyfenylalkanónov typu potenciálnych α/β-blokátorov
- Studium anabolické aktivity suchých extraktů listů a oddenků Iris hungarica na modelu hydrokortizonem navozeného katabolismu bílkovin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání