-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Spondyloartritidy: jejich genetická zátěž a dědičnost
Spondyloarthritis: genetic burden and heritability
Spondyloarthropathies (spondyloarthritides, SpA) belong to inflammatory rheumatologic diseases affecting the axial skeleton and peripheral joints. However, they can also manifest with extra-articular symptoms. According to prevailing disability we currently divide them into an axial and peripheral form. The longest known gene association of axial spondyloarthritis is the presence of HLA-B27 antigen. However, this antigen occurs in 6–8 % of the general population and only 2 % of the carriers of this antigen develop SpA during their lifespan. The prevalence of HLA-B27 antigen and the associated prevalence of ankylosing spondylitis (AS) differ not only geographically but also across ethnic groups. Other antigens of the MHC complex (DPA1 or DRB1) as well as gene variants of intracellular proteins (ERAP1, ERAP2, LNPEP, NPEPPS and others) have been found in genetic analyses, the presence of which increases the risk for developing the disease. In spite of great effort, however, only a small part of the heritability of axial spondyloarthritis has been elucidated to date. In peripheral forms, especially in psoriatic arthritis, frequent association with HLA-B27 antigen is also known, as well as an association with HLA-Cw6 antigens and other MHC complex antigens (HLA-B39 and HLA-DQw3). Other studies have shown novel gene variants of proteins that affect TNFα secretion or IL-17 immune response activation (IL-12B, IL-23R, TNIP1, TRAF3IP2, or NFKBIA) that could affect the development of the disease.
Key words:
Spondyloarthritis, heritability, ankylosing spondylitis, psoriatic arthritis
Autoři: K. Grobelná
Působiště autorů: Revmatologický ústav, Revmatologická klinika 1. LF UK, Praha
Vyšlo v časopise: Čes. Revmatol., 25, 2017, No. 2, p. 85-90.
Kategorie: Přehledový článek
Souhrn
Spondyloartritidy patří mezi zánětlivá revmatologická onemocnění postihující axiální skelet, periferní klouby, ale mohou se manifestovat i mimokloubními příznaky. Dle převažujícího postižení je dnes dělíme na formu axiální a periferní. Nejdéle známou genovou asociací axiálních spondyloartritid je přítomnost antigenu HLA-B27, nicméně tento antigen se vyskytuje u 6–8 % populace a pouze 2 % nosičů v průběhu života SpA onemocní. Prevalence antigenu HLA-B27 a s ní spojená prevalence onemocnění AS se nicméně liší nejen geograficky, ale i napříč etnickými skupinami. V rámci genetických analýz byly nalezeny i jiné antigeny MHC komplexu (DPA1 nebo DRB1) ale i genové varianty intracelulárních proteinů (ERAP1, ERAP2, LNPEP, NPEPPS a další), jejichž přítomnost zvyšuje riziko vývoje onemocnění. I přes velkou snahu je však stále objasněna pouze malá část dědičnosti axiálních spondyloartritid. U periferních forem, a to zejména u psoriatické artritidy, je rovněž popisována častá asociace s HLA-B27 antigenem, dobře známá je i asociace s antigeny HLA-Cw6 a dalšími antigeny MHC komplexu (HLA-B39 a HLA-DQw3). Další studie ukázaly nové genové varianty proteinů ovlivňující zejména sekreci TNFα nebo aktivaci IL-17 imunitní odpovědi (IL-12B, IL - 23R, TNIP1, TRAF3IP2, nebo NFKBIA), které by mohly mít vliv na vnik onemocnění.
Klíčová slova:
Spondyloartritidy, dědičnost, ankylozující spondylitida, psoriatická artritidaÚvod
Spondyloartritidy (SpA) jsou heterogenní skupinou zánětlivých revmatických onemocnění, do níž řadíme ankylozující spondylitidu (AS), reaktivní artritidu (ReA), psoriatickou artritidu (PsA), artritidu spojenou s nespecifickým střevním zánětem (EA), juvenilní a nediferencovanou spondyloartritidu. Celá skupina SpA je charakterizována obdobnými klinickými projevy, mezi které patří sakroiliitida, spondylitida, asymetrická periferní oligoartritida postihující zejména velké klouby dolních končetin, entezitida, daktylitida a uveitida. Dále je toto onemocnění asociováno s přítomností antigenu HLA-B27 a s absencí protilátkové aktivity. Dle převažujícího kloubního postižení můžeme spondyloartritidy zjednodušeně dělit na predominantně axiální (charakterizované přítomností zánětlivého postižení páteře a/nebo sakroiliakálních skloubení) a predominantně periferní formu, čehož využívají i klasifikační kritéria odborné společnosti ASAS (Assessment of SpondyloArthritis International Society). Prevalence spondyloartritid je v běžné populaci odhadována na 1-2% procenta, což je více než v případě revmatoidní artritidy.
Axiální spondyloartritidy
Prototypem axiální spondyloartritidy (axSpA) je AS, známá též jako Bechtěrevova choroba. Prevalence tohoto onemocnění se geograficky různí, v Evropě se udává okolo 0,1–1,5 % a v Africe se kupříkladu téměř nevyskytuje. Postihuje 2–3krát častěji muže než ženy. Obvykle začíná mezi 25. až 30. rokem jako nespecifická, pomalu progredující bolest v zádech, probouzející pacienta v noci a zlepšující se po rozcvičení. Vzhledem k široké diferenciální diagnóze bolestí zad a dlouhému časovému úseku k detekci prvních radiografických změn bývá diagnóza tohoto onemocnění opožděna zhruba o 6–9 let (1).
S příchodem magnetické rezonance došlo k možnosti záchytu časné formy, tzv. neradiografické axiální spondyloartritidy (nr-axSpA). Pro tuto jednotku je charakteristická absence typických změn na klasickém rentgenovém snímku sakroiliakálních skloubení (SI) za přítomnosti klinických příznaků odpovídajících AS. Hlavním rozhodujícím zobrazovacím nálezem je v případě nr-axSpA aktivní zánět ve formě kostního edému v SI oblasti patrného při vyšetření magnetickou rezonancí (2,3).
Z prognostického hlediska se jedná o chorobu potenciálně invalidizující. Proto je kladen důraz na včasnou diagnostiku, rychlé zahájení léčby a snížení aktivity nemoci na minimum.
Dědičnost axiálních spondyloartritid
Dřívější teorie o silném genetickém podkladu onemocnění byly podpořeny studiemi, při kterých se prokázalo zvýšení rizika vzniku onemocnění pro sourozence zhruba 50x oproti všeobecnému populačnímu riziku (4).
Nejznámější asociace s rozvojem onemocnění se týká antigenu HLA-B27 (human leukocyte antigen B27). Samotný gen kóduje glykoprotein schopný vázat peptidové fragmenty jiných proteinů pohlcených či produkovaných buňkou a vystavovat je na buněčném povrchu. Existuje mnoho jeho subtypů, z nichž některé jeví silnou (B*2704, 2705), slabou (B*2703) nebo naopak protektivní asociaci s AS (B*2709) (5-8). Přestože je prokázáno silné spojení mezi přítomností antigenu a onemocněním, pouze asi 2 % nosičů nemoc plně vyvine. Samotná prevalence HLA-B27 pozitivních jedinců se liší geograficky a napříč etnickými skupinami. Nejvyšší prevalence je popisována u kmene Pawaia na Papua Nové Gunei (53 %) či domorodců Hadia v západní Kanadě (50 %), téměř nedetekovatelná je naopak u australských Aboriginců či jihoamerických indiánů. V Evropě je prevalence odhadována okolo 6–8 %, přičemž nejvyšší hodnota je udávána ve Skandinávii (14–16 %) a klesá směrem ke středozemnímu moři, na východ od Evropy se prevalence dále snižuje (v Číně 2–9 %, v Japonsku méně než 1 %) (9). Se snižující se prevalencí HLA B27 v jednotlivých populacích se snižuje i prevalence AS.
Dalším antigenem v minulosti asociovaným s onemocněním je kupříkladu i varianta B60, jejíž nosiči mají 3,5x vyšší riziko vzniku nemoci (10). Existuje evidence i o variantách mimo B skupinu HLA komplexu (DPA1 nebo DRB1), které se zdají být nezávislé na přítomnosti B27, avšak jejichž konkrétní typy nebyly dosud plně determinovány. Z předběžných analýz nicméně vycházejí pozitivně pro možnou asociaci s onemocněním haplotypy DRB1*03, DRB1*04 a DRB1*07 (11–13).
V mnoha studiích byl dále prokázán pozitivní záchyt genových variant pro aminopeptidázu endoplazmatického retikula 1 a 2 (ERAP1, ERAP2), případně i jiných peptidáz (Leucyl/cystinyl Aminopeptidase (LNPEP) a Puromycin-sensitive Aminopeptidase (NPEPPS)). ERAP1 je cytoplazmatický protein účastnící se zapracování ligandů do struktury MHC-I (Major Histocompatibility Complex – I). Relativní atributivní riziko vzniku AS pro ERAP1 je asi 25 %, což ho spolu s HLA-B27 (50 %) činí jedním z nejvyšších rizikových faktorů vzniku nemoci. Zajímavé je, že asociace ERAP1 je omezena pouze na HLA-B27 pozitivní pacienty oproti genu pro ERAP2, u kterého existuje tendence k propuknutí choroby u HLA-B27 negativních jedinců (14-16). Většina polymorfismů ERAP1 asociovaných s onemocněním (rs27037, rs27980 a rs27582) je podle metaanalýzy společná pro populaci evropskou ale i východo - a středoasijskou, ale existují i polymorfismy, vyskytující se pouze v dané populaci (17). Důvod těchto rozdílů zůstává neobjasněn.
Při dalším pátrání mimo MHC komplex se slibně ukazují některé geny související s interleukin 23 (IL-23) signální kaskádou, kdy se určité asociace s onemocněním prokázaly jednak u variant pro samotný receptor, ale i pro molekuly přenášející aktivační signál do jádra buňky (Janus Kinase 2 (JAK2), Signal Transducer and Activator of Transcription 3 (STAT3), Tyrosine Kinase 2 (TYK2)) (15, 18, 19). Receptor IL-23 je exprimovaný na velkém množství buněk včetně Th-17 lymfocytů, kde podporuje jejich diferenciaci a zvýšenou produkci IL-17, cytokinu usnadňujícího sekreci dalších prozánětlivých faktorů, např. IL-6, IL-8 nebo tumor nekrotizujícího faktoru α (TNFα). U AS bylo nadměrné množství Th-17 lymfocytů spolu se zvýšenými sérovými hladinami IL-17 popsáno již dříve a v dnešní době se tímto směrem ubírá i vývoj nových léčiv (20, 21).
Přestože velké studie zabývající se identifikací dalších polymorfismů detekovaly již velké množství kandidátních genů (tab. 1), je zatím objasněna jen malá část dědičnosti AS (14, 15, 18).
Tab. 1. Souhrn genů suspektních z asociace s ankylózující spondylitidou identifikovaných pomocí GWAS (15, 18) 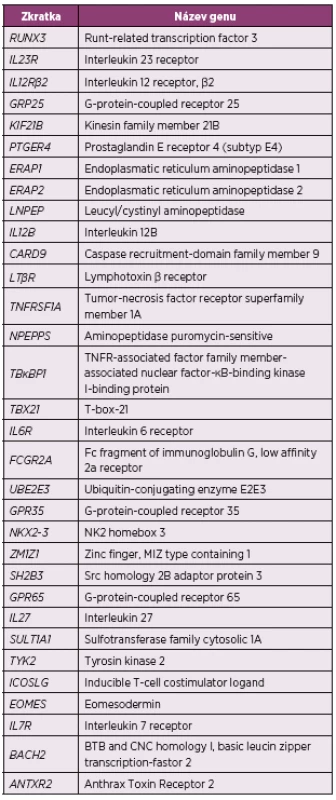
Periferní spondyloartritidy
Periferní spondyloartritidy (pSpA) jsou charakterizované přítomností zánětlivého postižení periferních kloubů, které bývá obvykle asymetrické s preferenčním postižením dolních končetin. Současně v laboratoři nenacházíme přítomnost protilátkové aktivity charakteristickou pro jiné formy artritid. Dalším typickým periferním příznakem je entezitida, definovaná jako zánět v oblasti inzerce svalového úponu ke kosti s nejčastější lokalizací při úponu Achillovy šlachy a plantární fascie. Daktylitidou, třetím typickým příznakem pSpA, rozumíme zánětlivou afekci celého prstu, je tvořena artritidou interfalangeálních kloubů a současnou tenosynovitidou flexoru, často bývá pro svůj vzhled rovněž označována jako „párkový prst“.
Nejčastějším zástupcem pSpA je psoriatická artritida (PsA), která postihuje stejným dílem obě pohlaví s nejvyšší incidencí mezi 35. – 45. rokem věku (22). Recentní analýza 20 epidemiologických studií ukázala přítomnost PsA u 7–26 % pacientů s psoriázou (tento relativně široký interval byl dán nedostatečně odpovídajícími vstupními diagnostickými kritérií PsA napříč studiemi) (23). Celková prevalence v běžné populaci je popisována mezi 0,2–1,9 % (24). Ve většině případů předcházejí kožní projevy psoriázy kloubnímu postižení (25).
Dědičnost psoriatické artritidy
Vyšší riziko vzniku artritidy mají zejména pacienti, kteří mají příbuzné prvního stupně s PsA (26). U PsA je dokonce na základně studií s monozygotními dvojčaty a studií celých rodin udávána silnější dědičnost než u samotné psoriázy (heritabilita psoriasis vulgaris je odhadována mezi 50–90 %, heritabilita PsA je odhadována mezi 80–100 %) (27, 28).Stran přítomnosti samotné psoriázy v rodině, jakožto rizikového faktoru pro vznik PsA, jsou výsledky studií sporné (29, 30).
Podobně jako u AS je i u PsA popisována asociace s HLA lokusy. U PsA byla nejčastější asociace popsána s antigenem HLA-Cw6, nicméně frekvence HLA-B27 antigenu je rovněž velmi vysoká (31–33). Univariantní analýza pacientů s PsA poukázala na asociaci progrese onemocnění s antigeny HLA-B27, HLA-B39 a HLA-DQw3, poslední zmiňovaný antigen je dokonce podezřelý z velmi časné progrese onemocnění (34).
Kromě HLA oblasti byl v roce 1999 popsán polymorfismus v MICA lokusu (konkrétně MICA-002 alela), který znamená zvýšené riziko vzniku a současně nezávislý rizikový faktor pro vývoj PsA u Cw6 pozitivních pacientů (35).
Z dalších kandidátních genů podezřelých s asociací s onemocněním stojí za zmínku varianty IL-12B, IL - 23R, TNIP1, TRAF3IP2, nebo NFKBIA (další varianty viz tabulka 2) (28, 36-38). Téměř ve všech případech byly asociace těchto genových variant prokázány nejprve se vznikem psoriázy a následně v subanalýze vztaženy i k rozvoji PsA. Některé z výše zmíněných genů ovlivňují regulaci sekrece TNFα nebo aktivaci IL-17 imunitní odpovědi, z tohoto důvodu byl recentně výzkum nových léčiv zaměřen směrem k inhibici zmíněných imunitních cest (39, 40).
Tab. 2. Souhrn genů suspektních z asociace s psoriatickou artritidou identifikovaných pomocí GWAS (28) 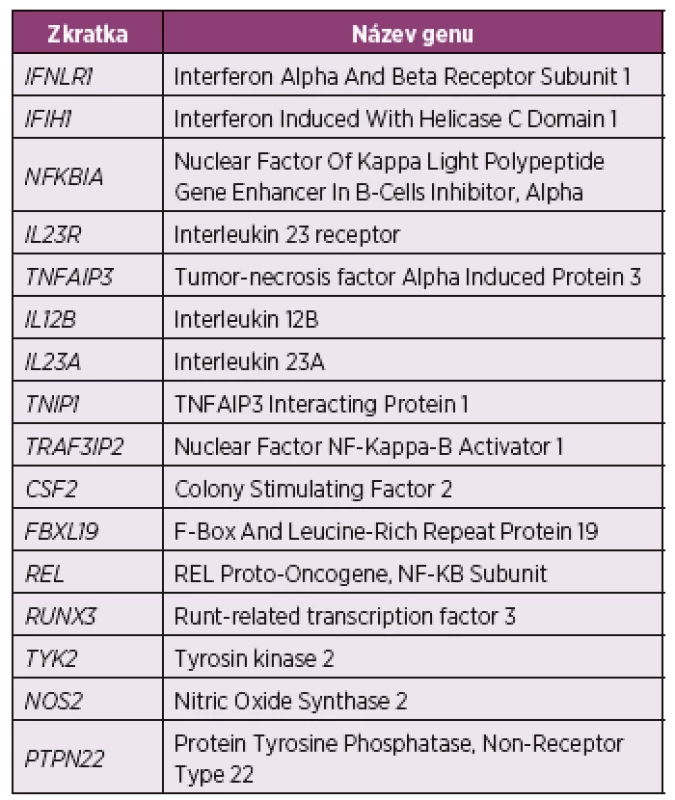
Dědičnost dalších skupin periferních spondyloartritid
ReA patří mezi spondyloartritidy, u kterých je přítomnost artritidy asociovaná s prodělaným infekčním onemocněním (nejčastěji urogenitální nebo průjmové) (41). Postihuje zejména skupinu populace mezi 20.–40. rokem života s častějším výskytem u mužů (třikrát častěji oproti ženám). Výskyt se odhaduje mezi 1–4 % pacientů po prodělané urogenitální infekci (s rozvojem několik dní až 6 týdnů po infekci) (42). Prevalence je značně různorodá napříč populacemi a její hodnocení je obtížné vzhledem k rozdílné klasifikaci nemoci u dětí a dospělých a dále z důvodu nedostatečných národních registrů. Většina populačních studií pochází ze Skandinávie, kde se incidence odhaduje na 10–30/100 000 obyvatel (42). ReA je podobně jako ostatní typy spondyloartritid silně asociována s antigenem HLA-B27 (30–70 % pacientů) a má tendenci ke zvýšenému rodinnému výskytu. HLA-B27 pozitivní pacienti mají 50x zvýšené riziko vývoje ReA. Zároveň se u HLA-B27 pozitivních pacientů zvyšuje riziko závažnějšího a prolongovaného průběhu (41).
Pro skupinu enteropatických spondyloartritid (EA) platí, že se artritida objevuje u pacientů trpícími zároveň idiopatickými střevními záněty (IBD), Whippleho chorobou, celiakií nebo po bariatrických operacích. U pacientů s IBD patří revmatická onemocnění vůbec k nejčastějším extraintestinálním příznakům a jejich přítomnost se odhaduje u 17–39 % pacientů. Kloubní postižení se může vyskytnout před, zároveň nebo i po manifestaci IBD (43). Periferní artritida se vyskytuje u 10–20 % pacientů a axiální postižení je u 2–16 % pacientů s IBD (43) (prevalence se ještě mírně liší u různých typů IBD). Periferní postižení je oproti axiálnímu častější u žen (44). Přítomnost HLA-B27 antigenu se udává u 30–80 % axiálních forem (45, 46). Periferní artritida se pojí i s přítomností jiných antigenů, a to konkrétně HLA-DR0103, B35 (u periferní artritidy 1. typu – akutní oligoartritida trvající méně než 10 týdnů, obvykle v koincidenci s relapsy IBD) a B44 (u periferní artritidy 2. typu – polyartritida, trvající i několik let s možným erozivním postižením kloubů, independentní na průběhu IBD) (47, 48). Kromě genů souvisejících s MHC komplexem byly s onemocněním asociovány i genové polymorfismy jiných proteinů (IL-23R, CARD15, KIF21B, STAT3, IL-12B,CDKAL1, LRRK2/MUC19) (49-51).
Závěr
K dnešnímu dni existuje velké množství prací zabývajících dědičností SpA. Pro již v minulosti popsanou zvýšenou četnost onemocnění v takto postižených rodinách a zvýšenou incidenci u pacientů s pozitivitou HLA-B27 antigenu se výzkum nejprve obracel směrem k MHC komplexu (4, 10, 11). Vzhledem k nedostatečnému vysvětlení dědičnosti onemocnění v rámci této části genomu se postupně objevovaly další práce zabývající se genovými variantami i jiných proteinových molekul (16, 19). Nejen u axiálních, ale i periferních SpA byly recentně publikovány genomové analýzy popisující další suspektní genové lokusy (18, 28). I přes veškerou snahu není stále dědičnost SpA plně objasněna a je nutné další studium nových genových variant s možnou asociací s tímto potenciálně závažným onemocněním.
Podpořeno institucionální podporou MZ ČR 023728 a z SV 260373
Adresa pro korespondenci:
MUDr. Kristýna Grobelná
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: grobelna@revma.cz
Zdroje
1. Braun J, Sieper J. Ankylosing spondylitis. Lancet 2007; 369 : 1379 – 90.
2. Rudwaleit M, van der Heijde D, Landewe R, Akkoc N, Brandt J, et al. The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011; 70 : 25–31.
3. 3. Mandl P, Navarro-Compán V, Terslev L, et al. EULAR recommen-dations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Annals of the Rheumatic Diseases Published Online First: 02 April 2015. doi:10.1136/annrheumdis-2014-206971.
4. Carter N, Williamson L, Kennedy LG, Brown MA, Wordsworth BP. Susceptibility to ankylosing spondylitis. Rheumatology (Oxford, England) 2000; 39 : 445.
5. Ben Radhia K, Ayed-Jendoubi S, Sfar I, Ben Romdhane T, Makhlouf M, et al. Distribution of HLA-B*27 subtypes in Tunisians and their association with ankylosing spondylitis. Joint Bone Spine Rev Rhum 2008; 75 : 172–5.
6. Lopez-Larrea C, Sujirachato K, Mehra NK, Chiewsilp P, Isarangkura D, et al. HLA-B27 subtypes in Asian patients with ankylosing spondylitis. Evidence for new associations. Tissue Antigens 1995; 45 : 169–76.
7. MacLean IL, Iqball S, Woo P, Keat AC, Hughes RA, et al. HLA-B27 subtypes in the spondarthropathies. Clin Exp Immunol 1993; 91 : 214–9.
8. Reveille, J.D., Inman, R., Khan, M.A., Yu, D.T.K., Jin, L. Family studies in ankylosing spondylitis: microsatellite analysis of 55 concordant sib pairs. J Rheumatol. 2000; 27 : 5.
9. van der Linden SM, Valkenburg HA, de Jongh BM, Cats A. The risk of developing ankylosing spondylitis in HLA-B27 positive individuals. A comparison of relatives of spondylitis patients with the general population. Arthritis Rheum 1984; 27 : 241–9.
10. Wei JC, Tsai WC, Lin HS, Tsai CY, Chou CT. HLA-B60 and B61 are strongly associated with ankylosing spondylitis in HLA-B27-negative Taiwan Chinese patients. Rheumatology (Oxford) 2004; 43 : 839–42.
11. Diaz-Pena R, Aransay AM, Bruges-Armas J, Lopez-Vazquez A, Rodriguez-Ezpeleta N, et al. Fine mapping of a major histocompatibility complex in ankylosing spondylitis: association of the HLA-DPA1 and HLA-DPB1 regions. Arthritis Rheum 2011; 63 : 3305–12.
12. Breban M. Genetic studies of spondylarthropathies. French Spondylarthropathy Genetic Study Group. Ann Med Interne 1998; 149 : 142–4.
13. Sims AM, Barnardo M, Herzberg I, Bradbury L, Calin A, et al. Non-B27 MHC associations of ankylosing spondylitis. Genes Immunity 2007; 8 : 115–23.
14. Robinson PC, Brown MA. Genetics of ankylosing spondylitis. Mol Immunol 2014; 57 : 2–11.
15. Cortes A, Hadler J, Pointon JP, Robinson PC, Karaderi T, et al. Identification of multiple risk variants for ankylosing spondylitis through high-density genotyping of immune-related loci. Nature Genetics 2013; 45 : 730–8.
16. Alvarez-Navarro C, Lopez de Castro JA. ERAP1 structure, function and pathogenetic role in ankylosing spondylitis and other MHC-associated diseases. Mol Immunol 2014; 57 : 12–21.
17. Lee YH, Song GG. Associations between ERAP1 polymorphisms and susceptibility to ankylosing spondylitis: a meta-analysis. Clin Rheumatol 2016; 35 : 2009–15.
18. Reveille JD, Sims AM, Danoy P, Evans DM, Leo P, et al. Genome-wide association study of ankylosing spondylitis identifies non-MHC susceptibility loci. Nature Genet 2010; 42 : 123–7.
19. Rahman P, Inman RD, Gladman DD, Reeve JP, Peddle L, Maksymowych WP. Association of interleukin-23 receptor variants with ankylosing spondylitis. Arthritis Rheum 2008; 58 : 1020–5.
20. Jandus C, Bioley G, Rivals JP, Dudler J, Speiser D, Romero P.Increased numbers of circulating polyfunctional Th17 memory cells in patients with seronegative spondylarthritides. Arthritis Rheum 2008; 58 : 2307–17.
21. Smith JA, Colbert RA. Review: The interleukin-23/interleukin-17 axis in spondyloarthritis pathogenesis: Th17 and beyond. Arthritis Rheumatology (Hoboken, 2014; 66 : 231–41.
22. Gladman DD. Psoriatic arthritis. Rheum Dis Clin North Am 1998; 24 : 829–44.
23. Prey S, Paul C, Bronsard V, Puzenat E, Gourraud PA, et al.Assessment of risk of psoriatic arthritis in patients with plaque psoriasis: a systematic review of the literature. J Eur Acad Dermatol Venerol 2010; 24 (Suppl 2): 31–5.
24. Paparo F, Revelli M, Semprini A, Camellino D, Garlaschi A, et al. Seronegative spondyloarthropathies: what radiologists should know. Radiol Med 2014; 119 : 156–63.
25. Gladman D, Antoni C, Mease P, Clegg D, Nash P. Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Annals of the Rheumatic Diseases. 2005;64(Suppl 2):ii14-ii17. doi:10.1136/ard.2004.032482.
26. Moll JM, Wright V. Familial occurrence of psoriatic arthritis. Ann Rheum Dis 1973; 32 : 181–201.
27. Liu Y, Helms C, Liao W, Zaba LC, Duan S, et al. A genome-wide association study of psoriasis and psoriatic arthritis identifies new disease loci. PLoS Genet 2008; 4: e1000041.
28. Stuart PE, Nair RP, Tsoi LC, Tejasvi T, Das S, et al. Genome-wide association analysis of psoriatic arthritis and cutaneous psoriasis reveals differences in their genetic architecture. Am J Hum Genet 2015; 97 : 816–36.
29. Reich K, Kruger K, Mossner R, Augustin M. Epidemiology and clinical pattern of psoriatic arthritis in Germany: a prospective interdisciplinary epidemiological study of 1511 patients with plaque-type psoriasis. Br J Dermatol 2009; 160 : 1040–7.
30. Soltani-Arabshahi R, Wong B, Feng BJ, Goldgar DE, Duffin KC, Krueger GG. Obesity in early adulthood as a risk factor for psoriatic arthritis. Arch Dermatol 2010; 146 : 721–6.
31. Castelino M, Barton A. Genetic susceptibility factors for psoriatic arthritis. Curr Opin Rheumatol 2010; 22 : 152–6.
32. Nair RP, Stuart PE, Nistor I, Hiremagalore R, Chia NV, et al. Sequence and haplotype analysis supports HLA-C as the psoriasis susceptibility 1 gene. Am J Hum Genet 2006; 78 : 827–51.
33. Gladman DD, Farewell VT, Pellett F, Schentag C, Rahman P.HLA is a candidate region for psoriatic arthritis. evidence for excessive HLA sharing in sibling pairs. Hum Immunol 2003; 64 : 887–9.
34. Gladman DD, Farewell VT. The role of HLA antigens as indicators of disease progression in psoriatic arthritis. Multivariate relative risk model. Arthritis Rheum 1995; 38 : 845–50.
35. Gonzalez S, Martinez-Borra J, Torre-Alonso JC, Gonzalez-Roces S, Sanchez del Rio J, et al. The MICA-A9 triplet repeat polymorphism in the transmembrane region confers additional susceptibility to the development of psoriatic arthritis and is independent of the association of Cw*0602 in psoriasis. Arthritis Rheum 1999; 42 : 1010–6.
36. Stuart PE, Nair RP, Ellinghaus E, Ding J, Tejasvi T, et al. Genome-wide association analysis identifies three psoriasis susceptibility loci. Nat Genet 2010; 42 : 1000–4.
37. Duffin KC, Freeny IC, Schrodi SJ, Wong B, Feng BJ, et al. Association between IL13 polymorphisms and psoriatic arthritis is modified by smoking. J Investigative Dermatol 2009; 129 : 2777–83.
38. Huffmeier U, Lascorz J, Bohm B, Lohmann J, Wendler J, et al. Genetic variants of the IL-23R pathway: association with psoriatic arthritis and psoriasis vulgaris, but no specific risk factor for arthritis. Journal Investigative Dermatol 2009; 129 : 355–8.
39. Mease P, McInnes IB. Secukinumab: A New Treatment Option for Psoriatic Arthritis. Rheumatol Ther 2016; 3 : 5–29.
40. Soubrier M, Pereira B, Frayssac T, Abdi D, Couderc M, et al.Psoriatic arthritis treated by anti-TNFs: a monocentric trial of 102 cases in Auvergne (France).Clin Exp Rheumatol. 2016 Nov-Dec;34(6):1059-1064. Epub 2016 Aug 31
41. Hamdulay SS, Glynne SJ, Keat A. When is arthritis reactive? Postgrad Med J 82 : 446–53.
42. Leirisalo-Repo M, Sieper J. Chapter 5 - Reactive spondyloarthritis: epidemiology, clinical features, and treatment A2 - Weisman, Michael H. In Ankylosing Spondylitis and the Spondyloarthropathies, ed. Dvd Heijde, JD Reveille:53-64. Philadelphia: Mosby 2006 Number of 53–64.
43. Peluso R, Di Minno MND, Iervolino S, Manguso F, Tramontano G, et al. Enteropathic spondyloarthritis: from diagnosis to treatment. Clin Develop Immunol 2013 : 631408.
44. Yuksel I, Ataseven H, Basar O, Koklu S, Ertugrul I, et al. Peripheral arthritis in the course of inflammatory bowel diseases. Digestive Dis Sciences 2011; 56 : 183–7.
45. Mallas EG, Mackintosh P, Asquith P, Cooke WT. Histocompatibility antigens in inflammatory bowel disease. Their clinical significance and their association with arthropathy with special reference to HLA-B27 (W27). Gut 1976; 17 : 906–10.
46. Rodríguez-Reyna TS, Martínez-Reyes C, Yamamoto-Furusho JK. Rheumatic manifestations of inflammatory bowel disease. W J Gastroenterol 2009; 15 : 5517–24.
47. Orchard TR, Thiyagaraja S, Welsh KI, Wordsworth BP, Hill Gaston JS, Jewell DP. Clinical phenotype is related to HLA genotype in the peripheral arthropathies of inflammatory bowel disease. Gastroenterol 2000; 118 : 274–8.
48. Yamamoto-Furusho JK. Genetic factors associated with the development of inflammatory bowel disease. W J Gastroenterol 2007; 13 : 5594–7.
49. Duerr RH, Taylor KD, Brant SR, Rioux JD, Silverberg MS, et al. A genome-wide association study identifies IL23R as an inflammatory bowel disease gene. Science 2006; 314 : 1461–3.
50. Miceli-Richard C, Zouali H, Lesage S, Thomas G, Hugot JP, et al. CARD15/NOD2 analyses in spondylarthropathy. Arthritis Rheum 2002; 46 : 1405–6.
51. Van Praet L, Van den Bosch F, Mielants H, Elewaut D. Mucosal inflammation in spondylarthritides: past, present, and future. Curr Rheumatol Reports 2011; 13 : 409–15.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2017 Číslo 2- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
Nejčtenější v tomto čísle- Reaktivní artritidy
- Doporučení České revmatologické společnosti pro léčbu systémové sklerodermie
- Spondyloartritidy: jejich genetická zátěž a dědičnost
-
XIV. seminář mladých revmatologů
Mikulov, 11. – 13. 5. 2017
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



