-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba revmatoidní artritidy a játra
Treatment of rheumatoid arthritis and the liver
A review of liver diseases which are commonly associated with rheumatoid arthritis is presented. In adults, liver steatosis, autoimmune hepatitis, primary biliary cirrhosis and hepatitis B reactivation and recurrence are frequently encountered. Basic differential diagnosis of these medical conditions and their therapy is discussed. A drug-induced liver injury is also frequent in patients with rheumatoid arthritis. We define the drug-induced liver injury and its classification, and further, we discuss differential diagnosis, ethiology and mechanism of toxicity of drugs used in rheumatoid arthritis therapy.
Key words:
rheumatoid arthritis, liver, hepatitis B, drug-induced liver injury
Autoři: S. Fraňková
; J. Šperl
; J. Špičák
Působiště autorů: Klinika hepatogastroenterologie, Institut klinické a experimentální medicíny, Praha
Vyšlo v časopise: Čes. Revmatol., 18, 2010, No. 3, p. 112-118.
Kategorie: Přehledné referáty
Souhrn
Práce se zabývá onemocněními jater, která můžeme diagnostikovat u pacientů s revmatoidní artritidou. U dospělých je to nejčastěji jaterní steatóza, dále autoimunní hepatitida, primární biliární cirhóza. Vlivem imunosupresiv může dojít k reaktivaci či rekurenci infekce virem hepatitidy B. Je zde uvedena základní diferenciální diagnostika těchto onemocnění. Polékové poškození jater je u pacientů léčených pro revmatoidní artritidu časté. Je uvedena definice a základní rozdělení polékového jaterního poškození a jeho diferenciální diagnostika, dále je popsán mechanismus vzniku a typický klinické obraz jaterního poškození léky nejčastěji užívanými při terapii revmatoidní artritidy.
Klíčová slova:
revmatoidní artritida, játra, hepatitida B, polékové jaterní poškozeníÚvod
Revmatoidní atritida jako autoimunní onemocnění může být provázena řadou jaterních chorob. Z hlediska etiologie lze jaterní onemocnění provázející revmatoidní artritidu rozdělit do následujících skupin: (1) asociovaná autoimunní onemocnění jater, tj. zejména autoimunní hepatitida a primární biliární cirhóza, (2) další velkou skupinu tvoří toxické poškození jater podávanými léky, (3) specifickou skupinu tvoří zhoršení průběhu chronické infekce virem hepatitidy B a C vlivem imunosupresiv, (4) steatóza jater pak může být projevem jak lékové toxicity, tak tzv. metabolického syndromu, k jehož rozvoji přispívá zejména omezená pohybová aktivita pacientů s revmatoidní artritidou (tab. 1).
Tab. 1. Onemocnění jater asociovaná s revmatoidní artritidou a její léčbou. 
Steatóza jater
Steatóza jater při léčbě revmatoidní artritidy může být projevem metabolického syndromu, ale může vzniknout rovněž při léčbě kortikoidy jako projev polékového jaterního poškození. Nealkoholické ztučnění jater (NAFLD), v současné době nejčastěji diagnostikovanou chorobou jater v USA a západních zemích (1). Vyskytuje se u žen i mužů, ve všech věkových skupinách včetně dětí. NAFLD se stává významnou nozologickou jednotkou díky své vysoké prevalenci (20–30 % populace v USA) a možnosti progrese zánětu a fibrózy při nealkoholické steatohepatitidě (NASH). NAFLD je dnes chápáno jako jaterní manifestace metabolického syndromu. Rizikovými faktory vzniku NAFLD jsou: centrální typ obezity, diabetes mellitus 2. typu, inzulínová rezistence (IR) a porucha metabolismu lipidů. Diagnózu NAFLD stanovujeme per exclusionem, vyloučením ostatních jaterních onemocnění s podobným klinickým a histologickým obrazem (obr. 1). Rozhodující je pečlivá anamnéza týkající se konzumace alkoholu, neboť laboratorní, klinická a histologická manifestace alkoholické nemoci jater a NASH má společné rysy. Tolerované množství alkoholu je v tomto případě 10 g/ den u žen a 20 g/ den u mužů. U pacientů s NASH i malé množství konzumovaného alkoholu může přispívat k progresi jaterního poškození.
Obr. 1. Steatóza jater při léčbě kortikoidy. Těžká (85–90 % hepatocytů) smíšená, převážně velkokapénková steatóza, mírná zánětlivá celulizace, mírná periportální a perisinusoidální fibróza. Barvení: H&E, zvětšeno 10x. 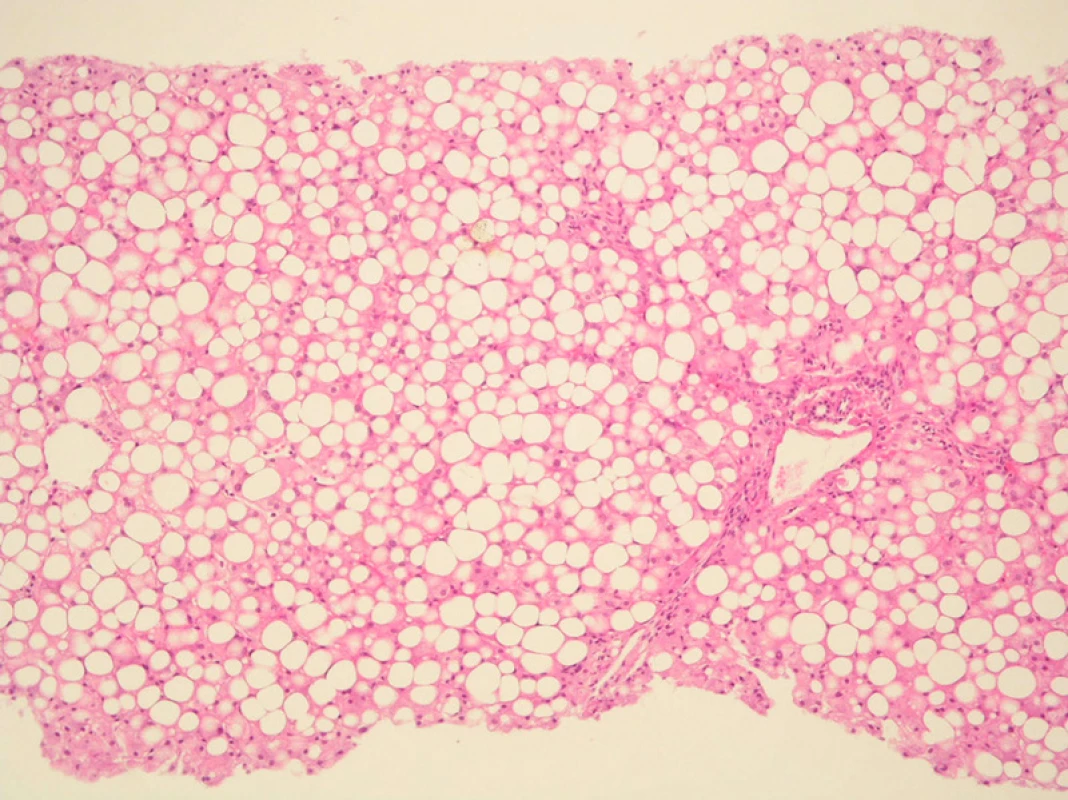
Steatóza jater je obvykle zcela asymptomatická a projevuje se pouze mírnou, kolísavou elevací aktivity jaterních enzymů (2–5násobek normy AST a ALT). Pouze malá část pacientů si může stěžovat na nevýkonnost, únavu či bolest v pravém podžebří, při fyzikálním vyšetření pacienta pak zjišťujeme hepatomegalii.
Zobrazovací metody, kterými nejčastěji stanovujeme diagnózu steatózy jater, jsou nespecifické. Ultrazvukové vyšetření, CT a vyšetření magnetickou rezonancí (včetně MR spektroskopie) spolehlivě detekují steatózu, ale nejsou schopna rozlišit NAFLD (steatózu prostou) od NASH (se zánětlivou složkou a možnou progresí fibrózy), proto zlatým standardem diagnostiky zůstává necílená jaterní biopsie, ať již se jedná o steatózu při NAFLD nebo steatózu jako následek lékové toxicity. Histologicky je pro steatózu charakteristická přítomnost tukových kapének ve více než 5 % hepatocytů. Minimální histologická kritéria pro diagnózu NASH jsou pak steatóza, smíšená zánětlivá lobulární infiltrace a balónová degenerace hepatocytů (2).
Autoimunní hepatitida
Autoimunní hepatitida (AIH) je chronické zánětlivé onemocnění jater, jehož příčina není dosud známá. Je charakterizována nálezem tzv. interface hepatitidy (lymfoplazmocytární zánětlivá infiltrace portálních polí pronikající do přilehlého jaterního parenchymu s nekrózami hepatocytů) v histologickém obraze, laboratorně je přítomna hypergamaglobulinémie a autoprotilátky (3). AIH je následkem složité interakce mezi genetickými predispozicemi, spouštějícími faktory, autoantigeny a imunoregulačními mechanismy. V Evropě prevalence AIH činí přibližně 16,9 případů na 100 000 obyvatel, ženy jsou postiženy častěji než muži (3,6 : 1). Diagnóza AIH je založena na průkazu autoprotilátek, hypergamaglobulinémie a zvýšené aktivity sérových aminotransferáz a je potvzena charakteristickým bioptickým nálezem (obr. 2) po vyloučení ostatních možných příčin jaterního onemocnění. Diagnostická kritéria autoimunní hepatitidy shrnuje tabulka 2. Vzácně může být první manifestací AIH akutní jaterní selhání. Diagnóza je obtížná u nemocných již léčených imunosupresivy, neboť podávaná medikace ovlivní laboratorní a histologický nález. Léčba kortikoidy v monoterapii či v kombinaci s azathioprinem zabrání progresi fibrózy a vede k remisi onemocnění u více než 80 % pacientů. Léčba má být zahájena u všech nemocných s vysokou aktivitou onemocnění a ukončena teprve po dosažení biochemické, ale i histologické remise choroby. K relapsu onemocnění po vysazení medikace dojde u 50–79 % pacientů, ti pak jsou léčeni znovu dlouhodobě azathioprinem (4).
Tab. 2. Diagnostická kritéria autoimunní hepatitidy. 
Obr. 2. Autoimunní hepatitida. Portální pole s fibrózou, edémem a smíšenou, převážně lymfoplazmocytární infiltrací s výraznou interface aktivitou. Barvení: H&E, zvětšeno 200x. 
Primární biliární cirhóza
Primární biliární cirhóza (PBC) je chronické cholestatické onemocnění, charakterizované autoimunitně podmíněnou destrukcí malých a středních intrahepatálních žlučovodů (5). Laboratorně je charakteristický vysoký sérový titr antimitochondriálních protilátek (AMA). Onemocnění postihuje téměř výhradně ženy (10 : 1 k mužům) středního věku, a může se projevit pruritem, únavou a ikterem. Většina pacientek však nemá v době diagnózy žádné příznaky a onemocnění je zjištěno náhodně, často v rámci diagnózy jiného autoimunního onemocnění (6). Ultrazvukové vyšetření není pro PBC charakteristické, je však nutné k vyloučení dilatace žlučových cest při elevaci ALP a GMT. Diagnóza PBC (7) je založena na průkazu zvýšení aktivity cholestatických jaterních enzymů (ALP), titru sérových AMA > 1 : 40 a charakteristickém obraze poškození žlučovodů v jaterní biopsii (obr. 3), která rovněž posoudí stupneň jaterní fibrózy. Lékem volby při PBC je kyselina ursodeoxycholová (UDCA) v dávce 13–15 mg/kg a den. UDCA snižuje hodnotu sérového bilirubinu, ALP, GMT i cholesterolu, zlepšuje rovněž histologický nález, zabrání progresi onemocnění, zejména je-li podávání zahájeno v časných stadiích (8).
Obr. 3. Primární biliární cirhóza. Mírně aktivní chronická hepatitida, destrukce interlobulárních žlučovodů, stadium 2 dle Ludwiga. Barvení: H&E, zvětšeno 20x. 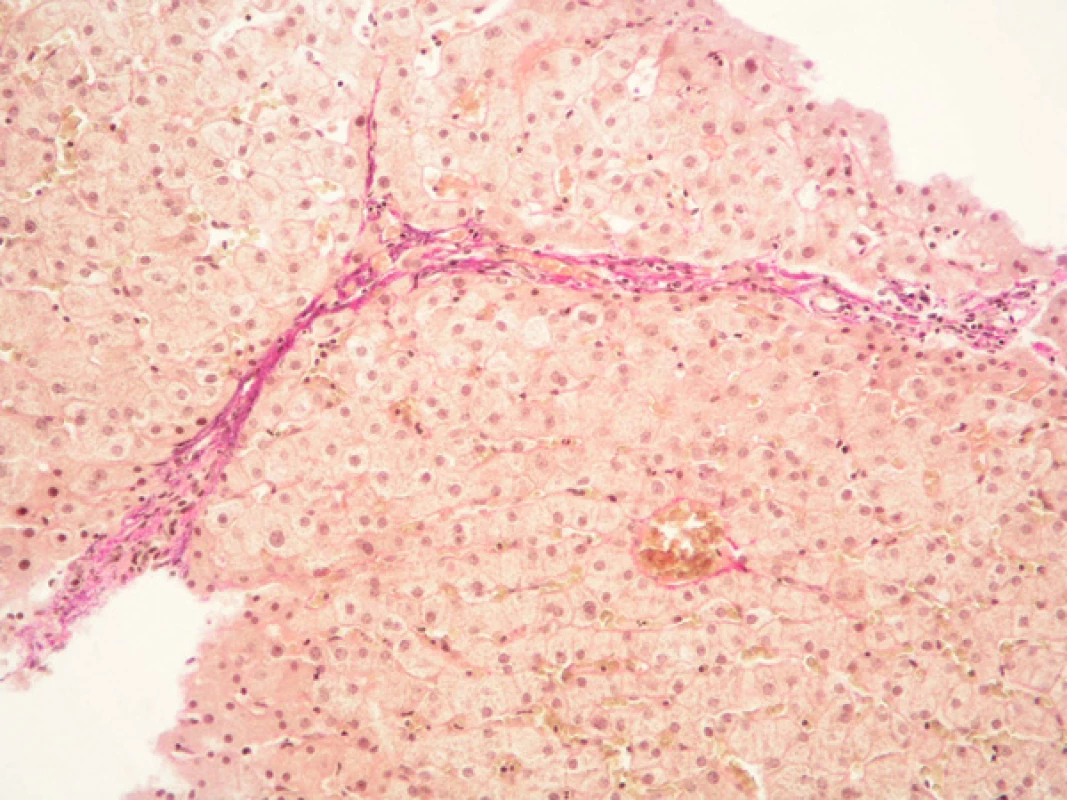
Reaktivace a rekurence virové hepatitidy B
Virus hepatitidy B (HBV) je hepatotropní, malý obalený DNA virus. HBV není přímo cytopatogenní a zánik infikovaných hepatocytů je vyvolán imunitní reakcí hostitele. Akutní fáze infekce je zpravidla mírná a končí většinou spontánním ukončením virové replikace a vyhojením hepatitidy. Přechod infekce do chronicity je zvláště častý u novorozenců a osob imunosuprimovaných. Imunosupresivní léčba sníží imunitní reakci namířenou proti infikovaným hepatocytům, na druhou stranu oslabí imunitní kontrolu replikace viru (9). Zvyšuje se podíl infikovaných hepatocytů, replikace HBV stoupá. Replikace viru hepatitidy B tak dosáhne úrovně, kdy již vede k přímému poškození infikovaných hepatocytů, virus hepatitidy B se tím stává cytopatogenní. Klinickým obrazem popsaných pochodů je rozvoj vzplanutí chronické hepatitidy („flare-up“), v krajním případě i fulminantní hepatitida se selháním jater. V případě, kdy imunosupresivní léčba vede k výraznému nárůstu virémie a vzplanutí hepatitidy u dosud inaktivního nosiče viru (HBsAg pozitivního), hovoříme o reaktivaci chronické hepatitidy B. Dalším nepříznivým pochodem, který může imunosupresivní léčba vyvolat u pacientů, kteří v minulosti prodělali hepatitidu B, je rekurence onemocnění. Rekurencí rozumíme stav, kdy se pacient znovu stane HBsAg pozitivním a replikace HBV rychle roste. Virová nukleová kyselina perzistuje trvale v hepatocytech ve formě tzv. γDNA (covalently closed circular DNA) i u pacientů, kteří dle sérologické terminologie virus „eliminovali“ a stali se HBsAg negativními. Současná data založená na výsledcích molekulárně biologických metod dokládají, že k úplné eliminaci viru hepatitidy B nikdy nedojde. Stav dříve nazývaný eliminací viru je jen účinnou imunitní kontrolou replikace s poklesem virémie k mezím detekovatelnosti. Ztráta imunitní kontroly replikace viru vlivem imunosupresivní léčby tak vede k rekurenci hepatitidy B.
Reaktivací a rekurencí hepatitidy B jsou ohroženi nejen pacienti s tumory podstupující chemoterapii, ale i nemocní s autoimunními chorobami léčení klasickými imunospresivy a nově i anti-TNF-α a anti-CD20 preparáty. Za nejnebezpečnější léčbu z hlediska reaktivace hepatitidy B se nyní považuje rituximab v kombinaci s kortikosteroidy. Klinický obraz reaktivace hepatitidy B obvykle kolísá od asymptomatického zvýšení aktivity aminotransferáz (50 %) k obrazu těžké akutní hepatitidy s ikterem (10 %), nejzávažnější variantou je fulminantní selhání jater (5 %). Významnou úlohu v patogenezi chronické hepatitidy B má TNF-α, riziko reaktivace či rekurence chronické HBV infekce je proto stále častěji diskutováno u pacientů léčených preparáty s anti-TNF-α aktivitou (infliximabem, adalimumabem, ale i etanerceptem). Reaktivace chronické hepatitidy B s těžkým „flare-up“ hepatitidy či dokonce s obrazem fulminantní hepatitidy u pacientů léčených infliximabem byla popsána v řadě kazuistických sdělení (10).
Asymptomatické nosičství HBsAg i prodělanou hepatitidu B lze velmi snadno odhalit vyšetřením sérologických markerů HBV (HBsAg, anti-HBc a dalších). V současné době je již jednoznačně prokázán přínos profylaktické léčby lamivudinem ve smyslu snížení frekvence reaktivací HBV při imunosupresivní léčbě, lehčího průběhu vzniklých reaktivací a snížení mortality. Lamivudin je vysoce účinný inhibitor revezní transkriptázy i HBV polymerázy, je prvním syntetickým antivirotikem použitým v léčbě chronické hepatitidy B, jeho nevýhodou je rychlá selekce rezistentních mutací. Podobně je již popsán příznivý vliv profylaktického podávání lamivudinu u pacientů HBsAg pozitivních léčených infliximabem. Základním předpokladem pro správnou indikaci profylaktické protivirové léčby je vyšetření sérologických markerů hepatitidy B před zahájením imunosuprese. V doporučených postupech Evropské asociace pro studium jater (11) je vyšetření sérologických markerů HBV u všech kandidátů chemoterapie a imunosupresivní léčby považováno za racionální, u pacientů trvale užívajících imunosupresivní léčbu musí podávání lamividinu trvat po celou dobu této léčby. Profylaktickou léčbu lamivudinem u HBsAg pozitivních pacientů, kteří mají dostat imunosupresi, doporučuje Evropská i Americká společnost pro studium jater (EASL a AASLD), stejně tak se shodují v tom, že u pacientů, kteří hepatitidu B prodělali, ale jsou již HBsAg negativní (ale anti-HBc pozitivní) není profylaktické podávání lamivudinu jednoznačně indikováno (12). Takové pacienty je nutno pečlivě sledovat a pravidelně vyšetřovat sérologické markery HBV i HBV-DNA v krvi. Lamivudin musí dostat ihned při vzestupu HBV-DNA nebo po HBsAg reverzi (tj. opětná pozitivita HBsAg), dříve než se rozvine laboratorní i klinický obraz reaktivace hepatitidy B. Doporučeným postup screeningu HBV infekce a profylaktického podávání antivirotik je shrnut v tabulce 3.
Tab. 3. Doporučený postup vyšetření a profylaktické léčby HBV infekce u imunosuprimovaných nemocných. 
Chronická hepatitida C
U chronické infekce virem hepatitidy C neexistuje na rozdíl od infekce virem hepatitidy B stadium asymptomatického nosičství s neprokazetelnou či stopovou virémií. U pacientů, kteří prodělali akutní hepatitidu C se spontánním vyléčením nebo u pacientů po úspěšné protivirové léčbě, je virus z organismu plně eliminován a imunosuprese pro ně nepředstavuje riziko. Pojem reaktivace chronické hepatitidy C je používán pro zvýšení virémie a aktivity u pacientů s chronickou hepatitidou C vlivem chemoterapie či imunosuprese (13). Reaktivace chronické hepatitidy C vlivem imunosuprese s obrazem akutního selhání jater či fibrotizující cholestatické hepatitidy jsou raritní a jsou předmětem pouze několika kazuistických sdělení. Reaktivace chronické hepatitidy C obvykle vede k vzestupu virémie, zánětlivé aktivity a k urychlení procesu fibrózy jater. Jediným účinným lékem na chronickou hepatitidu C je v současné době interferon α (resp. peginterferon), jehož profylaktické podávání není doporučováno. Několik kazuistických sdělení ukazuje, že léčba anti-TNF-α preparáty u pacientů s chronickou hepatitidou C je bezpečná a nemá negativní vliv na současně probíhající infekci (14). Chronická HCV infekce není považována za absolutní kontraindikaci léčby infliximabem či adalimumabem. U takových pacientů je ale nutno před léčbou vyšetřit kvantitativně virémii (HCV-RNA) a zhodnotit funkční stav jater. Obojí je nutno během léčby pravidelně monitorovat a při případném zhoršení individuálně hodnotit přínos léčby a její rizika.
Polékové jaterní poškození
Vzhledem k zásadní úloze jater při biotransformaci a eliminaci xenobiotik platí, pacienti užívající bohatou medikaci mají i častěji poškození jater léky. Trvalá snaha o objevování nových léků a jejich zavádění do klinické praxe je spojena s narůstajícím počtem nežádoucích lékových reakcí. Hepatotoxicita je možnou komplikací použití jakéhokoliv léku (15, 16). Léky lze rozdělit na obligatorně hepatotoxické, které v závislosti na dávce způsobí toxickou lézi vždy (např. methotrexát). Druhou skupinou jsou léky fakultativně hepatotoxické, které vyvolají toxickou lézi jen u predisponovaných jedinců (např. NSAID). S přibývajícími znalostmi lze stále více tzv. idiosynkratických reakcí vysvětlit geneticky podmíněmými variacemi metabolismu xenobiotik, polymorfismy a mutacemi (viz dále). Polékovým jaterním poškozením rozumíme elevaci jaterních enzymů (AST, ALT, ALP, GMT) a bilirubinu způsobenou podávanou medikací. Při lehkém jaterním poškození hodnota aktivity ALT nepřekročí trojnásobek normy. Jaterní poškození těžké je definováno jako elevace ALT nad osminásobek horní hranice normy a/nebo elevace celkového bilirubinu nad dvojnásobek normy. Rozlišujeme jaterní poškození hepatocelulární, provázené zvýšením AST a ALT, cholestatické (elevace ALP/±bilirubinu) a smíšené, které má rysy obou dříve uvedených. Klinický obraz poškození jater léky může mít široké spektrum: může se manifestovat akutní hepatitidou, ikterem, fulminantním jaterním selháním, progredující jaterní fibrózou nebo cirhózou jater. Diagnóza polékového poškození je obvykle stanovena per exclusionem, po vysazení „podezřelého“ léku by mělo dojít k úpravě hodnot jaterních enzymů a bilirubinu. Pečlivá farmakologická anamnéza je podmínkou pro identifikaci podezřelého léku. Prognóza závisí na tíži poškození, při těžkém jaterním polékovém poškození má největší prognostický význam hodnota bilirubinu, resp. přítomnost ikteru. Ikterus predikuje závažný průběh s až 10 % mortalitou.
Mezi rizikové faktory polékového jaterního poškození patří délka léčby, dávka léku, polypragmazie, preexistující jaterní onemocnění, dětský či naopak vysoký věk a ženské pohlaví. Také některé genové variace (SNP) byly indentifikovány jako rizikový faktor vzniku toxické jaterní léze. Podstatou je snížená eliminace toxického metabolitu u jedinců s variantní alelou snižující funkci příslušného enzymu.
Nesteroidní antirevmatika
Všechna NSAID, včetně COX-2 selektivních, jsou potenciálně hepatotoxická. Těžké jaterní poškození vzniká přibližně u 0,1 % uživatelů NSAID. Paulus ve své prospektivní studii popsal elevaci jaterních aminotransferáz u 3 % pacientů (17) užívajících NSAID. K normalizaci jaterních testů došlo vždy po vysazení léku. Při užívání NSAID se jedná obvykle o hepatocelulární typ poškození, s elevaci ALT a AST, na pokladě idiosynkratické lékové reakce, v prvních 4–6 týdnech od začátku podávání léku. Riziko toxicity je úměrné podané dávce, roste s věkem a je vyšší při renální insuficienci a současném abusu alkoholu. Průběh jaterního poškození je obvykle lehký, asymptomatický, s úpravou po redukci dávky či vysazení léku. Při léčbě diclofenakem mají pacienti s alelickými variantami UGT2B7, CYP2C8, and ABCC2 vyšší riziko hepatotoxicity díky vzniku a akumulaci reaktivních metabolitů diclofenaku (18). Při léčbě diclofenakem by měla být provedena kontrola jaterních testů před léčbou, následně každé 2 týdny v prvních 8 týdnech, poté po půl roce (19).
Methotrexát
Hepatotoxicita methotrexátu (MTX) je jevem častým a je jedním z nejzávažnějších nežádoucích účinků při dlouhodobé léčbě. Toxicita MTX není zcela vysvětlena, možná je aktivace hvězdicových jaterních buněk MTX vedoucí k depozici kolagenu, další teorie vysvětluje hepatotoxicitu akumulací MTX a jeho metabolitů, které mají za následek poruchu syntézy methioninu a nukleotidů vedoucí k jaternímu poškození (20). Elevaci ALT můžeme zaznamenat u 20–48 % léčených nemocných (21), perzistující elevace ALT koreluje s rizikem rozvoje fibrózy (22). Vyšší riziko toxicity je zaznamenáno u pacientů, kteří užívají MTX denně, pravidelně konzumují alkohol, mají sníženou funkci ledvin, diabetes mellitus, jsou obézní a mají preexistující jaterní onemocnění (alkoholická choroba jater, hepatitida B a C, NASH atd.) (23). U nemocných s onemocněním jater by měla být provedena jaterní biopsie před zahájením léčby k posouzení stupně fibrózy. Bezpečná kumulativní dávka MTX je 1500 mg (24). Při užívání MTX je nutná pravidelná kontrola jaterních testů (19) a albuminu, v prvních 3 měsících jedenkrát za 4 týdny, dále po 3 měsících. Při vzestupu jaterních testů nad trojnásobek normy je nutné provádět kontrolu po 14 dnech, event. snížit dávku. Při přetrvávající elevaci ALT i přes snížení dávky MTX je vhodné kontaktovat hepatologa a provést jaterní biopsii, pokud se vyloučí jiná příčina elevace jaterních testů. Pacientům, u kterých jaterní biopsie prokáže těžkou fibrózu či cirhózu jater, by měla být léčba MTX ukončena.
Azathioprin
Azathioprin je derivát 6-merkaptopurinu, oproti merkaptopurinu s nižším rizikem hepatotoxicity, i přesto je při léčbě azathioprinem toxicita popisována až u 40 % léčených nemocných (25). Cholestatické jaterní poškození je závislé na dávce (zejména dávka nad 2,5 mg/kg) a může se projevit až za několik měsíců po zahájení terapie. V klinickém obraze dominuje ikterus a pruritus, laboratorně pak elevace bilirubinu, ALP a GMT.
Leflunomid
Mechanismus účinku leflunomidu spočívá i inhibici dihydrooroátdehydrogenázy. Leflunomid je rychle přeměňován na aktivní metabolit ve střevní stěně a játrech, eliminační poločas je 1–4 týdny, proto se může hepatotoxicita projevit i po vysazení léku. V průběhu léčby leflunomidem byly opakovaně popsány případy těžkého poškození jater (26, 27), zejména v prvních 6 měsících léčby, riziko hepatotoxicity je vyšší v kombinaci s MTX či jiným hepatotoxickým lékem, při preexistujícím jaterním onemocnění, zvláště je-li provázeno hypalbuminémií, a při abusu alkoholu (28). Kontrola jaterních enzymů byl měla být provedena před zahájením léčby, dále v měsíčních intervalech v prvních 6 měsících, následně každých 6–8 týdnů (19). Při elevaci ALT mezi dvoj - a trojnásobkem normy je vhodné redukovat denní dávku na polovinu za pečlivé monitorace jaterních enzymů po 14 dnech. Při trvalém zvýšení ALT i přes redukci dávky je třeba přerušit léčbu a zvážit podání cholestyraminu.
Sulfasalazin
Hlavním nežádoucím účinkem léčby je myelotoxicita, hepatotoxicita s elevací jaterních aminotranferáz je méně častá, nejčastější v prvních 3 měsících léčby a postihuje 2–5 % nemocných léčených sulfasalazinem (29). Jaterní enzymy a bilirubin by měly být sledovány měsíčně v prvním trimestru léčby, následně v tříměsíčních intervalech, při stabilní dávce léku a normálních hodnotách jaterních enzymů je možno snížit frekvenci na jednou za půl roku (19). Při elevaci ALT se má podávání přerušit, po normalizaci pak zahájit podávání v nižší dávce.
Biologická léčba
Elevace hodnot jaterních enzymů při léčbě anti-TNF preparáty je obvykle přisuzována konkomitantní medikaci jiným hepatotoxickým lékem (MTX, leflunomid). Ve studii s 6861 pacienty léčenými infliximabem, adalimumabem a etanerceptem a/nebo jinými DMARD se vyskytla elevace ALT u 5,8 % léčených pouze anti-TNF, vzestup ALT nad dvojnásobek normy jen u 0,6 % léčených nemocných (30). Před zahájením léčby anti-TNF preparáty je třeba provést screeningové vyšetření virových hepatitid B a C (viz výše) k zabránění rekativace infekce během léčby.
Přechodná mírná elevace AST a ALT byla popsána i při léčbě tocilizumabem, častěji při současném užití jiné hepatotoxické medikace, např. MTX (31). Většina elevací ALT v klinických studiích byla do trojnásobku normy, pouze přechodná a hodnoty se normalizovaly i při pokračování léčby. Elevace ALT nebyly spojeny s klinicky významnou elevací bilirubinu. Při léčbě tocilizumabem nebyl zaznamenán žádný případ polékové hepatitidy nebo jaterního selhání (32). Při terapii tocilizumabem by měly být jaterní testy kontrolovány za 4–8 týdnů v prvních 6 měsících léčby, následně jedenkrát za 3 měsíce. Při elevaci ALT/AST na hodnoty vyšší než trojnásobek normy bychom měli podávání dočasně přerušit, po poklesu ALT/AST na trojnásobek normálních hodnot se tocilizumab může opětovně podat ve snížené dávce, aby byla udržena efektivita terapie.
Závěr
Jaterní onemocnění u pacientů s revmatoidní artritidou může představovat závažnou komplikaci terapie a může vést k přerušení či ukončení léčby, která zásadně ovlivňuje prognózu nemocného. Snížení výskytu jaterních komplikací u pacientů s revmatoidní artritidou lze dosáhnout zejména účelnou farmakoterapií, jejíž podmínkou je znalost jednotlivých preparátů a jejich nežádoucích účinků.
MUDr. Soňa Fraňková
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
Zdroje
1. Younossi ZM. Review article: current management of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2008 Jul; 28(1): 2-12.
2. Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005 Jun; 41(6): 1313-21.
3. Czaja AJ, Freese DK. Diagnosis and treatment of autoimmune hepatitis. Hepatology 2002 Aug; 36(2): 479-97.
4. Czaja AJ. Current and future treatments of autoimmune hepatitis. Expert Rev Gastroenterol Hepatol 2009 Jun; 3(3): 269-91.
5. Invernizzi P, Selmi C, Gershwin ME. Update on primary biliary cirrhosis. Dig Liver Dis Jun; 42(6): 401-8.
6. Hudson M, Rojas-Villarraga A, Coral-Alvarado P, Lopez-Guzman S, Mantilla RD, Chalem P, et al. Polyautoimmunity and familial autoimmunity in systemic sclerosis. J Autoimmun 2008 Sep; 31(2): 156-9.
7. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol 2009 Aug; 51(2): 237-67.
8. Corpechot C, Carrat F, Bonnand AM, Poupon RE, Poupon R. The effect of ursodeoxycholic acid therapy on liver fibrosis progression in primary biliary cirrhosis. Hepatology 2000 Dec; 32(6): 1196-9.
9. Lalazar G, Rund D, Shouval D. Screening, prevention and treatment of viral hepatitis B reactivation in patients with haematological malignancies. Br J Haematol 2007 Mar; 136(5): 699-712.
10. Chung SJ, Kim JK, Park MC, Park YB, Lee SK. Reactivation of hepatitis B viral infection in inactive HBsAg carriers following anti-tumor necrosis factor-alpha therapy. J Rheumatol 2009 Nov; 36(11): 2416-20.
11. European Association For The Study Of The L. EASL Clinical Practice Guidelines: management of chronic hepatitis B. J Hepatol 2009 Feb; 50(2): 227-42.
12. Lok AS, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology 2009 Sep; 50(3): 661-2.
13. Ghany MG, Strader DB, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology 2009 Apr; 49(4): 1335-74.
14. Peterson JR, Hsu FC, Simkin PA, Wener MH. Effect of tumour necrosis factor alpha antagonists on serum transaminases and viraemia in patients with rheumatoid arthritis and chronic hepatitis C infection. Ann Rheum Dis 2003 Nov; 62(11): 1078-82.
15. Nathwani RA, Kaplowitz N. Drug hepatotoxicity. Clin Liver Dis 2006 May; 10(2): 207-17, vii.
16. Watkins PB, Seeff LB. Drug-induced liver injury: summary of a single topic clinical research conference. Hepatology 2006 Mar; 43(3): 618-31.
17. Paulus HE. FDA Arthritis Advisory Committee meeting. Arthritis Rheum 1982 May; 25(5): 595-6.
18. Daly AK, Aithal GP, Leathart JB, Swainsbury RA, Dang TS, Day CP. Genetic susceptibility to diclofenac-induced hepatotoxicity: contribution of UGT2B7, CYP2C8, and ABCC2 genotypes. Gastroenterology 2007 Jan; 132(1): 272-81.
19. Šedová L, Horák P, Pavelka K. Doporučení České revmatologické společnosti pro monitorování bezpečnosti léčby revmatoidní artritidy. Čes Revmatol 2009; 17(1): 4-15.
20. Bridges SL, Jr., Alarcon GS, Koopman WJ. Methotrexate-induced liver abnormalities in rheumatoid arthritis. J Rheumatol 1989 Sep; 16(9): 1180-3.
21. Rau R, Karger T, Herborn G, Frenzel H. Liver biopsy findings in patients with rheumatoid arthritis undergoing longterm treatment with methotrexate. J Rheumatol 1989 Apr; 16(4): 489-93.
22. Kremer JM, Lee RG, Tolman KG. Liver histology in rheumatoid arthritis patients receiving long-term methotrexate therapy. A prospective study with baseline and sequential biopsy samples. Arthritis Rheum 1989 Feb; 32(2): 121-7.
23. Kremer JM, Alarcon GS, Lightfoot RW, Jr., Willkens RF, Furst DE, Williams HJ, et al. Methotrexate for rheumatoid arthritis. Suggested guidelines for monitoring liver toxicity. American College of Rheumatology. Arthritis Rheum 1994 Mar; 37(3): 316-28.
24. Tishler M, Caspi D, Halperin Z, Baratz M, Moshkowitz M, Yaron M. A prospective analysis of liver biopsies in rheumatoid arthritis patients receiving long term methotrexate therapy. Rheumatol Int 1992; 12(1): 39-41.
25. Perry MC. Chemotherapeutic agents and hepatotoxicity. Semin Oncol 1992 Oct; 19(5): 551-65.
26. Suissa S, Ernst P, Hudson M, Bitton A, Kezouh A. Newer disease-modifying antirheumatic drugs and the risk of serious hepatic adverse events in patients with rheumatoid arthritis. Am J Med 2004 Jul 15; 117(2): 87-92.
27. Weinblatt ME, Dixon JA, Falchuk KR. Serious liver disease in a patient receiving methotrexate and leflunomide. Arthritis Rheum 2000 Nov; 43(11): 2609-11.
28. www.arava.com.
29. Farr M, Symmons DP, Bacon PA. Raised serum alkaline phosphatase and aspartate transaminase levels in two rheumatoid patients treated with sulphasalazine. Ann Rheum Dis 1985 Nov; 44(11): 798-800.
30. Sokolove J, Strand V, Greenberg JD, Curtis JR, Kavanaugh A, Kremer JM, et al. Risk of elevated liver enzymes associated with TNF inhibitor utilisation in patients with rheumatoid arthritis. Ann Rheum Dis May 6.
31. Genovese MC, McKay JD, Nasonov EL, Mysler EF, da Silva NA, Alecock E, et al. Interleukin-6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to disease-modifying antirheumatic drugs: the tocilizumab in combination with traditional disease-modifying antirheumatic drug therapy study. Arthritis Rheum 2008 Oct; 58(10): 2968-80.
32. Smolen JS, Beaulieu A, Rubbert-Roth A, Ramos-Remus C, Rovensky J, Alecock E, et al. Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double-blind, placebo-controlled, randomised trial. Lancet 2008 Mar 22; 371(9617): 987-97.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2010 Číslo 3- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Léčba revmatoidní artritidy a játra
- Využití sonografie při diagnostice a léčbě revmatoidní artritidy
-
Kožní manifestace revmatoidní artritidy
(Kazuistický případ pyoderma gangrenosum) - 54. VÝROČNÍ SJEZD ČESKÝCH A SLOVENSKÝCH REVMATOLOGŮ, 12. – 15. 5. 2010 PLZEŇ
- 54. VÝROČNÍ SJEZD ČESKÝCH A SLOVENSKÝCH REVMATOLOGŮ, 12. – 15. 5. 2010 PLZEŇ
- 54. VÝROČNÍ SJEZD ČESKÝCH A SLOVENSKÝCH REVMATOLOGŮ, 12. – 15. 5. 2010 PLZEŇ
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Kožní manifestace revmatoidní artritidy
(Kazuistický případ pyoderma gangrenosum) - Léčba revmatoidní artritidy a játra
- Využití sonografie při diagnostice a léčbě revmatoidní artritidy
- 54. VÝROČNÍ SJEZD ČESKÝCH A SLOVENSKÝCH REVMATOLOGŮ, 12. – 15. 5. 2010 PLZEŇ
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



