-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Permanentní močový katétr – dobrý sluha, zlý pán: Doporučení pro prevenci, diagnostiku a léčbu močových infekci spojených s katetrizací
Permanent urethral catheter – a good servant, but bad master: Guidelines for prevention, diagnosis, and treatment of catheter-associated urinary tract infections
Catheter-associated urinary tract infections (CAUTI) are among the most common healthcare-associated infections, which increase morbidity, mortality, prolong the length of hospitalization and have a significant impact on the cost of treatment.
The most efficient preventive method is removing catheters as soon as possible and avoid unnecessary catheterizations. Treatment of asymptomatic bacteriuria is not recommended. In cases of serious CAUTI, vigorous antibiotic therapy covering multidrug-resistant uropathogens should be initiated.
These recommendations are intended for all medical specialties to improve the care of patients with indwelling catheters in the prevention, diagnosis, and treatment of CAUTI in primary care and subsequent long-term care.
Keywords:
urinary tract infection – dysfunction of lower urinary tract – catheter-associated urinary tract infections – permanent urethral catheter – intermittent catheterization
Autoři: Vladimír Šámal 1,2; Jan Krhut 3; Roman Zachoval 4; Michaela Matoušková 5; Miloš Broďák 1
Působiště autorů: Urologická klinika LF UK a FN Hradec Králové 1; Urologické oddělení, Krajská nemocnice Liberec, a. s. 2; Urologická klinika LF OU a FN Ostrava 3; Urologická klinika FTN a 3. LF UK v Praze 4; Urocentrum Praha, s. r. o. 5
Vyšlo v časopise: Čas. Lék. čes. 2022; 161: 303-308
Kategorie: Doporučené postupy
Souhrn
Močové infekce spojené se zavedeným permanentním katétrem (CAUTI – catheter-associated urinary tract infections) patří mezi nejčastější infekce spojené s poskytovanou zdravotní péčí, které zvyšují morbiditu, mortalitu, prodlužují délku hospitalizace a mají nezanedbatelný vliv na cenu léčby.
Nejvýznamnějším preventivním opatřením je zkrácení doby zavedení permanentního katétru (PMK) na nezbytnou dobu a zamezení zbytečného zavedení PMK. Léčba asymptomatické bakteriurie není doporučována. V případech závažné CAUTI je třeba zahájit razantní antibiotickou léčbu pokrývající multirezistentní uropatogeny.
Tato doporučení jsou určena pro všechny medicínské odbornosti s cílem zlepšit péči o pacienty s permanentním katétrem v oblasti prevence, diagnostiky a léčby CAUTI v primární péči a následné dlouhodobé péči.
Klíčová slova:
močová infekce – dysfunkce dolních močových cest – permanentní močový katétr – intermitentní katetrizace
ÚVOD
Permanentní močový katétr (PMK) je široce používán k monitoraci diurézy při léčbě akutních, život ohrožujících stavů a pacientů v akutní péči. Dlouhodobě zavedený PMK se používá k řešení poruch evakuace močového měchýře nejrůznější etiologie. Doba výměny katétrů není standardizovaná. U chronických dobře adaptovaných pacientů je možno katétr ponechat tak dlouho, dokud spolehlivě plní svoji derivační funkci, současně je však třeba respektovat doporučení výrobce konkrétního katétru. Doba ponechání permanentního katétru je individuální, běžně prováděné rutinní výměny katétrů po 4–6 týdnech nemají oporu v odborné literatuře. V případě opakovaných epizod neprůchodnosti katétru se doba výměny zkracuje až na 7–10 dní. Závažné komplikace ve smyslu urosepse jsou poměrně časté. Pokud se nelze trvalé derivaci vyhnout, volíme raději jako trvalé řešení epicystostomii, která je z hlediska ošetřovatelské péče přístupnější a minimalizuje komplikace v oblasti uretry.
K rizikům dlouhodobě zavedeného permanentního katétru patří trvalá kolonizace močového traktu, močová infekce, riziko vzniku cystolitiázy a riziko vzniku dekubitů uretry nebo uretrokutánních píštělí u mužů (1). U žen mohou vznikat tlakem katétru dekubity na labiích, případně eroze uretry.
Mezi nejčastější komplikace dlouhodobě zavedeného PMK patří močová infekce.
Pro tyto infekce se používá zkratka CAUTI (catheter-associated urinary tract infection). Reprezentují přibližně 40 % infekcí získaných v nemocnicích (2). Močový katétr znamená 80% riziko močové infekce. Do jednoho měsíce po zavedení PMK mají téměř všichni pacienti bakteriurii (3). Monobakteriální infekce se rychle mění na polybakteriální a narůstá počet multirezistentních kmenů. Infekce vyvolaná multirezistentními kmeny zvyšuje morbiditu, mortalitu, zvyšuje rehospitalizace, prodlužuje délku hospitalizace a má nezanedbatelný vliv na náklady léčby.
Většina poznatků o CAUTI je z kohortových či observačních studií a studií případů a kontrol (case-control), zatímco randomizovaných studií na toto téma k dispozici mnoho není. Existují doporučení pro diagnostiku, léčbu a prevenci CAUTI, řada z nich je podpořena zejména stanovisky expertních týmů (4–8).
V současné době převládá snaha trvalou derivaci co nejvíce omezovat ve smyslu indikace a délky katetrizace (4, 6, 9). V případech, kdy je to možné, nahrazovat zavedení PMK metodou čisté intermitentní katetrizace (ČIK).
Cílem práce je sjednotit terminologii, diagnostiku a léčbu CAUTI a upozornit na rizika s ní spojená. Zvláštní důraz je kladen na prevenci, především na omezení doby katetrizace.
DEFINICE POJMŮ
Podle National Healthcare Safety Network, součást Centers for Disease Control and Prevention (NHSN) je CAUTI definována jako epizoda močové infekce, kdy je PMK zaveden v době manifestace infekce a doba zavedení PMK je delší než dva dny (10). Je charakterizována současným výskytem klinických symptomů zánětu, spojitostí se zavedením PMK a identifikovaným uropatogenem (³ 103 CFU/ml ³ 1 bakteriálního druhu) (4). Za CAUTI se považuje také epizoda močové infekce pacienta, kterému byl v předchozích 48 hodinách odstraněn PMK nebo epicystostomie (4).
Asymptomatická bakteriurie (ABU) je u pacientů s permanentním katétrem, epicystostomií nebo na režimu intermitentní katetrizace velmi častá. Definujeme ji jako přítomnost ³ 105 CFU/ml ³ 1 bakteriálního druhu ve vzorku moči bez symptomů močového zánětu (4).
V roce 2009 NHSN vyjmula asymptomatickou bakteriurii z definice CAUTI. Také podle klasifikace Evropské urologické asociace (EAU) založené na klinické manifestaci a anatomické lokalizaci infekce, dostupnosti antibiotické terapie a rizikových faktorech (ORENUC) je asymptomatická bakteriurie rizikovým faktorem, ale není považovaná za močovou infekci (11).
Dříve často používaný výraz nozokomiální infekce byl nahrazen termínem infekce spojené s poskytovanou zdravotní péčí (HCAI – healthcare-associated infections).
Za krátkodobou katetrizaci se považuje zavedení PMK do 30 dní včetně, dlouhodobá katetrizace je katetrizace delší než 30 dní.
PATOGENEZE CAUTI
Zavedení PMK představuje největší riziko pro vznik infekce, a to narušením obranných mechanismů. Již samotným zavedením PMK může dojít k zanesení kožních nebo fekálních bakterií do močového měchýře. Ponechání PMK umožní přestup patogenů do močového měchýře buď intraluminálně, nebo rozhraním katétr-sliznice, takto vznikají přibližně dvě třetiny infekcí (12).
Častá je také kolonizace močového traktu ze zevního prostředí, přenosem mezi pacienty a ze strany zdravotnického personálu. Kolonizace může dlouhou dobu probíhat bez známek akutního zánětu. Nicméně pokud ke kolonizaci dojde, je pacient v riziku rekurentních močových infekcí po zbytek života (13).
Biofilm je struktura tvořená bakteriemi žijícími v extracelulární bílkovinné matrix pokrývající povrch PMK. Bakterie biofilmu mají proti planktonně se vyskytujícím bakteriím nižší citlivost k antibiotikům. Proti běžným močovým infekcím je také častý polymikrobiální nález. Riziko kolonizace močového traktu a bakteriurie při zavedeném PMK narůstá o 3–10 % každý den (14). Vznik biofilmu na povrchu PMK je jednou ze základních příčin CAUTI.
KLINICKÁ DIAGNOSTIKA CAUTI
Symptomy zánětu odpovídající CAUTI při zavedeném PMK zahrnují nový výskyt nebo zhoršení horečky, zimnici, alteraci vědomí, nevolnost bez jiné příčiny; bolest v bedrech; zvýšenou citlivost v kostovertebrálním úhlu; hematurii; bolest v podbřišku. U pacientů po odstranění PMK zahrnují horečky, dysurii, urgentní a frekventní močení, bolesti v podbřišku.
Je třeba mít na mysli, že prakticky všichni pacienti s PMK mají pozitivní kultivaci moči (4). Pokud pacient nemá typické příznaky, jako jsou bolesti v podbřišku, bolesti v bedrech, zánětlivý nález na genitálu, známky obstrukce urogenitálního traktu nebo hematurii, tak je třeba pátrat i po jiných příčinách horečnatého stavu.
LÉČBA CAUTI
Před zahájením léčby je třeba mandatorně odebrat moč ke kultivaci (u septických pacientů také hemokulturu). Doporučenou metodou odběru moči na bakteriologické vyšetření je u krátkodobé katetrizace odběr z portu urinálního sáčku za sterilních podmínek. U dlouhodobé katetrizace je doporučeno provést výměnu PMK a k vyšetření zaslat vzorek odebraný z nového katétru. Odběr moči se nesmí provádět ze sběrného sáčku. Vzhledem k přítomnosti biofilmu na katétru je doporučené na začátku léčby CAUTI provést výměnu PMK.
Antibiotickou léčbu zpravidla začínáme empiricky, volíme širokospektrá antibiotika. Výhodou je znalost lokální rezistence na antibiotika u hlavních uropatogenů (15). U klinicky závažných stavů je vhodné nasadit širokospektrá antibiotika pokrývající i možné multirezistentní kmeny (karbapenemy) a následně provést úpravu antibiotické léčby (step-down) po stabilizaci stavu s ohledem na výsledek kultivačního vyšetření moči (16). Nedostatečně razantní iniciální antibiotická léčba má horší výsledky a vyšší mortalitu (17).
Všechny CAUTI patří mezi komplikované infekce a je u nich nutná delší antibiotická léčba (minimálně 7–10 dní).
LÉČBA ASYMPTOMATICKÉ BAKTERIURIE
Rutinní antibiotická léčba ABU není doporučována. Z dlouhodobého hlediska není možné bakteriurii eradikovat a navíc může dlouhodobé používání antibiotik vést k selekci rezistentních kmenů. Nejsou důkazy, že léčba ABU sníží mortalitu spojenou s CAUTI (18). Existují stavy, kde je konsenzuálně antibiotická profylaxe doporučovaná (4, 14, 19):
- před invazivním urologickým výkonem nebo implantací ortopedické protézy
- v těhotenství
- u pacientů s vysokým rizikem závažných infekčních komplikací
Screening ABU při krátkodobé i dlouhodobé katetrizaci není doporučován a nevede k poklesu epizod CAUTI.
INKRUSTACE KATÉTRU
K dalším problémům u pacientů s dlouhodobě zavedeným PMK patří tvorba močových konkrementů a inkrustací na katétru. Z toho vyplývají problémy s průchodností katétru. Každá neprůchodnost PMK znamená pro pacienta riziko infekční či septické komplikace (20). Inkrustace katétru jsou způsobené mikroorganismy v biofilmu katétru, které mají schopnost hydrolyzovat ureu v moči na volný amoniak. To způsobuje lokální zvýšení pH moči. Alkalické prostředí urychluje precipitaci minerálů a vznik hydroxyapatitových a struvitových krystalů, která potom zamezí průchodnosti katétru (21, 22). Mezi nejčastější tzv. urea splitting bakterie patří Proteus sp., Pseudomonas aeruginosa, Klebsiella sp. a Providencia sp. (21). Všechny tyto bakterie jsou většinou polyrezistentní vůči antibiotické léčbě.
Při prevenci neprůchodnosti PMK inkrustacemi hraje roli frekvence výměn PMK, správná péče o katétr, diuréza, léčba močové infekce a také acidifikace moči. V praxi lze použít preventivní proplach močového katétru acidifikujícím roztokem kyseliny citronové (G soluce). O profylaktickém vlivu acidifikujících roztoků existují jen limitované doklady (23–25).
ALTERNATIVNÍ ZPŮSOBY DERIVACE MOČI
Epicystostomie
Epicystostomie je alternativou PMK. Indikace k trvalé derivaci epicystostomií jsou stejné, jako pro PMK. Je metodou volby u pacientů s trvalou derivací moči, kde došlo ke komplikacím a poškození uretry, nebo u pacientů s poškozenou uretrou (např. strikturou uretry). Výhodou epicystostomie je relativně snadnější ošetřovatelská péče. Nevýhodou její invazivní zavedení s rizikem poranění nitrobřišních orgánů. Zavedení epicystostomie u pacientů s malou kapacitou močového měchýře a nízkou kompliancí nemusí být vždy snadné. Pro tyto účely jsou k dispozici sety pro endoskopickou punkční epicystostomii. V tomto případě se jehla zavede flexibilním cystoskopem z měchýře směrem ven (26). Při krátkodobé katetrizaci může použití epicystostomie snižovat výskyt CAUTI (5, 8). V prospektivní studii byl výskyt ABU 95 %, což je srovnatelné s výskytem ABU při zavedeném PMK (27). Jasná data na preferenci epicystostomie pro dlouhodobou katetrizaci k dispozici nejsou (4, 6).
Čistá intermitentní katetrizace
Čistá intermitentní katetrizace je metoda, kdy si pacient zavádí sám močový katétr do močového měchýře a po vypuštění moči jej zase odstraní. Metodu je možné provádět také druhou osobou. Již při zavedení této metody Lapides et al. v observační studii prokázali menší míru infekčních komplikací (28). ČIK je považována za metodu s nižším výskytem febrilních močových infekcí, epididymitidy, periuretrálních abscesů, vznikem hydronefróz, cystolitiázy a nefrolitiázy (29, 30). Data z randomizovaných studií o výskytu CAUTI u dlouhodobé katetrizace nejsou dostupná. Lze však s jistou mírou nadsázky konstatovat, že zatímco při metodě ČIK je CAUTI rizikem, tak při dlouhodobé derivaci PMK je jistotou.
PREVENCE VZNIKU CAUTI
Základním opatřením v prevenci CAUTI je omezení doby zavedení PMK na nezbytně nutnou dobu. Udává se, že na standardních odděleních nemocnic 30–50 % pacientů se zavedeným PMK tento katétr nezbytně nepotřebuje (31, 32). Zdravotnické zařízení by mělo mít vypracovaná kritéria pro zavedení PMK a popsanou ošetřovatelkou péči o PMK. Indikace k zavedení PMK u konkrétního pacienta by měla být periodicky přehodnocována (33). Nedoporučuje se používat katétr k řešení inkontinence moči, výjimkou jsou stavy refrakterní na léčbu a na vlastní žádost pacienta.
Permanentní katétr u pacientů v nemocnicích a dalších zařízeních s vysokým rizikem infekcí spojených s poskytovanou zdravotní péčí
Zavedení PMK musí být provedeno zcela asepticky a atraumaticky. Pro atraumatické zavedení PMK je potřeba dostatečné množství lubrikantu. U mužů je doporučené 2/3 gelu aplikovat do uretry a zbývající část na katétr. U žen je dostatečné aplikovat gel na konec katétru.
Nezbytným předpokladem hladkého zavedení katétru je edukovaný personál. V řadě zdravotnických zařízení je zavedení PMK delegováno na střední zdravotnický personál. Je třeba dbát, aby tento personál byl dostatečně edukovaný a proces edukace pravidelně hodnotit.
Po zavedení je PMK napojen na uzavřený systém. K rozpojování systému by nemělo docházet (4). K odběru moči na bakteriologické případně biochemické vyšetření slouží odběrové porty v koncovce sběrného sáčku. Udržení uzavřeného systému je jedno z nejdůležitějších opatření v prevenci CAUTI (8, 34–36). V nekomparativní studii použití uzavřeného systému snížilo incidenci ABU na ~50 % při krátkodobé katetrizaci (34) v porovnání s 95 % výskytem ABU bez uzavřeného systému (37). Doporučení udržovat uzavřený systém je také součástí expertního doporučení (4, 5, 7, 8).
Je třeba dbát na umístění sáčku v gravitačním spádu pod úrovní močového měchýře, aby nedocházelo k přelévání moči ze sáčku zpět do močového měchýře. U ležících pacientů je třeba připevnit sběrný sáček k lůžku tak, aby se vypouštěcí koncovka nedotýkala podlahy. Zcela základní opatření v prevenci před vznikem CAUTI je včasné odstranění PMK, profylaktický vliv čisté intermitentní katetrizace je známý (4, 5, 38).
Ačkoli se řada těchto opatření jeví jako triviální, jsou zcela zásadní pro minimalizaci rizika CAUTI.
Permanentní katétr u pacientů v domácím prostředí
Zpravidla se jedná o dlouhodobou katetrizaci v domácím prostředí komunitních mikrobiálních kmenů. Kolonizace močového traktu ABU v této populaci dosahuje téměř 100 %. V tomto prostředí se péče o PMK a jeho výměna blíží metodě čisté katetrizace. Čistou metodou katetrizace se rozumí dodržování zásad komunitní hygieny – omýt ruce, použít nesterilní rukavice, omýt oblasti zevního ústí uretry dezinfekcí a použití sterilního katétru.
Alternativou uzavřeného drenážního systému může být v individuálních případech intermitentní uzavírání katétru kolíčkem nebo chlopní (39). Pacient si tak několikrát denně při pocitu náplně močového měchýře moč vypustí. Předpokladem je dobrý stav kognitivních funkcí a motoriky. Tuto metodu lze akceptovat u pacientů s dlouhodobou katetrizací, kde se nevyskytují časté epizody CAUTI.
Úpravy povrchu katétru
Cílem změny charakteru povrchu katétru je zabránit usazení biofilmu na jeho povrchu. Pro tyto účely se historicky používaly katétry s řízeným uvolňováním antibiotika (rifampicinu, nitrofurantoinu), katétry s antiadhezivním povrchem (heparinem, fosforylcholinem), katétry s antiseptickým povrchem (stříbrem) nebo katétry s hydrofilním povrchem. Většina katétrů s modifikovaným povrchem je schopna v krátkodobém časovém horizontu (do týdne) redukovat výskyt bakteriurii (40, 41).
V dlouhodobém časovém horizontu není jejich vliv na snížení ABU nebo epizod symptomatických infekcí významný, a proto nejsou pro rutinní použití doporučována (5, 6).
U pacientů, kteří místo PMK používají metodu čisté intermitentní katetrizace (ČIK), je naopak používání hydrofilních katétrů spojeno s nižším výskytem CAUTI (4, 38).
Antibiotická profylaxe
Niël-Weise et al. v review v rámci Cochraneovy databáze nalezli pouze nízký stupeň důkazů, že antibiotická profylaxe snižuje počet symptomatických infekcí u pacientů po břišní operaci, kteří měli katétr po dobu 24 hodin (42). Také u nechirurgických pacientů neexistuje jednoznačný důkaz, že antibiotická profylaxe snižuje epizody CAUTI (18). Metaanalýza studií prokázala, že antibiotická profylaxe u krátkodobě zavedeného PMK (do dvou týdnů) snižuje incidenci bakteriurie a febrilní mortality u chirurgických pacientů (43). U pacientů na intermitentní katetrizaci bylo prokázáno, že antibiotická profylaxe podávaná v týdenních cyklech snižuje počet CAUTI (44), obdobná data pro pacienty s PMK nejsou dostupná.
Podle platných guidelines EAU není rutinní antibiotická profylaxe krátkodobě zavedeného PMK indikovaná. Relevantní data o antibiotické profylaxi u dlouhodobé katetrizace jsou sporá (18). Antimikrobiální profylaxi není z důvodů nízké účinnosti a selekce antibiotické rezistence doporučeno rutinně používat u krátkodobé i dlouhodobé katetrizace včetně pacientů před chirurgickými výkony k redukci CAUTI (4).
Antibiotická profylaxe při výměně PMK nebo před jeho extrakcí
Výměna či odstranění PMK může být spojeno s epizodou CAUTI nebo bakteriémií. Často je proto před výměnou nebo odstraněním PMK diskutována antibiotická profylaxe. Podle provedené ankety používá v této indikaci antibiotickou profylaxi 60 % dotázaných urologů (45). Incidence bakteriémie u pacientů s dlouhodobou katetrizací po výměně nebo odstranění PMK se udává v rozmezí 4–10 % (46, 47).
Při hodnocení antibiotické profylaxe před odstraněním PMK vedla jedna dávka aztreonamu podaná tři hodiny před extrakcí PMK ke statisticky významnému poklesu CAUTI (bez známek infekce bylo 89 % pacientů po antibiotické profylaxi vs. 46 % bez profylaxe) (48). V jiné randomizované studii byla hodnocena 48hodinová léčba ciprofloxacinem/placebem započatá 2 hodiny před odstraněním PMK. Po 2 týdnech po odstranění PMK nebyl pozorován rozdíl v incidenci CAUTI (16 vs. 13 %) (49). V metaanalýze studií měli pacienti s antibiotickou profylaxí v době extrakce PMK méně CAUTI, ale řada těchto studií měla publikační bias a inkonzistentní data (50).
Na základě těchto nejednoznačných dat a z obavy ze vzniku antibiotické rezistence není rutinní antibiotická profylaxe při zavedení, výměně nebo odstranění PMK doporučovaná.
Preventivní irigace PMK a doplňky stravy
Preventivní irigace PMK fyziologickým roztokem nebo roztokem antibiotika není v prevenci CAUTI efektivní (51). Také používání doplňků stravy na bázi brusinek nevede ke snížení epizod CAUTI u pacientů s derivací moči PMK nebo na režimu ČIK (52).
Intenzivní péče o zevní meatus uretry
Většina infekcí vzniká průnikem bakterií parakatetrálním prostorem. Intenzivní péče o meatus aplikací mýdla nebo antibiotického roztoku nevedla v randomizovaných studiích k poklesu CAUTI (53, 54). Efektivitu ve studiích neprokázaly ani aplikace antibiotického krému nebo sulfadiazinu stříbra také (54, 55).
Denní intenzifikovaný režim hygieny zevního ústí uretry dezinfekčními, antimikrobiálními roztoky nebo mýdlem není doporučovaný a nevede k poklesu CAUTI.
Podávání antibiotik do sběrného sáčku
Randomizované studie neprokázaly, že podávání antibiotik do sběrného sáčku má efekt na snížení CAUTI (56, 57).
Zásady správné péče o permanentní močový katétr a prevence CAUTI (5–7, 9, 11):
- Pečlivě zvažovat indikaci k zavedení PMK a nutnost zavedení PMK periodicky přehodnocovat.
- Zkrátit dobu zavedení PMK na minimum.
- Zavedení katétru v prostředí s vysokým rizikem infekcí spojených s poskytovanou zdravotní péčí provádět aseptickou technikou.
- Zavádění nebo výměna permanentního katétru edukovaným a zkušeným personálem.
- Minimalizace traumatu uretry použitím dostatečného množství lubrikantu a přiměřeným kalibrem katétru (tab. 1).
- Pokud možno používat uzavřený drenážní systém.
- Drenážní sáček na moč udržovat v gravitačním spádu pod úrovní močového měchýře.
- V případech, kdy je to možné, nahradit PMK režimem intermitentní katetrizace.
Tab. 1. Doporučená velikost PMK 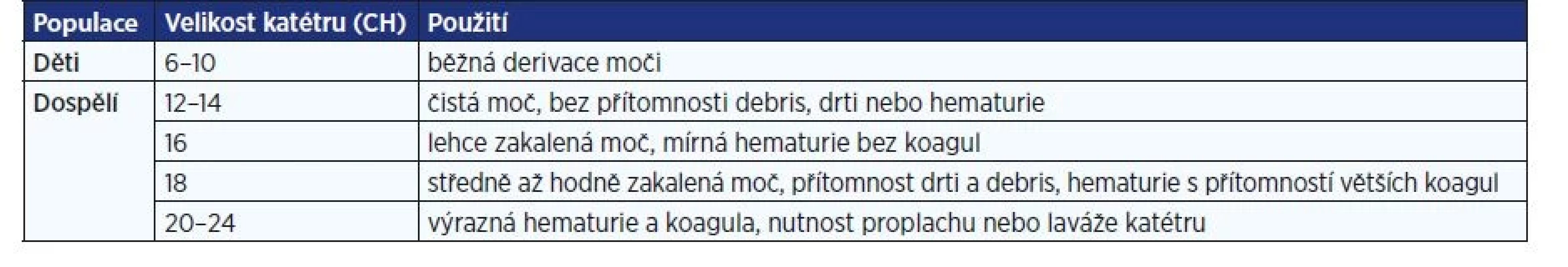
ZÁVĚR
CAUTI patří mezi závažné infekce spojené s poskytovanou zdravotní péčí, které výrazným způsobem ovlivňují morbiditu, mortalitu a mají vliv na cenu léčby. Pro snížení výskytu CAUTI je zásadní omezit dobu zavedení PMK na minimum, u dlouhodobé derivace pravidelně přehodnocovat její nutnost. U stavů, kde je to možné, volit jiné metody, především čistou intermitentní katetrizaci.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů. Vznik publikace nebyl finančně podpořen žádnou farmaceutickou firmou.
Seznam použitých zkratek
ABU asymptomatická bakteriurie
CAUTI infekce spojené s permanentním katétrem
CFU jednotka tvořící kolonie (colony-forming unit)
ČIK čistá intermitentní katetrizace
EAU Evropská urologická asociace (European association of Urology)
PMK permanentní katétr
Adresa pro korespondenci
MUDr. Vladimír Šámal, Ph.D.
Urologické oddělení, Krajská nemocnice Liberec, a. s.
Husova 357, 463 00 Liberec
Tel.: 485 312 382
e-mail: vladimir.samal@nemlib.cz
Zdroje
- Wyndaele J, Madersbacher H, Kovindha A. Conservative treatment of the neuropathic bladder in spinal cord injured patients. Spinal Cord 2001; 39 : 294–300.
- Klevens R, Edwards J, Richards C jr. et al. Estimating health care-associated infections and deaths in U.S. hospitals, 2002. Public Health Rep 2007; 122 : 160–166.
- Maki D, Tambyah P. Engineering out the risk for infection with urinary catheters. Emerg Infect Dis 2001; 7 : 342–347.
- Hooton T, Bradley S, Cardenas D et al. Diagnosis, prevention, and treatment of catheter-associated urinary tract infection in adults: 2009 International Clinical Practice Guidelines from the Infectious Diseases Society of America. Clin Infect Dis 2010; 50 : 625–663.
- Tenke P, Kovacs B, Bjerklund Johansen TE et al. European and Asian guidelines on management and prevention of catheter-associated urinary tract infections. Int J Antimicrob Agents 2008; 31 (Suppl. 1): S68–S78.
- Tenke P, Köves B, Johansen T. An update on prevention and treatment of catheter-associated urinary tract infections. Curr Opin Infect Dis 2014; 27 : 102–107.
- Lo E, Nicolle L, Coffin S et al. Strategies to prevent catheter-associated urinary tract infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol 2014; 35 : 464–479.
- Gould C, Umscheid C, Agarwal R et al. Guideline for prevention of catheter-associated urinary tract infections 2009. Infect Control Hosp Epidemiol 2010; 31 : 319–326.
- Chenoweth C. Urinary tract infections: 2021 update. Infect Dis Clin North Am 2021; 35 : 857–870.
- National Healthcare Safety Network. Catheter-Associated Urinary Tract Infection (CAUTI) and Non-Catheter-Associated Urinary Tract Infection (UTI) (and Other Urinary System Infection (USI)). NHSN, 2022. Dostupné na: www.cdc.gov/nhsn/psc/uti/index.html
- Johansen T, Botto H, Cek M et al. Critical review of current definitions of urinary tract infections and proposal of an EAU/ESIU classification system. Int J Antimicrob Agents 2011; 38 (Suppl.): 64–70.
- Tambyah P, Halvorson K, Maki D. A prospective study of pathogenesis of catheter-associated urinary tract infections. Mayo Clin Proc 1999; 74 : 131–136.
- Waites K, Canupp K, DeVivo M. Microbiology of the urethra and perineum and its relationship to bacteriuria in community-residing men with spinal cord injury. J Spinal Cord Med 2004; 27 : 448–452.
- Warren J, Tenney J, Hoopes J et al. A prospective microbiologic study of bacteriuria in patients with chronic indwelling urethral catheters. J Infect Dis 1982; 146 : 719–723.
- MacFadden D, Ridgway J, Robicsek A et al. Predictive utility of prior positive urine cultures. Clin Infect Dis 2014; 59 : 1265–1271.
- Chuang L, Tambyah P. Catheter-associated urinary tract infection. J Infect Chemother 2021; 27 : 1400–1406.
- Ortega M, Marco F, Soriano A et al. Epidemiology and outcome of bacteraemia in neutropenic patients in a single institution from 1991–2012. Epidemiol Infect 2015; 143 : 734–740.
- Niël-Weise B, van den Broek P, da Silva E et al. Urinary catheter policies for long-term bladder drainage. Cochrane Database Syst Rev 2012; 8: CD004201.
- Kumon H. Management of biofilm infections in the urinary tract. World J Surg 2000; 24 : 1193–1196.
- Heráček J, Urban M, Sobotka V a kol. Urologické komplikace poranění míchy. Postgraduální medicína 2007; 9 : 957–964.
- Saint S, Chenoweth C. Biofilms and catheter-associated urinary tract infections. Infect Dis Clin North Am 2003; 17 : 411–432.
- Morris N, Stickler D. Encrustation of indwelling urethral catheters by Proteus mirabilis biofilms growing in human urine. J Hosp Infect 1998; 39 : 227–234.
- Moore K, Hunter K, McGinnis R et al. Do catheter washouts extend patency time in long-term indwelling urethral catheters? A randomized controlled trial of acidic washout solution, normal saline washout, or standard care. J Wound Ostomy Continence Nurs 2009; 36 : 82–90.
- Kennedy A, Brocklehurst J, Robinson J et al. Assessment of the use of bladder washouts/instillations in patients with long-term indwelling catheters. Br J Urol 1992; 70 : 610–615.
- Kyrianová A, Šámal V, Šrám J a kol. Použití proplachového systému SUBY G u pacientů s neurogenní dysfunkcí dolních močových cest a dlouhodobě zavedeným permanentním katétrem. Česká urologie 2017; 21 : 65–72.
- Alagiri M, Seidmon E. Percutaneous endoscopic cystostomy for bladder localization and exact placement of a suprapubic tube. J Urol 1998; 159 : 963–964.
- Bonkat G, Widmer A, Rieken M et al. Microbial biofilm formation and catheter-associated bacteriuria in patients with suprapubic catheterisation. World J Urol 2013; 31 : 565-571.
- Lapides J, Diokno A, Silber S et al. Clean, intermittent self-catheterization in the treatment of urinary tract disease. J Urol 1972; 107 : 458–461.
- Wyndaele J. Complications of intermittent catheterization: their prevention and treatment. Spinal Cord 2002; 40(10): 536–541.
- Weld K, Dmochowski R. Effect of bladder management on urological complications in spinal cord injured patients. J Urol 2000; 163 : 768–772.
- Umscheid C, Mitchell M, Doshi J et al. Estimating the proportion of healthcare-associated infections that are reasonably preventable and the related mortality and costs. Infect Control Hosp Epidemiol 2011; 32 : 101–114.
- Armbruster C, Prenovost K, Mobley H et al. How often do clinically diagnosed catheter-associated urinary tract infections in nursing homes meet standardized criteria? J Am Geriatr Soc 2017; 65 : 395–401.
- Loeb M, Hunt D, O'Halloran K et al. Stop orders to reduce inappropriate urinary catheterization in hospitalized patients: a randomized controlled trial. J Gen Intern Med 2008; 23 : 816–820.
- Kunin C, McCormack R. Prevention of catheter-induced urinary-tract infections by sterile closed drainage. N Engl J Med 1966; 274 : 1155–1161.
- Thornton G, Andriole V. Bacteriuria during indwelling catheter drainage. II. Effect of a closed sterile drainage system. Jama 1970; 214 : 339–342.
- Wolff G, Grädel E, Buchman B. Indwelling catheter and risk of urinary infection: a clinical investigation with a new closed-drainage system. Urol Res 1976; 4 : 15–18.
- Kass E. Asymptomatic infections of the urinary tract. Trans Assoc Am Physicians 1956; 69 : 56–64.
- Wyndaele J, Brauner A, Geerlings S et al. Clean intermittent catheterization and urinary tract infection: review and guide for future research. BJU Int 2012; 110 (11 Pt. C): E910–E917.
- Geng V, Farrell J, Gea-Sánchez M et al. Catheterization indwelling catheters in adults – urethral and suprapubic. Evidence-based guidelines for best practice in urological health care. European Association of Urology Nurses, 2012. Dostupné na: http://nurses.uroweb.org/guideline/catheterisation-indwelling-catheters-in-adults-urethral-and-suprapubic
- Schumm K, Lam T. Types of urethral catheters for management of short-term voiding problems in hospitalized adults: a short version Cochrane review. Neurourol Urodyn 2008; 27 : 738–746.
- Johnson J, Kuskowski M, Wilt T. Systematic review: antimicrobial urinary catheters to prevent catheter-associated urinary tract infection in hospitalized patients. Ann Intern Med 2006; 144 : 116–126.
- Niël-Weise B, van den Broek P. Antibiotic policies for short-term catheter bladder drainage in adults. Cochrane Database Syst Rev 2005; 3: CD005428.
- Lusardi G, Lipp A, Shaw C. Antibiotic prophylaxis for short-term catheter bladder drainage in adults. Cochrane Database Syst Rev 2013; 7: CD005428.
- Salomon J, Denys P, Merle C et al. Prevention of urinary tract infection in spinal cord-injured patients: safety and efficacy of a weekly oral cyclic antibiotic (WOCA) programme with a 2-year follow-up – an observational prospective study. J Antimicrob Chemother 2006; 57 : 784–788.
- Wazait H, van der Meullen, Patel H et al. Antibiotics on urethral catheter withdrawal: a hit and miss affair. J Hosp Infect 2004; 58 : 297–302.
- Jewes L, Gillespie W, Leadbetter A et al. Bacteriuria and bacteraemia in patients with long-term indwelling catheters--a domiciliary study. J Med Microbiol 1988; 26 : 61–65.
- Bregenzer T, Frei R, Widmer A et al. Low risk of bacteremia during catheter replacement in patients with long-term urinary catheters. Arch Intern Med 1997; 157 : 521–525.
- Romanelli G, Giustina A, Cravarezza P et al. A single dose of aztreonam in the prevention of urinary tract infections in elderly catheterized patients. J Chemother 1990; 2 : 178–181.
- Wazait H, Patel H, van der Meulen J et al. A pilot randomized double-blind placebo-controlled trial on the use of antibiotics on urinary catheter removal to reduce the rate of urinary tract infection: the pitfalls of ciprofloxacin. BJU Int 2004; 94 : 1048–1050.
- Marschall J, Carpenter C, Fowler S et al. Antibiotic prophylaxis for urinary tract infections after removal of urinary catheter: meta-analysis. Bmj 2013; 346: f3147.
- Davies A, Desai H, Turton S et al. Does instillation of chlorhexidine into the bladder of catheterized geriatric patients help reduce bacteriuria? J Hosp Infect 1987; 9 : 72–75.
- Jepson R, Williams G, Craig J. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev 2012; 10: CD001321.
- Burke J, Garibaldi R, Britt M et al. Prevention of catheter-associated urinary tract infections. Efficacy of daily meatal care regimens. Am J Med 1981; 70 : 655–658.
- Burke J, Jacobson J, Garibaldi R et al. Evaluation of daily meatal care with poly-antibiotic ointment in prevention of urinary catheter-associated bacteriuria. J Urol 1983; 129 : 331–334.
- Huth T, Burke J, Larsen R et al. Randomized trial of meatal care with silver sulfadiazine cream for the prevention of catheter-associated bacteriuria. J Infect Dis 1992; 165 : 14–18.
- Gillespie W, Simpson R, Jones J et al. Does the addition of disinfectant to urine drainage bags prevent infection in catheterised patients? Lancet 1983; 1 : 1037–1039.
- Classen D, Larsen R, Burke J et al. Prevention of catheter-associated bacteriuria: clinical trial of methods to block three known pathways of infection. Am J Infect Control 1991; 19 : 136–142.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚVODEM
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- ÚVODEM
- Mezinárodní kodex lékařské etiky Světové lékařské asociace
- V roce 2022 bylo Světovou lékařskou asociací (WMA) přijato nové znění etického kodexu – co nového přináší?
- Etické zásady pro používání a sdílení genomických dat z výzkumu
- Indikace metabolické a bariatrické chirurgie – ASMBS/IFSO 2022
- Nové bariatrické postupy a etika v bariatrické chirurgii – stanovisko IFSO
- Praktická doporučení pro péči o dětské pacienty po transplantaci ledviny a jater
- Permanentní močový katétr – dobrý sluha, zlý pán: Doporučení pro prevenci, diagnostiku a léčbu močových infekci spojených s katetrizací
- Pravidla výběru hormonální léčby v klimakteriu a její alternativy
- Nízké hladiny vitaminu D v populaci exponované významnému znečištění životního prostředí
- Využití extrakorporální membránové oxygenace (ECMO) v léčbě kritického průběhu pneumonie
- Imunita po koronavirové infekci jako podle učebnice
- Trendy lázeňství v době postkovidové, dopady a perspektivy
- Spolek českých lékařů v Praze a jeho činnost v posledních desetiletích
- 160 let české medicíny prizmatem 16 jubileí Spolku českých lékařů na stránkách Časopisu lékařů českých
- Zemřel profesor Miroslav Ryska
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Permanentní močový katétr – dobrý sluha, zlý pán: Doporučení pro prevenci, diagnostiku a léčbu močových infekci spojených s katetrizací
- Imunita po koronavirové infekci jako podle učebnice
- Pravidla výběru hormonální léčby v klimakteriu a její alternativy
- Využití extrakorporální membránové oxygenace (ECMO) v léčbě kritického průběhu pneumonie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



