-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVznik a vývoj tukové kapénky a její role ve zdraví a nemoci
The origin and development of fat droplet and its role in health and illness
Lipid droplets are found in most cells, where they are needed for lipid metabolism and energy homeostasis. Their biogenesis is still not entirely described process, in which an organelle with monomolecular layer on the surface originates from two-layer membrane of the smooth endoplasmic reticulum. Large lipid droplets can be formed either by growth or by fusion of smaller lipid droplets. Their basic functions are controlled lipid deposition and lipid metabolism and the protection of the intracellular environment from lipotoxicity. Currently, dysfunction of lipid droplet is associated with a number of diseases such as obesity, cardiometabolic syndrome, tumor and neurodegenerative diseases, lipodystrophy and cachexia.
Keywords:
lipid droplet, adipocyte, endoplasmic reticulum, perilipin, obesity, type 2 diabetes mellitus, lipodystroph
Autoři: Jana Dvořáková 1; Miroslava Čedíková 2; Anna Malečková 3,4; Vlastimil Kulda 1; Zbyněk Tonar 3; Dana Müllerová 5
Působiště autorů: Ústav lékařské chemie a biochemie LF UK Plzeň 1; Ústav fyziologie LF UK Plzeň 2; Ústav histologie a embryologie LF UK Plzeň 3; Biomedicínské centrum LF UK Plzeň 4; Ústav hygieny a preventivní medicíny LF UK 5
Vyšlo v časopise: Čas. Lék. čes. 2018; 157: 254-262
Kategorie: Přehledový článek
Souhrn
Tukové kapénky nacházíme ve většině buněk, kde jsou potřebné pro metabolismus lipidů a energetickou homeostázu. Jejich biogeneze je zatím málo prozkoumaný proces, při kterém z dvouvrstvé membrány hladkého endoplazmatického retikula vzniká organela s monomolekulární vrstvou na povrchu. Velké tukové kapénky se mohou tvořit buď růstem, nebo spojováním menších tukových kapének. Jejich základními funkcemi jsou kontrolované ukládání a řízený metabolismus lipidů a ochrana intracelulárního prostředí před lipotoxicitou. V současné době je dysfunkce tukové kapénky spojována s řadou onemocnění, jako jsou obezita, kardiometabolický syndrom, nádorová a neurodegenerativní onemocnění, lipodystrofie a kachexie.
Klíčová slova:
tuková kapénka, adipocyt, endoplazmatické retikulum, perilipin, obezita, diabetes mellitus 2. typu, lipodystrofie
ÚVOD
Tukové kapénky byly po mnohá desetiletí považovány jen za pouhý inertní rezervoár zásobní energie ve formě lipidů. Stále více se však potvrzuje jejich nenahraditelná role v mnohých fyziologických i patofyziologických pochodech. Do popředí zájmu se tukové kapénky dostávají zejména z důvodu zvyšující se prevalence obezity, diabetu mellitu 2. typu a dalších složek metabolického syndromu (1).
Jedná se o dynamické organely heterogenní ve struktuře, chemickém složení a tkáňovém rozložení, jež se vyskytují především v adipocytech. V proměnlivém počtu a velikosti jsou nacházeny i v mnoha dalších typech eukaryotických buněk (tab. 1, obr. 1).
Tab. 1. Příklady výskytu tukových kapének a jejich funkce v různých buněčných typech 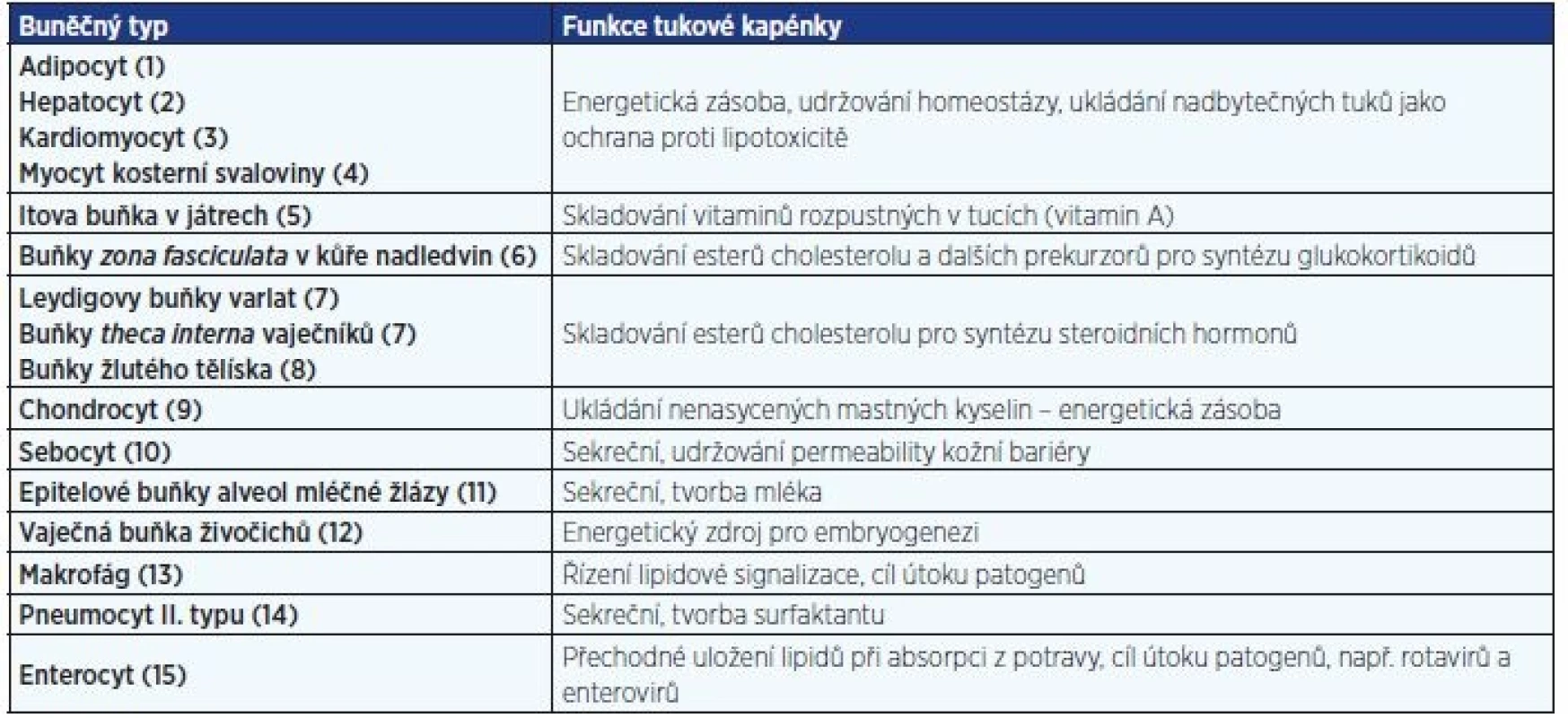
Obr. 1. Tukové kapénky v různých buněčných typech: 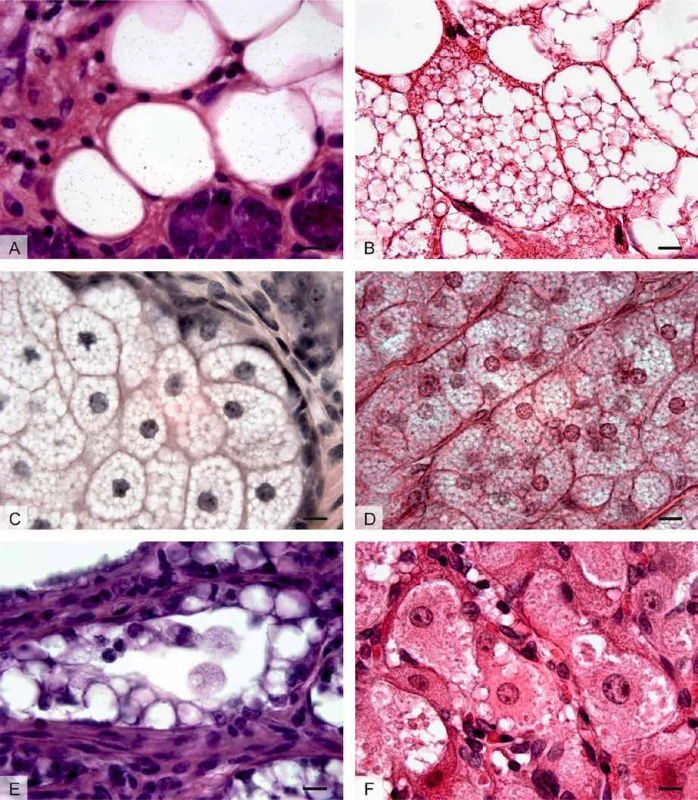
A: Adipocyty bílého tukového vaziva glandula parotis. Velká tuková vakuola vyplňuje téměř celou buňku („prázdné“ prostory uvnitř buňky). Jádro a ostatní organely jsou v adipocytech bílého tukového vaziva umístěny excentricky na okraji buňky a společně s úzkým lemem cytoplazmy vytvářejí na běžných histologických preparátech tvar pečetního prstenu.
B: Multilokulární adipocyty hnědé tukové tkáně obsahující velké množství tukových kapének menších rozměrů.
C: Mazové žlázy kůže s holokrinním způsobem sekrece. Světlé sebocyty obsahující velké množství menších tukových kapének, jejichž nahromadění postupně vede k porušení cytoplazmatické membrány a tím pádem k jejich uvolnění společně s buněčným obsahem – kožním mazem (sebem).
D: Epitelové buňky kůry nadledvin zona fasciculata uspořádané do podlouhlých provazců. V buňkách se nachází velké množství tukových kapének s obsahem neutrálních lipidů, fosfolipidů a cholesterolu, který slouží jako prekurzor syntézy steroidních hormonů – glukokortikoidů.
E: Mléčná žláza v laktačním období s apokrinním způsobem sekrece. Světlé galaktocyty vyskytující se v sekrečních alveolech mléčné žlázy hromadí v apikální části cytoplazmy tukové kapénky, které se společně s tenkou vrstvou apikální cytoplazmy uvolňují do mléka.
F: Granulóza-luteinní buňky vaječníku corpus luteum s pěnitou (vakuolizovanou) cytoplazmou, jejíž vzhled je podmíněn množstvím tukových kapének. Podobně jako buňky kůry nadledvin, granulózaluteinní buňky jsou producenty steroidních hormonů – progesteronu.
Foceno imerzním objektivem se 100násobným zvětšením (měřítko = 10 μm). Preparáty barveny hematoxylinem a eozinem.Hlavní funkcí tukové kapénky je skladování tuků ve formě hydrofobních triacylglycerolů (triglyceridů). Tato funkce je nejvíce zřetelná u adipocytů bílé tukové tkáně s jednou velkou unilokulární tukovou kapénkou, která vyplňuje většinu cytoplazmy buňky a jádro a další organely utlačuje do periferie. Bílá tuková tkáň je u savců rozptýlená po celém těle. Nejvíce tuku se nachází v podkoží a v intraabdominální oblasti.
Rozeznáváme ještě další dva typy tukové tkáně, hnědou a béžovou. Větší zásoby hnědé tukové tkáně mají kojenci, časem tato tkáň podléhá involuci, ale celý život přetrvává v interskapulárním prostoru, paravertebrálně, axilárně a perirenálně. Hnědá tuková tkáň je termogenním orgánem. Její buňky jsou menší než buňky bílé tkáně, obsahují větší množství malých tukových kapének a hodně mitochondrií. Béžovou tukovou tkání jsou nazývány hnědé adipocyty vyskytující se po termogenní stimulaci v anatomických místech odpovídajících bílé tukové tkáni. Tento proces se nazývá hnědnutí tukové tkáně. Béžovou tukovou tkáň můžeme charakterizovat kombinací obou předešlých typů. Její buňky jsou prostřední velikosti, mají více větších tukových kapének a o něco méně mitochondrií než buňky hnědé tukové tkáně (16).
Pro všechny organismy představuje schopnost skladovat energii evoluční výhodu. Mezi další buněčné funkce, na kterých se tukové kapénky podílejí a jež se nevztahují přímo k metabolismu lipidů, se řadí například ukládání a degradace proteinů a imunitní odpověď (17). Všechny funkce tukových kapének jsou dány jejich unikátní strukturou (18–20).
STRUKTURA TUKOVÉ KAPÉNKY
Tukové kapénky (obr. 2) jsou útvary kulovitého tvaru, které mohou být seskupeny do hroznovitých struktur (21). Jejich průměr se pohybuje v rozmezí 0,1–5 µm u netukových buněk, u bílých adipocytů pak mohou dosahovat velikosti > 100 µm (22).
Obr. 2. Struktura tukové kapénky. 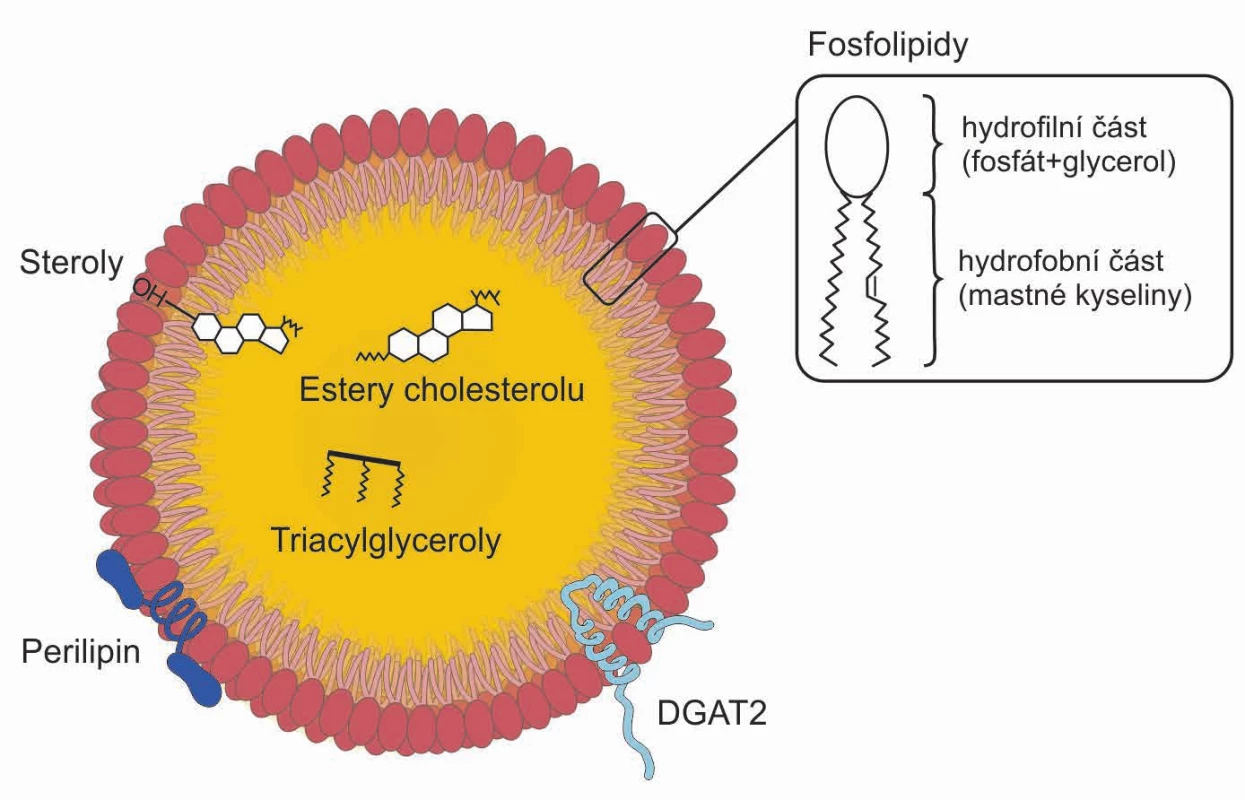
V monovrstvě na povrchu jsou částečně polární (amfipatické) fosfolipidy a steroly. V hydrofobním jádře jsou uskladněny triacylglyceroly a estery cholesterolu. Na povrchu tukové kapénky jsou různé proteiny syntetizující neutrální lipidy (např. DGAT2) a proteiny skupiny PAT řídící ukládání a využití tuků (např. perilipin). V monovrstvě na povrchu jsou částečně polární (amfipatické) fosfolipidy a steroly. V hydrofobním jádře jsou uskladněny triacylglyceroly a estery cholesterolu. Na povrchu tukové kapénky jsou různé proteiny syntetizující neutrální lipidy (např. DGAT2) a proteiny skupiny PAT řídící ukládání a využití tuků (např. perilipin).
Povrch kapének není ohraničen konvenční biologickou membránou, jako je tomu u jiných organel, které mají vodný obsah uvnitř membrány tvořené fosfolipidovou dvouvrstvou. Tukové kapénky jsou tvořeny hydrofobním jádrem z neutrálních lipidů pokrytých monomolekulární fosfolipidovou vrstvou. Ta je tvořena více druhy fosfolipidových molekul (21). Nejhojněji je zastoupen fosfatidylcholin (PC), v menším množství je nalézán fosfatidyletanolamin (PE), fosfatidylinositol (PI), lysofosfatidylcholin (lysoPC) a lysofosfatidyletanolamin (lysoPE). Dále mohou být ve fosfolipidové membráně identifikovány amfifilní proteiny (mj. perilipiny v tukových buňkách a buňkách produkujících steroidní hormony). Rovněž se zde může nacházet volný cholesterol, který se pravděpodobně vyskytuje i uvnitř tukové kapénky (1).
K povrchu tukové kapénky jsou přichyceny specifické proteiny, z nichž se mnohé účastní metabolismu lipidů. Většina tukových kapének má na povrchu 50–200 různých proteinů. Spektrum proteinů se může lišit mezi tukovými kapénkami různých velikostí nebo různé lipidové kompozice. Složení monomolekulární vrstvy je velmi důležité pro regulaci velikosti tukové kapénky a pro její schopnost komunikovat a interagovat s ostatními tukovými kapénkami nebo organelami, např. s endoplazmatickým retikulem a mitochondriemi (23).
Další skupinu představují proteiny, které se nacházejí uvnitř kapénky. Hydrofilní proteiny pravděpodobně samy v kapénce neexistují, ale amfifilní proteiny se mohou skládat s fosfolipidy a vytvářet struktury kompatibilní s hydrofobním prostředím (1). Jedná se například o proteiny ze skupiny perilipinů, tj. tail-interacting protein (TIP47) a adipofilin (ADRP), u nichž se předpokládá zapojení i do nitrobuněčného metabolismu lipidů (24).
V tukové kapénce se střádají neutrální tuky – triglyceridy a estery cholesterolu. V bílých adipocytech jsou uloženy převážně triglyceridy, ale ve většině ostatních buněčných typů koexistují triglyceridy a estery cholesterolu v různých poměrech. Předpokládá se, že triglyceridy a estery cholesterolu jsou od sebe odděleny. Estery cholesterolu tvoří pod povrchem monofosfolipidové membrány koncentrické vrstvy, zatímco triglyceridy jsou víceméně náhodně uspořádány v centru tukové kapénky (25). K podobnému oddělení může docházet také mezi triglyceridy, z důvodu velké rozdílnosti teploty tání závislé na složení mastných kyselin. Pod kryoelektronovým mikroskopem jsou pozorovány soustředné linky vzhledu slupky cibule, což zřejmě odráží toto dělení mezi lipidy (19).
BIOGENEZE TUKOVÉ KAPÉNKY
V současnosti existují dvě hlavní hypotézy procesu tvorby tukových kapének (lipogeneze) (1). Podle jedné z nich vznikají tukové kapénky de novo, podle druhé mohou být odvozeny od již existujících tukových kapének dělením. Upřednostňován je proces vzniku de novo. Tento proces probíhá ve třech fázích. Nejprve dochází k syntéze neutrálních lipidů, pak k jejich akumulaci a vzniku čočkovité formace a nakonec k samotnému vzniku tukové kapénky odškrcením z endoplazmatického retikula směrem do cytosolu (23).
Syntéza neutrálních lipidů
Neutrální lipidy jsou syntetizovány izoformami enzymů vázaných v membráně endoplazmatického retikula, a to acyl-CoA:diacylglycerol-acyltransferázami (DGAT1, DGAT2) a acyl-CoA:cholesterol-acyltransferázami (ACAT1, ACAT2). Experimentálně bylo zjištěno, že zatímco DGAT2 je pro život nezbytná, DGAT1, ACAT1 a ACAT2 nikoliv (26). Své substráty potkávají tyto enzymy přímo v endoplazmatickém retikulu. Jeden z běžných substrátů odvozený od mastných kyselin je acyl-CoA produkovaný acyl-CoA-syntetázou (ACSL); navázání mastné kyseliny na acyl-CoA ji aktivuje pro použití v metabolických drahách. Enzymy DGAT využívají acyl-CoA a diacylglycerol k vytvoření triacylglycerolů. Podobně jsou estery cholesterolu produkovány kondenzací acyl-CoA s cholesterolem za katalýzy ACAT (23).
Akumulace lipidů a vznik čočkovité formace
Vzniklé lipidy se akumulují v hladkém endoplazmatickém retikulu na místech, která jsou od syntetizačních enzymů oddělená. Po nahromadění určitého množství a překročení konkrétního prahu se v endoplazmatickém retikulu vytvoří tukové čočky, které se vyklenují směrem do cytoplazmy. Tomu, aby se tuková kapénka vytvořila směrem do lumen endoplazmatického retikula, brání protein FIT2 (27).
Uvolnění tukové kapénky odškrcením z endoplazmatického retikula
Nad určitou velikost, v závislosti na fosfolipidovém složení, jsou čočkovité formace tuků v endoplazmatickém retikulu nestabilní a mechanismem podobným odškrcení dochází k jejich uvolnění. Nejmenší zralé cytosolové tukové kapénky mají průměr v rozsahu 250–500 nm, ale není vyloučeno, že rodící se kapénky mohou být i menší než 100 nm.
Do vývoje vznikajících tukových kapének jsou zapojeny i některé proteiny, které mohou stabilizovat nebo zlepšovat počáteční konvexní zakřivení kapének. Tuto funkci zřejmě zastává TIP47 ze skupiny perilipinů, který je považován za hlavní regulační protein (28). Nicméně tukové kapénky se tvoří rovněž v organismech, které perilipiny neexprimují. Proto se předpokládá, že tvorba kapének může probíhat spontánně, přičemž proteiny ji mohou pouze usnadňovat nebo regulovat (23).
Dalšími proteiny účastnícími se vzniku tukových kapének jsou například seipin (BSCL2), lipiny a transmembránové proteiny vyvolávající ukládání tuku (fat storage-inducing transmembrane proteins 1 a 2; FIT1/FITM1 a FIT2/FITM2). Seipin je regulátorem katabolismu lipidů, je nezbytný pro diferenciaci adipocytů a pro správné ukládání lipidů. Jedná se o protein endoplazmatického retikula, jehož nedostatek dramaticky snižuje počet a velikost tukových kapének (23). Při absenci seipinu je formování tukových kapének zpožděné. Dochází k akumulaci neutrálních lipidů v endoplazmatickém retikulu, čímž se mohou dostat na nevhodná místa, např. do jádra. Mutace seipinu vedou k některým lipodystrofiím.
Lipidy jsou v savčích buňkách exprimovány v pěti izoformách. Jsou nutné k zabránění velké akumulace neutrálních lipidů v endoplazmatickém retikulu (28). FIT1 je primárně exprimován v kosterním svalstvu a FIT2 v tukové tkáni. Tyto proteiny nesyntetizují triglyceridy, ale nejspíš je rozdělují do vznikajících tukových kapének (29).
RŮST TUKOVÉ KAPÉNKY
Tukové kapénky jsou heterogenní a dynamické struktury, které jsou schopné měnit svůj počet a velikost v závislosti na potřebách buňky. Proto je jejich velikost v maturovaných buňkách různá a závisí na konkrétním buněčném typu a na metabolických podmínkách uvnitř buňky. Největší tukové kapénky nacházíme v adipocytech bílé tukové tkáně, jejichž velké unilokulární tukové kapénky představují efektivní uložení energie. Tvorbu unilokulárních kapének podporují proteiny skupiny CIDE (cell death-inducing DFF45-like effector). Členy této skupiny proteinů jsou u savců CIDEA, CIDEB a CIDEC (Fsp27). Jsou lokalizované především na kontaktních místech mezi kapénkami, kde usnadňují přenos lipidů z menších kapének na větší. Jejich nedostatek tvorbě unilokulárních kapének brání, naopak nadměrná exprese indukuje vznik větších tukových kapének v menším množství (30).
Velké tukové kapénky vznikají dvěma mechanismy, buď růstem, nebo vzájemným spojováním (fúzí) malých tukových kapének ve větší.
Růst tukových kapének probíhá přidáváním neutrálních lipidů do hydrofobního centra a polárních lipidů (fosfolipidů a sterolů) na jejich periferii (31).
Vzájemná fúze je závislá na mikrotubulech a molekulárních motorech, jako jsou dynein a kinesin. Podílejí se na ní proteiny SNARE (receptory SNAP), dále SNAP23 (synaptosomal-associated protein), syntaxin-5 a VAMP4 (vesicle-associated membrane protein 4). Mutací genů pro tyto proteiny se snižuje rychlost fúze a velikost tukových kapének (32). Fúze může být také podpořena ztrátou CTP:fosfocholin-cytidylyltransferázy, která je důležitá pro syntézu fosfatidylcholinu. Dostupnost fosfatidylcholinu by tak mohla být dalším kritickým regulačním faktorem růstu tukových kapének (33).
Bez ohledu na mechanismus vzniku je při růstu tukových kapének jejich povrch a objem proporcionálně koordinován (22).
ROZPAD A ZÁNIK TUKOVÉ KAPÉNKY
V kontrastu k procesu růstu tukových kapének byl v adipocytech po silné lipolytické stimulaci pozorován proces jejich štěpení, který je charakteristický fragmentací tukové kapénky na velké množství malých dispergovaných kapének. Zvýšení počtu – a tak také zvětšení povrchu – kapének je nezbytné pro umožnění přístupu lipázy k jádru tvořenému triacylglyceroly. Lipidy uvolněné při tomto procesu mohou být buňkou využity pro metabolismus, ale i k tvorbě nových tukových kapének (31).
Využití neutrálních lipidů z kapének se také účastní hormonálně řízený autofágní proces nazvaný lipofágie. Při lipofágii obalí tukovou kapénku dvojitá membrána, vytvoří se autofagosom, který předchází fúzi s lyzosomem (makroautofágie přítomné u savců) nebo je kapénka pohlcena lyzosomem rovnou (mikroautofágie přítomné u kvasinek) (28). Degradace tukových kapének autofágií hraje zásadní roli při mobilizaci volných mastných kyselin pro metabolismus, udržování lipidové homeostázy v tukových kapénkách, ale také při adaptaci buňky na lipidovou nerovnováhu při hladovění (34). Životní cyklus tukové kapénky je schematicky znázorněn na obr. 3 (28).
Obr. 3. Životní cyklus tukové kapénky. Na obrázku jsou znázorněny důležité události v životním cyklu tukových kapének: 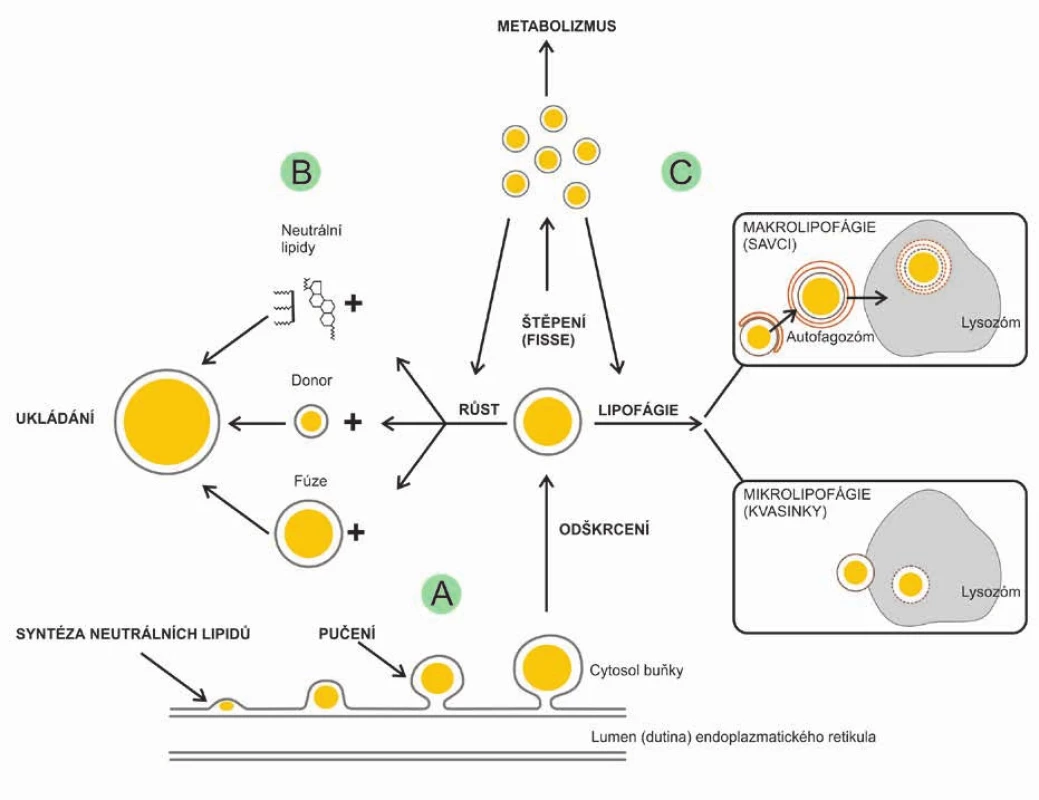
A: Biogeneze tukové kapénky. Na membráně endoplazmatického retikula dochází k syntéze neutrálních lipidů, uková kapénka pučí a odškrcuje se směrem do cytosolu buňky.
B: Růst tukové kapénky přidáváním neutrálních lipidů do hydrofobního jádra a vzájemnou fúzí různě velkých kapének. Ukládání v tukové tkáni.
C: Rozpad a zánik tukové kapénky. Tuková kapénka se po lipolytické stimulaci štěpí na množství dispergovaných kapének. Část těchto kapének je využita pro metabolismus, další se vracejí do procesu tvorby nových tukových kapének. Degradace tukových kapének probíhá také autofágií (lipofágií). U savců vzniká autofagosom tak, že je tuková kapénka nejprve obalena dvojitou membránou a pak pohlcena lyzosomem (makrolipofágie), u kvasinek je tuková kapénka pohlcena rovnou (mikrolipofágie).SKUPINA PROTEINŮ PAT
V ukládání a využití tuků v tukových kapénkách hrají kritickou roli proteiny PAT umístěné na povrchu tukové kapénky. U savců jsou to perilipin (PLIN1), adipofilin (ADRP – adipose differentiation-related protein; PLIN2) a TIP47 (tail-interacting protein; PLIN3), dalšími členy jsou pak S3-12 (PLIN4) a OXPAT (PLIN5). Liší se od sebe velikostí, tkáňovou expresí, afinitou k tukovým kapénkám, stabilitou a transkripční regulací. Tyto rozdíly způsobují, že každý z proteinů PAT má odlišné buněčné funkce, ale všechny pravděpodobně regulují rozhraní mezi tukovými kapénkami a buněčným prostředím, řídí přístup lipáz k lipidům uvnitř jádra a rovněž se mohou účastnit buněčných procesů důležitých pro biogenezi kapének.
Jako první byl objeven perilipin v laboratoři Constantinea Londose v roce 1990 (35). Jeho objev poukázal na existenci regulačních mechanismů pro kontrolu skladování tuku. Perilipin se u savců vyskytuje ve třech izoformách (perilipin A, B a C). Je exprimován v adipocytech a steroidogenních buňkách a je hlavním regulačním faktorem lipolýzy v bílých adipocytech. Perilipin může přístup lipáz (enzymů hydrolyzujících triacylglyceroly) k tukovým kapénkám buď omezovat, nebo naopak jejich enzymatickou aktivitu za vhodných metabolických podmínek usnadňovat. Je markerem adipocytové diferenciace, a proto se využívá k identifikaci regulátorů adipogeneze. Exprese perilipinu je primárně regulována peroxisomovými proliferátory aktivovanými receptory gamma (PPARγ). Genetické variace v genu pro perilipin byly spojeny s metabolickými onemocněními, včetně diabetu mellitu 2. typu a obezity.
ADRP a TIP47 jsou nacházeny ve všech typech buněk, S3-12 je také jako perilipin omezen hlavně na adipocyty a OXPAT je exprimován zejména v orgánech, kde probíhá aktivní oxidace mastných kyselin, jako jsou játra, svaly a hnědá tuková tkáň (35).
POHYBLIVOST TUKOVÝCH KAPÉNEK A JEJICH INTERAKCE S JINÝMI ORGANELAMI
Tukové kapénky jsou pohyblivé struktury. Pohyb je důležitý pro regulaci jejich intracelulární distribuce a interakci s jinými organelami. Vykazují dva typy pohybu. Prvním je náhodný pohyb na krátké vzdálenosti, druhým pohyb na delší vzdálenosti, obvykle podél mikrotubulů. Tento druhý typ pohybu podporuje růst a odbourávání kapének a umožňuje přenos živin z míst syntézy na místa jejich potřeby. Protein LSD2 (lipid storage droplet 2), který je homologem proteinu PAT, reguluje obousměrné pohyby tukových kapének koordinací opačně polárních motorických proteinů (dyneinu a kinesinu). Dynein obstarává pohyb podél vláken mikrotubulů ke konci minus a kinesin ke konci plus mikrotubulů (1). Experimentálně navozená nadměrná exprese nebo naopak nedostatek LSD2 vedla ke vzniku buď obézní, nebo podvyživené mouchy octomilky, což ukazuje, že LSD2 je důležitý pro normální skladování lipidů. Je možné, že aktivní pohyb podél mikrotubulů zvyšuje pravděpodobnost vzájemné fúze a tím podporuje tvorbu větších tukových kapének, které jsou mnohem rezistentnější vůči lipolýze než kapénky menší (12).
Tukové kapénky nejsou v buňce na dráhy vezikulárního transportu přímo napojené, avšak pro správné plnění jejich funkce jsou interakce s jinými buněčnými organelami důležité. Interakce můžeme rozdělit na heterotypické, kdy se jedná o interakce tukových kapének s endoplazmatickým retikulem, mitochondriemi, peroxisomy a endosomy, a na homotypické, což jsou interakce pouze mezi tukovými kapénkami.
Při vzájemné interakci tukových kapének byla zjištěna role proteinu Fsp27 (fat-specific protein 27; CIDEC) lokalizovaného na membráně v kontaktních místech. Fsp27 interaguje s adipocytární triglyceridovou lipázou (ATGL) a reguluje tak bazální a stimulovanou lipolýzu. Zprostředkovává tvorbu velkých unilokulárních tukových kapének přítomných v adipocytech obratlovců. Jestliže chybí, adipocyty akumulují menší multilokulární tukové kapénky, které mají relativně zvětšený povrch, a tím k němu mají lipázy snadnější přístup. To však může omezovat skladování lipidů v tukové tkáni a místo toho se mohou lipidy akumulovat v jiných orgánech (např. v játrech) a vyvolávat inzulinovou rezistenci (36).
S endoplazmatickým retikulem souvisejí tukové kapénky už z toho důvodu, že je místem jejich vzniku a slouží také jako prostředník pro dopravu intracelulárních lipidů. Na kontaktním místě tukové kapénky a endoplazmatického retikula je lokalizován integrální membránový protein seipin, řídící třídění neutrálních lipidů, fosfolipidů a některých proteinů na tukové kapénce, aby se tím zajistila její identita a zrání (37).
Tukové kapénky se také nacházejí v těsné blízkosti mitochondrií a peroxisomů. V těchto organelách dochází k beta-oxidaci (v mitochondriích u živočichů, v peroxisomech u kvasinek a rostlin), tj. konverzi mastných kyselin na acetyl-CoA. Mezi tukovými kapénkami a mitochondriemi nebo peroxisomy proto musí být zajištěna koordinace mezi dodáváním mastných kyselin a lipolýzou. Fyzický kontakt mezi mitochondrií a tukovou kapénkou zprostředkovává OXPAT (PLIN5) pomocí C-terminální oblasti.
Degradace tukových kapének probíhá lipofágií – vzájemnou interakcí kapének s lyzosomy. Zvýšená lipofágie vede k vylučování tukových kapének, což může zabránit patologickým stavům, jako je např. steatóza jater (37).
Kromě výše uvedených informací mají tukové kapénky přechodný kontakt s fagosomy. Toto setkání slouží v neutrofilech k dodání kyseliny arachidonové, která je prekurzorem eikosanoidů sloužících pro aktivaci NADPH oxidázy fagosomů (1).
FUNKCE TUKOVÝCH KAPÉNEK
Hlavní funkcí tukových kapének je skladování lipidů, a to v adipocytech i v neadipocytových buňkách. Skladované lipidy slouží hlavně jako energetická zásoba a jsou mobilizovány pro beta-oxidaci, biogenezi membrán, posttranslační modifikaci proteinů, syntézu lipoproteinů, steroidů, signálních lipidů, jiných lipidových mediátorů. Slouží jako rezervoár různých proteinů, včetně transkripčních faktorů a komponent chromatinu a také se v nich ukládají vitaminy rozpustné v tucích (5).
Klíčovými enzymy zapojenými v intracelulární degradaci triacylglycerolů v adipocytech i v neadipocytárních buňkách jsou adipocytární triglyceridová lipáza (ATGL) a hormon-senzitivní lipáza (HSL) (38).
Lipidové kapénky rovněž chrání buňku před toxickým účinkem volných mastných kyselin. Ty mohou ohrozit integritu membrány, ale esterifikací do neutrálních triglyceridů se stávají stabilními a neškodnými. (13).
Kromě běžných funkcí souvisejících se skladováním lipidů nebo jejich metabolismem jsou tukové kapénky zapojeny rovněž do dalších důležitých procesů v buňce, i takových, které se přímo k lipidovému metabolismu nevztahují a jsou často spojené s patologickými stavy (39). Tukové kapénky jsou důležité pro replikaci a životní cyklus virů a jiných intracelulárních patogenů (40). Mezi patogeny využívající tukové kapénky pro svoji proliferaci a přežití patří například Chlamydia trachomatis a virus hepatitidy C (HCV) (1).
Významné pro vznik metabolických onemocnění je rovněž uskladnění perzistentních organických polutantů v tukových kapénkách adipocytů. Jedná se o látky jako polychlorované pesticidy, bifenyly, dioxiny a dibenzofurany, bromované zpomalovače hoření a další. Jsou to látky lipofilní, bioakumulativní, do lidského těla se dostávají hlavně živočišnou tučnou potravou. Řadíme je mezi tzv. endokrinní disruptory, protože poškozují embryonální vývoj a reprodukční schopnosti a podílejí se na vzniku obezity a jejích komorbidit, zejména rozvoji diabetu mellitu 2. typu (41).
Je známo, že tukové kapénky hrají důležitou roli i v imunitním systému. Jsou místem syntézy eikosanoidů, signálních lipidů ovlivňujících například zánět, bolest a kontrakce hladké svaloviny. Pro jejich syntézu je prekurzorem kyselina arachidonová (42).
PATOLOGICKÉ STAVY SPOJENÉ S TUKOVÝMI KAPÉNKAMI
S nedostatkem nebo naopak nadbytkem tukových kapének v buňce je spojeno široké spektrum onemocnění (tab. 2). Pochopení mechanismů, jež se v kapénkách odehrávají, může osvětlit řadu patologických stavů a poskytnout příležitost k jejich léčbě (43).
Tab. 2. Patologické stavy asociované s dysfunkcí tukových kapének 
Obr. 4. Histologický obraz tkání u patologických stavů spojených s tukovými kapénkami: 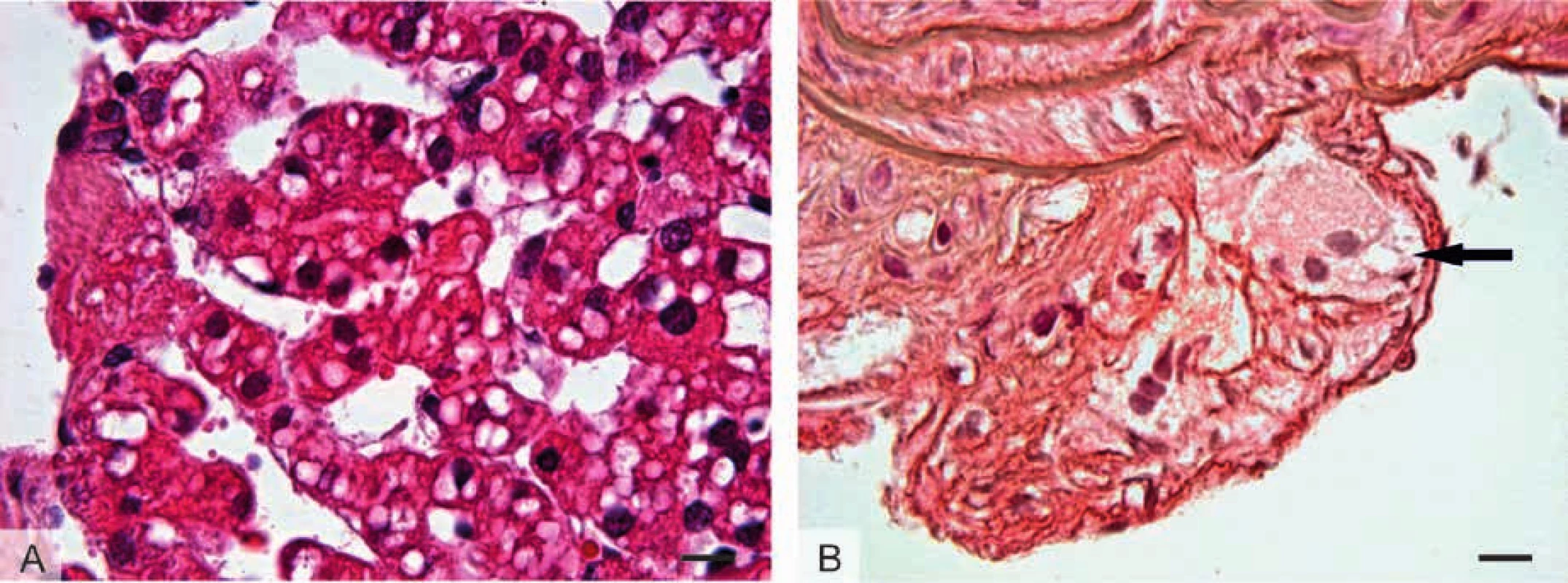
,b>A: Játra prasete domácího s obrazem jaterní steatózy s nahromaděním tukových kapének v cytoplazmě hepatocytů.
B: Preparát karotidy myši s aterosklerotickým plátem stadia II histologické klasifikace. V subendotelové vrstvě vaziva se nacházejí velké pěnové buňky – mnohojaderné makrofágy s nahromaděním tukových kapének (šipka).Lipodystrofie
Lipodystrofie jsou poruchy charakterizované ztrátou tukové tkáně. Buď může jít o klinické projevy celkové, vrozené generalizované lipodystrofie, nebo částečné, familiární parciální lipodystrofie. Protože je porušena schopnost uchovávat triglyceridy v tukové tkáni, jsou lipidy skladovány v jiných tkáních, což vede k lipotoxicitě a závažným změnám metabolismu. S nimi jsou běžně spojovány poruchy jako inzulinová rezistence, jaterní steatóza, hypertenze a další metabolické dysfunkce. Nedostatek bílé tukové tkáně vede k deficitu leptinu (adipokinu zajišťujícího energetickou homeostázu) a k inzulinové rezistenci. Mnoho závažných lipodystrofií lze korigovat podáváním leptinu.
Lipodystrofie jsou způsobené defekty řady genů, z nichž mnohé řídí syntézu triglyceridů nebo ukládání proteinů a jsou zapojeny v tvorbě a regulaci tukových kapének. Především se jedná o 1-acylglycerol-3-fosfát-O-acyltransferázu 2 (AGPAT2), lipin 1 (LPIN1; způsobuje lipodystrofii pouze v myších modelech), dále seipin (BSCL2). Seipin je vestavěný do membrány endoplazmatického retikula a inhibuje diferenciaci adipocytů a potlačuje expresi PPAR-γ. K lipodystrofiím vede také nedostatek membránového proteinu kaveolinu 1 (CAV1). Bylo pozorováno, že částečné lipodystrofie jsou rovněž způsobeny mutacemi dvou proteinů v tukové kapénce – perilipinu 1 (PLIN) a CIDEC, který hraje významnou roli v apoptóze. Mutace CIDEC brání tvorbě unilokulárních tukových kapének v adipocytech (43).
Kachexie
Kachexie je komplexní metabolický syndrom častý zejména u pacientů s gastrointestinálními, prostatickými a plicními karcinomy. Metabolismus lipidů se u nich zásadně mění, což vede k dramatickému snížení jejich tělesné hmotnosti způsobenému ztrátou tukové tkáně a poté i k atrofií kosterního svalstva.
Klíčovým faktorem při kachexii je zvýšená lipolýza, která je zprostředkovaná ATGL (adipocytární triglyceridovou lipázou), nikoliv HSL (hormon-senzitivní lipázou), jak se dříve předpokládalo. Myši s nefungující ATGL jsou chráněny před ztrátou tukové tkáně (ne však před ztrátou kosterního svalstva) a po indukci kachexie nemají zvýšenou lipolýzu navzdory vysokým hladinám faktorů mobilizujících lipidy, jako jsou zink-alfa-2-glykoprotein 1 (AZGP1), tumor nekrotizující faktor α (TNF-α) nebo interleukin 1 (IL-1). Zánětlivé a lipolytické mediátory, jež aktivují ATGL potenciálně vylučované nádorem, tedy mohou v kachexii způsobit nekontrolovanou ztrátu tukové tkáně (43).
Chanarinův-Dorfmanův syndrom (ichtyóza) a myopatie
Tato onemocnění tvoří heterogenní skupinu autosomálně recesivně dědičných poruch charakterizovaných deficitem degradace triglyceridů a jejich následnou akumulací v mnoha tkáních a orgánech, jako jsou kůže, játra, svaly, střevo, oči a uši.
Chanarinův-Dorfmanův syndrom (ichtyóza) je způsoben mutacemi genu CGI-58. Při tomto postižení je narušena oxidace mastných kyselin s dlouhým řetězcem. Výsledkem je poškození propustnosti kůže.
Mutace ATGL způsobují abnormální skladování neutrálních lipidů, provázené některými závažnými typy kardiomyopatií. Výzkumy naznačují, že při léčbě by mohlo být užitečné použití agonistů PPAR-α, kteří dokážou zvrátit mitochondriální dysfunkci a akumulaci lipidů v srdci a obnovit tak jeho funkci (43).
Obezita, metabolický syndrom a diabetes
Obezita se stala vzhledem k sedavému životnímu stylu a nezdravým stravovacím návykům celosvětovým zdravotním problémem. Jedná se o obtížně léčitelné onemocnění, proto se intenzivně zkoumají možnosti medikamentózní léčby, při níž se využívá hlavně tlumení chuti k jídlu, blokáda vstřebávání tuku v trávicím traktu, ovlivnění hormonů trávicího traktu (inkretinů) a nově blokáda zpětné absorpce glukózy v ledvinách (47).
Obezita může vést k metabolickému syndromu, což zvyšuje riziko vzniku diabetu 2. typu, steatohepatitidy a kardiovaskulárního onemocnění.
Hypertrofované adipocyty nevylučují dostatek adipokinů k udržení citlivosti na inzulin. Zvyšuje se množství zánětlivých cytokinů, např. MCP-1, TNF-α, IL-6. Tuková tkáň je infiltrována aktivujícími se makrofágy. TNF-α snižuje hladiny buněčného perilipinu, což vede ke zvýšení bazální lipolýzy a hladiny volných mastných kyselin v krvi. Tyto efekty TNF-α vyvolávající inzulinovou rezistenci mohou být antagonizovány antidiabetiky typu thiazolidindionů.
Za normálních podmínek skladuje tuková tkáň mastné kyseliny ve formě neutrálních triglyceridů. Při metabolickém syndromu je však rezervoárová funkční kapacita tukové tkáně překročena a volné mastné kyseliny se pak hromadí v kosterním svalstvu, srdci či játrech. Působí zde lipotoxicky a spolupodílejí se na rozvoji metabolického syndromu s inzulinovou rezistencí.
Na buněčné úrovni zde dochází při akumulaci triglyceridů k nadměrnému zmnožení tukových kapének. V adipocytech pak jde o zvětšení tukové kapénky s následkem celkového zvětšení buňky. Patologii nadměrného ukládání triglyceridů mohou ovlivnit proteiny asociované s tukovými kapénkami. Pro unilokulární tukové kapénky jsou klíčové proteiny FSP27/CIDEC a perilipin 1.
FSP27/CIDEC ovlivňuje vývoj metabolického syndromu regulací ukládání triglyceridů v adipocytech a jeho polymorfismy ovlivňují riziko obezity. Exprese perilipinu 1, lokalizovaného rovněž na povrchu tukových kapének, je důležitým faktorem asociovaným s obezitou. Chrání kapénku před bazální lipolýzou, ale když dojde ke stimulaci lipolýzy, reguluje přístup lipáz ke kapénce. Vysoké hladiny exprese těchto proteinů podporují skladování triglyceridů v tukové tkáni, chrání před lipotoxicitou a inzulinovou rezistencí (43).
Steatóza jater
Metabolický syndrom je často doprovázen jaterní steatózou, tj. akumulací tukových kapének s triglyceridy v hepatocytech. V játrech postižených steatózou hepatocyty exprimují perilipin 1, který se normálně vyskytuje pouze v tukové tkáni. Se zvýšeným rizikem vývoje jaterní steatózy jsou spojeny i polymorfismy a genetické variace dalších genů, např. PNPLA (adiponutrinu), jaterní lipáza (LIPC/HTGL) a lysofosfolipáza 1 (LYPLAL1) a enzymy DGAT2 zapojené v syntéze triglyceridů.
Riziko steatózy jater se také silně zvyšuje po infekci virem hepatitidy C, která vyvolává metabolické změny v infikovaných hepatocytech. Mechanismus šíření virových částic je závislý na DGAT1 a tukových kapénkách. Vir HCV inhibuje lipolýzu, tím tukové kapénky stabilizuje, a tak může indukovat vznik steatózy (43).
Kardiovaskulární onemocnění
Častou příčinou úmrtí v průmyslových zemích je ateroskleróza. Při ní se v cévách ukládají estery cholesterolu, což může vést k infarktu myokardu, cévní mozkové příhodě nebo náhlé srdeční smrti. Estery cholesterolu jsou v cévách uloženy hlavně v tukových kapénkách pěnových buněk (makrofágy střádající lipidy). Hromadění esterů cholesterolu makrofágy má funkci ochrannou, protože volný cholesterol je pro buňky toxický a prozánětlivý. Toto skladování esterů cholesterolu v tukových kapénkách podporují některé jejich proteiny, např. ADRP, CIDEB a CIDEC. Překročení kapacity akumulace cholesterolu nad odstraňujícími mechanismy vede k tvorbě plátu, erozi, prasknutí plátu a následné trombóze (43).
Onemocnění nervového systému
Ve zdravých neuronech a gliích se vyskytují tukové kapénky velmi málo nebo vůbec. K hromadění tukových kapének v gliích však dochází při zvýšení hladiny reaktivních kyslíkových radikálů, které je způsobeno mitochondriální dysfunkcí v neuronech. Protože metabolismus lipidů vzhledem ke svým membránovým a signálním funkcím hraje v nervovém systému klíčovou roli, byla již nalezena řada důkazů o spojitosti tukových kapének s neurodegenerací.
Tukové kapénky byly detekovány v axonech neuronů, v kultivovaných neuronech a v částech mozku při Huntingtonově chorobě. Její příčinou je mutace v genu HTT pro protein huntingtin. Tato choroba se projevuje mimovolními pohyby, depresemi, psychózou, paranoiou a demencí.
Byla objevena také souvislost mezi α-synukleinem a tukovými kapénkami. Synuklein je protein, jehož dysfunkce nebo naopak nadměrná exprese může způsobit Parkinsonovu chorobu. Laboratorně bylo prokázáno, že se váže na lipidové kapičky.
Dědičné spastické paraplegie jsou poruchy charakterizované degenerací axonů motorických nervů, slabostí dolních končetin a spasticitou. Mnoho genů, které se tohoto onemocnění účastní, má ústřední roli v biologii tukových kapének, např. atlastin, REEP1, seipin, spartin, spastin a kinesin1 (13).
Součástí této skupiny genetických poruch je i Troyerův syndrom, který způsobuje degeneraci a odumírání svalových buněk a motorických neuronů. Je způsoben mutací genu SPG20, který kóduje spartin, multifunkční protein tukové kapénky, který je esenciální pro životaschopnost neuronů (44). Spartin se váže na TIP47 a spolu konkurují ADRP ve spojení s tukovou kapénkou. Pokles nebo nadměrná exprese spartinu vede ke zvýšení počtu a velikosti tukových kapének. Mutovaný spartin nemůže ADRP konkurovat a způsobuje onemocnění Troyerovým syndromem (1).
Nádorová onemocnění
Bylo zjištěno, že počet lipidových kapének ve zdravých buňkách prsu je asi poloviční než u nádorových buněk prsu, a dokonce až 4× nižší než u agresivních maligních buněk prsu. Zvýšené množství lipidových kapének tedy koreluje se zvýšenou agresivitou nádoru a může být spojeno se zvýšenou rychlostí syntézy lipidů v nádorových tkáních. Tento zvýšený metabolismus transformovaných buněk poskytuje většinu lipidů potřebných pro rychlou proliferaci nádorových buněk (46).
Kolorektální karcinom je ve světě třetím nejběžnějším druhem nádoru u mužů a druhým u žen. Předpokládá se, že za recidivu rakoviny po terapii jsou zodpovědné rakovinné kmenové buňky (CSC). Proto je důležitá identifikace jejich specifických markerů. Ramanovou spektroskopií bylo jasně odhaleno, že výraznou známkou buněk CSC při rakovině tlustého střeva je vysoká hladina tukových kapének. Tento poznatek je důležitý pro další terapeutické postupy (45).
ZÁVĚR
Tukové kapénky jsou buněčné organely, které hrají zásadní roli v uskladňování energie ve formě zásobních lipidů. Chrání přitom intracelulární prostředí buňky před lipotoxickým účinkem volných mastných kyselin. Podílejí se na kontrolované lipolýze, ve specifických buňkách i syntéze steroidních hormonů a dalších derivátů lipidů. V posledních letech bylo popsáno mnoho nových bílkovin, přítomných ať už na povrchu či uvnitř organely, které se podílejí např. na její velikosti, aktivním pohybu, modulaci bazální či aktivované lipolýzy, kontaktu s dalšími buněčnými organelami, jako je endoplazmatické retikulum či mitochondrie.
Adipocyty bílé tukové tkáně jsou buňkami, kde unilokulární tukové kapénky jsou rezervoárem energie nikoli pouze pro vlastní intracelulární potřebu, ale poskytují i energetickou rezervu a zároveň ochranu před lipotoxicitou ostatním tkáním. Poškození jejich funkcí či překročení jejich adaptačních limitů je spojeno s řadou závažných onemocnění projevujících se na straně jedné jako lipodystrofie, na straně druhé jako obezita s rozvojem inzulinové rezistence a kardiometabolických onemocnění. Dysfunkce tukové kapénky je ovšem v poslední době spojována i neurodegenerativními a nádorovými onemocněními. Další výzkum základních biologických vlastností tukových kapének a jejich vztahu k jiným organelám by proto mohl poskytnout i nové molekulární cíle pro terapeutickou intervenci.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Práce byla podpořena Programem rozvoje vědních oborů Univerzity Karlovy (Progres Q39), Národním programem udržitelnosti I (NPU I) č. LO1503 poskytovaným Ministerstvem školství, mládeže a tělovýchovy a programem Univerzitní výzkumná centra UK UNCE/MED/006 „Univerzitní centrum klinické a experimentální jaterní chirurgie“.
Seznam použitých zkratek
ACAT1 acyl-CoA:cholesterol acyltransferáza 1
ACAT2 acyl-CoA:cholesterol acyltransferáza 2
ACSL acyl-CoA syntetáza
acyl-CoA acetylkoenzym A
ADRP perilipin 2 (PLIN2), adipofilin (adipose differentiation-related protein), člen skupiny proteinů PAT
AGPAT2 1-acylglycerol-3-fosfát-O-acyltransferáza 2
ATGL adipocytární triglyceridová lipáza
AZGP1 zink-alfa-2-glykoprotein 1
BSCL2 seipin (Berardinelli-Seip congenital lipodystrophy)
CAV1 kaveolin 1 (membránový protein)
CIDE skupina proteinů podporujících buněčnou smrt a fragmentaci DNA v savčích buňkách (cell death-inducing DFF45-like effector)
CIDEA, CIDEB, CIDEC (Fsp27) proteiny ze skupiny CIDE
CSC rakovinné kmenové buňky
DGAT1 acyl-CoA:diacylglycerol acyltransferáza 1
DGAT2 acyl-CoA:diacylglycerol acyltransferáza 2
FIT1/FITM1 transmembránový protein vyvolávající ukládání tuku (fat storage-inducing transmembrane protein 1)
FIT2/FITM2 transmembránový protein vyvolávající ukládání tuku (fat storage-inducing transmembrane protein 2)
Fsp27 fat-specific protein 27 (CIDEC)
HCV virus hepatitidy C
HSL hormon-senzitivní lipáza
IL-1, IL-6 interleukin 1, interleukin 6
LIPC (HTGL) jaterní lipáza
LPIN1 lipin 1
LSD2 protein lipid storage droplet 2
LYPLAL1 lysofosfolipáza 1
lysoPC lysofosfatidylcholin
lysoPE lysofosfatidylethanolamin
MCP1 macrophage cationic peptide 1
OXPAT perilipin 5 (PLIN5), člen skupiny proteinů PAT
PC fosfatidylcholin
PE fosfatidylethanolamin
PI fosfatidylinositol
PLIN1 perilipin 1, člen skupiny proteinů PAT
PNPLA adiponutrin (patatin-like phospholipase domain-containing protein)
PPAR-γ gamma receptory aktivované peroxisomovými proliferátory
REEP1 (SPG31) receptor accessory protein A
S3-12 perilipin 4 (PLIN4) člen skupiny PAT proteinů
SNAP23 synaptosomal-associated protein
SNARE skupina proteinů (small ILF3/NF90-associated RNA E)
SPG20 gen kódující spartin, spastic paraplegia 20
TIP47 perilipin 3 (PLIN3), tail-interacting protein, člen skupiny PAT proteinů
TNF-α tumor nekrotizující faktor alfa
VAMP4 vesicle-associated membrane protein 4
Adresa pro korespondenci
MUDr. Miroslava Čedíková, Ph.D.
Ústav fyziologie LF UK
alej Svobody 76, 323 00 Plzeň
Tel.: 377 593 354
e-mail: miroslava.cedikova@lfp.cuni.cz
Zdroje
- Fujimoto T, Parton RG. Not just fat: the structure and function of the lipid droplet. Cold Spring Harb Perspect Biol 2011; 3(3), pii: a004838.
- Carr RM, Ahima RS. Pathophysiology of lipid droplet proteins in liver diseases. Exp Cell Res 2016; 340 : 187–19
- Wang H, Lei M, Hsia R et al. Analysis of lipid droplets in cardiac muscle. Methods Cell Biol 2013; 116 : 129–149.
- Bosma M. Lipid droplet dynamics in skeletal muscle. Exp Cell Res 2016; 340 : 180–186.
- Puche JE, Saiman Y, Friedman SL. Hepatic stellate cells and liver fibrosis. Compr Physiol 2013; 3 : 1473–1492.
- Tachibana T, Kusakabe KT, Osaki S et al. Histocytological specificities of adrenal cortex in the New World Monkeys, Aotus lemurinus and Saimiri boliviensis. J Vet Med Sci 2016; 78 : 161–165.
- Shen W-J, Azhar S, Kraemer FB. Lipid droplets and steroidogenic cells. Exp Cell Res 2016; 340 : 209–214.
- Niswender GD. Molecular control of luteal secretion of progesterone. Reprod Camb Engl 2002; 123 : 333–339.
- Mansfield J, Moger J, Green E, et al. Chemically specific imaging and in situ chemical analysis of articular cartilage with stimulated Raman scattering. J Biophotonics 2013; 6 : 803–814.
- Schneider MR, Zhang S, Li P. Lipid droplets and associated proteins in the skin: Basic research and clinical perspectives. Arch Dermatol Res 2016; 308(1): 1–6.
- Russell TD, Schaack J, Orlicky DJ et al. Adipophilin regulates maturation of cytoplasmic lipid droplets and alveolae in differentiating mammary glands. J Cell Sci 2011; 124 : 3247–3253.
- Welte MA. Fat on the move: intracellular motion of lipid droplets. Biochem Soc Trans 2009; 37 : 991–996.
- Welte MA. Expanding roles for lipid droplets. Curr Biol 2015; 25: R470–481.
- Castranova V, Rabovsky J, Tucker JH et al. The alveolar type II epithelial cell: a multifunctional pneumocyte. Toxicol Appl Pharmacol 1988; 93 : 472–483.
- Beilstein F, Carrière V, Leturque A et al. Characteristics and functions of lipid droplets and associated proteins in enterocytes. Exp Cell Res 2016; 340 : 172–179.
- Čedíková M, Kripnerová M, Dvořáková J et al. Mitochondria in white, brown, and beige adipocytes. Stem Cells Int 2016 : 6067349.
- Wang CW. Lipid droplets, lipophagy, and beyond. Biochim Biophys Acta 2016; 1861 : 793–805.
- Murphy S, Martin S, Parton RG. Lipid droplet-organelle interactions; sharing the fats. Biochim Biophys Acta 2009; 1791(6): 441–447.
- Tauchi-Sato K, Ozeki S, Houjou T et al. The surface of lipid droplets is a phospholipid monolayer with a unique Fatty Acid composition. J Biol Chem 2002; 277 : 44507–44512.
- Walther TC, Farese RV. The life of lipid droplets. Biochim Biophys Acta 2009; 1791 : 459–466.
- Penno A, Hackenbroich G, Thiele C. Phospholipids and lipid droplets. Biochim Biophys Acta 2013; 1831(3): 589–594.
- Fujimoto T, Ohsaki Y, Cheng J et al. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol 2008; 130 : 263–279.
- Wilfling F, Haas JT, Walther TC et al. Lipid droplet biogenesis. Curr Opin Cell Biol 2014; 29 : 39–45.
- Robenek H, Lorkowski S, Schnoor M, et al. Spatial integration of TIP47 and adipophilin in macrophage lipid bodies. J Biol Chem 2005; 280 : 5789–5794.
- Czabany T, Wagner A, Zweytick D et al. Structural and biochemical properties of lipid particles from the yeast Saccharomyces cerevisiae. J Biol Chem 2008; 283 : 17065–17074.
- Wilfling F, Haas JT, Walther TC et al. Lipid droplet biogenesis. Curr Opin Cell Biol 2014; 29 : 39–45.
- Chen X, Goodman JM. The collaborative work of droplet assembly. Biochim Biophys Acta 2017; 1862 : 1205–1211.
- Hashemi HF, Goodman JM. The life cycle of lipid droplets. Curr Opin Cell Biol 2015; 33 : 119–124.
- Gross DA, Zhan C, Silver DL. Direct binding of triglyceride to fat storage-inducing transmembrane proteins 1 and 2 is important for lipid droplet formation. Proc Natl Acad Sci U S A 2011; 108 : 19581–19586.
- Schuldiner M, Bohnert M. A different kind of love – lipid droplet contact sites. Biochim Biophys Acta 2017; 1862 : 1188–1196.
- Boschi F, Rizzatti V, Zamboni M et al. Models of lipid droplets growth and fission in adipocyte cells. Exp Cell Res 2015; 336 : 253–262.
- Boström P, Andersson L, Rutberg M et al. SNARE proteins mediate fusion between cytosolic lipid droplets and are implicated in insulin sensitivity. Nat Cell Biol 2007; 9 : 1286–1293.
- Farese RV, Walther TC. Lipid droplets finally get a little R-E-S-P-E-C-T. Cell 2009; 139 : 855–860.
- Garcia EJ, Vevea JD, Pon LA. Lipid droplet autophagy during energy mobilization, lipid homeostasis and protein quality control. Front Biosci Landmark Ed 2018; 23 : 1552–1563.
- Bickel PE, Tansey JT, Welte MA. PAT proteins, an ancient family of lipid droplet proteins that regulate cellular lipid stores. Biochim Biophys Acta 2009; 1791 : 419–440.
- Barbosa AD, Savage DB, Siniossoglou S. Lipid droplet-organelle interactions: emerging roles in lipid metabolism. Curr Opin Cell Biol 2015; 35 : 91–97.
- Barbosa AD, Siniossoglou S. Function of lipid droplet-organelle interactions in lipid homeostasis. Biochim Biophys Acta 2017; 1864 : 1459–1468.
- Morak M, Schmidinger H, Riesenhuber G et al. Adipose triglyceride lipase (ATGL) and hormone-sensitive lipase (HSL) deficiencies affect expression of lipolytic activities in mouse adipose tissues. Mol Cell Proteomics MCP 2012; 11 : 1777–1789.
- Murphy S, Martin S, Parton RG. Lipid droplet-organelle interactions; sharing the fats. Biochim Biophys Acta 2009; 1791(6): 441–447.
- Roingeard P, Melo RCN. Lipid droplet hijacking by intracellular pathogens. Cell Microbiol 2017; 19(1), doi: 10.1111/cmi.12688.
- Müllerová D, Pešta M, Dvořáková J et al. Polychlorinated biphenyl 153 in lipid medium modulates differentiation of human adipocytes. Physiol Res 2017; 66 : 653–662.
- Bozza PT, Viola JPB. Lipid droplets in inflammation and cancer. Prostaglandins Leukot Essent Fatty Acids 2010; 82 : 243–250.
- Krahmer N, Farese RV, Walther TC. Balancing the fat: lipid droplets and human disease. EMBO Mol Med 2013; 5(7): 973–983.
- Bizzari S, Hamzeh AR, Nair P et al. Novel SPG20 mutation in an extended family with Troyer syndrome. Metab Brain Dis 2017; 32(6): 2155–2159.
- Tirinato L, Liberale C, Di Franco S et al. Lipid droplets: a new player in colorectal cancer stem cells unveiled by spectroscopic imaging. Stem Cells Dayt Ohio 2015; 33 : 35–44.
- Abramczyk H, Surmacki J, Kopeć M, et al. The role of lipid droplets and adipocytes in cancer. Raman imaging of cell cultures: MCF10A, MCF7, and MDA-MB-231 compared to adipocytes in cancerous human breast tissue. The Analyst 2015; 140 : 2224–2235.
- Svačina S, Sucharda P, Stránská Z a kol. Perspektivy farmakoterapie obezity. Časopis lékařů českých 2014; 153 : 127–130.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Přerušovaný půst může mít významná zdravotní rizika
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Úvodem
- Pneumologie v současném kontextu
- Karcinom plic
- Idiopatická plicní fibróza: Nastal čas opět změnit doporučený postup diagnostiky a léčby?
- Léčba závislosti na tabáku jako standardní součást onkologické péče
- Alkohol z pohledu veřejného zdraví v ČR: fakta a souvislosti
- Vznik a vývoj tukové kapénky a její role ve zdraví a nemoci
- Aulus Cornelius Celsus a životospráva
- César Milstein (1927–2002)
- Encyklopedie zdravotnického humoru
- Kalendář akcí
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Karcinom plic
- Vznik a vývoj tukové kapénky a její role ve zdraví a nemoci
- Idiopatická plicní fibróza: Nastal čas opět změnit doporučený postup diagnostiky a léčby?
- Alkohol z pohledu veřejného zdraví v ČR: fakta a souvislosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



