-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Co je nového v léčbě chronického srdečního selhání?
New perspectives in the treatment of chronic heart failure
The most recent guidelines on heart failure of the European Society of Cardiology were published in 2021. These guidelines devide patients according to the ejection fraction of the left ventricle into the group with reduced, mildly reduced and preserved ejection fraction. The guidelines follow the recent evidence based medicine and clinical studies in their recommendations. A novel group of drugs aiming to reduce morbidity and mortality and to improve the quality of life in patients with reduced ejection frations are SGLT2 inhibitors – gliflozins. The guidelines of the American Society of Cardiology set the treatment by gliflozins regardless of ejection fracion. The guidelines point out the treatment of comorbidities like diabetes, iron deficiency or tumors. A complex approach of patients with heart failure including heart failure clinics is presented.
Keywords:
Ejection fraction – SGLT2 inhibitors – heart failure – guidelines
Autoři: Barbora Nussbaumerová
Působiště autorů: Centrum preventivní kardiologie, II. interní klinika LF a FN v Plzni, UK v Praze
Vyšlo v časopise: Vnitř Lék 2023; 69(2): 82-87
Kategorie: Hlavní téma
doi: https://doi.org/10.36290/vnl.2023.015Souhrn
V roce 2021 byla publikována zatím poslední odborná doporučení pro léčbu srdečního selhání Evropské kardiologické společnosti. Pacienti se srdečním selháním jsou děleni dle ejekční frakce do skupiny se sníženou, mírně sníženou a zachovalou ejekční frakcí. Na základě medicíny založené na důkazech se do odborných doporučení promítají recentní výsledky klinických studií. Novou převratnou lékovou skupinou indikovanou u pacientů se sníženou ejekční frakcí s cílem snížení morbidity a mortality a zlepšení kvality života jsou inhibitory SGLT2 – glifloziny. Doporučení Americké kardiologické společnosti vydaná r. 2022 uvádějí léčbu glifloziny již u všech fenotypů srdečního selhání nezávisle na ejekční frakci. Odborná doporučení kladou důraz na léčbu komorbidit, jako je diabetes, deficit železa nebo nádorová onemocnění. Prosazují komplexní péči o pacienty se srdečním selháním v ambulancích srdečního selhání.
Klíčová slova:
srdeční selhání – SGLT2 inhibitory – ejekční frakce – odborná doporučení
Úvod
Chronické srdeční selhání je klinický syndrom charakterizovaný typickými symptomy a známkami. Mortalita na srdeční selhání je vysoká a kvalita života pacientů není v mnoha případech dostatečná. Potěšující jsou nové a stále se vyvíjející možnosti farmakologické i nefarmakologické léčby. Poslední odborná doporučení pro diagnostiku a léčbu srdečního selhání byla vydána Evropskou kardiologickou společností (ESC) v r. 2021 a záhy byla komentována a přehledně shrnuta domácími autory (1, 2). Americká kardiologická společnost (ACC) vydala svá odborná doporučení r. 2022 (3). Cílem léčby chronického srdečního selhání je snížení úmrtnosti, nemocnosti vč. četnosti hospitalizací a zlepšení kvality života pacientů. Odborná doporučení vycházejí z nejnovějších poznatků medicíny založené na důkazech. Aktuální odborná doporučení akcentují nové možnosti farmakoterapie vč. nové lékové skupiny SGLT2 inhibitorů a léčby anémie/deficience železa u srdečního selhání. Nové koncepty pro chronické srdeční selhání v doporučeních ESC zahrnují změny hned v několika oblastech a jsou shrnuty v tabulce 1. Jednotlivým bodům se budeme blíže věnovat. Text článku vychází z textů odborných doporučení. Neklade si za cíl obsáhnout celou problematiku srdečního selhání, ale pokouší se vybrat nové a důležité informace. Článek obsahuje odkazy na recentní souhrnné publikace v češtině k rozšíření povědomí o popisované problematice.
Tab. 1. Nové koncepty léčby chronického srdečního selhání (dle (1)) 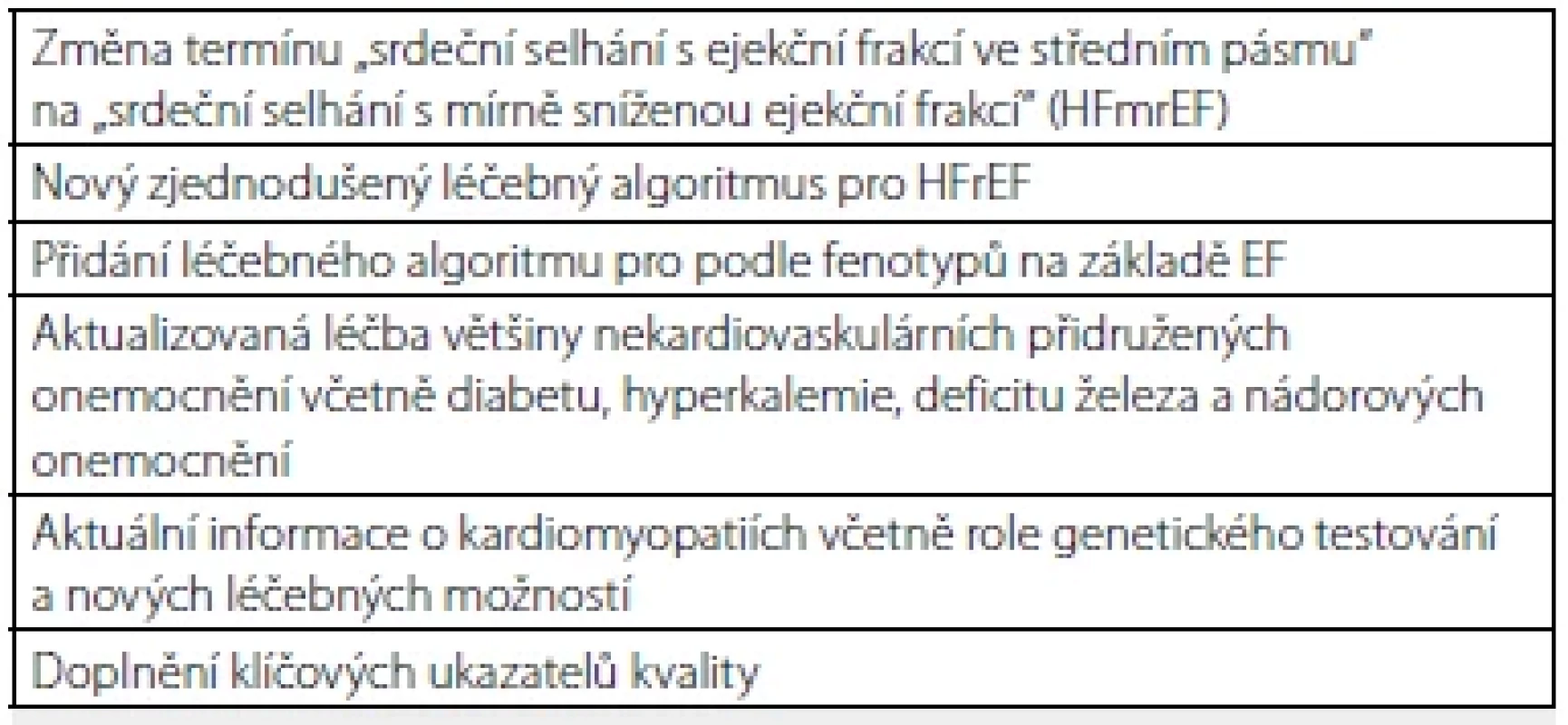
HFmrEF – srdeční selhání s ejekční frakcí ve středním pásmu (heart failure with mid-range ejection fraction), srdeční selhání s mírně sníženou ejekční frakcí (heart failure with mildly reduced ejection fraction); HFrEF – srdeční selhání se sníženou ejekční frakcí (heart failure with reduced ejection fraction) Terminologické změny a srdeční selhání
Terminologické změny se týkají upřesnění definice srdečního selhání v kategorii ejekční frakce levé komory „mrEF“. Již v minulých odborných doporučeních jsme si zvykli dělit pacienty s chronickým srdečním selháním dle hodnot ejekční frakce do tří skupin (1). Skupina s ejekční frakcí v rozmezí 41–49 % byla dříve charakterizována jako heterogenní a vyžadující další zkoumání. Nyní jsou do ní řazeni zejm. mladí muži, kteří mají ischemickou chorobu srdeční. Termín byl změněn ze „srdeční selhání s ejekční frakcí ve středním pásmu“ na „srdeční selhání s mírně sníženou ejekční frakcí“ (HFmrEF). Důvodem je, že v retrospektivně analyzovaných klinických studiích měli tito pacienti podobný prospěch z léčby jako pacienti s významným snížením ejekční frakce. Pacienti se sníženou ejekční frakcí (HFrEF) (heart failure with reduced ejection fraction) mají ejekční frakci levé komory významně sníženou na hodnotu ≤ 40 %. Pacienti se symptomy a známkami srdečního selhání, s průkazem strukturální a/nebo funkční srdeční abnormality a/nebo zvýšením hodnoty natriuretických peptidů a s ejekční frakcí levé komory ≥ 50 % jsou klasifikováni jako HFpEF (heart failure with preserved ejection fraction), srdeční selhání se zachovalou ejekční frakcí.
Nový zjednodušený léčebný algoritmus pro HFrEF
V porovnání s předchozími odbornými doporučeními je terapeutický algoritmus HFrEF značně zjednodušen (Graf 1). V prvním kroku farmakoterapie jsou indikovány léky, u nichž byl prokázán příznivý účinek na morbiditu a mortalitu a snížení závažnosti symptomů u pacientů s HFrEF. Měla by být snaha titrovat je do maximálních dávek, resp. dávek ověřených klinickými studiemi. Základem léčby je modulace systému renin‑angiotenzin‑aldosteron pomocí inhibitorů angiotenzin konvertujícího enzymu (ACEI) nebo inhibitorů angiotenzinových receptorů a neprilysinu (ARNI). U pacientů netolerujících ACEI je indikována léčba blokátory receptorů AT 1 pro angiotenzin II (ARB) – sartany. Dále jsou indikovány kardioselektivní betablokátory a antagonisté mineralokortikoidních receptorů (MRA). Zmíněné ARNI jsou indikovány u pacientů, jejichž symptomy srdečního selhání přetrvávají i při léčbě maximální tolerovanou/doporučenou dávkou ACEI/ARB (NYHA II – III). Pro úhradu léčby ARNI musí mít pacient nastavenu optimální léčbu HFrEF vč. ACEI/ ARB, betablokátoru a MRA, ev. mít dokumentovanou jejich intoleranci. Ejekční frakce levé komory musí být ≤ 35 % a eGFR > 30 ml/min/1,73 m2. ARNI se poprvé v léčbě HFrEF objevily v minulých odborných doporučeních a již si vydobyly pevné místo v terapii pacientů s HFrEF. Ve studii PARADIGM‑HF sakubitril‑valsartan (jediný zástupce ARNI) snižoval u nemocných s HFrEF primární cílový ukazatel celkovou mortalitu, mortalitu z kardiovaskulárních příčin a počty hospitalizací pro srdeční selhání statisticky vysoce významněji než zlatý standard léčby HFrEF – ACEI enalapril. Při převádění pacientů na léčbu ARNI je třeba dbát na vysazení léčby ACEI/ARB 36 hodin před podáním ARNI. Použití ARNI by mohlo vést i ke snížení nutnosti podávání kličkových diuretik. Kromě výše uvedených pozitivních vlastností ARNI snižují incidenci diabetes mellitus, který vyžaduje léčbu inzulinem, redukují pokles glomerulární filtrace a zlepšují symptomy a kvalitu života nemocných (4–6). Všechny tyto výše uvedené léky mají doporučení I založená na robustních datech (A, B). U pacientů se známkami/symptomy kongesce patří do léčby kličková diuretika (IC).
Graf 1. Algoritmus léčby srdečního selhání se sníženou ejekční frakcí (dle (1)) 
ACEI – inhibitory angiotenzin konvertujícího enzymu; ARNI – inhibitory angiotenzinových receptorů a neprilysinu; CRT-D – resynchronizace s defibrilátorem; CRT-P – resynchronizace s pacemakerem; EF LK – ejekční frakce levé komory; ICD – implantabilní kardioverter-defibrilátor; MRA – antagonisté mineralokortikoidních receptorů; SR – sinusový rytmus SGLT2 inhibitory v léčbě HFrEF
Novinkou ve farmakoterapii v nejnovějších odborných doporučeních je zavedení nové lékové skupiny SGLT2 inhibitorů (SGLT2i) mezi základní léky pro farmakoterapii HFrEF. Glifloziny blokují v ledvinách bílkovinu nazvanou sodíko‑glukózový transportér 2 (SGLT2). V průběhu filtrace krve v ledvinách SGLT2 odpovídá za zpětné vychytávání glukózy z moči do krevního oběhu. Zablokování SGLT2 pomocí gliflozinů působí zvýšené vylučování glukózy močí, a tudíž snižování hladiny glukózy v krvi. Do léčby HFrEF by dále měly být nově přidány SGLT2i dapagliflozin nebo empagliflozin, na základě nových klinických studií provedených s těmito léky. I když byly SGLT2i iniciálně považovány za léky snižující hladinu glykemie, byly postupně objeveny velmi komplexní a mnohočetné mechanismy jejich účinku, které přesahují koncept pouhého perorálního antidiabetika. Jejich účinek není vázán pouze na přítomnost diabetu. Ovlivněno je srdeční selhání nezávisle na ejekční frakci levé komory, ledviny, ale i ateroskleróza a dyslipidemie. Počáteční klinické studie, které vnímaly SGLT2i primárně jako antidiabetika a nebyly zaměřeny na srdeční selhání, zaznamenaly v sekundární prevenci aterosklerotických vaskulárních onemocnění (ASKVO) (EMPAREG – OUTCOME s empagliflozinem v porovnání s placebem) nebo i mezi pacienty v primární prevenci ASKVO s rizikovými faktory (CANVAS program s kanagliflozinem v porovnání s placebem a DECLARE–TIMI 58 s dapagliflozinem v porovnání s placebem) významný účinek SGLT2i i na srdeční selhání, což bylo potvrzeno i v následné metaanalýze těchto třech základních studií (7). V této metaanalýze zahrnující všechny tři základní studie byly provedeny analýzy skupin pacientů s ASKVO a zvlášť pacientů s rizikovými faktory. V obou skupinách došlo k významnému snížení hospitalizací pro srdeční selhání (o 29 %, resp. 36 %).
Tyto pozitivní a nadějné výsledky vedly k provedení klinických studií, které se zabývaly již přímo pacienty se srdečním selháním. Studie DAPA‑HF zahrnovala pacienty s HFrEF s/bez diabetu. U aktivně léčených pacientů došlo nejen ke snížení primárního složeného cíle (zhoršení srdečního selhání a úmrtí z kardiovaskulárních příčin) o 26 % a hospitalizací pro srdeční selhání o 30 %, ale také ke snížení úmrtí z kardiovaskulárních příčin o 18 % a úmrtí z jakýchkoli příčin o 17 %. Nebyl statisticky významný rozdíl mezi osobami s diabetem a bez něj (8). Podobné výsledky u kompozitního cíle (snížení o 25 %) a hospitalizací pro srdeční selhání (snížení o 24 %) ukázala i studie s empagliflozinem EMPEROR–Reduced, v níž byl u celkové mortality patrný trend ke snížení o 8 % (CI 0,77–1,10) a obdobně i ke snížení úmrtí z kardiovaskulárních příčin o 8 % (CI 0,75–1,12) (9, 10). Obě studie potvrdily obrovský význam SGLT2i v léčbě srdečního selhání a díky jejich výsledkům byly SGLT2i (dapa - a empagliflozin) zařazeny mezi základní farmakoterapii HFrEF v nových odborných doporučeních pro léčbu srdečního selhání (IA) (1, 2, 11).
Ostatní léky v léčbě HFrEF
Z ostatních léků by měl být zvážen blokátor kanálu If – ivabradin u symptomatických nemocných s ejekční frakcí ≤ 35 %, sinusovým rytmem a srdeční frekvencí nad 70/minutu (IIa B). Novinkou je solubilní stimulátor guanylát cyklázového receptoru – vericiguat, který může být zvážen u nemocných ve funkční třídě NYHA II–IV, kteří se klinicky horší i přes léčbu ACEI či ARNI (IIb B) na základě výsledků studie VICTORIA (12, 13). Je evidentní, že starší léky ustupují novým a doporučení jejich užití není akcentováno. Hydralazin a izosorbid dinitrát by měly být zváženy u černošských nemocných s ejekční frakcí < 35 % a/nebo < 45 % v kombinaci s dilatací levé komory ve funkční třídě NYHA III–IV (IIa B). Hydralazin a izosorbid dinitrát mohou být zvažovány u nemocných se symptomatickým HFrEF, kteří netolerují ACEI, ARNI či ARB (IIb B). Digoxin může být zvážen u symptomatických nemocných s HFrEF a sinusovým rytmem (IIb B).
Změny v doporučení pro přístrojovou terapii u HFrEF
Dle aktuálních odborných doporučení je vhodné zvážit implantaci implantabilního kardioverteru defibrilátoru (ICD) ke snížení rizika náhlé smrti a celkové mortality u pacientů se symptomatickým srdečním selháním (třída NYHA II–III) a EF LK ≤ 35 % i přes ≥ 3 měsíce trvající optimální farmakoterapii za předpokladu očekávaného přežití podstatně delšího než jeden rok v dobrém funkčním stavu. V prevenci náhlé smrti profitují zejm. mladší pacienti s ischemickou kardiomyopatií. V minulých odborných doporučeních bylo toto doporučení ve třídě I, ale pouze u pacientů s dilatační kardiomyopatií. Nová doporučení kladou lehce menší důraz na indikaci srdeční resynchronizační léčby – je vhodné ji zvážit (dříve doporučena) u symptomatických pacientů se srdečním selháním, sinusovým rytmem, šířkou komplexu QRS 130–149 ms, obrazem LBBB a EF LK ≤ 35 % i přes ≥ 3 měsíce trvající optimální farmakoterapii s cílem zmírnit symptomy a snížit morbiditu a mortalitu. Naopak vyšší třídu doporučení (IIa) dostává upgrade již implantovaného trvalého kardiostimulátoru na srdeční resynchronizační léčbu, pokud má pacient HFrEF s následným zhoršením srdečního selhání i přes optimální léčbu, pokud je významný podíl stimulace pravé komory.
Léčebný algoritmus HFmrEF
Skupina zahrnuje pacienty s ejekční frakcí 41–49 %, tzn. s mírným snížením systolické funkce levé komory. Doporučení uvádějí veškerou farmakoterapii s doporučením lze zvážit – IIb. Podávání ACEI/ARB, betablokátorů, MRA a ARNI lze zvážit ke snížení rizika hospitalizace pro srdeční selhání a rizika úmrtí.
Léčebný algoritmus HFpEF
U pacientů s HFpEF se doporučuje screening a léčba kardiovaskulárních i nekardiovaskulárních přidružených onemocnění, a tím doporučení v péči o ně končí, protože dostupné provedené studie s ACEI, ARB, MRA, digoxinem a ARNI neprokázaly snížení morbidity a mortality.
SGLT2 inhibitory v léčbě HFmrEF a HFpEF
V randomizované, placebem kontrolované studii III. fáze EMPEROR – Preserved bylo zahrnuto celkem 5 988 pacientů. V aktivní větvi byli léčeni 10 mg empagliflozinu jednou denně. Primární sledovaný parametr sledoval kompozit kardiovaskulární mortality a hospitalizace pro srdeční selhání. Zahrnuti byli dospělí nemocní s EF LK nad 40 % (tzn. pacienti s HFpEF a HFmrEF). Randomizováni byli pacienti se zvýšenou koncentrací NT–proBNP (stratifikované na základě přítomnosti fibrilace síní), se symptomy srdečního selhání třídy II–IV dle klasifikace NYHA a s přítomností strukturálních změn na srdci nebo hospitalizací v posledních 12 měsících. Během mediánu sledovaného období 26,2 měsíce vykázal empagliflozin 21% relativní snížení rizika primárního sledovaného parametru (13,8 vs. 17,1 %; HR = 0,79; 95% CI 0,69–0,90; p < 0,001), k zabránění jedné příhodě (NNT) bylo nutné léčit uspokojivých 31 nemocných. První a následující hospitalizace pro srdeční selhání byly v empagliflozinové větvi rovněž signifikantně méně časté (HR = 0,73). Tento účinek byl konzistentní bez ohledu na přítomnost diabetu a ve všech dalších sledovaných podskupinách rozdělených podle věku, pohlaví, rasy, přítomnosti fibrilace síní, výchozí EF LK, klasifikace NYHA nebo funkce ledvin nebo užívání MRA. Hlavním účinkem léčby empagliflozinem bylo snížení hospitalizací pro srdeční selhání. To má velký vliv na kvalitu života pacientů a u osob s HFpEF je takový lék ojedinělý (14).
Studie DELIVER byla radomizovaná, dvojitě zaslepená, globální studie provedená v 350 centrech v 20 zemích včetně České republiky. Zařazeni do ní byli pacienti starší 40 let se srdečním selháním s již strukturálním srdečním onemocněním (hypertrofie levé komory nebo dilatace levé síně), NYHA II–IV, s elevací natriuretických peptidů s hraniční hodnotou v závislosti na srdečním rytmu. EF LK vstupně musela dosahovat alespoň 40 %, připouštělo se ale historické snížení pod tuto hodnotu. Celkem 6 263 pacientů dostávalo buď dapagliflozin v dávce 10 mg denně, nebo placebo, medián sledování dosáhl 2,3 roku. Randomizace byla vyvážená, zařazená populace byla velmi reprezentativní pro nemocné se srdečním selháním – průměrný věk dosáhl 71 let, ženy tvořily asi 44 % souboru, průměrná vstupní EF LK byla 54 % a EF LK pod 60 % se týkala 70 % souboru. Asi tři čtvrtiny pacientů spadaly do NYHA třídy II. Hospitalizaci pro srdeční selhání už mělo za sebou 40 % souboru, populace byla také značně předléčená. Tři čtvrtiny užívaly kličková diuretika a 40 % MRA. Kompozitní ukazatel první příhody, zahrnující kardiovaskulární úmrtí nebo zhoršení srdečního selhání vyžadující hospitalizaci nebo akutní návštěvu zdravotnického zařízení (primární sledovaný parametr), byl signifikantně superiorní v aktivní větvi (HR 0,82; 95% CI 0,73–0,92; p = 0,0008). K zabránění jedné příhodě (NNT) bylo třeba léčit velmi uspokojivých 32 nemocných. Redukovány byly zejména příhody zhoršení srdečního selhání (HR 0,79; 95% CI 0,69–0,91; p = 0,001). Snížení kardiovaskulární mortality statisticky signifikantní sice nebylo (HR 0,88; 95% CI 0,74–1,05; p = 0,17), studie ale nebyla navržena k prokázání izolovaného mortalitního benefitu. Výsledky byly konzistentní pro všechny prespecifikované podskupiny. Analogických výsledků bylo dosaženo pro sekundární sledované parametry, včetně kompozitního ukazatele kardiovaskulárního úmrtí a všech zhoršení srdečního selhání (RR 0,77; 95% CI 0,67–0,89; p = 0,0003). Byla zlepšena i kvalita života pacientů. Nežádoucí účinky se vyskytly v aktivní a placebové větvi srovnatelně (15).
Studie DELIVER a EMPEROR–Preserved začlenily velmi podobné a pro srdeční selhání reprezentativní pacientské populace. Byla provedena analýza 12 251 pacientů z těchto studií. Hlavním závěrem této analýzy je, že obě látky poskytují srovnatelný a robustní vliv na primární cílový kompozitní parametr kardiovaskulární mortality a zhoršení srdečního selhání (HR 0,80; 95% CI 0,73–0,87; p < 0,0001). Dle sdružených dat je zřejmé, že účinek je vyvážený na obě jednotlivé komponenty a nejedná se pouze o snížení počtu hospitalizací pro srdeční selhání. To je velmi důležité, protože izolované závěry obou studií vliv na snížení kardiovaskulární mortality signifikantně neprokázaly. Nedisponovaly pro to ale dostatečně silným uspořádáním. Výsledky byly výjimečně konzistentní napříč všemi podskupinami včetně stratifikace dle EF LK, tíže srdečního selhání nebo další medikace. Tato část publikace potvrdila rovněž pozitivní účinek na skóre kvality života. K podobným výsledkům došla také sesterská metaanalýza veškeré dostupné evidence v léčbě srdečního selhání pomocí SGLT2i s daty nejenom ze studí EMPEROR–Preserved a DELIVER, ale také ze studií EMPEROR–Reduced, DAPAHF a SOLOISTWHF. I ta demonstrovala snížení událostí primárního sledovaného parametru o 33 % procent (HR 0,77; 95% CI 0,72–0,82; p < 0,0001) a patrné snížení kardiovaskulární a celkové mortality o 13 %, respektive 8 %. Veškerá dostupná data tak ukazují, že SGLT2i jsou skutečně vhodné u všech pacientů se srdečním selháním, bez ohledu na EF LK, fenotyp nebo místo zahájení terapie (16).
Výsledky studií s glifloziny u HFmrEF a HFpEF se v obdobných doporučeních ESH ještě nestačily odrazit. Nicméně doporučení pro léčbu srdečního selhání ACC již uvádějí léčbu SGLT2i u HFpEF/HFmrEF v třídě doporučení IIa (3). V době vzniku toho článku ještě nebyla známa přesná indikace a podmínky úhrady SGLT2i u této skupiny pacientů, ale je jasné, že tato událost se blíží.
Nekardiovaskulární přidružená onemocnění – diabetes
Vzhledem k důkazům z výše uvedených klinických studií jsou SGLT2i doporučeny u pacientů s diabetes mellitus 2. typu a zvýšeným kardiovaskulárním rizikem ke snížení hospitalizací pro srdeční selhání, ke snížení významných kardiovaskulárních komplikací. Jsou doporučeny u selhání ledvin a ke snížení úmrtí z kardiovaskulárních příčin (IA). Empagliflozin je vhodné zvážit u pacientů s diabetes mellitus 2. typu s cílem zabránit nástupu srdečního selhání nebo jej oddálit a prodloužit život (IIa). Expertní konsenzy popisují praktické aspekty spolupráce odborníků a terapie nejen SGLT2i u pacientů s diabetem a současně HFrEF nebo selháním ledvin (17, 18).
Nekardiovaskulární přidružená onemocnění – deficience železa a anémie
Deficience železa je u pacientů s chronickým srdečním selháním častá a přibývá údajů o tom, že tato komorbidita přispívá k symptomům, snížené kvalitě života a vyššímu riziku hospitalizace, a to nezávisle na stupni anémie (19). Deficit železa se vyskytuje u pacientů s chronickým srdečním selháním nezávisle na anémii až u 55 % nemocných, v případě akutního srdečního selhání včetně akutní dekompenzace chronického srdečního selhání až u 80 % pacientů. U všech nemocných s chronickým srdečním selháním je doporučeno pravidelně vyhledávat anémii a deficit železa a kontrolovat krevní obraz, koncentraci feritinu v séru a saturaci transferinu (IA). Pacienti s deficitem železa mají ale často sníženou schopnost železo vstřebat z perorálních preparátů. V klinických studiích FAIR–HF a CONFIRM–HF bylo prokázáno, že korekce deficitu železa u pacientů se stabilním chronickým srdečním selháním zlepšuje kvalitu života a toleranci zátěže (20, 21). Nedávno zveřejněná studie AFFIRM–AHF zdokumentovala snížení počtu rehospitalizací u pacientů s akutně dekompenzovaným srdečním selháním (22). Na základě těchto údajů nyní odborná doporučení uvádějí, že nitrožilní náhradu železa karboxymaltózou železa je třeba zvážit u symptomatických nemocných s EF LK < 45 % a deficiencí železa definovanou jako koncentrace feritinu v séru < 100 ng/ml nebo koncentrace feritinu v séru 100–299 ng/ml se saturací transferinu < 20 %, k úlevě symptomů chronického srdečního selhání, zlepšení zátěžové kapacity a kvality života (IIa). Současně je třeba toto zvážit u symptomatických nemocných čerstvě hospitalizovaných pro srdeční selhání s EF LK < 50 % s výše definovanou deficiencí železa, ke snížení rizika hospitalizací pro chronické srdeční selhání (IIa). Přítomnost anémie není podmínkou. Přípravky na bázi erytropoetinu nejsou doporučeny pro absenci klinických dat. Blíže je tato neprávem opomíjená problematika rozebrána v expertním konsenzu (23).
Srdeční selhání a nádorová onemocnění
Mnohé léky užívané k terapii nádorů mají zvýšené riziko kardiotoxicity. Patří mezi ně zejm. skupina antracyklinů užívaná v terapii nádorů prsu, lymfomů, akutních leukemií a sarkomů, HER2 (humánní epidermální receptor 2) cílená léčba při terapii citlivých tumorů prsu a gastrointestinálního traktu, androgen‑deprivační léčba a mnohé další. Proto je doporučeno, aby pacienti s nádorovým onemocněním a se zvýšeným rizikem kardiotoxicity (s anamnézou nebo rizikovými faktory kardiovaskulárního onemocnění, plánovanou nebo předchozí expozicí kardiotoxickým látkám) podstoupili kardiovaskulární zhodnocení před plánovanou protinádorovou terapií, preferenčně kardiologem se zkušenostmi/zájmem o kardioonkologii (I). U pacientů bez zmíněných rizikových faktorů by toto zhodnocení mělo být zváženo (IIa). Pokud se u pacientů během antracyklinové chemoterapie rozvine systolická dysfunkce levé komory (definovaná jako snížení EF LK o ≥ 10 %, a to do hodnoty < 50 %), měla by být zvážena léčba ACEI a betablokátorem (preferenčně carvedilolem) (IIa).
Aktuální informace o kardiomyopatiích včetně role genetického testování a nových léčebných možností
Kardiomyopatie jsou heterogenní skupinou onemocnění, která mohou být vrozená (geneticky podmíněná) a/nebo získaná. Jde o jednu z hlavních příčin srdečního selhání. Odhadovaná prevalence v obecné populaci je 1 : 250–500 u dilatační kardiomyopatie (DKMP), 1 : 500–5 000 u hypertrofické kardiomyopatie (HKMP) a 1 : 1 000–5 000 u arytmogenní kardiomyopatie (AKMP). Příčinami rozvoje kardiomyopatií mohou být patogenní mutace, vliv toxinů, autoimunitních procesů, střádavá a infiltrativní onemocnění, infekce či tachyarytmie. Základem diagnostiky jsou vedle klinického vyšetření také laboratorní vyšetření a především zobrazovací metody, významnou roli hraje genetická diagnostika, v řadě případů využíváme endomyokardiální biopsii. V diagnostice postižení myokardu jako příčiny srdečního selhání je stále častěji jako diagnostická metoda doporučována magnetická rezonance srdce (CMR). CMR se doporučuje pro charakterizaci myokardu při podezření na infiltrativní onemocnění, Fabryho chorobu, zánětlivá onemocnění (myokarditidu), non‑kompaktní levou komoru, amyloidózu, sarkoidózu, přetížení železem/hemochromatózu (IC), ale i arytmogenní kardiomyopatii. CMR s hodnocením pozdního sycení gadoliniem (LGE) by mělo být zvažováno pro rozlišení mezi ischemickým a neischemickým poškozením myokardu u nemocných s dilatační kardiomyopatií (IIaC).
Odborná doporučení přinášejí nový pohled na kardiomyopatie, tzn. není již dostačující léčba dle obecných principů léčby srdečního selhání, ale jsou zde možnosti genetického testování a v některých případech i specifické léčby. Je snaha o zachycení preklinických forem a časné poskytnutí specifické léčby i jejich nositelům. Týká se to zejm. kardiomyopatie dilatační, hypokinetické nedilatační kardiomyopatie a hypertrofické kardiomyopatie. Rizikoví pacienti jsou indikováni k zajištění ICD v prevenci náhlé srdeční smrti, může být provedena alkoholová ablace hypertrofické mezikomorové přepážky nebo podána specifická léčba (např. mevacamten – specifický inhibitor myosinu u HKMP nebo substituce alfa‑galaktosidázy A u Fabryho nemoci). Odborná doporučení se věnují poddiagnostikované příčině srdečního selhání, srdeční amyloidóze. Nejčastější formu srdeční amyloidózy představuje amyloidóza z lehkých řetězců imunoglobulinů (AL) a transtyretinová (ATTR) amyloidóza. Více než 90 % případů ATTR představuje tzv. wild‑type forma (wtATTR) a méně než v 10 % případů se jedná o hereditární neboli variantní formu tohoto onemocnění (hATTR). Věk nad 65 let, projevy srdečního selhání v přítomnosti hypertrofie levé komory s diastolickou tloušťkou stěny > 12 mm měřené echokardiograficky nás vedou k suspekci na srdeční amyloidózu. Na srdeční amyloidózu bychom měli myslet u pacientů s extrakradiálními projevy (rodinná anamnéza, renální insuficience s proteinurií, oboustranný syndrom karpálního tunelu, polyneuropatie, vegetativní dystonie…) a kardiálními projevy, jako je hypotenze u předešlé hypertenze, pseudoinfarktové změny, nízká voltáž na EKG v přítomnosti hypertrofie myokardu a typické echokardiografické nálezy. V diagnostice využíváme stanovení volných lehkých řetězců a scintigrafii myokardu zaměřenou na detekci amyloidózy, ev. CMR. V případě ATTR amyloidózy jsou k dispozici léčebné možnosti. Léčba tafamidisem se doporučuje u pacientů s geneticky prokázanou hereditární formou srdeční ATTR amyloidózy ve třídě NYHA I nebo II ke snížení symptomů, hospitalizací z kardiovaskulárních příčin a mortality. Podat tafamidis se doporučuje i u pacientů s „wild‑type“ formou srdeční ATTR amyloidózy ve třídě NYHA I nebo II ke snížení symptomů, hospitalizací z kardiovaskulárních příčin a mortality.
Komplexní péče o pacienty se srdečním selháním
Srdeční selhání je komplexní syndrom s mnoha klinickými, psychologickými a dalšími souvislostmi. Vzhledem ke komplexnosti problematiky srdečního selhání se doporučuje zařadit pacienty se srdečním selháním do programu multidisciplinární péče s cílem snížit riziko hospitalizace pro srdeční selhání i mortalitu. Za tímto účelem je doporučeno budovat a v současné době fungují i vznikají ambulance nebo jednotky srdečního selhání. Zaměření programu péče o pacienty se srdečním selháním by mělo být flexibilní a mělo by zahrnovat prevenci progrese onemocnění, kontrolu příznaků a možnost udržení pacientů v jejich preferovaném místě péče až do konečného stadia srdečního selhání. K vedení ambulance srdečního selhání je třeba personální obsazení kompetentními a odborně vzdělanými pracovníky a podpora zapojení pacientů/pečovatelů do pochopení a vedení léčby jejich stavu. Odborná doporučení akcentují možnost snadného přístupu ke zdravotní péči, s cílem předcházet dekompenzacím, hospitalizacím a zvládat je. Léčba pacientů se srdečním selháním by měla být optimalizovaná s důrazem na změny životního stylu, farmakologické možnosti a přístrojovou léčbu. Pacienti by měli být edukováni a měli by pochopit podstatu svého onemocnění srdečním selháním. Měli by mít kromě možnosti ambulantních návštěv i možnost telefonických konzultací, ev. telemonitoringu, např. k domácí úpravě farmakoterapie, zejm. titrace dávky diuretika (24). Rozebrána je i problematika mechanických srdečních podpor u pacientů s nejtěžší formou srdečního selhání (25).
Závěr
Počet pacientů se srdečním selháním se neustále zvyšuje. Srdeční selhání je komplexní syndrom vyžadující komplexní péči o pacienty. Prognóza srdečního selhání není dobrá. V současné době přicházejí nové terapeutické možnosti, ať farmakologické, nebo přístrojové, které mají potenciál zlepšit kvalitu života postižených pacientů a prodloužit jejich kvalitnější život.
MUDr. Barbora Nussbaumerová, Ph.D.
Centrum preventivní kardiologie, II. interní klinika LF a FN v Plzni, UK v Praze
nussbaumerova@fnplzen.cz
Cit. zkr: Vnitř Lék. 2023;69(2):82-87Článek přijat redakcí: 30. 1. 2023
Článek přijat po recenzích: 28. 2. 2023
Zdroje
1. McDonagh TA, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 doi: 10.1093/eurheartj/ehab368.
2. Špinar J, Špinarová L, Vítovec J. Co internistům přinášejí nová doporučení ESC pro léčbu srdečního selhání 2021? Vnitř Lék. 2022;68(2):104-110.
3. Heidenreich PA, Bozkurt B, Aguilar D, el al. 2022 AHA/ACC/HFSA Guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022;79 : 1757-1780.
4. McMurray JJ, Packer M, Desai AS, et al. PARADIGM‑HF Investigators and Committees. Angiotensin‑neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014;371 : 993-1004.
5. Seferovic JP, Claggett B, Seidelmann SB, et al. Effect of sacubitril/valsartan versus enalapril on glycaemic control in patients with heart failure and diabetes: a post‑hoc analysis from the PARADIGM‑HF trial. Lancet Diabetes Endocrinol. 2017;5 : 333-340.
6. Damman K, Gori M, Claggett B, et al. Renal effects and associated outcomes during angiotensin‑neprilysin inhibition in heart failure. JACC Heart Fail 2018;6 : 489-498.
7. Zelniker TA, Wiviott SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta‑analysis of cardiovascular outcome trials. Lancet 2019;393(10166):31-39.
8. McMurray JJV, Solomon SD, Inzucchi SE, et al. [DAPA‑HF Trial Committees and Investigators]. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019;381(21):1995-2008.
9. Packer M, Anker SD, Butler J, et al. [EMPEROR‑Reduced Trial Investigators]. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413 – 1424.
10. Zannad F, Ferreira JP, Pocock SJ, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta‑analysis of the EMPEROR‑Reduced and DAPA‑HF trials. Lancet. 2020;396(10254):819-829.
11. Prázný M. SGLT-2 inhibitory a jejich uplatnění v praxi – update 2022. Vnitř Lék. 2022;68(2):96-103.
12. Armstrong PW, Pieske B, Anstrom J, et al. Vericiguat in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2020;382 : 1883-1893. DOI: 10.1056/NEJMoa1915928.
13. Špinar J, Špinarová L, Vítovec J. Vericiguat u nemocných se srdečním selháním a sníženou ejekčí frakcí – studie VICTORIA. Vnitř Lék. 2021;67(3):180-182.
14. Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med 2021;385 : 1451-1461 DOI: 10.1056/NEJMoa2107038.
15. Scott D. Solomon SD, McMurray JVV, Claggett B, el al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction N Engl J Med. 2022;387 : 1089-1098. DOI: 10.1056/NEJMoa2206286.
16. Vaduganathan M, Docherty KF, Claggett FL, et al. SGLT-2 inhibitors in patients with heart failure: a comprehensive meta‑analysis of five randomised controlled trials. Lancet. 2022;400 : 757-767. Available from: https://doi.org/10.1016/S0140-6736(22)01429-5.
17. Haluzík M, Kubíčková M, Veselý J, el al. Expertní konsenzus k praktickým aspektům spolupráce kardiologa a diabetologa v péči o pacienty s chronickým srdečním selháním s redukovanou ejekční frakcí. Vnitř Lék. 2021;67(7):404-410.
18. Viklický O, Ryšavá R, Tesař V, el al. Expertní stanovisko ke spolupráci diabetologů a internistů s nefrology v péči o nemocné s chronickým onemocněním ledvin. Vnitř Lek. 2022;68(7):426-431.
19. van der Meer P, et al. Mitochondrial Function, Skeletal Muscle Metabolism, and Iron Deficiency in Heart Failure. Circulation. 2019;139(21):2399-2402.
20. Anker SD, et al. FAIRHF Trial: Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med. 2009;361(25):2436-2448.
21. Ponikowski P, et al. CONFIRMHF Trial: Beneficial effects of longterm intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J. 2015;36(11):657-668.
22. Ponikowski P, et al. AFFIRMAHF Trial: Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, doubleblind, randomised, controlled trial. Lancet. 2020;396(10266):1895-1904.
23. Melenovský V, Táborský M, Linhart A, et al. Expertní konsenzus k významu deficitu železa a možnosti jeho korekce u pacientů se srdečním selháním. Vnitř Lék. 2021;67(8):495-497.
24. Lazárová M, Hlavinka A, Šulc P, et al. Využití telemedicíny u pacientů se srdečním selháním. Vnitř Lék. 2022;68(3):154-158.
25. Pavlů L, Vícha M, Jelínek J, et al. Dlouhodobá mechanická srdeční podpora v terapii chronického srdečního selhání – reálná praxe. Vnitř Lék. 2021;67(8):E3-E6.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Hlavní téma – kardiologieČlánek Novinky v imunologii
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Dopady nekontrolované hypertenze na CNS
- Dávkování základní farmakoterapie a jeho vliv na prognózu pacientů hospitalizovaných pro srdeční selhání
- Možnosti léčby bolesti u osteoartrózy
- Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
- Novinky v imunologii
- Hlavní téma – kardiologie
- Kam kráčí preventivní kardiologie?
- Co je nového v léčbě chronického srdečního selhání?
- Novinky v diagnostice a léčbě kardiomyopatií
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Novinky v diagnostice a léčbě kardiomyopatií
- Co je nového v léčbě chronického srdečního selhání?
- Novinky v imunologii
- Supresní terapie levothyroxinem v léčbě karcinomu štítné žlázy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



