-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPolymyalgia rheumatica
Polymyalgia rheumatica
Polymyalgia rheumatica is the most frequent inflammatory disease of people over 50 years of age. It mainly affects the Caucasian race and roughly 2–3 times as many women. From the viewpoint of etiology, polymyalgia rheumatica is a complex disease. Involved in its origin is genetic predisposition, factors of age and outer environment. 16–21 % of patients with polymyalgia rheumatica may at the same time have symptoms of giant cell arteritis. Diagnosis is made primarily on the basis of clinical symptoms and it is supported by the presence of laboratory signs of inflammation. There is no specific diagnostic test available for diagnosing polymyalgia rheumatica. In recent time modern imaging devices, e.g. ultrasonography or positron emission tomography, can be used in diagnosing the disease. In the past a number of diagnostic and classification criteria were established which may be used in diagnosing of polymyalgia rheumatica in general practice. The differential diagnostics of the disease is extensive. Before the treatment commencement it is necessary to rule out the presence of another disease with manifestations simulating polymyalgia rheumatica. The treatment strategy should draw on the current EULAR/ACR Recommendations for the treatment of polymyalgia rheumatica issued in 2015.
Key words:
polymyalgia rheumatica – positron emission tomography – prognosis – treatment – ultrasonography
Autoři: Petr Němec 1; Andrea Šprláková-Puková 2; Zdeněk Řehák 3
Působiště autorů: Revmatologická ambulance II. interní kliniky LF MU a FN u sv. Anny Brno 1; Klinika radiologie a nukleární medicíny LF MU a FN Brno, pracoviště Bohunice 2; Oddělení nukleární medicíny Masarykova onkologického ústavu, Brno 3
Vyšlo v časopise: Vnitř Lék 2018; 64(2): 173-183
Kategorie: Přehledné referáty
Souhrn
Polymyalgia rheumatica je nejčastějším zánětlivým onemocněním osob starších 50 let. Postihuje zejména kavkazskou rasu a zhruba 2–3krát častěji ženy. Z hlediska etiologie je polymyalgia rheumatica komplexním onemocněním. Na jeho vzniku se podílí genetická predispozice, faktory věku a zevního prostředí. 16–21 % pacientů s polymyalgia rheumatica může mít současně příznaky obrovskobuněčné arteriitidy. Diagnóza se stanovuje primárně na základě klinických symptomů a je podpořena přítomností laboratorních známek zánětu. Pro diagnostiku revmatické polymyalgie není k dispozici žádný specifický diagnostický test. V poslední době lze k diagnostice onemocnění využít moderní zobrazovací techniky, např. ultrasonografii nebo pozitronovou emisní tomografii. V minulosti byla vytvořena řada diagnostických a klasifikačních kritérií, která mohou být použita pro stanovení diagnózy polymyalgia rheumatica v běžné praxi. Diferenciální diagnostika onemocnění je rozsáhlá. Před zahájením léčby je nutné vyloučit přítomnost jiného onemocnění s projevy napodobujícími revmatickou polymyalgii. Strategie léčby by měla vycházet z aktuálních Doporučení EULAR/ACR k léčbě polymyalgia rheumatica z roku 2015.
Klíčová slova:
léčba – polymyalgia rheumatica – pozitronová emisní tomografie – prognóza – ultrasonografieÚvod
Polymyalgia rheumatica (PMR) je nejčastějším zánětlivým onemocněním osob starších 50 let, ale vrchol jejího výskytu je ve věku 70–79 roků, přičemž 2–3krát častěji postihuje ženy [1]. PMR se objevuje převážně u příslušníků kavkazské rasy, naopak je vzácná u příslušníků černé rasy. Nízká incidence tohoto onemocnění je rovněž pozorována v Japonsku. Nejvyšší incidence PMR byla zaznamenána v severní Evropě, zejména ve Skandinávii [2]. Naopak nízká incidence onemocnění byla pozorována v některých oblastech jižní Evropy, severní Itálie, severozápadního Španělska a v Izraeli [3,4]. Historičtí epidemiologové upozorňují na zajímavou skutečnost, že zvýšená prevalence PMR do značné míry koresponduje s expanzí Vikingů v 2. polovině 1. tisíciletí našeho letopočtu [2]. Prevalence PMR v jižně severním gradientu je udávána mezi 12 až 600 případy na 100 000 obyvatel. Průměrná roční incidence PMR v Olmsted County v Minnesotě byla 52,5/100 000 u osob starších 50 roků. Prevalence PMR byla v této populaci 600/100 000 obyvatel [4].
Etiologie PMR doposud není objasněna, ale s velkou pravděpodobností se na vzniku onemocnění podílí více faktorů (věkový faktor, vliv prostředí, genetická predispozice). Byla prokázána asociace s alelami hlavního histokompatibilního komplexu II. třídy (HLA-DRB1). Několik prací prokázalo vztah mezi rizikem vývoje PMR a přítomností vybraných alel HLA genu (HLA-DRB1*0401, HLA-DRB1*0403, HLA-DRB1*0404), ale výsledky prací nejsou konzistentní [2]. Pacienti s PMR, kteří jsou nosiči alely HLA-DRB1*0401, mají vyšší náchylnost k relapsům onemocnění. Další polymorfizmy asociované s PMR byly detekovány v genech pro tumor nekrotizující faktor alfa (TNFα), interleukin 1 (IL1), intercelulární adhezivní molekulu 1 (ICAM1), vaskulární endoteliální růstový faktor (vascular endothelial growth factor – VEGF) nebo chemokin RANTES [5–9]. Aktuálně je studován vliv epigenetických faktorů, které modulují expresi genů asociovaných s PMR, zejména mikroRNA (miRNA) a proces metylace DNA [10–13]. Některé práce připouští sezonní výskyt PMR a obrovskobuněčné arteriitidy (OBA) ve Velké Británii, Itálii nebo ve skandinávských zemích [14–17]. Sezónní výskyt PMR nebyl naopak pozorován v Severní Americe [18]. Zajímavým kontrastem je pozorování vyšší incidence onemocnění ve Velké Británii během letních měsíců, zatím co v Itálii v průběhu zimy [19–21]. Řada prací se zabývala vztahem mezi infekcí a vznikem PMR a OBA [22–25]. Jednoznačný vztah ke konkrétnímu infekčnímu agens však nebyl doposud prokázán.
Vztah polymyalgia rheumatica a obrovskobunečné arteriitidy
Vztah mezi PMR a obrovskobuněčnou arteriitidou nebyl doposud plně objasněn. Není jasné, zda se jedná o 2 samostatná onemocnění, nebo zda PMR i OBA jsou různými projevy jedné choroby. Mnohé epidemiologické práce zabývající se studiem etnických a genetických faktorů PMR a OBA poukazují na existenci úzké vazby mezi oběma klinickými jednotkami [26,27]. 16–21 % pacientů s PMR má současně příznaky OBA nebo histologickou evidenci tohoto onemocnění. Naopak 40–60 % pacientů s OBA má současně příznaky PMR [27–29]. Z důvodu odlišné prognózy PMR a OBA je při klinické manifestaci PMR vždy nutné pátrat i po přítomnosti známek OBA, a to nejen klinicky, ale i pomocí dalších diagnostických metod.
Klinické projevy polymyalgia rheumatica
PMR se projevuje přetrvávající symetrickou pletencovou bolestí zejména v oblasti ramenních kloubů, krku a horních částí paží, méně často v oblasti pánve, stehen a dolní části zad spojenou s ranní ztuhlostí trvající déle než 45 min, která vede k problémům se vstáváním z lůžka a oblékáním [5]. Bolesti v oblasti ramenních pletenců se často zhoršují při pohybu a mohou narušovat kvalitu spánku. Vznik obtíží může být náhlý nebo pozvolný. Přibližně u 25 % pacientů se objevují synovitidy periferních kloubů, často symetricky postihující drobné klouby, což může být mylně interpretováno jako projev revmatoidní artritidy (RA). Až u třetiny pacientů mohou být přítomny systémové příznaky onemocnění zahrnující zvýšenou tělesnou teplotu, slabost, nechutenství, váhový úbytek nebo horečku. Systémové projevy PMR mají obvykle nižší intenzitu v porovnání se systémovými projevy OBA. Symptomy PMR jsou projevem zánětu synoviální membrány glenohumerálních a kyčelních kloubů a rovněž extraartikulárních synoviálních struktur (tenosynovitidy a burzitidy postihující subdeltoidní, subakromiální, trochanterické, iliopsoatické, ischiogluteální a interspinální burzy obklopující spinózní výběžky obratlů krční a bederní páteře) [6].
Diagnóza polymyalgia rheumatica
Diagnóza PMR se stanuje primárně na základě klinických symptomů a je podpořena přítomností laboratorních známek zánětu. PMR může být diagnostikována i bez jejich přítomnosti, pokud jsou přítomny typické klinické projevy onemocnění a rychlá odpověď na standardní léčbu glukokortikoidy (GK).
Běžným laboratorním nálezem u PMR je zvýšení hodnoty sérových hladin reaktantů akutní fáze (C-reaktivního proteinu – CRP a IL6) a sedimentace erytrocytů (FW). Často je přítomna normocytární, normochromní anémie. Hladiny orgánově nespecifických autoprotilátek jsou obvykle negativní. V současné době není k dispozici žádný diagnostický test specifický pro toto onemocnění. Diagnózu PMR je proto možné stanovit až po vyloučení jiných onemocnění s podobnými symptomy (per exclusionem).
Guidelines Britské společnosti pro revmatologii (British Society for Rheumatology – BSR) a Britské společnosti sdružující nelékařské zdravotnické pracovníky v revmatologii (British Health Professionals in Rheumatology – BHPR) doporučují při podezření na PMR provést kromě klinického vyšetření i minimální soubor doplňkových vyšetření [32]:
- krevní obraz a diferenciální rozpočet bílých krvinek
- CRP a FW
- urea a elektrolyty
- jaterní testy
- kostní soubor
- elektroforéza bílkoviny a případně imunofixace séra a moči
- tyroideální stimulující hormon (TSH)
- kreatinkináza (CK)
- revmatoidní faktor (RF), anticitrulinové protilátky (anti-CCP) a antinukleární faktor (ANA)
- základní biochemické vyšetření moči
- RTG snímek hrudníku (může být požadován)
Guidelines BSR/BHPR dále doporučují použít při stanovení diagnózy PMR bezpečný, sekvenční diagnostický postup. Diagnostika onemocnění by měla být zahájena posouzením základního souboru indikačních a vylučujících kritérií PMR:
- soubor indikačních kritérií:
- věk > 50 roků, trvání symptomů > 2 týdny
- oboustranná bolest ramenních nebo pánevních pletenců
- ranní ztuhlost trvající > 45 min
- evidence laboratorních známek zánětu
- soubor vylučujících kritérií:
- aktivní infekce
- aktivní malignita
- aktivní OBA
- soubor dalších vylučujících faktorů pro PMR, které by měly být vyloučeny:
- jiné zánětlivé revmatické onemocnění
- léky indukované myalgie
- chronické bolestivé syndromy
- endokrinní onemocnění
- neurologická onemocnění, např. Parkinsonova choroba
V případě možných projevů OBA by měl pacient být urgentně předán do péče specializovaného revmatologického pracoviště a měla by být zahájena adekvátní léčba OBA:
- náhlá bolest hlavy (obvykle temporální) a temporální bolestivost
- poruchy vízu, včetně diplopie
- klaudikační bolesti žvýkacích svalů nebo jazyka
- nález zbytnění temporální tepny a vymizení její pulzace
- parézy kraniálních nervů
- klaudikace končetin a další evidence postižení velkých tepen
Po zahájení terapie by měla být hodnocena odpověď na standardní léčbu GK [33,34]. V případě PMR dochází během 1. týdne léčby ke zlepšení symptomů onemocnění o ≥ 70 % (pacientovo hodnocení) a k normalizaci laboratorních známek zánětu během 4 týdnů léčby [32]. Atypické projevy onemocnění nebo neadekvátní odpověď na léčbu GK by měla vzbudit podezření na přítomnost jiného onemocnění a měly by být současně důvodem pro pokračování dalšího vyšetřování na specializovaném revmatologickém pracovišti.
Pracovní skupina EULAR (European League Against Rheumatism) navrhla v roce 2003 následující kritéria odpovědi na léčbu, která mohou být použita k monitorování efektu léčby zejména v klinických studiích, případně v běžné klinické praxi. K hodnoceným parametrům patří CRP nebo FW, bolest hodnocená pacientem na vizuální analogové škále, celkové hodnocení aktivity onemocnění lékařem, délka ranní ztuhlosti (minuty) a elevace horních končetin (0–3) [35].
V roce 2003 byl vytvořen a následně validizován kompozitní index Polymyalgia rheumatica Activity Score (PMR-AS) jako nástroj vhodný k monitorování aktivity onemocnění v průběhu léčby [36,37] (tab. 1).
Tab. 1. Kompozitivní index k hodnocení aktivity polymylagia rheumatica – Polymyalgia Rheumatica Activity Score (PMR-AS) 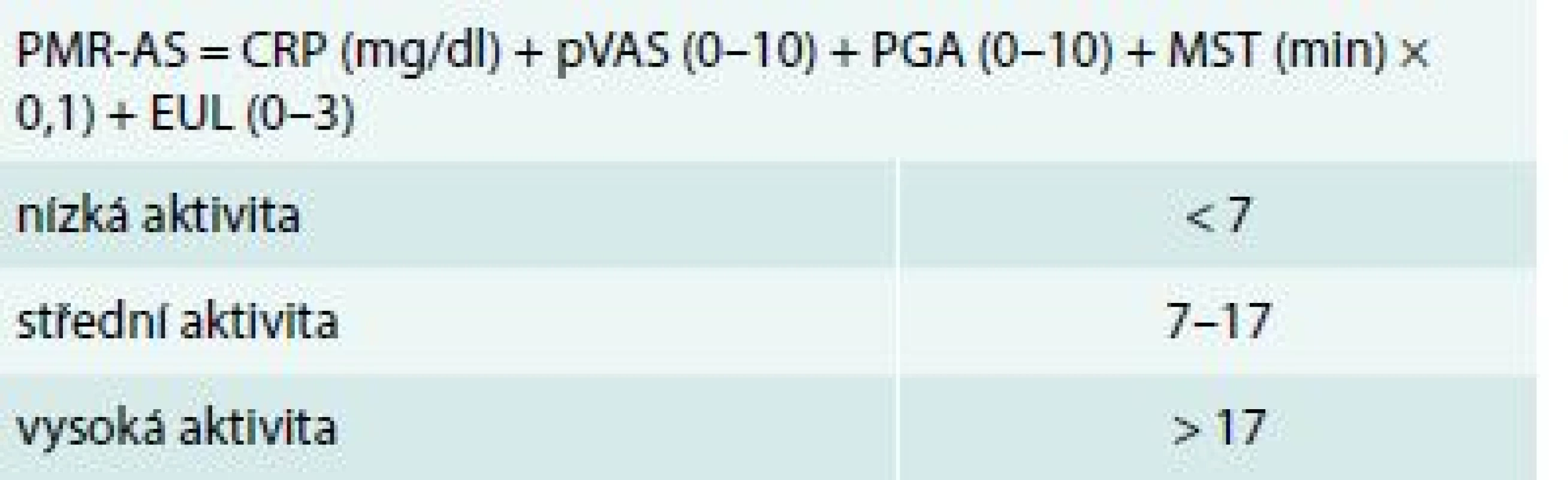
CRP – C-reaktivní protein EUL – elevace horních končetin (3 – žádná, 2 – po úroveň ramene, 1 – do úrovně ramene, 0 – nad úroveň ramene) MST – délka ranní ztuhlosti PMR-AS – Polymyalgia rheumatica Activity Score pVAS – hodnocení bolesti pacientem na vizuální analogové škále PGA – celkové hodnocení aktivity onemocnění lékařem na vizuální analogové škále Před zahájením léčby, ale i v jejím průběhu by měla být monitorována přítomnost přidružených onemocnění (komorbidit), doprovodná medikace a případná budoucí rizika selhání léčby GK. Je rovněž důležité stanovit rizika relapsu a prodloužené terapie onemocnění.
V minulosti byla vytvořena řada kritérií pro PMR, která byla koncipována jako diagnostická [2]. Nejnovějším příspěvkem jsou předběžná klasifikační kritéria pro PMR, která byla vytvořena v roce 2012 společným úsilím týmu odborníků Evropské ligy proti revmatizmu (EULAR) a Americké revmatologické akademie (American College of Rheumatology – ACR) (tab. 2) [38]. Byla vytvořena podle současného konceptu tvorby klasifikačních kritérií. Klasifikační kritéria jsou vytvářena především pro potřeby klinických studií s cílem shromáždit relativně homogenní soubor jedinců s vysokou pravděpodobností přítomnosti daného onemocnění. Navržená klasifikační kritéria jsou založena na přítomnosti vybraných klinických, laboratorních a nově i ultrasonografických (USG) nálezů. Byl vytvořen skórovací algoritmus pro nemocné, kteří splňují následující vstupní podmínky: věk ≥ 50 roků; oboustranná bolest ramen; abnormální CRP a/nebo FW. Nemocné, kteří dosáhnou skóre ≥ 4 bodů, odlišuje od osob s jiným onemocněním napodobujícím PMR se senzitivitou 72 % a specificitou 65 %. Nová klasifikační kritéria, na rozdíl od starších, nehodnotí rychlou odpověď onemocnění na léčbu GK, zejména proto, že tento faktor nedostatečně odlišuje PMR od jiných chorob. Důvodem může být i neexistující přesná definice tohoto druhu léčebné odpovědi [39,40]. Navržená klasifikační kritéria nebyla doposud validizována pro diagnostiku PMR v běžné klinické praxi, přesto je možné je v praxi použít.
Tab. 2. Klasifikační kritéria EULAR/ACR pro polymyalgia rheumatica z roku 2012. Skórovací algoritmus pro polymyalgia rheumatica s a bez použití USG vyšetření 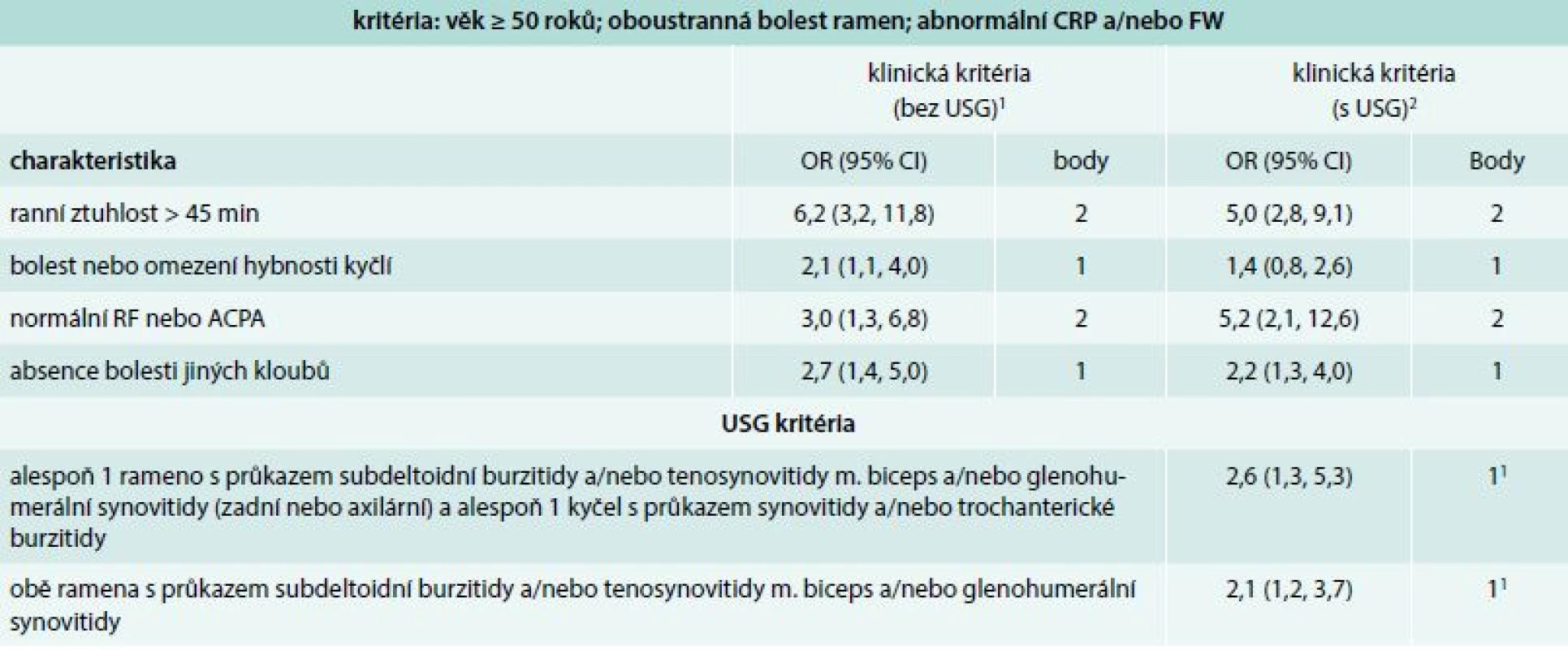
ACPA – protilátky proti citrulinovaným peptidům CI – interval spolehlivosti CRP – C-reaktivní protein RF – revmatoidní faktor FW – sedimentace erytrocytů, 1optimální hranice jsou 4 body. Skóre 4 a více je kategorizováno jako PMR; senzitivita 72 %; specificita 65 %; specificita je vyšší (79 %) pro odlišení postižení ramene od PMR a nižší (61 %) pro odlišení RA od PMR 2p = 0,008 a p = 0,009 pro dodatková kritéria; optimální hranice je 5 bodů: skóre 5 a více je kategorizováno jako PMR; senzitivita 71 %; specificita 70 %; specificita je vyšší (86 %) pro odlišení postižení ramene od PMR a nižší (65 %) pro odlišení RA od PMR Recentní evidence, která prokazuje u vysokého procenta pacientů s PMR přítomnost synovitidy, tenosynovitidy nebo burzitidy v oblasti glenohumerálních nebo kyčelních kloubů pomocí citlivých zobrazovacích technik (USG, nebo zobrazení magnetickou rezonancí/magnetic resonance imaging – MRI), vedla některé odborníky k rozhodnutí zařadit vyšetření těmito metodami mezi parametry nově navržených klasifikačních kritérií.
USG je široce používanou metodou při diagnostice řady revmatických onemocnění. Jak již bylo uvedeno, nově navržená klasifikační kritéria EULAR/ACR pro PMR umožňují použití USG průkazu synovitidy, tenosynovitidy nebo burzitidy v oblasti ramenních nebo kyčelních kloubů ke stanovení diagnózy PMR (obr. 1, 2 a 3). Pozitivní USG nález zvyšuje senzitivitu a specificitu navržených kritérií [38,41,42]. Detekce hypervaskularizované, zánětlivé synoviální tkáně je možná s použitím USG zobrazení s vysokým rozlišením a režimu Power-Doppler (PDUS). Doposud málo informací je k dispozici o využití USG vyšetření s kontrastem (contrast-enhanced ultrasonography – CEUS) v diagnostice PMR. CEUS umožňuje detekci průtoků malých objemů krve v drobných cévách. CEUS, na rozdíl od PDUS, je citlivější pro detekci intraartikulární synoviální mikrovaskulatury, a umožňuje tak lépe odlišit mezi zesílením synoviální membrány s nebo bez přítomnosti aktivního zánětu [43]. Současné studie týkající se zánětlivých revmatických onemocnění používají kontrastní látku druhé generace SonoVue [44]. USG a především CEUS může být důležitým nástrojem pro sledování aktivity onemocnění a odpovědi na léčbu.
Obr. 1. Pravý ramenní kloub, longitudinální zobrazení šlachy dlouhé hlavy bicepsu s okolní tenosynovitidou. Vyšetření proběhlo na přístroji Philips iU22 povrchovou lineární sondou 12 MHz. Otištěno s laskavým svolením MUDr. Andrey Šprlákové-Pukové, Ph.D. 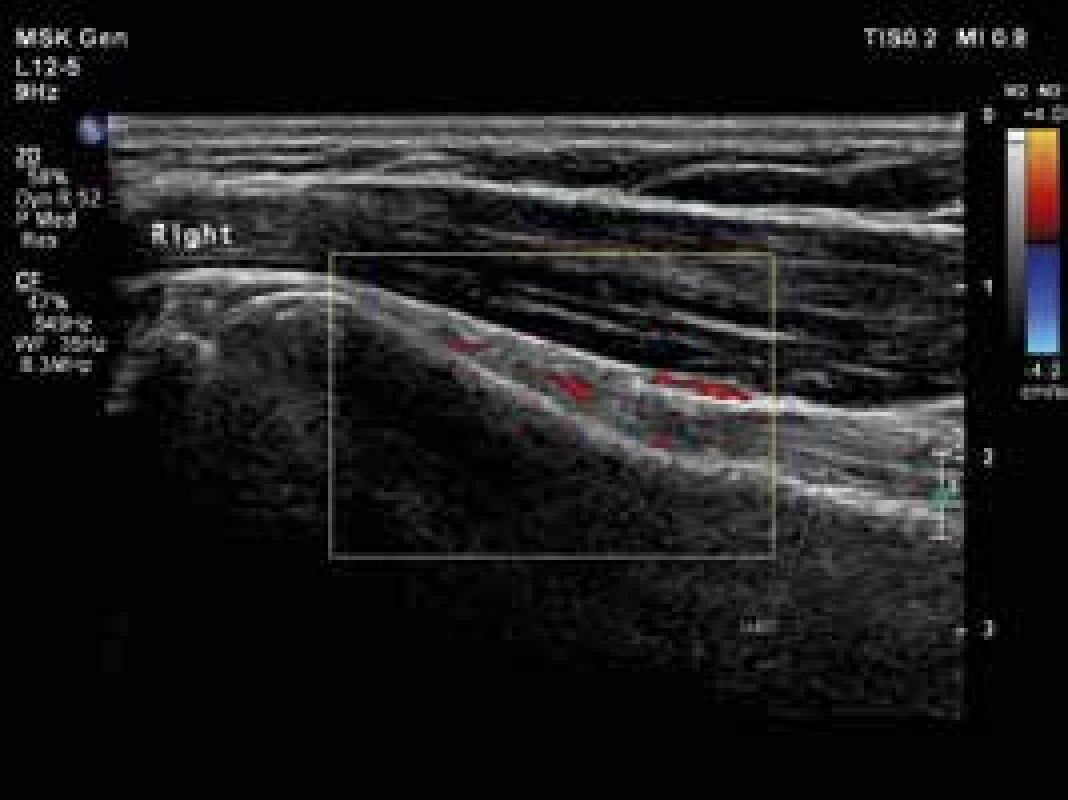
Obr. 2. Levý ramenní kloub, patologický zvýšená náplň v subakromiální burze, perfuze v rozšířené stěně burzy. Vyšetření proběhlo na přístroji Philips iU22 povrchovou lineární sondou 12 MHz. Otištěno s laskavým svolením MUDr. Andrey Šprlákové-Pukové, Ph.D. 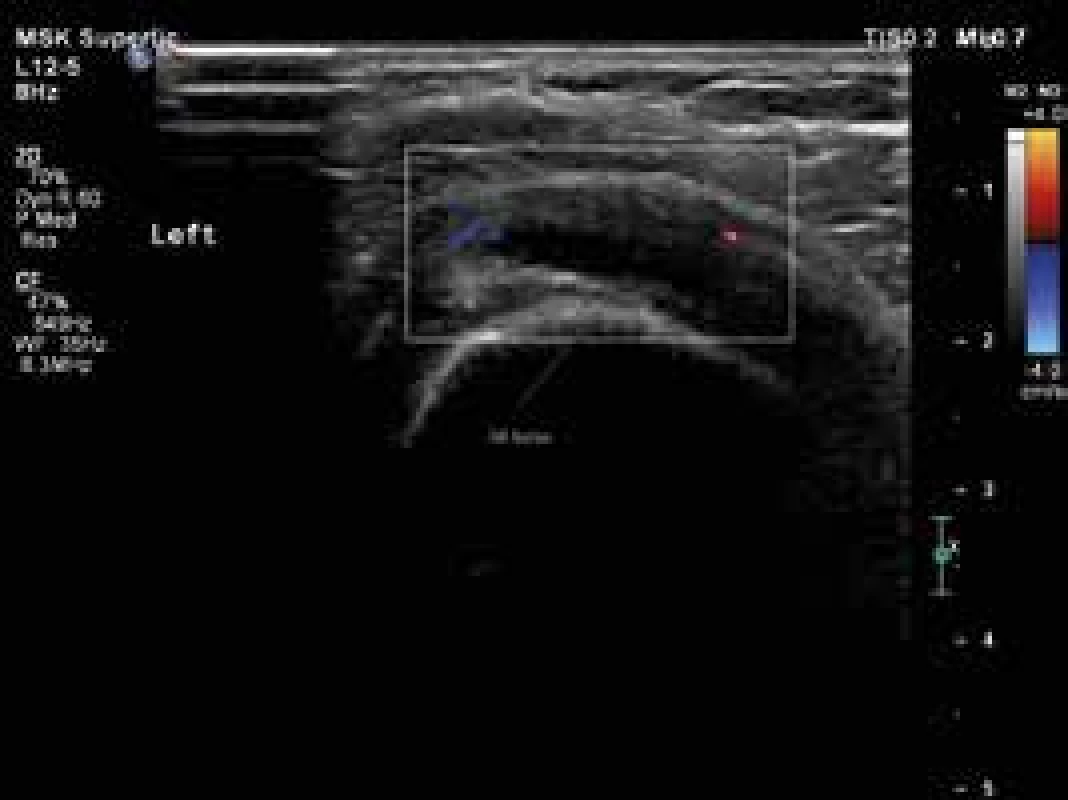
Obr. 3. Úponové změny s patologickou perfuzí v okolí šlach m. gluteus medius a minimus vpravo, jejich podélné zobrazení. Vyšetření proběhlo na přístroji Philips iU22 povrchovou lineární sondou 12 MHz. Otištěno s laskavým svolením MUDr. Andrey Šprlákové-Pukové, Ph.D. 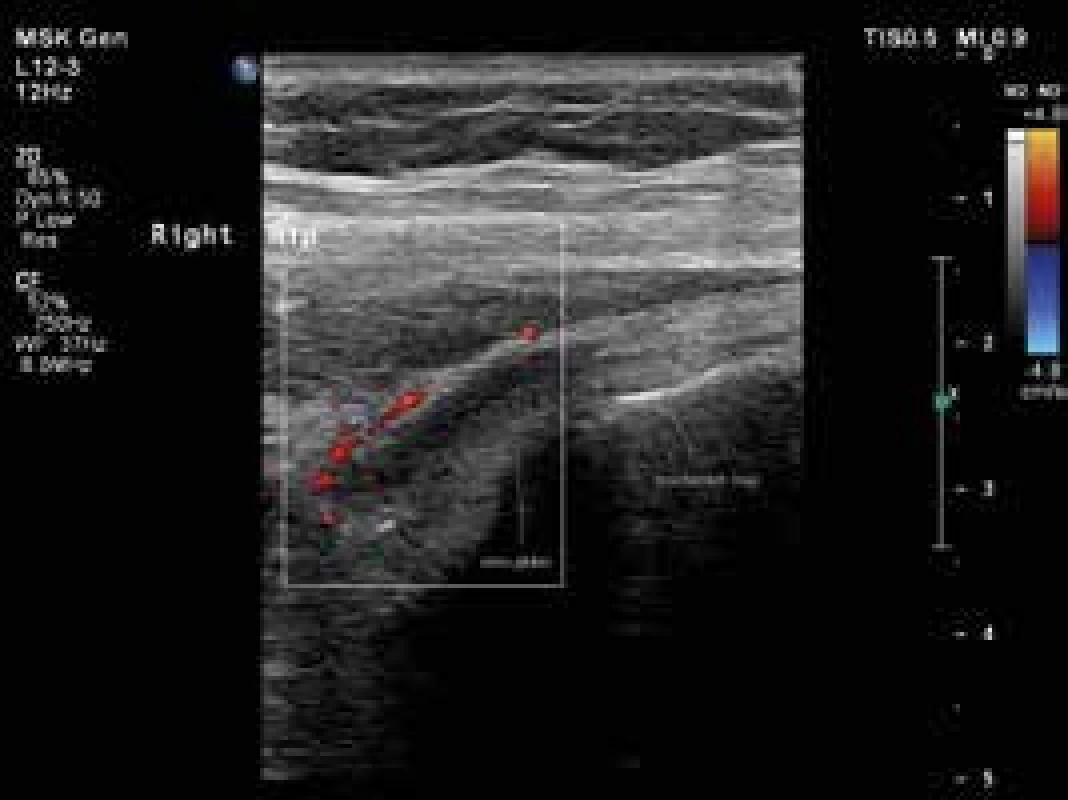
V časné diagnostice onemocnění může být rovněž použito vyšetření pomocí pozitronové emisní tomografie (PET) detekující radiofarmakum FDG (2-[18F]-fluoro-2-deoxy-D-glukózu). V současnosti se PET vyšetření obvykle kombinuje se zobrazením struktury tkání pomocí výpočetní tomografie (computed tomography – CT) nebo pomocí MRI. Blockmans et al byli v roce 2007 prvními, kteří zaznamenali pomocí PET zvýšenou aktivitu FDG v oblasti spinózních výběžků převážně bederních obratlů u 18 z 35 pacientů (51 %) s PMR [45]. V souboru vyšetřených pacientů navíc popsali PET nálezy postižení ramenních pletenců (94 % pacientů), pánevních pletenců (89 % pacientů) a rovněž vaskulitidu velkých cév (31 % pacientů, obr. 4. V případě cervikální a bederní interspinózní burzitidy byla u pacientů s PMR prokázána korelace mezi zvýšeným kontrastem po podání paramagnetické kontrastní látky při zobrazení MR a vysokou aktivitou FDG při PET vyšetření [46,47]. Řehák et al provedli vlastní studii, ve které hodnotili 67 pacientů s PMR pomocí FDG-PET (PET/CT) vyšetření [48]. U 59 pacientů (88,1 %) bylo prokázáno postižení velkých kloubů, u 51 pacientů (76,1 %) postižení extraartikulárních synoviálních struktur a u 27 pacientů (40,3 %) bylo pozorováno vaskulární postižení. FDG-PET (PET/CT, PET/MR) se jeví být výhodným jednostupňovým vyšetřením schopným komplexně detekovat aktivitu kloubních a mimokloubních synoviálních struktur, přítomnost vaskulitidy tepen velkého a středního kalibru a současně potvrdit nebo vyloučit přítomnost skryté malignity.
Obr. 4. Znázornění postižení kloubních synoviálních struktur (glenohumerální a kyčelní klouby) žlutě, mimokloubních synoviálních struktur (subdeltoidní, subakromiální, trochanterické, iliopsoatické a interspinózní burzy obklopující spinózní výběžky krčních a bederních obratlů, oblast úponů hamstringů na hrbol sedací kosti) zeleně a vaskulitidu tepen velkého a středního kalibru červeně pomocí pozitronové emisní tomografie (PET) detekující radiofarmakum FDG u polymyalgia rheumatica a obrovskobuněčné arteriitidy. Otištěno s laskavým svolením prim. MUDr. Zdeňka Řeháka, Ph.D. 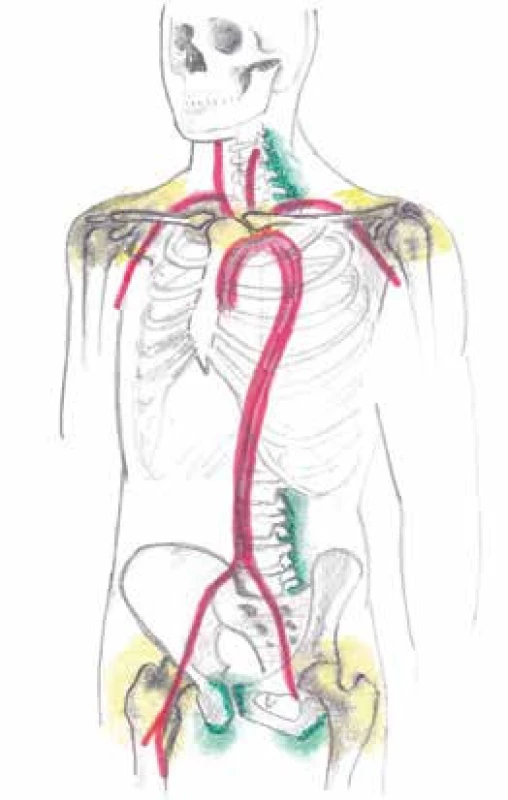
Diferenciální diagnóza polymyalgia rheumatica
Diferenciální diagnostika PMR je obsáhlá. Zahrnuje zejména skupinu zánětlivých revmatických onemocnění, mezi nimiž dominuje revmatoidní artritida vyššího věku (elderly onset rheumatoid arthritis – EORA). Pacienti s EORA mají obvykle více synovitidou postižených kloubů na rukou, zápěstích a nohou. PMR nebývá provázená pozitivitou autoprotilátek (RF, anti-CCP). Odlišení obou onemocnění může ztěžovat fakt, že se u geriatrické populace zvyšuje pravděpodobnost záchytu pozitivity RF. Při srovnání souboru 57 pacientů s EORA a 49 pacientů s PMR byly anti-CCP protilátky zachyceny u 65 % pacientů s EORA, ale u žádného pacienta s PMR [49]. K odlišení obou onemocnění může sloužit rovněž sledování odpovědi na standardní terapii GK. Nízká dávka GK vede u EORA pouze k částečnému ústupu obtíží, zatím co u PMR k rychlému a kompletnímu vymizení symptomů. Zvažována musí být i možnost překryvného syndromu obou onemocnění. Z dalších zánětlivých revmatických onemocnění je nutné vyloučit spondylartritidy, systémová autoimunitní onemocnění a vaskulitidy, relabující séronegativní symetrickou synovitidu s prchavým otokem (RS3PE) nebo krystaly indikované artritidy. Dále je nutné odlišit projevy mimokloubního revmatizmu v oblasti ramenních pletenců (adhezivní kapsulitida, burzitida, tendinitida rotátorové manžety ramene) a osteoartrózu. V rámci širší diferenciální diagnostiky mohou symptomy PMR napodobovat rovněž infekce (virové, chronická endokarditida, tuberkulóza, osteomyelitida), endokrinní onemocnění (hypertyreóza, hypotyreóza, hyperparatyreóza, hypovitaminóza D3), neurologická onemocnění (Parkinsonova choroba), léky indukované stavy, amyloidóza nebo psychosomatická onemocnění (fibromyalgie a deprese).
Četná sdělení upozorňují na zvýšené riziko malignity u pacientů s PMR. Údaje z britské General Practice Research Database ukazují na zvýšené riziko malignity po dobu prvních 6 měsíců od stanovení diagnózy PMR [50]. Příčin může být několik, ale nejzřetelnější z nich je nesprávně stanovená diagnóza. Data ze švédského nemocničního registru prokázala zvýšené riziko karcinomu u pacientů s PMR v průběhu prvního roku od stanovení diagnózy (Standard incidence ratio – SIR = 1,19), ale riziko klesalo, pokud byla malignita prokázána po více než roce od stanovení diagnózy (SIR = 1,06) [51]. Byla zaznamenána zvýšená incidence kožních nádorů, karcinomu žaludku, plic, prostaty, ledvin, nádorů nervového systému a endokrinních nádorů a rovněž nonhodgkinského lymfomu, mnohočetného myelomu a leukemie. Guidelines BRS/BHPR uvádějí aktivní malignitu jako jedno z hlavních vylučujících kritérií pro diagnózou PMR [32]. Zařazení PET/CT vyšetření do diagnostického algoritmu může k jejímu časnému odhalení významně přispět.
Léčba polymyalgia rheumatica
V roce 2015 byla zveřejněna nová Doporučení k léčbě PMR vytvořená expertní skupinou EULAR a ACR [52]. Jejich cílem je standardizovat a rovněž zlepšit péči o nemocné s PMR. Doporučení byla koncipována jako návod, jak postupovat při řešení některých specifických situací v rámci péče o nemocné s PMR, určený lékařům primární, sekundární a terciární péče (zejména praktickým lékařům, internistům a revmatologům). Doporučení byla vytvořena na základě principů medicíny založené na důkazech a rovněž s přihlédnutím na osobní názory expertů. Podkladem pro jejich tvorbu bylo provedení systematického přehledu odborné literatury týkající se PMR. Kvalita důkazů byla následně testována specifickými nástroji (GRADE). Expertní skupina vytvořila 8 obecných principů, které považuje za základní aspekty péče o nemocné s PMR, a dále 10 specifických doporučení. Doporučení dále rozdělila na silná a podmínečná.
Obecné principy péče o nemocné s polymyalgia rheumatica
Cílovou populací pro doporučení jsou nemocní s PMR diagnostikovanou na základě předběžných klasifikačních kritérií ACR/EULAR z roku 2012 nebo na základě některých z existujících diagnostických kritérií. Neposkytují návod, jak pečovat o pacienty s PMR a současnou obrovskobuněčnou arteriitidou, revmatoidní artritidou nebo jiným onemocněním s projevy napodobujícími PMR.
- expertní skupina doporučuje použít specifické a bezpečné postupy v diagnostice PMR, klinické vyšetření zaměřit na vyloučení klinicky podobných stavů (např. nezánětlivých, zánětlivých (OBA, RA), léky indukovaných, endokrinních, infekčních nebo maligních)
- dále doporučuje u každého pacienta s podezřením na PMR provést před zahájením léčby následující soubor vyšetření:
- základní laboratorní vyšetření (CRP, FW, krevní obraz, glukóza, kreatinin, jaterní soubor, kostní soubor včetně hladiny vápníku a alkalické fosfatázy, RF, anti-CCP, elektroforéza bílkovin krevního séra, biochemické vyšetření moči, TSH, kreatinkináza – CK, vitamin D3)
- v závislosti na klinických symptomech a při zvýšené pravděpodobnosti alternativní diagnózy stanovit přítomnost ANA, protilátek proti cytoplazmě neutrofilů (ANCA) a vyloučit aktivní tuberkulózu, zvážit provedení RTG vyšetření hrudníku
- monitorace přidružených onemocnění (hypertenze, diabetes mellitus, dyslipidemie, kardiovaskulární onemocnění, vředová choroba gastroduodena, osteoporóza včetně čerstvých zlomenin, katarakta, riziko glaukomu, chronické a rekurentní infekce), evidence současné léčby (včetně užívání nesteroidních antiflogistik), monitoring rizikových faktorů zvýšené toxicity GK
- monitorace zvýšeného rizika relapsu PMR a nutnosti prodloužené terapie
- expertní skupina zdůrazňuje nutnost konzultace se specialisty zejména při atypickém průběhu onemocnění (periferní artritida, systémové projevy, nízké hodnoty reaktantů akutní fáze, věk < 60 roků), při projevech a riziku toxicity léčby, u pacientů s relapsy onemocnění a s nutností dlouhodobé léčby
- každý nemocný s PMR by měl dostat nejlepší možnou zdravotní péči, která by měla být výsledkem sdíleného rozhodnutí mezi lékařem a poučeným pacientem
- pro každého pacienta je nutné vytvořit individuální léčebný plán – perspektivy a preference pacientů by měly být zohledněny při výběru iniciální dávky GK a rychlostí jejího snižování
- každý pacient by měl mít přístup k informacím týkajícím se onemocnění, jeho důsledků a léčby (včetně komorbidit a prediktorů onemocnění), každému nemocnému s PMR je nutné vypracovat individuální plán cvičení
- každý pacient s PMR by měl být pravidelně monitorován: rizikové faktory toxicity a projevy toxicity GK, komorbidity, doprovodná medikace, rizikové faktory relapsu onemocnění; výsledky klinického a laboratorního vyšetření by měly být v průběhu léčby dokumentovány – doporučená frekvence kontrolních návštěv je 4–8 týdnů v průběhu 1. roku léčby, 8–12 týdnů v průběhu 2. roku léčby, dále při relapsu, při změně dávky GK a při ukončení léčby
- je důležité, aby každý pacient s PMR měl přímý a rychlý přístup ke zdravotní péči především při změně zdravotního stavu (např. relaps onemocnění, toxicita léčby)
Specifická doporučení k léčbě PMR
- silné doporučení pro použití GK namísto nesteroidních antiflogistik (NSA) v terapii PMR – riziko dlouhodobé terapie NSA převažuje nad jejich možným malým přínosem v léčbě PMR, výjimkou může být krátkodobé použití NSA nebo analgetik u pacientů s PMR s přítomností jiného symptomatického onemocnění (např. osteoartrózy), k použití analgetik nebylo vytvořeno specifické doporučení
- silné doporučení pro individuální volbu nejkratší účinné délky terapie a nejnižší účinné dávky GK tak, aby byly optimálně vybalancovány přínosy a rizika léčby; volba individuální léčebné strategie by měla být provedena po zhodnocení rizika léčby GK, komorbidit, doprovodné medikace a rizika relapsu onemocnění – minimální doporučená délka léčby GK je 12 měsíců, specifičtější doporučení nebylo možné vytvořit z důvodu nedostatku důkazů a vlivu řady faktorů ovlivňujících průběh léčby
- podmínečné doporučení použití nejnižší účinné iniciální dávky GK v rozsahu 12,5–25 mg prednisonu nebo ekvipotentní dávky jiného perorálního GK denně – expertní panel neměl k dispozici dostatek důkazů k tomu, aby mohl vytvořit specifičtější doporučení, jak postupovat u konkrétního pacienta s ohledem na jeho individuální charakteristiky onemocnění a rizikový profil, nicméně vyšší dávky z uvedeného rozmezí by měly být použity u pacientů s vysokým rizikem relapsu onemocnění a s nízkým rizikem toxicity léčby – naopak nižší dávky by měly být použity u pacientů s komorbiditami (např. diabetes mellitus, osteoporóza, glaukom atd.) a s vysokým rizikem toxicity léčby, expertní panel podmínečně nedoporučuje použití iniciální dávky prednisonu ≤ 7,5 mg/den a současně nedoporučuje užití dávky > 30 mg/den, a to zejména z důvodu vysokého rizika spojeného s dlouhodobou léčbou vysokými dávkami GK a rovněž z důvodu nedostatku důkazu o účinnosti vysokých dávek GK u PMR [53–56], v situacích, v nichž je vyžadována léčba vyššími dávkami GK, musí být zvažována možnost alternativní diagnózy
- silné doporučení volby individuálního režimu snižování dávky GK na základě pravidelného monitorování aktivity onemocnění, laboratorních parametrů a toxicity léčby – expertní panel navrhuje následující režim redukce dávky GK:
- snížení iniciální dávky prednisonu na 10 mg/den během 4–8 týdnů
- po dosažení remise onemocnění snižování dávky prednisonu o 1 mg každé 4 týdny až do ukončení léčby v případě, že trvá remise onemocnění; není-li dostupný prednison o síle 1 mg, je doporučeno dávku redukovat s využitím alternativního režimu (např. 7,5 mg a 10 mg obden); redukce dávky může být v úvodu rychlejší, pokud byla iniciálně použita vyšší dávka prednisonu, a naopak pozvolnější, jestliže byla iniciálně použita nižší dávka prednisonu
- v případě relapsu PMR zvýšení dávky prednisonu na poslední dávku předcházející relapsu a poté postupné snižování dávky během 4–8 týdnů na dávku, při které se relaps objevil
- podmínečné doporučení pro použití intramuskulárně (i.m.) aplikovaného metylprednisolonu (MP) jako alternativy perorálních GK – použití parenterálního GK by mělo být zváženo zejména v situacích, v nichž je žádoucí snížit celkovou kumulativní dávku GK, např. u žen s obtížně kompenzovatelnou hypertenzí, diabetes mellitus, osteoporózou nebo glaukomem, efekt MP byl testován pouze v jedné randomizované, kontrolované klinické studii, do které bylo zařazeno 60 pacientů s PMR [57], pacienti byli léčeni buď MP acetátem podávaným i.m. v dávce 120 mg každé 3 týdny s následnou redukcí dávky nebo perorálním prednisonem v dávce 15 mg/den s následnou redukcí dávky – efekt obou způsoby léčby byl srovnatelný, kumulativní dávka byla nižší v případě MP (o 44 %), bezpečnost obou způsobů léčby byla srovnatelná s výjimkou nižšího nárůstu hmotnosti u pacientů léčených MP (0,82 kg vs 3,42 kg, P < 0,005), expertní panel proto z důvodu nedostatečné evidence souhlasil pouze s podmínečným doporučením takového způsobu léčby
- podmínečné doporučení použití jedné denní dávky GK – výjimkou pro zvážení rozdělení denní dávky může být situace, pokud se objeví výrazná noční bolest v průběhu redukce dávky GK (prednisonu < 5 mg denně), k dispozici však nejsou žádné klinické studie; expertní panel zdůrazňuje zejména obavu z možných nežádoucích účinků (např. narušení hypotalamohypofyzární osy)
- podmínečné doporučení časného přidání metotrexátu (MTX) k terapii GK zejména u pacientů s vysokým rizikem relapsu onemocnění spojeným s nutností prodloužené léčby a rovněž u pacientů s rizikovými faktory, komorbiditami a doprovodnou terapií, u kterých lze očekávat zvýšený výskyt nežádoucích účinků GK, MTX byl testován ve 4 randomizovaných, kontrolovaných studiích (194 pacientů s PMR) a jedné retrospektivní studii, ve kterých byl používán v dávkách 7,5–10 mg týdně [58–61]: s výjimkou jedné méně kvalitní studie byl zaznamenán pozitivní efekt MTX, ale použití MTX nevedlo k redukci toxicity GK – použití MTX by mělo být zvažováno u pacientů s relapsem onemocnění, který se objeví nezávisle na tom, zda pacient je, nebo není léčen GK, u pacientů s nedostatečnou odpovědí na terapii GK nebo u pacientů s projevy toxicity léčby GK, MTX může být kombinován s p.o. i i.m. formou GK, i když kombinace s parenterálním MP nebyla formálně testována – v klinické praxi může být jeho použití zváženo například u pacientů s vysokou vstupní hodnotou FW (> 40 mm/hod), s artritidou periferních kloubů a s komorbiditami negativně ovlivněnými léčbou GK
- silné doporučení nepoužívat v terapii PMR inhibitory TNFα – expertní panel vydal toto doporučení zejména z důvodu chybějících důkazů o účinnosti TNFα inhibitorů a z důvodů obav o bezpečnost a vysokou cenu biologické léčby, určitou naději na využití biologických léků v léčbě PMR poskytla data ze 2 otevřených prospektivních studií, které testovaly účinnost a bezpečnost léčby inhibitorem receptoru pro IL6 tocilizumabem (TCZ) – do studie TENOR (Tolerance and Efficacy of tocilizumab iN pOlymyalgia Rheumatica) bylo zařazeno 20 pacientů s aktivní PMR (PMR-AS > 10) s trváním symptomů onemocnění do 1 roku, kteří nebyli doposud léčeni GK, v první fázi studie byl aplikován TCZ intravenózně (i.v.) v dávce 8 mg/kg, v týdnech 0, 4 a 8 bez přidání GK [62], ve 12. týdnu byla zahájena terapie prednisonem v dávce 0,15 mg/kg. Remise onemocnění ve 12. týdnu léčby byla dosažena u všech pacientů – v průběhu dalšího sledování nebyl zaznamenán žádný relaps onemocnění a nutnost záchranné medikace, kumulativní dávka prednisonu ve 24. týdnu studie byla proti hypotetické skupině nemocných méně než poloviční (1690,5 mg vs 808,5 mg). Do další otevřené, prospektivní studie bylo zařazeno 10 pacientů s PMR, kteří byli léčeni GK (prednison ≤ 20 mg denně) ne déle než 1 měsíc [63], pacientům ve studii byl aplikován TCZ i.v. v dávce 8 mg/kg každé 4 týdny, hodnoceno bylo nakonec 9 pacientů. U všech pacientů byl splněn primární cíl studie, remise onemocnění po 6 měsících léčby TCZ bez nutnosti léčby GK – u všech pacientů mohla být ukončena terapie prednisonem během prvních 4 měsíců léčby, remise u všech pacientů přetrvávala po celou dobu sledování (15 měsíců), příznivý efekt léčby TCZ dokazuje i naše osobní zkušenost (nepublikovaná data): pacientka s PMR, refrakterní na léčbu GK a MTX byla léčena po dobu 1 roku TCZ. Během prvních 12 týdnů dávkou 8 mg/kg i.v. každé 4 týdny a následně dávkou 4 mg/kg i.v. každé 4 týdny – remise onemocnění byla dosažena ve 12. týdnu a přetrvávala i po 52 týdnech léčby (PMR-AS < 7, PET/CT). V průběhu studie byla ukončena terapie GK.
- podmínečné doporučení individuálního cvičebního programu pro každého pacienta s PMR z důvodů udržení svalové hmoty, fyzické kondice a prevence pádů zejména u starších pacientů dlouhodobě léčených GK – k dispozici však nejsou žádné studie prokazující efekt nefarmakologické léčby a rovněž chybí klinická zkušenost
- silné doporučení nepoužívat některé prostředky tradiční čínské medicíny k terapii PMR
Algoritmus léčby PMR navržený expertní skupinou EULAR/ACR ukazuje schéma.
Schéma. Algoritmus léčby polymyalgia rheumatica podle Doporučení EULAR/ACR z roku 2015. Upraveno podle [52] ![Schéma. Algoritmus léčby polymyalgia rheumatica podle Doporučení EULAR/ACR z roku 2015.
Upraveno podle [52]](https://pl-master.mdcdn.cz/media/image/fc4409231a3c408493cd1eee8a3985ea.jpg?version=1537797776)
GK – glukokortikoidy MTX – metotrexát PMR – polymyalgia rheumatica Prognóza polymyalgia rheumatica
Prognóza PMR je relativně příznivá, zejména v porovnání s OBA. Pokud však onemocnění není včas diagnostikováno a adekvátně léčeno, může mít negativní dopad na fyzickou kondici a kvalitu života. Výsledky několika studií prokazují, že pacienti s PMR mají zvýšené riziko všech typů makrovaskulárních příhod (kardiovaskulárních, cerebrovaskulárních i periferních) [64–66]. Hancock et al prokázali, že pacienti s PMR mají oproti zdravým jedincům zvýšené riziko cévních komplikací (poměr rizika – HR 2,9; 95% CI 2,6–3,2). Zvýšené riziko se objevuje již krátce po stanovení diagnózy a je vyšší zejména u mladších pacientů (< 60 let) [64]. Z tohoto pohledu je důležité, aby u každého pacienta s PMR byl sledován výskyt tradičních kardiovaskulárních rizikových faktorů a tyto byly adekvátně léčeny.
Relapsy onemocnění se objevují v průběhu léčby u 23–55 % pacientů v závislosti na délce jejich sledování [67,68]. V prospektivní studii britských autorů, do které bylo zařazeno 129 pacientů s PMR, se během ročního sledování objevil relaps onemocnění u 33 % pacientů [69]. Zvýšené hodnoty FW, CRP a IL6 v době diagnózy korelují se zvýšeným rizikem relapsu a s nutností použít vyšší dávku GK, zvláště pokud abnormální hodnoty těchto parametrů přetrvávají i během léčby [70–72]. Vysoká hladina hemoglobinu a nízké hodnoty FW jsou naopak spojeny s lepší odpovědí na léčbu GK [71]. Ženy mívají ve srovnání s muži častěji refrakterní onemocnění, více relapsů, potřebu vyšší kumulativní dávky GK a dlouhodobé léčby GK, ale také více nežádoucích účinků GK [73,74]. Riziko relapsu onemocnění je naopak snížené při dávce prednisonu > 10 mg denně a při opatrném snižování jeho dávky rychlostí < o 1 mg za měsíc. Doposud nemáme k dispozici informace o roli moderních vyšetřovacích technik např. USG nebo PET/CT v predikci rizika vývoje relapsů onemocnění nebo jejich o využití k tvorbě individuálních léčebných strategií.
Dlouhodobá léčba GK v populaci osob s PMR je spojena se zvýšením rizikem nežádoucích účinků léčby. Průměrná délka terapie PMR GK je 20–28 měsíců. Přibližně u 50 % pacientů je možné ukončit terapii GK po 2 letech (24–96 %). Až u 20 % pacientů je nutné v terapii GK pokračovat déle než 4 roky a u 10 % pacientů dokonce déle než 10 roků. V kohortě 232 pacientů s PMR, kteří byli sledováni průměrně po dobu 8 roků, byla minimálně jedna nežádoucí příhoda zaznamenána u 65 % pacientů léčených GK a dokonce u 80 % pacientů léčených současně GK a NSA [75]. Průměrná doba do vzniku první nežádoucí příhody byla 1,6 roku od zahájení léčby. Autoři identifikovali 3 faktory spojené se zvýšeným rizikem nežádoucích příhod: věk při diagnóze, kumulativní dávku prednisonu ≥ 1 800 mg a ženské pohlaví. Riziko vývoje diabetes mellitus, vertebrálních zlomenin a zlomenin proximálního femuru bylo zvýšeno 2–5krát ve srovnání se stejně starou zdravou populací.
Závěr
PMR není vzácným onemocněním, jak by se na první pohled mohlo zdát. Je považováno za nejčastější zánětlivé onemocnění osob starších 50 roků a vrchol výskytu je v především v osmém deceniu. Významná část pacientů s PMR může mít současně příznaky OBA. Odlišení obou projevů pravděpodobně jednoho onemocnění může předejít závažným komplikacím OBA, jakými je např. ztráta zraku. Přestože existující diagnostická a klasifikační kritéria umožnují stanovit diagnózu PMR v běžné praxi, nemáme k dispozici žádný diagnostický test specifický pro toto onemocnění. Velkým přínosem pro diagnostiku PMR je použití moderních zobrazovacích technik, především USG a PET. Dříve než může být zahájena adekvátní léčba, je nutné vyloučit přítomnost jiného onemocnění, které svými projevy napodobuje PMR. Zlatým standardem v terapii PMR jsou stále glukokortikoidy (GK). Úvodní dávka prednisonu by se měla pohybovat v rozmezí 12,5–25 mg denně. V případě dosažení remise onemocnění by měla být dávka GK snižována jen velmi opatrně v postupných krocích. V případě refrakterního onemocnění nebo v případě rizika léčby GK je možné v terapii využít metotrexát. Některé studie poskytují nadějná data o využití tocilizumabu v terapii PMR. Včas nerozpoznané a adekvátně neléčené onemocnění může mít negativní vliv na fyzickou kondici a kvalitu života nemocných, ale může být rovněž příčinou častého cévního onemocnění.
Doručeno do redakce 25. 9. 2017
Přijato po recenzi 19. 11. 2017
doc. MUDr. Petr Němec, Ph.D.
Revmatologická ambulance II. interní kliniky LF MU a FN u sv. Anny v Brně
Zdroje
1. Smeeth L, Cook C, Hall AJ. Incidence of diagnosed polymyalgia rheumatica and temporal arteritis in the United Kingdom, 1990–2001. Ann Rheum Dis 2006; 65(8): 1093–1098. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2005.046912>.
2. Rooney PJ, Rooney J, Balint G et al. Polymyalgia rheumatica: 125 years of epidemiological progress? Scott Med J 2015; 60(1): 50–57. Dostupné z DOI: <http://dx.doi.org/10.1177/0036933014551115>.
3. Sonnenblick M, Nesher G, Friedlander Y et al. Giant cell arteritis in Jerusalem: a 12 year epidemiological study. Br J Rheumatol 1994; 33(10): 938–941.
4. Salvarani C, Gabriel SE, O‘Fallon WM et al. Epidemiology of polymyalgia rheumatica in Olmsted County, Minnesota, 1970–1991. Arthritis Rheum 1995; 38(3): 369–373.
5. Gonzalez-Gay MA. Genetic epidemiology. Giant cell arteritis and polymyalgia rheumatica. Arthritis Res 2001; 3(3): 154–157. Dostupné z DOI: <http://dx.doi.org/10.1186/ar293>.
6. Boiardi L, Salvarani C, Timms JM et al. Interleukin-1 cluster and tumor necrosis factor-alpha gene polymorphisms in polymyalgia rheumatica. Clin Exp Rheumatol 2000; 18(6): 675–681.
7. Tarlow JK, Blakemore AI, Lennard A et al. Polymorphism in human IL-1 receptor antagonist gene intron 2 is caused by variable numbers of an 86-bp tandem repeat. Hum Genet 1993; 91(4): 403–404.
8. Coll-Vinent B, Vilardell C, Font C et al. Circulating soluble adhesion molecules in patients with giant cell arteritis. Correlation between soluble intercellular adhesion molecule-1 (sICAM-1) concentrations and disease activity. Ann Rheum Dis 1999; 58(3): 189–192.
9. Pulsatelli L, Meliconi R, Boiardi L et al. Elevated serum concentrations of the chemokine RANTES in patients with polymyalgia rheumatica. Clin Exp Rheumatol 1998; 16(3): 263–268.
10. Ceribelli A, Yao B, Dominguez-Gutierrez PR et al. MicroRNAs in systemic rheumatic diseases. Arthritis Res Ther 2011; 13(4): 229. Dostupné z DOI: <http://dx.doi.org/10.1186/ar3377>.
11. Furer V, Greenberg JD, Attur M et al. The role of microRNA in rheumatoid arthritis and other autoimmune diseases. Clinical Immunology 2010; 136(1): 1–15. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clim.2010.02.005>.
12. Hunter RG, McEwen BS. Stress and anxiety across the lifespan: structural plasticity and epigenetic regulation. Epigenomics 2013; 5(2): 177–194. Dostupné z DOI: <http://dx.doi.org/10.2217/epi.13.8>.
13. Razin A, Cedar H. DNA methylation and gene expression. Microbiol Rev 1991; 55(3): 451–458.
14. Bird HA, Esselinkx W, Dixon AS et al. An evaluation of criteria for Polymyalgia Rheumatica. Ann Rheum Dis 1979; 38(5): 434–439.
15. Mowat AG, Hazleman BL Polymyalgia rheumatica – a clinical study with particular reference to arterial disease. J Rheumatol 1984; 11(5): 580–581.
16. Cimmino MA, Caporali R, Montecucco CM et al. A seasonal pattern in the onset of polymyalgia rheumatica. Ann Rheum Dis 1990; 49(7): 521–523.
17. Kinmont PDC, McCollum DI. The aetiology, pathology and course of giant cell arteritis. The possible role of light sensitivity. Brit J Dermatol 1965; 77 : 193–202.
18. Chuang TY, Hunder GG, Ilstrup DM et al. Polymyalgia rheumatica: a 10 year epidemiologic and clinical study. Ann Intern Med 1982; 97(5): 672–680.
19. Smeeth L, Cook C, Hall AJ. Incidence of diagnosed polymyalgia rheumatica and temporal arteritis in the United Kingdom, 1990–2001. Ann Rheum Dis 2006; 65(8): 1093–1098. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2005.046912>.
20. Coomes EN, Ellis RM, Kay AG. A prospective study of 102 patients with the polymyalgia rheumatica syndrome. Rheumatology 1976; 15(4): 270–276.
21. Perfetto F, Moggi-Pignone A, Becucci A et al. Seasonal pattern in the onset of polymyalgia rheumatica. Ann Rheum Dis 2005; 64(11): 1662–1663. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2005.038901>.
22. Narvaez J, Clavaguera MT, Nolla-Sole JM et al. Lack of association between infection and onset of polymyalgia rheumatica. J Rheumatol 2000; 27(4): 953–957.
23. Bacon PA, Doherty SM, Zuckerman AJ. Hepatitis-B antibody in polymyalgia rheumatica. Lancet 1975; 2(7933): 476–478.
24. Bridgeford PH, Lowenstein M, Bocanegra TS et al. Polymyalgia rheumatica and giant cell arteritis: histocompatibility typing and hepatitis-B infection studies. Arthritis Rheum 1980; 23(4): 516–518.
25. Buchwald D, Sullivan JL, Leddy S et al. Chronic Ebstein-Barr virus infection’ syndrome and polymyalgia rheumatica. J Rheumatol 1988; 15(3): 479–482.
26. Gonzalez-Gay MA, Vasquez-Rodriguez TR, Lopez-Diaz MJ et al. Epidemiology of giant cell arteritis and polymyalgia rheumatica. Arthritis Rheum 2009; 61(10): 1454–1461. Dostupné z DOI: <http://dx.doi.org/10.1002/art.24459>.
27. Salvarani C, Cantini F, Boiardi L et al. Polymyalgia rheumatica and giant cell arteritis. N Eng J Med 2002; 347(4): 261–267. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra011913>.
28. Ross RT. From the Tadhkirat of Ali Ibn Isa of Baghdad (c 940–1010 AD) – an ancient description of what may be temporal arteritis. J Neurol Neurosurg Psychiatry 1988; 51(4): 528.
29. Calvo-Romero JM. Giant cell arteritis. Postgrad Med J 2003; 79(935): 511–515.
30. Mackie SL, Pease CT. Diagnosis and management of giant cell arteritis and polymyalgia rheumatica: challenges, controversies and practical tips. Postgrad Med J 2013; 89(1051): 284–292. Dostupné z DOI: <http://dx.doi.org/10.1136/postgradmedj-2012–131400>.
31. Salvarani C, Cantini F, Olivieri I et al. Proximal bursitis in active polymyalgia rheumatica. Ann Intern Med 1997; 127(1): 27–31.
32. Dasgupta B, Borg FA, Hassan N et al. BSR and BHPR guidelines for the management of polymyalgia rheumatica. Rheumatology 2010; 49(1): 186–190. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/kep303a>.
33. Dasgupta B, Salvarani C, Schirmer M et al. Members of the American College of Rheumatology Work Group for Development of Classification Criteria for PMR Development of classification criteria for polymyalgia rheumatica (PMR): results from an expert work group meeting and a wider survey. J Rheumatol 2008; 35(2): 270–277.
34. Hutchings A, Hollywood J, Lamping D et al. Clinical outcomes, quality of life and diagnostic uncertainty in the first year in polymyalgia rheumatica. Arthritis Rheum 2007; 57(5): 803–809. Dostupné z DOI: <http://dx.doi.org/10.1002/art.22777>.
35. Leeb BF, Bird HA, Nesher G et al. EULAR response criteria for polymyalgia rheumatica: results of an initiative of the European Collaborating Polymyalgia Rheumatica Group (subcommittee of ESCISIT). Ann Rheum Dis 2003; 62(12): 1189–1194.
36. Leeb BF, Bird HA. A disease activity score for polymyalgia rheumatica. Ann Rheum Dis 2004; 63(10): 1279–1283. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2003.011379>.
37. Leeb BF, Rintelen B, Sautner J et al. The polymyalgia rheumatica activity score in daily use: proposal for a definition of remission. Arthritis Rheum 2007; 57(5): 810–815. Dostupné z DOI: <http://dx.doi.org/10.1002/art.22771>.
38. Dasgupta B, Cimmino MA, Maradit-Kremers H et al. 2012 provisional classification criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis 2012; 71(4): 484–492. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2011–200329>.
39. Ortiz Z, Tugwell P. Raised ESR in polymyalgia rheumatica no longer a sine qua non. Lancet 1996; 348(9019): 4–5.
40. Gonzalez-Gay MA, Rodriguez-Valverde V, Blanco R et al. Polymyalgia rheumatica without significantly increased erythrocyte sedimentation rate: a more benign syndrome. Arch Int Med 1997; 157(3): 317–320.
41. Codreanu C, Enache L. Is ultrasound changing the way we understand rheumatology? Including ultrasound examination in the classification criteria of polymyalgia rheumatica and gout. Med Ultrason 2015; 17(1): 97–103. Dostupné z DOI: <http://dx.doi.org/10.11152/mu.2013.2066.171.ccle>.
42. Sakellariou G, Iagnocco A, Riente L et al. Ultrasound imaging for the rheumatologist. XLIII. Ultrasonographic evaluation of shoulders and hips in patients with polymyalgia rheumatica: a systematic literature review. Clin Exp Rheumatol 2013; 31(1): 1–7.
43. Klauser A, Demharter J, De Marchi A et al. Contrast enhanced gray-scale sonography in assessment of joint vascularity in rheumatoid arthritis: results from the IACUS study group. Eur Radiol 2005; 15(12): 2404–2410. Dostupné z DOI: <http://dx.doi.org/10.1007/s00330–005–2884–9>.
44. Klauser AS, De Zordo T, Bellmann-Weiler R et al. Feasibility of second-generation ultrasound contrast media in the detection of active sacroiliitis. Arthritis Rheum 2009; 61(7): 909–916. Dostupné z DOI: <http://dx.doi.org/10.1002/art.24648>.
45. Blockmans D, De Ceuninck L, Vanderscheueren S et al. Repetitive 18-fluorodeoxyglucose positron emission tomography in isolated polymyalgia rheumatica: a prospective study in 35 patients. Rheumatology 2007; 46(4): 672–677. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/kel376>.
46. Salvarani C, Pipitone N, Versari A et al. Clinical features of polymyalgia rheumatica and giant cell arteritis. Nat Rev Rheumatol 2012; 8(9): 509–521. Dostupné z DOI: <http://dx.doi.org/10.1038/nrrheum.2012.97>.
47. Yamashita H, Kubota K, Takahashi Y et al. Whole-body fluorodeoxyglucose positron emission tomography/computed tomography in patients with active polymyalgia rheumatica: evidence for distinctive bursitis and large vessel vasculitis. Mod Rheumatol 2012; 22(5): 705–711. Dostupné z DOI: <http://dx.doi.org/10.1007/s10165–011–0581-x>.
48. Rehak Z, Vasina J, Nemec P et al. Various forms of 18F-FDG PET and PET/CT findings in patients with polymyalgia rheumatica. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159(4): 629–636. Dostupné z DOI: <http://dx.doi.org/10.5507/bp.2015.026>.
49. Lopez-Hoyos M, Ruiz de Alegria C, Blanco R et al. Clinical utility of anti-CCP antibodies in the differential diagnosis of elderly-onset rheumatoid arthritis and polymyalgia rheumatica. Rheumatology (Oxford) 2004; 43(5): 655–657. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/keh143>.
50. Muller S, Hider SL, Belcher J et al. Is cancer associated with polymyalgia rheumatica? A cohort study in the General Practice Research Database. Ann Rheum Dis 2014; 73(10): 1769–1773. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2013–203465>.
51. Ji J, Liu X, Sundquist K et al. Cancer risk in patients hospitalized with polymyalgia rheumatica and giant cell arteritis: a follow-up study in Sweden. Rheumatology (Oxford) 2010; 49(6): 1158–1163. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/keq040>.
52. Dejaco C, Singh YP, Perel P et al. 2015 Recommendations for the management of polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Ann Rheum Dis 2015; 74(10): 1799–1807. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2015–207492>.
53. Duru N, van der Goes MC, Jacobs JWG et al. EULAR evidence-based and consensus-based recommendations on the management of medium to high-dose glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis 2013; 72(12): 1905–1913. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2013–203249>.
54. Grossman JM, Gordon R, Ranganath VK et al. American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Care Res (Hoboken) 2010; 62(11): 1515–1526. Dostupné z DOI: <http://dx.doi.org/10.1002/acr.20295>. Erratum inArthritis Care Res (Hoboken) 2012; 64(3): 464.
55. Van der Goes MC, Jacobs JWG, Boers M et al. Monitoring adverse events of low-dose glucocorticoid therapy: EULAR recommendations for clinical trials and daily practice. Ann Rheum Dis 2010; 69(11): 1913–1919. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2009.124958>.
56. Hoes JN, Jacobs JWG, Boers M et al. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis 2007; 66(12): 1560–1567. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2007.072157>.
57. Dasgupta B, Dolan AL, Panayi GS et al. An initially double-blind controlled 96 week trial of depot methylprednisolone against oral prednisolone in the treatment of polymyalgia rheumatica. Br J Rheumatol 1998; 37(2): 189–195.
58. Caporali R, Cimmino MA, Ferraccioli G et. Prednisone plus methotrexate for polymyalgia rheumatica: a randomized, double-blind, placebo-controlled trial. Ann Intern Med 2004; 141(7): 493–500.
59. Van der Veen MJ, Dinant HJ, van Booma-Frankfort C et al. Can methotrexate be used as a steroid sparing agent in the treatment of polymyalgia rheumatica and giant cell arteritis? Ann Rheum Dis 1996; 55(4): 218–223. Erratum in Ann Rheum Dis 1996; 55(8): 563.
60. Ferraccioli G, Salaffi F, De Vita S et al. Methotrexate in polymyalgia rheumatica: preliminary results of an open, randomized study. J Rheumatol 1996; 23(4): 624–628.
61. Nazarinia AM, Moghimi J, Toussi J. Efficacy of methotrexate in patients with polymyalgia rheumatica. Koomesh 2013; 14(3): 265–270.
62. Devauchelle V, Berthelot JM, Cornec D et al. Efficacy of first-line tocilizumab therapy in early polymyalgia rheumatica: a prospective longitudinal study. Ann Rheum Dis 2016; 75(8):1506–1510. Dostupné z DOI: <http://doi: 10.1136/annrheumdis-2015–208742>.
63. Lally L, Forbess L, Hatzis C et al. Brief Report: A Prospective Open-Label Phase IIa Trial of Tocilizumab in the Treatment of Polymyalgia Rheumatica. Arthritis Rheumatol 2016; 68(10): 2550–2554. Dostupné z DOI: <http://dx.doi.org/10.1002/art.39740>.
64. Hancock AT, Mallen CD, Muller S et al. Risk of vascular events in patients with polymyalgia rheumatica. CMAJ 2014; 186(13): E495-E501. Dostupné z DOI: <http://dx.doi.org/10.1503/cmaj.140266>.
65. Kremers HM, Reinalda MS, Crowson CS et al. Direct medical costs of polymyalgia rheumatica. Arthritis Rheum 2005; 53(4): 578–584. Dostupné z DOI: <http://dx.doi.org/10.1002/art.21311>.
66. Warrington KJ, Jarpa EP, Crowson CS et al. Increased risk of peripheral arterial disease in polymyalgia rheumatica: a population-based cohort study. Arthritis Res Ther 2009; 11(2): R50. Dostupné z DOI: <http://dx.doi.org/10.1186/ar2664>.
67. González-Gay MA, Garcia-Porrua C, Vazquez-Caruncho M et al. The spectrum of polymyalgia rheumatica in northwestern Spain: incidence and analysis of variables associated with relapse in a 10 year study. J Rheumatol 1999; 26(6): 1326–1332.
68. Narváez J, Nolla-Sole JM, Clavaguera MT et al. Long-term therapy in polymyalgia rheumatica: effect of coexistent temporal arteritis. J Rheumatol 1999; 26(9): 1945–1952.
69. Hutchings A, Hollywood J, Lamping DL et al. Clinical outcomes, quality of life, and diagnostic uncertainty in the first year of polymyalgia rheumatica. Arthritis Rheum 2007; 57(5): 803 - 809. Dostupné z DOI: <http://dx.doi.org/10.1002/art.22777>.
70. Kremers HM, Reinalda MS, Crowson CS et al. Relapse in a population based cohort of patients with polymyalgia rheumatica. J Rheumatol 2005; 32(1): 65–73.
71. Myklebust G, Gran JT. Prednisolone maintenance dose in relation to starting dose in the treatment of polymyalgia rheumatica and temporal arteritis: a prospective two-year study in 273 patients. Scand J Rheumatol 2001; 30(5): 260–267.
72. Salvarani C, Cantini F, Niccoli L et al. Acute-phase reactants and the risk of relapse/recurrence in polymyalgia rheumatica: a prospective follow-up study. Arthritis Rheum 2005; 53(1): 33–38. Dostupné z DOI: <http://dx.doi.org/10.1002/art.20901>.
73. Cimmino MA, Parodi M, Caporali R et al. Is the course of steroid-treated polymyalgia rheumatica more severe in women? Ann NY Acad Sci 2006; 1069 : 315–321. Dostupné z DOI: <http://dx.doi.org/10.1196/annals.1351.030>.
74. Dasgupta B, Dolan AL, Panayi GS et al. An initially double-blind controlled 96-week trial of depot methylprednisolone against oral prednisolone in the treatment of polymyalgia rheumatica. Br J Rheumatol 1998; 37(2): 189–195.
75. Gabriel SE, Sunku J, Salvarani C et al. Adverse outcomes of antiinflammatory therapy among patients with polymyalgia rheumatica. Arthritis Rheum 1997; 40(10): 1873–1878. Dostupné z DOI: <http://dx.doi.org/10.1002/1529–0131(199710)40 : 10<1873::AID-ART22>3.0.CO;2-V>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2018 Číslo 2- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Biologická léčba psoriatické artritidy
- Život ohrožující projevy systémového lupusu a antifosfolipidového syndromu ve vnitřním lékařství
- Systémová sklerodermie v roce 2017
- Idiopatické zánětlivé myopatie
- Nové trendy v monitorování a léčbě ANCA asociovaných vaskulitid
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
- Polymyalgia rheumatica
- Léčba k cíli u dnavé artritidy
- Nutraceutika v terapii gonartrózy: pohled ortopeda
- Osteoporóza a kvalita kostní hmoty
- Léčba chronické bolesti u zánětlivých revmatických onemocnění
- Revmatologie a vnitřní lékařství
- Revmatoidní artritida
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Axiální spondylartritida
- Využitie MRI vyšetrenia pri diagnostike axiálnej spondylartritídy
- Idiopatické zánětlivé myopatie
- Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



