-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam autologní transplantace u mnohočetného myelomu
The importance of autologous transplantation in multiple myeloma
Several randomized clinical trials in multiple myeloma (MM) completed in the last two decades have clearly shown that high-dose chemotherapy with hematopoietic stem cell support significantly increases the number of complete remissions and median overall survival in comparison to conventional chemotherapy. The median survival of MM patients treated with conventional chemotherapy is approximately 4 years in contrast to 5 to 6 years with autologous transplantation. Although high-dose chemotherapy with autologous transplantation is not curative and most patients will eventually relapse, more than 20% of patients treated using this strategy experience survival longer than 10 years. Thus, autologous transplantation is the preferred treatment option for all eligible patients with MM.
Key words:
multiple myeloma – autologous transplantation – long-term results
Autoři: L. Pour 1; R. Hájek 1,2; Z. Adam 1; M. Krejčí 1; J. Vorlíček 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Vorlíček, CSc. 1; Babákův výzkumný institut, Výzkumné pracoviště MU Brno a FN Brno, vedoucí centra prof. MUDr. Roman Hájek, CSc. 2
Vyšlo v časopise: Vnitř Lék 2009; 55(9): 767-772
Kategorie: 80. narozeniny prof. MUDr. Miloše Štejfy, DrSc., FESC, člena redakční rady časopisu Vnitřní lékařství
Souhrn
Od 90.
let 20. století bylo prokázáno několika randomizovanými klinickými studiemi, že vysokodávkovaná chemoterapie s podporou autologní transplantace hematopoetických buněk u nemocných s mnohočetným myelomem (MM) významně zvyšuje počet kompletních remisí a prodlužuje průměrné přežití ve srovnání se standardní chemoterapií. Nemocní s MM léčení konvenční chemoterapií mají medián přežití kolem 4 let, pacienti léčení autologní transplantací mají medián přežití 5–6 let. Nejedná se o kurativní léčebný postup, neboť u většiny nemocných dochází k relapsu onemocnění. Tato léčebná možnost však nabízí více než 20 % pacientů s MM přežití delší než 10 let. Dnes patří použití autologní transplantace mezi základní léčebné postupy u všech vhodných nemocných.Klíčová slova:
mnohočetný myelom – autologní transplantace – dlouhodobé výsledkyÚvod
Mnohočetný myelom (MM) je maligníklonální B-lymfoproliferativní onemocnění, charakterizované infiltrací kostní dřeně patologickými plazmocyty, osteolytickými ložisky skeletu a přítomností monoklonálního imunoglobulinu(MIG) v séru a/nebo v moči. V České republice je incidence MM 4/100 000 oby-vatel. Medián věku při stanovení diagnózy je 65 let [1].
Etiologie MM je nejasná a patogeneze je multifaktoriální proces. Podle diagnostických kritérií z roku 2003 je pro symptomatický MM nutná přítomnost klonálních nádorových plazmocytů v kostní dřeni, průkaz monoklonálního imunoglobulinu v séru a/nebo v moči a přítomnost některého z kritérií poškození tkání či orgánů myelomem: hyperkalcemie (C), renální insuficience (R), anémie (A), kostní postižení (B). Tato kritéria jsou označována zkratkou CRAB [34]. Naplnění některého z kritérií CRAB je pro lékaře jasným důvodem pro zahájení léčby.
Léčba je indikována u pacientů se symptomatickým MM. V léčbě je používána kombinovaná chemoterapie, skládající se z kortikoidů, alkylačních cytostatik, antracyklinů a nových léků (thalidomid, bortezomib a lenalidomid). Důležitou roli hraje od 90. let 20. století použití myeloblativní vysokodávkované chemoterapie s podporou krvetvorných hematopoetických buněk, tzv. autologní transplantace (AT). Provedení AT je indikováno u pacientů s MM bez přítomnosti jiného závažného onemocnění zpravidla do věku 65 let věku v rámci první léčebné linie [1]. Nemocní s MM léčení konvenční chemoterapií mají medián přežití kolem čtyř let, pacienti léčení AT mají medián přežití 5–6 let. Nejedná se o kurativní léčebný postup, neboť u většiny nemocných dochází k relapsu onemocnění. Tato léčebná možnost však nabízí více než 20 % pacientů s MM přežití delší než 10 let [3]. Autologní transplantace je v dnešní době považována za zlatý standard pro všechny vhodné nemocné do 60–70 let dle zvyklostí jednotlivých pracovních skupin. Léčba obvykle obsahuje vysokou myeloablativní dávku melfalanu 200 mg/m2, nejčastěji bez další alkylační látky a bez radioterapie. Vysokodávkovaná chemoterapie je obvykle podávána po dostatečné cytoredukci. Kmenové buňky z periferní krve jsou sbírány po stimulační chemoterapii a aplikaci leukocytárních růstových faktorů.
Vysokodávkové myeloablativní režimy pro autologní transplantace
Většina center ve světě podává vysokou dávku melfalanu (200 mg/m2 – MEL 200) v monoterapii, která se dnes považuje za etalon vysokodávkových režimů u MM. Některá centra přidávala k chemoterapii i celotělové ozáření, to však zvyšovalo toxicitu léčby, ale nezlepšovalo její výsledky [41]. Analýzy z registru EBMT [12] i výsledky randomizované klinické studie IFM 9502 potvrzují výhody použití melfalanu. Ve studii IFM 9502 bylo randomizováno celkem 282 nemocných do dvou skupin: MEL 200 mg/m2 vs MEL 140 mg/m2 + TBI (total body irradiation) 8 Gy. V rameni MEL 200 bylo signifikantně kratší přihojení štěpu, menší nutnost podání transfuzí a kratší doba hospitalizace a signifikantně nižší četnost těžké mukozitidy. Doba do relapsu se nelišila (21,0 vs 20,5 měsíce; p = 0,6), ale celkové přežití s mediánem sledování 45 měsíců bylo lepší v rameni s MEL 200 (65,8 % vs 45,5 %; p = 0,05) [45].
Byla zkoušena řada kombinací melfalanu s jinými cytostatiky [2,11,18,49]. V současnosti není k dispozici žádná práce prokazující lepší výsledky s menší toxicitou než režim MEL 200. Eskalace dávky melfalanu je možná, ale riziko mukozitidy se zvyšuje. Nicméně dosud chybí důkaz lepší léčebné účinnosti dávky vyšší než 200 mg/m2.
Srovnání autologní transplantace s konvenční léčbou
O přínosu AT oproti konvenční léčbě svědčí dlouhodobé výsledky 5 rando-mizovaných klinických studií (fran-couzské IFM 90, americké US INT, španělské Pethema, anglické MRC 7a francouzské MAG 91). Ve všech studiích byly výsledky AT lepší. Její zařazení přineslo při zkrácení doby léčení ve většině studií (4 z 5) významně vyšší počet dosažených kompletních remisí, významně delší dobu do relapsu onemocnění ve 3 z 5 studií a významně delší celkové přežití ve 2 z 5 klinických studií [4,10,13,24,33].
Za zdůraznění stojí fakt, že ne ve všech randomizovaných klinických studiích byl prokázán její přínos na celkové přežití. V některých studiích však např. byli z randomizace vyřazeni nemocní rezistentní na vstupní indukční léčbu, což následně ovlivnilo výsledky [10,13]. Zásadní přínos pro prodloužení remise potvrzuje i metaanalýza randomizovaných studií provedená u celkem 2 411 nemocných Korethem et al v roce 2007. Prokázala prodloužení doby do relapsu při použití AT oproti konvenční léčbě, ne však vliv na celkové přežití. Rovněž bylo prokázáno, že z AT mají přínos i nemocní s rezistentní nemocí po konvenční indukční léčbě [36]. Zjednodušeně je možné souhlasit s tvrzením, že nejintenzivnější konvenční chemoterapie podávaná 12 měsíců (např. ve studii US INT) má podobné dlouhodobé výsledky jako jednoduchá indukční léčba zakončená AT trvající šest měsíců [10]. Přesto je všeobecně upřednostňována AT, zejména pro prodloužení doby do relapsu a přínosu pro rezistentní nemocné na konvenční indukční primoléčbu a další výhody:
- Provedení AT je velmi bezpečné a schůdné pro drtivou většinu nemocných.
- Léčba trvá kratší dobu (šest měsíců včetně indukční fáze) ve srovnání s konveční léčbou, která trvá zpravidla 8–12 měsíců.
- Kratší expozice lékům znamená menší šanci indukce na kumulativní dávce závislé toxicity léků, jakou je např. neuropatie indukovaná vinkristinem a thalidomidem [29].
- Archivované krvetvorné hematopoetické buňky zamražené při vstupním sběru mohou být s výhodou použity jak pro účel opakování AT [39], tak k rekonstrukci hematopoézy v případě potřeby a k akutnímu řešení agresivních až fulminantních relapsů provázených hlubokou pancytopenií, kde bychom jinak mohli podat jen kortikoidy.
- Použití tzv. „mini AT“ s dávkou melfalanu 100 mg/m2 je stále jednou z nejúčinnějších variant léčby starších nemocných s odstupem řady let od první AT použité v primoléčbě (viz níže).
Použití tandemové autologní transplantace
Použití jedné či dvou AT (tzv. tandemové AT) bylo řešeno v 5 randomizovaných klinických studiích [3,18,25,26,51]. Výsledky tandemové AT byly lepší v případě léčebné odpovědi ve 3 (IFM 94, Bologna a HOVON) z 5 studií, v prodloužení doby do relapsu ve 3 (IFM 94, Bologna a GMMG) z 5 studií a v prodloužení celkového přežití ve 2 (IFM 94, MAG 95) z 5 studií. Data z největší z těchto studií s 399 zařazenými nemocnými potvrzují zásadní přínos tandemové AT pro podskupinu nemocných, kteří nedosáhli po provedení první AT velmi dobré léčebné odpovědi (VGPR) [32]. Podrobně uvedeno v tab. 1.
Tab. 1. Randomizované studie porovnávající provedení jednoduché a tandemové transplantace. 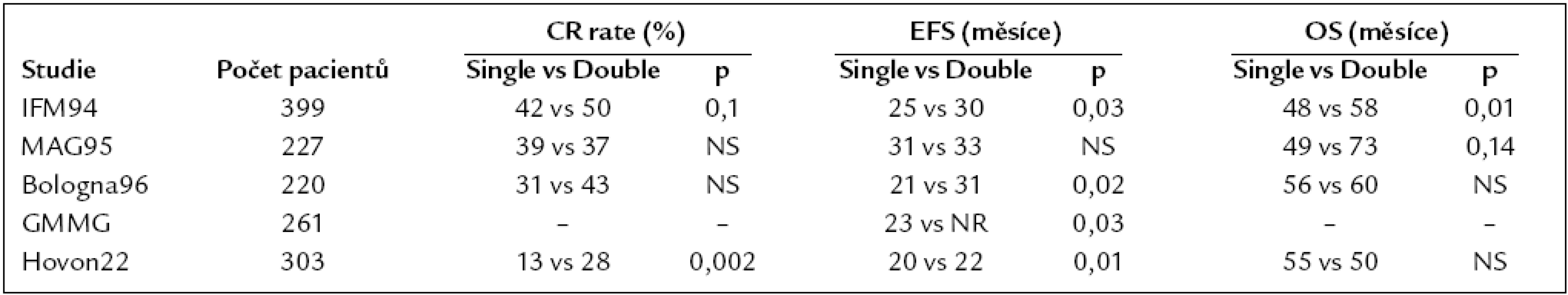
Ani dvě AT nevedou k dalšímu zásadnímu prodloužení klidového období. V případě relapsu po delším klidovém období lze přitom AT účinně opakovat [39]. Randomizovaná studie, srovnávající účinek transplantace provedené buď ihned po dosažení první remise, nebo až při prvním relapsu, neprokázala rozdíl v celkovém přežití. Prokázala však delší trvání první remise při použití této léčebné modality tandemovým způsobem, tj. do šesti měsíců od provedení první AT [25]. U prognosticky nepříznivé skupiny nemocných není tandemová AT přínosem [32]. Závěrem lze konstatovat, že na základě výše uvedených výsledků je provedení tandemové AT plně indikované u nemocných, u kterých není dosaženo VGPR po první AT, a na základě průběhu první AT nejsou na místě důvodné obavy, že průběh časné druhé (tandemové) AT bude mít pro nemocného vysoké riziko TRM a dalších komplikací.
Režimy s nižší dávkou melfalanu (100 mg/m2) vhodné pro seniory
Nad 70 let je použití standardní AT s MEL 200 vysoce rizikové s TRM až 16 % [6]. Subanalýza studie IFM 90 porovnávající konvenční léčbu oproti AT s použitím MEL 200 nepotvrdila přínos AT u pacientů nad 65 let [31]. Podobný trend byl popsán v rozsáhlé populační studii u 657 analyzovaných nemocných [42].
Alternativou předtransplantačního režimu s 200 mg/m2 melfalanu jsou režimy s nižší dávkou melfalanu (100 až140 mg/m2), které jsou vhodné jak pro seniory, tak i pro nemocné s orgánovým poškozením, které neumožňuje podání plné dávky a rovněž pro opakovanou transplantaci u nemocného, který mezitím dosáhl vyššího věku. Nejvíce prozkoumaným režimem je melfalan 100 mg/m2 (MEL 100). V randomizované studii se 194 nemocnými prokázala italská skupina přínos AT s dávkou 2krát MEL 100 oproti režimu melfalan + prednison u nemocných nad 65 let [48]. Signifikantně byly zlepšeny všechny klíčové parametry: near CR 6 % vs 25 % (p = 0,0002), doba do relapsu ve třech letech 16 % vs 37 % a celkové přežití 62 % vs 77 % (p < 0,001). Podstatné bylo, že zlepšení bylo průkazné i ve skupině od 65 do 70 let (medián celkového přežití 37,2 vs 58,0 měsíce). Ve studii IFM 99–06 dosáhl režim 2krát 100 mg/m2 melfalanu s podporou periferních kmenových buněk vyššího počtu léčebných odpovědí oproti standardnímu režimu melfalan + prednison (PR 71 % vs 34 %), ale ne však již oproti režimu MP s přidáním thalidomidu (MPT) (PR 71 % vs 84 %) [23]. Autologní transplantace s redukcí dávky melfalanu MEL 100 může být využita při retransplantaci seniorů, u pacientů v těžkém stavu a pacientů s poškozením orgánů. Použití AT s režimem MEL 100 pro seniory jako léčebné možnosti první volby není upřednostněno, neboť méně zatěžující léčebnou modalitou s lepšími výsledky je využití kombinovaných režimů s novými léky, např. thalidomidu nebo bortezomibu v kombinaci s klasickým režimem melfalan a prednison [27].
Autologní transplantace po indukční léčbě obsahující nové léky
V současné době probíhá optimalizace indukčních režimů s použitím nových léků i u nemocných indikovaných k autologní transplantaci.Vzhledem k době používání nových léků nejsou zatím známy údaje týkající se dlouhodobé prognózy pacientů a hodnocení je možné pouze podle dosažených léčebných odpovědí. V prospektivní randomizované studii HOVON-50/GMMG-HD3 byli noví pacienti s MM léčeni buď indukčním režimem TAD (thalidomide, doxorubicin, dexametazon), nebo konvenčním režimem VAD (vincristine, adriamycin, dexametazon). Do první analýzy bylo zařazeno celkem 402 pacientů. Po ukončení indukční léčby bylo dosaženo alespoň parciální remise (PR) u více pacientů zařazených do ramene TAD než v rameni VAD (72 % vs 54 %, p < 0,001). Po provedení autologní transplantace s přípravným režimem melfalan 200 mg/m2 bylo u pacientů zařazených do ramene TAD dosaženo kompletní remise (CR) a VGPR statisticky signifikantně ve vyšším počtu (49 % vs 32 %, p < 0,001) [43]. Studie IFM 2005/01 fáze II porovnávala indukční režim Velcade + dexametazon s konvenčním VAD. Po indukci a následovala autologní transplantace s přípravným režimem melfalan 200 mg/m2. Do studie bylo zařazeno celkem 482 pacientů. U pacientů léčených indukčním režimem Vel/Dex bylo dosaženo jednoznačně lepších léčebných odpovědí, a to před i po autologní transplantaci (tab. 2). Podání konsolidace DCEP nezvýšilo léčebnou odpověď [30]. Dnes je známo, že krátkodobé použití nových léků, thalidomidu a bortezomibu, nepoškozuje kmenové buňky, předchází-li stimulaci. Sběr kmenových buněk je bezproblémový podobně jako časné přihojení štěpu [7,15,30].
Tab. 2. Porovnání léčebných odpovědí po indukci a autologní transplantaci v rameni s konvenční léčbou a Velcade. 
Udržovací léčba po autologní transplantaci
Udržovací léčba interferonem a není v současnosti doporučována [10], přínos této léčby není zásadní a zásadní procento pacientů je postiženo nežádoucími účinky léčby.
Přínos thalidomidu v udržovací léčbě po AT prokázala studie na 597 nemocných, kteří podstoupili dvě AT. Pacienti bez progrese nemoci po transplantaci byli rozděleni do následujících tří skupin: A – žádná udržovací léčba, B – aplikace 90 mg pamidronátu ve 4týdenních intervalech, C – aplikace 90 mg pamidronátu ve 4týdenních intervalech a denní aplikace thalidomidu. Pacienti užívající thalidomid měli signifikantně delší dobu bezpříznakového a celkového přežití. Z udržovací léčby thalidomidem měla přínos jen podskupina nemocných, jejichž léčebná odpověď po AT byla menší než VGPR (tab. 3) [3]. Studie tuniských autorů porovnávala přínos druhé AT oproti udržovací léčbě thalidomidem. Do studie bylo zařazeno celkem 195 nemocných, kteří po primoléčbě thalidomidem a dexametazonem absolvovali autologní transplantaci s přípravným režimem MEL 200 mg/m2. Po transplantaci byli pacienti randomizováni do dvou ramen: A – tandemová AT, B – udržovací léčba thalidomidem v dávce 100 mg denně. Při mediánu sledování 33 měsíců bylo 3leté celkové přežití vyšší v rameni s thalidomidem (65 % vs 85 %; p = 0,04) stejně jako 3leté přežití bez progrese (85 % vs 57 %; p = 0,02). V rameni s udržovací léčbou thalidomidem bylo rovněž dosaženo statisticky signifikantně většího počtu léčebných odpovědí typu CR a VGPR (p = 0,04) [16].
Tab. 3. Porovnání přežití u skupiny pacientů bez udržovací léčby (skupina A), s udržovací léčbou pamidronátem (skupina B) a udržovací léčbou pamidronátem a thalidomidem (skupina C). 
Krátkodobá konsolidační léčba thalidomidem ne delší než jeden rok je v současnosti doporučovaným postupem pro pacienty, kteří nedosáhli VGPR po autologní transplantaci. Ale dlouhodobé podávání thalidomidu je asi u 2/3 pacientů spojeno s nežádoucími účinky, které zásadním způsobem ovlivňují kvalitu života. Optimální udržovací či konvenční léčba po autologní transplantaci není doposud známa. Nadějná se zdá být krátkodobá konsolidace pomocí kombinace nových léků, která může dále zlepšit a prodloužit léčebnou odpověď [10,32].
Dlouhodobé výsledky režimů s použitím autologní transplantace
Zavedení AT zásadně zlepšilo dlouhodobé přežití nemocných s MM mladších 65 let. V analýze provedené Brennerem et al je sledován trend prodloužení celkového přežití nemocných s MM v období 2002–2004 oproti období 1990–1992. Odhad zlepšení celkového přežití v 10 letech je 17,4 % vs 11,1 % pacientů. Zcela zásadní je zlepšení celkového přežití ve skupině pod 50 let (41,3 %) a 50–59 let (28,6 %). V kontrastu s tím ve skupině 60–69 let a 70–79 let je zlepšení přežití v 10 letech výrazně nižší (15 % a 10 %) a nad 80 let nebylo pozorováno oproti období 1990–1992 již zlepšení žádné [16]. Podobný trend pro věkové skupiny do 60 let jsme pozorovali i v naší analýze zaměřené na ČR a jednoznačně jsme je přisuzovali celoplošnému rozšíření AT transplantace v ČR v polovině 90. let minulého tisíciletí [28].
Dosažení maximální léčebné odpovědi, nejlépe kompletní remise, je jedním z klíčových cílů léčebné strategie. Má zásadní opodstatnění, které lze podpořit řadou publikovaných analýz, z nichž nejdůležitější je vliv na dlouhodobé přežití. Autoři analyzovali vliv dosažení kompletní remise (CR) u nemocných podstupující AT v metaanalýze 21 studií a dat od 4 990 nemocných. Pozitivní korelace mezi maximální léčebnou odpovědí a celkovým přežitím (p < 0,00001) a podobně i dobou do relapsu byla jednoznačná a vztahovala se na léčebnou odpověď jak po AT, tak i před AT v prospektivních i retrospektivních studiích provedené metaanalýzy [53]. Podobných výsledků bylo dosaženo i u pacientů léčených v brněnském centru CMG, kteří byly zároveň zařazeny do výše uvedené metaanalýzy (38). Nakonec uvádíme i zcela mimořádná data z dlouhodobého sledování klinické studie Total Therapy I z Arkansasu s mediánem sledování 12 let. Srovnatelné údaje pro 10leté přežití jsou: doba do relapsu – 15 % nemocných, celkové přežití 33 % [10]. Je zcela zjevné, že 10leté přežití nemocných se při použití AT zásadně zlepší oproti konvenční léčbě (asi 5 %) a dosáhne u nemocných mladších 65 let spolu se zavedením nových léků více než 20 %.
Závěr
Autologní transplantace má za sebou více než 20letou historii. U mnohočetného myelomu se ukázala být mimořádně účinnou léčebnou modalitou a dnes patří mezi klasické postupy. Autologní transplantace by měla být součástí primární léčebné strategie u pacienta s nově diagnostikovaným onemocněním ve věku do 65 let. Optimálním předtransplantačním režimem je melfalan 200 mg/m2. Tandemová AT by měla být použita u nemocných, kteří nedosáhli po první AT velmi dobré léčebné odpovědi a její průběh byl nekomplikovaný. Podobně účinnou variantou jako druhá AT u těchto nemocných je i udržovací léčba thalidomidem, která podle randomizované studie tuniských autorů dokonce účinnější. Udržovací léčba po AT by měla být podávána pouze pacientům, kteří nedosáhli alespoň VGPR. Konvenční udržovací léčba ani léčba interferonem nevede k zásadnímu zlepšení prognózy nemocných. Naproti tomu krátkodobá udržovací léčba thalidomidem je pro nemocné zásadním přínosem.
Pacienti ve věku 65–75 let mohou být také vhodnými kandidáty pro AT s využitím melfalanu v dávce redukované na 100 mg/m2 podaném 1krát či 2krát krátce po sobě. Nicméně zavedením nových léků do primoléčby MM tento postupně ztrácí na významu. Zavedení AT přineslo zásadní zkrácení léčby a rovněž tak zásadní prodloužení dlouhodobých výsledků. Bez vlivu nových léků je dlouhodobé přežití (> 10 let) nemocných podstupujících AT nad 20 %. V současné době probíhá optimalizace indukčních režimů s použitím nových léků i u nemocných indikovaných k AT. Ty obsahující thalidomid nebo bortezomid vykazují výrazně lepší léčebné odpovědi než klasický indukční režim VAD. Dosažení kompletní remise po autologní transplantaci je významným prognostickým faktorem a tito pacienti mají výrazně lepší přežití oproti pacientům ostatním. Je tedy na místě očekávání dalšího zásadního zlepšení dlouhodobých výsledků léčby u nemocných s mnohočetným myelomem.
Tato práce vznikla za podpory výzkumného záměru MSM0021622434, výzkumného centra LC06027, projektů IGA.
MUDr. Luděk Pour
www.fnbrno.cz
e-mail: l.pour@fnbrno.cz
Doručeno do redakce: 16. 7. 2009
Zdroje
1. Adam Z, Bačovský J, Flochová E et al. Diagnostika a léčba mnohočetného myelomu. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a experty Slovenské republiky pro diagnostiku a léčbu mnohočetného myelomu. Transfúze Hematol Dnes 2005; 1 (Suppl 1): 3–51.
2. Anagnostopoulos A, Aleman A, Ayers Get al. Comparison of high-dose melphalan with a more intensive regimen of thiotepa, busulfan, and cyclophosphamide for patients with multiple myeloma. Cancer 2004; 100 : 2607–2612.
3. Attal M, Harousseau JL, Facon T et al. InterGroupe Francophone du Myélome: Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med 2003; 349 : 2495–2502.
4. Attal M, Harousseau JL, Stoppa AM et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Français du Myélome. N Engl J Med 1996; 335 : 91–97.
5. Badros A, Barlogie B, Siegel E et al. Autologous stem cell transplantation in elderly multiple myeloma patients over the age of 70 years. Br J Haematol 2001; 114 : 600–607.
6. Badros A, Barlogie B, Siegel E et al. Results of autologous stem cell transplant in multiple myeloma patients with renal failure. Br J Haematol 2001; 114 : 822–829.
7. Barlogie B, Anaissie E, van Rhee F et al. Incorporating bortezomib into upfront treatment for multiple myeloma: early results of total therapy 3. Br J Haematol 2007; 138 : 176–185.
8. Barlogie B, Hall R, Zander A et al. High-dose melphalan with autologous bone marrow transplantation for multiple myeloma. Blood 1986; 67 : 1298–1301.
9. Barlogie B, Kyle RA, Anderson KC et al. Standard chemotherapy compared with high-dose chemoradiotherapy for multiple myeloma: final results of phase III US Intergroup Trial S9321. J Clin Oncol 2006; 24 : 929–936.
10. Barlogie B, Tricot GJ, van Rhee F et al. Long-term outcome results of the first tandem autotransplant trial for multiple myeloma. Br J Haematol 2006; 135 : 158–164.
11. Benson DM Jr, Elder PJ, Lin TS et al. High-dose melphalan versus busulfan, cyclophosphamide, and etoposide as preparative regimens for autologous stem cell transplantation in patients with multiple myeloma. Leuk Res 2007; 31 : 1069–1075.
12. Björkstrand B. European Group for Blood and Marrow Transplantation Registry studies in multiple myeloma. Semin Hematol 2001; 38 : 219–225.
13. Bladé J, Rosiñol L, Sureda A et al. Programa para el Estudio de la Terapéutica en Hemopatía Maligna (PETHEMA). High-dose therapy intensification compared with continued standard chemotherapy in multiple myeloma patients responding to the initial chemotherapy: long-term results from a prospective randomized trial from the Spanish cooperative group PETHEMA. Blood 2005; 106 : 3755–3759.
14. Bourhis JH, Bouko Y, Koscielny S et al. European Group for Blood and Marrow Transplantation. Relapse risk after autologous transplantation in patients with newly diagnose myeloma is not related with infused tumor cell load and the outcome is not improved by CD34+ cell selection: long term follow-up of an EBMT phase III randomized study. Haematologica 2007; 92 : 1083–1090.
15. Breitkreutz I, Lokhorst HM, Raab MS et al. Thalidomide in newly diagnosed multiple myeloma: influence of thalidomide treatment on peripheral blood stem cell collection yield. Leukemia 2007; 21 : 1294–1299.
16. Brenner H, Gondos A, Pulte D. Recent major improvement in long-term survival of younger patients with multiple myeloma. Blood 2008; 111 : 2521–2526.
17. Carreras E, Rosiñol L, Terol MJ et al. Spanish Myeloma Group/PETHEMA: Veno-occlusive disease of the liver after high-dose cytoreductive therapy with busulfan and melphalan for autologous blood stem cell transplantation in multiple myeloma patients. Biol Blood Marrow Transplant 2007; 13 : 1448–1454.
18. Cavo M, Tosi P, Zamagni E et al. Prospective, randomized study of single compared with double autologous stem-cell transplantation for multiple myeloma: Bologna 96 clinical study. J Clin Oncol 2007; 25 : 2434–2441.
19. Cavo M, Zamagni E, Tosi P et al. Bologna 2002 study. Superiority of thalidomide and dexamethasone over vincristine-doxorubicin dexamethasone (VAD) as primary therapy in preparation for autologous transplantation for multiple myeloma. Blood 2005; 106 : 35–39.
20. Craiu A, Saito Y, Limon A et al. Flowing cells through pulsed electric fields efficiently purges stem cell preparations of contaminating myeloma cells while preserving stem cell function. Blood 2005; 105 : 2235–2238.
21. Deola S, Scaramuzza S, Birolo RS et al. Molecular purging of multiple myeloma cells by ex-vivo culture and retroviral transduction of mobilized-blood CD34+ cells. J Transl Med 2007; 5 : 35.
22. Durie BG, Salmon SE. A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. Cancer 1975; 36 : 842–852.
23. Facon T, Mary JY, Hulin C et al. Intergroupe Francophone du Myélome. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced-intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99–06): a randomised trial. Lancet 2007; 370 : 1209–1218.
24. Fermand JP, Katsahian S, Divine M et al. Group Myelome-Autogreffe. High-dose therapy and autologous blood stem-cell transplantation compared with conventional treatment in myeloma patients aged 55 to 65 years: long-term results of a randomized control trial from the Group Myelome-Autogreffe. J Clin Oncol 2005; 23 : 9227–9233.
25. Fermand JP, Ravaud P, Chevret S et al. High-dose therapy and autologous peripheral blood stem cell transplantation in multiple myeloma: up-front or rescue treatment? Results of a multicenter sequential randomized clinical trial. Blood 1998; 92 : 3131–3136.
26. Goldschmidt H. Single vs. double high-dose therapy in multiple myeloma: Second analysis of the GMMG–HD2 trial. Haematologica 2005; 90 (Suppl 1): 38.
27. Hajek R, Krejci M, Krivanova A et al. Salvage treatment with melphalan 100 mg/m2 in fulminant progression of multiple myeloma. Haematologica 2007; 2 (Suppl 1). Abstract 262.
28. Hájek R, Pour L, Krejčí M et al. Elektronická forma parametrické registrace dat pro klinický výzkum v praxi v onkologii – případová studie myelomy. Klin Onkol 2004(Suppl): 73–78.
29. Hájek R, Maisnar V, Krejčí M. Thalidomid. Klin Farmakol Farm 2005; 19 : 43–46.
30. Harousseau JL, Attal M, Leleu X et al. Bortezomib plus dexamethasone as induction treatment prior to autologous stem cell transplantation in patients with newly diagnosed multiple myeloma: results of an IFM phase II study. Haematologica 2006; 91 : 1498–1505.
31. Harousseau JL, Attal M. High-dose therapy in multiple myeloma. Hematol J 2003; 4 : 163–170.
32. Harousseau JL. Stem cell transplanta-tion in multiple myeloma (0, 1, or 2). Curr Opin Oncol 2005; 17 : 93–98.
33. Child JA, Morgan GJ, Davies FE et al. High-dose chemotherapy with hematopoietic stem-cell rescue for multiple myeloma. N Engl J Med 2003; 348 : 1875–1883.
34. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 2003; 121 : 749–757.
35. Jantunen E. Autologous stem cell transplantation beyond 60 years of age. Bone Marrow Transplant 2006; 38 : 715–720.
36. Koreth J, Cutler CS, Djulbegovic B et al. High-dose therapy with single autologous transplantation versus chemotherapy for newly diagnosed multiple myeloma: A systematic review and meta-analysis of randomized controlled trials. Biol Blood Marrow Transplant 2007; 13 : 183–196.
37. Krejci M, Buchler T, Hajek R et al. Prognostic factors for survival after autologous transplantation: a single centre experience in 133 multiple myeloma patients. Bone Marrow Transplant 2005; 35 : 159–164.
38. Krejci M, Hajek R, Adam Z et al. Significant improvement of long-term survival after autologous transplantation in multiple myeloma patients: a single centre experience. Bone Marrow Transplant 2008; 41 (Suppl 1). Abstract 1358.
39. Krivanova A, Hajek R, Krejci M et al. Czech Myeloma Group. Second autologous transplantation for multiple myeloma patients relapsing after the first autograft – a pilot study for the evaluation of experimental maintenance therapies. Report of the prospective non-randomized pilot study of the Czech Myeloma Group. Onkologie 2004; 27 : 275–279.
40. Kuglík P, Filková H, Oltová A et al. The significance and current diagnostic options of cytogenetic changes in multiple myeloma. Vnitř Lék 2006; 52 (Suppl 2): 76–78.
41. Lahuerta JJ, Martinez-Lopez J, Grande Cet al. Conditioning regimens in autologous stem cell transplantation for multiple myeloma: a comparative study of efficacy and toxicity from the Spanish Registry for Transplantation in Multiple Myeloma. Br J Haematol 2000; 109 : 138–147.
42. Lenhoff S, Hjorth M, Westin J et al. Nordic Myeloma Study Group. Impact of age on survival after intensive therapy for multiple myeloma: a population-based study by the Nordic Myeloma Study Group. Br J Haematol 2006; 133 : 389–396.
43. Lokhorst HM, Schmidt-Wolf I, Sonneveld P et al. Dutch-Belgian HOVON; German GMMG.: Thalidomide in induction treatment increases the very good partial response rate before and after high-dose therapy in previously untreated multiple myeloma. Haematologica 2008; 93 : 124–127.
44. McElwain TJ, Powles RL. High-dose intravenous melphalan for plasma-cell leukaemia and myeloma. Lancet 1983; 2 : 822–824.
45. Moreau P, Facon T, Attal M et al. Intergroupe Francophone du Myélome. Comparison of 200 mg/m2 melphalan and 8 Gy total body irradiation plus 140 mg/m2 melphalan as conditioning regimens for peripheral blood stem cell transplantation in patients with newly diagnosed multiple myeloma: final analysis of the Intergroupe Francophone du Myélome 9502 randomized trial. Blood 2002; 99 : 731–735.
46. Moreau P, Hullin C, Garban F et al. Intergroupe Francophone du Myélome group. Tandem autologous stem cell transplantation in high-risk de novo multiple myeloma: final results of the prospective and randomized IFM 99–04 protocol. Blood 2006; 107 : 397–403.
47. Palumbo A, Bringhen S, Caravita T et al. Italian Multiple Myeloma Network, GIMEMA. Oral melphalan and prednisone chemotherapy plus thalidomide compared with melphalan and prednisone alone in elderly patients with multiple myeloma: randomised controlled trial. Lancet 2006; 367 : 825–831.
48. Palumbo A, Bringhen S, Petrucci MT et al. Intermediate-dose melphalan improves survival of myeloma patients aged 50 to 70: results of a randomized controlled trial. Blood 2004; 104 : 3052–3057.
49. Ria R, Falzetti F, Ballanti S et al. Melphalan versus melphalan plus busulphan in conditioning to autologous stem cell transplantation for low-risk multiple myeloma. Hematol J 2004; 5 : 118–122.
50. San Miguel JF, Schlag R, Khuageva N et al. MMY-3002 A Phase 3 Study Comparing Bortezomib-Melphalan-Prednisone (VMP) with Melphalan-Prednisone (MP) in Newly Diagnosed Multiple Myeloma. Blood 2007; 110 : 31a. Abstract 76.
51. Sonneveld P, van der Holt B, Segeren Cet al. Intensive versus double intensive therapy in untreated multiple myeloma. Update analysis of the randomized phase III HOVON 24 study. Haematologica 2005; 90 (Suppl 1): 37–38.
52. Stewart AK, Vescio R, Schiller G et al. Purging of autologous peripheral-blood stem cells using CD34 selection does not improve overall or progression-free survival after high-dose chemotherapy for multiple myeloma: results of a multicenter randomized controlled trial. J Clin Oncol 2001; 19 : 3771–3779.
53. van de Velde HJ, Liu X, Chen G et al. Complete response correlates with long-term survival and progression-free survival in high-dose therapy in multiple myeloma. Haematologica 2007; 92 : 1399–1406.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2009 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
-
Prof. MUDr. Miloš Štejfa, DrSc., FESC
(*28. 5. 1929) - Zamyšlení nad interno u
- Myokarditidy
- Transplantace srdce
- Kombinační léčba hypertenze blokátory osy renin-angiotenzin
- Hladiny cholesterolu v závislosti na věku
- Echokardiografie u nemocných s ischemickou chorobou srdeční
- Transplantace krvetvorných buněk
- Chronická B-lymfatická leukemie a jí podobné stavy
- Význam autologní transplantace u mnohočetného myelomu
- Jaterní cirhóza a její léčba
- Chirurgická léčba plicní embolie
- Nejčastější chlopenní vady srdce: aortální stenóza a mitrální regurgitace. Několik poznámek ke guidelines a k doporučením kardiologických společností
- Diabetes a vaskulárne poškodenie
- Tako-tsubo kardiomyopatie
- Snížení obsahu soli v potravě – opomíjený postup v prevenci a léčbě hypertenze v populaci
- Léčit, či neléčit nemocné s chronickým srdečním selháním statiny?
- Jak zlepšit odpověď na srdeční resynchronizační léčbu?
- Kontrola kardiovaskulárních rizikových faktorů u diabetiků 2. typu
- Prediabetes – 2009
- Některé současné názory na chronickou ischemickou srdeční chorobu
- Cílové hodnoty léčby hypertenze. Budou platit i u starších hypertoniků, diabetiků a u pacientů s ICHS?
- AT1-blokátory u arteriální hypertenze
- Konsenzuální stanovisko k poskytování paliativní péče u nemocných s nezvratným orgánovým selháním
-
XVI. kongres České internistické společnosti ČLS J. E. Purkyně
Praha, 13.–16. 9. 2009
-
Prof. MUDr. Miloš Štejfa, DrSc., FESC
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hladiny cholesterolu v závislosti na věku
- Chronická B-lymfatická leukemie a jí podobné stavy
- Jaterní cirhóza a její léčba
- Transplantace krvetvorných buněk
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



