-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Synchrónna nádorová duplicita neuroendokrinného tumoru Meckelovho divertikla s metastázami do pečene a kolorektálneho karcinómu
Synchronous tumor duplicity of a neuroendocrine tumor of Meckel’s diverticulum with liver metastases and colorectal carcinoma
Introduction: Meckel’s diverticulum (MD) is a developmental abnormality and a true diverticulum of the small intestine which can give rise to a malignant tumor. Neuroendocrine tumors (NETs) are the most common tumors arising in MD, but due to the prevalence of MD and its malignancy rate, there is no uniform guideline regarding these tumors. Recent knowledge shows that their biological behavior is aggressive and unrelated to size. Their behavior resembles that of an ileal NET.
Case report: A 62-year-old male was examined for enterorrhagia, and an adenocarcinoma of the ascending colon was diagnosed along with multiple liver lesions that resembled metastases. Needle biopsy of a liver lesion was performed and showed the lesions to be NET metastases of unknown origin. Treatment with somatostatin analogs was commenced, and because of the patient’s anemization a right hemicolectomy was indicated, during which a normal Meckel’s diverticulum was found and resected. Histological evaluation of MD confirmed a moderately differentiated NET.
Conclusion: Surgery is the primary modality for treating MD, including cases in which MD is asymptomatic and found incidentally during surgery for other causes. In the case of NET of MD, a radical surgical treatment is needed because of the risk of early metastatic dissemination. When liver metastases are present, an aggressive approach combining surgical and systemic treatment is recommended to improve the prognosis of the disease.
Keywords:
Meckel’s diverticulum – neuroendocrine tumor – prophylactic resection – liver metastases – tumor duplicity
Autoři: B. Tolmáči 1; J. Klein 1,2; P. Žuffa 1; M. Pospíšková 3; A. Řehulková 1,4; M. Piter 1
Působiště autorů: Chirurgické oddělení, Krajská nemocnice T. Bati, Zlín 1; Fakulta zdravotníctva, Trenčianská Univerzita Alexandera Dubčeka, Trenčín 2; Onkologické oddělení, Krajská nemocnice T. Bati, Zlín 3; Ústav molekulární a translační medicíny Lékařské fakulty Univerzity Palackého v Olomouci 4
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 9, s. 452-458.
Kategorie: Kazuistika
doi: https://doi.org/10.33699/PIS.2021.100.9.452–458Souhrn
Úvod: Meckelov divertikel (MD) je vývojovou abnormalitou a pravým divertiklom tenkého čreva, ktorý môže byť miestom vzniku zhubného nádoru. Najčastejšími tumormi MD sú neuroendokrinné tumory (NET), pričom jednoznačné odporučenie k riešeniu týchto nádorov v tejto lokalite vzhľadom k prevalencii MD a častosti nádorového bujnenia v ňom neexistuje. Posledné poznatky však ukazujú, že ich biologické chovanie je agresívne, nezávislé od veľkosti a svojim chovaním pripomínajú NET ilea.
Kazuistika: Prezentujeme prípad 62 ročného pacienta vyšetrovaného pre enterorágiu, u ktorého bol v rámci diagnostiky nájdený adenokarcinóm vzostupného hrubého čreva a viacpočetné ložiská pečene vzhľadu metastáz. Punkčná biopsia ložísk pečene zistila, že sa nejedná o metastázy kolorektálneho karcinómu, ale o metastázy NET nejasného origa. Nasadená bola liečba analógmi somatostatínu a pre anemizáciu pacienta sa vykonala pravostranná hemikolektómia, pri ktorej bol peroperačným nálezom Meckelov divertikel bez makroskopických známok patológie. MD bol zresekovaný a pri histologickom vyšetrení sa v ňom diagnostikoval stredne diferencovaný NET.
Záver: Chirurgická terapia je základnou modalitou liečby MD, a to aj v prípade asymptomatickej formy nájdenej peroperačne pri výkone z inej indikácie. Pri náleze NET v MD je nutné radikálne chirurgické riešenie pre riziko skorého metastatického šírenia, pri metastatickom postihnutí pečene sa pre zlepšenie prognózy takisto odporúča agresívny prístup s kombináciou chirurgickej a systémovej liečby.
Klíčová slova:
Meckelov divertikel – neuroendokrinný tumor – profylaktická resekcia – metastázy pečene – nádorová duplicita
ÚVOD
Meckelov divertikel predstavuje najčastejšiu vrodenú abnormalitu gastrointestinálneho traktu. V populácii má predpokladanú prevalenciu medzi 0,3 % až 2,9 %, štyrikrát častejšie sa vyskytuje u mužov [1]. Ide o pozostatok omfaloenterického duktu, ktorý zaniká v priebehu ôsmeho embryonálneho týždňa. Prvýkrát ho opísal Fabricius Hildanus v roku 1598, názov má však podľa nemeckého anatóma Johanna Friedricha Meckela, ktorý objasnil jeho embryonálny pôvod v roku 1809. Neuzavretie omfaloenterického duktu ústi do vzniku viacerých abnormalít. V 90 % ide o vznik MD, ktorý môže mať spojenie s umbilikom alebo mezentériom. Medzi ďalšie abnormality patrí omfalomezenterická fistula, enterocysta alebo vznik fibrózneho zväzku spájajúceho črevo s umbilikom [2]. Lokalizácia MD v rámci tenkého čreva je variabilná, väčšinou sa nachádza vo vzdialenosti 7–200 cm od ileocekálnej chlopne, priemerne vo vzdialenosti 52 cm [1].
Väčšina MD je celý život asymptomatických, udáva sa, že hodnota celoživotných komplikácii je 4 % [2]. Častokrát sa MD nájde náhodne pri autopsii, operácii z inej indikácie alebo pri zobrazovacom vyšetrení. Viac ako 50 % symptomatických MD sa prejaví u detí mladších ako 10 rokov. Väčšinu komplikácii spôsobuje ektopické žalúdočné tkanivo v MD alebo prítomnosť adhézii, či už umbilikálnych alebo mezodivertikulárnych. Najčastejšie sa symptomatické MD prejavujú krvácaním, obštrukciou, divertikulitídou a v neposlednom rade príznakmi spojenými s prítomnosťou tumoru [2]. Malígne zmeny pozorujeme priemerne v 6. decéniu života, vyskytujú sa s incidenciou medzi 0,5–3,2 % [3]. Upravené riziko výskytu zhubného nádoru v MD je 70× vyššie ako v ktorejkoľvek inej ileálnej lokalite, čo z tohto pravého divertiklu robí „hot-spot“, čiže vysokorizikovú oblasť pre onkogenézu v tenkom čreve [4]. Najčastejšie sa v MD vyskytujú neuroendokrinné tumory (86 %), potom adenokarcinómy (6,8 %) a gastrointestinálne stromálne tumory (5,6 %) [5].
KAZUISTIKA
62 ročný muž, diabetik 2. typu liečený intenzifikovaným inzulínovým režimom a perorálnymi antidiabetikami, hypertonik, s anamnézou gastroezofageálneho refluxu a chronickej renálnej insuficiencie na podklade nefroangiosklerózy, bol prijatý na interné oddelenie našej nemocnice pre anamnesticky udávanú melénu. Pri prijatí bol bez klinických známok krvácania do gastrointestinálneho traktu, laboratórne bez poklesu v červenej krvnej rade, hodnota hemoglobínu bola pri prijatí 135 g/l, hematokrit 39,4. Za hospitalizácie sa opakovane vyskytla enterorágia s poklesom hemoglobínu na 113 g/l, hematokrit 33,0. Gastroskopické vyšetrenie bolo s fyziologickým nálezom. Sigmoideoskopické vyšetrenie do vzdialenosti 70 cm nenašlo patológiu, na transabdominálnom ultrazvukovom vyšetrení bol nález ložiskovitého postihnutia pečene. Ďalej sa doplnilo pankolonoskopické vyšetrenie, kde bol vo vzdialenosti asi 130 cm od anu nález plošnej, centrálne exulcerovanej lézie v rozsahu približne jednej tretiny obvodu hrubého čreva, bez stenózy jeho lumen. Histologické vyšetrenie popísalo dobre diferencovaný tubulopapilárny adenokarcinóm. Vyšetrenie počítačovou tomografiou (CT) s podaním kontrastnej látky nešlo previesť kvôli elevácii kreatinínu. V rámci stagingu sa preto doplnilo natívne CT vyšetrenie trupu a malej panvy, kde nebola tumorózna expanzia hrubého čreva jednoznačne diferencovaná, zobrazili sa zväčšené mezenteriálne lymfatické uzliny a zmnožené retroperitoneálne lymfatické uzliny. Pre detailnejší popis pečeňových ložísk sa doplnila magnetická rezonancia (MR) pečene v natívnom režime a s kontrastnou látkou primovist, podľa ktorej sú v oboch lalokoch pečene prítomné difúzne mnohopočetné metastázy veľkosti do 25 mm.
Vzhľadom k výsledkom vyšetrení indikoval onkológ I. líniu paliatívnej chemoterapie v režime leukovorín, 5-fluorouracil, irinotekán (FOLFIRI), s redukciou irinotekánu na 70 % s ohľadom na chronickú renálnu insuficienciu a podľa stavu mutácie RAS génu s pridaním anti-EGFR liečby. V rezoch bioptických vzoriek z pankolonoskopického vyšetrenia nebol dostatok reprezentatívneho nádorového tkaniva na vyšetrenie mutácie KRAS + NRAS + BRAF. Opakovala sa preto kolonoskopia s odberom biopsie, v týchto vzorkách ale bola zastihnutá iba ťažká dysplázia bez nálezu invazívneho nádoru. Onkológ indikoval punkčnú biopsiu z ložísk pečene k vyšetreniu požadovaných genetických mutácií, ktorá ukázala, že sa v skutočnosti jedná o stredne diferencovaný metastatický neuroendokrinný tumor (hodnota proliferačného indexu Ki-67 bola 8,11 %). Pri imunohistochemickom vyšetrení bol pozitívny CDX2, chromogranín A a CD56. Pozitivita CDX2 ukázala, že tumor vychádzal z gastrointestinálneho traktu.
Kolonoskopické a gastroskopické vyšetrenia sa s časovým odstupom zopakovali, obe vylúčili primum neuroendokrinného tumoru v žalúdku, dvanástniku a hrubom čreve. Laboratórne bola hodnota chromogranínu A nad 770 μg/l (referenčná hodnota <102 μg/l) a takisto zvýšený odpad 5-hydroxyindoloctovej kyseliny v 24 hodinovom zbere moči, s hodnotou 512 μmol (referenčná hodnota 25–50 μg/l). Pri cielenom dotaze pacient udával vyššiu frekvenciu stolíc, bolo teda pomýšľané na karcinoidový syndróm a začala sa terapia analógmi somatostatínu v dávke Sandostatín 120 mg subkutánne každé 3−4 týždne. Takisto sa naplánovalo vyšetrenie octreotidovým scanom v rámci stagingu a určeniu primárneho ložiska neuroendokrinného tumoru.
Pre opakovanú anemizáciu pacienta bol adenokarcinóm hrubého čreva indikovaný k chirurgickej resekcii. Pri výkone sa vlastný tumor nachádzal v oblasti hepatálnej flexúry. Vykonala sa pravostranná hemikolektómia s peroperačnou revíziou dutiny brušnej, pri ktorej sa našiel Meckelov divertikel veľkosti 1,5x5 cm, makroskopicky bez patológie, ktorý bol transverzálne zresekovaný pri jeho báze. Vyšetrenie žalúdka, zbytku hrubého a tenkého čreva nenašlo ďalšiu patológiu, potvrdil sa masívny metastatický rozsev pečene. Pooperačný priebeh bol bez pozoruhodností, pacient bol prepustený do ambulantnej starostlivosti 10. pooperačný deň.
Definitívne histologické vyšetrenie hrubého čreva popísalo infiltráciu dobre diferencovaným tubulopapilárnym adenokarcinómom, pričom tunica muscularis hrubého čreva bola intaktná. Vyšetrilo sa celkovo 20 lymfatických uzlín, všetky bez metastatického postihnutia. Histologické vyšetrenie Meckelovho divertiklu odhalilo stredne diferencované ložisko neuroendokrinného tumoru veľkosti 10x10 mm lokalizované od tunica mucosa po tunica muscularis. Tento neuroendokrinný tumor najskôr predstavoval primárne ložisko, ktoré spôsobilo vznik mnohopočetných metastatických ložísk v pečeni.
Plánovaný Octreoscan už po 4 hodinách po aplikácii rádiofarmaka zobrazil mnohopočetnú patologickú ložiskovú depozíciu rádiofarmaka v parenchýme oboch lalokov zväčšenej pečene. Vyšetrenie po 24 hodinách od aplikácie ukázalo ďalšiu depozíciu rádiofarmaka v oblasti hlavy pankreasu či duodena, tento nález bol bez CT korelátu.
U pacienta pokračuje aplikácia analógov somatostatínu, kolorektálny karcinóm je vzhľadom k štádiu bez ďalšej liečby, s pravidelnými dispenzárnymi vyšetreniami. Subjektívne pacient pociťuje intermitentný abdominálny dyskomfort a má občasné hnačkovité stolice s odchodom stolice dva až trikrát za deň.
DISKUSIA
Neuroendokrinné tumory patria do skupiny neuroendokrinných nádorov (NEN), čo je značne rôznorodá skupina tumorov pochádzajúca z buniek difúzneho neuroendokrinného systému. Väčšina NEN sa vyskytuje v gastrointestinálnom trakte a pankrease, preto sa používa názov gastroenteropankreatické neuroendokrinné nádory (GEP-NEN) [6]. NET sú najčastejším primárnym nádorom tenkého čreva, najčastejším miestom výskytu je apendix a následne posledných 60 cm ilea [3].
Klasifikácia GEP-NEN je založená na morfologickej charakteristike a rozsahu proliferácie. WHO klasifikácia z roku 2019 rozdeľuje GEP-NEN na dobre diferencované GEP-NET grade 1 – 3 a zle diferencované gastroenteropankreatické karcinómy (GEP-NEC), ktoré sú vždy grade 3 [7] (Tab. 1).
Tab. 1. WHO 2019 klasifikácia pre gastroenteropankreatické NEN [8]
Tab. 1: WHO 2019 classification for gastroenteropancreatic NENs [8]![WHO 2019 klasifikácia pre gastroenteropankreatické NEN [8]<br>
Tab. 1: WHO 2019 classification for gastroenteropancreatic NENs [8]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1ddc4b99b44b4cd02aae72c468d05b54.png)
Vysvětlivky: WHO − Svetová zdravotnícka organizácia; NEN − neuroendokrinná neoplázia; NET − neuroendokrinný tumor; NEC − neuroendokrinný karcinóm; MiNEN − zmiešaná neuroendokrinno–ne-neuroendokrinná neoplázie; a – mitotická aktivita je určená spočítaním 50 polí o veľkosti 0,2 mm2; hodnota Ki-67 proliferačného indexu je určená spočítaním minimálne 500 buniek v „hot-spot“ regiónoch; finálny grade sa určuje podľa toho, ktorý z týchto dvoch proliferačných indexov je vyšší; b – pri väčšine MiNEN sú obe komponenty zle diferencované, ale do úvahy prichádza možnosť, že jedna alebo obe komponenty môžu byť dobre diferencované a preto by mali byť obe komponenty hodnotené samostatne.
Notes: WHO − World Health Organization; NEN − neuroendocrine neoplasm; NET− neuroendocrine tumor; NEC− neuroendocrine carcinoma; MiNEN− mixed neuroendocrine–non-neuroendocrine neoplasm; a – mitotic rate is determined by counting in 50 fields of 0.2 mm2; Ki-67 proliferation index value is determined by counting at least 500 cells in hot spot regions; the final grade is based on whichever of the two proliferation indexes places the neoplasm in the higher-grade category; b – in most MiNENs both of the components are poorly differentiated, but there is a possibility that one or both components may be well differentiated, therefore both components should be graded separately.GEP-NET môžu byť rozdelené na funkčné a nefunkčné subtypy podľa sekrécie hormónov a peptidov. Funkčné tumory sú pomaly rastúce a morbidita sa často odvíja od vylučovaného hormónu alebo hormónov. Nefunkčné tumory bývajú agresívnejšie a prejavy vyplývajú často z nádorovej masy [9]. Najčastejšie vylučovanými hormónmi pri tenkočrevných NET patrí substancia P a sérotonín [3].
Symptómy tenkočrevných NET môžu byť intermitentné bolesti brucha, gastrointestinálne krvácanie či obštrukcia. V prípade funkčných NET môže byť prítomný typický karcinoidový syndróm (záchvaty kožného flushu, hnačka, astmatické záchvaty s bronchospazmom, kardiálne lézie). Karcinoidový syndróm sa objavuje pri 20 % tenkočrevných NET, pričom 45 % pacientov s karcinoidovým syndrómom má pokročilé ochorenie s pečeňovými metastázami [3]. Karcinoidový syndróm má u pacientov s NET v MD približne rovnakú incidenciu ako pri tenkočrevných NET [10].
Z hľadiska diagnostiky a stagingu GEP-NEN je hlavnou modalitou CT vyšetrenie. Magnetická rezonancia predstavuje alternatívu k CT vyšetreniu, medzi jej výhody patrí najmä presnejšie zobrazenie pečeňových a pankreatických lézií a zobrazovanie kostných a mozgových metastáz. Súčasťou stagingu, preoperatívneho zobrazovania a restagingu by mala byť celotelová scintigrafia somatostatínových receptorov pomocou SPECT/CT (Octreoscan) alebo senzitívnejšia metóda využívajúca pozitrónovú emisnú tomografiu s 68Galiom (68Ga-DOTA-TOC PET/CT). Obidve tieto metódy nukleárnej medicíny sú založené na prítomnosti somatostatínových receptorov, ktoré u menej diferencovaných nádorov či NEC môžu chýbať. V prípade absencie somatostatínových receptorov sa môže uplatniť PET vyšetrenie s deoxyglukózou značenou rádioaktívnym fluórom (FDG-PET/CT vyšetrenie) [6, 7]. Hormóny a peptidy produkované GEP-NEN môžu byť v rámci diagnostiky využité ako biomarkery. Najjednoduchším je vyšetrenie hladiny hydroxyindoloctovej kyseliny v 24 hodinovom zbere moči, ktoré sa využíva hlavne pri diagnostike karcinoidového syndrómu [11]. Chromogranín A, prípadne aj NSE a v moči kyselina hydroxyindoloctová, sa u tenkočrevných NET využívajú aj v rámci dispenzarizácie po kuratívnych či nekuratívnych výkonoch [7].
Základom liečby lokálneho a lokoregionálneho ochorenia pri NET G1 a G2 tenkého čreva je chirurgia. Pri funkčných NET má pred akoukoľvek intervenciou prednosť riešiť klinické symptómy [7]. Tenkočrevné NET majú vysoký malígny potenciál, preto je zlatým štandardom makroskopická radikálna resekcia s radikálnou mezenteriálnou lymfadenektómiou, a to aj pri nádoroch menších ako 1 cm [11]. Za dostatočný počet uzlín pre vykonanie radikálnej lymfadenektómie sa považuje vyšetrenie najmenej ôsmich uzlín [7], avšak Chen et al. podľa analýzy údajov zo SEER (Surveillance, Epidemiology, and End Results Program) odporúča na zlepšenie prežívania resekciu aspoň dvanástich uzlín [12]. Okrem dostatočnej radikality výkonu je takisto peroperačne nutná dôkladná revízia tenkého čreva, keďže u 25%−30 % pacientov sa popisuje mnohopočetný výskyt tenkočrevných NET [6]. Neoadjuvantná terapia nie je u NEN indikovaná [6]. Adjuvantná chemoterapia na báze platiny môže byť zvážená u pacientov s NEC [7].
Kvôli agresívnej povahe tenkočrevných NET dochádza k metastázovaniu do pečene pomerne rýchlo, ale charakteristický je pomalý rast metastáz a prispôsobovanie pečeňového parenchýmu k ich rastu. Z biologickej povahy metastáz NET a širokých možností multimodálnej liečby vyplýva opodstatnenosť nielen kuratívnych resekcií, ale aj paliatívnych cytoredukčných výkonov [11]. K cytoredukčným výkonom patria embolizačné techniky: transarteriálna embolizácia (TAE) alebo chemoembolizácia (TACE), rádioembolizácia (SIRT), termoablačné techniky ako rádiofrekvenčná ablácia (RFA) alebo mikrovlnná ablácia (MWA). Embolizačné a ablačné výkony možno podľa potreby opakovať [13]. Chirurgická liečba a resekcia pečene sú metódou voľby, hoci v manažmente metastáz NET sa v špeciálnych prípadoch uplatňuje aj transplantácia pečene [11]. V medikamentóznej liečbe lokálne pokročilých a metastatických NET sa používajú analógy somatostatínu, interferón alfa, terapia rádioaktívnymi izotopmi (PRRT), biologická liečba a hlavne pri menej diferencovaných nádoroch aj chemoterapeutické režimy [13]. Výber a sekvencia všetkých vyššie uvedených prostriedkov k liečbe pokročilého ochorenia sú štandardizované, avšak najčastejším postupom je ten, že pre NET G1 a G2 sa v prvej línii používa somatostatínový analóg, pri progresii možno indikovať PRRT. Ak nie je dostupná, potom sa v druhej línii volí kombinácia somatostatínového analógu s interferónom alfa alebo somatostatínového analógu s everolimom. V tretej línii je vhodné zvážiť cytostatiká (režim temodal, kapecitabin) alebo PRRT. Interferón alfa možno použiť ako primárnu liečbu neakumulujúcich NET G1 a G2 bez karcinoidového syndrómu. Pre NEN G3, to znamená NET aj NEC, sa ihneď pristupuje k liečbe založenej na platinovom deriváte a etoposide, s možnosťou nasadiť streptozotocín a 5-fluorouracil ako liečbu druhej línie [14] (Schéma 1).
Schéma 1: Chirurgický prístup pri tenkočrevných NET [7]
Diagram 1: Surgical approach in small intestinal NETs [7]![Schéma 1: Chirurgický prístup pri tenkočrevných NET [7]<br>
Diagram 1: Surgical approach in small intestinal NETs [7]](https://pl-master.mdcdn.cz/media/image_pdf/cba0fab1390fc423a2e849a836e26633.png?version=1632569217)
Vysvětlivky: NET − neuroendokrinný tumor; RECIST− response evaluation criteria in solid tumours.
* Pomalý rast tumoru je podľa RECIST kritérií definovaný ako stabilné ochorenie po dobu dlhšiu ako jeden rok.
** Na zváženie iba v špecifických prípadoch: hlavne pri funkčných tumoroch, pri chýbaní extrahepatického ochorenia, dobre diferencovaných NET (G1 –G2, Ki-67 <10 %), predošlom odstránení primárneho tumoru, metastatickej difúzii <50 % celkového objemu pečene, stabilné ochorenie so systémovou terapiou aspoň šesť mesiacov pred transplantáciou, vek menej ako 60 rokov.
Notes: NET− neuroendocrine tumour; RECIST− response evaluation criteria in solid tumours;
* Slow tumour growth is defined as stable disease by RECIST criteria (for >1 year).
** To be considered only in exceptional cases (particularly in functioning tumours) in the absence of extrahepatic disease, well-differentiated NET (G1–G2, Ki-67 <10%), previous removal of primary tumour, metastatic diffusion <50% of the total liver volume, stable disease on medical therapies for at least 6 months before transplantation, age <60 years.V posledných dekádach pozorujeme nárast incidencie tumorov spojených s MD [5]. NET sú najčastejšími tumormi takisto v ďalšom pravom divertikle gastrointestinálneho traktu, v apendixe, v ktorom majú pri veľkosti menšej ako 2 cm nízky metastatický potenciál, a preto sú často riešené jednoduchou apendektómiou [15]. NET v MD však vykazujú omnoho agresívnejšie chovanie, čo popisuje Dogeas et al., ktorý retrospektívne analyzoval údaje 280 pacientov s NET v MD, pričom zistil, že aj keď boli uzlinové metastázy spojené s väčšími tumormi s vyšším T štádiom, tak 26,5 % tumorov menších ako 1 cm malo prítomné uzlinové metastázy. Takisto popisuje, že prítomnosť dobre diferencovaných tumorov nevylučovala možnosť výskytu uzlinových metastáz [5]. Lorenzen et al. [10] referuje o siedmich pacientov s NET v MD, z ktorých šesť pacientov malo uzlinové metastázy, u troch pacientov bol pritom tumor menší ako 2 cm. Štyria pacienti mali v čase stanovenia diagnózy prítomné aj pečeňové metastázy. Poncet et al. [16] popisuje osem prípadov NET v MD. Päť pacientov malo metastázy v mezenteriálnych lymfatických uzlinách a traja pečeňové metastázy. Všetky tumory nad 1 cm, okrem jedného, mali regionálne alebo vzdialené metastázy.
Neexistuje konsenzus ohľadom terapie NET v MD, odporúčania nie sú uvedené ani v „guidelineoch“ pre manažment GEP-NEN [7]. Podľa súčasných poznatkov sa má pre zvýšenie prežívania pri NET v MD postupovať rovnako ako pri tenkočrevných NET. Pri lokálnom a lokoregionálnom ochorení to znamená nutnosť radikálneho výkonu s adekvátnou lymfadenektómiou (minimálne ôsmich lymfatických uzlín) a to aj pri tumoroch menších ako 1 cm. V prípade nášho pacienta sa lymfadenektómia nevykonala primárne a ani v druhej dobe kvôli prítomnosti mnohopočetných a chirurgicky radikálne neriešiteľných pečeňových metastáz.
Dlhodobou bola otázka profylaktickej resekcie asymptomatického MD náhodne objaveného peroperačne. Spočiatku sa profylaktická resekcia neodporúčala. Niektorí autori začali resekciu postupne indikovať v prípade rizikových faktorov, akými je napríklad MD prichytený adhéziami, zhrubnutá stena MD alebo jeho úzka báza. Analyzovaním dát z väčších súborov pacientov sa ukázalo, že riziko rozvoja komplikácii MD s vekom neklesá, prínos incidentálnej divertikulektómie prevyšuje pooperačnú morbiditu a mortalitu a preto sa odporúča profylaktická resekcia MD [2,16,17]. Pri možnej prítomnosti tumoru v MD je lepšie zvoliť klinovitú resekciu alebo až segmentálnu resekciu aj s resekciou príslušného mezentéria, transverzálnu divertikulektómiu je lepšie použiť v prípade absencie rizikových faktorov a negatívneho peroperačného vyšetrenia vrátane palpácie bázy divertiklu. Alternatívou k otvorenému prístupu pri resekčných výkonoch u MD je laparoskopický prístup, pri ktorom však v prípade profylaktickej resekcie chýba možnosť priameho vyšetrenia a tým teda kompletného zhodnotenia rizikových faktorov [16] (Obr. 1).
Obr. 1. Typy resekčných výkonov Meckelovho divertiklu: 1A−1B – transverzálna divertikulektómia; 2A–2B – klinovitá resekcia; 3A–3B – segmentálna resekcia
Fig. 1. Types of resection for Meckel’s diverticulum: 1A−1B – transversal diverticulectomy; 2A−2B – wedge resection; 3A−3B – segmental resection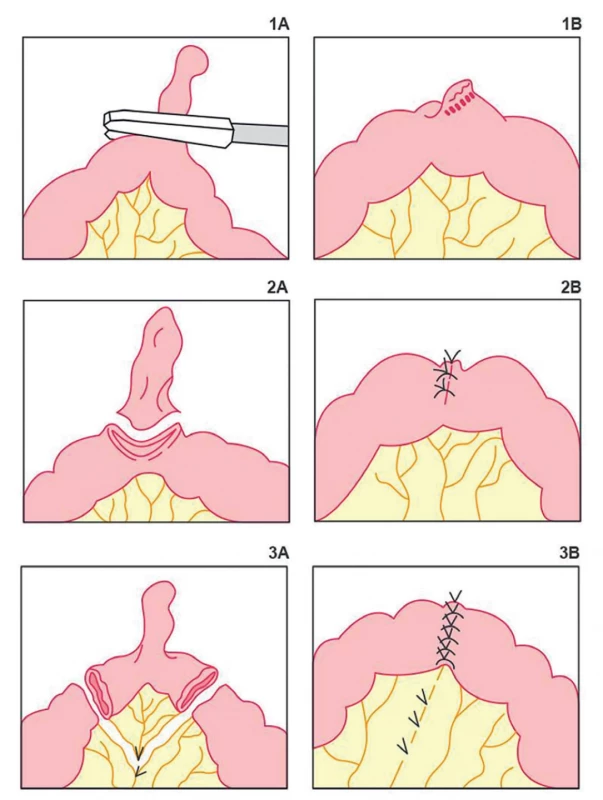
Hodnotenie prognózy a päťročného prežívania pri NET v MD je vzhľadom k dostupným dátam limitované, ale zdá sa, že miera prežívania je podobná ako päťročné prežívanie pri tenkočrevných NET, ktoré je podľa SEER databázy 75 % pre lokalizované ochorenie, 50 % pre regionálne ochorenie a 20 % so vzdialenými metastázami [3,18].
Frekvencia výskytu sekundárnych primárnych tumorov u pacientov s NET je 17 %, vrátane tumorov synchrónnych (diagnostikovaných 6 mesiacov pred alebo po diagnostike NET) aj metachrónnych (diagnostikovaných viac ako 6 mesiacov od diagnózy NET). Táto frekvencia predstavuje dvojnásobok incidencie sekundárnych primárnych malignít, ktorú predpokladáme v prípade iných neuroendokrinných tumorov [19,20]. Pri stanovení diagnózy NET (obzvlášť pri tenkočrevných, apendikálnych a kolorektálnych NET) je preto veľmi dôležité došetrenie a pravidelné kontrolné vyšetrenia hrubého čreva, rekta, tenkého čreva, pľúc a u žien aj krčku maternice a ovárií [18].
ZÁVER
NET tenkého čreva a MD majú veľa podobných vlastností, medzi ktoré patrí aj to, že veľkosť nádoru nekoreluje s prítomnosťou metastáz. Toto referujeme aj v našej kazuistike, kde mal pacient stredne diferencovaný NET s najširším diametrom primárneho tumoru 10 mm a pritom mnohopočetné metastázy pečene. Preto je aj pri malých nádoroch dôležitý agresívny prístup s radikálnou chirurgickou liečbou, ktorá zahrňuje resekciu dostatočného úseku čreva s príslušným mezentériom. V prípade generalizácie výrazne zlepšuje prežívanie kombinácia chirurgickej, cytoredukčnej a systémovej terapie. Pri NET sa všeobecne pozoruje zvýšený výskyt sekundárnych primárnych tumorov. Vzhľadom k incidencii MD a nádorov v ňom však nie je výskyt duplicity kolorektálneho karcinómu a NET v MD častý, jedná sa skôr o raritu. V doteraz publikovanej literatúre sa popisujú jednotlivé prípady, je však dôležité vedieť o možnosti tejto duplicity a ako k nej pristupovať.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise, s výnimkou kongresových abstrakt a klinických odporúčaných postupov.
MUDr. Benjamín Tolmáči
Chirurgické oddělení
Krajská nemocnice T. Bati, a.s.
Havlíčkovo nábřeží 600
762 75 Zlín
e-mail: benjamin.tolmaci@bnzlin.cz
Zdroje
1. Hansen CC, Søreide K. Systematic review of epidemiology, presentation, and management of Meckel’s diverticulum in the 21st century. Medicine (Baltimore) 2018 Aug;97(35):e12154. doi: 10.1097/ MD.0000000000012154.
2. Yahchouchy EK, Marano AF, Etienne JC, et al. Meckel’s diverticulum. J Am Coll Surg. 2001 May;192(5):658−662. doi: 10.1016/ s1072-7515(01)00817-1.
3. Kabir SA, Raza SA, Kabir SI. Malignant neoplasms of Meckel’s diverticulum; an evidence based review. Ann Med Surg. (Lond) 2019 Jun 4;43 : 75−81. doi: 10.1016/j.amsu.2019.05.017.
4. Thirunavukarasu P, Sathaiah M, Sukumar S, et al. Meckel’s diverticulum – a high-risk region for malignancy in the ileum. Insights from a population-based epidemiological study and implications in surgical management. Ann Surg. 2011 Feb;253(2):223−230. doi: 10.1097/SLA.0b013e3181ef488d.
5. Dogeas E, Magallanes M, Porembka MR, et al. Neuroendocrine tumors in Meckel’s diverticulum: recommendation for lymphadenectomy regardless of tumor size based on the NCDB experience. J Gastrointest Surg. 2019 Apr;23(4):679−685. doi: 10.1007/s11605-018-04096-7.
6. Barkmanová J, Ulrych J. Neuroendokrinní nádory. In: Krška Z, Hoskovec D, Petruželka L, et al. Chirurgická onkologie. 1. vyd. Praha, Grada Publishing 2014 : 591−599.
7. Pavel M, Öberg K, Falconi M et al. Gastroenteropancreatic neuroendocrine neoplasms: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020 Jul;31(7):844−860. doi: 10.1016/j.annonc.2020.03.304.
8. Nagtegaal ID, Odze RD, Klimstra D et al. The 2019 WHO classification of tumours of the digestive system. Histopathology 2020;76(2):182−188. doi: 10.1111/ his.13975.
9. Katalinic D, Santek F, Juretic A et al. Gastroenteropancreatic neuroendocrine tumour arising in Meckel’s diverticulum coexisting with colon adenocarcinoma. World J Surg Oncol. 2014 Nov 27;12 : 358. doi: 10.1186/1477-7819-12-358.
10. Lorenzen AW, O’Dorisio TM, Howe JR. Neuroendocrine tumors arising in Meckel’s diverticula: frequency of advanced disease warrants aggressive management. J Gastrointest Surg. 2013 Jun;17(6):1084−1091. doi: 10.1007/ s11605-013-2191-8.
11. Kothaj P. Neuroendokrinné nádory GIT. In: Pechan J, Haruštiak S, Kothaj P, et al. Princípy chirurgie III. 1. vyd. Bratislava, Prima-Print 2013 : 772−782.
12. Chen L, Song Y, Zhang Y, et al. Exploration of the exact prognostic significance of lymphatic metastasis in jejunoileal neuroendocrine tumors. Ann Surg Oncol. 2018 Jul;25(7):2067−2074. doi:10.1245/ s10434-018-6511-9.
13. Tomášek J. Neuroendokrinní nádory. In: Büchler T, et al. Speciální onkologie 2. vyd. Praha, Maxdorf 2020 : 157−162.
14. Vítek P, Novotný J, Krutílková V. Neuroendokrinní nádory. In: Novotný J, Vítek P, Kleibl Z, et al. Onkologie v klinické praxi. 3. vyd. Praha, Mladá fronta 2019 : 270−288.
15. Pape UF, Niederle B, Costa F, et al. ENETS Consensus Guidelines for Neuroendocrine Neoplasms of the Appendix (Excluding Goblet Cell Carcinomas). Neuroendocrinology 2016;103(2):144−152. doi: 10.1159/000443165.
16. Poncet G, Hervieu V, Walter T, et al. Neuroendocrine tumors of Meckel’s diverticulum: lessons from a single institution study of eight cases. J Gastrointest Surg. 2011 Jan;15(1):101−109. doi: 10.1007/ s11605-010-1312-x.
17. Van Malderen K, Vijayvargiya P, Camilleri M, et al. Malignancy nad Meckel’s diverticulum: A systematic literature review and 14-year experience at a tertiary referral center. United European Gastroenterol J. 2018 Jun;6(5):739−747. doi: 10.1177/2050640617752771.
18. Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003 Feb 15;97(4):934−959. doi: 10.1002/cncr.11105.
19. Prommegger R, Ensinger C, Steiner P, et al. Neuroendocrine tumors and second primary malignancy – a relationship with clinical impact? Anticancer Res Mar. 2004;24(2C):1049−1051.
20. Pirozzi A, Riccardi F, Arpino G, et al. Occurence of second primary malignancies in patients with neuroendocrine tumors of the digestive tract. Medicine (Baltimore) 2019 Jul;98(29):e16508. doi: 10.1097/MD.0000000000016508.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Atestace
- Komentář k editorialu pana profesora Pavla Pafka
- Prehabilitace, cesta ke zlepšení pooperačních výsledků
- Akutní apendicitida v době jarní pandemie covid-19 v roce 2020 − srovnávací retrospektivní studie
- Regenerační schopnosti nanovláknového obvazu na bázi polylaktidu
- Laparoskopická versus otevřená hernioplastika uskřinuté tříselné kýly
- Trombolýza jako léčba transplantační trombózy renálních tepen – tři neúpěšné kazuistiky a přehled literatury
- Synchrónna nádorová duplicita neuroendokrinného tumoru Meckelovho divertikla s metastázami do pečene a kolorektálneho karcinómu
- Torze omenta jako možná příčina náhlé příhody břišní
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prehabilitace, cesta ke zlepšení pooperačních výsledků
- Laparoskopická versus otevřená hernioplastika uskřinuté tříselné kýly
- Torze omenta jako možná příčina náhlé příhody břišní
- Atestace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



