-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekce v místě chirurgického výkonu a lokální management rány − metaanalýza
Surgical site infection and local management of the wound − meta-analysis
Surgical site infections are relatively common complications observed in patients during postoperative period. SSIs worsen the outcomes of the surgery, impair patient’s quality of life, increase morbidity and mortality after the surgery, the treatment become longer and more expensive. SSIs form around 18% of healthcare-associated infections. In developed countries the incidence of SSI varies from 2 to 15%. Intrinsic and extrinsic factors affect the incidence of SSI. CDC classification from 1992 differentiate 3 types of SSI: superficial, deep and organ/space infections. Controversial results of already published studies focused on the postoperative management of surgical wounds did not provide a space for strong clinical evidence-based guidelines. Early diagnostics of wound-healing complications related to high-risk patients provides for individualized surgery and postoperative management of the incision.
Keywords:
infection − surgical site – surgical wound − management
Autoři: J. Stryja
Působiště autorů: Salvatella, s. r. o., Třinec
Vyšlo v časopise: Rozhl. Chir., 2021, roč. 100, č. 7, s. 313-324.
Kategorie: Souhrnné sdělení
doi: https://doi.org/10.33699/PIS.2021.100.7.313–324Souhrn
Infekce v místě chirurgického výkonu jsou relativně častou komplikací, se kterou se setkáváme u pacientů v pooperačním období. IMChV zhoršují výsledky operační léčby, zhoršují kvalitu života pacienta, zvyšují pooperační morbiditu i mortalitu, prodražují a prodlužují pooperační péči o pacienty. Tvoří asi 18 % infekcí vzniklých v souvislosti s poskytováním zdravotní péče. Ve vyspělých zemích se incidence IMChV pohybuje mezi 2−15 %. Na výskyt IMChV má vliv řada zevních a vnitřních faktorů. Klasifikace CDC z roku 1992 rozlišuje 3 typy infekcí: povrchní infekce, hluboké infekce a infekce orgánů/prostor. Kontroverzní výsledky publikovaných klinických studií zaměřených na pooperační péči o chirurgické rány nedávají prostor pro silná klinická doporučení založená na důkazech. Včasným odhalením pacientů se zvýšeným rizikem vzniku poruch hojení je možné individualizovat samotný operační výkon i pooperační management místa incize.
Klíčová slova:
infekce − místo výkonu – operační rána − management
Úvod
Infekce v místě chirurgického výkonu (IMChV, dříve infekce operační rány, pooperační ranné infekce) jsou relativně častou komplikací, se kterou se setkáváme u pacientů v pooperačním období. Tématu IMChV se věnoval v souhrnném sdělení publikovaném v Rozhledech v chirurgii v roce 2017 Bělina [42]. I když pokroky v chirurgických oborech umožňují minimalizovat operační trauma a snížit riziko kontaminace operačního pole během výkonu samotného, stárnutí populace, polymorbidita operovaných pacientů a stoupající výskyt mikrobiálních kmenů rezistentních vůči používaným antibiotikům vedou k tomu, že incidence infekcí v místě chirurgického výkonu neklesá tak, jak by se dalo očekávat. I přes jasnou patogenezi IMChV se v poslední době často diskutuje o tom, zdali je možné vhodnou pooperační péčí o pacienta a operační ránu incidenci IMChV snížit. Naše souhrnné sdělení přináší aktuální pohled na tuto problematiku. Vychází při tom z aktuálních mezinárodních doporučených postupů publikovaných v roce 2018 (WHO, World Health Organization) [2] a 2020 (EWMA, European Wound Management Organization) [12].
IMChV jsou třetí nejčastěji hlášenou infekcí vzniklou ve spojitosti s poskytováním zdravotní péče. Z dat prevalenční studie Evropského centra pro prevenci a kontrolu nemocí (ECDC) z roku 2018 vyplývá [1], že IMChV tvoří asi 18 % infekcí vzniklých v souvislosti s poskytováním zdravotní péče. Data WHO dokládají, že IMChV postihují téměř jednu třetinu pacientů, kteří podstupují chirurgický zákrok [2]. Ve vyspělých zemích se incidence IMChV pohybuje mezi 2−15 % [3]. Na výskyt IMChV má vliv řada zevních a vnitřních faktorů: zdravotní stav pacienta před operačním výkonem, poskytnutá perioperační péče, z chirurgického hlediska je důležitá zejména souvislost s typem operačního výkonu a potenciální mikrobiální náloží, která může během výkonu kontaminovat místo operace. S ohledem na patofyziologii a zkracující se délku hospitalizace pacientů se až 50 % infekcí projeví po propuštění pacienta ze zdravotnického zařízení [4] a jejich udávaná incidence je podhodnocena.
IMChV jsou komplikace poskytování zdravotní péče, které zhoršují výsledky operační léčby, zhoršují kvalitu života pacienta, zvyšují pooperační morbiditu i mortalitu, prodražují a prodlužují pooperační péči o pacienty. Coello v roce 2005 publikoval zjištění [5], že zvýšená nemocniční mortalita pacientů s hlubokou a orgánovou/dutinovou infekcí po výkonu je signifikantně spojena zejména se třemi typy operací: s implantacemi endoprotéz kyčelního kloubu (OR 2,5; 95%CI 1,3−4,5), operacemi na tlustém střevě (OR 1,8; 95%CI 1,1−3,2) a cévními rekonstrukcemi (OR 6,8; 95%CI 3,0−15,4). Několik studií potvrdilo, že bez ohledu na typ infekce v místě chirurgického výkonu zdvojnásobují dobu strávenou pacientem po operaci v nemocnici [6,7]. Negativní ekonomický dopad IMChV dokumentují například data ze Spojených států amerických, Austrálie a Spojeného království, která dokládají výši vícenákladů spojených s managementem IMChV ve zdravotnických zařízeních akutní péče (USA 1,6 miliardy USD ročně [8], Austrálie 268 milionů AUD ročně [9], UK 930 milionů GBP [10]). Tato ekonomická a epidemiologická data podtrhují význam preventivních opatření a časné diagnostiky infekcí. Podle závěrů studie Umscheida je až 60 % IMChV preventabilních a jejich negativnímu vlivu je možno předejít důsledným uplatňováním klinických doporučených postupů a nejlepší klinické praxe v perioperačním období [11].
Definice infekce v místě chirurgického výkonu
Klinická definice IMChV vychází z výskytu typických symptomů, které nacházíme v místě invazivního výkonu či operace v pooperačním období [12]. Pro infekční proces svědčí zejména nález zteplání, zarudnutí a otoku v okolí incize, zvýšená tělesná teplota a hnisavá ranná sekrece, respektive hnisavý obsah v drénu vyvedeném mimo operační ránu.
Pro potřeby dohledu nad výskytem IMChV bylo nutné určit jasná pravidla pro stanovení této diagnózy. Doporučený postup Centra pro kontrolu chorob (CDC, Center for Disease Control and Prevention) definuje infekce v místě chirurgického výkonu jako infekce, které do 30 dnů od operace (respektive do 1 roku od operačních výkonů u pacientů s ponechaným protetickým implantátem) postihují kůži nebo měkké tkáně v místě operačního výkonu [13]. Komplexní pohled na definici IMChV včetně algoritmu pro stanovení přítomnosti infekce je možno nalézt v Protokolu dohledu nad výskytem IMChV, který byl vytvořen pracovní skupinou CDC [14].
Patogeneze vzniku infekcí v místě chirurgického výkonu
V průběhu operačního výkonu dochází k expozici sterilních tkání pacienta zevnímu prostředí. Mikroorganismy, které se touto cestou dostávají do operační rány, se zde mohou pomnožit a následně vést k rozvoji infekce. Tento proces usnadňuje kromě jiných rizikových faktorů také přítomnost tzv. třetího (mrtvého) prostoru v ráně. Kolekce tekutiny v podobě ranného hematomu či séromu poskytuje mikroorganismům vhodné prostředí k růstu, zatímco průnik antibiotik, protilátek i buněk imunitního systému je omezený.
Mikroorganismy vyvolávající IMChV mohou pocházet z míst na těle pacienta, která jsou bakteriemi běžně kolonizována (např. kůže, povrchy sliznic, dýchací a trávicí trakt), pak hovoříme o tzv. endogenních IMChV [12]. Původci exogenních IMChV pocházejí z vnějších zdrojů, např. ze zařízení a ovzduší operačních sálů, zdravotnického personálu, chirurgických nástrojů apod. [12]. Riziko vzniku IMChV může být zvýšeno také v případech zvýšeného rizika endogenní kontaminace operačního pole (např. u výkonů kolorektální chirurgie), při selhání antiseptické přípravy operačního pole a nedodržení zásad asepse nebo u prolongovaných operačních výkonů se zvýšeným rizikem exogenní kontaminace rány. Působení těchto vnějších faktorů může být potencováno přítomností vnitřních faktorů spojených s celkovým zdravotním stavem pacienta (komorbidity – diabetes mellitus, malnutrice, obezita, imunosupresivní medikace) a místní odolností tkání vůči infekci (např. hematomy, zhmožděné tkáně na okrajích rány, tkáňová ischemie, cizí tělesa v ráně apod.).
Klasifikace chirurgických ran
Podle úrovně potenciální mikrobiální nálože klasifikujeme chirurgické rány do čtyř tříd [15], viz Tab. 1. Původní klasifikace byla publikována Berardem v roce 1964 a její principy dosud nebyly překonány. Aktuální klinické doporučené postupy odkazují především na CDC modifikaci SWC (surgical wound classification) z roku 1982 [45]. Na základě této klasifikace je možné predikovat riziko vzniku infekce v místě chirurgického výkonu, zajistit vhodnou antibiotickou profylaxi i peroperačně provést úkony snižující mikrobiální a toxickou zátěž rány.
Tab. 1. Klasifikace chirurgických ran [15]
Tab. 1: Classification of surgical wounds [15]![Klasifikace chirurgických ran [15] <br>
Tab. 1: Classification of surgical wounds [15]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/051ee8a029dc666602d40e9e7a97ebf5.png)
U čistých operačních ran je incidence IMChV nízká. V registrech ECDC dosahuje kumulativní incidence IMChV u pacientů po totální endoprotéze kolenního kloubu 0,5 %, po totální endoprotéze kyčelního kloubu 1 % a u pacientů po aortokoronárním bypassu 2,8 % [1]. Plánované otevřené kolorektální operační výkony, které splňují kritéria kategorie čistých kontaminovaných ran, jsou komplikovány IMChV o kumulativní incidenci 10,4 %, zatímco laparoskopická kolorektální operativa má incidenci IMChV 6,3 %. Podobná data poskytuje registr ECDC i v případě operací žlučníku (laparoskopická cholecystektomie 1,5 % versus klasická cholecystektomie 3,4 % IMChV [1]). I přes tyto nadějné výsledky miniinvazivních operačních výkonů je nutné kriticky podotknout, že u operací s časným propuštěním pacientů do domácího ošetřování a omezenou možností dohledu nad výskytem IMChV po dimisi z lůžkových zařízení akutní péče bývá incidence IMChV podhodnocena. Kontaminované rány jsou zatíženy výskytem do 20 % IMChV, zatímco u znečištěných chirurgických ran může dosahovat incidence IMChV podle různých autorů až 20–40 % [16,17,18].
Vnější a vnitřní rizikové faktory vzniku IMChV
Mezi rizikové faktory IMChV spojené s pacientem (tzv. vnitřní faktory) se řadí zejména věk pacienta, obezita – BMI ≥35 kg/m2 (BMI − body mass index), přítomnost závažných komorbidit vyjádřená ASA (American Society of Anaesthesiologists) skóre nad 3 nebo diabetes mellitus [19]. Podle zjištění některých autorů existuje rozdíl v zastoupení rizikových faktorů podílejících se na vzniku IMChV během hospitalizace, respektive po propuštění pacienta do domácího ošetřování. Wiseman a kol. pozorovali [20], že IMChV manifestující se až po dimisi jsou častěji spojené s komorbiditami pacienta (např. s diabetem mellitem, kouřením, arteriální hypertenzí, ischemickou chorobou srdeční, chronickou obstrukční nemocí bronchopulmonální), zatímco u hospitalizovaných pacientů jsou IMChV častěji spojeny s perioperačními rizikovými faktory.
Tzv. vnější rizikové faktory (související s výkonem) zahrnují [19] operační techniku (otevřená versus miniinvazivní operativa), dovednosti operatéra, zkušenost operačního týmu, načasování výkonu (plánované versus emergentní operace), typ zdravotnického zařízení (specializovaná centra versus provinční nemocnice). Také protrahovaná délka operačního výkonu je považována za závažný prediktor zvýšeného rizika vzniku IMChV [21].
Typy infekcí v místě chirurgického výkonu a jejich klinické symptomy
Klasifikace CDC z roku 1992 rozlišuje 3 typy infekcí [22]: povrchní infekce (s postižením kůže a podkoží v místě incize), hluboké infekce (s postižením kůže a podkoží, svalové vrstvy a fascie) a infekce orgánů/prostor (navíc s postižením tělesných orgánů, dutin či prostoru, se kterými bylo manipulováno v průběhu operační procedury), viz Obr. 1. Téměř polovinu IMChV hlášených ECDC (European Centre for Disease Prevention and Control) tvoří povrchní infekce, 30 % hluboké a 20 % tvoří infekce postihující orgány/dutiny [1]. Rozložení výskytu jednotlivých typů IMChV je do značné míry závislé na typu operačního výkonu a způsobu hlášení IMChV do jednotlivých národních registrů – podíl hlubokých a orgánových infekcí bývá vyšší v případech, kdy je dohled nad výskytem IMChV primárně zaměřen na průběh hospitalizace po operaci nebo na pacienty rehospitalizované pro diagnózu infekce. Naopak u operačních výkonů s velmi krátkou hospitalizací po samotném zákroku (např. sectio Caesarea) může být většina IMChV odhalena až po propuštění pacienta do domácího ošetřování (pokud je funkční systém dohledu nad výskytem infekcí i v ambulantním prostředí) [1].
Obr. 1. Typy infekcí v místě chirurgického výkonu, převzato z Horan a kol.
Fig. 1: Surgical site infection types, adapted from Horan et al.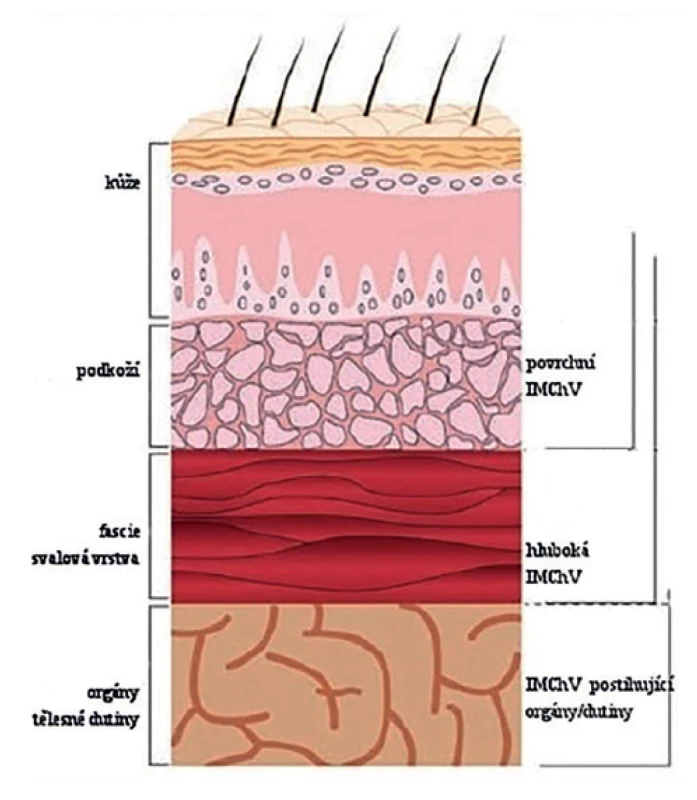
Symptomy IMChV se v klinickém obraze nejčastěji objevují koncem prvého pooperačního týdne. V případě méně invazivních mikrobiálních kmenů nebo výkonů s ponecháním implantátu nebo cizího materiálu v těle může dojít ke klinické manifestaci infekce i s odstupem několika měsíců. Přehled klinických symptomů IMChV uvádí Tab. 2 [23,24,25].
Tab. 2. Klinické známky a symptomy infekce v místě chirurgického výkonu [23,24,25]
Tab. 2: Clinical signs and symptoms of infection at the site of surgery [23,24,25]![Klinické známky a symptomy infekce v místě chirurgického výkonu [23,24,25] <br>
Tab. 2: Clinical signs and symptoms of infection at the site of surgery [23,24,25]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f43f49c9f4933d35dd0065dc01e20746.png)
Vysvětlivka: * infekce zahrnuje jakékoli anatomické struktury mimo samotnou incizi Principy uzávěru chirurgické rány
Hlavním cílem uzávěru chirurgické rány je její nekomplikované zhojení per primam intentionem. Chirurgický uzávěr incize precizním přiložením okrajů rány k sobě je nejrychlejší cestou ke znovuobnovení integrity tělesného povrchu. K dosažení optimálních podmínek pro hojení a tím i prevenci vzniku pooperačních ranných komplikací napomáhá dodržování těchto zásad [26]: pečlivá hemostáza v průběhu vlastní operace, zabránění ischemizaci okrajů rány a dosažení jejího beznapěťového uzávěru, sutura měkkých tkání rány po anatomických vrstvách a obnova anatomických struktur, eliminace mrtvého prostoru v ráně, zabránění peroperační kontaminaci operačního pole, adaptace okrajů rány při sutuře kůže, opatření k prevenci jizvení. Dalšími nezbytnými podmínkami pro nekomplikované hojení rány je dodržení zásad antisepse (procesy ke snížení mikrobiální kontaminace) a asepse (úkony zamezující kontaminaci operačního pole) [27]. Základem nerušeného procesu hojení chirurgické rány je excelentní operační technika [13]. Tzv. fyziologický operační přístup byl publikován Františkem Burianem [28] v roce 1949. Je založen na šetrné manipulaci s okraji rány a útrobami, vystříhání se jejich náhodnému poranění a ochraně zdravých tkání s cílem zkrátit dobu hojení, pacientovu rekonvalescenci a celkovou pacientovu odezvu na operaci. Přestože neexistuje žádná randomizovaná kontrolovaná studie (RCT) potvrzující prospěšnost fyziologického operačního přístupu, sterilní, ohleduplná a pečlivá operační technika je jednou z podmínek zajišťujících dobrý výsledek operace.
K uzávěru operační rány suturou (případně slepením) lze použít řadu materiálů – atraumatická monofilamentní vlákna, vstřebatelná vlákna, vlákna potažená biocidem, klipy, svorky, adhezivní pásky či tkáňová lepidla. Volba optimálního materiálu i chirurgická technika sutury jsou ovlivněny řadou faktorů, jako např. typem a lokalizací rány, dostupností materiálů, zkušeností a osobní preferencí operatéra, zdravotním stavem pacienta apod. [29]. V případě, že dojde k dehiscenci operační rány, je na místě provedení akutní revize s následnou resuturou, případně můžeme využít k uzávěru rány odloženou suturu, respektive zhojit ránu per secundam s využitím metod a krytí tzv. vlhké terapie.
Porovnání jednotlivých materiálů a způsobů uzávěru operační rány popisuje Tab. 3 převzatá z Journal of Cutaneous and Aesthetic Surgery [29].
Tab. 3. Techniky uzávěru operační rány a jejich klinický dopad
Tab. 3: Would closure techniques and their clinical impact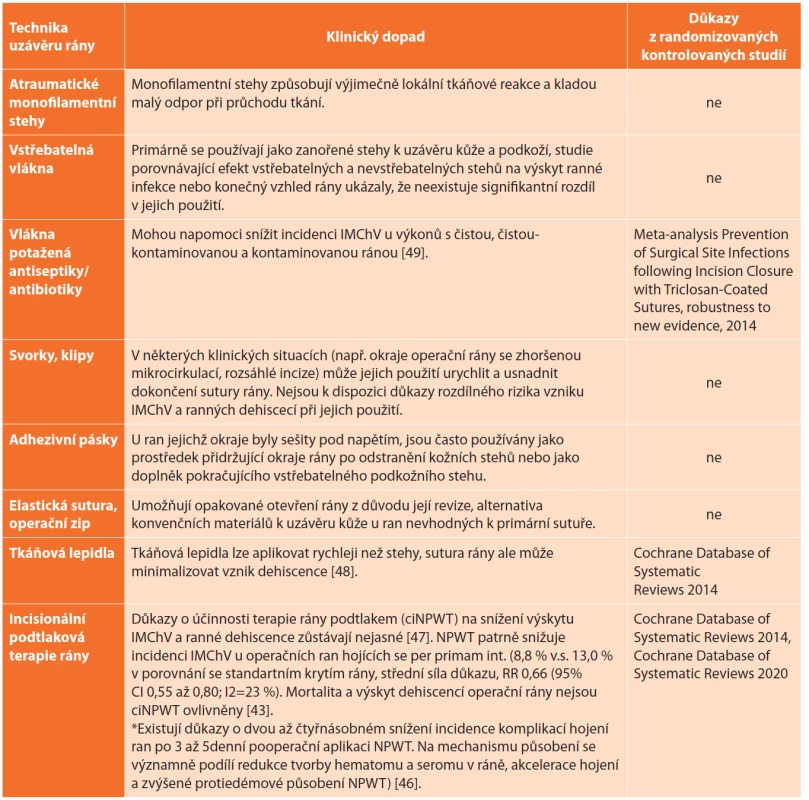
Pooperační management rány spočívá v zajištění klidu a stabilních místních podmínek pro hojení – rány kryjeme vhodným pooperačním krytím (dle většiny klinických doporučení minimálně na 48, resp. 72 hodin), ránu sledujeme a kontrolujeme s cílem včas odhalit případné infekční ranné komplikace a poruchy hojení. Součástí péče je i poučení pacienta o vhodném léčebném režimu v domácím prostředí. S ohledem na provozní možnosti chirurgických oddělení a požadavky operovaného se přistupuje k extrakci kožních stehů ve většině případů ambulantně.
Prevence IMChV v perioperačním období
Preventivní opatření spočívají v omezení vlivu vnějších a vnitřních rizikových faktorů. Níže uvedený souhrn doporučení v perioperačním období k prevenci IMChV byl publikován v dokumentu Evropské asociace pro léčbu ran v roce 2020 [12], viz Tab. 4.
Tab. 4. Souhrn doporučení pro prevenci infekcí v místě chirurgického výkonu
Tab. 4: Summary of recommendations for the prevention of surgical site infection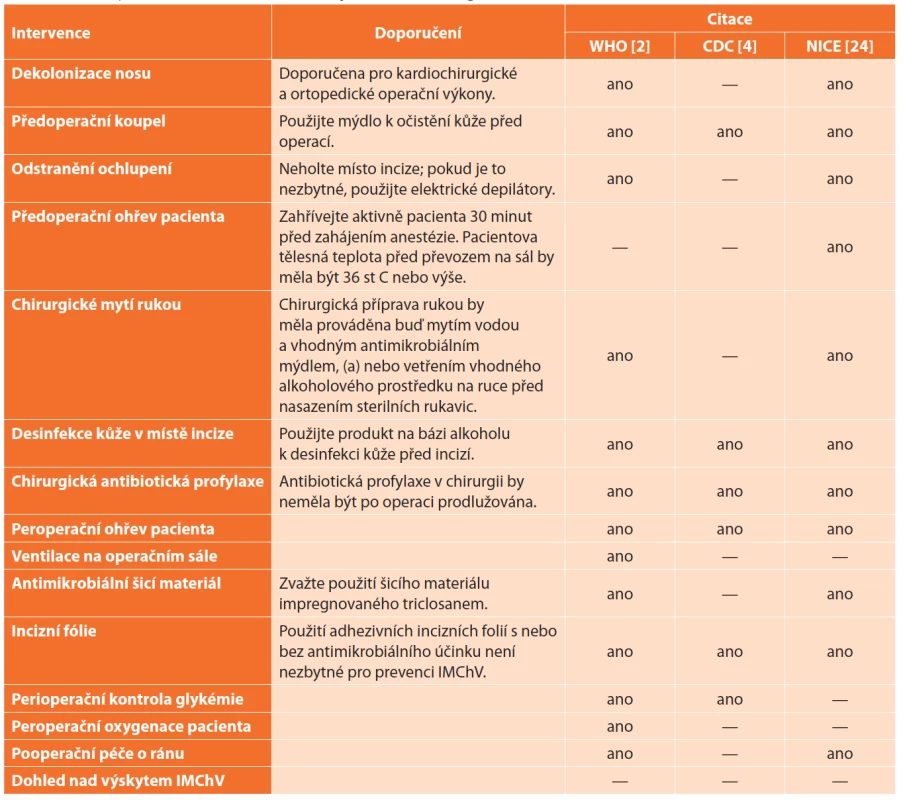
Incizionální podtlaková terapie (ciNPWT)
V poslední době byly publikovány výsledky studií o pozitivním vlivu použití incizionální podtlakové terapie na výskyt infekcí v místě chirurgického výkonu (viz též Tab. 3). Řada těchto studií ale neposkytuje dostatečnou kvalitu důkazů z důvodu chabého designu, nedostatečného počtu zařazených subjektů či retrospektivního sledování. O efektivitě ciNPWT na prevenci komplikací hojení operačních ran se vedou časté diskuze na odborných fórech. Metaanalýzy studií i aktuální mezinárodní doporučené postupy jsou k univerzálnímu použití ciNPWT velmi obezřetné: Apelqvist a kol. v doporučeném postupu EWMA z roku 2015 došli k závěru, že i přes slibné výsledky ciNPWT na pokles incidence IMChV při současném stavu znalostí neexistuje důvod aplikovat ciNPWT na všechny pooperační rány, zejména s ohledem na příliš vysoké náklady v porovnání s cenou standardních krytí [30]. Také doporučený postup WHO k prevenci IMChV ohodnotil preventivní použití ciNPWT u operačních ran podmínečným doporučením (rizikový pacient, rizikový výkon) s nízkou úrovní důkazů [2]. Metaanalýza publikovaná Cochrane Institutem v roce 2020 [43] posuzovala 44 RCT, které zahrnovaly 7447 účastníků, a pět farmakoekonomických studií. V závěru metaanalýzy je konstatováno, že NPWT patrně snižuje incidenci IMChV u operačních ran hojících se per primam intentionem (8,8 % vs. 13,0 % v porovnání se standardním krytím rány, střední síla důkazu, RR 0,66 (95% CI 0,55 až 0,80; I2=23 %). Mortalita a výskyt dehiscence operační rány nejsou ciNPWT ovlivněny. Většina RCT posuzujících účinnost ciNPWT na incidenci IMChV udává délku aplikace NPWT na ránu pět až sedm dnů [44].
Efekt terapeutických krytí na operační ránu
Terapeutická krytí jsou nedílnou součástí léčby nehojících se ran, k jejichž uzávěru dochází postupně, hojením per secundam intentionem. V případě aplikace na primárně se hojící rány je jejich význam předmětem řady diskuzí. Krytí mají v managementu akutní rány řadu funkcí: bariérová funkce brání kontaminaci rány z vnějšího prostředí, transparentnost umožňuje průběžnou vizuální kontrolu rány, retenční schopnost adhezivního okraje krytí zajišťuje retenci krytí v místě aplikace, semipermeabilita umožňuje prostup vodních par z pokožky a spodiny rány do okolí, absorpční funkce napomáhá zvládání ranného exsudátu u secernujících ran či přechodného pooperačního krvácení z okrajů rány, antimikrobiální vlastnosti krytí mohou omezit růst mikroorganismů na povrchu kůže a rány. Použití terapeutických krytí v prevenci a managementu IMChV shrnuje přehledná Tab. 5 převzatá z dokumentu EWMA "Surgical site infection: preventing and managing surgical site infection across health care sectors" publikovaného v roce 2020 [12]. Efektivitou terapeutických krytí v prevenci IMChV se dále detailně zabývá metaanalýza publikovaná týmem v čele s J. C. Dumvillem v Cochrane Database of Systematic Reviews v roce 2016 [31].
Cílem metaanalýzy RCT studií, kterou provedla pracovní skupina Cochrane v čele s J. C. Dumvillem v roce 2016, bylo posouzení schopnosti terapeutických krytí zabránit vzniku IMChV. Byla porovnávána účinnost běžných absorpčních krytí aplikovaných na operační rány hojící se per primam intentionem versus ponechání ran bez krytí, respektive byla posuzována účinnost alternativních krytí navzájem.
Tab. 5. Terapeutická krytí v managementu pooperačních ran
Tab. 5: Dressings in the management of surgical wounds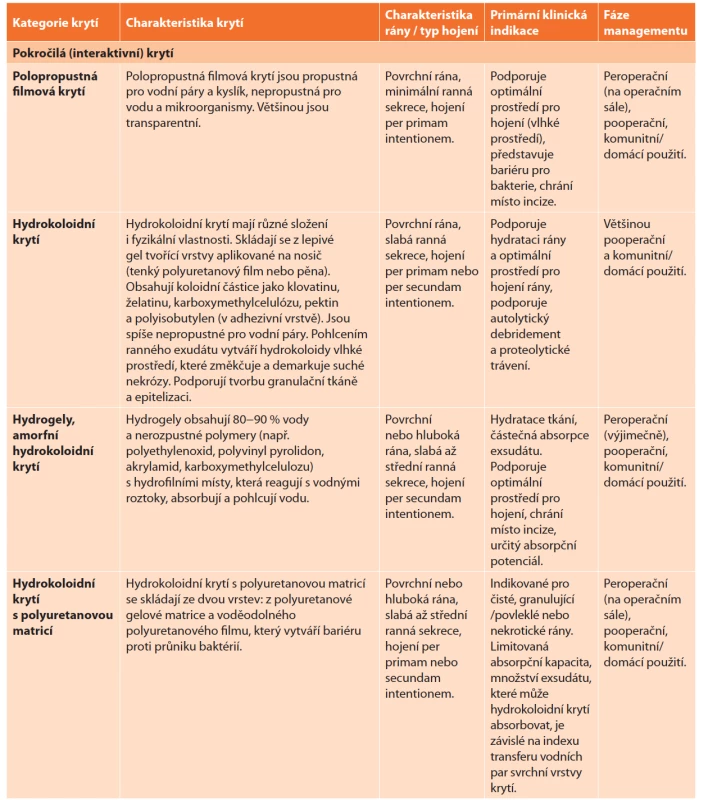
Metody
K vyhledání potenciálních studií vhodných do zařazení do analýzy byly použity databáze: Cochrane Wounds Specialised Register, Cochrane Central Register of Controlled Trials, Ovid MEDLINE, Ovid Embase a EBSCO CINAHL [31]. Do výběru byly zařazeny randomizované kontrolované studie porovnávající krytí rány s jejím nekrytím nebo s krytím alternativním. Výběr studií, zhodnocení rizik a extrakci dat provedli nezávisle dva autoři. Primárním výsledkem byl posouzení výskytu IMChV. Sekundárními výsledky byly ranné bolesti vnímané pacientem, hodnocení jizvy, respektive přijatelnost krytí účastníkem a snadnost jeho odstranění.
Výsledky
Do analýzy bylo zařazeno celkem dvacet devět studií (5718 pacientů), viz Schema 1. Šestnáct studií zařadilo pacienty s „čistou“ chirurgickou ránou, pět studií zařadilo pacienty s ránou po „čistých kontaminovaných“ výkonech, u osmi studií byli zastoupeni pacienti s různým stupněm kontaminace rány. Čtyři studie porovnávaly výskyt IMChV u ran ponechaných bez krytí a ošetřených krytím. Dvacet pět studií porovnávalo alternativní krytí (základní absorpční krytí, filmová krytí, antimikrobiální krytí bez stříbra, krytí se stříbrem, hydrokoloidní krytí). Po analýze dat bylo konstatováno, že v zahrnutých studiích a výsledcích porovnání byla kvalita důkazů velmi nízká a jakýkoli odhad účinnosti by byl velmi nespolehlivý. Nebyly nalezeny jasné důkazy svědčící pro to, že by byl jeden typ krytí účinnější než druhý ve snížení rizika vzniku IMChV, ani že by překrytí operační rány jakýmkoli krytím snižovalo riziko vzniku IMChV. Zároveň nebyly nalezeny jasné důkazy toho, že by měl některý typ krytí pozitivní vliv na jizvení, vnímanou bolest, snášenlivost krytí pacientem a snadnost jeho odstranění. Tato zjištění vedou autory metaanalýzy k závěru, že rozhodnutí o způsobu ošetření operační rány má být založeno na zkušenostech klinika, preferencích pacienta a ceně krytí.
Schema 1: Prisma graf Cochrane review Krytí pro prevenci infekcí v místě chirurgického výkonu, 2016
Diagram 1: Prisma flow diagram of the Cochrane review: Dressings for the prevention of SSI, 2016
Terapie infekcí v místě chirurgického výkonu
S ohledem na rozsah sdělení si dovolíme zmínit terapii IMChV pouze heslovitě. Základem terapie je časná diagnostika IMChV. Chirurgický management IMChV musí odpovídat jejímu rozsahu. Nechirurgická léčba spočívá ve vhodné antibiotické a lokální antimikrobiální terapii. Tu může v indikovaných případech vhodně doplnit hyperbarická oxygenoterapie [32].
U povrchních infekcí bývá dostatečné provedení revize rány s jejím otevřením a odstraněním stehového materiálu. K zabránění předčasného spontánního uzavření incize je možné vložit do rány plastový drén nebo proužek antiseptického krytí. Ránu je možné při převazu proplachovat vhodnými antiseptickými oplachovými roztoky. Důležitou úlohu má při ošetření rány chirurgický débridement. Hluboké infekce mohou vyžadovat agresivnější přístup s revizí fascie a svalové vrstvy, zejména v ischemickém terénu. Na zvážení jsou i cílená systémová antibiotická terapie, léčba rány pomocí metod kontrolovaného podtlaku nebo aplikace antimikrobiálních krytí vlhké terapie. Léčba orgánových a dutinových infekcí často vyžaduje hospitalizaci pacienta, neobejde se bez cílené antibiotické terapie, drenáže infekčního ložiska a komplexní léčby (včetně operační revize postiženého orgánu), která je závislá na místě a rozsahu infekce.
Diskuze
Kontroverzní výsledky publikovaných klinických studií zaměřených na pooperační péči o chirurgické rány nedávají prostor pro silná klinická doporučení založená na důkazech. I když zatím nebyly předloženy důkazy o prospěšnosti použití konkrétního krytí k prevenci IMChV, National Institute for Health and Care Excellence (NICE) [24] doporučuje zakrytí místa incize na konci operačního výkonu vhodným interaktivním krytím. Také aktualizace NICE guidelines z roku 2013 souhlasí s tvrzením, že se žádný typ terapeutického krytí neukazuje jako nejefektivnější ve snížení rizika vzniku IMChV, přesto připouští existenci dat o tom, že nylonová krytí se stříbrem mohou být efektivnější než gáza [33]. Většina klinických doporučení a protokolů [34,35] založených na důkazech („care bundle“) uvádí, že krytí přiložené na operační ránu na sále by mělo zůstat na místě minimálně 48 hodin po operaci (nebo déle, pokud to klinický stav dovolí, nejdéle však 4 dny), pokud nedojde dříve k prosáknutí krytí ranným sekretem nebo nedojde k manifestaci jiných symptomů. S ohledem na fakt, že klinické projevy IMChV nacházíme na ráně nejčastěji pátý až sedmý pooperační den, s tímto doporučením nelze než souhlasit.
K časnému ošetření nekomplikované operační rány lze použít řadu krytí, která mají dostatečnou bariérovou funkci. S ohledem na potřebu průběžné monitorace stavu rány představují atraumatické a transparentní kontaktní krycí fólie jistou výhodu [36,37,38] (nižší počet převazů, nižší spotřeba materiálu a redukce nákladů), která ale dosud nebyla podepřena robustními daty RCT. Případová kontrolovaná studie z roku 2017 [39] sledovala 834 pacientů po totální endoprotéze kolenního nebo kyčelního kloubu. Autoři konstatovali statisticky signifikantní pokles ve výskytu IMChV při použití nylonového krytí se stříbrem v porovnání se standardním krytím. K podobným výsledkům došly i další menší klinické studie [40] zahrnující pacienty po kolorektálních výkonech, neurochirurgických a spinálních operacích. Také randomizovaná kontrolovaná studie [41] porovnávající efektivitu krytí impregnovaného dialkylcarbamoyl chloridem (DACC) versus standardní krytí přinesla důkazy o tom, že by DACC krytí mohla být nápomocná v prevenci IMChV u pacientek po císařském řezu. Přesto doporučený postup WHO [2] nedoporučuje u primárně zavřených operačních ran upřednostňování tzv. pokročilých krytí vlhké terapie před standardním suchým absorpčním krytím s odvoláním na nízkou úroveň důkazů a nedostatek klinických studií na úrovni I. Baktericidní a bakteriostatická účinnost antiseptických krytí vlhké terapie může chirurgy vybízet k častějšímu používání těchto materiálů z preventivních důvodů na primárně se hojící rány. Přesto považujeme za nutné ctít zásadu, že časově omezená aplikace antimikrobiálních krytí na operační ránu by měla být vyhrazena pro specifické klinické situace u pacientů s vysokým rizikem vzniku IMChV (s přítomností známých rizikových faktorů), kteří podstoupili rizikový operační výkon.
Závěr
Infekce v místě chirurgického výkonu jsou komplikacemi, se kterými se zřejmě budeme setkávat u pacientů i při důsledném dodržování všech preventivních zásad a pravidel fyziologického operování. Příčinami jsou mimo jiné evidentní stárnutí populace, nárůst počtu pacientů s obezitou, diabetem mellitem a polymorbidních nemocných. Ke snížení incidence IMChV může přispět správná předoperační příprava pacientů zaměřená na screening a eliminaci rizikových faktorů. Včasným odhalením pacientů se zvýšeným rizikem vzniku poruch hojení je možné individualizovat samotný operační výkon i pooperační management místa incize. Negativní vliv rizikových faktorů mohou omezit nové technologie a postupy, které ale zatím často nemají dostatečnou oporu v medicíně založené na důkazech. Přesto je jejich použití medicínsky odůvodnitelné, zejména pokud jsou cíleny na jedince se zvýšeným rizikem pooperačních ranných komplikací.
Seznam zkratek:
ASA – American Society of Anaesthesiologists
BMI – body mass index
CDC – Center for Disease Control and Prevention
ciNPWT – incizionální podtlaková terapie
CI – confidence interval
ECDC – European Centre for Disease Prevention and Control
EWMA – European Wound Management Organization
DACC – dialkylcarbamoyl chlorid
IMChV – infekce v místě chirurgického výkonu
NICE – National Institute for Health and Care Excellence
OR – odds ratio
RCT – randomizovaná kontrolovaná studie
SSI – surgical site infection
SWC – surgical wound classification
WHO – World Health Organization
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Jan Stryja, Ph.D.
Salvatella, s. r. o.
Staroměstská 280
739 61 Třinec
e-mail: jan.stryja@atlas.cz
Zdroje
- European Centre for Disease Prevention and Control. Surgical site infections. In: ECDC. Annual epidemiological report for 2016. Stockholm 2018.
- Global guidelines for the prevention of surgical site infection, second edition. Geneva, World Health Organization 2018.
- Castella A, Argentero PA, Farina EC, et al. Incidence of surgical-site infections in orthopaedic surgery: a northern Italian experience. Epidemiol Infect. 2011;139(5):777–782. https://doi.org/10.1017/S0950268810001627.
- Berríos-Torres SI, Umscheid CA, Bratzler DW, et al. Centers for disease control and prevention guideline for the prevention of surgical site infection. JAMA Surg. 2017;152(8):784–791. https://doi.org/10.1001/jamasurg.2017.0904.
- Coello R, Charlett A, Wilson J, et al. Adverse impact of surgical site infections in English hospitals. J Hosp Infect. 2005;60(2):93–103. https://doi.org/10.1016/j.jhin.2004.10.019.
- Broex EC, van Asselt AD, Bruggeman CA, et al. Surgical site infections: how high are the costs? J Hosp Infect. 2009;72(3):193–201. https://doi.org/10.1016/j.jhin.2009.03.020.
- Jodra VM, Soler LS, Pérez CD, et al. Excess length of stay attributable to surgical site infection following hip replacement: a nested case-control study. Infect Control Hosp Epidemiol. 2006;27(12):1299–1303. https://doi.org/10.1017/S0195941700075214.
- de Lissovoy G, Fraeman K, Hutchins V, et al. Surgical site infection: Incidence and impact on hospital utilization and treatment costs. Am J Infect Control. 2009; 37(5):387–397. https://doi.org/10.1016/j.ajic.2008.12.010.
- McLaws ML, Taylor PC. The Hospital Infection Standardised Surveillance (HISS) programme: analysis of a two-year pilot. J Hosp Infect. 2003;53(4):259–267. https://doi.org/10.1053/jhin.2002.1361.
- Plowman R, Graves N, Griffin MA, et al. The rate and cost of hospital-acquired infections occurring in patients admitted to selected specialties of a district general hospital in England and the national burden imposed. J Hosp Infect. 2001;47(3):198–209. https://doi.org/10.1053/jhin.2000.0881.
- Umscheid CA, Mitchell MD, Doshi JA, et al. Estimating the proportion of healthcare-associated infections that are reasonably preventable and the related mortality and costs. Infect Control Hosp Epidemiol. 2011;32(2):101–114. https://doi.org/10.1086/657912.
- Stryja J, Sandy-Hodgetts K, Collier M, et al. Surgical site infection: preventing and managing surgical site infection across health care sectors. J Wound Care 2020;29 : 2, Suppl 2b, S1–S69.
- Mangram AJ, Horan TC, Pearson ML, et al. Guideline for prevention of surgical site infection. Infect Control Hosp Epidemiol. 1999;20(4):247–280. https://doi.org/10.1086/501620.
- Centers for Disease Control and Prevention. Procedure-associated module. Surgical Site Infection Event. 2019.
- Berard F, Gandon J. Postoperative wound infections: the influence of ultraviolet irradiation of the operating room and of various other factors. Ann Surg. 1964;160 Suppl 2 : 1–192.
- Vazquez-Aragon P, Lizan-Garcia M, Cascales-Sanchez P, et al. Nosocomial infection and related risk factors in a general surgery service: a prospective study. J Infect. 2003 Jan;46(1):17−22. doi: 10.1053/jinf.2002.1073.
- Lilani SP, Jangale N, Chowdhary A, et al. Surgical site infection in clean and clean-contaminated cases. Indian J Med Microbiol. 2005 Oct;23(4):249−252.
- Ortega G, Rhee DS, Papandria DJ, et al. An evaluation of surgical site infections by wound classification system using the ACS-NSQIP. J Surg Res. 2012 May 1;174(1):33−38. doi: 10.1016/j.jss.2011.05.056. Epub 2011 Jun 24.
- Mu Y, Edwards JR, Horan TC, et al. Improving risk-adjusted measures of surgical site infection for the national healthcare safety network. Infect Control Hosp Epidemiol. 2011;32(10):970–986. https://doi. org/10.1086/662016.
- Wiseman JT, Fernandes-Taylor S, Barnes ML, et al. Predictors of surgical site infection after hospital discharge in patients undergoing major vascular surgery. J Vasc Surg. 2015; 62(4):1023–1031.e5. doi:10.1016/j.jvs.2015.04.453.
- Leong G, Wilson J, Charlett A. Duration of operation as a risk factor for surgical site infection: comparison of English and US data. J Hosp Infect. 2006;63(3):255–262. doi:10.1016/j. jhin.2006.02.007.
- Horan TC, Gaynes RP, Martone WJ, et al. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC definitions of surgical wound infections. Infect Control Hosp Epidemiol. 1992; 13(10):606–608. doi:10.2307/30148464.
- World Health Organization. Patient safety. WHO guidelines for safe surgery 2009: safe surgery saves lives. Available from: https://tinyurl.com/rhsupup (accessed 21 November 2019).
- National Institute for Health and Clinical Excellence (NICE). Guidance. Surgical site infection: Prevention and treatment of surgical site infection. London, RCOG Press 2017. Available from: https://tinyurl.com/y9spc75p (accessed 21 November 2019).
- Cohen J, Powderly WG, Opal SM (eds). Infectious diseases. Volume 2, 4th ed. Elsevier Health Sciences 2017.
- Boffard KD. Manual of definitive surgical trauma care. 3rd ed. 2011 ISBN-13 : 978-1444102826
- Garner JS. CDC guideline for prevention of surgical wound infections, 1985. Supersedes guideline for prevention of surgical wound infections published in 1982. (Originally published in November 1985). Revised. Infect Control. 1986 Mar;7(3):193−200. doi: 10.1017/s0195941700064080.
- Měšťák J. Úvod do plastické chirurgie. Praha, Karolinum 2005.
- Al-Mubarak L, Al-Haddab M. Cutaneous wound closure materials: An overview ISBN-13 : 978-1444102826and update. J Cutan Aesthet Surg. 2013;6(4):178–188. doi:10.4103/0974-2077.123395.
- Apelqvist J, Willy C, Fagerdahl A-M, Fraccalvieri M, et al. EWMA document: negative pressure wound therapy. J Wound Care 2017; 26(Sup3):S1–154-doi: 10.12968/jowc.2017.26.Sup3.S1.
- Dumville JC, Gray TA, Walter CJ, et al. Dressings for the prevention of surgical site infection. Cochrane Database of Systematic Reviews 2016 Dec 20;12(12):CD003091.doi: 10.1002/14651858.CD003091.pub4.
- Gottrup F, Dissemond J, Baines C, et al. Use of oxygen therapies in wound healing. J Wound Care 2017; 26(Sup5):S1–43. doi:10.12968/jowc.2017.26.sup5.s.
- Surgical site infection: evidence update 43. Manchester, National Institute for Health and Care Excellence 2013. Available from: https://arms.evidence.nhs.uk/resources/hub/1006598/attachment.
- Preventing surgical site infections. 2018. Available from: https://www.hps.scot.nhs.uk/web-resources-container/preventing-surgical-site-infections-ssi/.
- High impact intervention. Care bundle to prevent surgical site infection. London, Department of Health 2011.
- Bredow J, et al. Randomized clinical trial to evaluate the performance of a flexible self-adherent absorbent dressing coated with a soft silicone layer after hip, knee or spinal surgery in comparison to standard wound dressing. Poster presentation at the 5th Congress of WUWHS. Florence, Italy 2016, 25−29 Sep.
- Zarghooni K. Effect of a modern dressing compared to standard dressings on outcome after primary hip and knee arthroplasty: a prospective, non-randomised controlled study. E-poster presentation at EWMA Conference. London 13−15 May 2015.
- Van Overschelde P, Beele H, Olivecrona C, et al. A randomised controlled trial comparing two wound dressings used after elective hip and knee arthroplasty. Poster presentation at the 5th congress of WUWHS. Florence, Italy 2016, 25−29 Sep.
- Tisosky AJ, Iyoha-Bello O, Demosthenes N, et al. Use of a silver nylon dressing following total hip and knee arthroplasty decreases the postoperative infection rate. J Am Acad Orthop Surg Glob Res Rev. 2017;1(7):e034. doi: 10.5435/JAAOSGlobal-D-17-00034.
- Abboud EC, Settle JC, Legare TB, et al. Silver-based dressings for the reduction of surgical site infection: Review of current experience and recommendation for future studies. Burns 2014;40 Suppl 1:S30–S39. doi: 10.1016/j.burns.2014.09.011.
- Stanirowski PJ, Bizoń M, Cendrowski K, et al. Randomized controlled trial evaluating dialkylcarbamoyl chloride impregnated dressings for the prevention of surgical site infections in adult women undergoing cesarean section. Surg Infect (Larchmt) 2016;17(4):427–435. doi:10.1089/sur.2015.223.
- Bělina F. Současné možnosti ovlivnění infekce v místě operačního výkonu. Rozhl Chir. 2017;96(5):189−196.
- Norman G, Goh EL, Dumville JC, et al. Negative pressure wound therapy for surgical wounds healing by primary closure. Cochrane database of systematic reviews. 2020;(6):CD009261. doi:10.1002/14651858.CD009261.pub6.
- Smolle MA, Nischwitz SP, Hutan M, et al. Closed-incision negative-pressure wound management in surgery—literature review and recommendations. Eur Surg. 2020;52;249–267. doi:10.1007/s10353-020-00657-w.
- Onyekwelu I, Yakkanti R, Protzer L, et al. Surgical wound classification and surgical site infections in the orthopaedic patient. J Am Acad Orthop Surg Glob Res Rev. 2017;1(3):e022. doi:10.5435/JAAOSGlobal-D-17-00022.
- Karlakki S, Brem M, Giannini S, et al. Negative pressure wound therapy for management of the surgical incision in orthopaedic surgery: A review of evidence and mechanisms for an emerging indication. Bone Joint Res. 2013 Dec 18;2(12):276−284. doi:10.1302/2046-3758.212.2000190.
- Webster J, Scuffham P, Sherriff KL, et al. Negative pressure wound therapy for skin grafts and surgical wounds healing by primary intention. Cochrane Database Syst Rev. 2012 Apr 18;(4):CD009261. doi: 10.1002/14651858.CD009261.pub2. Update in: Cochrane Database Syst Rev. 2014;(10):CD009261.
- Dumville JC, Coulthard P, Worthington HV, et al. Tissue adhesives for closure of surgical incisions. Cochrane Database Syst Rev. 2014 Nov 28;(11):CD004287. doi: 10.1002/14651858.CD004287.pub4.
- Daoud FC, Edmiston CE Jr, Leaper D. Meta-analysis of prevention of surgical site infections following incision closure with triclosan-coated sutures: robustness to new evidence. Surg Infect (Larchmt). 2014 Jun;15(3):165−181. doi: 10.1089/sur.2013.177. Epub 2014 Apr 16.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2021 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Management ran v „době kovidové“
- Infekce v místě chirurgického výkonu a lokální management rány − metaanalýza
- Antibiotická terapie při léčbě kožního abscesu − metaanalýza
- Infekce cévních rekonstrukcí v aortoilické oblasti – náš pohled ve světle aktuálních doporučení Evropské společnosti cévní chirurgie − retrospektivní observační studie
- Léčba ileokolické invaginace v České republice
- Migrace síťky do tlustého střeva po opravě tříselné kýly – kazuistika
- Perforace tlustého střeva u pacientů s pneumonií covid-19 – kazuistiky
- Primární retroperitoneální mucinózní cystadenokarci-nom v těhotenství – kazuistika
- 3D printed custom-made titanium cranioplasty after repeatedly failed cranial reconstructions and surgical site infections
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Infekce v místě chirurgického výkonu a lokální management rány − metaanalýza
- Antibiotická terapie při léčbě kožního abscesu − metaanalýza
- Léčba ileokolické invaginace v České republice
- Perforace tlustého střeva u pacientů s pneumonií covid-19 – kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





