-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pseudomyxom peritonea (PMP) a jeho léčba − dvacetileté zkušenosti jednoho pracoviště
Pseudomyxoma peritonei (PMP) and its therapy – 20 years’ experience of a single surgical department
Introduction: Pseudomyxoma peritonei (PMP) is a rare malignant disease with various grades of malignancy, producing mucinous and gelatinous masses. The origin of PMP is usually connected with the rupture of appendiceal mucinous tumours, other mucinous tumours of the gastrointestinal tract or of the ovary. The staging of this disease is determined by the PCI score (peritoneal cancer index), and the efficiency of surgical procedure by the CC score. Clinical presentation is very variable and depends on the stage of the disease. Many patients are asymptomatic with a minimal clinical finding, presented only with abdominal discomfort. A typical finding of the “jelly belly“ syndrome expands with progression of the disease. The diagnosis consists in preoperative determination of the tumour characteristics and PCI based on imaging methods, especially CT imaging.
Methods: The Sugarbaker technique of complete tumour removal or the so-called cytoreductive surgery (CRS) was used, including hyperthermic intraperitoneal chemotherapy (HIPEC) or alternatively early postoperative intraperitoneal chemotherapy (EPIC). We performed retrospective evaluation of 73 patients with pseudomyxoma peritonei undergoing surgery, 39 males and 34 females, mean age 50.6 and 56.4 years, respectively. Surgical revision was performed in 18 patients, 14 males and 4 females. The mean age of this group was 48.8 for the males and 47 for the females. The surgical procedures were performed between 1999 and 2018. Survival rates, median survival, complications based on Clavien-Dindo classification, lethality rates, and PCI and CC scores were assessed in the patient group.
Results: 96 surgeries were performed in 73 patients with pseudomyxoma peritonei at our surgical department between 1999−2018. The surgery had to be repeated in 18 patients (24.6%). High grade (HG) pseudomyxoma was diagnosed in 29 patients (39.7%), and low grade (LG) pseudomyxoma in 44 patients (60.3%). Overall morbidity was 27.3%, and the mortality rate was 5.4%. The mean overall survival (OS) was 139.5 months in the LG pseudomyxoma group and 71.5 months in the HG pseudomyxoma group. Median survival was 86 months in the entire group and 72 in the HG pseudomyxoma group; the median was not reached in the LG pseudomyxoma group.
Conclusions: Results in the literature and our results are comparable, confirming the high efficiency of this method both in the world and in the Czech republic. The results indicate a highly statistically significant improvement of the OS with acceptable mortality and morbidity. These results confirm this method as a gold standard therapy for selected patients.
Keywords:
pseudomyxoma peritonei – HIPEC – hyperthermic intraperitoneal chemotherapy – peritoneal carcinoma index – cytoreductive surgery
Autoři: P. Bartoška 1; F. Antoš 1; P. Vítek 2; J. Marx 1; P. Holečková 3; M. Novotný 1; M. Kengbaeva 1
Působiště autorů: Chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Nemocnice Na Bulovce, Praha, subkatedra koloproktologie IPVZ Praha 1; Proton Therapy Center Czech, Praha 2; Ústav radiační onkologie, Nemocnice Na Bulovce a 1. lékařské fakulty Univerzity Karlovy, Praha 3
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 4, s. 159-166.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2020.99.4.159–166Souhrn
Úvod: Pseudomyxom peritonea (PMP) je poměrně vzácné nádorové onemocnění s různým stupněm malignity, charakterizované produkcí mucinu a gelatinózních hmot. Jeho vznik je často spojován s rupturou mucinózních nádorů apendixu a ostatních hlenotvorných nádorů trávicího traktu či ovaria. Rozsah PMP se obvykle určuje pomocí PCI skórovacího systému (Peritoneal Carcinoma Index). Klinický obraz se různí v závislosti na rozsahu onemocnění. Nezřídka nalézáme u asymptomatických pacientů minimální klinický nález spojený jen s břišním diskomfortem. U rozsáhlého postižení dutiny břišní se rozvíjí typický nález pro PMP, tzv. „jelly belly“ syndrom („syndrom rosolovitého břicha“). Diagnostika spočívá ve stanovení charakteru nádoru a předoperačního PCI pomocí zobrazovacích metod, zejména pak CT.
Metody: V léčení bylo použito Sugarbakerovy metody maximální cytoredukce (CRS) + HIPEC (hyperthermic intraoperative peritoneal chemotherapy), ev. EPIC (early postoperative intraperitoneal chemotherapy). Retrospektivně jsme hodnotili skupinu 73 operovaných pacientů s pseudomyxomem peritonea, 39 mužů a 34 žen, průměrného věku 50,6 roku, resp. 56,4. Opakovaný výkon podstoupilo 18 pacientů, 14 mužů a 4 ženy. Průměrný věk v této skupině byl u mužů 48,8, u žen 47 let. Pacienti byli operováni v letech 1999 až 2018. V souboru nemocných jsme hodnotili délku přežití a její medián, výskyt komplikací dle Clavien-Dindo klasifikace, letalitu, PCI a CC skóre.
Výsledky: V letech 1999–2018 bylo provedeno 96 operací u 73 pacientů s onemocněním pseudomyxomu peritonea, z nichž u 18 pacientů, tj. 24,6 % byl chirurgický výkon proveden opakovaně. U 29 (39,7 %) pacientů se vyskytoval high grade (HG) pseudomyxom, u 44 (60,3 %) pak byl diagnostikován low grade (LG) pseudomyxom peritonea. Morbidita v celém souboru činila 27,3 %, mortalita pak 5,4 %. Průměrná doba přežití pro LG pseudomyxom byla v našem souboru 139,5 měsíce, pro HG pseudomyxom pak 71,5 měsíce. Medián přežití v celé skupině je 86 měsíců, z toho 72 pro HG pseudomyxom, pro LG pseudomyxom nebylo mediánu dosaženo.
Závěr: Literární i naše výsledky jsou srovnatelné, potvrzují vysokou efektivitu této metody u nás i ve světě. Jde o statisticky velmi významné prodloužení OS (celkové přežití) s akceptabilní mortalitou i morbiditou. U vybraných pacientů výsledky potvrzují tuto metodu jako zlatý standard pro léčbu PMP.
Klíčová slova:
pseudomyxom peritonea – peritoneal carcinoma index – cytoreduktivní chirurgie – hypertermická intraperitoneální chemoterapie – HIPEC
Úvod
PMP je nádorové onemocnění s různým stupněm maligního potenciálu, charakterizované produkcí mucinu a gelatinózních hmot v peritoneální dutině.
Nádorové hmoty v dutině břišní se vyskytují volně nebo vázané na peritoneum břišní stěny či orgány dutiny břišní. Postižení peritonea (tzv. peritoneální karcinomatóza) je přítomné u tohoto onemocnění v různé míře vždy. Velmi často postiženou oblastí bývá omentum − tzv. omental cake.
Ostatní predilekční oblasti odpovídají cirkulačním cestám peritoneální tekutiny. Jsou to zejména malá pánev, oba parakolické a oba podbrániční prostory [1].
Produkce hlenu i vznik PMP vycházejí z postižení MUC2 pozitivních pohárkových buněk. Imunohistochemické vyšetření prokazuje pozitivní cytokeratin 20 a negativní cytokeratin 7 [2]. Výskyt PMP se odhaduje přibližně u 1 pacienta na 1 milion obyvatel za rok.
Příčinou vzniku onemocnění bývá velmi často perforace nezhoubných mukokél apendixu, hlenotvorných neoplazií apendixu (70−80 %), střeva a hlenotvorných ovariálních nádorů
(2−5 %). Ojediněle se PMP pozoruje i u cystických nádorů pankreatu, nádorů žaludku, žlučových cest a močového měchýře. Perforace může probíhat asymptomaticky, proto bývá nádorový proces diagnostikován až peroperačně. Klinický obraz je u PMP velice variabilní, závisí na rozsahu onemocnění. Na jedné straně nalézáme pacienty asymptomatické s minimálním klinickým nálezem, na druhé straně pak pacienty s různě rozvinutou neprůchodností střevní, ascitem či hmatnými tumorózními rezistencemi, ev. tzv. jelly belly syndrom – „rosolovité břicho“.
Metoda
Retrospektivně jsme hodnotili skupinu 73 pacientů s pseudomyxomem peritonea, 39 mužů a 34 žen, průměrného věku 50,6 roku, resp. 56,4. Opakovaný výkon podstoupilo 18 pacientů, 14 mužů a 4 ženy. Průměrný věk v této skupině byl u mužů 48,8, u žen 47 let.
Všichni pacienti byli k chirurgické intervenci indikováni po posouzení multidisciplinárním týmem (MDT) na základě provedených předoperačních vyšetření (interní vyšetření se stanovením personal status – PS, histologické vyšetření a CT vyšetření břicha a malé pánve). Nemocní byli operováni na naší klinice v letech 1999−2018 metodou CRS (cytoreductive surgery) a HIPEC, ev. EPIC (early postoperative intraperitoneal chemotherapy).
Současný postup, uplatňovaný i na našem pracovišti, vychází z kombinace maximálního možného chirurgického odstranění nádorového procesu tzv. CRS (cytoreductive surgery) a aplikace peroperační intraabdominální hypertermické chemoterapie (HIPEC – hyperthermic intraperitoneal chemotherapy) a EPIC.
Integrální součástí CRS je peritonektomie (dle lokálního nálezu úplná či částečná). Vlastní chirurgický zákrok se provádí v následných krocích:
- totální omentektomie velkého omenta a pravostranná perietální peritonektomie s, nebo bez resekce pravé poloviny kolon,
- pánevní peritonektomie s, nebo bez resekce sigmatu, hysterektomie a oboustranná adnexektomie,
- omentektomie malého omenta a disekce oblasti lig. hepatoduodenale s, nebo bez antrektomie či cholecystektomie,
- peritonektomie horního pravého kvadrantu a ev. odstranění Glissonského pouzdra,
- peritonektomie levého horního kvadrantu s, nebo bez splenektomie,
- ostatní střevní a jiné resekce břišních nádorových mas [3].
HIPEC (hypertermické intraperitoneální chemoterapie) se využívá k zefektivnění intraperitoneálně podaného cytostatika, při zachování relativně nízké systémové toxicity. Speciální přístroj (v našem případě fy Skala) zajišťuje po celou dobu laváže teplotu proplachové tekutiny s cytostatikem v rozmezí 42−43 °C.
Konstantní teplota okolo 42 °C je podmínkou efektivity této metody, tedy zajištění snadnějšího průniku cytostatika do zbytkových nádorových struktur (buněk) a dosažení vysoké (letální) koncentrace daného léčiva.
K instilaci cytostatika do dutiny břišní se používají speciální sterilní sety s teplotními čidly.
Sety jsou spojeny s přístrojem, který lavážní roztok (cytostatikum) do dutiny břišní vhání, filtruje, zahřívá a opět vrací k další cirkulaci.
Tento koloběh je udržován po celou dobu procedury, obvykle 60−90 min., dle typu cytostatika.
Pro PMP jsme používali Mitomycin C v dávce 30 mg pro objem 2−3 litry lavážní tekutiny.
Na našem pracovišti, na rozdíl od jiných center pro CRS a HIPEC, používáme systém polouzavřený, který zaručuje oproti jiným modalitám efektivnější cirkulaci horkého cytostatika ve všech oblastech dutiny břišní (Obr. 1).
Obr. 1. Konstrukce lavážního polouzavřeného systému s manuální obsluhou. V pozadí lavážní přístroj Skala.
Fig. 1: Construction of the manual semi-closed lavage system. Skala lavage device – in the background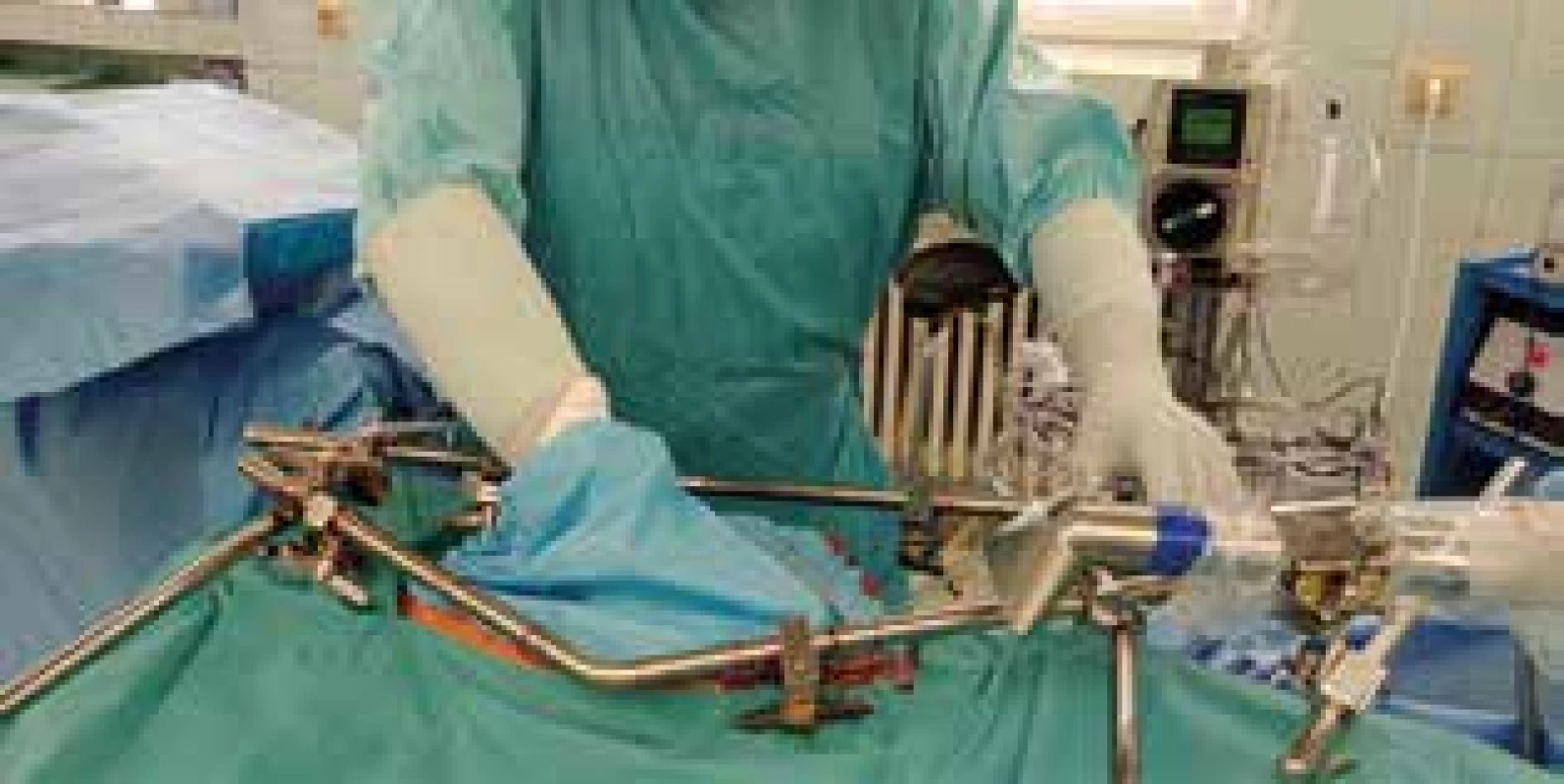
Množství, koncentraci, složení, teplotu lavážního roztoku a délku laváže určuje klinický onkolog. Peroperační podání je zpravidla ještě následováno další aplikací cytostatika (5 fluoruracil 1200 mg normotermicky) do dutiny břišní, a to v časném pooperačním období – EPIC, po dobu 5 dnů.
Smyslem tohoto postupu je zvýšit koncentraci chemoterapeutika v dutině břišní (v porovnání se systémovou léčbou) a zlepšit efektivitu léčby, při prakticky stejném výskytu nežádoucích komplikací.
Soubor pacientů jsme dle výsledků histologického vyšetření rozdělili do dvou skupin podle WHO klasifikace. Skupinu s low grade PMP tvořilo 44 pacientů (60,3 %), druhou s high grade PMP 29 pacientů (39,7 %).
U obou skupin jsme sledovali celkové přežití (OS), jeho medián, morbiditu a mortalitu. Stejné parametry pak byly hodnoceny i u podskupiny 18 pacientů (24,6 %), u kterých byl proveden CRS a HIPEC opakovaně (tzv. re-do chirurgie).
Střevní anastomózy konstruujeme po provedení HIPEC.
Výsledky
U všech nemocných bylo během operace stanoveno PCI, které v celé skupině činilo průměrně 18,6, 43 pacientů (58,9 %) mělo PCI do 20, zbylých 30 pacientů (41,1 %) mělo PCI vyšší. U všech pacientů bylo po provedeném chirurgickém zákroku stanoveno i CC skóre.
U 37 pacientů (50,7 %) bylo dosaženo CC 0-1, CC-2 u 23 pacientů (31,5 %) a u zbylých 13 pacientů (18,6 %) bylo dosaženo CC skóre 3.
Ve skupině PCI do 20 bylo provedena CRS v rozsahu CC O-1 u 32 pacientů (74,4 %), CC-2 u 8 pacientů (18,6 %) a CC-3 u 3 pacientů (7 %). U zbylých pacientů, s PCI vyšším 20, bylo dosaženo CC O-1 resekce u 5 pacientů (16,6 %), CC-2 u 15 pacientů (50 %) a CC-3 u 10 pacientů (33,3 %).
Průměrné přežití pro LG bylo v našem souboru 139,5 měsíce, pro HG pseudomyxom pak 71,5 měsíce. Medián přežití v celé skupině je 86 měsíců, z toho 72 měsíců pro HG pseudomyxom, pro LG pseudomyxom mediánu přežití nebylo dosaženo (Graf 1, 2), (p=0.03).
Graf 1. Přežití u pacientů s PMP po CRS a HIPEC (medián přežití)
Graph 1: Median survival of patients undergoing CRS and HIPEC
Graf 2. Srovnání přežití u pacientů HG a LG PMP po CRS a HIPEC
Graph 2: Comparison of survival in HG and LG PMP patients undergoing CRS and HIPEC
Celková morbidita v našem souboru činila 27,3 %, přičemž dle hodnocení Clavien-Dindo se komplikace I. a II. stupně vyskytovaly u 5 pacientů (6,8 %), III. a IV. stupně u 15 pacientů (20,5 %), 4 pacienti zemřeli (5,4 %) − (Tab. 1, 2).
Tab. 1. Výskyt komplikací v celém souboru CRS, HIPEC
Tab. 1: Complications of CRS and HIPEC
Tab. 2. Výskyt komplikací dle klasifikace Clavien-Dindo
Tab. 2: Complications according to Clavien-Dindo classification
Mortalita byla způsobena u 2 pacientů těžkým dřeňovým útlumem. Příčinou úmrtí dalších pacientů bylo multiorgánové selhání, u prvního způsobené těžkou nekrotizující pankreatitidou, u druhého pak insuficiencí anastomózy.
Statisticky byly křivky přežívání hodnoceny podle Kaplan-Meiera, pro srovnání dat přežívání byl použit log-rank test.
Re-do chirurgie
V souboru pacientů opakovaně operovaných bylo 18 pacientů (24,6 %), 14 mužů a 4 ženy. Průměrný věk v této skupině byl u mužů 48,8, u žen 47 let.
Celkem bylo provedeno 23 re-do operací, 15 pacientů bylo operováno 2×, 1 pacient 3× a 2 pacienti 4×.
V této skupině sledovaných nebylo zaznamenáno žádné úmrtí, u 9 pacientů nebyly zachyceny žádné komplikace. U 5 pacientů (27,8 %) se vyskytovaly komplikace dle klasifikace Clavien-Dindo I. a II. stupně, u 4 nemocných (22,2 %) pak byly zaznamenány komplikace III. stupně.
Komplikace IV. a V. stupně se v této skupině nevyskytly (Tab. 3).
Tab. 3. Výskyt komplikací re-do chirurgie T
Tab. 3: Complications of re-do surgery
Diskuze
Metoda léčby PMP na naší klinice vychází z principů prof. Sugarbakera spočívajících v maximální možné cytoredukci, která je doplněna peroperační hypertermickou aplikací cytostatika dle rozpisu klinického onkologa včetně EPIC.
WHO klasifikace dělí PMP na low grade (LG) a high grade (HG).
Low grade typ PMP je typický pomalým, neinvazivním a nedestruktivním růstem, bez tvorby metastáz. Nejčastěji je spojován s nezhoubným mucinózním tumorem apendixu (mucocele).
Naproti tomu high grade PMP je charakterizován invazivitou, vysokou mírou agresivity a destrukce. Často tvoří hematogenní i lymfogenní metastázy a je biologicky blízko k high grade mucinóznímu adenokarcinomu. Této charakteristice odpovídají i klinické výsledky léčby, potvrzené i naší sestavou (Graf 2).
Jako další histologický podtyp high grade PMP je popisován tumor charakterizovaný přítomností buněk tvaru pečetního prstene (signet ring cell), jehož chování je obecně velmi invazivní a agresivní, se špatnou klinickou prognózou [4,5,6]. V našem souboru nebyl zaznamenán.
Cílem diagnostiky je verifikace procesu, stanovení rozsahu onemocnění ve vztahu k další léčbě, provedení odhadu prognózy a délky přežití. Opírá se o anamnézu, klinický nález, histologické vyšetření a předoperační stanovení rozsahu onemocnění tzv. PCI (peritoneal cancer index) pomocí zobrazovacích metod.
Mezi základní metody stanovování předoperačního PCI patří multidetektorové CT s multiplanární rekonstrukcí nebo 3dimenzionální CT s vysokým rozlišením.
Ostatní vyšetření (PET CT, MRI…) jsou prováděna při diagnostických rozpacích, či k vyloučení extraabdominálních metastáz.
Pozitivní prediktivní hodnota radiologických metod ve srovnání s chirurgickými metodami se pohybuje okolo 85 %, negativní prediktivní hodnota je pak udávána cca 56 % [7,8].
Kromě běžných laboratorních vyšetření nutných k posouzení stavu pacienta a únosnosti dlouhého chirurgického výkonu je doporučováno provádět i odběry CEA, CA 19.9 a CA 125. Hladina těchto onkologických markerů může být dalším faktorem predikce rozsahu postižení dutiny břišní PMP, dlouhodobého přežití (OS) i progrese onemocnění (PFS).
Vzhledem ke vzácnému výskytu onemocnění je někdy k potvrzení diagnózy nutné i opakované čtení a hodnocení histologických vzorků zkušeným centrovým patologem [9,10].
K posouzení rozsahu onemocnění v dutině břišní během operace se u nás i ve světě stanovuje tzv. peroperační PCI − Obr. 2.
Obr. 2. Peritonealcancer index (PCI)
Pro každou vyznačenou oblast (0−12) se určuje velikost přítomné léze, tzv. „lesion size“ (LS 0-3), součet LS z jednotlivých oblastí pak určuje PCI
Fig. 2: Peritonealcancer index (PCI)
Lesion size (LS 0−3) is specified for each designated area (0−12), amount of individual lesions (LS) determines PCI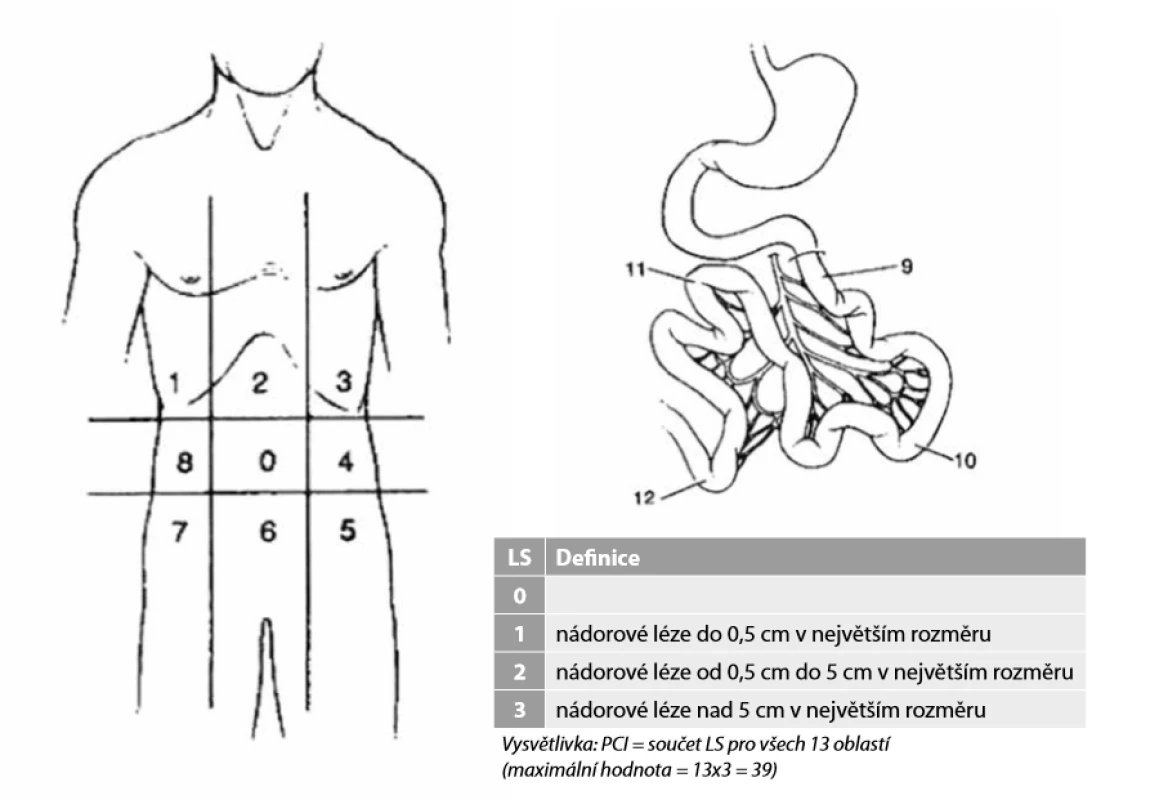
PCI hodnotí nejen rozsah onemocnění v dutině břišní, ale spoluurčuje prognózu, přežití a výskyt komplikací. K dalším klinickým dopadům PCI patří i ovlivnění indikace k provedení vlastního CRS a HIPEC výkonu. Toto platí nejen u PMP, ale i u jiných onemocnění způsobujících peritoneální karcinomatózu (např. karcinom žaludku, kolorektální a ovariální karcinom, mezoteliom).
Nález hodnoty PCI nad 20 u peritoneální karcinomatózy má velmi špatnou prognózu (i přes ev. provedení CRS a HIPEC), proto by se u těchto pacientů výkon provádět neměl.
Jiná situace je u PMP, kde lze zpravidla provést kompletní odstranění tumoru i u hodnoty PCI okolo 28, inkompletní pak i u hodnot PCI vyšších [11,12].
V naší sestavě bylo průměrné PCI 18,6, 43 pacientů (58,9 %) mělo PCI do 20, u 30 pacientů (41,1 %) se PCI pohybovalo v rozmezí 20−39.
Efektivita CRS je posuzována pomocí CC-skóre – completness of cytoreduction after surgery. CC-skóre hodnotí úplnost chirurgické cytoredukce posouzením nuceně ponechaných zbytků nádoru v dutině břišní po chirurgickém výkonu. Dle velikosti nuceně ponechaných reziduálních nádorových hmot se pacienti dělí do 4 skupin (Obr. 3).
Obr. 3. CC skóre (0−3) je určeno dle velikosti zbylých solitárních ložisek po provedené cytoreduktivní chirurgii (CRS)
Fig. 3: CC score (0−3) is determined by the presence of the remaining residual tumorous lesions after cytoreductive surgery (CRS)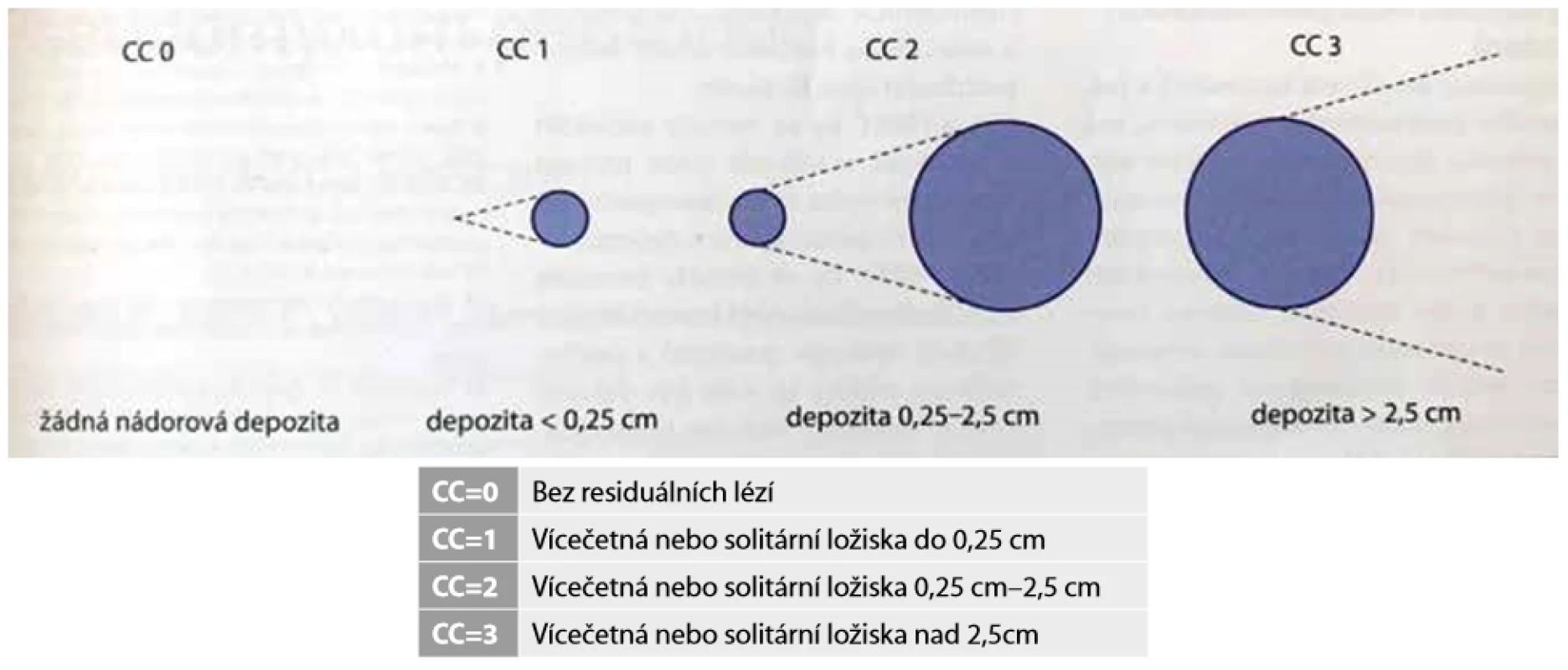
Za radikální, kurabilní, výkon je považována nejen resekce typu CC-O, ale i typu CC-1.
Důvodem je fakt, že nádorová rezidua do 0,25 cm (2,5 mm) jsou celkem spolehlivě ničena metodou HIPEC [13,14,15]. Vzhledem k tomu, že po provedení HIPEC bývá stěna střevní změněná, silně edematózní, anastomózu zakládáme pouze jednu, a to až po ukončení laváže. Při nutnosti konstrukce další anastomózy např. na tlustém střevě zakládáme protektivní střevní vývod. Tento postup považujeme za racionální, neboť při obnovení kontinuity lze provést second look, ev. HIPEC opakovat.
Výsledky metody (CRS a HIPEC) v léčbě PMP udávané v literatuře jsou velice povzbudivé.
2leté přežití se pohybuje okolo 90 %, 3leté 60−90 %, 5 a 10leté přežití po kompletní CRS a HIPEC se udává 80−85 %, resp. 60−68 %. 15leté přežití pak 55−60 %.
Retrospektivní analýza dat multicentrického registru pacientů s PMP ze 16 velkých center [16], kteří podstoupili CRS a HIPEC, udává medián PFS (interval do progrese onemocnění) 98 měsíců a medián OS (přežití) 196 měsíců. 20leté přežití pacientů s CRS a HIPEC pro low grade PMP vznikajícího na základě nádorového onemocnění apendixu ve srovnání se systémovou chemoterapií je 70 % versus 0 %. Mortalita CRS a HIPEC se pohybuje v rozmezí od 0 do 12 %.
V centrech se zaměřením na CRS a HIPEC je udávána 1−5 %. Úplnost resekce (pozitivní rizikový faktor) je v centrech obvykle lepší, udává se 70−75 % [16,17,18,19].
Celkový výskyt komplikací po CRS chirurgii a HIPEC je 27–56 %.
Nejčastěji se u pacientů objevují plicní (10–16 %) a hematologické komplikace (4–39 %), z nichž nejčastějšími jsou neutropenie, trombocytopenie a leukopenie.
Neutropenie je spojována s mortalitou kolísající mezi 0 až 66 %. Pooperační krvácení a septický šok se vyskytují přibližně v 17 %, resp. v 16 %, insuficience anastomózy (leak) je popisována v rozmezí 4,5−19 % [20,21].
Ostatní komplikace (Clavien-Dindo III. a IV. stupně) jsou méně časté [20,21].
Ze strany pacientů je CRS a HIPEC chirurgie hodnocena velmi pozitivně, 80 % pacientů, kteří podstoupili CRS a HIPEC, bylo spokojeno a uváděli, že zmíněná léčba neměla žádný negativní dopad na kvalitu jejich následného života [22]. Námi získané výsledky, počty úmrtí i frekvence komplikací výše uvedené statistiky z velkých center plně potvrzují.
Re-do chirurgie
Recidiva onemocnění se objevuje u PMP i po kompletní CRS a HIPEC obvykle u 25−30 % pacientů do 22−30 měsíců od primárního výkonu. Časový medián se udává cca 26 měsíců.
U 25−30 % pacientů postižených recidivou je možné provést tzv. re-do chirurgii (opakovaná revize dutiny břišní spojená s CRS + HIPEC).
Kompletní provedení CRS je možné až u 50−60 % pacientů. Perioperativní morbidita u těchto výkonů se pohybuje v rozmezí 15−76 %, mortalita 0−17 % [23]. V naší sestavě 18 nemocných, kdy průměrné PCI bylo 18,8, byla morbidita dle Clavien-Dindo klasifikace III. stupně 22,2 % a mortalita nulová.
Opakovaný chirurgický zákrok (CRS a HIPEC) pacientovi přináší delší přežití (OS).
3leté přežití je udáváno až ve 100 % a 5leté přežití pak okolo 90 %. Tam, kde re-do CRS nebyla provedena, přežívá 3 roky jen 50−64 % pacientů [23]. V literatuře lze nalézt i práce, které tyto výsledky re-do chirurgie nepotvrzují [24]. Naše malá podskupina pacientů (18), kteří podstoupili tuto léčbu, však dává spíše za pravdu těm, kteří opakované zákroky CRS a HIPEC u vybraných pacientů doporučují.
Závěr
Naše zkušenosti i výsledky s léčbou PMP jsou srovnatelné s výsledky renomovaných světových center prezentovaných ve světové literatuře.
CRS a HIPEC je metodou volby u vybraných pacientů s onemocněním (syndromem) PMP.
Pacienti indikovaní pro tuto metodu by měli být diskutováni předem ve specializovaných multidisciplinárních týmech jednotlivých peritonektomických center.
Vzhledem k vyšší morbiditě, náročnosti operace a pooperační péči by tato metoda měla být aplikována výhradně a jen v těchto centrech. V léčbě PMP je CRS a HIPEC vysoce efektivní, a to i u recidiv. Velmi nízká mortalita, výrazně prodloužený PFS i OS oprávněně povýšily metodu na zlatý standard léčby tohoto nepříliš četného onemocnění.
Seznam zkratek:
PMP – pseudomyxom peritonea
HG – high grade
LG – low grade
CRS – cytoreduktivní chirurgie
HIPEC – hypertermická intraperitoneální chemoterapie
EPIC – časná pooperační intraperitoneální chemoterapie
CC-skóre – skórovací systém – úplnost chirurgické cytoredukce (completness of cytoreduction after surgery)
RE-DO – opakovaný chirurgický zákrok stejného charakteru
OS – celkové přežití
PFS – interval do progrese onemocnění
MDT – multidisciplinární tým
PS – personal status (osobní stav)
CT – počítačová tomografie
PET CT – pozitronová emisní tomografie
MRI – magnetická rezonance
CEA – karcino-embryonální antigen
CA 19-9 – nádorově specifický nádorový marker (GIT, slinivka), tzv. antigen karcinomu
CA 125 – nádorově specifický nádorový marker (ovarium)
PSOGI – Peritoneal Surface Oncology International – organizace
WHO – Světová zdravotnická organizace
Podpořeno MZ-ČR – RVO (NNB 00064211)
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Petr Bartoška
Chirurgická klinika Nemocnice Na Bulovce
Budínova 67/2
180 81 Praha
e-mail: bartoska.petr@centrum.cz
Zdroje
- Antoš F, Dytrych P. Peritoneální nádory, Chirurgická onkologie. Praha, Grada publishing 2014 : 601−613. ISBN 978-80-247-4284-7.
- Baratti D, Kusamura S, Nonaka D, et al. Pseudomyxoma peritonei: Clinical pathological and biological prognostic factors in patients treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC). Gastrointestinal Oncology 2008;15(2):526−534. doi: 10.1245/s10434-007-9691-2.
- Sugarbaker PH. Peritonectomy procedure. Ann Surg. 1995;221(1):29−42. doi: 10.1097/00000658-199501000-00004.
- Kocián R. Pseudomyxoma peritonei. Aktuální gynekologie a porodnictví 2013;5 : 10−13.
- AJCC Cancer staging manual. 8thedition 2017 : 237−239. doi: 10.1007/978-3-319-40618-3.
- Carr NJ, Cecil TD, Mohamed F, et al. Consensus for classification and pathologic reporting of pseudomyxoma peritonei and associated appendiceal neoplasia: The results of the peritoneal surface oncology group international (PSOGI) modified Delphi process. Am J Surg Pathol. 2016;40(1):14−26. doi:10.1097/PAS.0000000000000535.
- Dineen SP, Royal RE, Hughes MS, et al. A simplified preoperative assessment predicts complete cytoreduction and outcomes in patients with low-grade mucinous adenocarcinoma of the appendix. Annals of Surgical Oncology 2015;22 : 3640−3646. doi: 10.1245/s10434-015-4446.
- Flicek K, Ashfaq A, Johnson CD, et al. Correlation of radiologic with surgical peritoneal cancer index scores in patients with pseudomyxoma peritonei and peritoneal carcinomatosis: How well can we predict resectability? J Gastrointest Surg. 2016;20(2):307−312.doi: 10.1007/s11605-015-2880-6.
- Canbay E, Ishibashi H, Sako S, et al. Preoperative carcinoembryonic antigen level predicts prognosis in patients with pseudomyxoma peritonei treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. World Journal of Surgery 2013;37(6):1271-1276. doi: 10.1007/s00268-013-1988-7.
- Kusamura S, Baratti D, Hutanu I, et al. The role of baseline inflammatory-based scores and serum tumor markers to risk stratify pseudomyxoma peritonei patients treated with cytoreduction (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC). EJSO the Journal of Cancer Surgery 2015;41(8):1097−1105. doi: 10.1016/j.ejso.2015.04.005.
- Sugarbaker PH. Cytoreductive surgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome. European Journal of Surgica Oncology 2001;27(3):239−243. doi: 10.1053/ejso.2000.1038.
- Antoš F. Léčení diseminovaných nádorů dutiny břišní pomocí peritonektomie a peroperační hypertermické chemoterapie s možností profylaktického užití u kolorektálních karcinomů – závěrečná zpráva grantového projektu IGA MZ ČR NR 8414/5.
- Sugarbaker PH. New standard of care for appendiceal epithelial neoplasms and pseudomyxoma peritonei syndrome? Lancet Oncol. 2006;7(1):69−76, doi: 10.1016/s1470-2045(05)70539-8.
- Yan Li, Yun-Feng Zhou, Han Liang, et al. Chinese expert consensus cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal malignancies. World Journal of Gastroenterology 2016;22(30):6906−6916. doi: 10.3748/wjg. v 22. i30.6906.
- Antoš F, Vítek P, Kopic J, et al. Cytoreduktivní chirurgie a hypertermická peroperativní chemoterapie (HIPEC) v léčbě malignit peritoneálních povrchů. Onkologická revue 2018;5(2):62−67.
- Chua TC, Moran BJ, Sugarbaker PH, et al. Early and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol. 2012;30(20):2449−2456. doi: 10.12OO/JCO.2011.39.7166.
- Iversen LH, Rasmussen PC, Hagemann-Madsen R, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for peritoneal carcinomatosis: the Danish experience. Colorectal Dis. 2013;15(7):e365−e372. doi: 10.1111/codi.12185.
- Ansari N, Chandrakumaran K, Dayal S, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in 1000 patients with perforated appendiceal epithelial tumours. Eur J Surg Oncol. 2016;42(7)1035−1041. doi: 10.1016/j.ejso.2016.03.017.
- Moran B, Cecil T, Chandrakumaran K, et al. The results of cytoreductive surgery and hyperthermic intraperitonealchemotherapy in 1200 patients with peritoneal malignancy, colorectal disease. Colorectal Dis. 2015;17(9):772−778. doi: 10.1111/codi.12975.
- Mehta SS, Gelli M, Agarwal A, et al. Complications of cytoreductive surgery and HIPEC in the treatment of peritoneal metastasis. Indian J Surg Oncol. 2016;7(2):225−229. doi: 10.1007/s13193-016-0504-6.
- Saxena A, Yan TD, Morris DL. Critical assessment of risk factors for complications after cytoreductive surgery and perioperative intraperitoneal chemotherapy for pseudomyxoma peritonei. Ann Surg Oncol. 2010;17(5)1291−1301. doi: 10.1245/s10434-009-0875-9.
- Kirby R, Winston L, Zhao J, et al. Quality of life study following cytoreductive surgery and ntraperitoneal chemotherapy for pseudomyxoma peritonei including redo procedures. International Journal of Surgical Oncology 2013, On-line. doi: 10.1155/2013/461041.
- Delhorme JB, Honoré C, Benhaim L, et al. Long-term survival after aggressive treatment of relapsed serial or distant pseudomyxoma peritonei. Eur J Surg Oncol. 2017 Jan;43(1):159-167. doi: 10.1016/j.ejso.2016.08.021.
- Lord AC, Shihab O, Chandrakumaran K, et al. Recurrence and outcome after complete tumour removal and hyperthermic intraperitoneal chemotherapy in 512 patients with pseudomyxoma peritonei from perforated appendiceal mucinous tumours. Eur J Surg Oncol. 2015;41(3):396−399. doi: 10.1016/j.ejso.2014.08.476.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- HIPEC
- Aktuální možnosti minimálně invazivní terapie divertiklů jícnu
- Pseudomyxom peritonea (PMP) a jeho léčba − dvacetileté zkušenosti jednoho pracoviště
- Výsledky chirurgickej liečby nádorových trombov dolnej dutej žily pri karcinóme obličky
- Chirurgická léčba karcinomu prsu po neoadjuvantní terapii
- Cirkulující nádorová DNA jako biomarker metastazujícího kolorektálního karcinomu − kazuistika
- Podtlaková terapie − účinky a jejich využití, soubor kazuistik
- Komplikovaný priebeh u pacientky s cervikálnou krčnou fascitídou a descendentnou nekrotizujúcou mediastinitídou – kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pseudomyxom peritonea (PMP) a jeho léčba − dvacetileté zkušenosti jednoho pracoviště
- Podtlaková terapie − účinky a jejich využití, soubor kazuistik
- Aktuální možnosti minimálně invazivní terapie divertiklů jícnu
- Chirurgická léčba karcinomu prsu po neoadjuvantní terapii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



