-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
Hyperthermic intraoperative intrapleural chemotherapy and surgical cytoreduction as part of multimodal treatment of malignant pleural mesothelioma – case report M. Szkorupa1, D. Klos1, J. Chudacek1, J. Hanuliak1, M. Stasek1, O. Fischer2, R. Lemstrova3
Malignant pleural mesothelioma is one of the most aggressive malignancies with a very poor prognosis. Multimodal treatment consisting of three modalities – chemotherapy, radiotherapy and cytoreductive surgery is optimal. The use of new therapeutic modalities, such as hyperthermic intraoperative intrapleural chemotherapy or photodynamic therapy can improve the current results of mesothelioma treatment. Combined hyperthermic intraoperative chemotherapy and cytoreductive surgery as part of multimodal therapy of malignant mesothelioma has been used since 2017 at the 1st Department of Surgery of University Hospital Olomouc. The authors report the case of a 47-year-old man with malignant epithelioid mesothelioma of the left pleural cavity. Following neoadjuvant chemotherapy, this patient underwent extrapleural pneumonectomy with intraoperative intracavitary hyperthermic chemotherapy. The postoperative period was complicated by circulatory instability and later by tension fluidothorax with signs of heart failure. Currently, 8 months have elapsed from the surgery and the patient remains without any signs of recurrence.
Autoři: Hyperthermic Intraoperative Intrapleural Chemotherapy; Surgical Cytoreduction As Part Of Multimodal Treatment Of Malignant Pleural Mesothelioma-Case Report; M. Szkorupa 1; Dušan Klos 1
; J. Chudacek 1; J. Hanuliak 1; M. Stasek 1; O. Fischer 2; R. Lemstrová 3
Působiště autorů: I. Chirurgická klinika, Fakultní nemocnice Olomouc 1; Klinika plicních nemocí a tuberkulózy, Fakultní nemocnice Olomouc 2; Onkologická klinika, Fakultní nemocnice Olomouc 3
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 10, s. 456-461.
Kategorie: Kazuistika
Souhrn
Maligní mezoteliom pleury patří k nejagresivnějším maligním onemocněním s velmi špatnou prognózou. Optimální je multimodální způsob léčby, který zahrnuje tři modality − chemoterapii, radioterapii a cytoreduktivní chirurgii. Možností, jak zlepšit dosavadní výsledky léčby mezoteliomu, je zařazení dalších metod léčby, např. hypertermické peroperační intrapleurální chemoterapie či fotodynamické terapie.
Na I. chirurgické klinice Fakultní nemocnice Olomouc se kombinace hypertermické peroperační chemoterapie spolu s cytoreduktivní chirurgií v rámci multimodální terapie maligního mezoteliomu využívá od roku 2017. Autoři uvádějí případ 47letého muže s maligním epiteloidním mezoteliomem pleury vlevo. Po neoadjuvantní chemoterapii byla u tohoto pacienta provedena extrapleurální pneumonektomie s peroperačním intrakavitárním podáním hypertermické chemoterapie. Pooperační průběh byl komplikován nestabilitou oběhu a později tenzním chováním fluidotoraxu se známkami srdečního selhání. Pacient je v současnosti 8 měsíců po operaci a bez známek recidivy nemoci.
Klíčová slova:
pleural mesothelioma – surgery − multimodal therapy − intraoperative hyperthermic chemotherapy
Úvod
Maligní mezoteliom pleury (MPM) je agresivní maligní onemocnění, které postihuje častěji muže a má sice nízkou incidenci (muži 10–66/1 000 000, ženy 1–25/1 000 000), bohužel však velmi špatnou prognózu. Z rizikových faktorů je zásadní dlouhodobá expozice azbestu, mohou se uplatňovat i faktory genetické, záření, keramická vlákna a viry. Histopatologicky se dělí na 3 typy – epiteloidní, sarkomatoidní a bifázický, z nichž nejlepší prognózu má forma epiteliální. Mezi další příznivé prognostické faktory patří nízký PS (performance status), ženské pohlaví, věk do 50 let, časné stadium, nepřítomnost bolestí hrudníku v době diagnózy a normální počet leukocytů a trombocytů v periferní krvi. Maligní mezoteliom pleury je řazen podle klinické klasifikace TNM maligních onemocnění do stadií I–IV, přičemž medián přežívání je u jednotlivých stadií 21,19,14 a 10 měsíců. Podle doporučení napříč onkologickými společnostmi (NCCN, ASCO, ESMO) je ve stručnosti kandidátem multimodální terapie, zahrnující chemoterapii, radioterapii a chirurgii, nemocný s epiteliálním, event. bifázickým typem mezoteliomu ve stadiu I–III, s dobrým PS a vyloučeným extratorakálním výskytem nemoci nebo pokročilým postižením lymfatických uzlin. Posloupnost a zařazení jednotlivých modalit léčby je na rozhodnutí multioborového týmu, který zahrnuje chirurga, onkologa, pneumologa, radioterapeuta, radiologa a při rozhodnutí o chirurgickém řešení i anesteziologa. Možností je zařazení chemoterapie a radioterapie jako indukční nebo adjuvantní v závislosti na pokročilosti onemocnění. Chirurgická fáze léčby představuje cytoreduktivní výkon. U maligního pleurálního mezoteliomu nelze splnit parametr R0 resekce, proto se hovoří o tzv. makroskopicky maximální (kompletní) resekci. Té lze v současnosti dosáhnout dvěma typy operací, a to rozšířenou radikální dekortikací (EPD) a extrapleurální pneumonektomií (EPP). EPD zahrnuje odstranění parietální i viscerální pleury se zachováním nejčastěji celého plicního křídla, doplněná popřípadě resekcí bránice a perikardu. U EPP je odstraněno celé plicní křídlo s celou parietální i mediastinální pleurou, bránice i perikard a představuje nejradikálnější výkon pro MPM, který je ale zatížen také vyšším procentem pooperační morbidity a mortality [1−5].
HITHOC, tedy hypertermická peroperační intrapleurální chemoterapie, je možnou přídavnou modalitou léčby pleurálních malignit, která může přinést zlepšení regionální kontroly nemoci a její historie sahá již do 90. let minulého století. Představuje intratorakální laváž hrudníku cytostatikem zahřátým na 38−42 °C pomocí extrakorporální pumpy. Laváž je prováděna, po chirurgické cytoredukci, v uzavřeném nebo otevřeném systému. Nejčastěji užívanými cytostatiky jsou cisplatina, doxorubicin nebo mitomycin. Mechanismus účinku spočívá v lokálním působení cytostatika s omezenou systémovou toxicitou, potencovaný vyšší teplotou roztoku, který zajišťuje zvýšenou vnímavost nádorových buněk. Cílem je prodloužení doby do progrese nemoci a prodloužení celkového přežívání. HITHOC je nejčastěji využíván právě u maligního mezoteliomu, dále jej lze indikovat u diseminace maligního thymomu a experimentálně i u léčby maligních výpotků karcinomu plic, prsu či ovaria [6,7].
Na I. chirurgické klinice Fakultní nemocnice Olomouc se kromě cytoreduktivní chirurgie maligního mezoteliomu pleury využívá od roku 2017 i metoda HITHOC.
Kazuistika
Pacient, 47letý vědecký pracovník jihoasijského etnika, si vyhledal naše pracoviště poté, co mu byl diagnostikován maligní epiteloidní mezoteliom pleury ve spádové nemocnici. Primárními příznaky byly dušnost při zátěži, intermitentní bolesti levé poloviny hrudníku, bez kašle, teplot či hemoptýzy. Na skiagramu srdce a plic byl nález nehomogenního zastření v levém dolním plicním poli více laterálně s možným podezřením na empyém či hypoventilaci. Na echokardiografii byla popsána separace perikardu s kapsou organizovaného výpotku apikolaterálně, difuzní hypokinézou a nízkou ejekční frakcí 35 %. V rámci diagnostického protokolu bylo dále provedeno CT a později PET CT hrudníku, bronchoskopie a biopsie pleury s nálezem FDG (fluorodeoxyglukóza) avidního nepravidelného plošného zesílení pleury levého hemithoraxu tloušťky až 22 mm, nejvýrazněji v oblasti segmentů S1-2, S4-6 a S9-10 s možným prorůstáním do mediastinálního tuku při oblouku a sestupné aortě, invaze do hlubších vrstev hrudní stěny nebyla patrná. Byl přítomen široký kontakt s perikardem bez infiltrace srdečních struktur, nález pouze jedné lehce zvětšené mediastinální uzliny subaortálně 11x6 mm s lehce vyšší akumulací FDG, bez známek jiné generalizace. Bronchoskopie prokázala normální endobronchiální nález a z biopsie pleury vyšel histologický nález maligního epiteliálního mezoteliomu. V pracovní anamnéze bez kontaktu a expozici azbestu, výzkumný pracovník, který v minulosti pracoval v Japonsku v kosmickém výzkumu s uhlíkovými tyčinkami (Obr. 1).
Obr. 1. Předoperační PET CT s postižením levého hemithoraxu maligním mezoteliomem, nádorová tkáň prorůstá do plicního parenchymu a ventrálně do mediastina s intimním vztahem k perikardu
Fig. 1: Preoperative PET CT with involvement of the left hemithorax with malignant mesothelioma. Tumor tissue grows into the lung parenchyma and into the anterior mediastinum adjacent to the pericardium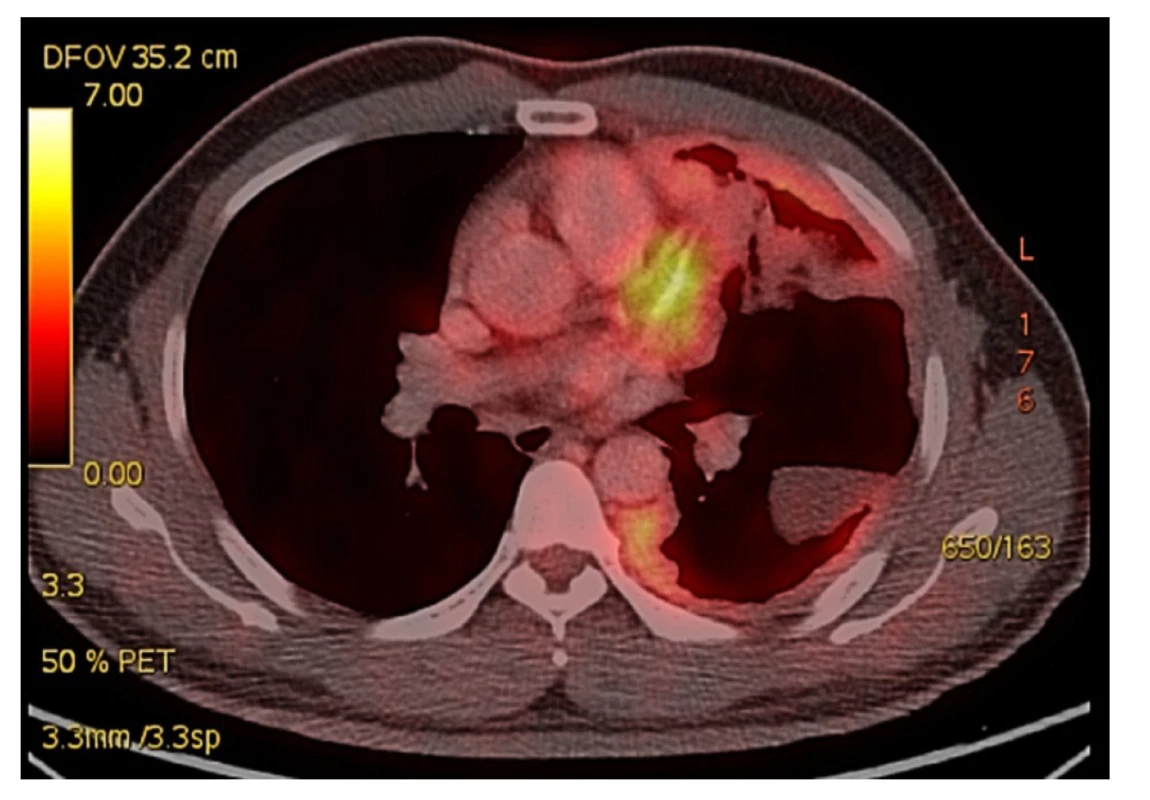
V první době byla pacientovi podána indukční chemoterapie ve složení karboplatina + pemetrexed, celkově 4 cykly. Původně zvažovaná cisplatina byla onkologem kontraindikována pro výše uvedený kardiální nález. Kardiolog hodnotil kardiální postižení u mladého nemocného nejspíše jako důsledek proběhlé myokarditidy. Indukční chemoterapii pacient snesl bez komplikací. Následovalo restagingové CT, které neprokázalo významnou regresi, ale ani progresi původního nálezu. Doplnili jsme kontrolní echokardiografii, která prokázala dilataci a středně těžkou systolickou dysfunkci levé komory s diastolickou poruchou relaxace. Z kardiologického hlediska byl pacient hodnocen jako rizikový, nicméně v té době dobře kardiopulmonálně kompenzovaný. Ventilačně perfuzní scintigrafie popsala levostranně oslabenou perfuzi i ventilaci s podílem levá:pravá plíce=30 %:70 %. Při spiroergometrii dosáhl pacient maximálního výkonu 159 kW a maximální spotřebu kyslíku VO2 peak/kg/min. 19,7, tzn., že z kardiorespiračního hlediska byl pacient schopen podstoupit levostrannou pneumonektomii. Celkový nález byl probrán na mezioborovém onkologickém semináři a schválen navrhovaný výkon – extrapleurální pneumonektomie s HITHOC.
Po pečlivé přípravě jsme provedli operaci z rozšířené posterolaterální torakotomie pátým mezižebřím s resekcí šestého žebra, později jsme připojili i druhou torakotomii osmým mezižebřím z původního kožního řezu z důvodu přehlednějšího přístupu k resekci bránice a její náhradě. Po resekci šestého žebra a uvolnění pleury jsme pokračovali parietální pleurektomií směrem do kupuly a poté k hilu se snesením i celé mediastinální pleury, kdy zůstaly obnaženy cévní a nervové struktury. Pokračovali jsme pleurektomií od torakotomie směrem distálně k bránici, dorzálně s obnažením celé sestupné aorty a jícnu, ventrálně pak s resekcí celé levé poloviny perikardu. Pacient reagoval na jakoukoliv i šetrnou manipulaci se srdcem výraznou nestabilitou oběhu – hypotenzí a arytmií, s nutností přerušení výkonu do stabilizace stavu. Po dokončení resekce perikardu a získání přístupu k cévním a bronchiálním strukturám jsme provedli pneumonektomii podvazem a přerušením levostranného kmene pulmonální tepny, horní a dolní plicní žíly a hlavního bronchu, jehož pahýl byl uzavřen staplerovou suturou. Resekci jsme dokončili odstraněním celé levé poloviny bránice. Obvykle se snažíme šetřit brániční peritoneum především z důvodu vodotěsnosti při proplachu hrudníku cytostatikem, což v tomto případě nebylo možné, poněvadž peritoneum bylo pevně srostlé s bránicí a stripping nebylo možné provést. Takto byl celý resekát en bloc odstraněn z hrudníku. Výkon jsme doplnili systematickou mediastinální lymfadenektomií. Rekonstrukci bránice jsme provedli záplatou Bard Dulex Mesh®, což je nepropustná polytetrafluoroethylenová síťka, používaná při rekonstrukci abdominálních kýl. Rekonstrukci perikardu jsme provedli náhradou z polypropylenové síťky (Obr. 2, 3). Po kontrole operačního pole byl založen hrudní drén a také dva lavážní drény pro cytostatikum. Po uzavření hrudní stěny byla na lavážní drény napojena extrakorporální pumpa, pomocí které se levý hemitorax naplnil ohřívaným fyziologickým roztokem o objemu 3000 ml (300 ml/min.) až na teplotu 41 °C. Po naplnění hrudníku roztokem došlo u pacienta k velmi závažné oběhové nestabilitě, těžké hypotenzi a tachykardii, na kterou jsme reagovali redukcí objemu lavážní tekutiny (o 500 ml) a tekutinovou volumoterapií, po kterých došlo ke stabilizaci stavu. Poté bylo možno dokončit laváž, kdy byl hrudník proplachován naředěným ohřátým roztokem cisplatiny v množství 125 mg (odpovídá 75 mg/m2). Cisplatina byla naředěna v 500 ml ohřátého fyziologického roztoku na 41 °C. Na našem pracovišti používáme k laváži systém s extrakorporální pumpou fy Skala. Laváž probíhala 90 minut, celý výkon pak trval 310 minut. Krevní ztráty byly odhadovány na 1500 ml.
Obr. 2. Pohled do levého hemithoraxu po extrapleurální pneumonektomii – kompletně odstraněná levá plíce, parietální i mediastinální pleura, perikard a bránice. Do hrudníku prominuje levý lalok jaterní.
Fig. 2: View of the left hemithorax after extrapleural pneumonectomy – completely resected left lung, parietal and mediastinal pleura, the pericardium and the diaphragm. The left lobe of the liver protrudes into the chest.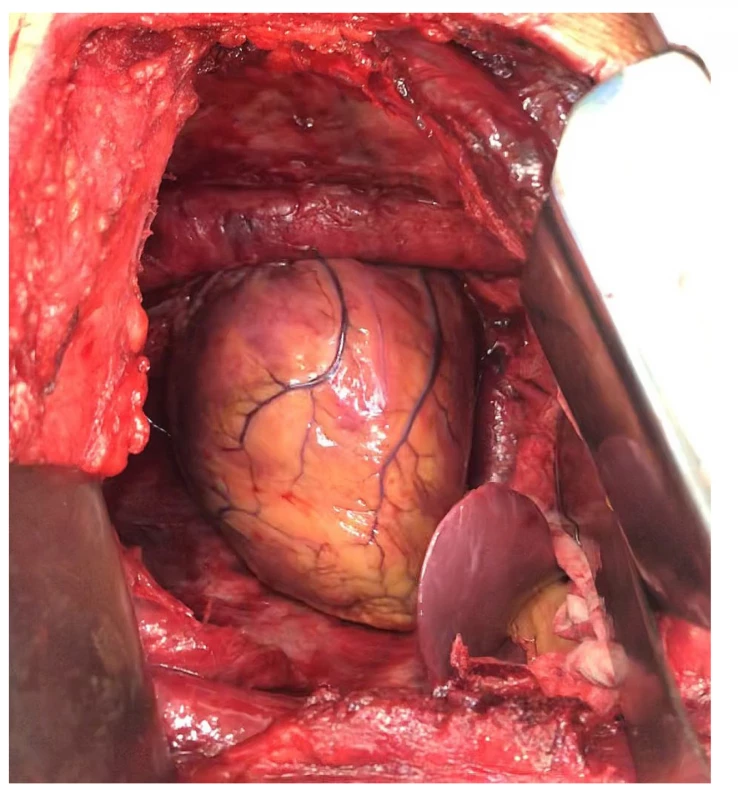
Obr. 3. Stav po náhradě bránice záplatou Bard Dulex Mesh® a perikardu polypropylenovou síťkou
Fig. 3: Condition after replacement of the diaphragm with a Bard Dulex Mesh® patch and pericardium with a polypropylene mesh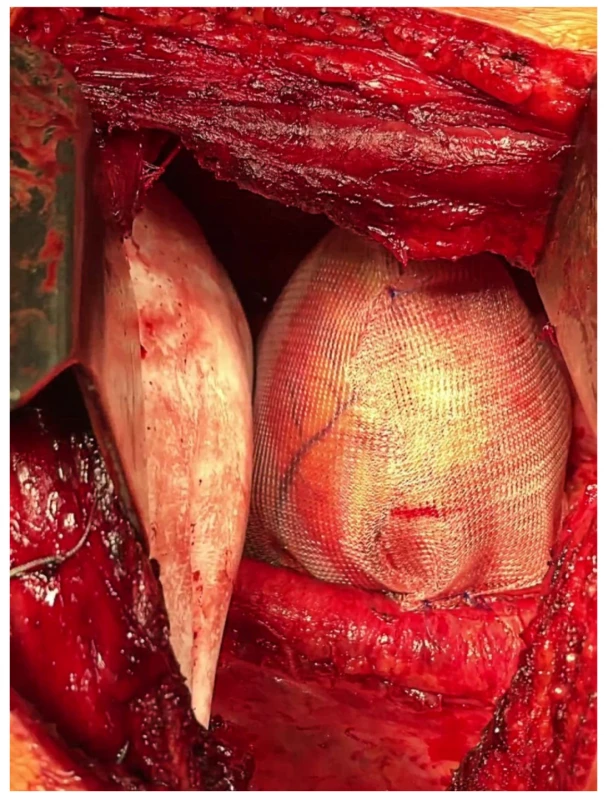
Pacient byl v prvních dnech po výkonu na umělé plicní ventilaci, oběhově nestabilní, s podporou vasopresory. Došlo k přesunu mediastina na operovanou stranu, což jsme řešili uzavřením hrudního drénu se sekvenční evakuací výpotku. Poté, co byl hrudní drén zcela ponechán uzavřený, došlo k úpravě polohy mediastina a stabilizaci stavu a oběhu. Pacient byl extubován 4. den po operaci, pro anemizaci podány 2 krevní převody. Postupně byla snižována podpora vasopresory. Hrudní drén byl extrahován 6. pooperační den, pacient byl realimentován, rehabilitován. Od 9. dne došlo ke zhoršování dušnosti, objevily se známky srdečního selhávání i přes diuretickou léčbu. Na skiagramu se objevilo přetažení mediastina a trachey na pravou, kontralaterální stranu, nejspíše následkem tenzního výpotku na operované straně, pro který jsme byli nuceni provést hrudní drenáž vlevo s postupnou sekvenční evakuací výpotku a pokračováním diuretické terapie. Pacient byl přeléčen antibiotiky pro známky zánětlivé kondenzace pravé plíce bazálně. Postupně došlo ke zlepšení celkového stavu, srdečního selhání i zánětlivých parametrů. Hrudní drén byl extrahován. Definitivní histologický nález prokázal epiteloidní maligní mezoteliom pleury s invazí do plicní tkáně, perikardu a bránice s metastázou v jedné lymfatické uzlině bifurkační, klasifikace TNM – ypT3 N2 MX. Pacient byl propuštěn 20. pooperační den do domácího ošetřování a předán k dalšímu sledování a léčbě spádovému onkologovi, který indikoval adjuvantní chemoterapii, tuto však pacient nebyl schopen podstoupit především z důvodu kardiálního postižení. Nemocný je nyní 8 měsíců od operace, dle kontrolního PET CT bez známek recidivy nemoci.
Diskuze
Ideální způsob léčby maligního mezoteliomu pleury bohužel v současnosti neexistuje. Jedná se o jeden z nejagresivnějších nádorů vůbec, jehož medián celkového přežívání nepřesahuje 14 měsíců. Po mnoho let nedošlo u tohoto onemocnění ke zlepšení celkového přežívání i přes pokroky v různých oblastech systémové léčby, především v biologické léčbě a imunoterapii [8].
Nejlepších výsledků u výběrové skupiny nemocných dosahuje multimodální léčba založená na třech tradičních pilířích – chemoterapii, radioterapii a chirurgii. Další možnosti léčby, které jsou v současné době zkoumány, zahrnují hypertermickou intrapleurální chemoterapii, imunoterapii, genovou terapii a fotodynamickou terapii. Dosud však nejsou k dispozici žádná randomizovaná srovnání [9].
Bohužel zdaleka ne všichni pacienti s MPM jsou schopni podstoupit multimodální terapii. Jednak pro pokročilost onemocnění, kdy většina nemocných je ve stadiu, které znemožňuje kurativní terapii. V druhé řadě pak z důvodu řady komorbidit, které limitují nemocné a kontraindikují je z možné, ale náročné radikální léčby. Pacienti schopní podstoupit celou multimodální terapii mají prokazatelně delší dlouhodobé přežívání. Optimálním kandidátem je pacient s epiteloidním MPM v časném stadiu a negativním nodálním postižením. U této skupiny pacientů lze dosáhnout mediánu přežívání od 30−51 měsíců [10].
Chirurgická fáze multimodální terapie zahrnuje cytoreduktivní výkon, jehož cílem je, jak již bylo uvedeno, makroskopická kompletní resekce, která přispívá k prodloužení přežívání nemocných. Tyto parametry splňují pouze EPP a EPD. Dříve upřednostňovaná EPP měla řadu let vysokou míru morbidity a mortality, které dosahovaly řádu až desítek procent. I přes výrazný pokrok ve snížení morbidity a mortality převážně ve vysokoobjemových centrech je poměr hospitalizační mortality ve srovnání EPP a EPD stále téměř dvojnásobný – 7 %, resp. 4 % [9]. Častou příčinou mortality u pravostranných EPP bývá bronchopleurální píštěl a s ní spojená sepse a multiorgánové selhání. Častěji se vyskytují u EPP také plicní embolie a oběhová nestabilita se srdečním selháním. Morbidita u EPP dosahuje až 50 %. U EPD bývají nejčastějšími komplikacemi atelektáza, pneumonie, protrahovaný vzduchový únik, plicní embolie a empyém a vyskytují se až u 46 % nemocných. V současnosti je pohled na srovnání EPP a EPD takový, že EPP poskytuje sice radikálnější formu chirurgické cytoredukce a je u ní nižší riziko lokální recidivy, má však významně vyšší procenta morbidity a mortality. EPD ve své rozšířené podobě s resekcí bránice a perikardu a při důsledně provedené viscerální pleurektomii má v některých studiích výsledky dlouhodobého přežívání srovnatelné s EPP za cenu nižší morbidity a mortality, navíc přináší nemocným lepší kvalitu života a v některých případech i možnost další chirurgické léčby v případě lokoregionální recidivy. Na základě těchto výsledků se zdá být metoda EPD pro cytoreduktivní chirurgii MPM přijatelnější [5,9]. Na druhé straně je nutno přihlédnout k lokálnímu nálezu postižení plicního parenchymu, protože ne vždy lze pouhou viscerální pleurektomií dosáhnout chirurgicky uspokojivé makroskopické kompletní resekce a je nutné provedení pneumonektomie.
V chemoterapii je zlatým standardem posledních deseti letech kombinace platinových derivátů s pemetrexedem, kdy bylo dosaženo mediánu celkového přežívání 12,3 měsíce. Lze použít i gemcitabin nebo vinorelbin. Druhá linie chemoterapie zatím nemá doporučený standardní postup. Pokud byl v první linii účinný pemetrexed, doporučuje se jeho podání i ve druhé linii. Biologicky cílená léčba u MPM dlouho neprokazovala efekt, nadějně se jevilo podávání bevacizumabu spolu s tradiční chemoterapií, nicméně výsledky studie nebyly tak průkazné a převažovaly nežádoucí účinky podávání bevacizumabu. Nadějná studie s nintedanibem byla předčasně ukončena pro neefektivitu. Další látky studované v klinických studiích jsou např. HSP90 inhibitory, COX2 inhibitory nebo dafactinib, zcela nové látky užívané v preklinických studiích jsou epigenetické inhibitory EZH2 u mezoteliomů s BAP1 mutací [11].
Radioterapie se vyvíjí s ohledem na její roli v multidisciplinární léčbě MPM. Dlouho byl MPM považován za rezistentní vůči radioterapii, nicméně vývoj nových radioterapeutických technik v posledních 15 letech umožnil optimalizovat vysoké dávky radioterapie s pokrytím celého hemithoraxu. Příkladem je radioterapie s modulovanou intenzitou (IMRT), jejíž užití v adjuvantní terapii po chirurgické cytoredukci, ale i jako neoadjuvantní terapie před EPP (která poté odstraní plíci ohroženou i radiační pneumonitidou) může přinést zlepšení lokální kontroly nemoci a prodloužení celkového přežívání [9,12,13].
Další možnosti léčby, například hypertermická peroperační intrapleurální chemoterapie, mají přinést zlepšení lokální kontroly nemoci, prodloužení doby do progrese nemoci a tím i celkové přežívání. V randomizovaných studiích nejsou účinky HITHOC ověřeny, nicméně v systematické review 27 prací a metaanalýze 5 z nich ohledně používání HITHOC v léčbě maligních pleurálních výpotků zjistil Zhou statisticky významný delší medián celkového přežívání a dobu přežívání bez nemoci u pacientů s provedeným HITHOC. Práce se týkaly použití HITHOC u nemocných s perioperačně provedenou cytoreduktivní chirurgií nebo po chirurgickém výkonu s primární diagnózou maligního mezoteliomu, diseminovaného thymomu, plicního karcinomu, karcinomu prsu a ovaria. Podání vysokokoncentrovaných cytostatik do pleurální dutiny umožňuje i jejich pronikání do ponechané plicní tkáně, a to až do hloubky 3−4 mm. Intrapleurální podání má tedy postihnout reziduální nádorové buňky po provedeném cytoreduktivním výkonu. V kombinaci s působením hypertermie, která sama o sobě působí selektivněji na nádorové buňky, inhibuje RNA syntézu a mitózu a v rozmezí teplot 41−43 °C způsobuje jejich apoptózu, má tak intrapleurálně podané cytostatikum lepší průnik do tkání a teplo zvyšuje jeho cytotoxicitu [6,14]. V dalších pracích Friedberga, Lang-Lazdunského a Sugerbakera je doporučováno začlenit intraoperační terapii jako čtvrtou dimenzi do konvenčnějších terapeutických protokolů trimodální léčby, ať už se jedná o intraoperační intrapleurální chemoterapii, fotodynamickou terapii či hypertermický výplach povidon-jódem [10,15,16].
Intratorakální podání hypertermických roztoků či cytostatik může být zatíženo řadou komplikací, i když jsou popisovány v nižším měřítku než u intraperitoneální aplikace (HIPEC). Je možný výskyt arytmií a oběhové nestability, související jednak s resekcí perikardu a také s náplní hrudníku hypertermickým roztokem. Pooperačně je to především renální insuficience, jejíž příčinou je nefrotoxicita cytostatika při vylučování ledvinami. Po celý perioperační průběh jsou zvykle monitorovány vitální funkce a tělesná teplota, která může být ovlivněna hypertermickým proplachem. Před - peri - a pooperačně je pacient hyperhydratován z důvodu omezení systémové toxicity a nefrotoxicity po podání cytostatika. Pooperačně je snaha o brzkou extubaci pacienta, převedení na spontánní ventilaci, pokud možno včasné vytažení hrudních drénů a komplexní rehabilitace.
Celý komplex léčby a péče o pacienty po kombinované terapii, zahrnující cytoreduktivní chirurgii a HITHOC, je velmi složitý a dobré výsledky mohou být dosaženy jen u perfektně spolupracujícího a dobře fungujícího multioborového týmu.
Závěr
Řada argumentů svědčí pro smysluplnost multimodální léčby se zařazením dalších perioperačních technik do terapie MPM, nicméně je nutné ji potvrdit v rozsáhlejších randomizovaných prospektivních studiích. S ohledem na skutečnost, že se jedná o náročnou terapii pro úzkou, selektivní skupinu pacientů, kteří jsou schopni ji podstoupit, je řešením pouze multiinstitucionální studie se zhodnocením co největšího homogenního souboru pacientů.
Seznam zkratek:
MPM − maligní mezoteliom pleury
PS − performance status
NCCN − National Comprehensive Cancer Network
ASCO − American Society of Clinical Oncology
ESMO − European Society for Medical Oncology
EPD − rozšířená radikální dekortikace
EPP − extrapleurální pneumonektomie
HITHOC - hypertermická peroperační intrapleurální chemoterapie
CT – výpočetní tomografie
PET – pozitronová emisní tomografie
FDG – fluorodeoxyglukóza
IMRT – radioterapie s modulovanou intenzitou
RNA – ribonukleová kyselina
HIPEC – hypertermická intraperitoneální chemoterapie
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Marek Szkorupa, Ph.D.
I. chirurgická klinika FN Olomouc
I. P. Pavlova 6
Olomouc 77900
e-mail: szkorupm@fnol.cz
Zdroje
- Kolek V, Kašák V, Vašáková M. Pneumologie. Maxdorf 2017.
- Pass HI, Giroux D, Kennedy C, et al. Supplementary prognostic variables for pleural mesothelioma: A report from the IASLC staging committee. Journal of Thoracic Oncology 2014;9(6):856−864. doi: 10.1097/JTO.0000000000000181.
- Davidson B. Prognostic factors in malignant pleural mesothelioma. Human Pathology 2015;46(6):789−804. doi: 10.1016/j.humpath.2015.02.006.
- Tsao AS, Wistuba I, Roth JA. Malignant pleural mesothelioma. Journal of Clinical Oncology 2009;27(12):2081. doi: 10.1200/JCO.2008.19.8523.
- Ricciardi S, Cardillo G, Zirafa CC, et al. Surgery for malignant pleural mesothelioma: An international guidelines review. Journal of Thoracic Disease 2018;10(2):S285. doi: 10.21037/jtd.2017.10.16.
- De Bree E, Van Ruth S, Baas P, et al. Cytoreductive surgery and intraoperative hyperthermic intrathoracic hemotherapy in patients with malignant pleural mesothelioma or pleural metastases of thymoma. Chest 2002;121(2):480−487. doi: 10.1378/chest.121.2.480.
- Bertoglio P, Aprile V, Ambrogi MC, et al. The role of intracavitary therapies in the treatment of malignant pleural mesothelioma. Journal of Thoracic Disease 2018;10(2):S293. doi: 10.21037/jtd.2017.10.165.
- Amin W, Linkov F, Landsittel DP, et al. Factors influencing malignant mesothelioma survival: A retrospective review of The National Mesothelioma Virtual Bank Cohort. F1000research 2018;7. doi: 10.12688/f1000research.15512.3.
- Van Schil PE, Opitz I, Weder W, et al. Multimodal management of malignant pleural mesothelioma: Where are we today? European Respiratory Journal 2014;44 : 754−764. doi:10,1183 / 09031936,00207213 2014.
- Wald O, Sugarbaker DJ. Malignant pleural mesothelioma: Key determinants in tailoring the right treatment for the right patient. Journal of Thoracic Disease 2017;9(3):485. doi: 10.21037/jtd.2017.03.27.
- Kolek V, Fischer O, Grygárková I, et al. Léčba maligního mezoteliomu pleury v České republice. Studia Pneumologica 2019;79 : 82.
- De Perrot M, Wu L, Wu M, et al. Radiotherapy for the treatment of malignant pleural mesothelioma. The Lancet Oncology 2017;18(9):E532−E542. doi: 10.1016/S1470-2045(17)30459-X.
- Gomez DR, Rimner A, Simone CB, et al. The use of radiation therapy for the treatment of malignant pleural mesothelioma: Expert opinion from The National Cancer Institute Thoracic Malignancy Steering Committee, International Association for the Study of Lung Cancer, and Mesothelioma Applied Research Foundation. Journal of Thoracic Oncology 2019;14(7):1172−1183. doi: 10.1016/S1470-2045(17)30459-X.
- Zhou H, Wu W, Tang X, et al. Effect of hyperthermic intrathoracic chemotherapy (Hithoc) on the malignant pleural effusion: A systematic review and meta-analysis. Medicine 2017;96(1). doi: 10.1097/MD.0000000000005532.
- Lang-Lazdunski L, Bille A, Papa S, et al. Pleurectomy/decortication, hyperthermic pleural lavage with povidone-iodine, prophylactic radiotherapy, and systemic chemotherapy in patients with malignant pleural mesothelioma: A 10-year experience. The Journal of Thoracic and Cardiovascular Surgery 2015;149(2):558−566. doi: 10.1016/j.jtcvs.2014.10.041.
- Friedberg JS, Simone CB II, Culligan MJ, et al. Extended pleurectomy-decortication–based treatment for advanced stage epithelial mesothelioma yielding a median survival of nearly three years. The Annals of Thoracic Surgery 2017;103(3):912-919. doi: 10.1016/j.athoracsur.2016.08.071.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Minimalizace a maximalizace v hrudní chirurgii
- Využití mimotělních podpor v hrudní chirurgii
- Pooperační chylothorax − souhrnné sdělení
- Léčba insuficience hrudní anastomózy po Ivor Lewis ezofagektomii
- Maligní onemocnění po transplantaci plic
- Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
- Problematika plicních metastáz při pseudomyxomu peritonea – kazuistika a přehled literatury
- Plicní arteriovenózní malformace řešená videoasistovanou torakoskopickou lobektomií
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pooperační chylothorax − souhrnné sdělení
- Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
- Maligní onemocnění po transplantaci plic
- Využití mimotělních podpor v hrudní chirurgii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



