-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Reverzný prístup k synchrónnym pečeňovým metastázam kolorektálneho karcinómu
Absolvovanie liečebného protokolu, strednodobé (trojročné) prežívanie a vzorec progresie ochorenia u 32 pacientov
Reverse strategy for synchronous colorectal liver metastases Therapeutic protocol completion, 3-year survival and progression pattern in 32 patients
Introduction:
Reverse, liver-first strategy is an alternative for patients with complicated liver metastases where disease progression would prove inoperable, or for patients with locally advanced pelvic disease where postoperative complications after primary tumour resection may lead to delayed treatment of metastatic disease.Methods:
Retrospective unicenter analysis of 32 patients approached liver-first approach between 2011 and 2015. During this period reverse strategy was considered a preferred approach for all initially or potentially resectable synchronous colorectal liver metastases based on multidisciplinary team consensus.Results:
26 patients (81.3%) completed their surgical plan (hepatectomy and primary tumour resection) but only 16 (50%) completed their oncosurgical plan (hepatectomy, primary tumour resection and full dose and length of perioperative or adjuvant systemic (bio)chemotherapy). Median overall survival was 50.5 months with the survival rate of 83.7% at 3 years. 20 patients (62.5%) progressed during the follow-up with median time to progression of 21.6 months. The liver was the most common site of recurrent disease followed by the lungs (65% and 20% of all recurrences, respectively).Conclusion:
While reverse strategy may allow complete tumour removal in the majority of patients, only half of them complete their oncosurgical plan even with the liver-first approach. The most problematic aspect of the liver-first strategy is the timing and length of perioperative (bio)chemotherapy. When deciding on preoperative chemotherapy in up-front resectable lesions one should take into account the risk of disease progression while on chemotherapy as well as the risks of complete radiologic response.Key words:
colorectal carcinoma − reverse strategy − liver-first approach − liver metastases
Autoři: M. Straka 1,2,4; M. Migrová 1,2; R. Soumarová 2,3; L. Burda 1,2; I. Selingerová 5
Působiště autorů: Chirurgické oddělení Nemocnice Nový Jičín primář: MUDr. M. Škrovina, Ph. D. 1; Komplexní onkologické centrum Nemocnice Nový Jičín vedoucí pracoviště: doc. MUDr. R. Soumarová, Ph. D., MBA 2; Oddělení radioterapie a onkologie Nemocnice Nový Jičín vedoucí pracoviště: doc. MUDr. R. Soumarová, Ph. D., MBA 3; Vzdělávací a výzkumný institut AGEL o. p. s., Prostějov ředitelka: Ing. Mgr. K. Murtingerová 4; Přírodovědecká fakulta Masarykovy univerzity Brno, Ústav matematiky a statistiky a MOÚ Brno ředitel: prof. RNDr. J. Slovák, Dr. Sc. 5
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 7, s. 280-286.
Kategorie: Původní práce
Souhrn
Úvod:
Reverzný, liver-first prístup je alternatívou pre pacientov s komplikovanými synchrónnymi pečeňovými metastázami, kde by progresia v pečeni viedla k inoperabilite, alebo pre pacientov s lokálne pokročilým nálezom v malej panve, kde by komplikácia resekcie primárneho tumoru mohla ohroziť včasnú resekciu pečeňových metastáz.Metódy:
Retrospektívna unicentrická analýza 32 pacientov liečených reverzným prístupom v období rokov 2011−2015. Reverzný prístup bol v tomto období indikovaný na základe konsenzu členov multioborovej onkologickej komisie ako preferovaný u všetkých pacientov s iniciálne, alebo potenciálne resekabilným synchrónnym izolovaným metastatickým postihom pečene pri adenokarcinóme kolorekta.Výsledky:
26 pacientov (81,3 %) úspešne absolvovalo kompletnú resekciu nádorovej masy (resekciu pečeňových metastáz a resekciu primárneho tumoru), ale iba 16 pacientov (50 %) absolvovalo kompletný onkochirurgický liečbený plán (hepatektómia, resekcia primárneho tumoru a plánovaná dávka a dĺžka perioperačnej, alebo adjuvantnej onkologickej liečby). Medián prežívania bol 50,5 mesiacov, trojročné prežívanie v súbore bolo 83,7 %. U 20 pacientov (62,5 %) došlo počas sledovania k progresii ochorenia s mediánom do progresie 21,6 mesiaca. Najčastejším miestom progresie bola pečeň, nasledovaná pľúcami (65 resp. 20 % všetkých rekurencií nádorového ochorenia).Záver:
Aj keď reverzný, liver-first prístup umožňuje kompletné odstránenie masy tumoru u väčšiny pacientov, iba polovica z nich absolvuje kompletný onkochirurgický liečebný plán. Najproblematickejším aspektom reverzného postupu je načasovanie a dĺžka perioperačnej (bio)chemoterapie. Dôkladné zváženie rizika progresie metastatického procesu počas liečby ako aj rizika kompletnej rádiologickej odpovede by malo viesť k uváženej indikácii perioperačnej (bio)chemoterapie najmä u pacientov s iniciálne resekabilnými pečeňovými metastázami.Klúčové slová:
kolorektálny karcinóm − reverzný prístup − liver-first approach − pečeňové metastázyÚVOD
Výskyt synchrónneho metastatického postihu u pacientov s kolorektálnym karcinómom je známym negatívnym prognostickým faktorom [1,2]. Pacienti s izolovaným metastatickým postihom pečene (CRLM) alebo pľúc však môžu dosiahnuť významné dlhodobé prežívanie [3,4]. Absolvovanie multimodálnej onkochirurgickej terapie dáva pacientovi väčšiu nádej na dlhodobé prežívanie ako samotné odstránenie nádorovej masy či systémová (bio)chemoterapia pri ponechanom primárnom nádore či metastázach in situ [5−7]. Reverzný, liver-first prístup bol v literatúre predstavený Mentha et al. 2006 s cieľom zbaviť “nešťastnú skupinu pacientov” (unlucky cohort) nádorovej masy a umožniť efektívnu systémovú terapiu [8]. Existuje niekoľko dôvodov pre resekciu pečeňových metastáz pred resekciou primárneho tumoru: 1. prítomnosť metastatického postihu pečene je významnejším determinantom prežívania ako primárny tumor samotný, 2. pri reverznom prístupe nehrozí odklad resekcie s prípadnou progresiou do inoperabilného stavu pri komplikáciách spojených s resekciou primárneho tumoru, 3. nestráca sa možný inhibičný efekt primárneho tumoru na vzdialené metastázy. Predradenie systémovej (bio)chemoterapie pred hepatektómiu navyše umožňuje: 1. selektovať vhodných pacientov k agresívnemu, často viacetapovému chirurgickému výkonu, 2. vyhnúť sa operačnej záťaži u rýchlo progredujúcich, na systémovú terapiu nereagujúcich pacientov, 3. stanoviť biologickú povahu ochorenia, 4. usmerniť pooperačnú, adjuvantnú systémovú terapiu, 5. detekovať okultné metastázy pri ich progresii počas perioperačnej liečby, 6. konverziu časti pôvodne inoperabilných CRLM na resekabilný stav a 7. navodiť u časti pacientov kompletnú röntgenologickú, či dokonca patologickú odpoveď primárneho tumoru na chemoterapiu [9−13]. V súčasnosti neexistuje ustálený, všeobecne akceptovaný protokol pre prístup k synchrónnym, izolovaným CRLM (klasický, synchrónny, alebo reverzný), ako ani jednoznačný pohľad na dĺžku a trvanie perioperačnej systémovej liečby [14−16]. Predkladaná štúdia retrospektívne hodnotí krátko a strednodobé výsledky reverzného postupu aplikovaného v podmienkach komplexného onkologického centra.
Metódy
Hypotéza
Resekcia pečeňových metastáz pred resekciou primárneho tumoru umožňuje vyhnúť sa možnému odkladu hepatektómie pre komplikácie pri resekcii primárneho tumoru. Reverzný prístup by tak mohol viesť k vyššiemu podielu pacientov, ktorí úspešne podstúpia kompletnú resekciu nádorovej masy (resekciu metastáz a resekciu primárneho tumoru), čo sa môže pozitívne prejaviť na dĺžke prežívania pacientov.
Metódy
So súhlasom etickej komisie Komplexného onkologického centra v Novom Jičíne boli retrospektívne analyzované dáta všetkých pacientov, ktorí podstúpili resekciu pečene a primárneho tumoru reverzným prístupom v období rokov 2011−2015. V uvedenom období bol tento prístup indikovaný ako preferovaný na základe spoločného konsenzu členov onkologickej komisie u všetkých pacientov s adenokarcinómom rekta a synchrónnym, izolovaným “up-front”, alebo potenciálne resekabilným metastatickým postihom pečene (Schéma 1). Ku konverzii pôvodne inoperabilného metastatického nálezu po iniciálnej chemoterapii došlo u jedného pacienta. Do štúdie boli zaradení aj pacienti, ktorí by netolerovali agresívnu kombinovanú chemoterapiu, ale boli schopní podstúpiť kompletnú resekciu nádorovej masy (starší pacienti so závažnou, najmä kardiálnou komorbiditou). Symptomatický primárny tumor nebol považovaný za kontraindikáciu reverzného postupu.
Liečebný protokol reverzného postupu s variantami liver-first a chemo-first Scheme 1: Therapeutic reverse strategy protocol with both liver-first and chemo-first options 
Staging primárneho tumoru bol stanovený na základe obligátneho CT vyšetrenia dutiny brušnej, MRI malej panvy a selektívne endosonografického vyšetrenia rekta. Staging pečeňových metastáz bol stanovený na základe štandardného trojfázového CT vyšetrenia, alebo MRI. PET/CT a CT vyšetrenie hrudníka bolo indikované selektívne u pacientov s vysokým rizikom diseminácie ochorenia.
Perioperačná systémová onkologická terapia bola podávaná najčastejšie ako systémová liečba na báze 5 fluorouracilu v kombinácii s oxaliplatinou, alebo irinotecanom, s/bez podania biologickej terapie (bevacizumab, cetuximab). Podanie kapecitabinu samotného nehodnotíme ako absolvovanie štandardnej perioperačnej, či adjuvantnej chemoterapie. Ak bola perioperačná systémová terapia indikovaná, cieľom bolo podanie 3−4 cyklov kombinovanej (bio)chemoterapie pred hepatektómiou a 3−4 cyklov (bio)chemoterapie po resekcii pečene podľa načasovania resekcie CRLM (Tab. 1). Neoadjuvantná terapia vo vzťahu k primárnemu tumoru bola indikovaná na základe všeobecne akceptovaných kritérií u pacientov s T3bN1 a vyšším štádiom ochorenia vo forme 5 týždňovej “long-course” 50.4 Gy rádioterapie v konkomitancii s kapecitabinom. Adjuvantná systémová terapia bola indikovaná najčastejšie vo forme kombinovanej chemoterapie v režime XELOX, FOLFOX, resp. FOLFIRI po resekcii primárneho tumoru, teda v prípade reverzného postupu po kompletnom chirurgickom odstránení nádorovej masy. Cieľom bolo podanie 6 cyklov kombinovanej systémovej chemoterapie. Kritériom úspešného absolvovania kompletného onkochirurgického liečebného plánu bolo kompletné odstránenie nádorovej masy (hepatektómia a resekcia primárneho tumoru) a absolvovanie plánovanej perioperačnej/adjuvantnej systémovej liečby v plnej dávke v stanovenom minimálnom počte cyklov. Ak pacient z akejkoľvek príčiny neabsolvoval plánovaný počet cyklov, alebo došlo k redukcii podávanej dávky, podanie liečby bolo hodnotené ako neúplné.
Medián prežívania a trojročné prežívanie v súbore bolo stanovené na základe Kaplan-Meierovej funkcie pre odhad prežívania. Analýza bola realizovaná v programe Statistica, verzia 12 pomocou programových produktov spoločnosti Microsoft® (Microsoft Word, Microsoft Excel) a pomocou programovacieho jazyka R.
VÝSLEDKY
Do štúdie bolo zaradených 32 pacientov, prevažnú väčšinu tvorili pacienti s pokročilým adenokarcinómom rekta (30 pacientov), iba u dvoch pacientov sa jednalo o primárny tumor kolon (Tab. 2). V histologickom náleze po hepatektómii bola u dvoch pacientov zachytená kompletná patologická odpoveď v resekáte a u dvoch boli identifikované benígne lézie predoperačne hodnotené ako CRLM. Títo dvaja pacienti boli vyradení z ďalšej analýzy prežívania. Ani jeden z dvoch pacientov indikovaných k reverznej etapovej resekcii pečene neabsolvoval obe resekčné fázy (jeden pre septickú komplikáciu po prvej hepatektómii a jeden pre rýchlu progresiu ochorenia v intervale). U 9 pacientov bola indikovaná iniciálna biochemoterapia pred resekciou pečeňových metastáz, všetkých 9 pacientov absolvovalo túto liečbu ako kompletnú, 7 z nich potom absolvovalo kompletnú druhú časť perioperačnej liečby po hepatektómii. Celkovo 26 pacientov (81,3 %) absolvovalo kompletnú resekciu nádorovej masy, alebo malo kompletnú odpoveď primárneho tumoru po iniciánej chemoterapii a resekcii pečene (2 pacienti). Akákoľvek perioperačná systémová terapia bola započatá u väčšiny pacientov (27), ale len 21 pacientov úspešne absolvovalo aspoň 3 cykly kombinovanej (bio)chemoterapie. 16 pacientov absolvovalo kompletný onkochirurgický terapeutický plán vrátane plnej dávky a trvania (bio)chemoterapie (biologickú liečbu ku kombinovanej chemoterapii dostali 4 pacienti) (Tab. 1).
Tab. 1. Perioperačná charakteristika 32 pacientov riešených reverzným prístupom Tab. 1: Perioperative characteristics of 32 patients with the liver-first approach 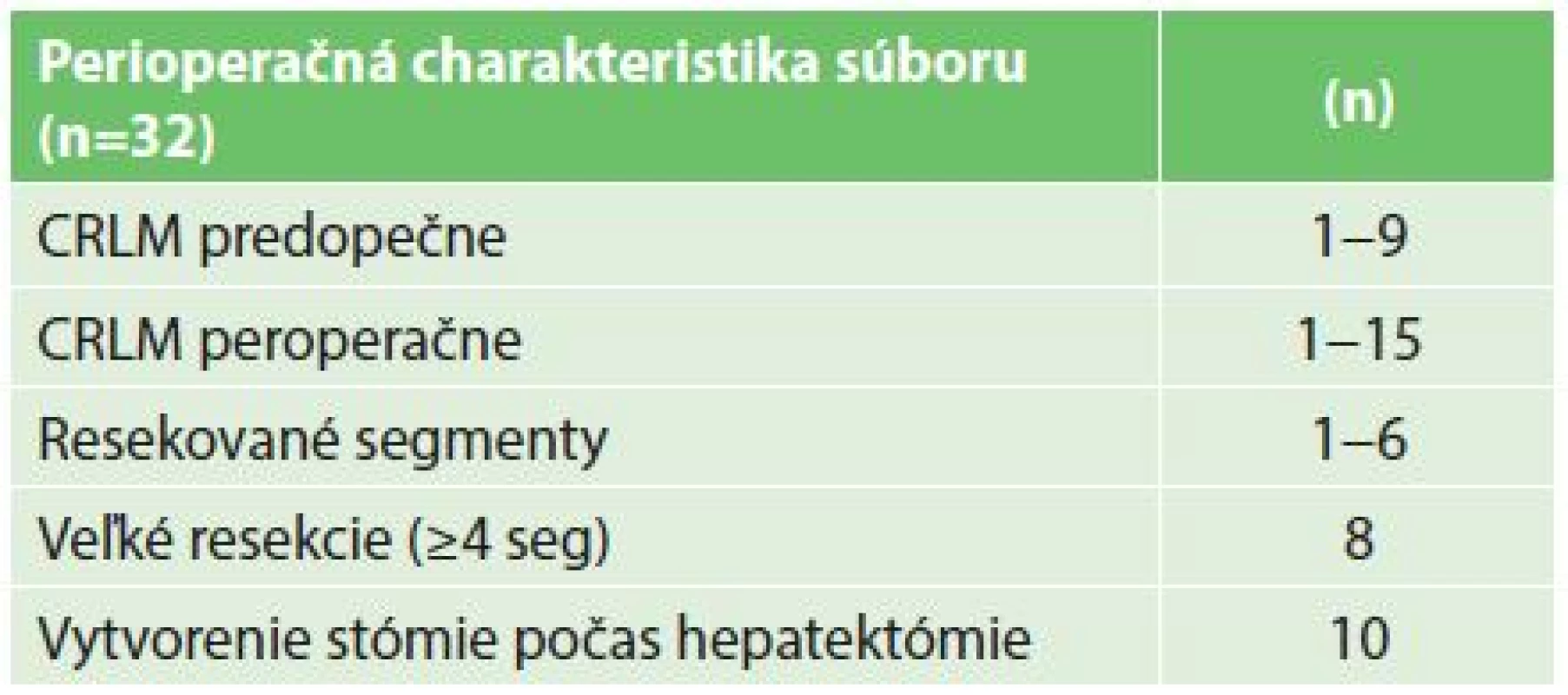
Tab. 2. Perioperačná a adjuvantná onkologická liečba Tab. 2: Perioperative and adjuvant (bio)chemotherapy 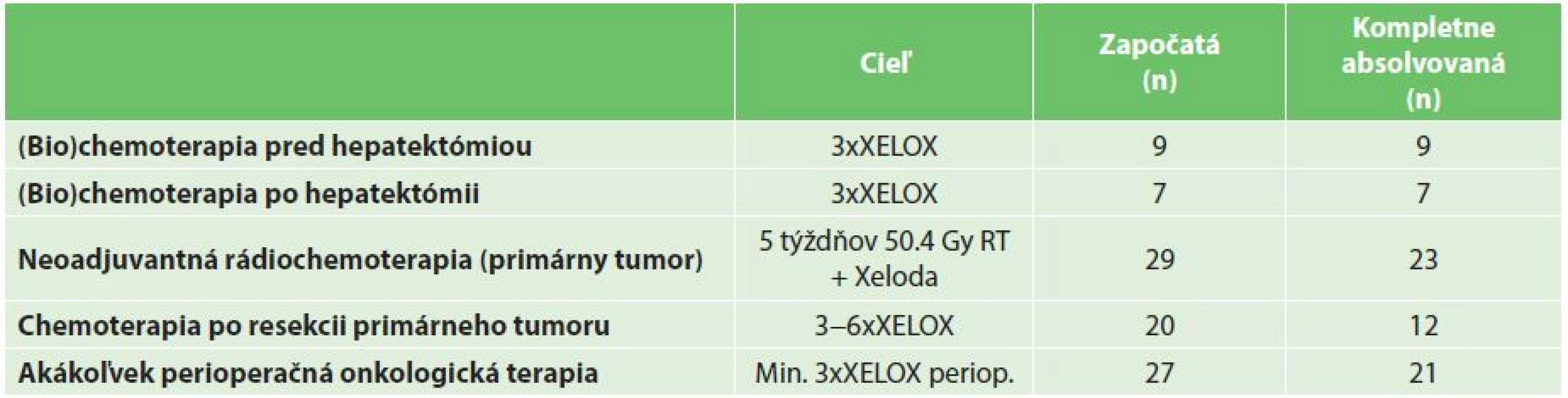
Trojročné prežívanie v súbore bolo 83,7 %, medián prežívania 50,5 mesiacov (Graf 1). U viac ako polovice pacientov (20 pacientov, 62,5 %) došlo počas sledovania k progresii ochorenia s mediánom do progresie 21,6 mesiaca (Graf 2). Najčastejším miestom progresie bola pečeň, nasledovaná pľúcami (65 resp. 20 % všetkých progresií nádorového ochorenia) (Tab. 3).
Graf 1. Celkové prežívanie v súbore Graph 1: Overall survival 
Graf 2. Čas do progresie ochorenia Graph 2: Time to progression 
Tab. 3. Vzorec progresie ochorenia (prvá zobrazená lokalita progresie ochorenia) Tab. 3: Progression pattern (first progression site identified) 
DISKUSIA
Predkladaná štúdia potvrdzuje predpoklad, že reverzný prístup umožňuje podstatnej časti pacientov (v našom súbore 84,4 %) zbaviť sa nádorovej masy. Predradenie hepatektómie pred resekciu primárneho tumoru pravdepodobne zvyšuje percento pacientov s kompletne zresekovanou nádorovou masou [9,15,17].
Prežívanie a čas do progresie
Doterajšie štúdie hodnotiace efekt reverzného postupu na prežívanie pacientov jednoznačný benefit nepotvrdili [18,19]. Analýza 4 štúdii publikovaných do roku 2014 [15] uvádza trojročné celkové prežívanie 41 % [20], 60 % [21], 79 % [22] a 89 % [23] (41−89 %). Pudil et al. [24] udáva 3 ročné prežívanie 75 %. Recentná analýza s využitím PSM metódy (propensity score matching) od Tanaka et al. 2015 superioritu reverzného postupu nedokázala [25] a nedokázala ju ani posledná publikovaná systematická review od Baltatzis et al. 2016 [14]. V nami prezentovanej sérii je trojročné prežívanie 83,7 % s mediánom prežitia 50,5 mesiacov. Brouquet et al. [22] porovnal prežívanie pri klasickom, synchrónnom a reverznom prístupe u 156 pacientov, ale signifikantný rozdiel v 3 a 5 ročnom prežívaní nezistil, pričom medián prežívania bez rekurencie ochorenia bol 11 mesiacov vo všetkých troch skupinách. Medián do progresie v našom súbore bol podstatne dlhší, až 21,6 mesiaca.
Pomerne široký rozptyl prežívania, času do progresie a nepriekazný benefit reverzného postupu na prežívanie pacientov môže byť daný: 1. nejednotnými kritériami selekcie pacientov k reverznému postupu [10,11], 2. nejasnými kritériami iniciálnej resekability, hraničnej resekability a neresekability pečeňových metastáz [15,26] a 3. nie univerzálne prijatým algoritmom perioperačnej systémovej terapie [13,15]. V našom súbore boli k reverznému postupu indikovaní principiálne všetci pacienti so synchrónne metastazujúcim adenokarcinómom rekta, čo môže vysvetľovať dlhší medián do progresie oproti iným publikovaným štúdiám v prípade, že naši pacienti mali priaznivejší pečeňový “tumor load”. Široké inklúzne kritériá mohli viesť k výslednému lepšiemu mediánu do progresie, keďže k tomuto postupu v našom zariadení indikujeme aj pacientov s up-front resekabilnými léziami, a nie iba hraničných pacientov s pokročilým nálezom na pečeni, kde hrozí inoperabilita z odkladu hepatektómie. Širšie indikačné kritériá v poslednom období používa niekoľko autorov [10,23].
Perioperačná chemoterapia
V našom súbore bola kombinovaná chemoterapia započatá u 27 pacientov (84,4 %), 21 pacientov absolvovalo aspoň 3 cykly liečby (65,6 %), ale kompletnú perioperačnú, či adjuvantnú chemoterapiu, alebo biochemoterapiu v plnom rozsahu absolvovalo iba 16 pacientov (50 %). Komplikácie po hepatektómii viedli k nedokončeniu druhej komponenty perioperačnej chemoterapie u 2 pacientov, u ostatných pacientov došlo k redukcii, či nepodaniu systémovej terapie z príčin nesúvisiacich s resekciou pečene. Aj keď autori v literatúre uvádzajú podiel pacientov, ktorí absolvovali celý liečebný protokol [9], ani pri našej najlepšej snahe sa nám nepodarilo nájsť analýzu kompletnosti reálne podanej systémovej terapie (plný/redukovaný počet cyklov, alebo dávky). Toto zistenie konštatuje aj Lam et al. 2014 v recentnom systematickom review [15]. Ostáva teda nejasné, aký podiel pacientov v jednotlivých štúdiách úspešne absolvuje kompletnú perioperačnú onkologickú terapiu. Hodnotenie strednodobého prežívania v predkladanej sérii ďalej sťažuje fakt, že počas štúdie došlo na základe aktualizácie NCCN odporučení k zmene liečebného protokolu v našom zariadení. Kým v prvom období 2011−2013 prevažoval pravý liver-first prístup, od roku 2014 prevažuje chemo-first s iniciálnou (bio)chemoterapiou (Schéma 1). Recentné NCCN odporučenia možnosť true liver-first neuvádzajú, aj keď v rámci aktuálnych ESMO guidelines 2014 [27] je takýto postup u jasne resekabilných CRLM stále akceptovaný. Aj keď tento fakt môže mať zásadný vplyv na celkové prežívanie, nízky počet pacientov v sérii neumožňuje podrobnú analýzu prežívania podskupín pacientov podľa typu, dĺžky podania a úspešného absolvovania onkologickej terapie (počet cyklov pred/po hepatektómii resp. adjuvantná terapia po kompletnej resekcii nádorovej masy).
Reverzný prístup bez iniciálnej chemoterapie
Tento prístup pôvodne popísaný Grundmann, et al. [28] považujeme aj v súčasnosti za možnú alternatívu a to hlavne u starších, polymorbídnych pacientov netolerujúcich agresívnu onkologickú liečbu (samotné kompletné odstránenie nádorovej masy môže priniesť survival benefit) a u pacientov s problematickým lokálnym nálezom zvlášť malých, centrálnych (najmä viacpočetných) lézií, kde resekcia naslepo v prípade kompletnej rádiologickej odpovede po chemoterapii môže byť problematická. Len menej ako 50 % “disappearing lesions” neobsahuje viabilné nádorové bunky [29,30], a preto resekciu týchto lézií považujeme za indikovanú. Výhodou je označenie lézií intervenčným rádiológom pred podaním iniciálnej chemoterapie (v našich podmienkach aplikácia RTG kontrastného materiálu – MReye coil® embolizačná špirála od firmy Cook Medical) (Obr. 1).
Obr. 1. Predliečebné označenie rizikových CRLM (hlboko uložené, priemer pod 2 cm) a) CT obraz po absolvovaní iniciálnej chemoterapie v režime XELOX. Kompletná rentgenologická odpoveď ; b) Lokalizácia “zmiznutej metastázy” prostredníctvom peroperačnej ultrasonografie. Fig. 1: Pretreatment identification of high-risk lesions (deeply localised, with less than 2 cm in diameter) a) CT scan after preoperative XELOX chemotherapy. Complete radiological response; b) Localization of the “disappearing” lesion by intraoperative ultrasound. 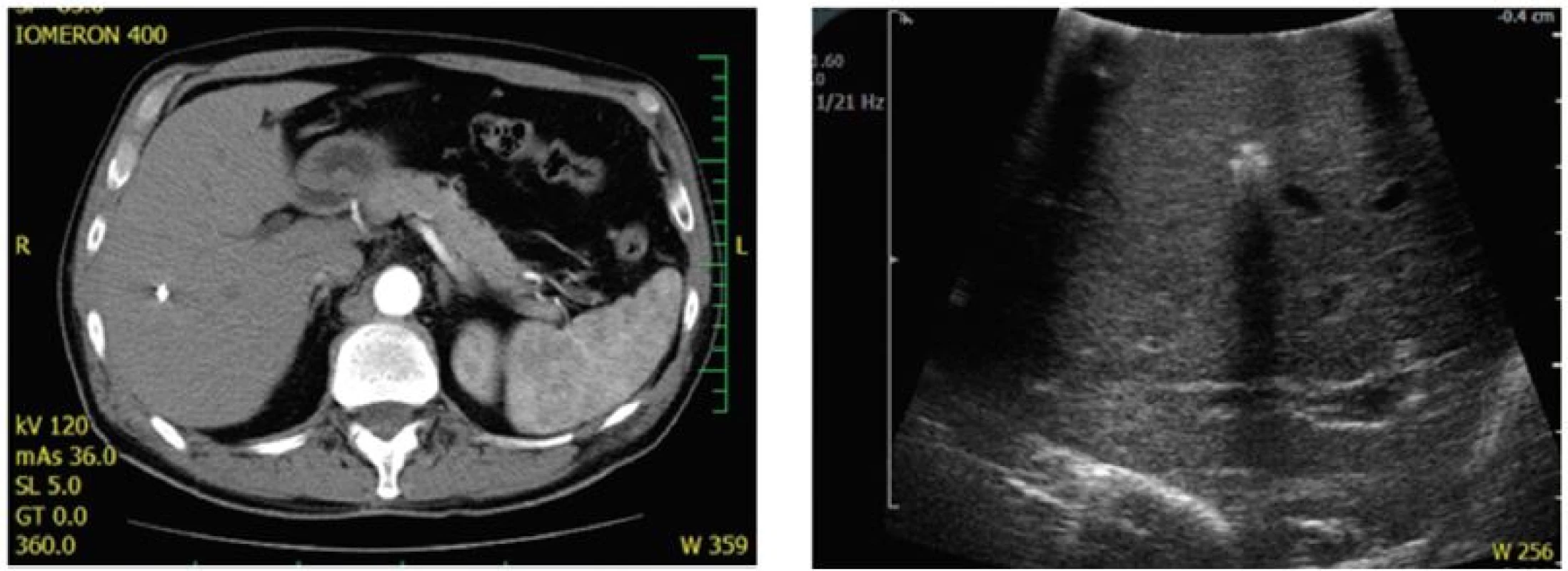
Progresia ochorenia
Najčasteším miestom progresie ochorenia v súlade s literatúrou [31,32] bola pečeň (Tab. 3). U všetkých pacientov s progresiou ochorenia v pečeni išlo o progresiu “de-novo”.
ZÁVER
Predradenie hepatektómie pred resekciu primárneho tumoru umožňuje väčšine pacientov kompletnú resekciu nádorovej masy, avšak pozitívny efekt tohto postupu na celkové prežívanie ostáva zatiaľ nepriekazný. Nejednotné kritériá selekcie pacientov, nejasná definícia iniciálnej resekabilty CRLM a neustálený algoritmus perioperačnej systémovej terapie sa môžu zásadným spôsobom podieľať na nepriekaznom efekte reverzného postupu na prežívanie pacientov. Analýza podskupín pacientov s definovaným “metastatic load” a “primary load” pri jednotných selekčných kritériách a algoritme podávanej onkologickej liečby zatiaľ v literatúre neexistuje a nie je ju možné realizovať ani na základe našej doterajšej skúsenosti.
Reverzná stratégia však jednoznačne nevedie k horším onkologickým výsledkom a nie je dôvod neponúknuť tento postup všetkým pacientom so synchrónne metastazujúcim, resekabilným kolorektálnym karcinómom do času, kedy bude možná exaktná analýza potenciálneho benefitu tohto postupu.
Zoznam použitých skratiek a ustálených cudzojazyčných spojení:
„liver first“ − reverzný postup, pri ktorom je resekcia pečeňových metastáz predradená pred resekciu primárneho tumoru
CRLM − (Colorectal Liver Metastases) metastázy kolorektálneho karcinómu do pečene
„unlucky cohort“ − termín „nešťastná skupina“ pacientov označuje v odkazovanej literatúre (Mentha 2006) prognosticky najnepriaznivejšiu skupinu pacientov (t.j. pacientov so synchrónnymi pečeňovými metastázami kolorektálneho karcinómu)
„up front“ resekabilné CRLM - jednoznačne radikálne resekabilné CRLM podľa vstupných zobrazovacích metód
„long course“ rádioterapia − štandardná schéma neoadjuvantnej rádioterapie zameraná na primárny tumor v dĺžke trvania 5 týždňov a celkovej dávke 50,4 Gy podávaná v konkomitancii s kapecitabinom
XELOX − režim kombinovanej chemoterapie na báze kapecitabinu a oxaliplatiny, prvá línia chemoterapie pre pacientov s metastatickým kolorektálnym karcinómom
FOLFOX − režim kombinovanej chemoterapie na báze kyseliny listovej, 5 - fluorouracilu a oxaliplatiny
FOLFIRI − režim kombinovanej chemoterapie na báze kyseliny listovej, 5 - fluorouracilu a irinotekanu
NCCN − (National Comprehensive Cancer Network) - nezisková organizácia združujúca 27 komplexných onkologických centier
PSM metóda − (Propensity Score Matching) štatistická metóda (metóda inštrumentálnych premenných), najstaršia metóda modelovania kauzálnych vzťahov prevzatá z ekonometrie
„chemo first“ − vetva reverzného postupu kde chemoterapia s neoadjuvantným, alebo konverzným zámerom predchádza resekciu pečeňových metastáz
„true liver first“ − vetva reverzného postupu, kde je resekcia pečeňových metastáz prvým terapeutickým krokom, bez predchádzajúcej chemoterapie
„tumor load“ − nádorová masa v tele pacienta (v danom kontexte masa pečeňových metastáz)Túto prácu by som chcel symbolicky venovať svojmu drahému otcovi, vynikajúcemu chirurgovi Doc. MUDr. Vladimírovi Strakovi CSc., ktorému som vďačný za celoživotné vedenie a podporu.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol v tejto podobe publikovaný v žiadnom inom časopise.Predbežné perioperačné výsledky reverzného postupu u časti tohto súboru boli publikované vo forme “feasibility study” v časopise Neoplasma 2014;61(4):447-52. pod názvom: “Up front hepatectomy for metastatic rectal carcinoma – reversed, liver first approach. Early experience with 15 patients”.
Poster na tému Liver-first strategy for synchronous colorectal liver metastases, treatment plan completion, progression pattern and survival at 3 years. Unicenter analysis of 32 liver – first approached patiens, bol prezentovaný na 12th World Congress of the International Hepato-Pancreato-Billary Association v Sao Paulo, Brazílii a abstrakt publikovaný v HPB 18:e168 DOI: 10.1016/j.hpb.2016.02.399
MUDr. Martin Straka
Ševčenka 2−13
036 01 Martin
e-mail: tulakmato@gmail.com
Zdroje
1. Chua TC, Saxena A, Chu F, et al. Predictors of cure after hepatic resection of colorectal liver metastases: an analysis of actual 5 - and 10-year survivors. J Surg Oncol 2011;103 : 796−800.
2. Tomlinson JS, Jarnagin WR, DeMatteo RP, et al. Actual 10-year survival after resection of colorectal liver metastases defines cure. J Clin Oncol. 2007;25 : 4575−80.
3. Scheele J, Stangl R, Altendorf-Hofmann A. Hepatic metastases from colorectal carcinoma: impact of surgical resection on the natural history. Br J Surg 1990;77 : 1241−6.
4. Fong Y, Fortner J, Sun RL, et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg 1999;230 : 309-18; discussion 318−21.
5. Donadon M, Ribero D, Morris-Stiff G, et al. New paradigm in the management of liver-only metastases from colorectal cancer. Gastrointest Cancer Res 2007;1 : 20−7.
6. Nordlinger B, Sorbye H, Glimelius B, et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet 2008;371 : 1007−16.
7. Patrlj L, Kopljar M, Kliček R, et al. The surgical treatment of patients with colorectal cancer and liver metastases in the setting of the liver first approach. Hepatobiliary Surg Nutr 2014;3 : 324−9.
8. Mentha G, Majno PE, Andres A, et al. Neoadjuvant chemotherapy and resection of advanced synchronous liver metastases before treatment of the colorectal primary. Br J Surg 2006;93 : 872−8.
9. Jegatheeswaran S, Mason JM, Hancock HC, et al. The liver-first approach to the management of colorectal cancer with synchronous hepatic metastases: a systematic review. JAMA Surg 2013;148 : 385−91.
10. Kardassis D, Ntinas A, Miliaras D, et al. Patients with multiple synchronous colonic cancer hepatic metastases benefit from enrolment in a liver first approach protocol. World J Hepatol 2014;6 : 513−9.
11. Donati M, Stavrou GA, Stang A, et al. Liver-first pproach for metastatic colorectal cancer. Future Oncol 2015;11 : 1233−43.
12. Waisberg J, Ivankovics IG. Liver-first approach of colorectal cancer with synchronous hepatic metastases: A reverse strategy. World J Hepatol 2015;7 : 1444−9.
13. Ihnát P, Vávra P, Zonča P. Treatment strategies for colorectal carcinoma with synchronous liver metastases: Which way to go? World J Gastroenterol 2015;21 : 7014−21.
14. Baltatzis M, Chan AK, Jegatheeswaran S, et al. Colorectal cancer with synchronous hepatic metastases: Systematic review of reports comparing synchronous surgery with sequential bowel-first or liver-first approaches. Eur J Surg Oncol 2016;42 : 159−65.
15. Lam VW, Laurence JM, Pang T, et al. A systematic review of a liver-first approach in patients with colorectal cancer and synchronous colorectal liver metastases. HPB (Oxford) 2014;16 : 101−8.
16. Gall TM, Basyouny M, Frampton AE, et al. Neoadjuvant chemotherapy and primary-first approach for rectal cancer with synchronous liver metastases. Colorectal Dis 2014;16:O197−205.
17. Andres A, Toso C, Adam R, et al. A survival analysis of the liver-first reversed management of advanced simultaneous colorectal liver metastases: a LiverMetSurvey-based study. Ann Surg 2012;256 : 772−8; discussion 778−9.
18. Lykoudis PM, O´Rilly D, Nastos K, et al. Systematic review of surgical management of synchronous colorectal liver metastases. Br J Surg 2014;101 : 605−12.
19. Kelly ME, Spolverato G, Lê GN, et al. Synchronous colorectal liver metastasis: a network meta-analysis review comparing classical, combined, and liver-first surgical strategies. J Surg Oncol 2015;111 : 341−51.
20. Mentha G, Roth AD, Terraz S, et al. „Liver first“ approach in the treatment of colorectal cancer with synchronous liver metastases. Dig Surg 2008;25 : 430−5.
21. Verhoef C, van der Pool AE, Nuyttens JJ, et al. The „liver-first approach“ for patients with locally advanced rectal cancer and synchronous liver metastases. Dis Colon Rectum 2009;52 : 23−30.
22. Brouquet A, Mortenson MM, Vauthey JN, et al. Surgical strategies for synchronous colorectal liver metastases in 156 consecutive patients: classic, combined or reverse strategy? J Am Coll Surg 2010;210 : 934−41.
23. de Jong MC, van Dam RM, Maas M, et al. The liver-first approach for synchronous colorectal liver metastasis: a 5-year single-centre experience. HPB (Oxford) 2011;13 : 745−52.
24. Pudil J, Batko S, Menclová K, et al. [“Liver fist approach“ in the management of synchronous liver metastases from colorectal cancer: Preliminary non-randomized study results]. Czech, Rozhl Chir 2015;94 : 522−5.
25. Tanaka K, Murakami T, Matsuo K, et al. Preliminary results of ‘liver-first‘ reverse management for advanced and aggressive synchronous colorectal liver metastases: a propensity-matched analysis. Dig Surg 2015;32 : 16−22.
26. Choti MA. Defining resectable metastatic CRC: indications, outcomes, and controversies. In: Marshall JA, Choti MA, editors. Managing CRC: the resectable and potentially resectable patient-A multidisciplinary approach. New Jersey, CMPMedica-United Business Media 2008 : 9–15.
27. Van Cutsem E, Cervantes A, Nordlinger B, et al. Metastatic colorectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014;25 Suppl 3:iii1-9. doi: 10.1093/annonc/mdu260.
28. Grundmann RT, Hermanek P, Merkel S, et al. Arbeitsgruppe Workflow Diagnostik und Therapie von Lebermetastasen kolorektaler Karzinome. Zentralbl Chir 2008;133 : 267−84.
29. Benoist S, Brouquet A, Penna C, et al. Complete response of colorectal liver metastases after chemotherapy: does it mean cure? J Clin Oncol. 2006;24 : 3939−45.
30. Passot G, Odisio BC, Zorzi D, et al. Eradication of missing liver metastases after fiducial placement. J Gastrointest Surg 2016; Jan 20. [Epub ahead of print]
31. Třeška V, Skalický T, Ferda J, et al. [Colorectal liver metastases surgery - the present and the perspectives] Czech, Rozhl Chir 2014;93 : 568−71.
32. Viganò L, Capussotti L, Lapointe R, et al. Early recurrence after liver resection for colorectal metastases: risk factors, prognosis, and treatment. A LiverMetSurvey-based study of 6,025 patients. Ann Surg Oncol 2014;21 : 1276−86.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2016 Číslo 7- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Akutní chirurgická péče − jak dál?
- Použití speciálních kontaktních dlah v pooperační péči u syndromu diabetické nohy
- Parametrické sledování kvality totální mezorektální excize a chirurgické léčby karcinomu rekta − výsledky multicentrické studie
- Technické zajištění sběru dat pro parametrické sledování totální mezorektální excize (TME) pro karcinom rekta
-
Reverzný prístup k synchrónnym pečeňovým metastázam kolorektálneho karcinómu
Absolvovanie liečebného protokolu, strednodobé (trojročné) prežívanie a vzorec progresie ochorenia u 32 pacientov - Raritní poranění hráze a anorekta − kazuistika
- Herniace céka do foramen Winslowi jako vzácná příčina ileózního stavu
- Juxtapapilární divertikl duodena jako příčina pankreatobiliárních potíží – kazuistika a přehled literatury
- 51st Congress of the European Society for Surgical Research, 25−28 May 2016, Prague, Czech Republic
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Juxtapapilární divertikl duodena jako příčina pankreatobiliárních potíží – kazuistika a přehled literatury
- Herniace céka do foramen Winslowi jako vzácná příčina ileózního stavu
- Parametrické sledování kvality totální mezorektální excize a chirurgické léčby karcinomu rekta − výsledky multicentrické studie
- Akutní chirurgická péče − jak dál?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



