-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaFototoxický vliv porfyrinových sensitizerů a viditelného záření na gram-pozitivní methicilin-rezistentní kmen S. aureus
Fototoxický vliv porfyrinových sensitizerů a viditelného záření na gram-pozitivní methicilin-rezistentní kmen S. aureus
The use of antimicrobial photodynamic therapy (aPDT) as a therapeutic modality for the treatment of localized microbial infections represents an developing new field. The emergence of strains resistant to antibiotics has provided the necessary impulse for new drug or technology discoveries to combat these resistant compounds. Although the aPDT is still in infancy, its need is still growing. Like PDT, main components of antimicrobial photodynamic therapy are appropriate light, dye called photosensitizer and created reactive oxygen species. In this article photosensitizers TMPyP and ZnTPPS4 are investigated for antimicrobial photodynamic therapy. We tested these porphyrins on bacterial methicilin – resistant strain MRSA alone and bound in complex created with hp-β-cyclodextrin. The light emitting diodes (414 nm) were used at the doses 0 and 150 J/cm2. Tested concentrations were from 0.78 to 100 µM. This experimental work predicated that TMPyP is very successful compound in aPDT. In contrary to ZnTPPS4 which was efficient for eradication of tested gram-positive bacteria only in higher concentrations.
Keywords:
Antimicrobial photodynamic therapy, porphyrins, blue light, light emitting diod
Autoři: Adéla Hanáková 1; Katerina Bogdanova 2; Katerina Tomankova 1; Klara Pizova 1; Jakub Malohlava 1; Svatopluk Binder 1; Robert Bajgar 1; Katerina Langova 1; Milan Kolar 2; Jiri Mosinger 3; Hana Kolarova 1
Působiště autorů: Ústav lékařské biofyziky, Lékařská fakulta Univerzity Palackého, Institut molekulární a translační medicíny, Olomouc, Česká republika 1; Ústav mikrobiologie, Lékařská fakulta Univerzity Palackého, Olomouc, Česká republika 2; Ústav anorganické chemie, Přírodovědecká fakulta Univerzity Karlovy, Praha, Česká republika 3
Vyšlo v časopise: Lékař a technika - Clinician and Technology No. 1, 2013, 43, 19-23
Kategorie: Původní práce
Souhrn
Použití antimikrobiální fotodynamické terapie (aPDT) jako terapeutické možnosti pro léčbu lokálních mikrobiálních infekcí představuje nově se vyvíjející oblast. Výskyt kmenů rezistentních k antibiotikům poskytuje impuls pro vývoj nových látek nebo technologických objevů k boji proti těmto rezistentním sloučeninám. Jako u PDT jsou hlavními komponentami antimikrobiální fotodynamické terapie světlo vhodné vlnové délky fotosensitivní látka (sensitizer) a vzniklé kyslíkové reaktivní částice. V této práci jsou pro antimikrobiální fotodynamickou terapii zkoumány fotosensitizery TMPyP a ZnTPPS4. Uvedené porfyriny jsme testovali na bakteriálním methicilin – rezistentním kmenu MRSA samotné i ve vazbě s hp-β-cyklodextrinem. LEDs (414 nm) byly použity intenzity záření 0 a 150 J/cm2. Testované koncentrace byly od 0,78 do 100 µM. Touto experimentální prací se dokázalo, že TMPyP je velmi úspěšnou komponentou v aPDT. Naopak ZnTPPS4 byl účinný pro vyhubení gram-pozitivních bakterií pouze ve vyšších koncentracích.
Klíčová slova:
antimikrobiální fotodynamická terapie, porfyriny, modré světlo, dioda emitující světloÚvod
PDT i aPDT využívá schopnosti látky (fotosen-sitizeru) absorbovat viditelné záření o vhodné vlnové délce, což vede k utvoření excitovaného tripletního stavu molekuly fotosensitizeru. Následuje přenos energie na molekulu kyslíku a tvorba reaktivního singletního kyslíku, který způsobí buněčnou smrt [1].
Hlavní faktory k úspěšné aPDT zahrnují optimalizaci typu a koncentrace fotosensitizeru a intenzitu záření [2]. Do budoucna můžeme počítat s léčbou rezistentních bakteriálních onemocnění, především lokálních infekcí, jejichž počet neustále roste, a dosavadní léčba není příliš úspěšná. Důvodem nepříliš kladných výsledků bývají infikované, špatně prokrvené tkáně nebo přítomnost bakteriálního biofilmu [3].
V současnosti vede časté užívání antibiotik k urgentní potřebě nových, vyhovujících, nenákladných a rezistenci nezpůsobujících léčebných metod v boji s rezistentními bakteriemi, především s methicilin-rezistentním Staphylococcus aureus [4]. Tento patogen způsobuje hlavně u hospitalizovaných pacientů s popáleninami kůže 75 % infekcí, vedoucích často až ke smrti pacientů [5].
Obecně lze říct, že gram-pozitivní bakterie jsou vůči aPDT více citlivé. Důvodem je stavba buněčné stěny, na kterou se fotosensitizer váže snáze a rychleji, než je tomu u gram-negativních bakterií [6]. V této práci se tedy snažíme popsat úspěšné výsledky, kterých bylo dosaženo ozářením pomocí systému LED diod o vlnové délce 414 nm s použitím dvou porfyrinových fotosensitizerů. Antimikrobiální fotodynamická terapie se aplikovala s cílem vyhubit kolonie MRSA a minimalizovat tak následnou viabilitu kmene.
Materiál a metody
Fotosensitizery, cyklodextrin, zdroj a intenzita záření
Použili jsme pro aPDT dva fotosensitizery (PS) - ZnTPPS4 (připravený J. Mosingerem) a TMPyP (komerčně zakoupený v Sigma Aldrich). Před použitím se rozpustily v PBS a uchovaly se v -20 ºC ve tmě. Byly použity koncentrace: 0,78; 1,56; 3,125; 6,25; 12,5; 25, 50 a 100 μmol/l. Abychom dosáhli vyšší účinnosti při in vitro terapii, připravili jsme kromě roztoků pouze s porfyriny i vzorky obsahující komplex s hp-β-cyklodextrinem (Sigma-Aldrich). Poměry komplexu PS:CD byly také připraveny v PBS v poměrech 1 : 4, 1 : 1 a 2 : 1.
Jako zdroj záření byla použita soustava LED diod o vlnové délce odpovídající maximu použitých fotosensitizerů 414 nm. Testované vzorky bakterií s fotosensitizerem nebo komplexem PS:CD byly za aerobních podmínek vystaveny intenzitě záření 150 J/cm2 ( ̴ 56 minut) při teplotě 37 °C.
Bakteriální kmen a podmínky kultivace
Byly odebrány 1–2 kolonie gram-pozitivního bakteriálního kmene S. aureus MRSA (methicilin-rezistentní) 4591, které se nechaly narůst v aerobních podmínkách ve 2 ml bujónu (Himedia) při 37 °C, 5% CO2 po dobu 45 minut ve tmě. Následně se odebralo do každé jamky 96-jamkové destičky 50 μl suspenze, odpovídající 1 x 106 CFU/ml.
aPDT
Antimikrobiální fotodynamická terapie se prováděla po jednotlivých krocích, jako jsou příprava a kultivace bakterií, příprava potřebných koncentrací fotosensitizerů a komplexů s cyklodextriny. Byly použity porfyriny TMPyP a ZnTPPS4 k otestování a stanovení viability kmene MRSA a poklesu růstu bakteriálních kolonií. Vzorky na deskách byly rozděleny do několika skupin (Tab. 1). Toto členění sloužilo pro získání výsledků na porovnání samotné antimikrobiální PDT, dále pro ověření pozitivní a negativní kontroly a pro stanovení cytotoxicity na bakteriálním kmeni MRSA. Ve všech případech se pokaždé použilo 50 µl bakteriální suspenze (106 cells/mL) inkubované za uvedených podmínek s fotosensitizery o koncentracích v rozmezí 0,78 μmol/l do 100 μmol/l. Po inkubaci a samotném ozáření byly měřeny absorbance pomocí spektrofotometru (BioTek, Winooski, Vermont, USA) v programu Gen5 každou hodinu po dobu 24 hodin.
Tab. 1. Tabulka znázorňuje rozdělení vzorků pro aplikaci aPDT. Skupina č. 1 zastupuje pozitivní kontrolu, skupina č. 2 slouží pro vyloučení cytotoxicity, skupina č. 3 je popsaná pro standardně provedenou aPDT a skupina č. 4 zastupuje negativní kontrolu. 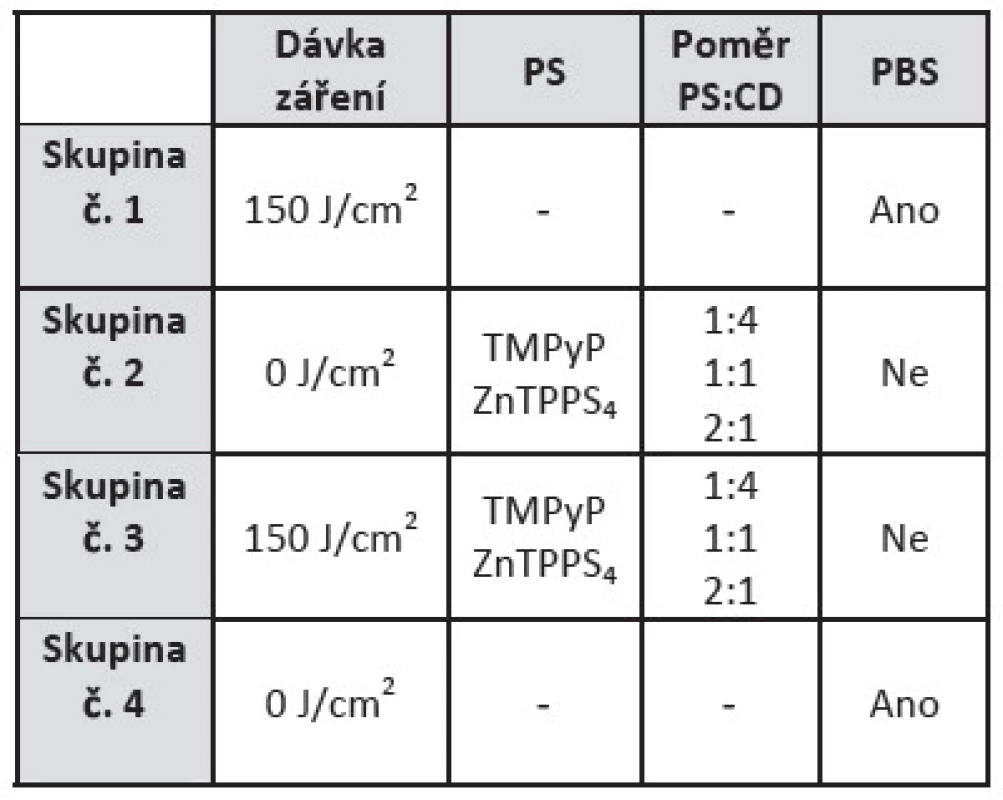
Z hodnot byly sestrojeny růstové křivky a bylo vypočteno % zastoupení živých bakterií. Růstové křivky vyjadřují nárůst absorbance odpovídající množství bakterií v závislosti na čase.
Stanovení viability bakteriálního kmene
Procentuální vyjádření počtu bakterií, které nejsou citlivé na aPDT, se stanovuje z hodnot naměřených absorbancí při vlnové délce 630 nm ve vybraných časových úsecích (1).
Procentuální inhibice růstu se u všech skupin testovaných bakterií kmene MRSA byla stanovena pomocí rovnice
AX (absorbance při dané koncentraci) a AC (absorbance kontrolního vzorku v PBS) jsou absorbance měřené po 45 minutách inkubace ve tmě v intervalech 0, 6, 12, 18 a 24 hodin, A0 představuje pro léčené a kontrolní suspenze počáteční hodnoty absorbance.
Statistika
K popisu růstu bakterií se použily regresní koeficient a intervaly spolehlivosti (95% CIs). Analýzy se prováděly s SPSS software vision 15 (SPSS, Ing. Chicago, USA) a statistická signifikance byla určená pro p<0.05.
Výsledky a diskuze
aPDT
Pro testovaný kmen MRSA se při aplikaci aPDT prokázaly účinné všechny ověřované koncentrace fotosensitizeru TMPyP v poměru 1 : 1 s CD (Graf 1). Došlo tu k výraznému poklesu růstu bakterií.
Graf 1. Růstové křivky pro MRSA kmen při aplikaci fotosensitizeru TMPyP s CD v poměru 1:1. 
V grafu 2 můžeme vidět eliminovaný růst MRSA, běžný růst kontrolní křivky MRSA v PBS a nepatrný nárůst křivky v koncentraci 0,78 μM bez aplikace CD. Ostatní koncentrace TMPyP v kombinaci se zářením o vlnové délce 414 nm snížily růst bakterií na minimum.
Graf 2. Růstové křivky pro MRSA kmen při aplikaci fotosensitizeru TMPyP bez CD. 
Prezentovaná data v grafu 3 ukazují nižší účinnost fotosensitizeru ZnTPPS4 s CD v poměru 1 : 1. Růstové křivky MRSA pro ZnTPPS4:CD v poměru 1 : 1 rostly v nejnižších koncentracích téměř shodně jako kontrolní růstové křivky bakterií, pouze s časovou prodlevou od 12. do 18. hodiny měření. Pokles růstu bakterií je zřejmý pouze v nejvyšších koncentracích 100 až 12,5 μM.
Graf 3. Růstové křivky pro MRSA kmen při aplikaci fotosensitizeru ZnTPPS<sub>4</sub>:CD 1:1. 
V případě použití ZnTPPS4 bez CD nedochází k poklesu růstu kmene MRSA, pouze pro 100 μM koncentraci je růst zredukován na 17 %. Konkrétní růstové křivky po aPDT jsou zobrazeny v grafu 4.
Graf 4. Růstové křivky pro MRSA kmen při aplikaci fotosensitizeru ZnTPPS<sub>4</sub> bez CD. 
Na následujících dvou grafech 5 a 6 je vynesen pokles růstu v procentech pro kmen MRSA během 0, 6, 12, 18 a 24 hodin. Je vidět, jak se snižuje nárůst MRSA po aPDT při aplikaci TMPyP s CD v poměru 2 : 1 a ZnTPPS4 s CD v poměru 1 : 4. V případě TMPyP klesla životnost ve všech zobrazených koncentracích výrazně pod 20 %, u ZnTPPS4 tomu tak je v případě 100 μM koncentrace.
Graf 5. Závislost poklesu růstu MRSA na čase pro TMPyP s CD v poměru 2:1. 
Graf 6. Závislost poklesu růstu MRSA na čase pro ZnTPPS<sub>4</sub> s CD v poměru 1:4. 
Staphylococcus aureus i další bakteriální druhy je možno vystavením modrému světlu v oblasti 400–420 nm fotodynamicky inaktivovat [7].
Aplikace aPDT s sebou stále nese některé otázky, na které je třeba odpovědět:
- Které bakterie jsou citlivé na ozáření?
- Jaký je přímý účinek na mikrobiální populaci?
- Jaký typ fotosensitizeru se selektivně váže na různé druhy bakterií?
- Jaká je vhodná terapeutická koncentrace PS?
- Jaké jsou přijatelné parametry záření (vlnová délka, délka expozice …)? [8].
Nicméně lze zdůraznit, že ačkoli je zatím tato oblast na počátku vývoje, posunuje se stále kupředu a objevuje se na toto téma pořád více publikací orientovaných směrem k antimikrobiální fotodynamické terapii, které potvrzují možnou inaktivaci gram-pozitivních, ale i gram-negativních bakteriálních kmenů [9, 10].Jako alternativa se aPDT může užívat v léčbě lokálních infekcí (v ústech nebo na pokožce) a zamezit tak rozvoji rezistence na systémová léčiva [11].
Jelikož aktuální využití aPDT v klinické praxi závisí na baktericidní aktivitě a zároveň na cytotoxicitě vůči okolní hostující tkáni [12], naše předchozí publikace byla zaměřena i na PDT nenádorové buněčné linie NIH3T3 (myší fibroblasty). Pro porovnání a z důvodu aplikace PDT také v oblasti tumorů [13], jsme testovali fotosensitizery i na nádorovou buněčnou linii HeLa.
Tato publikace demonstruje současnou práci, která byla úspěšná především z hlediska dosažení kladných výsledků inaktivace růstu bakterií pro kationtový fotosensitizer TMPyP, a to i ve velmi nízkých koncentracích.
Statistika
Statisticky významné regresní koeficienty a 95% CI (levá a pravá mez) se stanovily u MRSA kmene pro fotosensitizer ZnTPPS4 ve všech koncentracích 100 až 25 μM, v případě s CD v poměru 1 : 4 - 12,5 až 1,56 μM, v poměru 1 : 1 - 6,25 a 3,125 μM, v poměru 2 : 1 a bez CD - 12,5 a 6,25 μM. Pro fotosensitizer TMPyP byly regresní koeficienty významné ve všech kon-centracích a poměrech s CD i bez CD.
Tab. 2. Hodnoty životností po aPDT pro MRSA kmen a fotosensitizer ZnTPPS4 s CD v poměru 2:1. Kontrolní křivka běžného růstu bakterií v PBS byla označena jako kontrola a ostatní výpočty se k ní vztahovaly jako ke 100%. 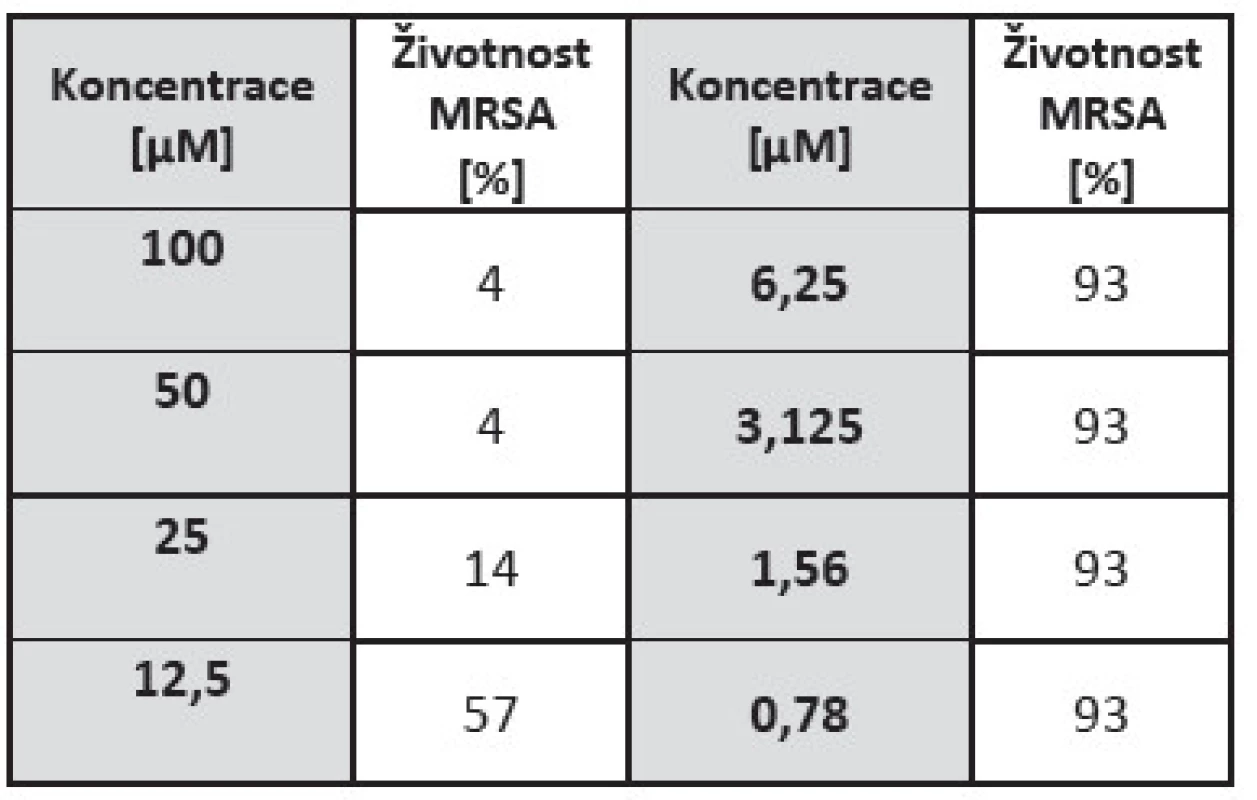
Závěr
Světlo o vlnové délce 414 nm v oblasti elektro-magnetického spektra odpovídá absorpčnímu maximu porfyrinů ZnTPPS4 a TMPyP, které byly použity pro navození fotodynamického jevu, a tedy k in vitro antimikrobiální, nádorové i nenádorové terapii.
V budoucnu se naše práce bude ubírat směrem kombinace aPDT s antibiotiky. Perspektivou bude možné zesílení efektu s použitím antibiotik, se kterými momentálně vykazují gram-pozitivní i gram-negativní kmeny rezistenci.
Poděkování
Tato práce byla podpořena grantovými projekty 303/09/H048, CZ.1.05/2.1.00/01.0030 a LF_2012_019.
Mgr. Adéla Hanáková
Katedra lékařské biofyziky
Lékařská fakulta
Univerzita Palackého v Olomouci
Hněvotínská 3, CZ-775 15 Olomouc
E-mail: a.hanakova@upol.cz
tel.: +420 585 632 110
Zdroje
[1] O’Riordan, K., Akilov, O. E., Hasan, T. The potential for photodynamic therapy in the treatment of localized infections. Photodiagnosis and Photodynamic Therapy, 2005, 2 : 247—262.
[2] Chan Y., Lai CH. H. Bactericidal effects of different laser wavelengths on periodontopathic germs in photodynamic therapy. Lasers Med Sci, 2003, 18 : 51–55.
Strnadova, A., Roubik, K. Document for the paper for YBERC 2010. Lékař a Technika, 2010, vol. 15, no. 1, p. 1–2.
[3] Hamblin M. R., Hasan T. Photodynamic therapy: A new antimicrobial approach to infectious disease? Photochem Photobiol Sci, 2004, 3 : 436–450.
[4] Tavares A., Carvalho C. M. B., Faustino M. A., Neves M. G. P. M. S., Tomé J. P. C., Tomé A. C., Cavaleiro J. A. S., Cunha A., Gomes N. C. M., Alves E., Almeida A. Antimicrobial Photodynamic Therapy: Study of Bacterial Recovery Viability and Potential Development of Resistance after Treatment. Mar. Drugs, 2010, 8 : 91-105.
[5] Banfi S., Caruso E., Buccafurni L., Battini V., Zazzaron S., Barbieri P., Orlandi V. Journal of Photochemistry and Photobiology B: Biology, 2006, 85 : 28–38.
[6] Jori G. Photodynamic therapy of microbial infections: state of the art and perspectives. Journal of environmental Pathology, Toxicology, and Oncology. 2006, 25(1-2): 505-519.
[7] Maclean M., MacGregor S. J., Anderson J. G., Woolsey G. A. The role of oxygen in the visible-light inactivation of Staphylococcus aureus. Journal of Photochemistry and Photobiology B: Biology, 2008, 92 : 180–184.
[8] Calin M. A., Parasca S. V. Light sources for photodynamic inactivation of bacteria. Lasers Med Sci, 2009, 24 : 453–460.
[9] Ganz R. A., Viveiros J., B. Ahmad A., Ahmadi A., Khalil A., Tolkoff M. J., Nishioka N. S., Hamblin M. R. Helicobacter pylori in Patients Can Be Killed by Visible Light. Lasers in Surgery and Medicine, 2005, 36 : 260–265.
[10] Hamblin M. R., Hasan T. Photodynamic therapy: A new antimicrobial approach to infectious disease? Photochem Photobiol Sci, 2004, 3 : 436–450.
[11] Banfi S., Caruso E., Buccafurni L., Battini V., Zazzaron S., Barbieri P., Orlandi V. Journal of Photochemistry and Photobiology B: Biology, 2006, 85 : 28–38.
[12] Lambrechts S. A. G., Demidova T. N., Aaldersa M. C. G., Hasan T., Hamblin M. R. Photodynamic therapy for Staphylococcus aureus infected burn wounds in mice. Photochem Photobiol Sci., 2005, 4(7): 503–509.
[13] Kudinova N. V., Berezov T. T. Photodynamic Therapy of Cancer: Search For Ideal Photosensitizer, Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry, 2010, 4(1): 95–103.
Štítky
Biomedicína
Článek vyšel v časopiseLékař a technika

2013 Číslo 1-
Všechny články tohoto čísla
- SROVNÁNÍ RŮZNÝCH PŘÍSTUPŮ HRANOVÉ DETEKCE KONČETINOVÝCH TEPEN V PODÉLNÉM ŘEZU ULTRAZVUKOVÉHO OBRAZU
- IMUNOFLUORESCENČNÍ ANALÝZA PROAPOPTICKÝCH SIGNÁLNÍCH MOLEKUL V BUŇKÁCH LIDSKÉHO MELANOMU PO FOTODYNAMICKÉ TERAPII
- Fototoxický vliv porfyrinových sensitizerů a viditelného záření na gram-pozitivní methicilin-rezistentní kmen S. aureus
- 13C-methacetinový dechový test u pacientů s jaterní cirhózou a dekompenzovaným srdečním selháním
- Testing of automatized rehabilitation device designed for elderly by industrial robot
- Specific behaviour of the blood sedimentation processes examined by the electrochemical impedance microsensor
- Development of biomedical information systems: MSL concept of e-learning – pilot study results
- MOŽNOSTI VYUŽITÍ ANALÝZY PŘEŽÍVÁNÍ V BIOMEDICÍNĚ A TECHNICE
- Lékař a technika
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- MOŽNOSTI VYUŽITÍ ANALÝZY PŘEŽÍVÁNÍ V BIOMEDICÍNĚ A TECHNICE
- 13C-methacetinový dechový test u pacientů s jaterní cirhózou a dekompenzovaným srdečním selháním
- Fototoxický vliv porfyrinových sensitizerů a viditelného záření na gram-pozitivní methicilin-rezistentní kmen S. aureus
- SROVNÁNÍ RŮZNÝCH PŘÍSTUPŮ HRANOVÉ DETEKCE KONČETINOVÝCH TEPEN V PODÉLNÉM ŘEZU ULTRAZVUKOVÉHO OBRAZU
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




