-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
Reklama13C-methacetinový dechový test u pacientů s jaterní cirhózou a dekompenzovaným srdečním selháním
13C-methacetinový dechový test u pacientů s jaterní cirhózou a dekompenzovaným srdečním selháním
An overview of new diagnostic device (Wagner Analysen Technik, Germany) is provided. This device uses the 13C stable isotope together with non-dispersive infrared selective spectroscopy for non – invasive quantification of hepatic function parameters, including kinetics (type of liver damage) and capacity (percentage of recovery yield of the liver). The short physical principle of infrared spectroscopy and acousto-optical detector of IRIS was presented. In the final section we verified the diagnostic quality of this new diagnostic device (using ANOVA and ROC analysis) on cohort of 103 patients divided into 3 groups according to diagnosis and the various level of liver damage.
Keywords:
13C-methacetin, dose, cumulative dose, infrared spectroscopy, transmitance, absorbance, cirrhosis
Autoři: Jana Vránová 1; Jozef Rosina 1; Miluše Hendrichová 2; Antonín Vrána 3; Karolína Krátká 2; Jiří Horák 2
Působiště autorů: Ústav lékařské biofyziky a lékařské informatiky, 3. lékařská fakulta, Univerzita Karlova 1; I. interní klinika, 3. lékařská fakulta, Univerzita Karlova, Praha, Česká republika 2; Ústav radiační onkologie, Nemocnice na Bulovce, Praha, Česká republika 3
Vyšlo v časopise: Lékař a technika - Clinician and Technology No. 1, 2013, 43, 24-34
Kategorie: Původní práce
Souhrn
Ve své práci jsme představili nový neinvazivní diagnostický přístroj IRIS (Wagner Analysen Technik, Německo), využívající princip infračervené nedisperzní spektroskopie, pomocí které měří ve vydechovaném vzduchu pacientů množství stabilního izotopu 13C. Naměřené hodnoty slouží pro kvantifikaci parametrů jaterní funkce, a to kinetiky, která definuje typ jaterního poškození a také kapacity jater, která udává procento zpětné výtěžnosti. V článku je krátce popsán fyzikální princip infračervené spektroskopie a akusto-optického detektoru, který diagnostický přístroj IRIS využívá. V závěrečné části jsme na studii 103 pacientů, rozdělených do 3 skupin (podle diagnózy a podle očekávaného různého stupně poškození jater) pomocí analýzy rozptylu a ROC analýzy ověřili diagnostickou kvalitu tohoto přístroje.
Klíčová slova:
13C-methacetin, dávka, kumulovaná dávka, infračervená spektroskopie, transmitance, absorbance, cirhózaÚvod
Vyšetření jaterních funkcí se provádí za účelem posoudit funkční rezervu jater (např. před transplantací jater), určit prognózu pacienta, nebo posoudit účinek léčby. V játrech probíhají základní metabolické, regulační a jiné funkce, které můžeme hodnotit řadou testů. Těmi nejvíce používanými jsou rutinní biochemické tzv. jaterní testy. Žádný z těchto testů však není schopen kvantifikovat celkovou jaterní kapacitu. Také kdysi velmi rozšířené chromoexkreční zkoušky např. s bromsulfoftaleinem nebo tzv. galaktózový eliminační test byly postupně opuštěny a nahrazeny metabolickými testy s použitím radioaktivních izotopů, které ovšem měly také svá významná omezení.
Poslední slovo v kvantifikaci jaterních funkcí patří látkám značeným izotopem 13C, který se vyskytuje v přírodě, neemituje ionizující záření a je tedy zcela bezpečný. Princip testování je jednoduchý – proband požije vhodnou látku označenou uhlíkem 13C, např. methacetin. Ten je metabolizován v játrech až na oxid uhličitý a množství 13CO2 ve vydechovaném vzduchu je mírou intenzity jaterního metabolismu. Výsledky testu velmi dobře korelují např. s funkční klasifikací jaterní cirhózy podle Childa a Pugha, na rozdíl od ní je však test dobře použitelný pro sledování změn v celém rozsahu jaterních funkcí [1]. Pro stanovení 13CO2 ve vydechovaném vzduchu se užívá infračervená izotopová spektroskopie. Sami již několik let používáme na našem pracovišti přístroj IRIS (Nondispersive InfraRed Isotope-selective Spectroscopy) od firmy Wagner Analysen Technik, Německo [2].
IRIS je dodáván spolu se softwarem, který je schopen rozlišit: játra zdravá (normal); stimulovanou jaterní funkci (stimulated) – metabolizmus jater je velmi rychlý, stimulovaný neustálým odbouráváním jedovatých látek (alkoholu, hepatotoxických léků apod.); jaterní cirhózu (cirrhosis) – metabolizmus jater je velmi poškozen. Průběh měřených veličin – % 13C dávky/hod a % C13 kumulované dávky ve vydechovaném vzorku pro tyto tři případy spolu s referenčním rozmezím, určujícím pásmo, ve kterém se pohybuje normální jaterní funkce, vidíme na obrázcích 1 a 2 [1].
Obr. 1. Dávka/h [%] <sup>13</sup>C methacetinu. ![Dávka/h [%] <sup>13</sup>C methacetinu.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d44bb40a7f8b582ef788f99dbef95a69.jpg)
Obr. 2. Kumulovaná dávka [%] <sup>13</sup>C methacetinu. ![Kumulovaná dávka [%] <sup>13</sup>C methacetinu.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/023cb493531886398d42a2273816e27e.jpg)
Test s 13C methacetinem je schopen rozlišit mezi zdravými, stimulovanými a cirhotickými játry. Pokusili jsme se zjistit, zda existuje statisticky významný rozdíl v naměřených hodnotách dávky a kumulované dávky 13C methacetinu diagnostickým přístrojem IRIS také u pacientů s poškozením jater jiné etiologie, a to konkrétně u pacientů s dekompenzovaným srdečním selháním. Provedli jsme měření a porovnání jaterních dechových testů mezi 3 skupinami pacientů, rozděle-nými podle diagnózy, a to ve všech časových inter-valech. Cílem studie bylo také určit, ve kterém časovém intervalu je tento rozdíl největší, čili který časový okamžik má největší rozlišovací sílu. Diagnostickou schopnost přístroje IRIS jsme porovnali s diagnostickou schopností běžných jaterních testů a také s APRI skóre a s AST/ALT poměrem.
Základní fyzikálně-chemické principy
Uhlík 13C
Uhlík 13C se běžně vyskytuje v přírodě a v lidském organizmu představuje za normálních okolností 1,1 % z celkového obsahu uhlíku. Je metabolizován stejně jako rozšířenější uhlík 12C, je netoxický, neradioaktivní a je stabilním izotopem, proto je vhodný k využití v diagnostice [1].
Methacetin označený 13C je metabolizován v jaterním smíšeném oxidázovém systému, a to exkluzivně s použitím podskupiny cytochromu P450 CYP1A2 demethylací/dekarboxylací na acetaminophen a CO2. Vzniklý oxid uhličitý je rychle absorbován a dostává se do krve, z ní krevním řečištěm do plic, kde je vydýchán. Použití 13C značeného methacetinu umožňu-je pomocí poměru 13CO2/12CO2 ve vydechovaném vzduchu kvantifikovat parametry jaterní funkce, a to kinetiku (% 13C dávky/hod), která definuje typ jaterního poškození a kapacitu (% 13C kumulované dávky), která udává procento zpětné výtěžnosti. Protože cytochrom CYP1A2 je aktivní při metabo-lizmu alkoholu, je také alkoholem poškozován a stimulován, poskytuje 13C-methacetin dechový test velmi dobré výsledky při diagnostice jaterních onemocnění způsobených alkoholem [1,2].
13C-methacetinový dechový test dále slouží ke stanovení stádia rozvoje NASH (nealkoholická steato-hepatitida, která je charakterizovaná postižením jater, které je morfologicky podobné postižení jater při abúzu alkoholu) nebo ASH (alkoholická steatohepatitida – alkoholické poškození jater), k hodnocení funkčního stavu fibrózy, steatózy či cirhózy, poskytuje informace o funkční rezervě jater při plánování jaterních resekcí a je také vhodným nástrojem pro načasování jaterní transplantace [1,3].
Infračervená spektroskopie
Infračervená spektroskopie je analytická technika určená pro identifikaci a strukturní charakterizaci organických sloučenin a anorganických látek. Její podstatou je interakce měřeného vzorku s infračerveným zářením (elektromagnetickým vlněním v rozsahu vlnových délek kolem 800 nm až 1 mm). Energie fotonů infračerveného záření (1–60 kJ/mol) nepostačuje pro excitaci elektronů v molekulových orbitalech, ale je dostatečná ke změně vibračního či rotačního stavu molekuly. Pokud je změna těchto vibračních a rotačních stavů spojena se změnou dipólových momentů, dochází k absorpci záření charakteristického pro danou vazbu v molekule. Pomocí infračervené spektroskopie sledujeme právě množství pohlceného infračerveného záření v závislosti na vlnové délce, přičemž množství pohlceného záření se vyjadřuje buď v procentech transmitance (% T) nebo jednotkách absorbance (A). Transmitanci definujeme jako poměr intenzit záření prošlého (I) a původního paprsku (I0) [4]:
Absorbance udává, jaké množství záření bylo pohlceno měřeným vzorkem. Pomocí transmitance ji můžeme definovat jako:
kde c – molární koncentrace, l – délka kyvety, ε – molární absorpční koeficient, který je tabelován.
Tento vztah označujeme také jako Lambertův – Beerův zákon, podle nějž je absorbance přímo úměrná koncentraci absorbující látky [5].
Analytickým výstupem infračervené spektroskopie jsou infračervená spektra, která jsou grafickým zobrazením funkční závislosti absorbované energie, vyjádřené právě transmitancí nebo absorbancí na vlnové délce. Pro jednotlivé látky je infračervené spektrum charakteristické natolik, že prakticky neexistují dvě sloučeniny, které by měly zcela shodné infra-červené spektrum. Příklad typického infračerveného spektra vidíme na obrázku 3.
Obr. 3. IČ spektrum analyzovaného vzorku. Transmitance (vlevo), absorbance (vpravo). 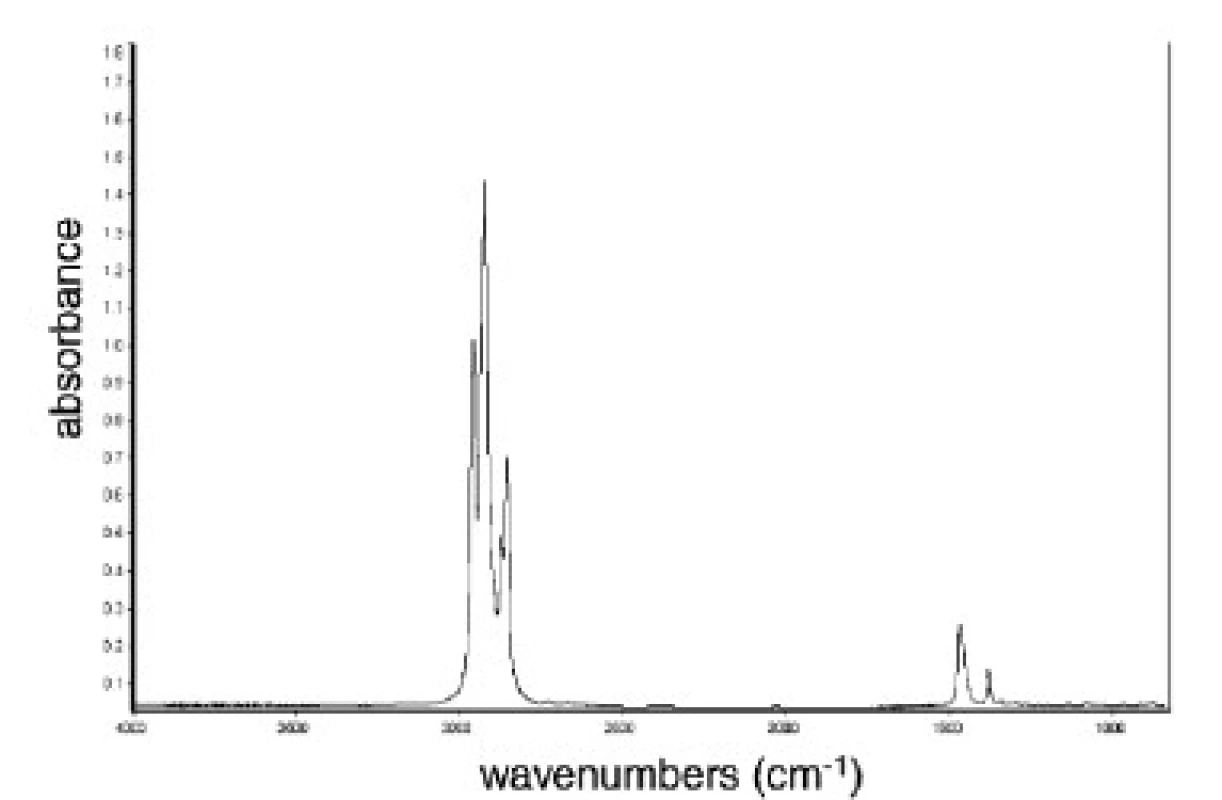
IRIS používá spolu s nedisperzní infračervenou spektroskopií širokopásmový zdroj záření a akusticko-optický detektor (Luft – Lehrerova typu), který je citlivý pouze na ty vlnové délky, při kterých vyšetřované plyny pohlcují infračervené záření. Dvěma takovými detektory citlivými speciálně na absorpční spektra 12CO2 a 13CO2 se měří koncentrace obou plynů a jejich poměr [2].
Luft – Lehrerův detektor
Základní schéma detektoru je znázorněno na obrázku 4 [6]. Detektor je tvořen uzavřenou komůrkou, ve které se nacházejí molekuly absorbující látky. Pružná membránová deska kondenzátoru rozděluje detektor na zadní část, ve které se nachází pevná deska kondenzátoru a přední, absorpční část, ve které se nachází optické okénko, kterým proniká dovnitř přerušované infračervené záření. Plyn je v důsledku absorpce záření ohříván, dochází k jeho rozpínání a v důsledku deformace membrány – mění se geometrie kondenzátoru – dochází ke změně napětí na deskách kondenzátoru. Membrána osciluje s frekvencí přerušovače a její deformace je nepřímo úměrná koncentraci absorbujících molekul v dechovém vzorku.
Obr. 4. Akusticko-optický detektor Luft – Lehrerova typu 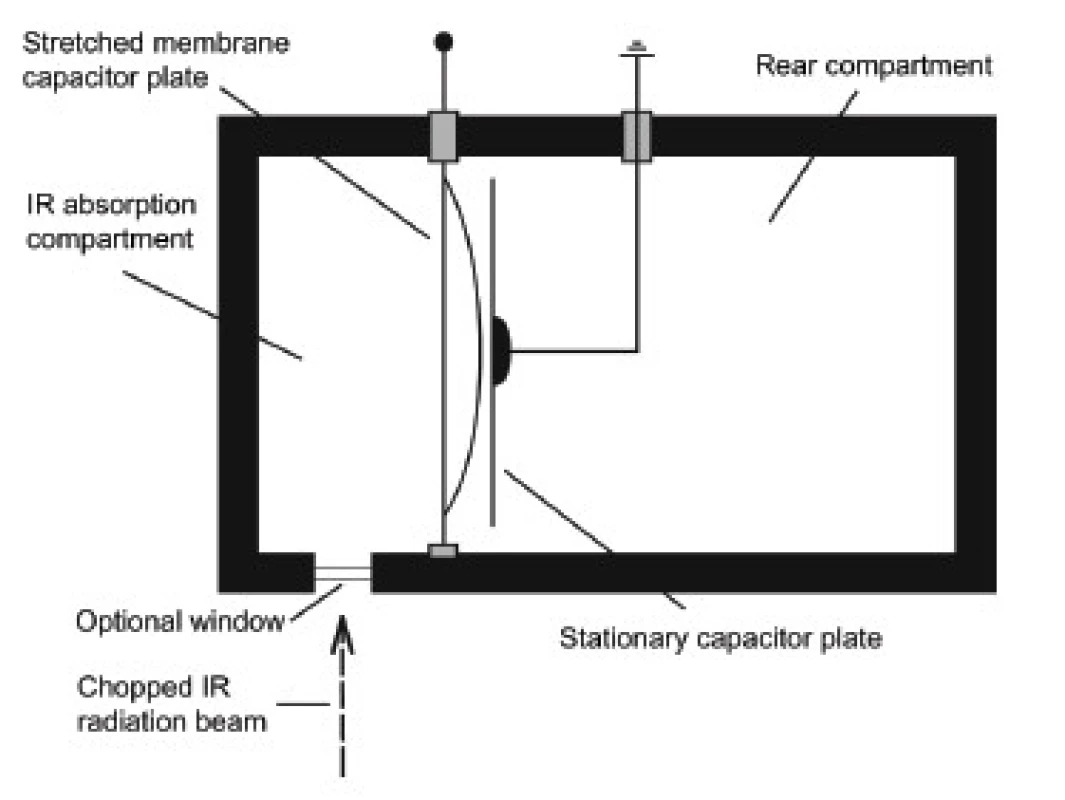
Materiály a metody
Pacienti
Studie se zúčastnilo 66 pacientů a 37 zdravých kontrol. Skupinu pacientů s cirhózou (CIRHÓZA) tvořilo 52 pacientů (průměrný věk 59.23 ± 9.87, rozpětí 36–80; poměr ženy/muži (F/M) 26/26; průměrná hodnota Body-Mass-Indexu (BMI) bylo 25.25 ± 6.08. U všech pacientů byla diagnóza potvrzena jaterní biopsií. 2. skupinu tvořilo 14 pacientů s dekompenzovaným srdečním selháním (chronic heart failure (ACHF)) s ejekcí levé komory LVEF ≤ 45%, NYHA III – IV (průměrný věk 77.21 ± 14.08, rozpětí 44–90; F/M poměr 4/10; průměrná hodnota BMI 26.13 ± 4.57). Kontrolní skupinu (KONTROLY) tvořilo 37 zdravých dobrovolníků (průměrný věk 66.81 ± 12.6, rozpětí 38–9; F/M poměr 15/22; BMI 27.27 ± 4.11). Všichni pacienti i zdravé kontroly podstoupili ultrazvukové vyšetření a rutinní biochemické testy. Všichni zdraví jedinci měli testy v rozmezí normálních hodnot, u žádného z nich nebylo zjištěno jaterní nebo závažné kardiovaskulární onemocnění, nebo abusus alkoholu. Všichni pacienti i zdravé kontroly byli vyšetření na I. interní klinice Fakultní nemocnice Královské vino-hrady, 3. lékařské fakulty Karlovy univerzity v Praze. Všichni účastníci studie podepsali informovaný sou-hlas. Studie byla odsouhlasená etickou komisí 3. lékařské fakulty Karlovy univerzity v Praze.
APRI skóre
APRI skóre jsme v naší studii použili k posouzení stupně jaterního poškození, přestože je hlavně používán k posouzení stupně jaterní fibrózy. Tento test se počítá ze snadno dostupných laboratorních parametrů a jeho diagnostická přesnost pro určení stupně fibrózy i cirhózy byla potvrzena v mnoha studiích [7, 8].
13C-methacetin jaterní dechový test
Pacienti před začátkem vyšetření přicházejí na lačno a před vypitím testovacího nápoje vydechnou do prvního dechového sáčku. Současně vypijí testovací nápoj (75 mg 13C methacetinu rozpuštěného v 200 ml neslazeného čaje nebo vody) a postupně vydechují v intervalech 10, 20, 30, 40, 50, 60, 80, 100 a 120 minut do dalších dechových sáčků.
Výsledky získané z přístroje IRIS byly vyjádřeny jako dávka (PDR) 13CO2/h (procento dávky izotopu uhlíku 13C získaného z vydýchaného vzduchu za hodinu), a kumulativní dávka (CPDR) procento 13C zjištěného ve vydýchaném vzduchu v průběhu vy-šetření (13C kumulativní dávka). V den vyšetření pomocí přístroje IRIS byly u všech pacientů změřeny rutinní jaterní testy včetně celkového bilirubinu (BILI), aspartát-aminotransferázy (AST), alaninaminotran-sferázy (ALT) a všichni pacienti také podstoupili ultrasonografické vyšetření břicha. Pacienti s de-kompenzovaným srdečným selháním podstoupili echokardiografické vyšetření pomocí přístroje Ultramark 7 [9, 10]. Průměry srdečních komor a předsíní byly měřeny pomocí dvourozměrné echokardiografie, ejekční frakce levé komory (EF) byla spočtena pomocí metody uvedené ve studii [11]. Skóre APRI a poměr AST/ALT byl spočten pro všechny pacienty a zdravé kontroly.
Statistická analýza
K nalezení statisticky významných rozdílů sledova-ných veličin mezi všemi skupinami jsme použili analýzu rozptylu s jednoduchým tříděním ANOVA s následným Bonferroniho testem pro mnohonásobné porovnávání. K určení diagnostické schopnosti jsme použili ROC analýzu. K porovnání diagnostické síly všech výše uvedených testů jsme použili také ROC analýzu, a to metodu to Z-kritérium podle Hanleyho a McNeila [12]. Ke statistické analýze jsme použili statistický program STATISTICA verze 9 firmy StatSoft Inc a IBM SPSS Statistics verze 20. Jako statisticky významnou jsme uvažovali hodnotu p < 0,05.
Výsledky
V tabulce 1 jsou uvedeny průměrné hodnoty a smě-rodatné odchylky biochemických jaterních testů. APRI skóre a poměru AST/ALT a naměřených dávek a kumulovaných dávek 13C methacetinu ve všech časových intervalech pro všechny 3 skupiny pacientů.
Tab. 1. Naměřené hodnoty vybraných biochemických testů, APRI skóre a AST/ALT poměr a hodnoty dávky a kumulované dávky <sup>13</sup>C methacetinu v časových intervalech (10, 20, 30, 40, 50, 60, 80, 100, 120 min.). 1 – kontrolní skupina – KONTROLY, 2 – cirhóza – CIRHÓZA, 3 – dekompenzované srdečné selhání – ACHF (průměr ± směrodatná odchylka). 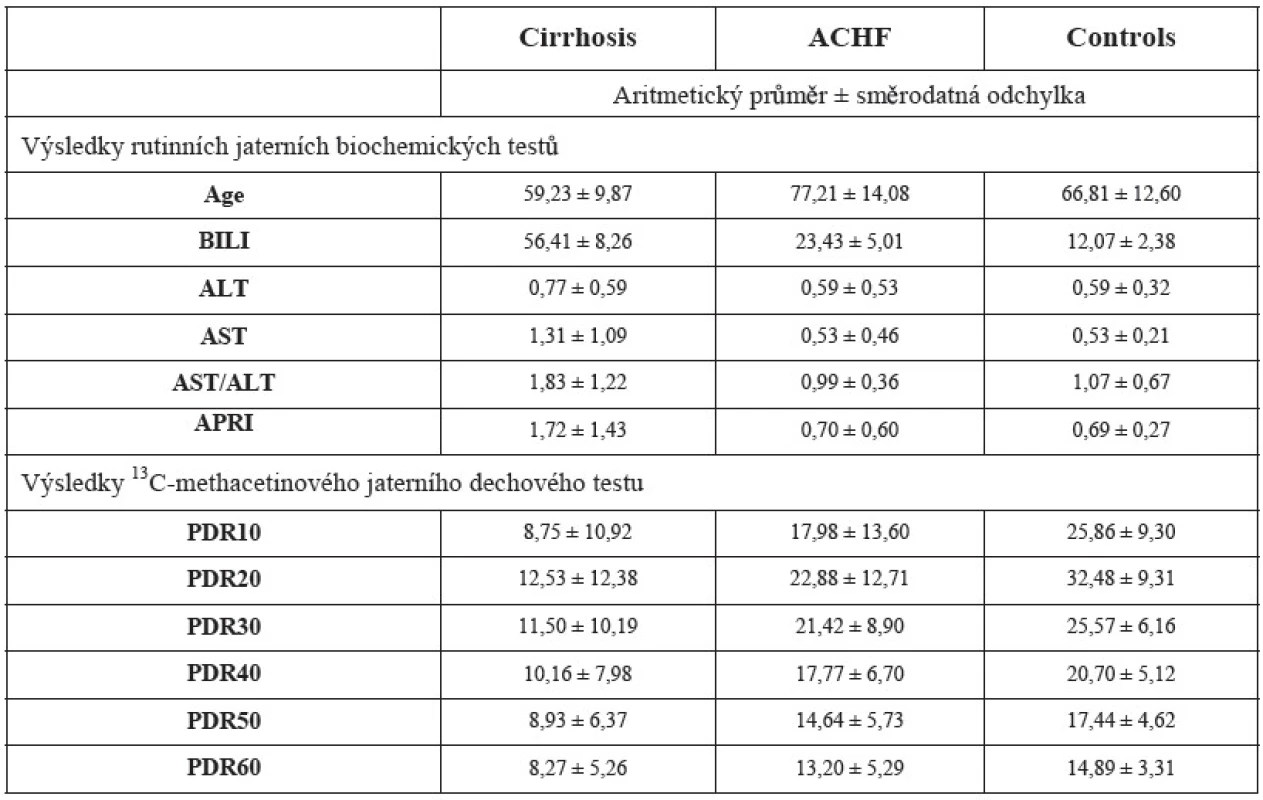
ROC analýza – nalezení nejlepšího časového intervalu pro 13C-methacetin jaterního dechový test pro diskriminaci mezí 3 skupinami pacientů
Pomocí ROC analýzy (podle velikosti plochy pod ROC křivkou (AUC)) jsme našli časový interval, který má největší rozlišovací schopnost mezi jednotlivými skupinami pacientů. Ve všech případech jsme největší diskriminační schopnost nalezli v 10. až 30. minutě dávky (PDR) dechového testu. Pro kumulovanou dávku byla nalezena největší diskriminační síla při porovnání skupin Kontroly vs. ACHF a Kontroly vs. Cirhóza opět mezi 10. až 20. minutou. Mezi skupinami Cirhóza vs. ACHF jsme nalezli největší rozlišovací schopnost v 60. a 80. minutě. Když použijeme tradiční skórovací systém podle Tapea je rozlišovací schopnost dechových testů následující: DOBRÁ (GOOD, AUC 0,80-0,90) pro skupiny Kontroly vs. Cirhóza a ACHF vs. Cirhóza a SLUŠNÁ (FAIR, AUC 0,70-0,80) pro skupiny Kontroly vs. ACHF. Detailní výsledky vidíme v tabulce 2 (AUC a směrodatná chyba (SE) plochy pod ROC křivkou).
Tab. 2. Plocha pod ROC křivkou (AUC) a směrodatná chyba plochy pod křivkou (SE) pro vybrané biochemické testy a <sup>13</sup>C-methacetin jaterní dechové testy pro 3 skupiny pacientů: CIRHÓZA (n = 52), ACHF (n = 14) a KONTROLY (n = 37). 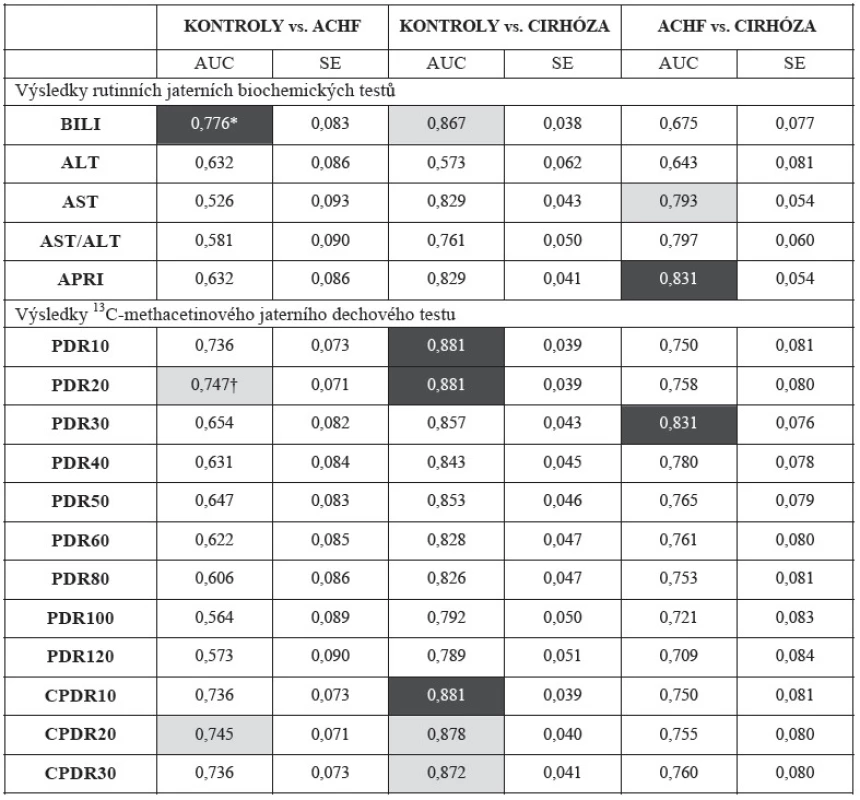

* bílé písmo na černém pozadí největší plocha pod křivkou – největší diskriminace † černé písmo na tmavošedém pozadí – hodnota s druhou největší diskriminační schopností ROC analýza – porovnání diskriminační schopnosti nejlepšího rutinního biochemického testu a nejlepšího časového okamžiku 13C-methacetin jaterního dechového testu
Při porovnání diskriminační schopnosti mezi rutinními jaterními testy a 13C-Methacetinovým dechovým jater-ním testem jsme nalezli větší diskriminační sílu u jaterních testů a to mezi skupinami Kontroly vs. Cirhóza a Kontroly vs. ACHF. V posledním případe Cirhóza vs. ACHF má největší rozlišovací schopnost celkový bilirubín. V žádném případě jsme nenalezli statisticky významný rozdíl mezi nejlepším rutinním biochemickým testem a jaterním dechovým testem. Detailní výsledky vidíme v tabulce 3.
Tab. 3. Porovnání klasifikační přesnosti a diskriminační síly mezi nejlepším rutinním jaterním testem a nejlepším časovým intervalem 13C-methacetinovým dechovým testem pomocí ROC analýzy. 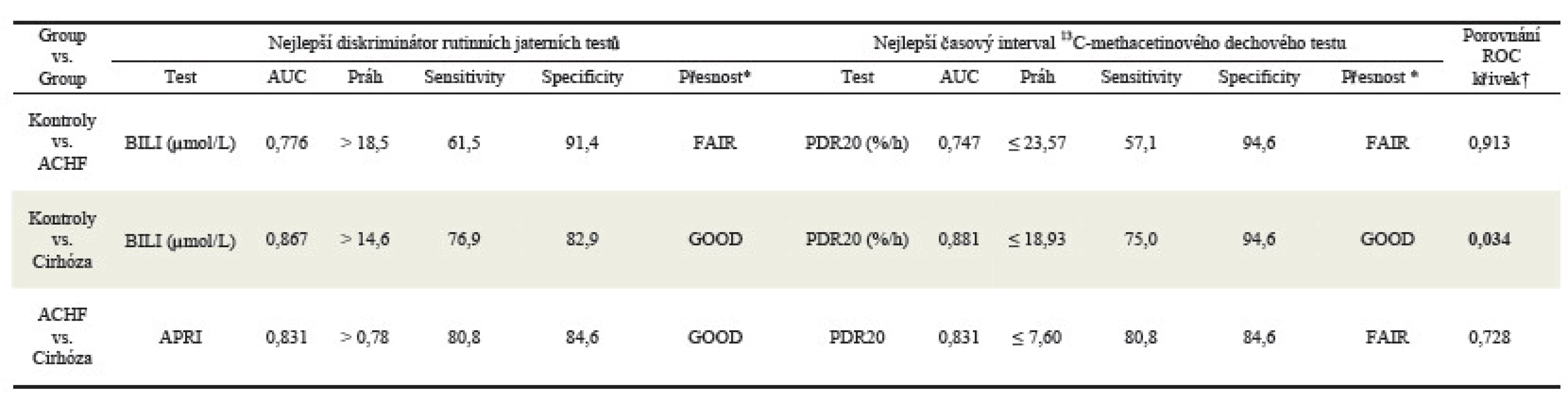
* Klasifikace přesnosti diagnostického test podle Tapea † p-hodnoty of Z-statistiky definované podle Hanleyho and McNeila (statisticky významný rozdíl je označen tučně) ANOVA – porovnání všech tří skupin s následným Bonferroniho testem
Při porovnání tří skupin pacientů jsme nalezli statisticky významný rozdíl u APRI skóre u AST/ALT poměru a mezi všemi ostatními biochemickými testy kromě ALT v následujících případech: Kontroly vs. Cirhóza a ACHF vs. Cirhóza. Mezi skupinami Kontroly vs. ACHF neexistuje statisticky významný rozdíl ani v jedné výše uvedené veličině. U 13C-methacetin dechové-ho testu jsme nalezli statisticky významný rozdíl ve všech časových intervalech při porovnání Kontroly vs. Cirhózy (p < 0,0001) a také mezi skupinami ACHF vs. Cirhózy (p < 0,01) s nejvyšší rozlišovací schopností ve 20. Minutě PDR p = 0,0009. V posledním případě Kontroly vs. ACHF jsme pozorovali statisticky významný rozdíl pouze ve 20. minutě PDR (p = 0,0259) a ve 20. a 30. minutě CPDR (p = 0,0370 a p = 0,0430). Detailní výsledky jsou uvedeny v tabulce 4 (p-hodnoty Bonferroniho testu).
Tab. 4. p-hodnoty Bonferroniho testu analýzy rozptylu ANOVA pro mnohonásobné porovnávání mezi třemi skupinami pacientů: CIRHÓZA (n = 52) vs. ACHF (n = 14) vs. KONTROLY (n = 37) 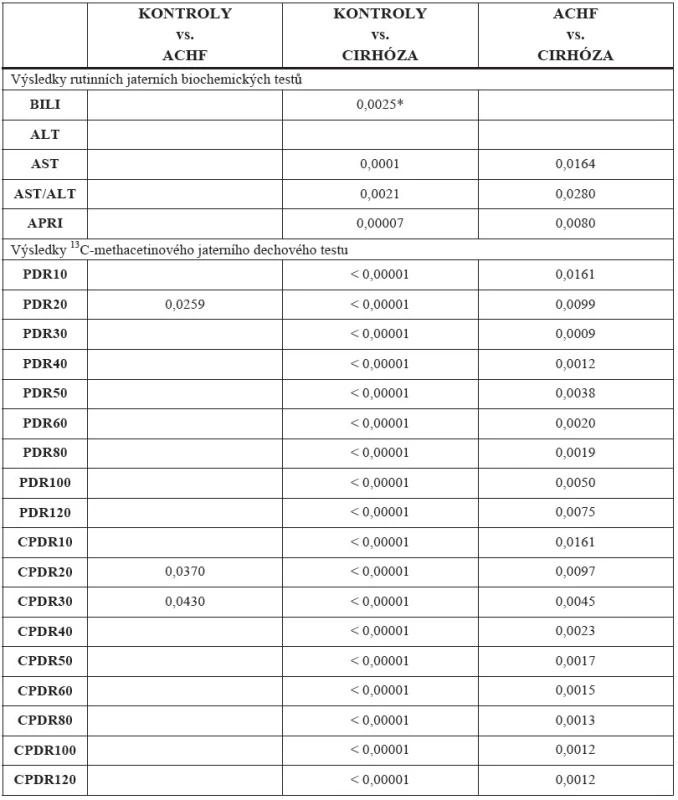
* Jen statisticky významné rozdíly Na obrázcích 5 a 6 jsou uvedeny grafy průměrů a intervalů spolehlivosti pro naměřenou hodnotu dávky a kumulované dávky 13C methacetinu pro všechny 3 skupiny pacientů.
Obr. 5. Graf průměrů s intervalem spolehlivosti – dávka/h [%] <sup>13</sup>C methacetinu. ![Graf průměrů s intervalem spolehlivosti – dávka/h [%] <sup>13</sup>C methacetinu.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f368d0376c6dcd26108b5adff6d85a72.jpg)
Obr. 6. Graf průměrů s intervalem spolehlivosti – kumulovaná dávka [%] <sup>13</sup>C methacetinu. ![Graf průměrů s intervalem spolehlivosti – kumulovaná dávka [%] <sup>13</sup>C methacetinu.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/acdbc86f480eefd77f5d3b7ed8b92d91.jpg)
Závěr
Výsledky jednoznačně ukazují, že u pacientů s dekompenzovaným srdečním selháním dochází k rozsáhlému poškození jaterní funkce, blížící se jaterní cirhóze. Výsledky studie jsou v naprosté shodě s očekávanými výsledky a ukazují, že analyzátor IRIS je velmi kvalitním diagnostickým přístrojem, který má vysokou schopnost rozlišení mezi různými stupni jaterního poškození.
Ing. Jana Vránová, CSc.
Ústav lékařské biofyziky a lékařské informatiky
3. lékařská fakulta
Univerzita Karlova v Praze
Ruská 87, CZ-100 00 Praha 10
E-mail: jana.vranova@lf3.cuni.cz
Tel.: +420 267 102 303
Zdroje
[1] Vránová, J., Rosina, J., Horák, J., Krátká, K., Hendrichová, M. Isotope-Selective Infrared Spectroscopy Reveals Pathological Changes in the Liver. Acta Mechanica Slovaca, 2010, vol. 14. no. 2, p. 62-67.
[2] Breath testing in clinical Diagnose [online] [cit 2010-06-18], http://www.wagner-bremen.de/
[3] Petrolati, A., Festi, D., De Berardinis, G., Colaiocco-Ferrante, L., Di Paolo, D., Tisone, G., Angelico, M. 13C-Methacetin Breath Test For Monitoring Hepatic Function in Cirrhotic Patients Before and After Liver Transplantation, Aliment Phramcol. Ther. 2004 Jan 15; vol. 19 no. 2, p. 243.
[4] Infrared Spectroscopy [online], [cit 2010-06-16], Faculty of Education, Charles University in Prague, Chemistry & Chemistry Didactics Dept., downloadable materials: http://userweb.pedf.cuni.cz/kch/downloads/materialy/INA/ICSpektroskopie.pdf
[5] Absorbance [online], [cit 2010-06-18], from Wikipedia, the free encyclopedia, http://cs.wikipedia.org/wiki/Absorbance
[6] Lucero, D. P. An analytical model of the pneumatic nondispersive infrared detector, J. Phys. E. 1973; vol. 6, p. 281-5.
[7] Wai, C.T., Greenson, J.K., Fontana, R.J., Kalbfleisch, J.D., Marrero, J.A., Conjeevaram, H.S., et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003, vol. 38, p. 518–26.
[8] Snyder, N., Gajula, L., Xiao, S.Y., Grady, J., Luxon, B., Lau, D.T. et al. APRI: An easy and validated predictor of hepatic fibrosis in chronic hepatitis C, J Clin Gastroenterol 2006, vol. 40, p. 535–42.
[9] Hendrichova, M., Malek, F., Kratka, K., Sedlakova, M., Vranova, J., Horak, J. Microsomal liver function in patients with liver cirrhosis and chronic heart failure assessed with the 13C-methacetin breath test, Ces a Slov Gastroent a Hepatol 2006, 60 (Supp l1), pages 109.
[10] Málek, F., Havrda, M., Frühaufová, Z., Vránová, J. Multidisciplinární přístup v péči o nemocné s kardiorenálním syndromem – první zkušenosti. Abstrakty, Echodny 2006, 21.9.-23.9.2006. Cor Vasa 2006, vol. 48, no. 9: Kardio K 185.
[11] Hendrichová, M., Málek, F., Kopřivová, H., Vránová, J., Ošťádal, P., Krátká, K., Sedláková, M., Horák, J. Correlation of NT-proBNP with metabolic liver function as assessed with 13C-methacetin breath test in patients with acute decompensated heart silure. International Journal of Cardiology 2010; vol. 144 no. 2, p. 321-2.
[12] Hanley, J.A., McNeil, B.J. A Method of Comparing the Areas under the Receiver Operating Curves Derived from the Same Cases, Radiology 1983 Vol. 148, p. 839-843.
Štítky
Biomedicína
Článek vyšel v časopiseLékař a technika

2013 Číslo 1-
Všechny články tohoto čísla
- SROVNÁNÍ RŮZNÝCH PŘÍSTUPŮ HRANOVÉ DETEKCE KONČETINOVÝCH TEPEN V PODÉLNÉM ŘEZU ULTRAZVUKOVÉHO OBRAZU
- IMUNOFLUORESCENČNÍ ANALÝZA PROAPOPTICKÝCH SIGNÁLNÍCH MOLEKUL V BUŇKÁCH LIDSKÉHO MELANOMU PO FOTODYNAMICKÉ TERAPII
- Fototoxický vliv porfyrinových sensitizerů a viditelného záření na gram-pozitivní methicilin-rezistentní kmen S. aureus
- 13C-methacetinový dechový test u pacientů s jaterní cirhózou a dekompenzovaným srdečním selháním
- Testing of automatized rehabilitation device designed for elderly by industrial robot
- Specific behaviour of the blood sedimentation processes examined by the electrochemical impedance microsensor
- Development of biomedical information systems: MSL concept of e-learning – pilot study results
- MOŽNOSTI VYUŽITÍ ANALÝZY PŘEŽÍVÁNÍ V BIOMEDICÍNĚ A TECHNICE
- Lékař a technika
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- MOŽNOSTI VYUŽITÍ ANALÝZY PŘEŽÍVÁNÍ V BIOMEDICÍNĚ A TECHNICE
- 13C-methacetinový dechový test u pacientů s jaterní cirhózou a dekompenzovaným srdečním selháním
- Fototoxický vliv porfyrinových sensitizerů a viditelného záření na gram-pozitivní methicilin-rezistentní kmen S. aureus
- SROVNÁNÍ RŮZNÝCH PŘÍSTUPŮ HRANOVÉ DETEKCE KONČETINOVÝCH TEPEN V PODÉLNÉM ŘEZU ULTRAZVUKOVÉHO OBRAZU
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání







