-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Volné lehké řetězce a páry těžkých a lehkých řetězců imunoglobulinů ve vztahu k morbiditě pacientů před transplantací jater a v potransplantačním období
ree light chains and pairs of heavy and light chains of immunoglobulins in relation to morbidity of patients before liver transplantation and post-transplantation.
Objective:
To assess the role of free light immunoglobulin chains and pairs of heavy and light immunoglobulin chains in patients before and after liver transplantation (LTx). To compare associations of immunoglobulins and their components with comorbidities as assessed by objective laboratory tests and to evaluate development of laboratory tests during 2-year follow-up.
Design:
observational prospective study
Settings:
Institute for Clinical and Experimental Medicine, Vídeňská 1958/9, 140 21 Prague
Material and methods:
A group of 174 patients was evaluated before LTx and during a 2-year follow-up. Organ dysfunctions were evaluated by means of ELF score, MELD score, and common laboratory parameters (red blood cells, platelets, liver function, renal function, nutrition, and glucose metabolism). Reagents and analyzers from The Binding Site (SPA Plus and Optilite analyzer), Abbott (Architect ci 16200), Sysmex (XN), Siemens (Centaur CP), and Stago (STA R Max) were used according to the manufacturer´s recommendation. The Spearman correlation, Mann-Whitney, and Friedman tests were used.
Results:
Increased IgA, FLC-κ and FLC-λ before LTx were associated with increased ELF and MELD score, creatinine and uric acid and also with decreased concentrations of hemoglobin, platelets, albumin, prealbumin, lipid parameters, and cholinesterase. In patients with increased concentrations of IgA and FLC-κ before LTx, increased IgA and FLC-κ occurred also during the follow-up and worsening of renal function and lipid metabolism was found.
Conclusion:
We confirmed prognostic role of serum IgA in patients with serious liver diseases requiring transplantation. Similar prognostic role was found for FLC-κ a FLC-λ. The measurement of HLC was not associated with organ dysfunctions and comorbidities in these patients.
Keywords:
liver transplantation, immunoglobulins, free light immunoglobulin chains, pairs of heavy/light immunoglobulin chains, ELF score.
Autoři: A. Jabor 1,2; S. Fraňková 3
; R. Šenkeříková 3; J. Komrsková 1; M. Labanczová 1; D. Viczénová 1; P. Sečník Jr. 3; T. Vacková 1; J. Franeková 1,2
Působiště autorů: Institut klinické a experimentální medicíny, Pracoviště laboratorních metod, Praha, Česká republika 1; Univerzita Karlova, 3. lékařská fakulta, Praha, Česká republika 2; Institut klinické a experimentální medicíny, Klinika hepatogastroenterologie, Praha, Česká republika 3; SK Lab, Lučenec, Slovensko 4
Vyšlo v časopise: Klin. Biochem. Metab., 26, 2018, No. 4, p. 166-172
Souhrn
Cíl studie:
Zhodnotit roli volných lehkých řetězců imunoglobulinů (FLC) a párů lehkých a těžkých řetězců imunoglobulinů (HLC) u pacientů před transplantací jater (LTx) a po transplantaci. Porovnat asociaci imunoglobulinů a jejich komponent s komorbiditami pacientů vyjádřených objektivními laboratorními testy a posoudit vývoj laboratorních nálezů v průběhu dvou let sledování.
Typ studie:
Observační prospektivní studie.
Název a sídlo pracoviště:
Institut klinické a experimentální medicíny, Vídeňská 1958/9, 140 21 Praha 4
Materiál a metody:
Sledovali jsme soubor 174 pacientů před LTx a v průběhu 2letého follow-up. Jako ukazatele orgánových dysfunkcí byly použity ELF skóre, MELD skóre, laboratorní parametry charakterizující červenou krevní řadu, trombocyty, jaterní funkce, renální funkce, stav nutrice a glukózového metabolismu. Pro stanovení FLC a HLC byly použity soupravy The Binding Site a analyzátor SPA Plus (HLC) a Optilite (FLC, imunoglobuliny). Pro biochemické parametry byl použit analyzátor Architect ci16200 Abbott, pro krevní parametry analyzátor Sysmex XN, koagulační analyzátor STA R Max (Stago), bylo vypočteno MELD skóre, ELF skóre bylo vypočteno z parametrů měřených na analyzátoru Centaur CP, Siemens, vždy s originálními reagenciemi příslušných firem. Statistické postupy zahrnovaly Spearmanův korelační koeficient pořadové korelace, Mannův a Whitneyho neparametrický test a Friedmanův neparametrický test pro opakovaná vyšetření.
Výsledky:
Zvýšené koncentrace IgA, FLC-κ a FLC-λ před LTx byly asociovány s častějším výskytem patologicky zvýšených hodnot ELF a MELD skóre, kyseliny močové a kreatininu a se sníženými hodnotami hemoglobinu, trombocytů, albuminu, prealbuminu, lipidových ukazatelů a cholinesterázy. Během 2letého follow-up se u pacientů se zvýšenými výchozími hodnotami IgA a FLC-κ koncentrace udržovaly zvýšené a zhoršovaly se renální funkce a lipidové ukazatele.
Závěr:
U pacientů s pokročilým jaterním onemocněním vyžadujícím transplantaci jater byla potvrzena prognostická role zvýšených koncentrací IgA, podobnou výpovědní hodnotu mělo stanovení FLC-κ a FLC-λ. Stanovení HLC nevykazovalo asociace s orgánovými dysfunkcemi a komorbiditami těchto pacientů.
Klíčová slova:
transplantace jater, imunoglobuliny, volné lehké řetězce imunoglobulinů, páry volných a těžkých řetězců imunoglobulinů, ELF skóre.
Úvod
Institut klinické a experimentální medicíny v Praze provádí ročně kolem 150 transplantací jater. Ve většině případů jde o pacienty s chronickým selháním jater (alkoholická choroba jater, virová hepatitida C, cholestatické jaterní choroby) či primárními tumory jater (hepatocelulární karcinom). V rámci širšího projektu sledování pacientů po transplantaci solidních orgánů, zaměřeného na rozvoj potransplantační lymfoproliferativní choroby (PTLD), prezentujeme část výsledků popisujících vztah mezi koncentracemi imunoglobulinů, HLC a FLC a závažností stavu pacientů před LTx a v průběhu follow-up.
Pro pacienty s jaterní cirhózou je obvyklé zmnožení imunoglobulinů především ve třídě IgA a IgG, provázené elektroforetickým nálezem polyklonálního zmnožení. Imunitní protilátková odpověď je v potransplantačním období modifikována indukční (související bezprostředně s LTx) a udržovací imunosupresivní terapií. U pacientů po transplantacích všeobecně dochází k různým změnám imunitní odpovědi, které mohou vyústit v rejekci, infekční komplikace nebo dokonce k rozvoji potransplantační lymfoproliferativní choroby (PTLD) [1,2]. Klíčovým imunoglobulinem, který se uplatňuje v patofyziologii cirhózy, je IgA [3].
Sekreční IgA (SIgA, dimer) je důležitý pro udržení homeostázy ve střevě. Reguluje složení mikrobiomu, chrání sliznici střeva před patogeny, ovlivňuje imunitní funkci. Je tvořen plasmatickými buňkami v lamina propria, do lumen střeva se dostává transcytózou přes epitel střevního lumen a játra jsou přímo přes vena portae ovlivněna produkty tvořenými ve střevě a jsou tedy podstatně ovlivněna porušenou homeostázou ve střevě. Kupfferovy buňky prostřednictvím receptorů rozpoznávajících molekulové vzory (pattern-recognition receptors, PRR) reagují na přítomnost bakteriálních zbytků (lipopolysacharidy) a spouštějí lokální zánětlivou reakci. Naopak játra ovlivňují mikrobiom přes IgA tvořený v játrech, který je společně se žlučovými kyselinami secernován do střeva.
Ukazuje se, že imunologická funkce sérového IgA (monomer) je rozsáhlejší, než se předpokládalo dříve, a má přidanou diagnostickou hodnotu. Sérový IgA (nikoli sekreční) po opsonizaci bakterií vytváří imunokomplex, zprostředkuje vazbu mezi FcαRI (CD89) a toll-like receptory (TLR), což vede k vyplavení prozánětlivých cytokinů, především TNFα, IL1 a IL6. Vazba na FcαRI však může indukovat nejen aktivační, ale naopak i inhibiční odpověď. Vazba volného IgA na FcαRI spouští inhibiční signál a blokuje aktivační odpověď. Exprese CD89 byla pozorována na různých typech buněk včetně neutrofilů, makrofágů, monocytů a Kupfferových buněk. Sérové, nesekreční IgA indukuje protektivní proinflamační odpověď různých myeoloidních imunitních buněk a reguluje cytokinovou odpověď v nemukózních tkáních [4,5].
Protože se zvýšené sérové koncentrace IgA považují za známku zhoršené prognózy pacientů, bylo cílem naší práce zjistit, zda existuje vztah mezi změnami protilátkové odpovědi a morbiditou pacientů. Stav pacientů byl objektivizován vyšetřením laboratorních parametrů charakterizujících hlavní orgánové dysfunkce. Kromě základních vyšetření protilátkové odpovědi (celkové IgA, IgG a IgM) jsme se zaměřili na význam stanovení volných lehkých řetězců imunoglobulinů třídy kappa a lambda (FLC-κ a FLC-λ) a párů lehkých a těžkých řetězců imunoglobulinů HLC IgA-κ, HLC IgA-λ, HLC IgG-κ, HLC IgG-λ, HLC IgM-κ a HLC IgM-λ v posouzení stavu nemocných s transplantací jater.
Metodika
Vyšetřili jsme celkem 174 pacientů před LTx, jeden a dva roky po LTx. Společně s vyšetřením FLC a HLC bylo vypočteno ELF skóre (matematické zpracování tří sérových parametrů: kyselina hyaluronová, HA; N-terminální propeptid prokolagenu typu III, PIIINP; tkáňový inhibitor metaloproteáz typu 1, TIMP-1) a MELD skóre (posuzující prognózu pacientů na základě matematického zpracování parametrů charakterizujících koagulaci – INR, renální funkce – sérový kreatinin, a jaterní funkce – sérový bilirubin). Z běžných laboratorních parametrů jsme sledovali parametry červené krevní řady (hemoglobin, hematokrit, počet erytrocytů), parametry koagulace (INR jako součást MELD skóre, trombocyty), ukazatele funkce ledvin nebo s funkcí ledvin souvisejícími (kreatinin, urea, kyselina močová v séru), sérové markery jaterní fibrózy (kromě již zmíněného ELF skóre koncentrace galectinu-3), ukazatele jaterních funkcí a aktivity jaterních enzymů (kromě již uvedeného MELD skóre ALT, AST, GGT, cholinesterázu), ukazatele nutrice (albumin, prealbumin, celkový cholesterol, HDL - a LDL-cholesterol, triacylglyceroly) a ukazatele glukózového metabolismu (koncentrace glukózy, HbA1c).
Sérové koncentrace HLC byly měřeny na analyzátoru SPA Plus (The Binding Site, UK), FLC a celkové imunoglobuliny na analyzátoru Optilite (The Binding Site, UK), biochemické markery na analyzátoru Architect ci16200 (Abbott), ELF skóre na analyzátoru Advia Centaur CP (Siemens) a krevní obraz na analyzátoru Sysmex XN. Všechny metody mají efektivní systém vnitřní kontroly kvality (IKK, UnityRealTime, BioRad) a externího hodnocení kvality (EHK, SEKK). Výjimkou je stanovení složek ELF skóre, pro které systém EHK sice není dostupný, ale sami organizujeme mezilaboratorní porovnávání [6], a galectin-3 (existuje pouze firemní zajištění kvality vyšetření).
Statistické zpracování
Použili jsme neparametrický Mann-Whitneyův test pro nezávislé soubory, Friedmanův test pro hodnocení po sobě jdoucích vyšetření a neparametrický Spearmanův korelační koeficient.
Výsledky
Tabulka 1 popisuje kohortu celého souboru pacientů před LTx.
Tab. 1. Basic characteristics of patients before LTx (N=174). There were 2, 2, and 4 patients with decreased IgA, IgG, and IgM, respectively, and 1 patient with decreased FLC-λ. Reference values for immunoglobulins were sex-specific, reference values for FLC κ/λ ratio were chosen with respect to the eGFR (CKD-EPI equation). 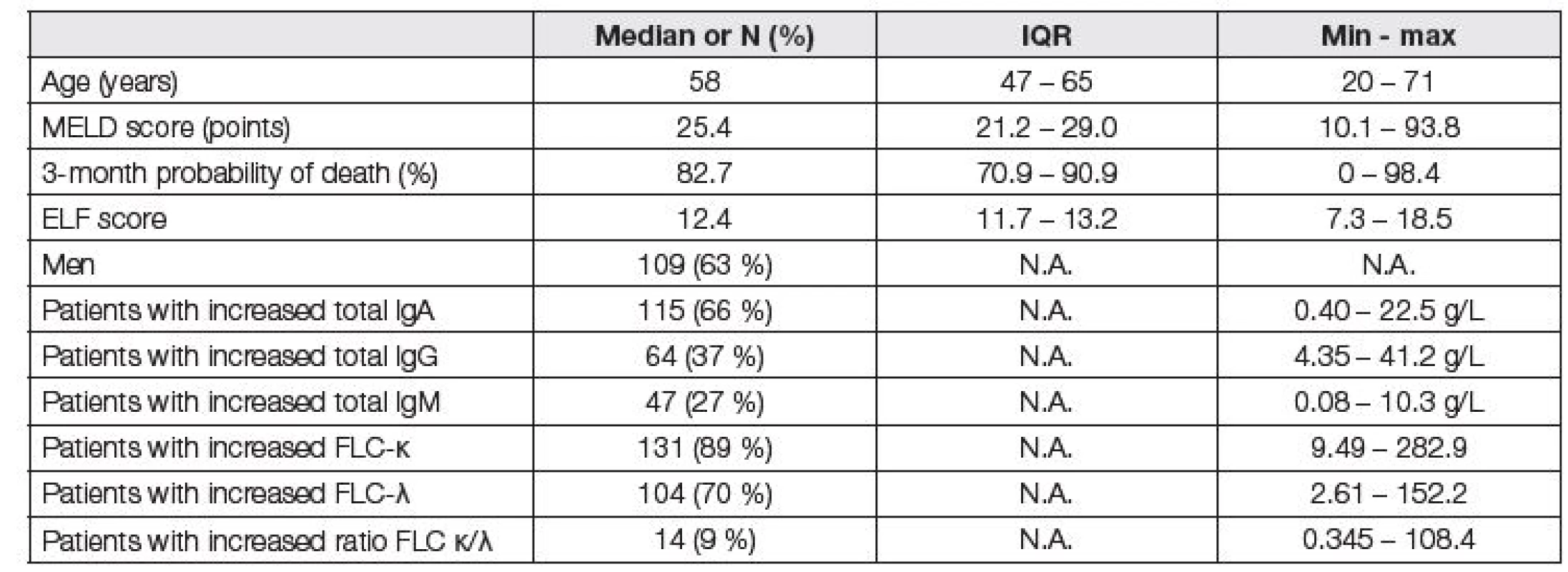
N.A. = not applicable Při vyhodnocení vztahů mezi ELF skóre a MELD skóre byla zjištěna vyšší těsnost vztahu pro FLC-κ než FLC-λ (r=0,305 vs. 0,268 pro ELF skóre, resp. r=0,429 vs. r=0,382 pro MELD skóre, p < 0,001 pro všechny vztahy). Pro celkové IgA, HLC IgA-κ a HLC IgA-λ byly vztahy s ELF skóre a MELD skóre rovněž významné, ale méně těsné. Prakticky zanedbatelné korelace vykazovaly s ELF a MELD skóre hodnoty IgG a IgM včetně HLC IgG a HLC IgM κ i λ. Poměr FLC κ/λ s oběma skóre nekoreloval vůbec.
Z uvedených důvodů jsme použili pro další sledování klasifikaci pacientů podle dvou různých kritérií: prvním kritériem byla hodnota celkového IgA v séru (s rozdělením kohorty pacientů na skupinu do mediánu 6,14 g/l a nad mediánem 6,14 g/l, v obou skupinách byl stejný počet pacientů N=87; dělení podle tohoto kritéria je na skupiny A a B); druhým kritériem byla hodnota FLC-κ (opět s rozdělením na skupinu do mediánu 48,3 mg/l a nad mediánem 48,3 mg/l, v obou skupinách bylo opět 87 pacientů, vznikly tak skupiny C a D).
V Tabulce 2 jsou hodnoty FLC a HLC zjištěné před LTx při rozdělení souboru pacientů podle dvou kritérií (celkové IgA nebo FLC kappa). Je vyznačen statistický rozdíl při vyhodnocení skupiny A a B, resp. C a D.
Tab. 2. Medians of immunoglobulin compounds before LTx. Comparison of two subgroups with respect to different criteria. Groups A and B according to the total IgA; group A above median of 6.14 g/L, group B up to median of 6.14 g/L. Groups C and D according to the FLC-κ; group C above median of 48.3 mg/L, group D up to median of 48.3 mg/L). Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). Symbol (a) means that the variable was used for classification to the respective group. 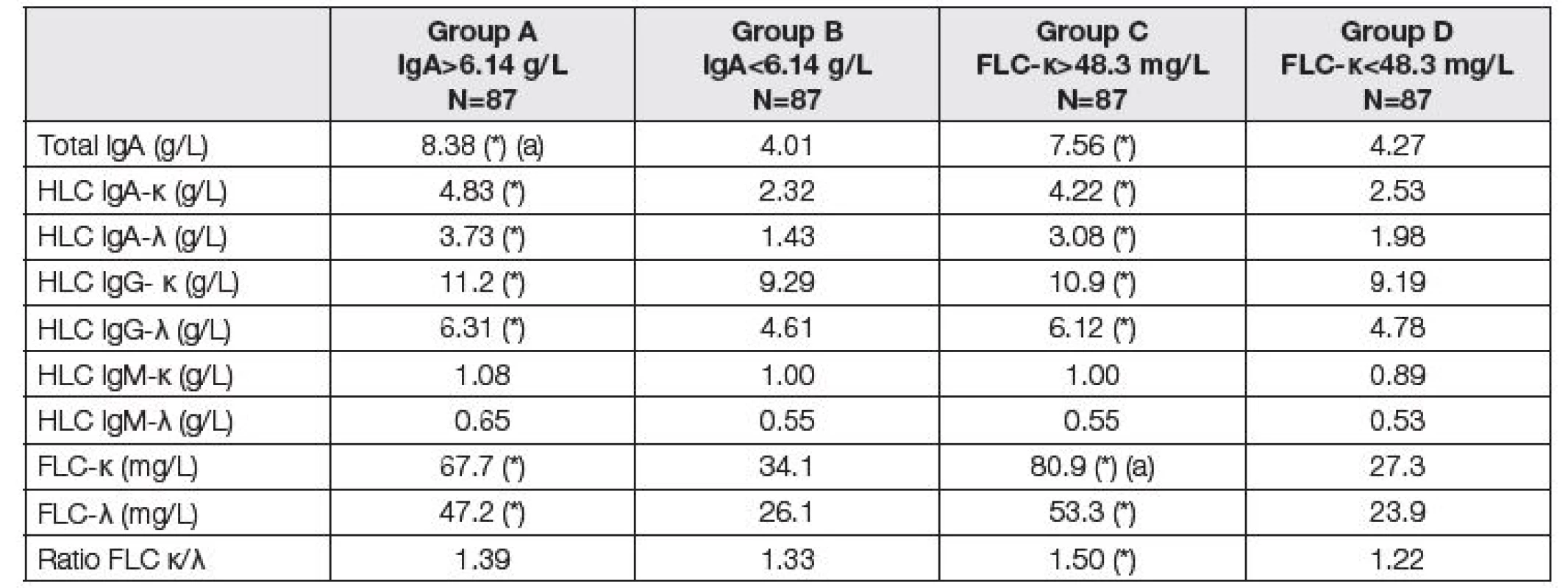
Analogicky jsou v Tabulkách 3 až 5 uvedeny parametry fibrózy před LTx (Tabulka 3), renálních funkcí a krevní obraz (Tabulka 4) a parametry jaterních funkcí a nutriční ukazatele (Tabulka 5).
Tab. 3. Medians of biomarkers of liver fibrosis before LTx. Comparison of two subgroups with respect to different criteria. Groups A and B according to the total IgA; group A above median of 6.14 g/L, group B up to median of 6.14 g/L. Groups C and D according to the FLC-κ; group C above median of 48.3 mg/L, group D up to median of 48.3 mg/L). Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). 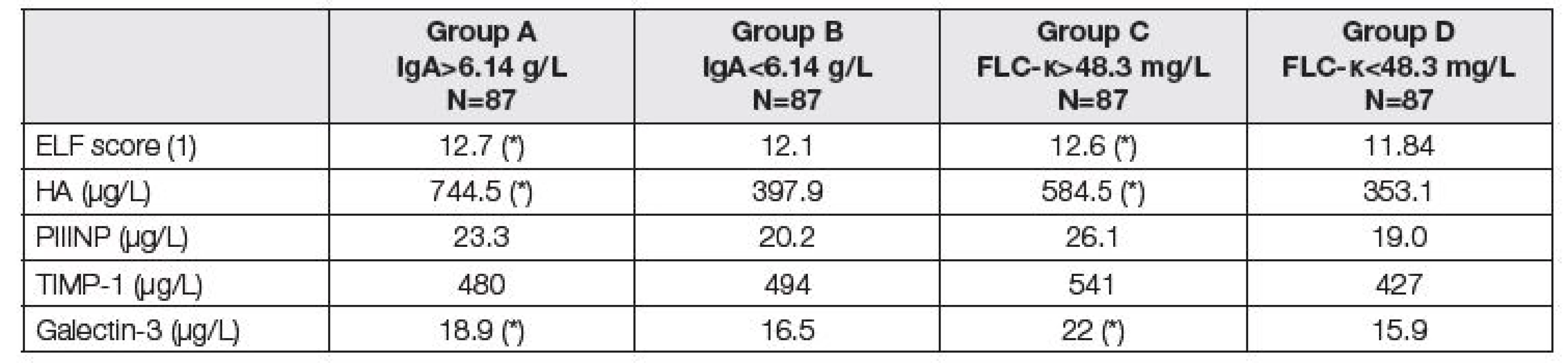
Tab. 4. Medians of parameters of renal function and liver fibrosis before LTx. Comparison of two subgroups with respect to different criteria. Groups A and B according to the total IgA; group A above median of 6.14 g/L, group B up to median of 6.14 g/L. Groups C and D according to the FLC-κ; group C above median of 48.3 mg/L, group D up to median of 48.3 mg/L). Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). 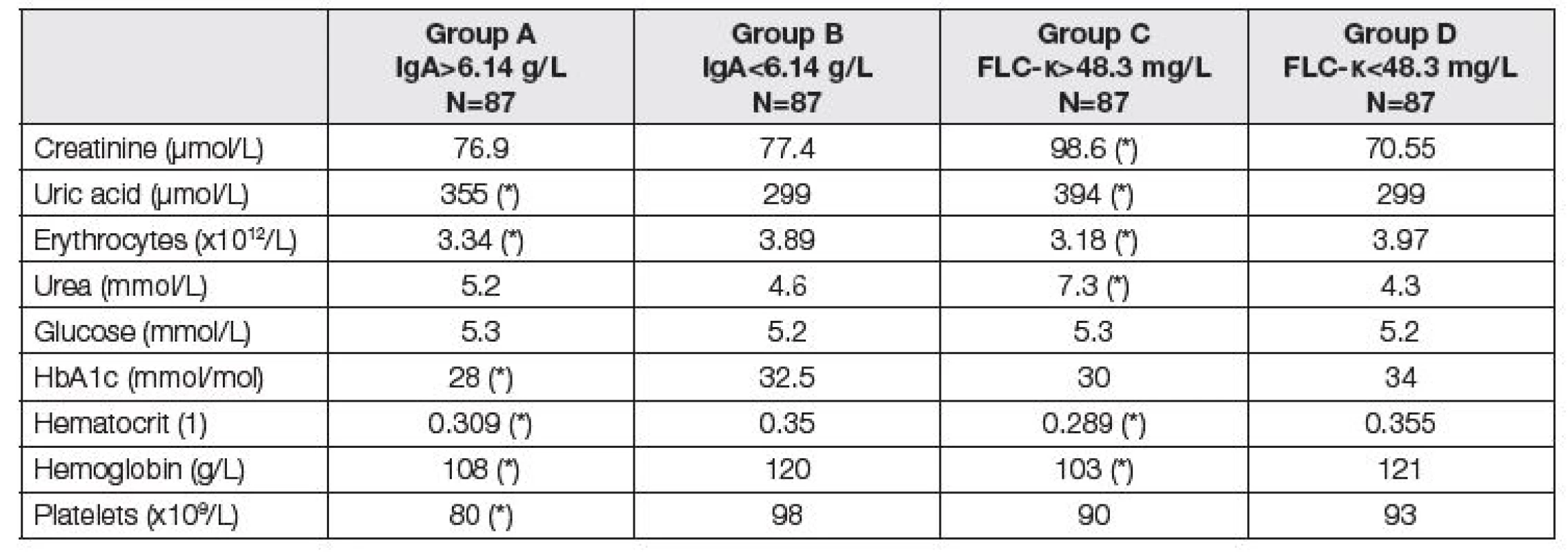
Tab. 5. Medians of parameters of liver function and nutritional parameters before LTx. Comparison of two subgroups with respect to different criteria. Groups A and B according to the total IgA; group A above median of 6.14 g/L, group B up to median of 6.14 g/L. Groups C and D according to the FLC-κ; group C above median of 48.3 mg/L, group D up to median of 48.3 mg/L. Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). 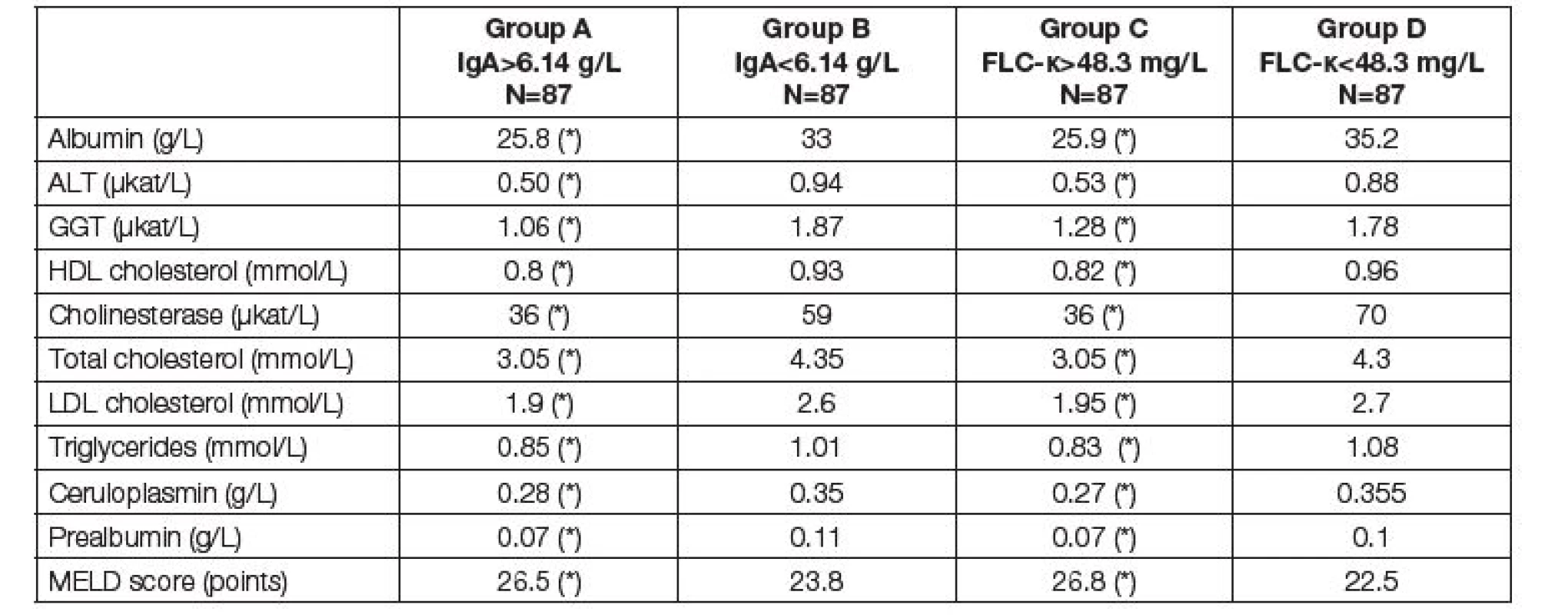
Po LTx dochází k poklesu koncentrace imunoglobulinů i jejich komponent (FLC a HLC). Vyhodnocení významnosti změn v koncentracích imunoglobulinů a jejich komponent pomocí Friedmanova testu ukázalo, že významný pokles je pro FLC-κ (p<0.001), FLC-λ (p<0.001), HLC IgA-κ (p<0.001), HLC IgA-λ (p<0.001), HLC IgG-κ (p<0.001), HLC IgG-λ (p<0.001), HLC IgM-κ (p<0.001) a HLC IgM-λ (p<0.001). Pokles HLC IgA-κ je znázorněn na obr. 1, pokles HLC IgA-λ je na obr 2.
Obr. 1. The significant decrease in HLC IgA-κ (y-axis, g/L) concentrations during the 2-year follow-up after LTx (Friedman test, p<0.001). The median of the rate of HLC IgA-κ decrease was 2.2 g/L (IQR 1.13-3.87) during the first year. 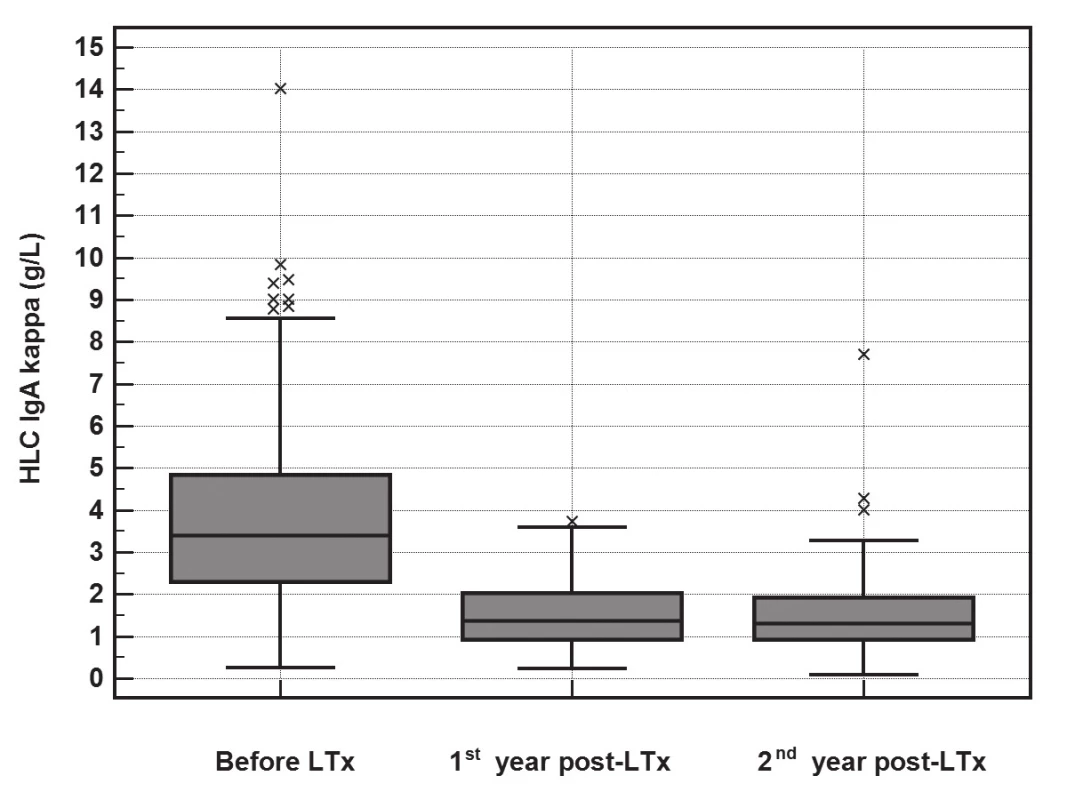
Obr. 2. The significant decrease in HLC IgA-λ (y-axis, g/L) concentrations during the 2-year follow-up after LTx (Friedman test, p<0.001). The median of the rate of HLC IgA-λ decrease was 2.0 g/L (IQR 0.82-2.97) during the first year. 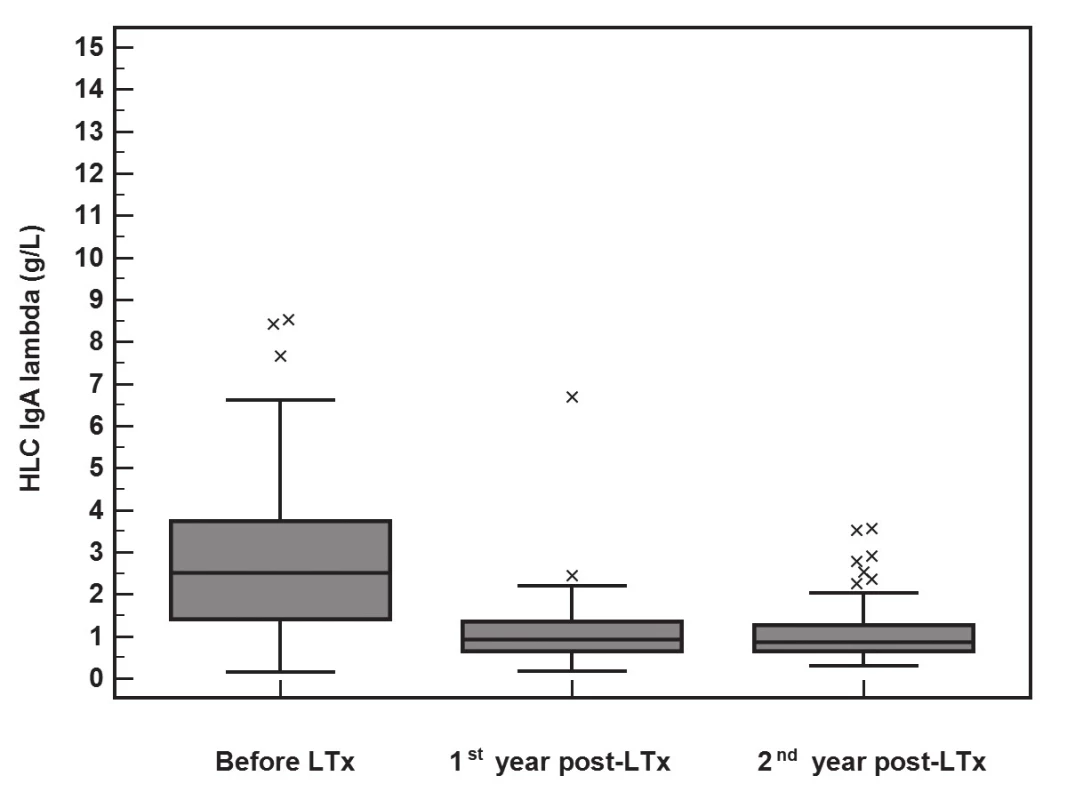
Tabulka 6 ukazuje změny ve sledovaných parametrech za 1, resp. 2 roky po LTx. Výchozí dělení na podskupiny bylo zachováno; to znamená, že pacient klasifikovaný do podskupiny A – D před LTx zůstal v této skupině i v prvním a druhém roce po LTx.
Tab. 6. Medians of selected parameters tested 1 and 2 years after LTx. Comparison of two subgroups with respect to the same criteria as used in the analysis of data before LTx. Asterisk (*) means significant difference between group A and B, or C and D, respectively (Mann-Whitney test). 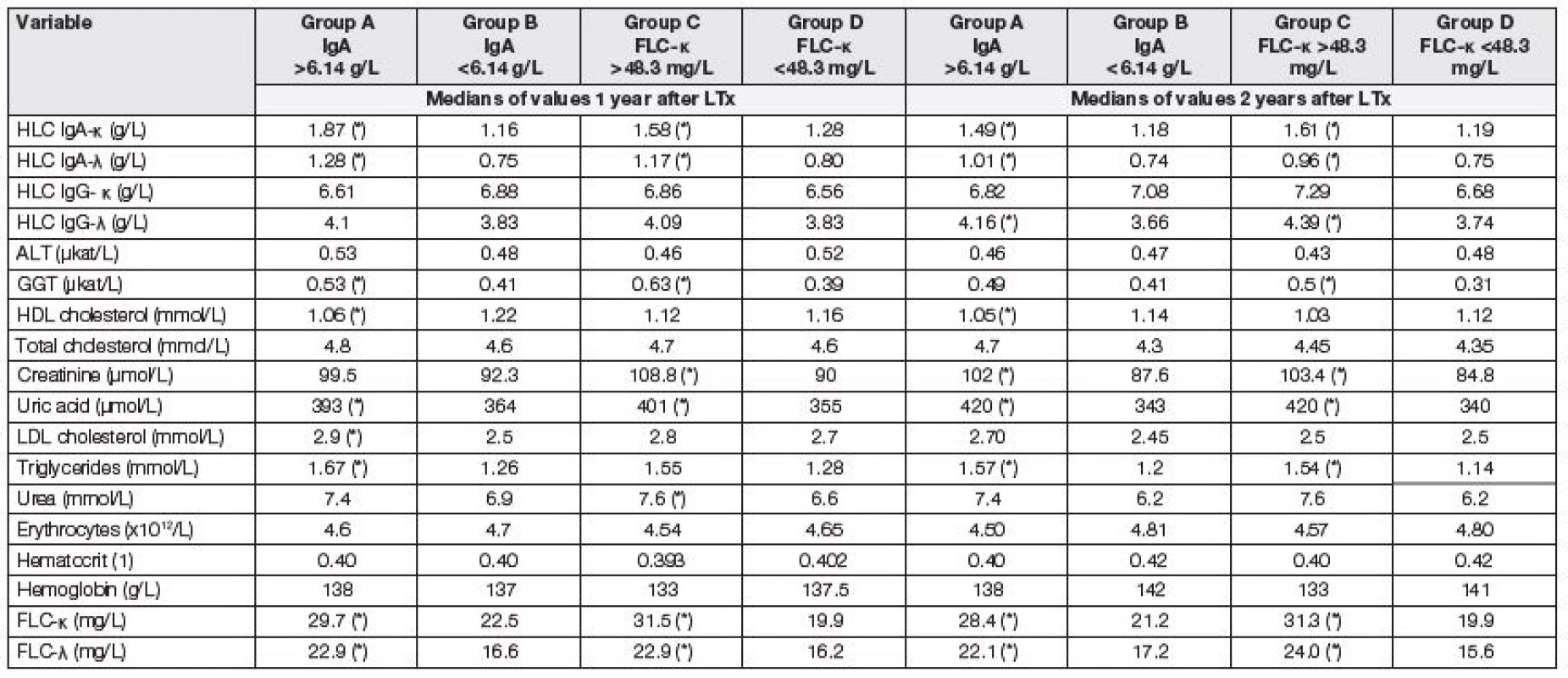
Klasifikace v Tabulkách 2 – 6 byla založena na použití mediánu FLC-κ. Pokud jsme pro hodnocení asociací s parametry orgánových dysfunkcí a komorbidit použili FLC-λ, byly vztahy podobné. Veškeré analýzy jsme rovněž provedli pro pacienty s hodnotami eGFR (CKD-EPI) 1,0 ml/s na 1,73 m2 a vyššími. Asociace zůstaly zachovány i po této úpravě, takže vliv renálních funkcí na výpovědní hodnotu FLC-κ i FLC-λ není podstatný.
Diskuse
V této práci jsme se pokusili objasnit vztah mezi protilátkovou odpovědí a prognózou u pacientů se závažným jaterním onemocněním, které vyžadovalo transplantaci jater. Vztah mezi sérovou koncentrací IgA a prognózou pacientů s chronickým jaterním onemocněním je známý [3-5], méně jasné jsou ale vztahy mezi volnými lehkými řetězci imunoglobulinů (FLC) nebo páry lehkých a těžkých řetězců imunoglobulinů (HLC) a klinickým stavem pacientů. Předtransplantační období je u jaterních onemocnění spojeno s řadou patofyziologických změn, zvýšenou produkcí imunoglobulinů ve třídě IgA a IgG, případně IgM u biliárních cirhóz. Potransplantační období znamená zásah do buňkami zprostředkované i humorální imunity; některé orgánové a systémové dysfunkce se mohou upravovat, jiné se mohou komplikovat například imunosupresivní terapií.
Vyšetřený soubor pacientů vykazoval před transplantací závažnou poruchu syntetické funkce jater (významně zvýšené MELD skóre s nízkou pravděpodobností přežití) i změny ve stupni fibrózy, charakterizované pomocí skóre ELF (Tabulka 1) [6]. Prokázali jsme také časté patologie v koncentracích imunoglobulinů a jejich komponent (Tabulky 1 a 2). Korelační analýza ukázala podobné vztahy mezi MELD nebo ELF skóre a hodnotami IgA a FLC-κ, podstatně slabší byly vztahy mezi oběma skóre a ostatními imunoglobulinovými komponentami, včetně HLC IgA, IgG a IgM. Zvýšená produkce IgA je logicky (patofyziologicky) propojena se zvýšením FLC-κ a FLC-λ. Protože vztah ke komorbiditám byl silnější pro FLC-κ, vybrali jsme tento parametr pro posouzení vazeb na biomarkery orgánových dysfunkcí v porovnání s IgA.
Jak ukazují Tabulky 3 – 5, vztah ke komorbiditám byl v podstatě rovnocenný při klasifikaci pacientů do skupin podle mediánů hodnot IgA nebo FLC-κ. Jak zvýšené IgA, tak zvýšení FLC-κ nad medián souboru je spojeno s poruchou jaterních a renálních funkcí, poruchou nutrice a anémií. Z parametrů jaterní fibrózy je vidět těsný vztah IgA a FLC-κ především k hodnotám kyseliny hyalorunové s výsledným zvýšením ELF skóre u pacientů se zvýšenými hodnotami IgA a FLC-κ (Tabulka 3). Tabulka 4 ukazuje závažnou asociaci mezi IgA nebo FLC-κ a červenou krevní řadou – přibližně každý čtvrtý pacient se zvýšením těchto parametrů má hemoglobin pod 108 g/l a trombocyty pod 80.109/l (pro vyšší IgA), resp. 90.109/l (pro vyšší FLC-κ). Nejvýraznější odchylky před LTx byly zjištěny u cholinesterázy (čtvrtina pacientů se zvýšením IgA nebo FLC-κ má CHS pod 36 µkat/l), současně jsou u těchto pacientů snížené hodnoty albuminu, krevních lipidů, ceruloplasminu a prealbuminu (Tabulka 5). Hodnocení FLC-λ ukázalo podobné asociace s komorbiditami jako FLC-κ.
V našem sledování jsme se vzhledem k celkovému zaměření studie i vzhledem k možnému riziku rozvoje PTLD zaměřili i na hodnocení významu stanovení párů lehkých a těžkých řetězců imunoglobulinů. V případě HLC IgA κ i λ změny koncentrací byly analogické jako změny celkového IgA, významnější asociace mezi HLC IgG nebo HLC IgM a komorbiditami jsme nepozorovali. Doménou stanovení HLC tedy zůstává monitorování pacientů s monoklonálními gamapatiemi, jak je popsáno v literatuře více autory. Katzmann popsal potenciál stanovení HLC IgA u pacientů s monoklonálním proteinem migrujícím v beta-frakci elektroforézy a navrhl možnost nahradit tímto vyšetřením sérovou elektroforézu proteinů, imunofixaci a stanovení koncentrace celkového IgA [7]. Podobně Ludwig popsal zhoršenou prognózu pacientů s IgG myelomem se suprimovaným párem HLC a možnost sledování odpovědi na terapii [8]. Podobně také Chae [9] a Michallet [10] popsali výhody monitorování párů lehkých a těžkých řetězců u pacientů s mnohočetným myelomem typu IgA a IgG. U pacientů s monoklonálním proteinem IgM bylo stanovení HLC IgM κ a λ hodnoceno jako užitečný způsob vyšetřování [11]. Potenciál využití HLC byl dále popsán u různých typů monoklonálních gamapatií, včetně monoklonálních gamapatií IgA a IgG, Waldenströmovy makroglobulinémie, chorob z lehkých řetězců a MGUS [12]. Nízká intraindividuální variabilita imunoglobulinů a jejich komponent (FLC, HLC) monitorování pacientů rozhodně umožňuje [13].
Největší pokles HLC IgA a FLC byl patrný během prvního roku po LTx (obr. 1 a 2). V prvním a druhém roce přetrvávají zvýšené koncentrace HLC IgA-κ, HLC IgA-λ, FLC-κ a FLC-λ u pacientů, kteří měli před LTx vysoké hodnoty těchto parametrů (tabulka 6). Došlo sice k normalizaci ukazatelů červené krevní řady a upravily se nutriční ukazatele, ale změnil se lipidový profil ve smyslu zhoršení u původně rizikových pacientů (se zvýšením IgA nebo FLC-κ před LTx) a přetrvávají horší renální funkce u původně rizikových pacientů. Není tedy zásadně jiná výpověď o orgánových dysfunkcích při rozdělení pacientů podle výchozí koncentrace IgA nebo FLC-κ, ale FLC-κ (i FLC-λ) může být biomarkerem rozvoje PTLD.
Závěry
Před LTx byly častější asociace mezi ukazateli morbidity a zvýšenými hodnotami IgA a FLC-κ: zjistili jsme častější anémie (signifikantně snížený počet erytrocytů, snížený hemoglobin a hematokrit, vše p < 0,0001), vyšší ukazatele fibrotizace jater (vyšší ELF skóre, kyselina hyaluronová, galectin-3, vše p < 0,05), zhoršenou funkci jater (snížené CHS, albumin, ceruloplasmin, vše p < 0,005), zhoršené renální funkce (vyšší kreatinin, urea, kyselina močová, vše p < 0,001) a zhoršené nutriční ukazatele (nižší prealbumin, nižší lipidy, vše p < 0,05). Pokud byly hodnoty FLC-κ zvýšeny před LTx, zůstaly signifikantně vyšší i v 1. a 2. roce po LTx. Zvýšené hodnoty IgA a FLC kappa jsou asociovány s nepříznivým stavem pacienta před transplantací. Zvýšená produkce IgA a FLC-κ, která přetrvává i v dalších letech po LTx, může predikovat zhoršení prognózy pacientů. Potvrdili jsme tedy význam stanovení celkové koncentrace IgA pro posouzení prognózy u pacientů s chronickým jaterním onemocněním, ale podobné výsledky přineslo stanovení FLC-κ a FLC-λ. Výhodou monitorování FLC-κ a λ je možnost detekce případného rozvoje PTLD. V první linii testů u pacientů s LTx je vhodné dále doplnění elektroforézy a případně imunofixace. Stanovení HLC zůstává zatím vyhrazeno pro situace s již prokázanou monoklonální gamapatií s nutností sledovat kvantity jednotlivých klonů.
Práce byla podpořena z grantu MZ ČR číslo AZV MZ 15-27579A.
Autoři děkují za technickou pomoc ing. Štěpánce Strnadové, Mgr. Jiřímu Vymětalíkovi a ing. Vandě Filové, Ph.D.
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 20. 9. 2018
Adresa pro korespondenci:
MUDr. Janka Franeková, Ph.D.
OKB PLM, Institut klinické a experimentální medicíny
Vídeňská 1958/9, 140 21 Praha
e-mail: jafa@ikem.cz
Zdroje
1. Sečník, P. Jr., Lavríková, P., Hošková, L., Malíková, P., Jabor, A., Franeková, J. Free light chain and intact immunoglobulin abnormalities in heart transplant recipients: Two year follow-up timelines and clinical correlations. Transpl Immunol, 2017,41, p. 22-26.
2. Lavríková, P., Sečník, P. Jr., Kubíček, Z., Jabor, A., Hošková, L., Franeková, J. Tacrolimus has immunosuppressive effects on heavy/light chain pairs and freelight chains in patients after heart transplantation: A relationship with infection. Transpl Immunol, 2018, 50, p. 43-47.
3. Inamine, T., Schnabl, B. Immunoglobulin A and liver diseases. J Gastroenterol, 2018, 53, p. 691-700.
4. Hansen, I.S., Hoepel, W., Zaat, S. A. J., Baeten, D. L. P., den Dunnen, J. Serum IgA Immune Complexes Promote Proinflammatory Cytokine Production by Human Macrophages, Monocytes, and Kupffer Cells through FcαRI-TLR Cross-Talk. J Immunol, 2017, 199, p. 4124-4131.
5. Lin, S., Sun, Q., Mao, W., Chen, Y. Serum Immunoglobulin A (IgA) Level Is a Potential Biomarker Indicating Cirrhosis during Chronic Hepatitis B Infection. Gastroenterol Res Pract, 2016, 2016 : 2495073. doi: 10.1155/2016/2495073.
6. Jabor, A., Kubíček, Z., Fraňková, S., Šenkeříková, R., Franeková, J. Enhanced liver fibrosis (ELF) score: Reference ranges, biological variation in healthy subjects, and analytical considerations. Clin Chim Acta, 2018, 483, p. 291-295.
7. Katzmann, J. A., Willrich, M. A., Kohlhagen, M. C., et al. Monitoring IgA multiple myeloma: immunoglobulin heavy/light chain assays. Clin Chem, 2015, 61, p. 360-367.
8. Ludwig, H., Milosavljevic, D., Berlanga, O. et al. Suppression of the noninvolved pair of the myeloma isotype correlates with poor survival in newly diagnosed and relapsed/refractory patients with myeloma. Am J Hematol, 2016, 91, p. 295-301.
9. Chae, H., Han, E., Yoo, J. et al. Heavy/light chain assay as a biomarker for diagnosis and follow-up of multiple myeloma, Clin Chim Acta, 2018, 479, p. 7-13.
10. Michallet, M., Chapuis-Cellier, C., Dejoie, T. et al. Heavy+light chain monitoring correlates with clinical outcome in multiple myeloma patients. Leukemia, 2018;32 : 376-382.
11. Sarto, C., Cappellini, F., Giagnacovo, M., Brambilla P. IgMκ-IgMλ pair quantitation in the clinical laboratory practice. Clin Biochem, 2018, 51, p. 56-60.
12. Greil, C., Ihorst, G., Gaiser, F. et al. The serum heavy/light chain immunoassay: A valuable tool for sensitive paraprotein assessment, risk, and disease monitoring in monoclonal gammopathies. Eur J Haematol, 2017, 99, p. 449-458.
13. Jabor, A., Kubíček, Z., Komrsková, J. et al. Within-subject biological variation of pairs of heavy/light immunoglobulin IgM chains (HLC IgM κ and λ) is low and requires monitoring: A comparison with HLC IgA, HLC IgG, and free light immunoglobulin chains (FLC) in healthy subjects. Clin Chim Acta, 2018, 486, p. 311-312.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek Rejstřík autorů
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2018 Číslo 4- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
-
Všechny články tohoto čísla
- Listopadový hurikán (To be up to date)
- Biologické účinky oxidu uhelnatého
- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Volné lehké řetězce a páry těžkých a lehkých řetězců imunoglobulinů ve vztahu k morbiditě pacientů před transplantací jater a v potransplantačním období
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Ověření referenčního rozmezí volného trijodtyroninu v séru na analyzátoru Architect ci 16200
- Urolitiáza - efekt terapie indapamidem – kazuistika
- Realimentační syndrom po paleodietě
- Rejstřík autorů
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hyponatrémie – frekvence, příčiny, patobiochemie, klinika a terapie
- Hemolytický index jako nástroj ke stanovení volného hemoglobinu v plazmě
- Realimentační syndrom po paleodietě
- Urolitiáza - efekt terapie indapamidem – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



