-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSoučasné možnosti farmakoterapie dětské obezity
Current pharmacotherapy options in pediatric obesity
Obesity is a serious chronic condition that requires a comprehensive multidisciplinary approach. The main components of obesity treatment are education towards healthy eating habits, increased physical activity, decreased sedentarism and regular sleep pattern. Excess body weight is often associated with psychopathological behavior. Children often present with sadness, depression, low self-esteem, and therefore the role of psychotherapy or cognitive behavioral therapy is highly important in the complex approach to the treatment of childhood obesity. In recent years, the use of pharmacotherapy, both targeted for the treatment of certain genetic disorders and for the treatment of polygenic obesity, has significantly expanded. Three drugs are currently approved for use in children. These are metreleptin for genetically confirmed leptin deficiency, and setmelanotide, which is used in individuals with pathogenic variants of genes encoding leptin receptor, proopiomelanocortin or proprotein convertase genes, and in patients with Bardet-Biedl syndrome. Other types of obesity may benefit from treatment with liraglutide, which is a glucagon-like peptide 1 analogue. Obesity research is ongoing, and new molecules and their combinations that may be complementary in a comprehensive approach to obesity treatment can be expected.
Keywords:
obesity – leptin – liraglutide – pharmacotherapy – glucagon-like peptide 1 – metreleptin – setmelanotide
Autoři: Malíková Křenek Jana 1; Hainerová Aldhoon Irena 2,3; Lebl Jan 1
Působiště autorů: Pediatrická klinika, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha 1; Klinika dětí a dorostu, 3. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 2; Pediatrická klinika, 1. lékařská fakulta Univerzity Karlovy a Fakultní Thomayerovy nemocnice, Praha 3
Vyšlo v časopise: Čes-slov Pediat 2023; 78 (2): 122-126.
Kategorie: Epidemie dětské obezity
doi: https://doi.org/10.55095/CSPediatrie2023/017Souhrn
Obezita je závažné chronické onemocnění, jehož léčba vyžaduje komplexní přístup. Základními pilíři léčby obezity jsou zdravé jídelní zvyklosti a návyky, dostatek pohybové aktivity a pravidelného spánku. Nadměrná tělesná hmotnost je často spojena s psychopatologickým chováním. Děti vykazují smutek, depresi, nízký stupeň sebehodnocení, a proto role psychoterapie či kognitivně-behaviorální terapie je v přístupu k obéznímu jedinci velmi důležitá. V posledních letech se významně rozšiřují možnosti využití farmakoterapie, a to jak cílené u léčby některých genetických poruch, tak i pro léčbu polygenně podmíněné obezity. V současnosti jsou pro použití u dětí schváleny tři léky – metreleptin, setmelanotid a liraglutid. Metreleptin je určen pro léčbu geneticky potvrzeného deficitu leptinu. Setmelanotid je indikován při patogenních variantách genů pro leptinový receptor, proopiomelanokortin či proprotein - -konvertázu a u pacientů s Bardetovým–Biedlovým syndromem. U jiných typů obezity lze využít léčbu liraglutidem, jenž je analogem glukagon-like peptidu 1. Výzkum stále pokračuje a další nové molekuly a jejich kombinace, které mohou být doplňkem v komplexním přístupu v léčbě obezity, lze očekávat.
Klíčová slova:
obezita – leptin – liraglutid – farmakoterapie – glukagon-like peptid 1 – metreleptin – setmelanotid
Úvod
Obezita je podle Světové zdravotnické organizace (WHO) nemocí, která je charakterizována nadměrnou akumulací tělesného tuku a která vede ke značným zdravotním komplikacím. Je důsledkem vzájemného působení genetických či epigenetických faktorů a vlivů prostředí. Celosvětově stoupající prevalence obezity u dětí i dospělých značně finančně zatěžuje zdravotní systémy.(1) Léčba nadměrné tělesné hmotnosti je založena na režimových opatřeních, která se zaměřují na stravování, pohybovou aktivitu a úpravy denního režimu. Pacienti s obezitou vyžadují komplexní přístup multidisciplinárního týmu, což je časově náročné a u některých pacientů, zejména v období dospívání, je spojeno s větší mírou nespolupráce. Studie van de Pas se spolupracovníky ukázala, že režimová opatření v průběhu jednoho roku byla úspěšná pouze u 15 % adolescentů ve věku 12–18 let, oproti téměř 32 % dětí ve věku od 2 do 11 let.(2) Pokud konvenční terapie nevede ke zlepšení stavu či dochází ke stagnaci váhového úbytku, lze vedle pokračujících režimových opatření uvažovat o využití farmakoterapie. Výzkum v posledních letech jasně prokázal účinnost několika antiobezitik nejen u dospělých, ale i u dospívajících. Aktuálně probíhají klinické studie dalších slibných molekul, které v některých případech vedou ke snížení tělesné hmotnosti srovnatelnému s bariatrickými výkony. Nedílnou součástí péče o pacienty s obezitou je i léčba jejích komplikací.
Současné možnosti farmakoterapie u dětí
U pacientů s vrozeným deficitem leptinu na podkladě patogenní varianty genu pro leptin a u případů vrozených či získaných lipodystrofií je účinný rekombinantní analog lidského leptinu – metreleptin. U monogenních forem obezity, které jsou způsobeny patogenními variantami genů pro leptinový receptor (LEPR), proopiomelanokortin (POMC) nebo proprotein-konvertázu (PCSK1), a u jedinců s Bardetovým – Biedlovým syndromem je od roku 2020 k dispozici léčba agonistou melanokortinového receptoru 4. typu setmelanotidem. V roce 2021 byl Evropskou lékovou agenturou (EMA, European Medicines Agency) k léčbě obezity u adolescentů starších 12 let schválen liraglutid – analog glukagon-like peptidu 1 (GLP-1 analog), který se u dospělých používá již od roku 2009. Liraglutid lze také použít k léčbě dětí ve věku od 10 let s nedostatečně kontrolovaným diabetes mellitus 2. typu jako doplněk k režimovým opatřením.(3) Výhledy do budoucna vypadají optimisticky – očekáváme schválení dalšího GLP-1 analoga, semaglutidu, pro obézní dospívající a dalších léčebných přípravků.
Metreleptin
Leptin je hormon produkovaný tukovou tkání. Jeho hlavní funkcí je regulace tělesné hmotnosti přímým působením na centrální nervový systém.(4) Hraje významnou roli v glukózovém a lipidovém metabolismu, ovlivňuje hypotalamo - hypofyzární osu včetně indukce puberty, ovlivňuje zánětlivou reakci a imunitní odpověď.(5) Podílí se také na remodelaci tkání, zejména centrálního nervového systému.(6) Metreleptin, který se dodává pod komerčním názvem Myalepta, je rekombinantní analog lidského leptinu složený ze 146 aminokyselin leptinu a s připojeným terminálním methioninem. Metreleptin se váže na leptinový receptor, který tím aktivuje.
V regulaci tělesné hmotnosti a výdeje energie přináší leptin signály o obsahu tuku v adipocytech do nucleus arcuatus v hypotalamu. Tam dochází k interakci s dalšími periferními signály – zejména s ghrelinem a inzulinem. Periferní signály aktivují anorexigenní neurony a pomocí proprotein-konvertázy dochází ke štěpení proopiomelanokortinu na melanokortiny, které se váží na melanokortinové receptory 4. typu (MC4R) a 3. typu (MC3R) v nuclei paraventriculares a intermediolaterales (obr. 1).(4) Aktivace MC4R sníží příjem energie a zvýší výdej energie. Následně se tedy obnoví rovnováha mezi obsahem tuku v adipocytech a pocitem hladu. V případě deficitu endogenního leptinu tuto signalizaci může zprostředkovat léčebně podávaný metreleptin.
Obr. 1. Regulace jídelního chování a cesty působení jednotlivých léků a lékových skupin – metreleptinu, setmelanotidu a analogů GLP-1 (liraglutid a semaglutid) 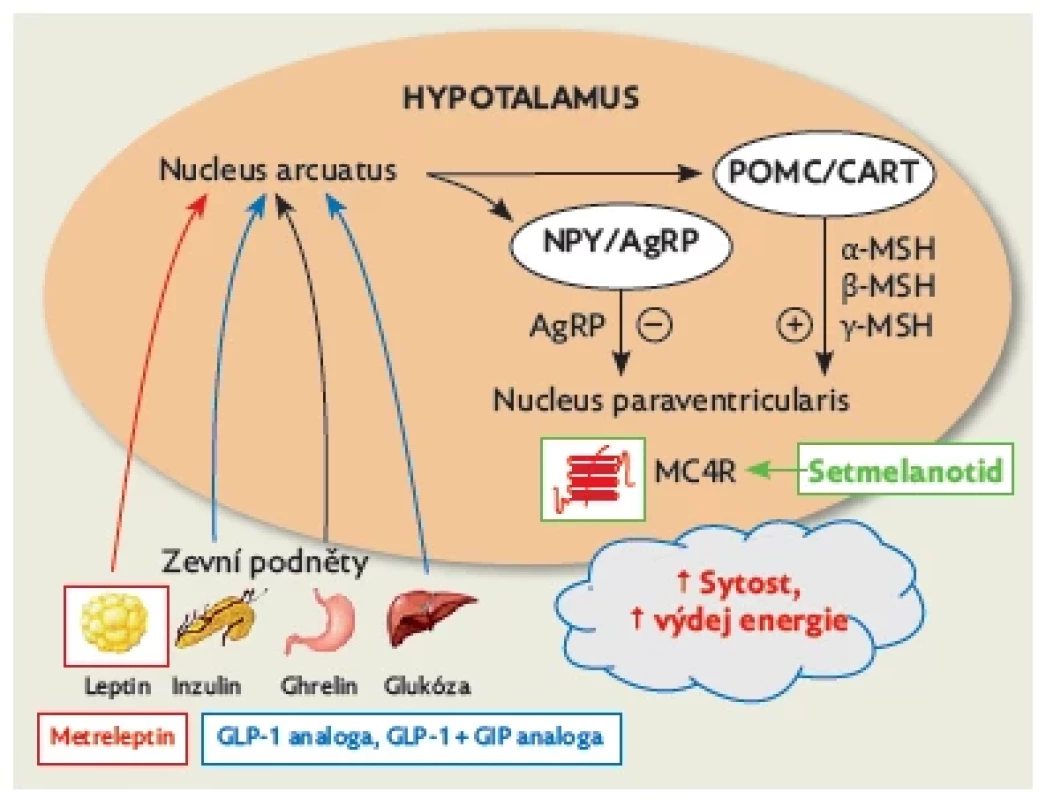
Metreleptin je jedinou možnou léčbou u pacientů s velmi těžkou obezitou v důsledku vrozeného deficitu leptinu při mutaci genu pro leptin. Podávání metreleptinu u těchto pacientů vede k velmi rychlé redukci tělesné hmotnosti, k normalizaci indexu tělesné hmotnosti (BMI, body mass index) a ke zlepšení metabolického profilu – snížení koncentrace triglyceridů a jaterních enzymů, zvýšení koncentrace HDL-cholesterolu, snížení inzulinové rezistence se zvýšením inzulinové senzitivity.(7–9) Poměrně nedávno byl metreleptin schválen k léčbě vrozené generalizované lipodystrofie u osob od věku 2 let a dědičné či získané částečné lipodystrofie u osob starších 12 let.(10) Ve studiích byl prokázán pozitivní efekt podávání metreleptinu u žen s anorexií a hypotalamickou amenoreou,(11,12) avšak jeho podávání v těchto indikacích zatím není schváleno. U běžné obezity není metreleptin účinný, a to v důsledku obezitou navozené endogenní hyperleptinemie a leptinové rezistence.(13)
U lipodystrofie se metreleptin podává injekčně do podkoží jednou denně. U vrozeného deficitu leptinu se vzhledem ke krátkému biologickému poločasu dává přednost rozdělení do dvou dávek za den. Dávku metreleptinu je nutné v začátcích podávání postupně titrovat podle pohlaví a tělesné hmotnosti. Mezi nejčastější nežádoucí účinky patří bolesti hlavy, hypoglykemie, a to zejména při současném užívání inzulinu, rychlé snížení tělesné hmotnosti, bolesti břicha, hypersenzitivní reakce a ojediněle i výskyt neutralizačních protilátek proti metreleptinu.(8,9)
Setmelanotid
MC4R v nucleus paraventricularis je aktivován melanokortiny a navozuje pocit sytosti, snižuje pocit hladu a navyšuje výdej energie (viz obr. 1).(4) Setmelanotid je cyklický oktapeptid, který je agonistou MC4R a částečně také stimuluje MC3R a melanokortinový receptor 1. typu (MC1R).(14) V současnosti je setmelanotid pod názvem Imcivree schválen pro léčbu dospělých a dětí starších 6 let s patogenními variantami genů POMC, PCSK1, LEPR a pro pacienty s Bardetovým – Biedlovým syndromem. Podle studie Clément et al., které se zúčastnilo 10 pacientů s defektem POMC či PCSK1, došlo během jednoho roku podávání setmelanotidu k redukci tělesné hmotnosti v průměru o 25,6 %. V obdobné studii s ročním podáváním setmelanotidu u pacientů s prokázaným defektem LEPR bylo dosaženo průměrného úbytku tělesné hmotnosti o 12,5 %. Po vysazení setmelanotidu se tělesná hmotnost opět zvyšuje.(15)
V září 2022 schválila EMA setmelanotid nově i k léčbě obezity u pacientů s Bardetovým–Biedlovým syndromem. Ve studii došlo při podávání setmelanotidu k významnému poklesu BMI oproti kontrolní skupině a snížil se pocit hladu.(16) U pacientů s Alströmovým syndromem nebyla účinnost léčby setmelanotidem prokázána.(16) V současné době se zkoumá účinek setmelanotidu u dalších geneticky podmíněných forem obezity – u chromozomálního defektu v oblasti 16p11.2, u patogenních variant genů SH2B1 (SH2B adaptor protein 1), CPE (karboxypeptidáza E) nebo SRC1 (steroid receptor koaktivátor 1) a u pacientů s deficitem leptinu, u kterých léčba metreleptinem nevedla ke zlepšení.(17) V rámci klinické studie se testuje setmelanotid také u pacientů po kraniotraumatech či po operacích mozku s rozvojem hypotalamické obezity, u kterých je zachován MC4R.
Biologický poločas setmelanotidu je 11 hodin a podává se ráno subkutánně, aby se zamezilo patologickému pocitu hladu. U dětí starších 12 let a u dospělých s prokázaným defektem POMC, PCSK1 a LEPR se setmelanotid podává v počáteční dávce 1 mg denně. Dávka se postupně navyšuje v dvoutýdenních intervalech do maximální dávky 3 mg denně. U dětí ve věku 6–12 let je úvodní dávka 0,5 mg a v dvoutýdenních intervalech se postupně navyšuje do maximální dávky 2,5 mg denně. U pacientů s Bardetovým–Biedlovým syndromem jsou počáteční dávky vyšší s maximální dávkou 3 mg u všech pacientů starších 6 let věku.
Jedinou kontraindikací podávání setmelanotidu je hypersenzitivita na účinnou látku nebo na kteroukoliv pomocnou látku přípravku. Mezi nejčastější nežádoucí účinky patří tmavnutí pokožky či vlasů způsobené stimulací MC1R, které se objevuje přibližně 2–3 týdny po zahájení léčby a mizí po jejím ukončení. Přestože během observační studie v délce 46 měsíců nebyl pozorován vývoj melanomu, je vhodné pravidelné sledování pigmentací k eventuálnímu včasnému odhalení malignizace.(18,19) Dalšími nežádoucími účinky jsou reakce v místě vpichu ve formě erytému, pruritu či indurace, dále pak nauzea, bolesti hlavy a erekce.(15,16) Nebyly zaznamenány interakce s jinými léky.
Liraglutid a další analoga
GLP-1 Analoga GLP-1 jsou odvozena od inkretinového hormonu GLP-1 (glukagon-like peptidu 1), který produkují hlavně L buňky v distální části tenkého střeva v reakci na průchod potravy.(20) Posttranslační úpravou preproglukagonu vzniká glukagon, GLP-1 a inzulinotropní peptid závislý na glukóze neboli gastrický inhibiční polypeptid (GIP).(21) GLP-1 působí prostřednictvím svého receptoru (GLP-1 receptor), který se exprimuje v pankreatu, centrálním nervovém systému, gastrointestinálním traktu, cévní stěně, srdci, ledvinách a plicích.( 22,23) V pankreatu ovlivňuje GLP-1 sekreci inzulinu v závislosti na aktuální glykemii a snižuje výdej glukagonu.(24,25) GLP-1 napomáhá také k ochraně samotných β buněk pankreatu, a to díky inhibici apoptózy a stimulaci neogeneze.(26,27) Mimo účinky v oblasti pankreatu zpomaluje GLP-1 motilitu gastrointestinálního traktu, zejména vyprazdňování žaludku,( 28) a v regulačních centrech hypotalamu přispívá k vyvolání pocitu sytosti.(29,30) GLP-1 a jeho analoga mají také kardioprotektivní účinky.(31) Biologický poločas endogenního GLP-1 je velmi krátký – přibližně 2 minuty. Je inaktivován enzymem dipeptidylpeptidázou 4.(32) Analog GLP-1 liraglutid má strukturu z 97 % shodnou s endogenním GLP-1 (obr. 2). Navázáním palmitoylu je jeho molekula chráněna před rychlým štěpením dipeptidylpeptidázou 4, což prodlužuje jeho biologický poločas na 13 hodin.(33)
Obr. 2. Porovnání molekulové struktury a biologického poločasu přirozeného GLP-1 a jeho analogu liraglutidu. Díky záměně jedné aminokyseliny a ukotvení palmitoylu má liraglutid větší odolnost vůči štěpení dipeptidylpeptidázou 4 a také se lépe váže na albumin. Tyto změny vedou k prodloužení biologického poločasu na 13 hodin. Upraveno dle(33) 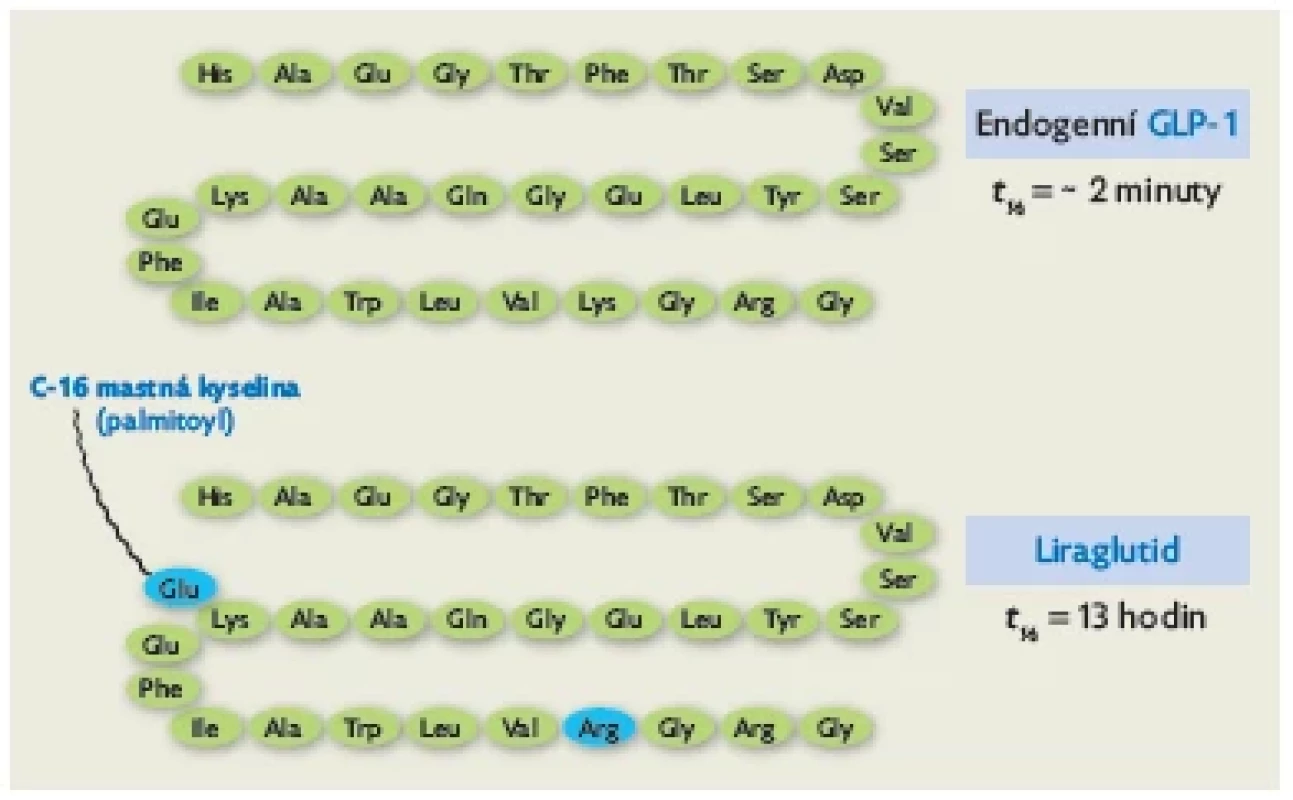
Liraglutid byl jako antidiabetikum pod názvem Victoza schválen EMA již v roce 2009. Victozu lze použít u dětí ve věku od 10 let s nedostatečně kontrolovaným diabetes mellitus 2. typu jako doplněk k režimovým opatřením. K léčbě obezity byl pod názvem Saxenda schválen EMA v roce 2015 pro dospělé pacienty a v roce 2021 pro děti starší než 12 let. Dle randomizované dvojitě zaslepené studie došlo u dětí ve věku 12–17 let během 56 týdnů sledování ke snížení BMI o 4,6 %. Efekt léčby byl významný oproti léčbě placebem.(34) Indikačním kritériem pro léčbu obezity u dětí liraglutidem je BMI vyšší než ekvivalent 30 kg/m2 podle mezinárodních hraničních hodnot (International Obesity Task Force – IOTF) pro obezitu dle pohlaví ve věku 12–18 let. Příbalová informace a souhrn údajů o přípravku tyto ekvivalentní hodnoty pro věk a pohlaví obsahují.
Liraglutid se podává jednou denně subkutánní cestou pomocí předplněného pera. Dávka liraglutidu se titruje v týdenních intervalech od nejnižší dávky 0,6 mg až po maximální dávku 3 mg. Dle klinického efektu a případných nežádoucích účinků nemusí být dosaženo maximální dávky a je možné dlouhodobě podávat i dávky nižší. Pokud nedojde během 12 týdnů od podávání maximální dávky k poklesu BMI nebo BMI z-skóre alespoň o 4 %, měl by být přípravek vysazen. Nežádoucí účinky se mohou objevit během prvních týdnů léčby a zahrnují nauzeu, bolesti břicha, průjem či zácpu a bolesti hlavy. Tyto nežádoucí účinky během několika týdnů postupně vymizí nebo jsou zcela minimální. Pokud se liraglutid užívá jako antidiabetikum v kombinaci s inzulinem či preparáty sulfonylurey, může dojít k vyššímu výskytu hypoglykemických epizod. Proto je důležité dávky inzulinu či preparátu sulfonylurey upravit. Výskyt hypoglykemií u dětí léčených jen pro obezitu byl mírně vyšší v porovnání se skupinou léčenou placebem, nejednalo se ale nikdy o těžké hypoglykemie.(34) Ojediněle byly zaznamenány epizody akutní pankreatitidy či cholecystitidy. Mezi kontraindikace podání liraglutidu patří alergická reakce na přípravek. Dále je nutná opatrnost u pacientů s medulárním karcinomem štítné žlázy či MEN 2 syndromem v osobní či rodinné anamnéze.(35) V současnosti liraglutid pod komerčním názvem Saxenda nemá v České republice preskripční omezení a není hrazen z veřejného zdravotního pojištění. V blízké budoucnosti lze očekávat možnost podávání liraglutidu i u dětí ve věku 6–11 let, u nichž v současné době probíhají klinické studie.
Dalším z léků ze skupiny analog GLP-1 je semaglutid, který se v současnosti používá jako antidiabetikum pod názvem Ozempic. Pro léčbu obezity u dospělých je již schválen pod názvem Wegovy. V klinické studii vedlo jeho podávání k poklesu BMI o téměř 15 %.(36) Ve věkové skupině 12–17 let již proběhla studie bezpečnosti a účinnosti – semaglutid vedl k poklesu hmotnosti o 16,7 % BMI.(37) Výhodou semaglutidu je podávání jednou týdně. Nežádoucí účinky jsou obdobné jako u liraglutidu.
Vývoj nových antiobezitik
Poznání fyziologických mechanismů regulace jídelního chování vedlo k úspěšnému vývoji antiobezitik inkretinového typu, která přinesla revoluci v léčbě obezity. Výzkum nových molekul a jejich kombinací v léčbě obezity pokračuje, lze očekávat další terapeutické možnosti.(38) Nový lék tirzepatid, který byl schválen (EMA, listopad 2022) pod komerčním názvem Mounjaro k léčbě diabetes mellitus 2. typu, je spojen s redukcí tělesné hmotnosti až o 20 %. Tirzepatid je peptid s 39 aminokyselinami, který současně stimuluje receptor pro GLP-1 a GIP. GIP je inkretin produkovaný v proximální části tenkého střeva K buňkami a podobně jako GLP-1 stimuluje sekreci inzulinu v závislosti na glykemii, a to prostřednictvím receptoru na β buňkách pankreatu. Receptory GIP najdeme i na α buňkách pankreatu a jejich aktivací dochází k zvýšené sekreci glukagonu. Současně se receptory GIP nacházejí i v tukové tkáni, v hypotalamu či v kostní tkáni. Kombinací účinku GLP-1 a GIP vede tirzepatid ke snížení chuti k jídlu, ke zpomalení motility gastrointestinálního traktu, ke zvýšení sekrece inzulinu, ke zvýšení lipolýzy v tukové tkáni, ke snížení kostní resorpce a má také kardioprotektivní účinky.(38,39) Tirzepatid má dlouhý biologický poločas, proto je možné jej podávat jednou týdně subkutánně. Má velmi dobrou snášenlivost s minimem nežádoucích účinků.
Dalšími nadějnými preparáty, jejichž účinek se nyní zkoumá v klinických studiích, jsou kombinace GLP-1 a glukagonu, GLP-1, GIP a glukagonu, analogu GLP-1 s leptinem nebo setmelanotidem a leptinu s amylinem.(39)
Závěr
Poznatky v oblasti monogenních forem obezity a genové regulace jídelního chování přispěly k vývoji velmi účinných léků na jednotlivé formy monogenně podmíněné obezity – metreleptinu a setmelanotidu. Nadějí pro pacienty s polygenním typem obezity bylo objasnění fyziologických mechanismů regulace jídelního chování a vývoj inkretinových analog. Po mnoha zklamáních jsme nyní svědky revoluce vývoje antiobezitik a rostoucí naděje v možnosti léčby. Právem očekáváme, že budeme svědky uplatnění dalších zajímavých molekul a jejich kombinací při snižování tělesné hmotnosti.
Na druhou stranu, farmakoterapii obezity zejména v pediatrii vnímáme jako doplňkovou léčbu k probíhající edukaci a podpoře zdravého životního stylu, a to jak na individuální, tak i celospolečenské úrovni.
Korespondenční adresa:
MUDr. Jana Křenek Malíková, Ph.D.
Pediatrická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
jana.malikova@lfmotol.cuni.czCes-slov Pediat 2023; 78(2): 122–126
Zdroje
1. Wijga AH, Mohnen SM, Vonk JM, Uiters E. Healthcare utilisation and expenditure of overweight and non-overweight children. J Epidemiol Community Health 2018; 72(10): 940–943.
2. van de Pas KGH, Lubrecht JW, Hesselink ML, et al. The effect of a multidisciplinary lifestyle intervention on health parameters in children versus adolescents with severe obesity. Nutrients 2022; 14(9): 1795.
3. Tamborlane WV, Barrientos-Pérez M, Fainberg U, et al.; Ellipse Trial Investigators. Liraglutide in children and adolescents with type 2 diabetes. N Engl J Med 2019; 381(7): 637–646.
4. Lebl J, Křenek Malíkova J, Aldhoon Hainerová I. Regulace energetické rovnováhy a jídelního chování. Ces-slov Pediat 2023; 78(1): 48–53.
5. Paz-Filho G, Mastronardi CA, Licinio J. Leptin treatment: facts and expectations. Metabolism. 2015; 64(1): 146–56.
6. Matochik JA, London ED, Yildiz BO, et al. Effect of leptin replacement on brain structure in genetically leptin-deficient adults. J Clin Endocrinol Metab. 2005; 90(5): 2851–4.
7. Farooqi IS, Jebb SA, Langmack G, et al. Effects of recombinant leptin therapy in a child with congenital leptin deficiency. N Engl J Med 1999; 341(12): 879–84.
8. Farooqi IS, Matarese G, Lord GM, et al. Beneficial effects of leptin on obesity, T cell hyporesponsiveness, and neuroendocrine/metabolic dysfunction of human congenital leptin deficiency. J Clin Invest 2002; 110(8): 1093 – 103.
9. E ihara K, Kusakabe T, Hirata M, et al. Efficacy and safety of leptin-replacement therapy and possible mechanisms of leptin actions in patients with generalized lipodystrophy. J Clin Endocrinol Metab 2007; 92(2): 532–41.
10. Meehan CA, Cochran E, Kassai A, et al. Metreleptin for injection to treat the complications of leptin deficiency in patients with congenital or acquired generalized lipodystrophy. Expert Rev Clin Pharmacol 2016; 9(1): 59 – 68.
11. Welt CK, Chan JL, Bullen J, et al. Recombinant human leptin in women with hypothalamic amenorrhea. N Engl J Med 2004; 351(10): 987–97.
12. Chou SH, Chamberland JP, Liu X, et al. Leptin is an effective treatment for hypothalamic amenorrhea. Proc Natl Acad Sci U S A 2011; 108(16): 6585 – 90.
13. Zelissen PM, Stenlof K, Lean ME, et al.; Author Group. Effect of three treatment schedules of recombinant methionyl human leptin on body weight in obese adults: a randomized, placebo-controlled trial. Diabetes Obes Metab 2005; 7(6): 755–61.
14. Collet TH, Dubern B, Mokrosinski J, et al. Evaluation of a melanocortin-4 receptor (MC4R) agonist (Setmelanotide) in MC4R deficiency. Mol Metab 2017; 6(10): 1321–1329.
15. Clément K, van den Akker E, Argente J, et al.; Setmelanotide POMC and LEPR Phase 3 Trial Investigators. Efficacy and safety of setmelanotide, an MC4R agonist, in individuals with severe obesity due to LEPR or POMC deficiency: single-arm, open-label, multicentre, phase 3 trials. Lancet Diabetes Endocrinol. 2020; 8(12): 960–970.
16. Haqq AM, Chung WK, Dollfus H, et al. Efficacy and safety of setmelanotide, a melanocortin-4 receptor agonist, in patients with Bardet-Biedl syndrome and Alström syndrome: a multicentre, randomised, double-blind, placebo - -controlled, phase 3 trial with an open-label period. Lancet Diabetes Endocrinol 2022; 10(12): 859–868.
17. Hinney A, Körner A, Fischer-Posovszky P. The promise of new anti-obesity therapies arising from knowledge of genetic obesity traits. Nat Rev Endocrinol 2022; 18(10): 623–637.
18. Kanti V, Puder L, Jahnke I, et al. A melanocortin-4 receptor agonist induces skin and hair pigmentation in patients with monogenic mutations in the leptin - melanocortin pathway. Skin Pharmacol Physiol 2021; 34(6): 307–316.
19. Tagliabue E, Gandini S, Bellocco R, et al. MC1R variants as melanoma risk factors independent of at-risk phenotypic characteristics: a pooled analysis from the M-SKIP project. Cancer Manag Res 2018; 10 : 1143–1154.
20. Orskov C, Wettergren A, Holst JJ. Secretion of the incretin hormones glucagon - like peptide-1 and gastric inhibitory polypeptide correlates with insulin secretion in normal man throughout the day. Scand J Gastroenterol 1996; 31(7): 665–70.
21. Mojsov S, Heinrich G, Wilson IB, et al. Preproglucagon gene expression in pancreas and intestine diversifies at the level of post-translational processing. J Biol Chem 1986; 261(25): 11880–9.
22. Körner M, Stöckli M, Waser B, Reubi JC. GLP-1 receptor expression in human tumors and human normal tissues: potential for in vivo targeting. J Nucl Med. 2007; 48(5): 736–43.
23. Baggio LL, Yusta B, Mulvihill EE, et al. GLP-1 Receptor Expression Within the Human Heart. Endocrinology. 2018; 159(4): 1570–1584.
24. Drucker DJ, Philippe J, Mojsov S, et al. Glucagon-like peptide I stimulates insulin gene expression and increases cyclic AMP levels in a rat islet cell line. Proc Natl Acad Sci U S A 1987; 84(10): 3434–8.
25. Kreymann B, Williams G, Ghatei MA, Bloom SR. Glucagon-like peptide-1 7-36: a physiological incretin in man. Lancet 1987; 330 : 1300–1304.
26. Cornu M, Thorens B. GLP-1 protects beta-cells against apoptosis by enhancing the activity of an IGF-2/IGF1-receptor autocrine loop. Islets 2009; 1 : 280–282.
27. Perfetti R, Hui H. The role of GLP-1 in the life and death of pancreatic beta cells. Horm Metab Res 2004; 36(11–12): 804–10.
28. Nauck MA, Niedereichholz U, Ettler R, et al. Glucagon-like peptide 1 inhibition of gastric emptying outweighs its insulinotropic effects in healthy humans. Am J Physiol 1997; 273(5): E981–8.
29. Turton MD, O’Shea D, Gunn I, et al. A role for glucagon-like peptide-1 in the central regulation of feeding. Nature 1996; 379(6560): 69–72.
30. Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest 1998; 101(3): 515–20.
31. Marso SP, Daniels GH, Brown-Frandsen K, et al.; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375(4): 311–22.
32. Mentlein R, Gallwitz B, Schmidt WE. Dipeptidyl-peptidase IV hydrolyses gastric inhibitory polypeptide, glucagon-like peptide-1(7-36)amide, peptide histidine methionine and is responsible for their degradation in human serum. Eur J Biochem 1993; 214(3): 829–35.
33. Knudsen LB, Nielsen PF, Huusfeldt PO, et al. Potent derivatives of glucagon - like peptide-1 with pharmacokinetic properties suitable for once daily administration. J Med Chem 2000; 43(9): 1664–9.
34. Kelly AS, Auerbach P, Barrientos-Perez M, et al.; NN8022-4180 Trial Investigators. A randomized, controlled trial of liraglutide for adolescents with obesity. N Engl J Med 2020; 382(22): 2117–2128.
35. Hu W, Song R, Cheng R, et al. Use of GLP-1 receptor agonists and occurrence of thyroid disorders: a meta-analysis of randomized controlled trials. Front Endocrinol (Lausanne) 2022; 13 : 927859.
36. Wilding JPH, Batterham RL, Calanna S, et al.; STEP 1 Study Group. Once - -weekly semaglutide in adults with overweight or obesity. N Engl J Med 2021; 384(11): 989–1002.
37. Weghuber D, Barrett T, Barrientos-Pérez M, et al.; STEP TEENS Investigators. Once-weekly semaglutide in adolescents with obesity. N Engl J Med 2022; 387(24): 2245–2257.
38. M üller TD, Blüher M, Tschöp MH, DiMarchi RD. Anti-obesity drug discovery: advances and challenges. Nat Rev Drug Discov 2022; 21(3): 201–223.
39. Hainer V, Kunešová M, Taxová Braunerova R, Aldhoon Hainerová I. Duální agonista inkretinových receptorů tirzepatid: Nové antidiabetikum je nadějnou perspektivou v léčbě obezity. DMEV 2022; 25(4): 136–140.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2023 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- Těžké kombinované imunodeficience
- Myokarditidy a kardiomyopatie
- Současné možnosti farmakoterapie dětské obezity
- Pediatrička Lenka Ťoukálková: Jsem týmová hráčka
- doc. MUDr. Michal Hladík, PhD., slávi 70 rokov
- Spomienka na veľkého pediatra – profesora Birčáka
- Pediatrická poezie
- Josef Čapek: Česající se
- Co jsme psali
- Wilhelm Conrad Röntgen (1845–1923): Sto let poté
- Hybridní zobrazení PET/MRI u pediatrických pacientů
- Moderné anatomické zobrazovanie v pediatrickej kardiológii pomocou CT angiokardiografie a 3D virtuálnych modelov srdca
- Příprava dítěte před vyšetřením magnetickou rezonancí
- Fetální magnetická rezonance – stručný přehled současného zobrazení a indikací
- Prenatální diagnostika ovariálních cyst, management a výsledky těhotenství
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Myokarditidy a kardiomyopatie
- Prenatální diagnostika ovariálních cyst, management a výsledky těhotenství
- Příprava dítěte před vyšetřením magnetickou rezonancí
- Současné možnosti farmakoterapie dětské obezity
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



