-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vakcíny z pohledu farmaceuta
Vaccines from the perspective of a pharmacist
The field of development, production and safety of vaccines has recently come under the public eye. The aim of this review article is not to provide comprehensive information on the development and production of vaccines, which would not be possible even in a limited space. Its purpose is to outline a brief overview of the principles, development, and production of basic types of vaccines and point out the benefits and risks from the perspective of a pharmacist. He can participate not only in basic research, but his role is mainly in the formulation of a dosage form, registration of a vaccine, its distribution, and educational activities towards the lay and professional public.
Keywords:
Safety
Autoři: Aleš Franc
Vyšlo v časopise: Čes. slov. Farm., 2020; 69, 151-162
Kategorie: Přehledy a odborná sdělení
Souhrn
Oblast vývoje, výroby a bezpečnosti vakcín se v poslední době dostává do zorného pole veřejnosti. Cílem tohoto přehledového článku není poskytnout vyčerpávající informace o vývoji a výrobě vakcín, což by ani na omezeném prostoru nebylo možné. Jeho smyslem je v krátkosti nastínit stručný přehled principů, vývoje a výroby základních druhů vakcín a poukázat na benefity a rizika z pohledu farmaceuta. Ten se může podílet nejen na základním výzkumu, ale jeho role je především ve formulaci lékové formy, registraci vakcíny, její distribuci a osvětové a edukační činnosti směrem k laické i odborné veřejnosti.
Klíčová slova:
vaccine – research – development – production – Safety
Úvod
Článek se z pohledu farmaceuta snaží stručně popsat problematiku vakcín s důrazem na jejich principy, výrobu, složení a aplikaci. Předpokládá u čtenáře základní orientaci z oblasti mikrobiologie a imunologie, jelikož používá některé termíny, které zde nejsou blíže vysvětleny. Taxonomie vakcín neodpovídá jednotlivým původcům nemoci (jsou vedle sebe řazeny vakcíny proti virům, bakteriím, prvokům a okrajově i nádorovým buňkám), ale právě uvedenému farmaceutickému aspektu. Nejprve jsou popsány vakcíny dle jejich podstaty (živé, inaktivované, subjednotkové, štěpné, toxoidy, rekombinantní, vektorové, DNA, perorální rostlinné a virům podobné částice). Poté jsou stručně probrány cesty aplikace s ohledem na lékové formy a jejich složení (injectabilia, transdermalia, nasalia a peroralia). Závěrem je krátce pojednáno o jištění jakosti z výrobního pohledu a jsou nastíněny další výzvy pro vývoj nových vakcín.
Co je to vakcína
Vakcína je biologický přípravek určený k navození či zvýšení specifické a aktivní imunity vůči infekčnímu agens. Bývá vyrobena z oslabených nebo usmrcených forem patogenů (bakterií a virů) nebo jejich částí, případně odvozených agens (např. toxoidů), které mají antigenní specificitu a dokážou v hostiteli vzbudit imunitní odpověď, resp. tvorbu protilátek či buňkami zprostředkovanou imunitu. Zároveň nesmí být pro organismus toxické. Vakcína stimuluje imunitní systém organismu, aby rozpoznával a ničil patogen jako cizorodý prvek a zároveň si „pamatoval“ jeho antigen, který by imunitní systém mohl v budoucnu snadněji eliminovat, aniž by došlo k rozvoji infekčního onemocnění1). Vakcíny dnes nejsou zaměřeny jen na mikroby, ale využívá se jich s různým úspěchem i k léčbě a prevenci nádorových onemocnění, resp. k imunitní eliminaci nádorových buněk2). Rozeznáváme vakcíny monovalentní, obsahující antigeny proti jedné nemoci, nebo polyvalentní, obsahující více antigenů proti více původcům nemocí.
Krátká historie a současnost
Je známo, že již ve středověku Indové požívali hadí jedy k imunizaci proti hadímu uštknutí, v čemž někteří rozpoznávají první zdokumentované používání toxoidů3). V Číně již v roce 1695 používali tampóny namáčené v lézích pravých neštovic (variola) k imunizaci zdravých jedinců, kterým potírali nosní sliznice4). Za počátek vakcinace je možné považovat až aplikaci rozdrceného neštovičného strupu z vemene dojnice (latinsky vacca), která prodělala kravské neštovice, k imunizaci proti variole, kterou provedl v roce 1796 anglický lékař Edward Jenner. Louis Pasteur pak poprvé formuloval teorii o mikrobech jako zdrojích infekčních nemocí a v roce 1885 připravil vakcínu z oslabeného viru vztekliny (lyssavirs). Již v roce 1830 byla na našem území největší proočkovanost proti variole a její eradikace o celé století předběhla svoji dobu. Dětská obrna (poliomyelitis) u nás vymizela v roce 1961 díky Sabinově vakcíně, zatímco ještě v roce 1988 bylo ve světě hlášeno 350 000 případů. Rovněž očkování proti TBC, které v Československu probíhalo v letech 1953–2010, až 40krát snížilo počet případů oproti zbytku světa5), kde nyní umírá ročně více než 1 500 000 lidí6). Zásluhu zde mají zejména virologové Dmitrij Slonim, Karel Žáček a epidemiologové Vilém Škovránek, Adam Ervín a Karel Raška7). Ve veterinární medicíně v roce 2002 došlo v České republice k eradikaci vztekliny (rabies) u lišek díky kladení návnad s perorální vakcínou, které byly později shazovány z letadla8). Podle WHO vakcinace každoročně na celém světě obecně zabraňuje asi 2–3 milionům úmrtí9). Vzhledem k vakcinaci zcela vymizela variola, přičemž její poslední výskyt byl zaznamenán v roce 1979 v Somálsku. Přes tyto úspěchy existují některé patogeny, včetně HIV, původce malárie a respiračního syncytiálního viru (RSV), které jsou vůči všem pokusům o vývoj vakcíny rezistentní a představují výzvu všem vědcům na tomto poli10). V současnosti se u nás uskutečňuje vakcinace v raném dětství například proti záškrtu (difterie), tetanu, černému kašli (pertussis), žloutence typu B (hepatitis B) nebo poliomyelitis a periodicky proti tetanu. Tím došlo k jejich dramatickému snížení či eradikaci11). Očkovací kalendář v České republice je uveden v tabulce 1.
Tab. 1. Očkovací kalendář (https://www.vakcinace.eu/ockovani-v-cr) 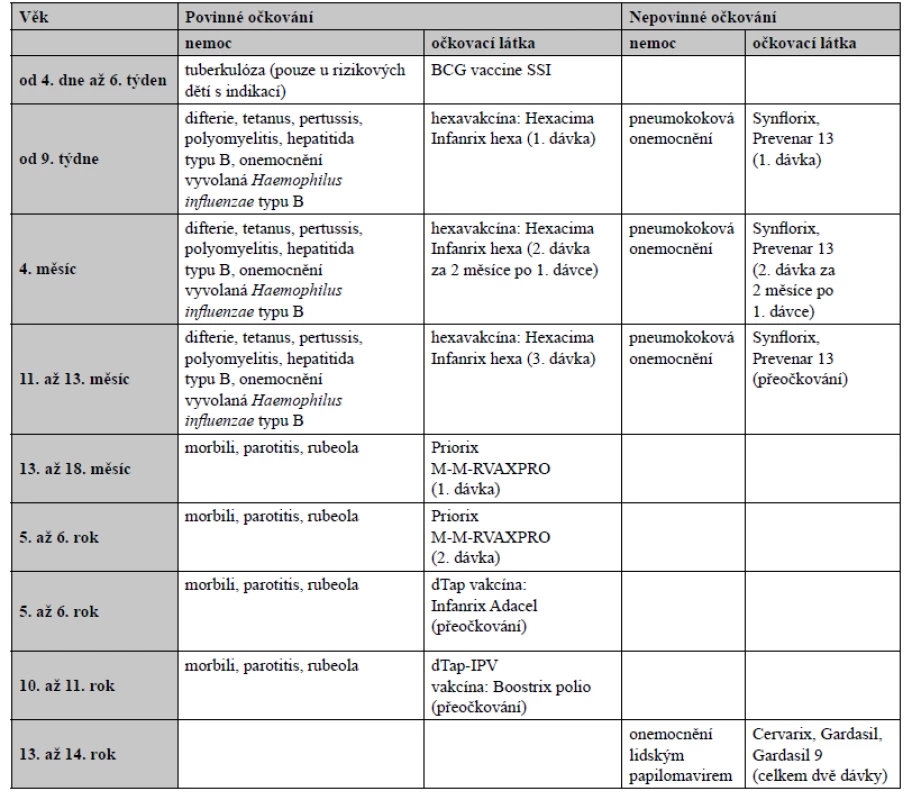
Druhy vakcín
Vakcíny dokážou stimulovat ať už humorální, nebo buněčnou imunitní odpověď a jejich design se vyvíjel v souvislosti s rozvojem vědeckého poznání. Přes původně „jednoduše“ oslabené či usmrcené mikroby se stále více uplatňovaly postupy biotechnologie, molekulární biologie a genetiky. Vznikaly tak nové druhy bezpečnějších vakcín, jako jsou např. rekombinantní, vektorové či DNA vakcíny. Moderní a bezpečnější druhy vakcín si sice zachovaly svoji antigenní specifičnost, ale jejich účinnost musela být v řadě případů zvyšována imunoadjuvanty. U každé vakcíny je proto třeba zvážit zejména dvě hlediska, kam patří reaktivita a imunogenita. Reaktivita je schopnost vakcíny vyvolat obvykle i nežádoucí odezvu organismu (horečka, bolest, obstipace, neurotoxicita, febrilní křeče nebo anafylaktický šok) a imunogenita je schopnost vyvolat adekvátní imunitní odpověď12). Samotné druhy vakcín, včetně nejdůležitějších pomocných látek, lékových forem a technologií jejich přípravy, jsou krátce zmíněny v následujícím textu.
Atenuované vakcíny
Jedná se o jednu z původních technologií přípravy z celých oslabených bakterií či virů, která je známá pod názvem LAV (live attenuated vaccines). Technologie byla rozvinuta v padesátých letech 20. století a dnes se od ní z důvodu bezpečnosti v mnoha případech upouští. Mikrobi jsou zde působením nejrůznějších exogenních faktorů oslabeni, aby se nemohli při aplikaci do lidského organismu množit. Mají však zachovanou antigenní specificitu, která je dostatečná k vyvolání imunitní odpovědi i po jedné dávce, která je srovnatelná s přirozeným onemocněním a poskytuje dostatečný čas k produkci paměťových T-lymfocytů. Historicky se LAV využívaly k produkci vakcín nejčastěji z viru spalniček (morbilliviru), polioviru, flavivirů, paramyxovirů a rotavirů13). Kultivace může probíhat na vhodných živných médiích, obsahujících nejčastěji zvířecí či lidské tkáně nebo buňky. U virů se dá využít oplodněných vajec, zvířecích embryí nebo zvířecí či lidské kultury fibroblastů. Například paramyxovirus parotititis lze produkovat na kuřecích embryích a poliovirus na tkáňové kultuře opičích jater14). K deaktivaci mikrobů se dá využít chemické nebo fyzikální inaktivace. Z chemických činidel se nejčastěji používají formaldehyd, fenol, hydroxid sodný, saponiny apod. a z fyzikálních metod teplota či UV záření15). V současné době existuje celkem pět LAV vakcín, které doporučuje WHO. Jedná se o bakteriální vakcínu proti původci tuberkulózy Mycobacterium tuberculosis, založené na Bacillus Calmette-Guérin (BCG)16), což je oslabený kmen Mycobacterium bovis se sníženou virulencí, a virové vakcíny, kam patří perorální vakcína proti poliomyelitidě (OPV)17), rubeole18), rotaviru19) a žluté zimnici (YF)20).
Inaktivované vakcíny
Jde zřejmě o historicky nejstarší vakcíny. Jedná se o chemicky nebo fyzikálně usmrcené celé bakterie nebo viry, které již nemohou ani potenciálně způsobit infekční onemocnění. Používá se pro ně zkratka KA (killed antigen) a jsou bezpečnější a stabilnější než LAV. Imunogenita, stejně jako reaktivita KA (zejména erytém, horečka, bolestivost) jsou vysoké, a v současné době se proto rutinně nepoužívají. Nestačí je obvykle podat v jediné dávce21). Získávají se stejně jako LAV, avšak namísto oslabení se požívají metody usmrcení, kam patří depozice vakcíny působením nejčastěji roztoku kyseliny askorbové, beta-aminofenylketonu, ethyleniminu, formaldehydu, fenolu, propiolaktonu nebo jejich směsi. Z fyzikálních metod jde o působení zvýšeného tlaku, teploty, UV záření apod. Tyto metody se mohou mezi sebou kombinovat22). Nedávno se ke klinickým účelům využívaly například KA vakcíny proti HIV, hepatitidy B a C23), chřipce (influenza) apod.24). V současné době je ve veterinární medicíně zkoumána KA vakcína z nového delta-koronaviru prasat (PDCoV), který způsobuje akutní průjem, zvracení, dehydrataci a úmrtnost u novorozených selat, což má za následek významné hospodářské ztráty. Vakcína vyvolává silnou humorální imunitu25). V humánní medicíně WHO v současné době doporučuje inaktivovanou vakcínu proti pertussis (wP)26) a poliomyelitidě (IPV)27).
Subjednotkové vakcíny
Jde o inaktivované subjednotkové vakcíny SUV (subunit vaccines), které obsahují pouze komponenty mikrobů, které jsou zodpovědné za imunogenitu. Usmrcený patogen je zde rozložen, jeho komponenty separovány a dále použity k přípravě vakcíny. SUV obsahují jen povrchové antigeny, neobsahují antigeny vnitřní, a mají proto slabší imunogenitu28). Mohou se členit podle obsahu komponent na proteinové, polysacharidové a konjugované. V současné době se používají jak proti bakteriím, tak proti virům. Jako protibakteriální vakcínu WHO doporučuje proteinovou acelulární vakcínu proti pertussis (aP), obsahující proteinový toxoid s případnou složkou dalších subcelulárních součástí29). Z protivirových vakcín sem patří vakcína proti hepatitidě B, která se skládá z povrchového proteinového antigenu viru hepatitidy B (HBsAg)30). Některé bakterie, jako jsou pneumokoky, vytvářejí polysacharidový obal, který ztěžuje imunitní odpověď hostitelského organismu. Těchto polysacharidů se využívá k tvorbě polysacharidové vakcíny. Jejich molekuly jsou však malé a nebývají dostatečně imunogenní, a proto se nepoužívají u dětí do 2 let. Patří sem vakcína Pneumo23, která chrání proti 23 typům pneumokoků a obvykle se přeočkovává po 5 letech31). Imunogenitu lze cíleně potencovat konjugací, resp. vazbou s proteinem, což vyvolá imunitní odpověď i u kojenců. Používají se k tomu různé proteinové nosiče, včetně difterického toxoidu (DT) a tetanického toxoidu (TT). V současné době se používají konjugované vakcíny pro meningokokové infekce, infekce bakterií Haemophilus influenzae typu b (HIb)32) nebo sedmivalentní (PCV-7), desetivalentní (PCV-10) nebo třináctivalentní (PCV-13) pneumokový konjugát proti pneumokokové infekci33).
Štěpné vakcíny
Štěpené inaktivované vakcíny SV (split vaccines) obsahují rozštěpené částice mikrobů a obvykle jak vnější, tak vnitřní antigeny, čímž se liší od SUV. Jejich reaktivita je minimální, avšak imunogenita přijatelná34). Virové kultivary jsou zde inaktivovány, štěpeny, separovány a z virů je odstraněn lipidový obal. Takto připravená vakcína proti influenze obsahuje pouze hemaglutinin (H), neuraminidázu (N), RNA a nukleoproteiny. Při každoročním opakovaném očkování proti influenze někteří dávají přednost právě SV, které při srovnání se SUV vedou k vyššímu vzestupu titru protilátek35). I zde se ale stále hledá způsob jak zvýšit jejich imunogenitu. Jedním ze způsobů je například obalení antigenních štěpů do kationických liposomů36). Komerčních SV se využívá právě k vakcinaci proti influenze37).
Toxoidy
Jedná se o vakcíny vyrobené z bakteriálního proteinového toxinu, inaktivovaného ve formě toxoidu (T), který je pro organismus netoxický, ale přesto má potřebnou imunogenitu. Mohou být tekuté, vysrážené, purifikované nebo adsorbované na příslušný sorbent. Při výrobě vakcín se dodnes používají endotoxiny produkované bakteriemi Clostridium tetani ve formě tetanotoxinu způsobujícího tetanus a Corynebacterium diphtheriae ve formě difterického toxinu způsobujícího diftérii38). TT a DT se vyrábějí inaktivací nativních toxinů vhodnými deaktivačními činidly. Například TT vzniká z tetanotoxinu, který se obvykle inaktivuje denaturací formaldehydem, což ovšem natolik mění jeho strukturu, že dochází k nedostatečné imunitní odpovědi. Proto bývá adsorbován na hlinité nebo vápenaté soli, které zároveň slouží jako imunoadjuvans. Alternativně byl například botulotoxin BoNT (botulický neurotoxin), produkt Clostridium botulinum, vedle formaldehydu inaktivován i alkylací jodacetamidem, což snížilo jeho neurotoxickou aktivitu na nedetekovatelnou úroveň. Po imunizaci pak byly hladiny neutralizačních protilátek in vivo u myší 600krát vyšší než hladiny produkované formaldehydovým toxoidem39). Vakcinace TT je volně dostupná i v rozvojových zemích, přesto náklady na dopravu jsou jednou z významných překážek, které lidem brání v očkování na klinikách v subsaharské Africe40). WHO doporučuje vakcinaci proti diftérii a tetanu právě formou vakcín ve formě TT41) a DT42).
Rekombinantní vakcíny
Rekombinantní vakcíny RV (recombinant vaccines) obsahují zpravidla virové částice, resp. fragmenty, které se při výrobě SUV separují z usmrcených patogenů. Zde jsou však produkovány metodami genetického inženýrství, a při jejich výrobě tak odpadá kultivace patogenu. Při vývoji RV je nejprve třeba zjistit strukturu imunogenního fragmentu a izolovat gen, který je zodpovědný za jeho produkci. Tento gen je následně vpraven do genomu kultivovaného mikrobu, obvykle kvasinky, Escherichia coli nebo tkáňové kultury savčích buněk. Biotechnologicky jsou v bioreaktorech následně produkovány dané proteiny, které jsou využity k vakcinaci. První RV proti hepatitidě typu B na základě povrchového antigenu (rHBsAg), což jest neglykosylovaný lipoprotein, byla léčebně využita již v roce 198643). Produkce antigenu zde probíhá v buňkách kvasinek, do kterých je vpraven příslušný plasmid. Po fermentaci je kultivát štěpen a příslušný protein je izolován pomocí afinitní a hydrofobní chromatografie. Získané proteinové nanočástice jsou následně inaktivovány formaldehydem a adsorbovány na imunoadjuvant hydroxid hlinitý44). V současné době je vyvíjena například RV k prevenci průjmových onemocnění způsobených bakteriemi rodu Shigella flexneri, kde jsou imunogenní epitopy z membránového kanálu a putativní lipoprotein produkovány v kultuře bakterií Escherichia coli45). Z komerčních vakcín se dnes využívá rekombinantní vakcína proti hepatitidě B (rHBsAg)46) nebo vakcína proti humánnímu papilomaviru (HPV) k prevenci rakoviny děložního čípku47).
Vektorové vakcíny
Vektorové vakcíny VV (vector vaccines) používají technologie RV s tím rozdílem, že pracují s celými mikroby, které se stávají nosiči heterogenních antigenů. Principem VV je vklonování antigenu pocházejícího z patogenu do nepatogenního mikrobu za účelem vytvoření epitopu, který je schopný vyvolat imunitní odezvu. Využívají se zde například virální nosiče odvozené od DNA adenovirů, poxvirů, herpes virů, pikornavirů, cytomegaloviru a RNA retrovirů a flavivirů48). Takto upravené VV jsou na rozdíl od řady polypeptidových SUV obvykle schopné vyvolat humorální i buněčnou imunitu, není zde třeba používat imunoadjuvantů a při výrobě vakcíny odpadají nákladné purifikační technologie49). Asi nejrozšířenějšími vektorovými jednotkami jsou dsDNA viru varioly a příbuzné nepatogenní vaccinia viry z rodu poxvirů, které se replikují v cytoplazmě infikované buňky50). Infekce virem vaccinia bývá mírná, obvykle bezpříznaková, přičemž chrání před variolou. Vaccinia virus přijímá a transkribuje velké úseky exogenní DNA, pojme až 30 genů a vytváří dlouhodobou imunitu14, 51). V současné době se ve výzkumu využívají i bakteriální vektory, kam se řadí např. bakterie druhu Typhimurium, Clostridium nebo Salmonela, které vedle onkolytických virů (adenovirů a echovirů) mohou zabezpečit produkci vakcín s cytostatickou, resp. onkolytickou aktivitou na základě transportu genů zodpovědných za apoptózu nádorových buněk52). Dnes již existuje řada vektorů, které mají potenciál indukovat robustní imunitní odpověď, a některé zatím ukazují, že mohou být dobře tolerovány a posléze vést k vývoji nových vakcín.
Genové (DNA) vakcíny
Genové vakcíny představují novou možnost imunizace a imunoterapie, která kvalitativně převyšuje KA nebo SUV. Jedná se o rekombinantní technologii, kde je za terapeutický efekt zodpovědná nativní DNA. Principem DNA vakcín je schopnost předávat geny hostitelským buňkám. Vakcína proto obsahuje jeden nebo několik genů, které se jejím prostřednictvím vnášejí do buněk hostitelského organismu (zvířete nebo potenciálně člověka), jehož metabolické procesy poté syntetizují proteiny na základě genů přítomných v plasmidu, který je schopný proniknout do buňky. Alternativně může být DNA zapouzdřena v proteinu, který usnadňuje její vstup do buněk. Bylo zjištěno, že intramuskulární injekce plasmidu DNA, kódujícího protein viru influenzy, je na myším modelu schopná vyvolat aktivaci specifických cytotoxických T-lymfocytů, které později zvíře chrání před onemocněním způsobeným tímto virem. Plasmidy mohou ovšem nést i geny kódující vylučování i jiných látek, např. cytokinů, případně i jiných molekul s imunostimulačním efektem53). Mechanismus DNA vakcín skýtá naději k vývoji vakcín proti onemocněním, proti kterým zatím úspěšně či trvale očkovat nelze. Je totiž známým faktem, že některé viry, jako jsou ortomyxoviry nebo HIV, snadno mutují, resp. mění svůj zevní obal, aby nevzbudily imunitní odpověď, což je právě překážkou úspěšného vývoje vakcín. Avšak vnitrobuněčné proteiny mutují velmi neochotně a stále přitom obsahují antigeny, na něž se mohou vázat cytolytické T-buňky. Hlavním cílem DNA vakcíny je proto navodit imunitu proti těm infekcím, u nichž tradiční vakcíny a terapie nejsou úspěšné, zdokonalit stávající vakcíny nebo léčit chronická onemocnění. V současné době probíhá klinické hodnocení DNA vakcíny proti viru Zika ZIKV VRC5283, kde byl na opičím modelu sledován přenos z matky na plod. V porovnání s neimunizovanými zvířaty došlo u těch očkovaných k významnému snížení incidence velikosti a délky mateřské viremie, časné ztrátě plodu, fetální infekce a fetální patologie mozku54). Podobně probíhají testy vakcíny proti HIV55). Tyto vakcíny zatím nejsou schválené k léčbě.
Perorální rostlinné vakcíny
Podání perorálních vakcín má být vhodnou alternativou k injekční aplikaci, jelikož tato dle WHO způsobila až 15 000 000 případů kontaminace hepatitidou B a dalšími patogeny, např. HIV56). Nadějným druhem jsou tzv. perorální rostlinné vakcíny PLV (plant-based peroral vaccines). Tento druh je v principu odvozen od RV vakcín s tím rozdílem, že hostitelským organismem je rostlinná buňka tzv. transgenní rostliny. K jejich produkci se využívá genetická agrobakteriální transformace např. pomocí bakterie Agrobacterium tumefaciens, jejíž plasmidy nesou regulační geny. Vzhledem k schopnosti této bakterie přenášet DNA do rostlin byla uskutečněna řada cílených přenosů genetické informace do rostlinných buněk. Pomocí rekombinantní T-DNA byla vyprodukována řada proteinů včetně antigenů, jako je např. glykoprotein S koronaviru.57) V současnosti bylo vyvinuto přes 700 PLV proti např. Escherichia coli, Vibrio cholerae, Plasmodium falciparum, rabies, rotaviru, viru hepatitidy A, B a C, morbilli viru, rinoviru, papilomaviru, cytomegaloviru atd.58). Od osmdesátých let 20. století, kdy se tyto technologie začaly zkoumat, vývoj notně pokročil a dnes se k přenosům antigenů do rostliny používají i virové vektory. Uvádí se, že využití jedlých částí takto geneticky modifikovaných rostlin jako vakcinačního materiálu je vzhledem k absenci kryptických patogenů zcela bezpečné. Při výrobě PLV, kdy lékovou formu tvoří například lyofilizovaná a enterosolventně enkapsulovaná droga, není ani potřeba nákladných fermentačních a purifikačních postupů, sterilizace lékové formy a speciálního skladování. Perorální vakcinace navíc způsobuje vzestup jak slizničních IgA, tak systémových IgG protilátek indukovaných kontaktem antigenu se střevní mukózou. Rizikem je ovšem možnost vzniku tolerance, aniž by byl aktivován imunitní systém hostitele59). V současné době jsou ze strany FDA schválené dvě vakcíny. První je na bázi glukocerebrosidázy, produkované kulturami mrkvové nati. Druhou tvoří MucoRice B-subunit CTB, což je podjednotka B-choleratoxinu, produkovaná semeny rýže60).
Virům podobné částice
VLP (virus like particles) jsou struktury o rozměrech obvykle 30–90 nm, které vznikají „samonaskládáním“ virových proteinů. Neobsahují nukleové kyseliny a často ani lipidové obaly. Jde o povrchové i vnitřní proteiny požadovaného viru, které vytvářejí tyčovou nebo ikosahedrální strukturu61). Ve všech těchto případech mají povrchy těchto VLP opakující se strukturu, která je ideální pro indukci humorální i buněčné imunity62). VLP strukturně jednoduchých virů se obvykle produkují v kulturách bakterií nebo kvasinek63). Proces zpravidla začíná fermentací rekombinantních Saccharomyces cerevisiae, které do média produkují potřebný protein, který se extrahuje a posléze purifikuje řadou fyzikálních a chemických metod, jako je adsorpce na silikagelu, hydrofobní interakční chromatografie, případně ultrafiltrace apod. Získaný protein bývá ošetřen formaldehydem a následně vysolen64). Příkladem je VLP odvozená od influenza viru, která obsahuje povrchové proteiny H a N smísené s proteiny M1 a M2 z jádra viru, které se poté samy sestaví do struktury VLP. Vzhledem k tomu, že se VLP nemohou replikovat, poskytují bezpečnější alternativu k LAV65). VLP jsou schváleny FDA jako vakcíny proti hepatitidě B (HepB) a lidskému papilomaviru (HPV)66).
Cesty aplikace
Vakcíny byly během své historie aplikovány řadou cest. Patři sem nejčastěji injekční podání – intramuskulární (např. HepB, IPV, HiB, PCV-7, DtwP, DTaP, DT, Td, TT), subkutánní (morbili, YF) nebo intradermální (např. BCG), kterými se aplikuje většina vakcín. Ačkoliv je injekční vakcinace nejvíce rozšířená, má řadu nevýhod, jako je např. potřeba vyškoleného zdravotnického personálu. Vpich je navíc bolestivý, může způsobit zranění a mohou nastat komplikace při skladování injekcí. Vedle toho se využívá i transdermálních náplastí a intranazálních přípravků těžících z velké sorpční vlastnosti nosní sliznice. I v současnosti je stále využívané perorální podání (např. OPV, rotavirus)67).
Lékové formy a technologie vakcín
Vakcína, stejně jako kterékoliv nové léčivo, samozřejmě prochází náročnými fázemi klinického hodnocení, kdy se v I. fázi hodnotí bezpečnost a imunogenita, ve II. fázi vedlejší účinky a optimální dávkování a ve III. fázi klinická účinnost. Vedle toho samozřejmě existuje vývoj lékové formy, včetně náročné fáze detekce a bezpečné izolace antigenu, fyzikálně chemické i biologické hodnocení léčivého přípravku, jeho zavádění do výroby včetně testování stability, validace výroby a samotné registrace. Je zřejmé, že vývoj moderní a bezpečné vakcíny trvá řadu let.
Injectabilia
Injekční vakcíny musí se samozřejmostí splňovat všechny náležitosti injekcí. To se týká i klasických kapalných injekcí a lyofilizátů, kde se injekce připravuje pro rekonstituci in situ. Jejich vývoj i průmyslová výroba, ačkoliv vychází z biotechnologie a genového inženýrství, se řídí běžnými standardy, jako je QbD (quality by design)68) s využitím metod MVDA (multiviariate data analysis)69). Pomineme-li nyní biotechnologické a inženýrské metody získávání antigenu, pak z hlediska klasické farmaceutické technologie injekční vakcíny obsahují kromě běžných i specifické komponenty. Jak již bylo řečeno, řada vakcín není schopná vyvolat dostatečnou imunitní odpověď, a proto se do nich přidávají tzv. imunoadjuvanty, které v místě vpichu zajišťují aktivací eozinofilů a produkcí IgE ve formě lokálního zánětu. Obvykle se dělí na anorganické sloučeniny (např. sloučeniny hliníku), bakteriální produkty (např. muramyl dipeptid), olejové emulze (známé je tzv. Freundovo adjuvans) a imunostimulátory (cytokiny a interleukiny)70). Mezi historicky a stále nejvíce používané látky patří anorganické sloučeniny jako hydroxid a fosforečnan hlinitý a fosforečnan vápenatý71). Tyto látky slouží zároveň jako sorbenty, přičemž vzniklá gelová struktura, která může pozitivně ovlivnit i délku imunitní odpovědi72). Vzhledem k často kritizované toxicitě hliníku se hledá i řada jiných dostupných a účinných látek, jako jsou různé uhlovodíky z rostlinné, bakteriální a syntetické produkce apod.73). Přítomnost imunoadjuvantů v různých typech vakcín uvádí tabulka 2.
Tab. 2. Přehled některých hodnocených složení k nazální aplikaci na lidech87) 
K dalším látkám patří stabilizátory, jako jsou například glutamát sodný, chlorid nebo síran hořečnatý, které chrání před zevními vlivy. Dále jsou to aditiva ve formě konstitucií zpravidla ve formě lyofilizovaných injekcí, jako jsou nejčastěji laktosa, sacharosa, glycin a albumin. Vedle nich se používají protimikrobní látky jako thiomersal, k jehož vypuštění v USA a EU došlo u dětských vakcín z hlediska toxicity, nebo 2-fenoxyethanol, fenol a formaldehyd. Nežádoucímu množení potenciálních patogenů lze bránit přídavkem antibiotik, jako je neomycin. Vakcíny pak samozřejmě mohou obsahovat běžná pufrační činidla. K rekonstituci lyofilizátů se používá fyziologický roztok nebo voda pro injekce74, 75). Vedle toho se mohou vyskytovat i kultivační residua76). Český lékopis u kontroly vakcín explicitně požaduje zkoušku na: pH, obsah adjuvans (hliníku a vápníku), volný formaldehyd, fenol a vodu, využitelný objem a bakteriální endotoxiny. Vakcíny se skladují při teplotě 5 ± 3 °C, přičemž tekuté adsorbované vakcíny nesmějí zmrznout (čl. 9.5 : 0153).
Transdermalia
Transdermální imunizace TCI (transcutaneous immunization) se stala atraktivní a alternativní cestou vakcinace a podnítila vývoj vakcín. Umožňují to dvě vrstvy lidské kůže: epidermis a dermis, které obsahují APC buňky (antigen presenting cells), kam patří zejména Langerhansovy buňky (LC), dermální dendritické buňky (dDC) a makrofágy, které dokážou reagovat na antigen a zahájit imunitní odpověď. K dosažení optimálního přístupu antigenu k APC, které indukují aktivaci imunitní odpovědi organismu, je třeba využít synergie vhodné cesty podání v koordinaci s potřebnými komponenty vakcíny. V současné době se proto vývoji TCI věnuje zvýšené úsilí, přičemž se využívá i synergických systémů a mechanismů ve formě např. ultrazvuku77), iontoforézy78), mikrojehel79) a nejčastěji liposomů80) nebo pevných nanoemulzí81). Nadějnými se zde v poslední době jeví exkluzivně aplikované částicové systémy na bázi lipidů, jako jsou transferosomy82), etosomy, kubosomy, niosomy nebo disperze v oleji83). Současné výzkumy na lidech, které se zabývaly např. ochranou před počáteční infekcí Mycobacterium tuberculosis, prokázaly, že intradermální revakcinace adolescentů BCG zajistila 45% ochranu proti infekci84). Příkladem úspěšně registrované intradermální vakcíny proti influenze je Fluzone® Intradermal Quadrivalent (Sanofi Pasteur)85).
Nasalia
Obvyklé virové a bakteriální patogeny střevních, respiračních a pohlavních nemocí vstupují skrze velkou plochu slizničních membrán respiračního ústrojí. Celý slizniční epitel horních cest dýchacích navíc představuje i účinnou fyzickou bariéru pro mnoho patogenů. Jeho lymfoidní tkáň spojená s mukózou má ovšem zvláštní význam pro rozvinutí imunitní odpovědi, což usnadňuje návrh vakcín schopných vyvolat vhodný typ ochranné imunitní odpovědi86). Proto se intranazální imunizace objevila jako velmi účinná cesta vakcinace jak pro periferní, tak systémovou, humorální i buněčnou imunitu87). Různá kvalita a míra reakce závisí na povaze antigenu a jeho interakci s mukózním indukčním místem, přičemž záleží na dávce, adjuvantech a frekvenci podání88). Na nosní sliznici je proto možné aplikovat buď samotné mikroby ve formě snad všech známých vakcín, jako jsou LAV, KA, SUV, RV, nebo například ve směsi s urychlovači penetrace (EP), případně ve formě systémů, jako jsou mikročástice obalené membránou (OMP), liposomy89), imunostimulační komplexy (ISCOM)90) nebo například mikročástice na bázi PLGA91). Tabulka 3 uvádí některé klinické studie nazálních vakcín prováděných na lidech.
Tab. 3. Přehled typů vakcín a přísady imuno adjuvantu48) 
Z komerčních intranazálních vakcín lze uvést trivalentní živou vakcínu proti influenze typu A a B (FluMins®) a kvadrivalentní živou vakcínu proti influenze typu A a B (FluMins Quadrivalemt®)92).
Peroralia
Perorální vakcíny OV (oral vaccines) mají ve vakcinaci letitou tradici. Nejprve se používaly živé a usmrcené bakterie. Například již v roce 1902 použil Wright inaktivovanou autologní kulturu stafylokoka k vakcinaci proti stafylokokovým infekcím93). Mezi nejúspěšnější perorální vakcíny proti poliomyelitidě patří inaktivovaná Salkova vakcína (1952) nebo živá Sabinova vakcína (1962), které podstatně snížily, až eradikovaly výskyt polyomyelitidy94). Při perorálním podání je třeba cílit antigen zejména na střevní enterocyty, pohárkové buňky a M-buňky. K nim však vede dlouhá cesta a antigen musí překonat mnoho fyzikálně-chemických a biologických bariér. Jedná se zejména o kyselé prostředí žaludku a přítomnost proteolytických enzymů, které mohou denaturovat proteinový antigen. Dále je zde biologická bariéra střevního epitelu a hlenu a omezené časové setrvání v tenkém střevě (cca 3–4 h), kdy dochází k většině absorpčních procesů. Rovněž je potřeba daleko většího množství antigenu ve srovnání například s injekčním podáním95).
Zcela zásadní je zde proto využití znalostí farmaceutické technologie při zpracování antigenu do OV, který je potřeba chránit před výše uvedenými hrozbami denaturace. Antigen je možné zpracovat ve více formách, jako jsou niosomy96), liposomy97), bilosomy98), ISCOM99), polymerní mikročástice (MPs) a nanočástice (NPs)100), kde se jako polymerů může využívat PLA a PLGA, případně různých fosforylovaných lipidů, chitosanu atd. Částice pak mohou být obaleny enterickými polymery. Pokud je třeba cílit částice až do kolonu, je možné využít i komerční polymerové disperze, např. Eudragit® FS101). O PLV vakcínách ve formě enkapsulovaných lyofilizovaných rostlinných materiálech bylo pojednání u PLV vakcín.
Většina OV se podává ve formě vodných suspenzí s orálními aplikátory. Kromě suspenze bakterií, resp. enkapsulovaných či různě technologicky zpracovaných antigenů, OV běžně obsahují cukry, v případě oslabených vakcín různá kultivační média, např. DMEM102), vodu pro injekce a různé pufrační přísady103).
Komerčně se OV využívá například ve formě enterických tvrdých tobolek u vakcíny proti Salmonela typhi (Vivotif®). Dále suspenzí proti Vibrio cholaerae ve formě rekombinantní SUV (Dukorale®) a LAV CVD-10-HgR (Vaxchora®). Kromě bakterií existují OV například proti rotaviru ve formě atenuovaného monovalentního kmene lidského rotaviru RIX4414 typu G1P (Rotarix®)104).
Jištění jakosti
Vývoj nového léčiva trvá řadu let, přičemž novým vakcínám je třeba se věnovat obzvlášť pečlivě. U běžného léčiva, které se podává již při propuknutém onemocnění, se počítá s nežádoucími účinky a vždy je třeba vyhodnotit „risk-benefit ratio“. Vakcína se však podává jako prevence zdravé populaci, kde má danému onemocnění předcházet a není možné předpokládat u ní trvalé nežádoucí účinky. Je proto více než diskutabilní vyvíjet nové vakcíny například při pandemiích řádově v horizontu několika měsíců. Při jištění jakosti je třeba sledovat bezpečnost, kdy nová vakcína nesmí vyvolávat onemocnění nebo poškozovat organismus, což je třeba zajistit dostatečně robustním klinickým hodnocením. Dále specificitu, kdy vakcína musí vyvolávat tvorbu protilátek proti konkrétnímu danému antigenu (který se při infekci a následném onemocnění uplatňuje) a chránit organismus co možná nejdéle. Vakcína by měla být zároveň co nejsnáze aplikovatelná a cenově dostupná i v rozvojových zemích, které jsou často ohniskem epidemií. Počet dávek k vyvolání imunity organismu by neměl překročit pět aplikací105).
Samotné vakcíny se pak vyrábějí podle zásad správné výrobní praxe (SVP) pro výrobu léčivých přípravků biologického původu, kde se podílejí pouze proškolení pracovníci v k tomuto účelu schválených prostorách, s patřičnou dokumentací jak výchozích látek, tak systémů jednotné inokulace a systémů buněčných bank, přičemž pečlivá pozornost má být věnována validaci odstraňování nebo inaktivaci virů. Tyto požadavky vycházejí z obecných požadavků WHO a požadavků CPMP (Committee for Medicinal Products for Human Use). V České republice je tato problematika řešena zejména zákonem o léčivech, jeho prováděcími předpisy a právními předpisy EU. SÚKL k tomu vydal pokyn VYR-32 týkající se výroby léčivých přípravků biologického původu106).
Český lékopis se v podstatě chronologicky věnuje aspektům výroby ve formě: obecných ustanovení bezpečnosti, substrátům pro kultivaci, inokolům a buněčným bankám, kultivačním médiím, kultivaci a sklizni, kontrolním buňkám a vejcím, purifikaci, bílkovinným nosičům, zkouškám na sterilitu meziproduktů, konečné várce, stabilitě meziproduktů, vzhledu a zkouškám na zvířatech (čl. 9.5 : 0153).
Výzvy ve vývoji nových vakcín
Vakcíny pro více než 30 bakteriálních a virových patogenů v průběhu let zachránily stovky milionů životů. Přesto byly některé patogeny, včetně HIV, malárie a RSV, rezistentní vůči intenzivním pokusům o vývoj vakcíny. Současné vakcíny proti celosvětově důležitým chorobám, jako je TBC a influenza, jsou navíc suboptimální, což vede k potenciální pandemicitě těchto onemocnění107).
Influenza
Ortomyxovirus influenzae vykazuje mírné, střední a hluboké mutace, které vedou k virovým variantám, jež nevyvolají trvalou imunitu po prodělané nemoci. To má každoročně za následek miliony infekcí s odhadem 300 000 až 600 000 úmrtí108). Úspěšnost vakcinace se zde odhaduje na 10–60 % podle toho, zda byl zvolen správný typ cirkulujícího viru. Vakcíny navíc nechrání před potenciální pandemicitou ptačích kmenů (např. H5N1 a H7N9), které mohou přejít na člověka109). Zároveň existuje intenzivní snaha vyvinout vakcínu zaměřenou na relativně konstantní části chřipkových antigenů N a H, jež by chránily proti širokému spektru různých virových kmenů110).
TBC
Tuberkulóza je celosvětové infekční, nezřídka smrtelné onemocnění. Odhaduje se, že až jedna čtvrtina světové populace je infikována Mycobacterium tuberculosis. Každoročně přitom dochází k 10 milionům nových infekcí a systémové projevy se vyskytují u 5–10 %, z nichž přibližně 1 700 000 ročně umírá111). Hlavní důraz je zde kladen na vývoj vakcín, které by mohly zabránit progresi z latentní infekce TBC na aktivní plicní anebo diseminovanou tuberkulózu112).
RSV
RSV podle odhadu WHO způsobuje ročně přibližně 33 milionů závažných infekcí dýchacích cest. To má za následek každoročně více než 3 miliony hospitalizací a téměř 60 000 úmrtí u dětí do 5 let. Téměř polovina těchto epizod se projevuje u dětí mladších 6 měsíců113). RSV je hlavní příčinou respiračních onemocnění a úmrtnosti kojenců, malých dětí a starších osob. Počáteční pokusy o vývoj vakcíny proti RSV na počátku šedesátých let 20. století s použitím inaktivované virové vakcíny nebyly úspěšné. Teprve nedávné porozumění struktuře, funkci a stabilitě povrchového glykoproteinu RSV F by mohlo vést k vývoji účinné vakcíny114).
Malárie
Navzdory značnému pokroku v boji proti malárii zůstává jednou z nejrozšířenějších infekčních chorob na světě, přičemž 50 % světové populace je ohroženo rozvojem této choroby, jejíž úmrtnost činí přes 400 000 případů ročně115). Starší zdroje uvádějí čísla přes 1 milion116). Absence účinné vakcíny a rezistence Plasmodium malarie k farmakoterapii jsou neustálou výzvou k vývoji bezpečné vakcíny. I přes to, že byl již ohlášen pokrok na tomto poli, není zaručeno, že půjde o trvalý úspěch117).
HIV
Na světě žije odhadem 38 000 000 lidí nakažených HIV, přičemž 1 700 000 bylo v roce 2018 nově infikovaných a 770 000 ve stejném roce zemřelo v souvislosti s AIDS118). Problém v úspěšném vývoji vakcíny spočívá v obtížné tvorbě protilátek proti kritickým konzervovaným, stericky špatně přístupným epitopům povrchového HIV glykoproteinu. Některé poslední výzkumy navrhují vakcínu směřovat proti fúznímu proteinovému trimeru, který je zabudován do virového obalu119). Další autoři pak navrhují, že spíše než pokusy o vytvoření vakcíny na základě strukturní analýzy antigenu mohou uspět empirické zkoušky imunogenity120).
Zvláštní jevy, které mohou ovlivnit účinky vakcinace
Při vakcinaci může docházet k některým jevům, které výrazně (pozitivně i negativně) ovlivňují možnost, resp. výsledek vakcinace.
Patří sem tzv. protilátkami zprostředkovaný enhancement (ADE – antibody-dependent enhancement), který může paradoxně zvýšit susceptibilitu k infekci. Princip se vysvětluje tím, že organismus může být infikován v průběhu času více sérotypy viru. Při prvním kontaktu s infekcí se vytvoří protilátky, které opsonizují daný virus a zprostředkují jeho fagocytózu. Při následném kontaktu příbuzného viru s těmito protilátkami (v tomto případě IgG) však protilátky virus nepoškodí, umožní mu vstup do makrofágů či jiných buněk imunitního systému, kde dojde k jeho zmnožení, a tím i k celkové progresi onemocnění. Tento jev byl pozorován u viru horečky dengue nebo virů Ebola a Zika121).
Dalším, tentokrát pozitivním jevem, je nespecifické zvýšení imunity vůči patogenu vlivem předchozí vakcinace vůči odlišnému antigenu. Bylo zdokumentováno, že vakcinace proti TBC zároveň snižuje incidenci respiračních onemocnění u disponovaných jedinců. Předpokládá se, že někteří oslabení mikrobi, v tomto případě BCG, jsou schopné ovlivnit hematopoetické buňky kostní dřeně tak, že dojde k robustní imunitní odpovědi po setkání již diferencovaných buněk imunitního systému s odlišným patogenem. Experimentálně byla zvýšená imunitní odpověď po předchozí vakcinaci BCG potvrzena u následné infekce, způsobené oslabeným virem YF122).
Závěr
Vývoj, výroba, kontrola a klinické hodnocení vakcín dnes zahrnuje mezioborový průnik mezi virology, bakteriology, imunology, molekulárními biology, biotechnology a farmaceutickými technology. Žádný z těchto oborů nelze opomenout. Tento přehledový článek se z farmaceutického pohledu snaží nabídnout základní a stručný přehled klasických i moderních vakcín, jejich alespoň základní principy a naznačit vybrané způsoby výroby, včetně technologie a složení finálních lékových forem. Chtěl by být studijním doplňkovým materiálem pro studenty farmacie a terénní lékárníky a umožnit jim nahlédnout do komplexnosti dané problematiky. Zároveň se snaží nabídnout adekvátní odkazovanou literaturu k případnému samostudiu.
Střet zájmů: žádný.
Seznam zkratek
ADE – protilátkami zprostředkovaný enhancement
aP – subjednotková (acelulární) vakcína proti pertussis
BCG – bacillus Calmette-Guérin
CTB – cholerický subjednotkový toxin B
DT – difterický toxoid
DtwP
(DTaP) – difterický a tetanický toxoid spolu se subjednotkovou vakcínou proti pertussis
EP – urychlovač penetrace
H – hemaglutinin
HepB – vakcína proti hepatitidě B
HiB – virus hepatitidy B
HIV – virus lidské imunitní nedostatečnosti
HPV – lidský papilomavirus
ISCOM – imunostimulační komplex
IPV – inaktivovaná vakcína proti polioviru
KA – usmrcený antigen
LAV – živá atenuovaná vakcína
MPs – polymerní mikročástice
N – neuramidáza
NPs – polymerní nanočástice
OMP – mikročástice obalené membránou
OPV – orální vakcína proti poliomyelitidě
OV – perorální vakcíny
PCV – pneumokokový konjugát
PLV – perorální rostlinná vakcína
rCTB – rekombinantní cholerický subjednotkový toxin B
rHBsAg – rekombinantní antigen proti hepatitidě B
RSV – respirační syncytiální virus
RV – rekombinantní vakcína
SUV – subjednotková vakcína
SV – štěpná vakcína
T – toxoid (anatoxin)
TBC – tuberkulóza
TCI – transdermální imunizace
Td – společná vakcína proti difterii a tetanu
TT – tetanický toxoid
VLP – částice podobná viru
VV – vektorová vakcína
wP – inaktivovaná vakcína proti pertussis
YF – žlutá zimnice
doc. PharmDr. ThDr. Mgr. Aleš Franc, Ph.D., ThD. ()
Ústav farmaceutické technologie
Farmaceutická fakulta, Masarykova univerzita
Palackého třída 1946/1, 612 42 Brno
e-mail: franca@pharm.muni. cz
Zdroje
1. Vaccine. News Medical Life Sciences. https://www.news-medical.net/condition/Vaccine (15. 3. 2020).
2. Lollini P. L., Forni G. Antitumor vaccines: is it possible to prevent a tumor? Cancer Immunol. Immun. 2002; 51, 409–416.
3. Stanley A. P., Walter A. O. Paul A. O. Vaccines: Elsevier Health Sciences 2008.
4. Dao Z. History of Chinese martial arts: DeepLogic 1985.
5. Trebichaský I. Lži a mýty o očkování. Živa 2016; 3, LIII–LV.
6. Ong E., He Y., Yang Z. Epitope promiscuity and population coverage of Mycobacterium tuberculosis protein antigens in current subunit vaccines under development. Infect. Genet. Evo. I. 2020; 8, 104186.
7. Věda přináší neuvěřitelné množství překvapení. Zdravotnictví a medicína. https://zdravi.euro.cz/rozhovory/predstavujeme/445824 (27. 8. 2012).
8. Letos se budou proti vzteklině vakcinovat lišky naposled. Tisková zpráva. SVS ČR. https://www.svscr.cz/letos_se_budou_proti_vztekline (14. 1. 2009).
9. Goodchild L. Could dissolvable microneedles replace injected vaccines? Mater. Today 2015; 18, 419–420.
10. Giersing B. K., Vekemans J, Nava S, Kaslow D. C., Moorthy V. WHO Product development for Vaccines Advisory Committee. Vaccine 2019; 50, 7315–7327.
11. Petrová M. Očkování v České republice. Tempus medicorum – Farmakoterapeutické informace. Časopis ČLK 2015; 3–7.
12. Cheng D. R., Perrett K. P., Choo S., Danchin M., Buttery J. P., Crawford N. W. Pediatric anaphylactic adverse events following immunization in Victoria, Australia from 2007 to 2013. Vaccine 2015; 33, 1602–1607.
13. Minor P. D. Live attenuated vaccines: historical successes and current challenges. Virology 2015; 479, 379–392.
14. Fusek M., Káš J., Ruml T. Bioléčiva. Praha: Vydavatelství VŠCHT 2008.
15. Ronald W. E. New Vaccine Technologies. CRC Press 2001.
16. BCG vaccine: WHO position paper. WER 2004; 79, 25–40.
17. Introduction of inactivated poliovirus vaccine into oral poliovirus vaccine-using countries. WHO position paper. WER 2003; 78, 241–252.
18. Measles vaccines: WHO position paper. WER 2009; 35, 349–360.
19. Rotavirus vaccines: an update. WER 2009; 84, 533–538.
20. Yellow fever vaccine: WHO position paper. WER 2003; 78, 349–360.
21. Inactivated whole-cell (killed antigen) vaccines: types of vaccines and adverse reactions. WHO. https://vaccine-safety-training.org/inactivated-whole-cell-vaccines.html (15. 6. 2020).
22. Stauffer F., El-Bacha T., Da Poian A. T. Advances in the development of inactivated virus vaccines. Recent Pat. Antiinfect. Drug Discov. 2006; 291–296.
23. Piet M. P., Chin S., Prince A. M., Brotman B., Cundell A. M., Horowitz B. The use of tri(N-butyl)phosphate detergent mixtures to inactivate hepatitis viruses and human immunodeficiency virus in plasma and plasma‘s subsequent fractionation. Transfusion 1990; 30, 591–598.
24. Danihelkova H., Zavadova H. Disruption of influenza virus A by diethyl ether-Tween and tri-N-butyl phosphate-Tween mixtures. Acta Virol. 1984; 28, 26–32.
25. Gao X., Zhao D., Zhou P., Zhang L., Li M., Li W., Zhang Y., Wang Y., Liu X. Characterization, pathogenicity and protective efficacy of a cell culture-derived porcine deltacoronavirus. Virus research 2020; 2, 197955.
26. Pertussis vaccine: WHO position paper. WER 2005; 80, 29–40.
27. Introduction of inactivated poliovirus vaccine into oral poliovirus vaccine-using countries. WER 2003; 78, 241–252.
28. Palache A. M., Brands R., Scharrenburg G. V. Immunogenicity and reactogenicity of influenza subunit vaccines produced in MDCK cells or fertilized chicken eggs. J. Infect. Dis. 1997; 176 (Suppl 1), S20–S23.
29. Möller J., Kraner M. E., Burkovski A. Proteomics of Bordetella pertussis whole-cell and acellular vaccines. BMC Res. Notes 2019; 12, 329.
30. Hepatitis B vaccines: WHO position paper. WER 2009; 84, 405–420.
31. de Greeff S. C., Sanders E. A., de Melker H. E., van der Ende A., Vermeer P. E., Schouls L. M. Two pneumococcal vaccines: the 7-valent conjugate vaccine (Prevenar) for children up to the age of 5 years and the 23-valent polysaccharide vaccine (Pneumo 23) for the elderly and specific groups at risk. NTvG 2007; 151, 1454.
32. Haemophilus influenzae type b conjugate vaccines: WHO position paper. WER 2006; 81, 445–452.
33. Pneumococcal conjugate vaccine for childhood immunization: WHO position paper. WER 2007; 82, 93–104.
34. van de Witte S. V., Nauta J., Giezeman-Smits K. M., de Voogd J. M. Trivalent inactivated subunit influenza vaccine Influvac®: 30-year experience of safety and immunogenicity. Trials Vaccinol. 2012; 1, 42–48.
35. Beran J, Havlík J. Chřipka. Klinický obraz, prevence, léčba, 2. rozšířené vydání. Praha: Maxdorf 2005.
36. Even-Or O., Avniel-Polak, S., Barenholz Y., Nussbaum G. The cationic liposome CCS/C adjuvant induces immunity to influenza independently of the adaptor protein MyD88. Human Vaccines & Immunotherapeutics 2020; 1–9.
37. Spila-Alegiani S., Salmaso S., Rota M. C., Tozzi A. E., Raschetti R. Reactogenicity in the elderly of nine commercial influenza vaccines: results from the Italian SVEVA study. Vaccine 1999; 17, 1898–1904.
38. Broder K. R., Cortese M. M., Iskander J. K., Kretsinger K, Slade B. A., Brown K. H., Mijalski C. M., Tiwari T, Weston E. J., Cohn A. C., Srivastava P. U. Preventing tetanus, diphtheria, and pertussis among adolescents; use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2006; 55, PR3.
39. Jones R. G., Liu, Y., Rigsby P., Sesardic D. An improved method for development of toxoid vaccines and antitoxins. J Immunol. Methods 2008; 337, 42–48.
40. Sato R., Fintan B. Effect of cash incentives on tetanus toxoid vaccination among rural Nigerian women: a randomized controlled trial. Hum. Vaccin Immunother. 2020; 16, 1181–1188.
41. Tetanus vaccine: WHO position paper. WER 2006; 81,197–208.
42. Diphtheria vaccine: WHO position paper. WER 2006; 81, 21–32.
43. Patzer E. J., Nakamura G. R., Hershberg R. D., Gregory T. J., Crowley C, Levinson A. D., Eichberg J. W. Cell culture derived recombinant HBsAg is highly immunogenic and protects chimpanzees from infection with hepatitis B virus. Bio/technology 1986; 7, 630–636.
44. Zhao Q., Wanga Y, Freedb D., Fub T. M., Gimeneza J. A., Sitrina R. D., Washabaugh M. W. Maturation of recombinant hepatitis B virus surface antigen particles. Hum. Vacc. 2006; 4, 174–180.
45. Kazi A, Ismail C. M., Amilda A. A., Chuah C, Leow C. H., Lim B. H., Singh K. K., Leow C. Y. Designing and evaluation of an antibody-targeted chimeric recombinant vaccine encoding Shigella flexneri outer membrane antigens. Infect. Genet. Evol. 2020; 7, 104176.
46. Hernández-Bernal F., Aguilar-Betancourt A., Aljovin V., Arias G., Valenzuela C., Perez de Alejo K., Hernández K., Oquendo O., Figueredo N., Figueroa N., Musacchio A. Comparison of four recombinant hepatitis B vaccines applied on an accelerated schedule in healthy adults. Human Vacc. 2011; 10, 1026–1036.
47. Cutts F. T., Franceschi S., Goldie S., Castellsague X. D., De Sanjose S., Garnett G., Markowitz, L. Human papillomavirus and HPV vaccines: a review. Bull. World Health. Organ. 2007; 85, 719–726.
48. Josefsberg J. O., Buckland B. Vaccine process technology. Biotechnol. Bioeng. 2012; 109, 1443–1460.
49. Li Y., Cao H., Dao, N., Luo Z., Yu H., Chen Y., Chen, X. High-throughput neuraminidase substrate specificity study of human and avian influenza A viruses. Virology 2011; 415, 12–19.
50. Ura T., Okuda K., Shimada M. Developments in viral vector-based vaccines. Vaccines 2014; 3, 624–641.
51. Sutter G., Staib C. Vaccinia vectors as candidate vaccines: the development of modified vaccinia virus Ankara for antigen delivery. Curr. Drug Targets Infect. Disord. 2003; 3, 263–271.
52. Shanmugaraj B., Priya L. B., Mahalakshmi B., Subbiah S., Hu, R. M., Velmurugan B. K., Baskaran, R. Bacterial and viral vectors as vaccine delivery vehicles for breast cancer therapy. Life Sci. 2020; 117550.
53. Srivastava I. K., Liu M. A. Gene vaccines. Ann. Intern. Med. 2003; 138, 550–559.
54. van Rompay K. K., Keesler R. I., Ardeshir A., Watanabe J., Usachenko J., Singapuri A., Cruzen C., Bliss-Moreau E., Murphy A. M., Yee JL, Webster H. DNA vaccination before conception protects Zika virus-exposed pregnant macaques against prolonged viremia and improves fetal outcomes. Sci. Transl. Med. 2019; 18, 523.
55. Felber B. K., Pavlakis G. N. HIV vaccine: better to start together? The Lancet HIV 2019; 11, e724–725.
56. Gaudinski M. R., Houser K. V., Morabito K. M, Hu Z., Yamshchikov G., Rothwell R. S., Berkowitz N., Mendoza F., Saunders J. G., Novik. L., Hendel C. S. Safety, tolerability, and immunogenicity of two Zika virus DNA vaccine candidates in healthy adults: randomised, open-label, phase 1 clinical trials. Lancet 2018; 391, 552–562.
57. Salyaev R. K., Rekoslavskaya N. I. Plant-Based Peroral Vaccines. In Multifunctional Systems for Combined Delivery. Biosensing and Diagnostics 2017; 1, 193–210.
58. Streatfield S. J., Howard J. A. Plant-based vaccines. Int. J. Parasitol. Parasites 2003; 33, 479–493.
59. Chan H. T., Daniell H. Plant‐made oral vaccines against human infectious diseases – are we there yet? Plant Biotechnol. J. 2015; 13, 1056–1070.
60. Takeyama N., Kiyono H., Yuki Y. Plant-based vaccines for animals and humans: recent advances in technology and clinical trials. Ther Adv Vaccines 2015; 3, 139–154.
61. Mak T. W., Saunders M. E., Jett B. D. Primer to the immune response: Academic Cell 2014.
62. Chackerian B. Virus-like particles: flexible platforms for vaccine development. Expert Rev. Vaccines 2007; 6, 381–390.
63. Fuenmayor J., Gòdia F., Cervera L. Production of virus-like particles for vaccines. New biotech. 2017; 39, 174–180.
64. Roldao A, Silva A. C., Mellado M. C., Alves P. M., Carrondo M. J. Viruses and virus-like particles in biotechnology: fundamentals and applications. Comprehensive biotechnology 2017; 1, 633–656.
65. Ludwig C., Wagner R. Virus-like particles – universal molecular toolboxes. Curr. Opin. Biotechnol. 2007; 18, 537–545.
66. Skwarczynski M., Toth I. Micro-and nanotechnology in vaccine development: William Andrew 2016.
67. Cook I. F. Evidence based route of administration of vaccines. Hum. Vacc. 2008; 4, 67–73.
68. Sheets R. L. Opinion on adventitious agents testing for vaccines: Why do we worry so much about adventitious agents in vaccines? Vaccine 2013; 31, 2791–2795.
69. Thomassen Y. E., van Sprang E. N., van der Pol L. A., Bakker W. A. Multivariate data analysis on historical IPV production data for better process understanding and future improvements. Biotechnology and bioeng 2010; 107, 96–104.
70. Aiyer-Harini P, Ashok-Kumar H. G., Kumar G. P., Shivakumar N. An overview of immunologic adjuvants. J. Vaccines Vacci. 2013; 4, 1000167.
71. Goto N., Kato H., Maeyama J. I., Eto K, Yoshihara S. Studies on the toxicities of aluminium hydroxide and calcium phosphate as immunological adjuvants for vaccines. Vaccine 1993; 11, 914–918.
72. HogenEsch H. Mechanisms of stimulation of the immune response by aluminum adjuvants. Vaccine 2002; 31, 34–39.
73. Petrovsky N., Cooper P. D. Carbohydrate-based immune adjuvants. Expert Rev Vaccines 2011; 10, 523–537.
74. Kino Y. Vaccine excipients. Nihon. Rinsho. 2008; 66, 1933–1937.
75. Excipients in vaccines per 0.5 mL dose. IVS. John Hoppkins Bluumberg School and Public. http://www.vaccinesafety.edu/components-Excipients.htm (15. 6. 2002).
76. Wiedermann-Schmidt U., Maurer W. Relevance of additives and adjuvants in vaccines for allergic and toxic side effects. Wien. Klin. Wochenschr. 2005; 117, 510–519.
77. Prausnitz M. R., Langer R. Transdermal drug delivery. Nature biotech. 2008; 26, 1261.
78. Toyoda M., Hama S, Ikeda Y, Nagasaki Y, Kogure K. Anti-cancer vaccination by transdermal delivery of antigen peptide-loaded nanogels via iontophoresis. Int. J. Pharm. 2015; 10, 110–114.
79. Quinn H. L., Kearney M. C., Courtenay A. J., McCrudden M. T., Donnelly R. F. The role of microneedles for drug and vaccine delivery. Expert Opin. Drug Deliv. 2014; 11, 1769–1780.
80. Mishra D., Dubey V., Asthana A., Saraf D. K., Jain N. K. Elastic liposomes mediated transcutaneous immunization against Hepatitis B. Vaccine 2006; 24, 4847–4855.
81. Gogoll K., Stein P., Lee K. D., Arnold P., Peters T., Schild H., Radsak M., Langguth P. Solid nanoemulsion as antigen and immunopotentiator carrier for transcutaneous immunization. Cell. Immunol. 2016; 308, 35–43.
82. Mahor S., Rawat A., Dubey P. K., Gupta P. N., Khatri K., Goyal A. K. Cationic Transfersomes based topical genetic vaccine against hepatitis B. Int. J. Pharm. 2007; 340 : 13–19.
83. Pielenhofer J., Sohl J., Windbergs M., Langguth P., Radsak M. P. Current progress in particle-based systems for transdermal vaccine delivery. Front. Immunol. 2020; 11, 266.
84. Nemes E., Geldenhuys H., Rozot V., Rutkowski K. T., Ratangee F., Bilek N., Mabwe S., Makhethe L., Erasmus M., Toefy A., Mulenga H. Prevention of M. tuberculosis infection with H4: IC31 vaccine or BCG revaccination. N. Engl. J. Med. 2018; 379,138–149.
85. Bragazzi N. L, Orsi A., Ansaldi F., Gasparini R., Icardi G. Fluzone® intra-dermal (Intanza®/Istivac® Intra-dermal): An updated overview. Hum. Vaccin Immunother. 2016; 12, 2616–2627.
86. Partidos C. D. Intranasal vaccines: forthcoming challenges. Pharm. Sci. Technol. Today 2000; 8, 273–281.
87. Davis S. S. Nasal vaccines. Adv. Drug Deliv. 2001; 51, 21–42.
88. Heurtault B., Frisch B., Pons F. Liposomes as delivery systems for nasal vaccination: strategies and outcomes. Expert Opin Drug Deliv. 2010; 7, 829–844.
89. Partidos C. D. Intranasal vaccines: forthcoming challenges. Pharm. Sci. Technol. Today 2000; 8, 273–2781.
90. Hu K. F., Lövgren-Bengtsson K., Morein B. Immunostimulating complexes (ISCOMs) for nasal vaccination. Adv. Drug Deliv. Rev. 2001; 51, 149–159.
91. Slütter B., Bal S, Keijzer C., Mallants R., Hagenaars N., Que I., Kaijzel E., van Eden W., Augustijns P., Löwik C., Bouwstra J. Nasal vaccination with N-trimethyl chitosan and PLGA based nanoparticles: nanoparticle characteristics determine quality and strength of the antibody response in mice against the encapsulated antigen. Vaccine 2010; 38, 6282–6291.
92. Vaccines licensed for use in the United States, FDA. https://www.fda.gov/vaccines-blood-biologics/vaccines/vaccines-licensed-use-united-states (15. 6. 2020).
93. Wright A. E. Notes on the treatment of furunculosis, sycosis, and acne by the inoculation of a staphylococcus vaccine: and generally on the treatment of localised bacterial invasions by therapeutic inoculations of the corresponding bacterial vaccines. Lancet 1902; 159 : 874–884.
94. Bakker W. A., Thomassen Y. E., van’t Oever A. G, Westdijk J., van Oijen M. G., Sundermann L. C., van’t Veld P., Sleeman E., van Nimwegen F. W., Hamidi A, Kersten G. F. Inactivated polio vaccine development for technology transfer using attenuated Sabin poliovirus strains to shift from Salk-IPV to Sabin-IPV. Vaccine 2011; 41, 7188–7196.
95. Ramirez J. E., Sharpe L. A., Peppas N. A. Current state and challenges in developing oral vaccines. Adv. Drug Deliv. Rev. 2017; 114, 116–131.
96. Arora R. Advances in niosome as a drug carrier: a review. Asian J. Pharm. 2016; 9, 29–39.
97. Gould-Fogerite S., Mannino R. J. Mucosal and systemic immunization using cochleate and liposome vaccines. J. Liposome Res. 1996; 2, 357–379.
98. Jain S., Khomane K. K., Jain A., Dani P. Nanocarriers for transmucosal vaccine delivery. Curr. Nanosci. 2011; 7, 160–177.
99. Ramirez J. E., Sharpe L. A., Peppas N. A. Current state and challenges in developing oral vaccines. Adv. Drug Deliv. Rev. 2017; 15, 116–131.
100. Narasimhan B., Goodman J. T., Vela Ramirez J. E. Rational design of targeted next-generation carriers for drug and vaccine delivery. Annu. Rev. Biomed. Eng. 2016; 18, 25–49.
101. Zhu Q., Talton J., Zhang G., Cunningham T., Wang Z., Waters R. C., Kirk J, Eppler B., Klinman D. M., Sui Y, Gagnon S. Large intestine-targeted, nanoparticle-releasing oral vaccine to control genitorectal viral infection. Nature Med. 2012; 18,1291–1296.
102. Marco I., Feyerabend F., Willumeit-Römer R., vVan der Biest O. Degradation testing of Mg alloys in Dulbecco’s modified eagle medium: Influence of medium sterilization. Mater. Sci. Eng. C. 2016; 62, 68–78.
103. Vogel F. R., Powell M. F. A compendium of vaccine adjuvants and excipients. Vaccine Design. Boston, MA: Springer 1995.
104. Rhee J. H. Current and New Approaches for Mucosal Vaccine Delivery. In Mucosal Vaccines. Academic Press 2020.
105. Mort M., Baleta A., Destefano F. Vaccine safety basics learning manual. WHO Press, Switzerland 2013.
106. Výroba léčivých přípravků biologického původu. Doplněk 2. SÚKL 2003. http://www.sukl.cz/leciva/doplnek-2
107. Mascola J. R., Fauci A. S. Novel vaccine technologies for the 21st century. Nat. Rev. Immunol. 2020; 2, 87–88.
108. Paules C. I., Sullivan S. G., Subbarao K., Fauci A. S. Chasing seasonal influenza – the need for a universal influenza vaccine. N. Engl. J. Med. 2018; 378, 7–9.
109. Hewajuli D. A., Dharmayanti N. I. Efficacy, mechanism and antiviral resistance of neuraminidase inhibitors and adamantane against avian influenza. ICARD 2019; 29, 61–74.
110. Andrews, S. F., Graham, B. S., Mascola, J. R., McDermott, A. B. Is it possible to develop a “universal” influenza virus vaccine? Cold Spring Harbor Perspectives in Biology 2018; 10, a029413.
111. Bloom, B. R. New promise for vaccines against tuberculosis. N. Engl. J. Med. 2018; 379, 1672–1674.
112. Gursel M., Gursel I. Is global BCG vaccination coverage relevant to the progression of SARS-CoV-2 pandemic? Med. Hypotheses 2020; 6, 109707.
113. Bohmwald K., Espinoza J. A., Pulgar R. A., Jara E. L., Kalergis A. M. Functional impairment of mononuclear phagocyte system by the human respiratory syncytial virus. Front. Immunol. 2017; 27, 1643.
114. Crank M. C., Ruckwardt T. J., Chen M., Morabito K. M., Phung E., Costner P. J., Holman L. A., Hickman S. P., Berkowitz N. M., Gordon I. J., Yamshchikov G. V. A proof of concept for structure-based vaccine design targeting RSV in humans. Science 2019; 6452, 505–509.
115. Malaria, Key facts. WHO 14. January 2020. https://www.who.int/news-room/fact-sheets/detail/malaria
116. New estimates of malaria deaths: concern and opportunity. Lancet 201; 9814, 385.
117. Thera M. A., Plowe C. V. Vaccines for malaria: how close are we? Annu. Rev. Med. 2012; 63, 345–357.
118. Global HIV & AIDS statistics - 2019 fact sheet, UNADIS. https://www.unaids.org/en/resources/fact-sheet (15. 6. 2009).
119. Phillips M. A., Goldberg D. E. Toward a chemical vaccine for malaria. Science 2018; 6419, 1112–1118.
120. van Regenmortel M. H. HIV/AIDS: Immunochemistry, Reductionism and Vaccine Design: A review of 20 years of research: Springer Nature 2019.
121. Eroshenko N., Gill T., Keaveney M. K., Church G. M., Trevejo J. M., Rajaniemi H. Implications of antibody-dependent enhancement of infection for SARS-CoV-2 countermeasures. Nature Biotech. 2020; 38, 789–791.
122. Gursel M., Gursel M. Is global BCG vaccination-induced trained immunity relevant to the progression of SARS-CoV-2 pandemic? Allergy 2020; 7, 1815–1819.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Přerušovaný půst může mít významná zdravotní rizika
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
-
Všechny články tohoto čísla
- Vakcíny z pohledu farmaceuta
- Kolagen v kombinaci s kyselou formou karboxymethylcelulosy v podobě netkané textilie jako moderní krycí prostředek pro terapii ran – formulace, příprava a hodnocení
- Aplikácia inhalačných liekov z pohľadu lekárnika
- Současné stanovení amoxicilinu a klavulanátu draselného v kombinovaných lékových formách: přenos postupu z HPLC na UPLC
- Složení mastných kyselin v Centaurea cyanus (L.)
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vakcíny z pohledu farmaceuta
- Aplikácia inhalačných liekov z pohľadu lekárnika
- Kolagen v kombinaci s kyselou formou karboxymethylcelulosy v podobě netkané textilie jako moderní krycí prostředek pro terapii ran – formulace, příprava a hodnocení
- Složení mastných kyselin v Centaurea cyanus (L.)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



