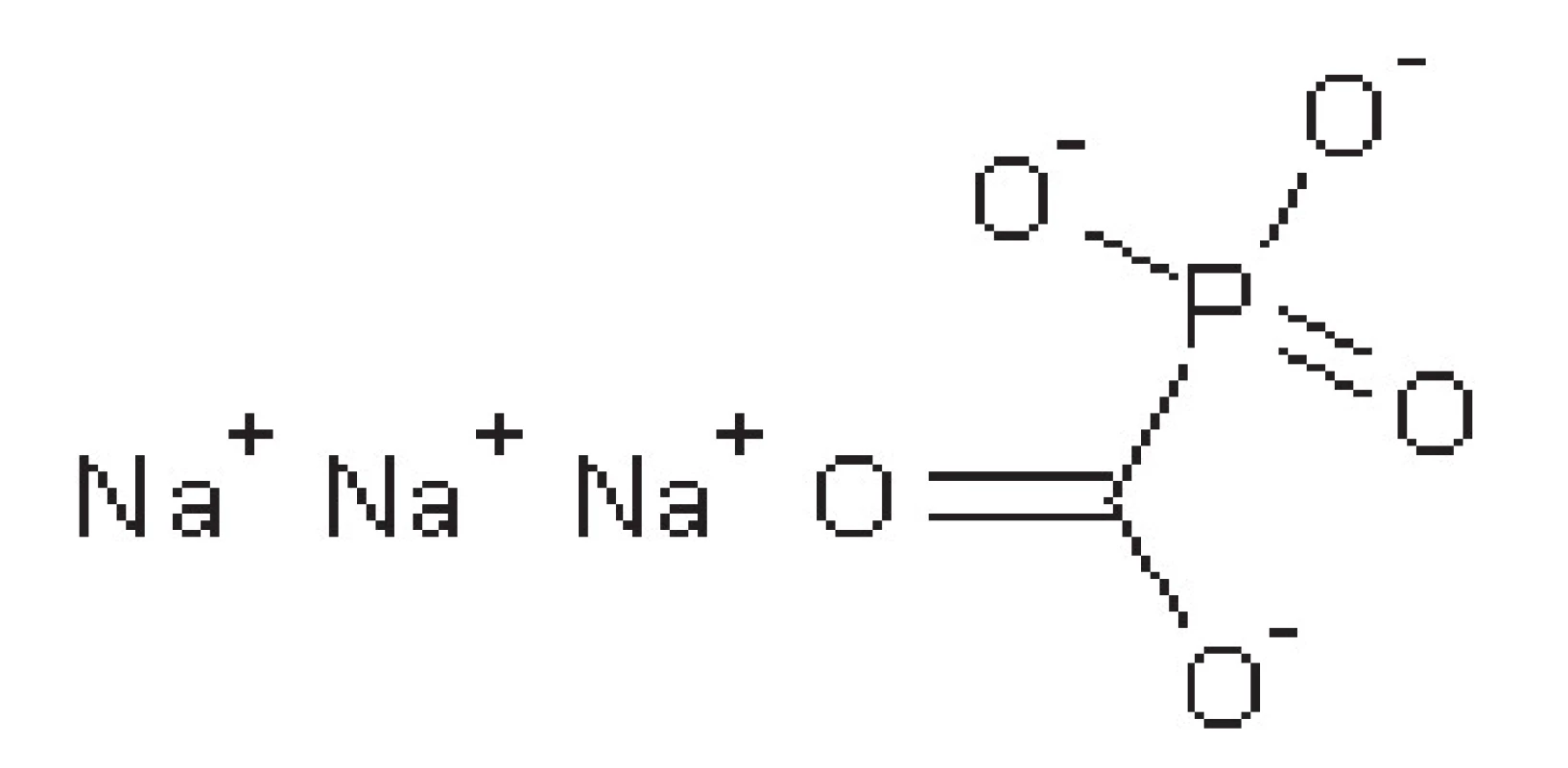-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaInfekce viru herpes simplex: přehled problematiky, farmakologická terapie a dietní opatření
Herpes simplex virus infection: an overview of the problem, pharmacologic therapy and dietary measures
Treatment of infectious diseases remains one of the principal research target for many researchers and healthcare providers worldwide. Herpes simplex virus 1 (HSV-1) and herpes simplex virus 2 (HSV-2) are common human pathogens with an estimated 60–95% of the adult population infected by at least one of them. The worldwide disease burden of HSV is substantial, and acyclovir and related nucleoside analogues (viral DNA polymerase inhibitors) as therapies have led to significantly increased treatment efficacy of HSV infections. Although the treatment of HSV infection has greatly advanced through the use of nucleoside analogues therapy, the treatment efficacy has decreased significantly. This is due to the extensive use of nucleoside analogues drugs, which has created drug resistance, associated with other adverse effects as well. In this review, we aim to shed light on the HSV infection, the current pharmacologic treatment, and the use of dietary measures as alternative therapy option.
Key words:
HSV infection • dietary measures • antiviral drugs • nucleoside analogues • natural compounds
Autoři: Sherif T. S. Hassan; Miroslava Šudomová; Radka Masarčíková
Vyšlo v časopise: Čes. slov. Farm., 2017; 66, 95-102
Kategorie: Přehledy a odborná sdělení
Souhrn
Léčba infekčních onemocnění je hlavním výzkumným cílem mnoha vědců a lékařů na celém světě. Herpes simplex virus 1 (HSV-1) a herpes simplex virus 2 (HSV-2) jsou nejčastějšími lidskými patogeny. Přibližně 60 až 90 % populace je infikováno alespoň jedním z nich. Řešení onemocnění HSV celosvětově je velmi podstatné, pomocí acikloviru a nuklesidových analogů (inhibitory virové DNA polymerázy) jako terapie vedou k výraznému zvýšení léčby infekce HSV. Přestože léčba infekce HSV výrazně pokročila pomocí terapie nukleosidovými analogy, účinnost léčby se ale významně snížila. To je důsledkem rozsáhlého použití léků na bázi nukleosidových analogů, které vytvořily odolnost vůči antivirotikům, a to i při jiných nežádoucích účincích. V tomto přehledu se snažíme osvětlit infekci HSV, současnou farmakologickou léčbu a použití dietních opatření jako alternativní terapii.
Klíčová slova:
HSV infekce • dietní opatření • antivirotika • nukleosidové analogy • přírodní látkyÚvod
Infekce herpes simplex viry jsou v lidské populaci velmi časté. Nejčastějšími jsou typy HSV-1 a HSV-2, které ovlivňují všechny věkové i sociální skupiny lidí. Postihují převážně kůži a sliznice. Oba typy HSV-1 a HSV-2 patří mezi nejrozsáhleji zkoumané herpesviry, kde HSV-1 je obyčejně spojován s orální a obličejovou infekcí, ale taktéž s encefalitidou, na rozdíl od HSV-2, který způsobuje genitální infekce. Více než 80 % lidí na celém světě je infikováno HSV-1, a zhruba 40 % má opakující se infekce. Kromě toho bylo zjištěno, že infekce HSV-2 může být vysokým rizikovým faktorem pro potenciální infekci viru HIV a stejně tak pro invazivní karcinom krku1–5).
Herpetické viry jsou neléčitelné a zůstávají dlouho v těle hostitele. Během primární infekce virus vstupuje do nervové buňky a generuje latenci smyslových neuronů. Reaktivace latentní HSV, zejména při nedostatku imunity, indikuje rekurentní infekce a dále infikuje nové hostitele. Kromě toho HSV také souvisí s mnoha očními onemocněními, jako jsou stromální keratitida, endotelitida a neurotropní keratopatie2, 3).
V současné době není k dispozici žádné očkování proti HSV infekci, proto se mnoho výzkumů zabývá zkoumáním nových účinných látek v této oblasti. Léčba HSV infekcí je momentálně založena na používání několika selektivních a účinných léků, jako je aciklovir, penciklovir, famciklovir, cidofovir, valaciklovir, trifluridin, a vidarabin, které působí jako inhibitory DNA (deoxyribonukleová kyselina) polymerázy4–7).
Cílem přehledové práce je seznámení se s infekcí HSV, nastínění současného stavu problematiky a farmakologické terapie a také role dietního opatření. Publikační podklady byly vyhledány v databázích PubMed, Scopus, Google Scholar a Web of Knowledge pod klíčovými slovy: herpes simplex virus, nucleoside analogues, antiherpetic drugs, pharmacological therapy and dietary measures.
Herpes simplex viry
Herpes simplex viry neboli lidské herpetické viry typu 1 a 2 (HSV-1 a HSV-2) patří do čeledi Herpesviridae, podčeledi Alphaherpesvirinae. Jedná se o skupinu dsDNA (double strand DNA) virů. Alphaherpesvirinae napadají buněčné kultury mnoha druhů savců a ptáků, ovšem jediným přirozeným rezervoárem nákazy viry herpes simplex v přírodě jsou lidé1–3).
Stuktura virů
Jedná se o poměrně velké viry o průměru asi 150 až 200 nm.
Virion se skládá ze čtyř vrstev:
- jádro: obsahující dvojvláknitou DNA a bazický protein
- kapsid: tvaru dvacetistěnu složeného ze 162 subjednotek zvaných kapsomery
- mezivrstva (tegument): homogenní vrstva obsahující proteiny
- vnější obal (envelope): tvořený lipidovou dvojvrstvou pocházející z membrány hostitelské buňky, ve které jsou zakotveny virové glykoproteiny, které se účastní adsorpce, penetrace a šíření částic
DNA je složená z 152 000 párů bází. Sekvence DNA HSV-1 a HSV-2 jsou si značně podobné. Liší se v některých úsecích, které kódují antigenně odlišné glykoproteiny (gG1 a gG2). DsDNA obsahuje koncové (TR) a vnitřní (IR) repetice uspořádané podle schématu TRL-UL-IRL-IRS-US-TRS. Dlouhý jedinečný úsek (unic long = UL) obsahuje 66 genů, krátký jedinečný úsek (unic short = US) má 14 genů. Koncové repetice kódují další nejméně čtyři bílkoviny a obsahují informace pro vbalování do kapsidu. Nejčastěji udávaný celkový počet genů HSV-1 je tedy 84. Hustota uchovávané genetické informace je velmi vysoká1) 4, 5).
Počet proteinů produkovaných nakaženou buňkou nepřesahuje 84, při nákaze cytomegalovirem je to až 150. Méně než polovina bílkovin (asi 25–33) se stává součástí virové částice. Imunitní systém člověka dokáže reagovat pouze na polovinu proteinů HSV-11, 6).
Reprodukce
Cyklus rozmnožování buněk HSV v kultuře vnímavých buněk trvá 16–18 hodin. Přichycení na receptory buněk probíhá během několika minut za pomoci glykoproteinů. Buněčné receptory jsou glukoaminoglykany (dříve zvané mukopolysacharidy) a skupina herpes virus entry mediator (např. HVEA = receptor pro TNF). Velmi významné jsou také na povrchu buněk epitelu receptory pro imunoglobuliny, tzv. nektiny7, 8).
Během pozdní fáze adsorpce dochází k tvorbě fúzních můstků mezi obalem částic a povrchem buňky působením glykoproteinu gD, který je zodpovědný za ireverzibilní průběh, a komplexu gH/gL, který je iniciátorem fúze, což vede k průniku viru do buňky. Cytoplazmatická oblast gB reguluje fúzi9).
Specifické protilátky neutralizují virus navázáním na antigeny glykoproteinů. Rozmnožování HSV-1 a HSV-2 začíná proniknutím virové DNA skrz póry jaderné membrány do jádra. Pro průnik DNA do buňky je nutné její odbalení. Protein kapsidu asociuje s dineinem, transportním proteinem mikrotubulů, čímž umožní transport virové genetické informace přes cytoplazmu k jaderné membráně. Následně se vDNA (virová DNA) cirkularizuje, přičemž nastává postupná exprese virových genů. Geny jsou přepisovány do podoby lineárních nesestříhaných molekul mRNA o velikosti asi 1700 bp. V této době (asi 1–2 hodiny od průniku) také dochází k pozastavení tvorby proteinů hostitelské buňky, aby se buněčné polyribozomy mohly věnovat tvorbě virových bílkovin. Na tomto procesu se podílí protein virion host shutoff z mezivrstvy a později také nestrukturní proteiny viru10).
Při procesu proteosyntézy jsou nejprve tvořeny velmi rané proteiny (α), které napomáhají přepisu mRNA pro rané a pozdní proteiny, α-proteiny také inhibují přesun antigenních peptidů do molekul systému HLA I, a tím brání jejich rozpoznání cytotoxickými lymfocyty. Ve druhé fázi nastává tvorba raných proteinů (β), které jsou nezbytně nutné pro replikaci vDNA herpes virů. β-protein se naváže na začátek kódovací oblasti pro UL nebo US, a tím umožní navázání dalších potřebných proteinů pro syntézu nových vláken DNA11, 12). Ve třetí fázi vznikají pozdní proteiny γ, tedy strukturní bílkoviny kapsidu, mezivrstvy a proteiny vnější stěny, které dále podstupují glykosylaci v Golgiho aparátu za pomoci buněčných glykosyltransferas11–13).
Vzniklá virová DNA prochází sestřihem a poté se balí do neobalených kapsid typu B, které vznikly z prekurzorových kapsid typu A připojením proteinu kostry kapsidu a jeho proteasového komplexu. Prekurzorový kapsid vzniká interakcí několika kapsidových proteinů. Začleněním vDNA do této struktury vzniká zralý kapsid typu C. Zralé kapsidy se obalují na vnitřní lamele jaderné membrány a získávají zde glykoproteiny obalu. Obalené viriony opouští buňku systémem transportních kanálků a vezikul za účasti glykoproteinu K. V dlaždicovém epitelu kůže se uplatňuje gE/gI spolu s gM, které umožňují šíření z buňky a také pronikání viru do nervových zakončení. Uvolnění viru z buňky je často doprovázeno její lýsou11–15).
Šíření podél nervů
Herpes simplex viry se v organismu šíří pomocí krve a také lymfatického systému. Dále mohou využívat transport pomocí nervů, tato cesta obchází hematoencefalickou bariéru.
Stejný způsob transportu využívají také další viry, např. virus vztekliny, Varicella zoster virus, Togavirus a Flaviviry16).
Místem kontaktu HSV s organismem bývá obvykle kůže, sliznice nosohltanu, dutiny ústní, oka a pohlavních orgánů, odkud se dostávají do zakončení motorických nebo senzorických nervů. Mohou také vstupovat sliznicí stěny střeva, odkud virus proniká do vegetativních neuronů17).
Po uvolnění vnitřního ribonukleoproteinu se virová podjednotka transportuje podél mikrotubulů, čímž virus využívá rychlý axonový transport synaptických vezikul. Tyto vezikuly obsahují neurotransmitery a enzymy produkované v cytoplazmě neuronů, jejichž transport je velmi rychlý a je zajišťován ve směru anterográdním (asi 200–400 mm/den) i retrográdním (asi 100–200 mm/den). Proteiny nevbalené do vezikul se transportují pomalým axonovým tokem (asi 0,1–1 mm/den)16–18).
Transportované viriony (obalené kapsidy, které asociovaly s dineinem) se rychle dostávají do prvního neuronu v gangliu, kde se DNA viru usadí ve formě latentní infekce.
U virů šířených pouze pomocí neuronálního transportu je zjevná spojitost mezi místem vniknutí infekce do organismu a postižením odpovídajících neuronů v nejbližších gangliích a v příslušných oblastech centrálního nervového systému. U herpes simplex virů tato souvislost není vzhledem k dalším možnostem šíření krví a lymfatickými cestami tak patrná19).
Alfaherpesviry se navíc mohou množit ve Schwannových buňkách periferních nervů a v satelitních buňkách senzorických ganglií.
Primoinfekce u dětí virem HSV-1 často probíhá jako gingivostomatitida. Vir se pak usazuje v gangliu nervus trigeminus. Po reaktivaci se pak vir zpětným transportem dostává ke sliznicím a projevuje se jako klasický herpes labialis nebo herpes cornae.
Při infekci kůže nebo sliznice genitálu virem HSV-2 se tento virus trvale usazuje v lumbosakrálních gangliích19–20).
Navození latence
Alfaherpesviry mají sklon navodit latentní infekci v nervových gangliích, jejichž vlákna inervují oblast vstupu viru do organismu.
V neuronech, které byly infikovány pouze cestou axonálního transportu, jsou přítomny kofaktory potřebné pro expresi viru v nízkých koncentracích, které nepostačují k propuknutí infekce (v důsledku nižší virulence viru se neprojevuje viremie). Jejich transport probíhá mnohem pomaleji než transport samotných virových částic. Zralé neurony infikované viry HSV-1 a HSV-2 jsou schopné zabránit funkčnímu uplatnění viru blokádou indukované transkripce. Tyto neurony jsou označovány jako nepermisivní a infekce v nich přetrvává v latentní formě. Virová DNA zde přetrvává v cirkularizované formě. Nedochází tudíž k tvorbě žádných virových proteinů, vznikají pouze RNA molekuly latence, tzv. „latency associated transcripts“ (LAT)21).
Nahromadění LAT usnadňuje reaktivaci viru. Nejdůležitější okolností zvyšující pravděpodobnost reaktivace viru je metabolická aktivita neuronu, která vede k aktivaci transkripce virových proteinů. Virus mohou aktivovat také různé další podněty, které způsobují podráždění nervového zakončení, jako jsou mechanické poškození, stres nebo UV záření22).
Při reaktivaci dochází k vycestování viru podél axonu zpět na periferie do epitelu kůže a sliznic, kde způsobuje vznik rekurentních lézí. Reaktivace může proběhnout v několika gangliích zároveň. Rekurentní infekce se často vyskytují v místech primoinfekce a mohou se objevovat i v několika desítkách případů za rok.
Až do okamžiku reaktivace není možné v gangliích detekovat přítomnost infekčního viru. V séru jsou protilátky přítomné. Hladina imunoglobulinu G během doby latence s časem klesá22–23).
Imunitní odpověď
V rané fázi imunitní reakce dochází k indukci interferonu I, aktivaci „natural killer“ buněk a monoklonálních fagocytů (makrofágy a dendrické buňky). Poté probíhá tvorba protilátek IgM.
V pozdní fázi (6. až 7. den) se zapojují specifické T-lymfocyty a protilátky IgG. Indukce imunitní odpovědi je zprostředkovaná T buňkami s markerem CD4, eliminace viru probíhá pomocí cytotoxických buněk s označením CD824).
Patogeneze
Herpetické infekce jsou rozšířeny celosvětově, vyskytují se celoročně a mezi všemi věkovými i sociálními vrstvami obyvatel.
Infekce viry HSV-1 a HSV-2 má mnoho společných rysů. Klinické projevy jsou velmi podobné, liší se obvyklým místem výskytu. HSV-1 je zodpovědný za orální infekce, HSV-2 za onemocnění genitálu. Navíc je virus typu 2 virulentnější25, 26).
Důležitým faktorem průběhu nemoci je věk pacienta, respektive vyzrálost jeho imunitního systému. Mezi rizikové skupiny patří děti do 10 dní věku, geriatričtí a imunokomprimovaní pacienti. Až 95 % pacientů trpících AIDS se potýká s herpes simplex viry27).
Infekce herpes viru se přenáší pouze blízkým kontaktem s nakaženou osobou. Hlavně u viru HSV-2 nemusí být na kůži patrné léze, a přesto může dojít k přenosu.
Průběh infekce se různí podle místa vniku viru do organismu (tab. 1)28–33).
Tab. 1. Průběh infekce podle místa vniku 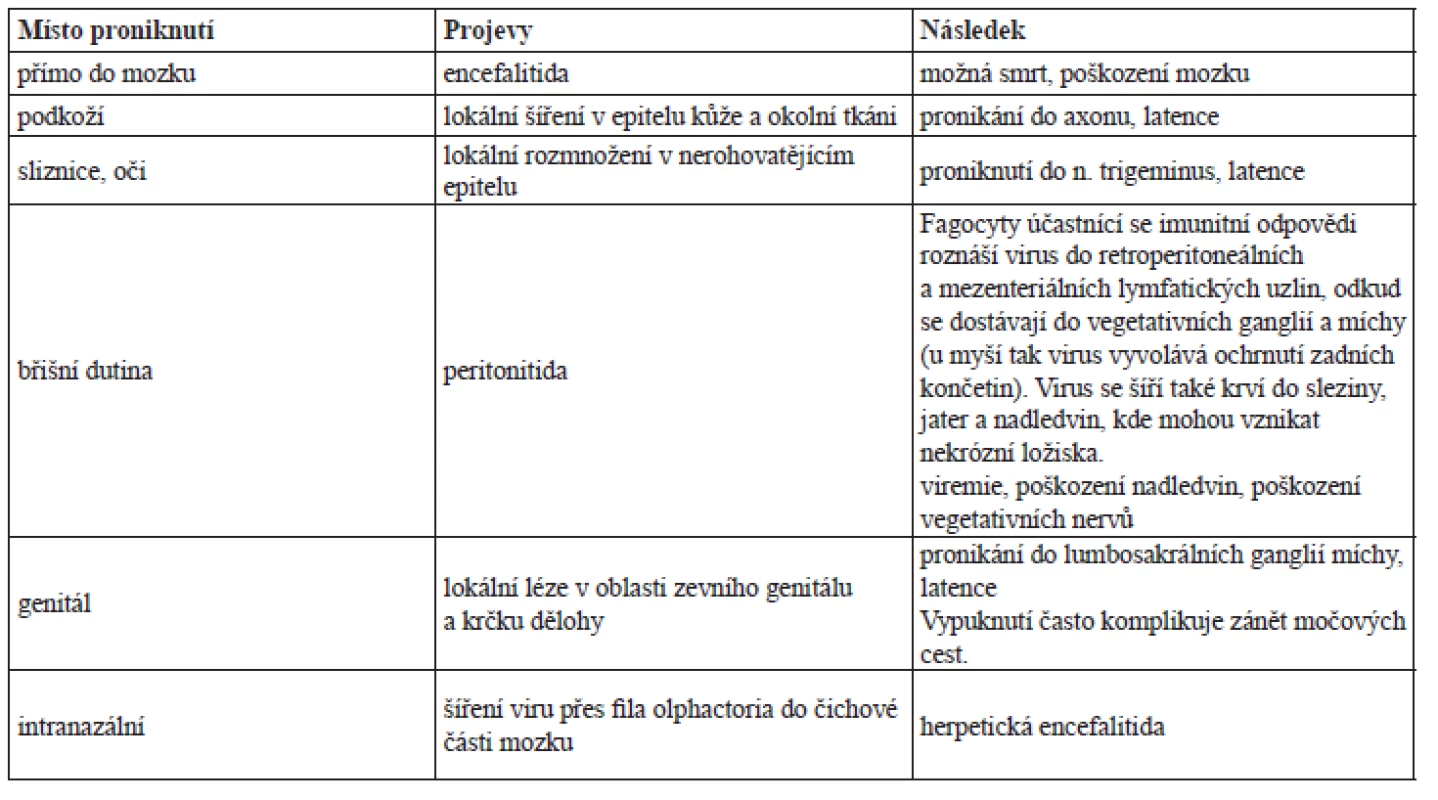
Epidemiologie
Během svého života se s herpetickou infekcí setká téměř každý. V populaci dospělých mezi 20–40 lety se vyskytují protilátky proti HSV-1 u 80 % jedinců. Výskyt antigenů proti HSV-2 je u dětí menší než 5 %, u běžné dospělé populace asi 30 % a u rizikových skupin (prostitutky, imunokomprimovaní) více než 70 %28, 29).
Klinické příznaky herpetických infekcí
Klinické příznaky nákazy HSV-1 a HSV-2 se příliš neliší. Rozdílná je hlavně lokalizace projevů.
Generalizovaný herpes novorozenců
Nemoc propuká v důsledku perinatální infekce virem HSV-2 nebo postnatálním přenosem viru HSV-1 na novorozence od rodičů nebo nemocničního personálu. Možný je také transplacentární přenos viru. Toto riziko je ovšem velmi malé (max. 5 % infikovaných dětí). Projevuje se tvorbou rozsáhlých herpetických puchýřů na kůži, hepatoadrenální nekrózou s poruchami krevní srážlivosti a intravaskulární koagulací (DIC – diseminovaná intravaskulární koagulopatie), syndromem šoku. Dochází také k herpetické encefalitidě30, 34).
Při postižení kůže je naděje na přežití 70%. Je zde ovšem vysoké riziko trvalé slepoty nebo neurologického poškození (až u 50 % nakažených). Je-li postižena CNS (centrální nervová soustava), pak mortalita dosahuje 50–80 %35).
Výskyt onemocnění se snižuje díky možnosti kontroly séropozitivity matky, přesto u nás plošný screening zatím neprobíhá. I během těhotenství je možná léčba aciklovirem34, 36).
Herpetická encefalitida
Nemoc vzniká po primoinfekci (u séronegativních) nebo po reaktivaci latentního viru (u séropozitivních osob). Projevuje se stavy zmatenosti, strnutím šíje, poruchami myšlení, vysokou horečkou, zvýšením nitrolebního tlaku, změnami EEG a také morfologickými změnami patrnými na CT (počítačová tomografie).
Onemocnění končí fatálně v 70 % případů. Léčba aciklovirem je úspěšná pouze při včasné diagnóze37).
Gingivostomatitis herpetica
Jedná se o nejčastější formu primoinfekce. Často se vyskytuje u kojenců a dětí do 6 let věku. Může proběhnout bezpříznakově. Klinicky pozorovatelná stomatitida nastává pouze u 10 % nemocných. Pak jsou v ústech viditelné puchýřky na dásních, jazyku a měkkém patře doprovázené silným sliněním a vysokou horečkou. Komplikací je faringititida. Onemocnění trvá obvykle 7–10 dní37, 38).
Herpes facialis
Jedná se obvykle o rekurentní infekce v oblasti inervace n. trigeminus. Objevují se výsevy na obličeji, velmi často jako herpes labialis nebo herpetická keratitida.
Herpes labialis se projevuje tvorbou drobných puchýřků na rtu, v okolí úst nebo nosu. Je provázen svěděním a bolestí, která po 2–3 dnech ustupuje. Úplné vyhojení nastává do 7 dní37, 39).
Herpetická keratitida se projevuje pálením v očích, ostrou bolestí a světloplachostí. Postiženy mohou být také spojivky. U komplikovaných případů se tvoří neprůsvitné rohovkové léze. V 25–50 % případů je onemocnění chronické a může způsobit trvalé postižení zraku39, 40).
Eczema herpeticatum
Onemocnění se projevuje rozsáhlým výsevem na kůži na podkladě atopické nebo alergické dermatitidy. Vezikuly často splývají a olupují se. Kůže je zanícená a zhrublá. Mohou se vyskytovat horečky a zduření mízních uzlin. Na poškozená místa snadno nasedají sekundární stafylokokové infekce41).
Herpes genitalis
Jedná se o jedno z nejčastějších pohlavně přenášených onemocnění. Jen ve Spojených státech amerických se odhaduje až milion nových případů ročně. Onemocnění způsobuje HSV-2. Projevuje se puchýřky a vřídky na zevním genitálu obou pohlaví, perirektálně a u žen také na cervixu. Kožní projevy provází svědivost, malátnost, anorexie.
Při primoinfekci často dochází ke zduření místních lymfatických žláz. Při reaktivaci bývají léze méně výrazné, ale mohou se často opakovat. Častou komplikací je ascendentní zánět močových cest, který může vést k pyelonefritidě.
Náchylnější k infekci HSV-2 jsou ženy. Toto onemocnění je nebezpečné hlavně pro těhotné ženy, u kterých hrozí přenos viru na dítě42).
Diagnostika
Pro správnou léčbu je nutné správné stanovení infekčního agens. Existují diagnostické metody přímé a nepřímé.
Mezi přímé metody patří kultivace viru na tkáňových kulturách, průkaz virové DNA pomocí polymerasové řetězové reakce (PCR) a imunohistochemický průkaz virových antigenů v otiskových preparátech ze stěrů ulcerací. Vyšetření pomocí PCR je vhodné nejen pro stěry z vezikul, ale také pro jiné klinické materiály, jako je mozkomíšní mok, krev, moč atd.
Nepřímé diagnostické metody stanovují výskyt protilátek IgA, IgG a IgM, druhově i typově specifických. Tím umožňují odlišení nákazy HSV-1 a HSV-242, 43).
Ke stanovení protilátek proti herpes virům se využívají metody ELISA, nepřímá imunofluorescence anebo komplement-fixace. K rozlišení typu herpes viru se využívá ELISA s glykoproteinem G44).
Farmakologická terapie
V terapii herpetických infekcí se v současnosti uplatňuje škála antivirotik (virostatik). Tato léčiva jsou účinná proti herpes simplex virům a také proti ostatním herpes virům (Varicella zoster, virus Epsteina-Baarové, cytomegalovirus)42–44).
Aciklovir
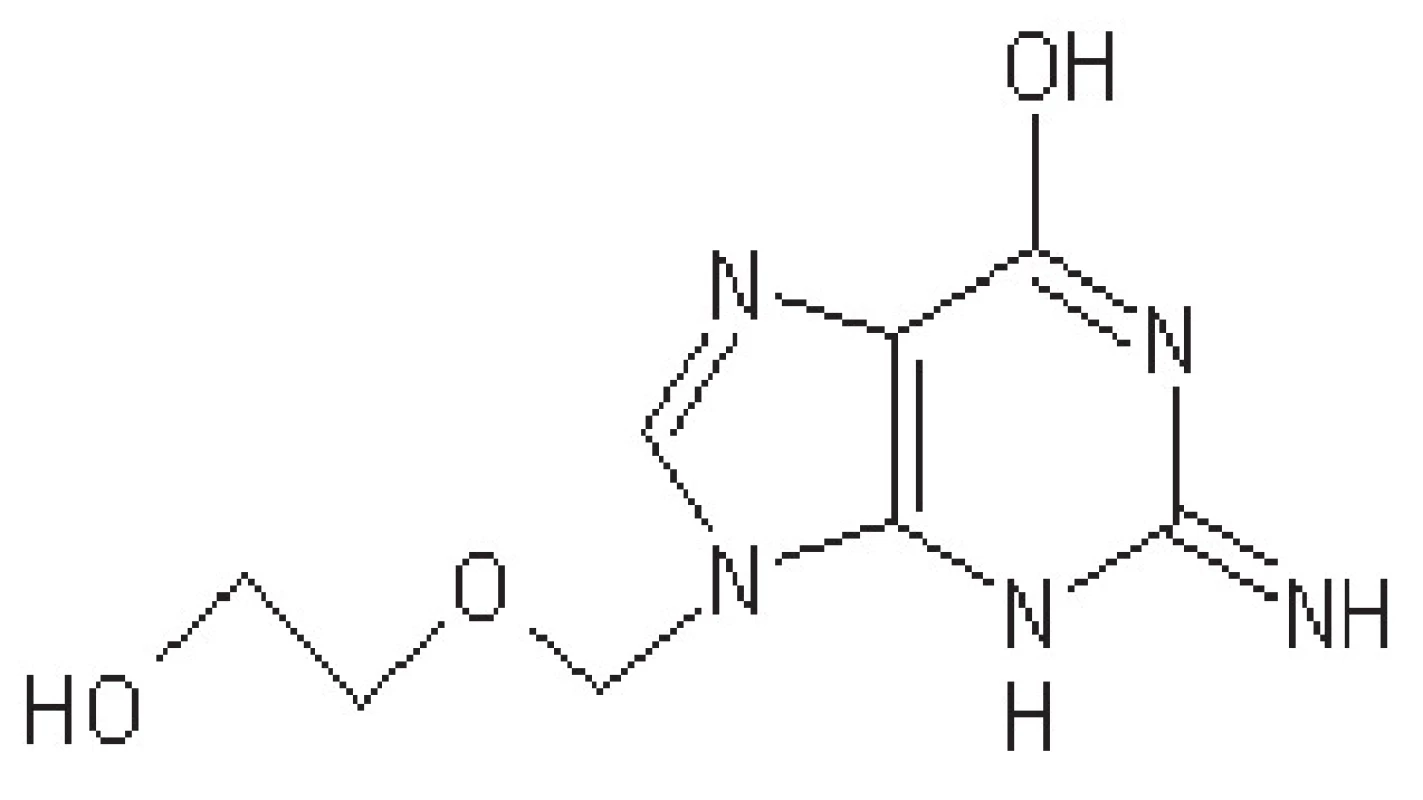
Jedná se o léčivo první volby (obr. 1), jde o guanin-nukleosidový derivát. V nakažené buňce je za pomoci virové thymidinkinasy konvertován na monofosfát, který je dále fosforylován buněčnou kinasou na trifosfát. Tento aktivní metabolit inhibuje replikaci virové DNA kompetitivní inhibicí inkorporace deoxyguanosintrifosfátu do struktury vznikající virové DNA (kompetitivní inhibice DNA-polymerasy), kde navíc působí jako terminátor.
Aciklovir účinkuje pouze v nakažených buňkách. Je tedy vysoce specifický a málo toxický. Mezi nežádoucí účinky patří vyrážka, průjem, snížená funkce ledvin, tromboflebitida, vzácně také dezorientace, halucinace. Aciklovir se užívá ve formě lokální, perorální nebo intravenózní.
Ze střeva je vstřebáván pouze částečně (15–30 %), vazba na bílkoviny krevní plazmy není vysoká (8–20 %)33–36, 45).
Plazmatický poločas je asi 3‒4 hodiny. U pacientů s poruchou funkce ledvin se prodlužuje až na 20 hodin. U dětí je asi 2‒3 hodiny. Vylučuje se nezměněn močí. Obvykle se dávkuje 4‒5x denně v intervalech po 4 hodinách s vynecháním noční dávky, a to při lokálním i perorálním podání. U pacientů se zhoršenou funkcí ledvin je nutné interval prodloužit. Při parenterálním podání se aplikuje 5–10 mg/kg každých 8 hodin. Obvyklá doba léčby je 5–10 dní45, 46).
V cerebrospinální tekutině dosahuje 50 % koncentrace plazmy. Při systémovém podávání přechází do mateřského mléka.
Podávání zlepšuje projevy infekce, snižuje bolestivost, zabraňuje vzniku komplikací a rozvoji postherpetické neuralgie.
Rezistence je způsobena mutací virové DNA-polymerasy nebo thymidinkinasy. V populaci se vyskytuje poměrně vzácně, kolem 0,2 %. Častější (až 6 %) je u imunokomprimovaných pacientů, hlavně při dlouhodobém podávání. Zde je indikován foscarnet45–47).
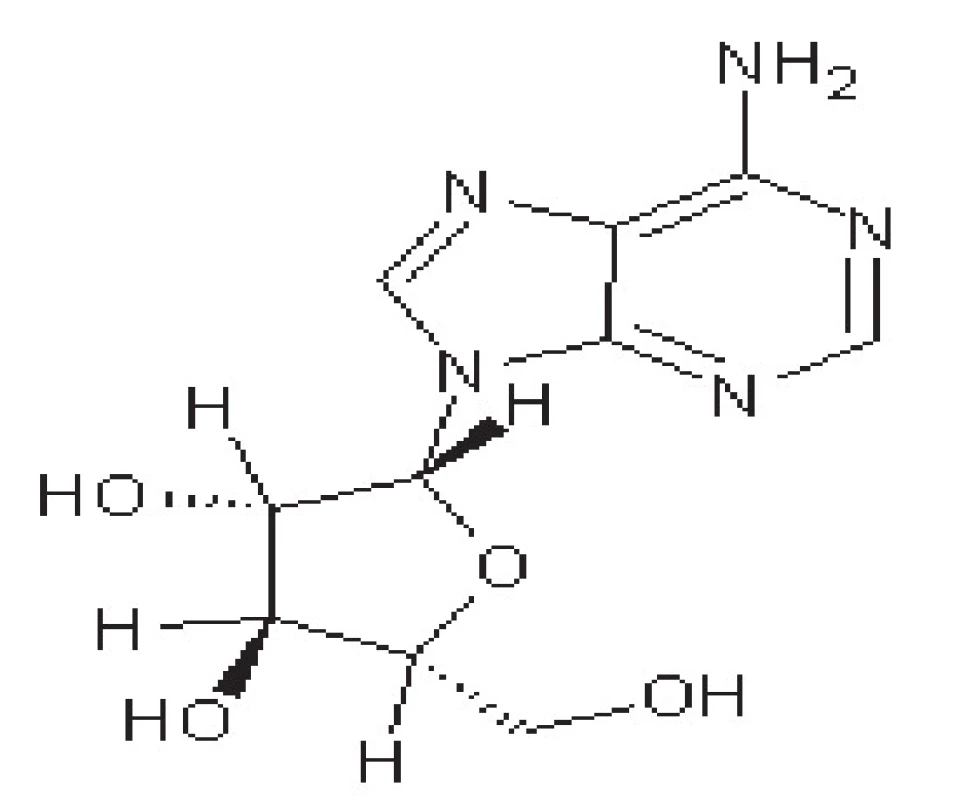
Valaciklovir
Jde o proléčivo, které je v organismu konvertováno na aciklovir (obr. 2). Jedná se o jeho L-valinový ester. Má vyšší biologickou dostupnost při perorálním podání (až 50 %). Biologická dostupnost není snižována jídlem. Obvykle se podává 2x denně v dávkách 500–1000 mg, u imunonekompetentních pacientů se podává 4x denně v dávce až 2000 mg48).
Obr. 2. Struktura valacikloviru 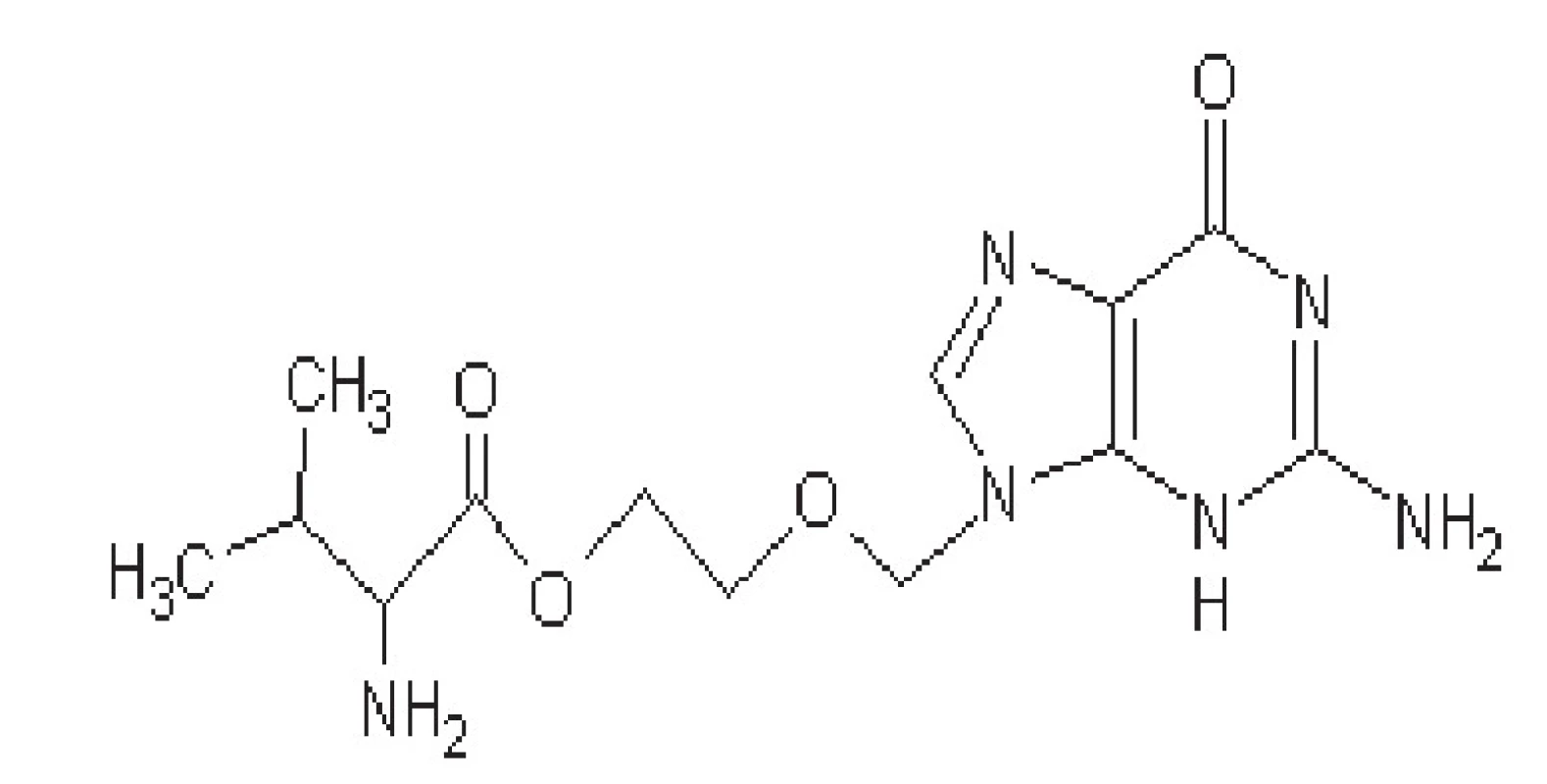
Famciklovir
Famciklovir je proléčivo pencikloviru (obr. 3). Mechanismus účinku je podobný ACV, po konverzi na aktivní penciklovir-trifosfát působí jako kompetitivní inhibitor virové DNA-polymerasy.
Obr. 3. Struktura famcikloviru 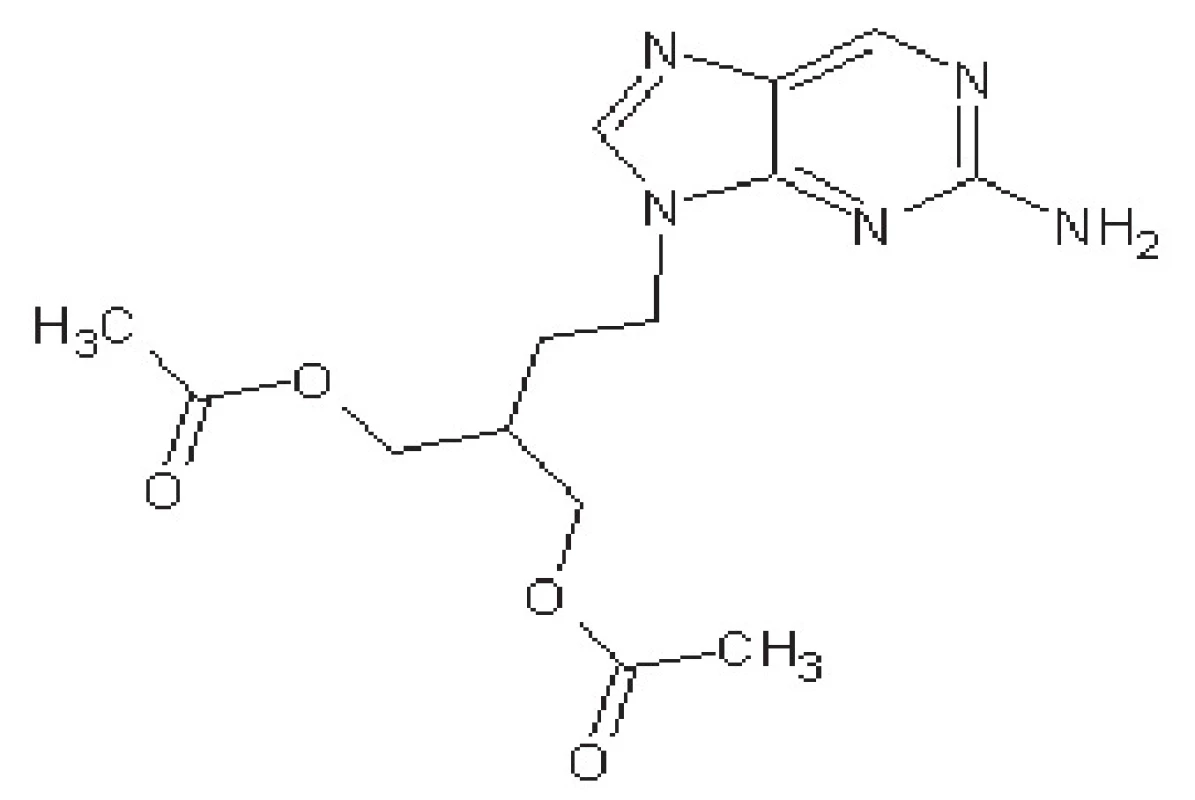
Famciklovir má 80% biologickou dostupnost. Eliminační poločas je stejně dlouhý jako u ACV, ale v buňkách setrvává 7–20 hodin. Proto jej lze podávat pouze 2krát denně.
Používá se převážně pro léčbu genitální infekce a pásového oparu vyvolaného virem Varicella zoster 49).
Vidarabin
Vidarabin je derivát purinu (obr. 4), který v molekule obsahuje místo ribózy arabinózu. Působí proto jako antimetabolit. Po převedení na trifosfát kompetitivně inhibuje DNA-polymerasu. Při parenterálním podání proniká do mozku. Dříve se užíval pro léčbu herpetické encefalitidy, kvůli vysoké toxicitě byl ovšem vytlačen ACV. V současné době se používá se už jen lokálně 50)
Foscarnet
Foscarnet je analog anorganického pyrofosfátu (obr. 5). Nekompetitivně inhibuje virovou DNA-polymerasu a reverzní transkriptasu retrovirů blokádou pyrofosfátového místa těchto enzymů. Používá se u pacientů s HSV infekcí, která je rezistentní k ACV, u imunokomprimovaných osob a u cytomegalovirové infekce u pacientů trpících AIDS.
Podává se intravenózně, nejprve jako bolus a poté v infuzi. Léčivo se hromadí v kostech, proto má dvojí biologický poločas. Primární poločas je 4‒8 hodin, sekundární pak 45‒130 hodin. Eliminován je močí v nezměněné podobě.
Mezi nežádoucí účinky patří hlavně nefrotoxicita, nevolnost, zvracení, bolesti hlavy46–48, 51).
Očkování
Na rozdíl od jiných virových infekcí (např. neštovice, příušnice či zarděnky), které se podařilo díky účinnému očkování téměř vymýtit, neexistují proti HSV účinné vakcíny. Prozatím se jedná pouze o vakcíny ve stadiu vývoje – a nejsou tedy dostupné50).
Dietní opatření
Úprava stravovacích návyků nebo zařazení některých potravních doplňků je vhodné jako prevence nebo podpůrná terapie projevů herpetických infekcí. Mnoho klinických studií prokázalo, že dodáním některých látek, například vitaminů, je možné urychlit léčbu a zmírnit průběh nemoci50, 51).
Lysin/arginin
Proteiny syntetizované herpesviry obsahují více argininu a méně lysinu než bílkoviny hostitele. Arginin je nezbytný pro replikaci viru. Lysin je v mnoha ohledech antagonistou argininu. V lidském těle soupeří o přenašeče ve střevě při vstřebávání, v renálních tubulech při reabsorpci a také o transportéry pro vstup do buňky. Lysin navíc indukuje enzym arginasu, která degraduje arginin. V tkáňových kulturách lysin blokuje působení argininu jako růstového faktoru48–50).
Při klinických studiích bylo prokázáno, že zvýšený příjem lysinu má pozitivní vliv na léčbu a prevenci projevů HSV. Lepších výsledků bylo dosaženo za současného snížení množství argininu v potravě. Vzhledem k rozdílům v absorpci lysinu je dávkování variabilní. Pro 70 kg vážícího člověka je vhodná dávka 800–3000 mg/den52).
Mezi potraviny bohaté na lysin patří luštěniny, droždí, obilné klíčky, mléčné výrobky, ovoce a zelenina, např. avokádo, řepa, mango, rajčata. Snížit by se měla konzumace potravin bohatých na arginin jako obilniny, ořechy nebo čokoláda52, 53).
Vitamin C
Kyselina askorbová in vitro inaktivuje velké množství virů. Podporuje také funkci imunitního systému. Pro léčbu HSV je užívaná už od roku 1936. Vysoké dávky vitaminu C podávané perorálně, parenterálně nebo topicky snižují výskyt lézí a urychlují hojení i u imunokomprimovaných pacientů s AIDS.
Krátkodobě (5‒10 dní) se mohou uplatnit velmi vysoké dávky – až 10 000 mg/den podané v jedné dávce. Pro dlouhodobé preventivní užívání se doporučují dávky 500–3000 mg/den. Účinná se zdá být také kombinace relativně malých množství vitaminu C (200 mg/den) v kombinaci s flavonoidy (hesperidin, kvercetin, rutin), které zlepšují absorpci a využití kyseliny askorbové. Bohatým zdrojem vitaminu C i přírodních flavonoidů je ovoce, zelenina a šípky53, 54).
Zinek
Lokální i perorální podávání zinku vede ke zmírnění příznaků a zkrácení doby léčby. Ionty zinku inhibují replikaci HSV-1 i HSV-2 in vitro při koncentraci 0,1 mM.
Při intravaginálním podání síranu zinečnatého myším se snižuje závažnost infekce. Pro lokální podání u lidí je možné využít síran zinečnatý, glycin s oxidem zinečnatým nebo monoglycerolát zinečnatý. Samotný oxid zinečnatý neuvolňuje dostatek iontů21–23).
Perorální podávání zinku má pozitivní vliv na zkrácení doby léčby. Je vhodné užívat jej v kombinaci s vitaminem C (23 mg + 250 mg) nebo s vitaminy B (50 mg + 5 mg thiaminu + 5 mg riboflavinu). Při dlouhodobé léčbě je vhodné užívat také měď, aby se předcházelo jejímu zinkem vyvolanému nedostatku.
Zdrojem zinku jsou mořské plody, ryby, dýňová semínka, fazole, čočka, celozrnné potraviny53–55).
Úprava stravy může u mnoha lidí výrazně ovlivnit délku trvání a průběh nemoci. Dodáním některých vhodných potravin mohou pacienti předcházet rozvoji lézí. Stejně jako u klasické léčby je vhodné zahájit podávání doplňků stravy co nejdříve, nejlépe při prodromálních příznacích, tedy u prvních pocitů svědění. Čím dřív se léčba zahájí, tím je účinnější.
Mezi vhodné potraviny patří především ovoce a zelenina, které jsou bohatými zdroji vitaminů a minerálů. Naopak nevhodné pro osoby často trpící projevy herpetických infekcí jsou potraviny s vysokým obsahem argininu, jako je bílá mouka a rýže, jídla s vysokým obsahem cukrů a alkohol, který snižuje účinnost vitaminů a zatěžuje metabolismus. Úprava jídelníčku by měla doprovázet i klasickou léčbu HSV53–58).
Závěr
Herpes simplex viry představují celosvětový problém. Infekce každoročně postihuje milionovou populaci dětských i dospělých jedinců. Ve většině případů se jedná o nepříjemné projevy na kůži nebo sliznicích. Tyto viry ovšem působí i závažné infekce CNS, jež mohou ohrozit na životě imunokomprimované pacienty.
Infekce herpetických virů, zejména HSV-2, byla zjištěna jako potencionální rizikový faktor pro infekci HIV. Do současné doby nebyla nalezena žádná účinná profylaktická očkovací vakcína, která by odstranila HSV infekci, zejména kvůli hlavnímu důvodu 0 virové latenci.
Práce si kladla za cíl představit infekci HSV a její typy, seznámit se se současným stavem problematiky a s následnou farmakologickou terapií, či jakou roli má dietní opatření. Navíc pro podporu léčby a prevence výskytu rekurentních infekcí je možné využít úpravu jídelníčku se zařazením vhodných potravin a případně také doplňků stravy.
Střet zájmů: žádný.
Došlo: 23. dubna 2017
Přijato: 21. května 2017
Ing. Sherif T. S. Hassan
Ústav přírodních léčiv,
Veterinární a farmaceutická univerzita FaF
Palackého tř. 1946/1,
612 42 Brno
Katedra aplikované ekologie,
Fakulta životního prostředí,
Česká zemědělská univerzita,
Praha
e-mail: sherif.hassan@seznam.cz
R. Masarčíková
Ústav přírodních léčiv, Veterinární a farmaceutická univerzita FaF,
Brno
M. Šudomová
Muzeum Brněnska, p.o. – Památník písemnictví na Moravě,
Předklášteří
Zdroje
1. Abad M. J., Bermejo P., Gonzales E., Iglesias I., Irurzun A., Carrasco L. Antiviral activity of Bolivian plant extracts. Gen Pharmacol. 1999; 32(4), 499–503.
2. Albiol Matanic V. C., Castilla V. Antiviral activity of antimicrobial cationic peptides against Junin virus and herpes simplex virus. Int J Antimicrob Agents 2004; 23(4), 382–389.
3. Andrighetti-Fröhner C. R., Sincero T. C., da Silva A. C., Savi L. A., Gaido C. M., Bettega J. M., et al. Antiviral evaluation of plants from Brazilian Atlantic Tropical Forest. Fitoterapia 2005; 76(3–4), 374–378.
4. Cardozo F. T., Camelini C. M., Mascarello A., Rossi M. J., Nunes R. J., Barardi C. R., et al. Antiherpetic activity of a sulfated polysaccharide from Agaricus brasiliensis mycelia. Antiviral Res. 2011; 92(1), 108–114.
5. Chattopadhyay K., Ghosh T., Pujol C. A., Carlucci M. J., Damonte E. B., Ray B. Polysaccharides from Gracilaria corticata: Sulfation, chemical characterization and anti-HSV activities. Int J Biol Macromol. 2008; 43(4), 346–351.
6. Debbab A., Aly A. H., Lin W. H., Proksch P. Bioactive compounds from marine bacteria and fungi. Microb. Biotechnol. 2010; (3), 544–563.
7. Duarte M. E., Noseda D. G., Noseda M. D., Tulio S., Pujol C. A., Damonte E. B. Inhibitory effect of sulfated galactans from the marine alga Bostrychia montagnei on herpes simplex virus replication in vitro. Phytomedicine 2001; (8), 53–58.
8. Eo S. K., Kim Y. S., Lee C. K., Han S. S. Possible mode of antiviral activity of acidic protein bound polysaccharide isolated from Ganoderma lucidum on herpes simplex viruses. J. Ethnopharmacol. 2000; 72(3), 475–481.
9. Evans C. M., Kudesia G., McKendrick M. Management of herpesvirus infections. Int J Antimicrob Agents 2013; 42(2), 119–128.
10. Férir G., Petrova M. I., Andrei G., Huskens D., Hoorelbeke B., Snoeck R., et al. The lantibiotic peptide labyrinthopeptin A1 demonstrates broad anti-HIV and anti-HSV activity with potential for microbicidal applications. PLoS One 2013; 8(5), e64010.
11. Field H. J. Persistent herpes simplex virus infection and mechanisms of virus drug resistance. Eur. J. Clin. Microbiol. Infect. Dis. 1989; 8, 671–680.
12. Flowerdew S. E., Wick D., Himmelein S., Horn A. K., Sinicina I., Strupp M., et al. Characterization of neuronal populations in the human trigeminal ganglion and their association with latent herpes simplex virus-1 infection. PLoS One 2013; 8(12), e83603.
13. Frobert E., Burrel S., Ducastelle-Lepretre S., Billaud G., Ader F., et al. Resistance of herpes simplex viruses to acyclovir: An update from a ten-year survey in France. Antiviral Res. 2014; 111C, 36–41.
14. Gu C. Q., Li J. W., Chao F, Jin M, Wang X. W., Shen Z. Q. Isolation, identification and function of a novel anti-HSV-1 protein from Grifola frondosa. Antiviral Res. 2007; 75(3), 250–257.
15. Hamza M. A., Higgins D. M., Ruyechan W. T. Two alphaherpesvirus latency-associated gene products influence calcitonin gene-related peptide levels in rat trigeminal neurons. Neurobiol Dis. 2007; 25(3), 553–560.
16. Hassan S. T. S., Majerová M., Šudomová M., Berchová K. Antibacterial activity of natural compounds – essential oils. Čes. slov. Farm. 2015; 64(6), 243–253.
17. Hassan S. T. S., Masarčíková R., Berchová K. Bioactive natural products with anti–herpes simplex virus properties. J. Pharm. Pharmacol. 2015; 67(10), 1325–1336.
18. Hayashi T., Hayashi K., Maeda M., Kojima I. Calcium spirulan, an inhibitor of enveloped virus replication, from a blue-green alga Spirulina platensis. J. Nat. Prod. 1996; 59(1), 83–87.
19. Hong W., Li T., Song Y., Zhang R., Zeng Z., Han S., et al. Inhibitory activity and mechanism of two scorpion venom peptides against herpes simplex virus type 1. Antiviral Res. 2014; 102, 1–10.
20. Huleihel M., Isanu V. Anti-herpes simplex virus effect of an aqueous extract of propolis. Isr. Med. Assoc. J. 2002; 4(11 Suppl), 923–927.
21. Ichiba T., Corgiat J. M., Scheuer P. J., Kelly-Borges M. 8-Hydroxymanzamine A, a beta-carboline alkaloid from a sponge, Pachypellina sp. J. Nat. Prod. 1994; 57(1), 168–170.
22. Imura K., Chambers J. K., Uchida K., Nomura S., Suzuki S., Nakayama H., Miwa Y. Herpes Simplex Virus Type 1 Infection in Two Pet Marmosets in Japan. J. Vet. Med. Sci. 2014; 76(12), 1667–1670.
23. Jenssen H., Hamill P., Hancock R. E. Peptide Antimicrobial Agents. Clin. Microbiol. Rev. 2006; 19(3), 491–511.
24. Jenssen H. Anti herpes simplex virus activity of lactoferrin/lactoferricin – an example of antiviral activity of antimicrobial protein/peptide. Cell Mol. Life Sci. 2005; 62(24), 3002–3013.
25. Kitazato K., Wang Y., Kobayashi N. Viral infectious disease and natural products with antiviral activity. Drug Discov. Ther. 2007; 1(1), 14–22.
26. Kleymann G. Agents and strategies in development for improved management of herpes simplex virus infection and disease. Expert Opin Investig Drugs 2005; 14(2), 135–161.
27. Kopp S. J., Ralay Ranaivo H., Wilcox D. R., Karaba A. H., Wainwright M. S., Muller W. J. Herpes simplex virus serotype and entry receptor availability alter CNS disease in a mouse model of neonatal HSV. Pediatr. Res. 2014; 8.
28. Levin M. J., Bacon T. H., Leary J. J. Resistance of herpes simplex virus infections to nucleoside analogues in HIV-infected patients. Clin. Infect. Dis. 2004; 39(Suppl 5), S248–257.
29. Mirchandani D., Jawed R., Khawar N., Narula P., John M. Effectiveness of early antiviral therapy in disseminated neonatal herpes simplex virus 2 (HSV–2) with fulminant hepatic failure. Am. J. Case Rep. 2017; 18, 381–385.
30. Li T., Peng T. Traditional Chinese herbal medicine as a source of molecules with antiviral activity. Antiviral Res. 2013; 97(1), 1–9.
31. Mandal P., Pujol C. A., Damonte E. B., Ghosh T., Ray B. Xylans from Scinaia hatei: Structural features, sulfation and anti-HSV activity. Int. J. Biol. Macromol. 2010; 46(2), 173–178.
32. Markham A., Faulds D. Ganciclovir. An update of its therapeutic use in cytomegalovirus infection. Drugs 1994; 48, 455–484.
33. You H., Yuan H., Fu W., Su C., Wang W., Cheng T., Zheng C. Herpes simplex virus type 1 abrogates the antiviral activity of Ch25h via its virion host shutoff protein. Antiviral Res. 2017; 143, 69–73.
34. Newman D., Cragg G. Marine natural products and related compounds in clinical and advanced preclinical trials. J. Nat. Prod. 2004; (67), 1216–1238.
35. Palem J. R., Bedadala G. R., El Sayed K. A., Hsia S. C. Manzamine A as a Novel Inhibitor of Herpes Simplex Virus Type-1 Replication in Cultured Corneal Cells. Planta Med. 2011; 77(1), 46–51.
36. Paludan S. R., Bowie A. G., Horan K. A., Fitzgerald K. A. Recognition of herpesviruses by the innate immune system. Nat. Rev. Immunol. 2011; 11, 143–154.
37. Penesyan A., Kjelleberg S., Egan S. Development of novel drugs from marine surface associated microorganisms. Mar. Drugs 2010; 8(3), 438–459.
38. Perry N. B, Blunt J. W, Munro M. H. G, Thompson A. M. Antiviral and antitumor agents from a New Zealand sponge, Mycale sp. 2. Structures and solution conformations of mycalamides A and B. J. Org. Chem. 1990; 55(1), 223–227.
39. Piret J., Boivin G. Resistance of herpes simplex viruses to nucleoside analogues: mechanisms, prevalence, and management. Antimicrob. Agents Chemother. 2011; 55(2), 459–472.
40. Reusser P. Herpesvirus resistance to antiviral drugs: a review of the mechanisms, clinical importance and therapeutic options. J. Hosp. Infect. 1996; 33(4), 235–248.
41. Bartosová D., Klapácová L., Gruber J. Eczema herpeticum in children: clinical picture and therapy. Cesk Pediatr. 1992; 47(5), 289–292.
42. Sagar S., Kaur M., Minneman K. P. Antiviral Lead Compounds from Marine Sponges. Mar. Drugs 2010; 8(10), 2619–2638.
43. Sakai R., Higa T., Jefford C. W., Bernardinelli G. Manzamine A, a novel antitumor alkaloid from a sponge. J. Am. Chem. Soc. 1986; 108, 6404–6405.
44. Sartori G., Pesarico A. P., Pinton S., Dobrachinski F., Roman S. S., Pauletto F., Junior L. C., Prigol M. Protective effect of brown Brazilian propolis against acute vaginal lesions caused by herpes simplex virus type 2 in mice: involvement of antioxidant and anti-inflammatory mechanisms. Cell Biochem. Funct. 2012; 30(1), 1–10.
45. Schnitzler P., Neuner A., Nolkemper S., Zundel C., Nowack H., Sensch K. H., et al. Antiviral activity and mode of action of propolis extracts and selected compounds. Phytother. Res. 2010; 24(Suppl 1), S20–28.
46. Shannon T. E., Griffin S. L. Managing aggression in global amnesia following herpes simplex virus encephalitis: The case of E. B. Brain Inj. 2014; 19, 1–7.
47. Shestakov A., Jenssen H., Hancock R. E., Nordström I., Eriksson K. Synthetic analogues of bovine bactenecin dodecapeptide reduce herpes simplex virus type 2 infectivity in mice. Antiviral Res. 2013; 100(2), 455–459.
48. Simpson D., Lyseng-Williamson K. A. Famciclovir: a review of its use in herpes zoster and genital and orolabial herpes. Drugs 2006; 66, 2397–2416.
49. Soltan M. M., Zaki A. K. Antiviral screening of forty-two Egyptian medicinal plants. J. Ethnopharmacol. 2009; 126(1), 102–107.
50. Souza T. M., Abrantes J. L., de Epifanio A. R., Leite Fontes C. F., Frugulhetti I. C. The alkaloid 4-methylaaptamine isolated from the sponge Aaptos aaptos impairs Herpes simplex virus type 1 penetration and immediate-early protein synthesis. Planta Med. 2007; 73(3), 200–205.
51. Talarico L. B., Zibetti R. G., Faria P. C., Scolaro L. A., Duarte M. E., Noseda M. D., et al. Anti-herpes simplex virus activity of sulfated galactans from the red seaweeds Gymnogongrus griffithsiae and Cryptonemia crenulata. Int. J. Biol. Macromol. 2004; 34(1–2), 63–71.
52. Tan H. H., Goh C. L. Viral infections affecting the skin in organ transplant recipients: epidemiology and current management strategies. Am. J. Clin. Dermatol. 2006; 7(1), 13–29.
53. Villarreal E. C. Current and potential therapies for the treatment of herpesvirus infections. Prog. Drug Res. 2001; 56, 77–120.
54. Yasin B., Pang M., Turner J. S., Cho Y., Dinh N. N., Waring A. J., et al. Evaluation of the inactivation of infectious herpes simplex virus by host-defense peptides. Eur. J. Clin. Microbiol. Infect. Dis. 2000; 19(3), 187–194.
55. Yeung-Yue K. A., Brentjens M. H., Lee P. C., Tyring S. K. The management of herpes simplex virus infections. Curr. Opin. Infect. Dis. 2002; 15(2), 115–122.
56. Yoosook C., Bunyapraphatsara N., Boonyakiat Y., Kantasuk C. Anti-herpes simplex virus activities of crude water extracts of Thai Medicinal Plants. Phytomedicine 2000; 6(6), 411–419.
57. Hassan S. T. S., Berchová-Bímová K., Petráš J. Plumbagin, a plant-derived compound, exhibits antifungal combinatory effect with amphotericin B against Candida albicans clinical isolates and anti-hepatitis C virus activity. Phytother. Res. 2016; 30(9), 1487–1492.
58. Faulkner D. J. Marine natural products. Nat. Prod. Rep. Nat Prod Rep. 2002; 19(1), 1–48.
Štítky
Farmacie Farmakologie
Článek Nové knihy
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2017 Číslo 3- Přerušovaný půst může mít významná zdravotní rizika
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
- MUDr. Václav Šmíd, Ph.D.: Jaterní fibróza a iniciální stadia cirhózy jsou potenciálně vratné stavy
-
Všechny články tohoto čísla
- Léčiva a lékové formy jako rizikové faktory pro zubní kaz
- Stupeň výskytu syndromu vyhoření u farmaceutů: dílčí studie
- Role nemocničního farmaceuta v managementu astmatu ve Velké Británii
- Vliv vaginálních globulí Melanizol® a Klimedeks® na hladinu glykogenu ve vaginální tkáni potkanů s experimentálně vyvolanou vaginitidou
- XXXIX. pracovní dny Radiofarmaceutické sekce
- Nové knihy
- Infekce viru herpes simplex: přehled problematiky, farmakologická terapie a dietní opatření
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Infekce viru herpes simplex: přehled problematiky, farmakologická terapie a dietní opatření
- Léčiva a lékové formy jako rizikové faktory pro zubní kaz
- Stupeň výskytu syndromu vyhoření u farmaceutů: dílčí studie
- XXXIX. pracovní dny Radiofarmaceutické sekce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání