-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Alzheimerova demence: aspekty současné farmakologické léčby
Alzheimer’s disease: aspects of contemporary pharmacological treatment
Neurodegenerative disorders are highly spread all over the world. It is estimated that 23.5 million people worldwide are suffering from neurodegeneration, and Alzheimer’s disease (AD) is the most frequently occurring one. Owing to the increasing life expectancy, the number of patients is supposed to be increased in the next decades. The disease is atrophic-degenerative disorders affecting the brain. Although the etiology of AD is unknown, several interrelated causes are being considered: the loss of the cholinergic system, an amyloid plaque and an amyloid precursor, tau protein, excitotoxicity and other risk factors. The symptomatic manifestations of AD are the disruption of the cognitive function including aphasia, apraxia and agnosia. Today, several registered drugs for the treatment of AD (donepezil, rivastigmine, galantamine and memantine) are in use, but the treatment is not able to resolve or slow down degeneration. In this paper, the authors summarize the available pharmacotherapy and outline an opportunity in the treatment of AD in ongoing clinical studies (etanercept, methylthionium chloride and huperzine). Some nontraditional procedures which are expected to help patients to join common life situation are described at the end of the paper.
Key words:
Alzheimer’s disease – acetylcholinesterase – donepezil – rivastigmine – galantamine – memantine
Autoři: Lucie Drtinová; Miroslav Pohanka
Působiště autorů: Univerzita Obrany v Brně, Fakulta vojenského zdravotnictví Hradec Králové
Vyšlo v časopise: Čes. slov. Farm., 2011; 60, 219-228
Kategorie: Přehledy a odborná sdělení
Souhrn
V současné době se odhaduje, že nějakou formou demence trpí asi 23,5 milionů obyvatel světa, z toho většina právě Alzheimerovou chorobou. Předpokládá se, že v příštích desetiletí počet nemocných zvýší v závislosti na vzrůstající délce života populace. Jedná se o atroficko-degenerativní onemocnění postihující mozek. Ačkoliv vlastní vznik Alzheimerovy choroby není dodnes známý, uvažuje se o několika navzájem souvisejících příčinách: ztráta cholinergního systému, amyloidní plak a amyloidní prekurzor, tau protein, excitotoxicita a další rizikové faktory. Symptomatickými projevy Alzheimerovy choroby je narušení kognitivních funkcí, mezi něž patří afázie, apraxie a agnózie. V dnešní době používáme několik registrovaných léčivých přípravků v léčbě Alzheimerovy choroby (donepezil, rivastigmin, galantamin a memantin), nicméně tato léčba je především symptomatická. Cílem tohoto článku je shrnout dostupnou farmakoterapii a nastínit možnosti léčby Alzheimerovy choroby léčivy v probíhajících klinických studiích (etanercept, methylthionium chlorid a huperzin). Dále chceme zmínit některé netradiční postupy, které pacientům pomáhají se zapojovat do běžných životních situací.
Klíčová slova:
Alzheimerova choroba – acetylcholinesterasa – donepezil – rivastigmin – galantamin – memantinÚvod
Alzehimerova choroba (Alzheimer’s disease – AD) patří mezi atroficko-degenerativní choroby. Celosvětově se jedná o nejčastější formu demence. Například v České republice je odhadováno, že touto chorobou trpí přibližně 123 194 obyvatel1). V Evropské unii je to pak 6 milionů a odhaduje se, že v příštích 20 letech se až zdvojnásobí2), v USA téměř 5 milionů3) a v Japonsku jsou to další 2 miliony obyvatel starších 65 let4). Odhaduje se, že zastoupení nemocných v populaci nadále poroste, a to především v souvislosti s čím dál tím větším stárnutím populace. Alzheimerova demence je nepředvídatelná choroba, jejíž etiologie není dodnes známa, a která končí po 3–10 letech od stanovení diagnózy letálně5). Současná farmakoterapie a poskytování základní domácí péče je nejen značně nákladná, ale hlavně nám neumožňuje pacienta vyléčit, nýbrž jen oddálit stadium těžké demence, kdy je pacient již nesoběstačný. Na druhou stranu léčba zvyšuje nároky pacienta na kvalitu života QOL (Quality of life).
Etiologie, excitotoxicita, tau protein a amyloidní prekurzor
Ačkoliv není vznik AD jasný, podle histologických nálezu v lidském mozku jsou předpokládány tři hlavní možné způsoby vzniku AD.
Progredující ztráta cholinergního systému
Prvním z nich je nejstarší hypotéza o porušeném cholinergním přenosu signálu a ubýváním (tvorba i výdej) samotného neurotransmiteru acetylcholinu (ACh). Cholinergní přenos bývá u AD postižený jako první. Dále je pak sledován úbytek cholinergních jader v entorinární kůře, hipokampech a přilehlých oblastech temporální kůry. Relativně neporušena však zůstává inervace ve striatu a thalamu. Z toho se dá usoudit, že cholinergní léze nejsou tedy u AD generalizované, nýbrž regionálně selektivní. Správná funkce cholinergního systému mozku je nezbytná pro schopnost učit se, pro krátkodobou paměť, vyjadřovat se a také pro zachování osobnosti. Možností jak udržet dostatečnou hladinu ACh je podávat nemocnému inhibitory cholinesteras, které prodlouží poločas Ach v cholinergních neurosynapsích. Navíc bylo prokázáno, že cholinergní dysfunkce se jeví jako potenciální původce generalizovaného zánětů mozku6).
Beta amyloid a amyloidní plak
Beta amyloid je peptid, který se hromadí v mozkové tkáni, a jeho svinutím se tvoří amyloidní plak. Vznikající amyloidní ložiska znesnadňují výživu jednotlivých částí mozku. Za původce amyloidního plaku se považován prekurzor amyloidového proteinu (APP). Tento prekurzorový protein je ukotven v membráně a je enzymaticky štěpen sekretasami. Ve zdravém mozku je přednostně APP štěpen α-sekretasou, která z membrány uvolňuje rozpustnou složku APPsα s neuroprotektivní funkcí7). Ta část z APP, která zůstala v membráně, zase pozitivně ovlivňuje aktivitu jiných genů. Existují však ještě dva typy sekretas, a to ß-sekretasa (BACE) a γ-sekretasa. BACE stejně jako α-sekretasa, uvolňuje z APP protein APPsß. Tento protein je menší než neuroprotektivní protein uvolňovaný α-sekretasou. Po rozštěpení proteinu zůstane větší část APP proteinu lokalizovaná v membráně, která následně může být štěpena γ-sekretasou. γ-sekretasa odštěpuje peptidy tvořené 36–43 aminokyselinami, tzv. beta amyloidy Aß1–40 Aß1–428). U amyloidů beta, a to především u Aß1–42, dochází k chybnému stočení, další polymerizaci a ukládají se do mozkových cév, kde se následně vytváří amyloidní plak.
Jedním z dalších v současné době diskutovaných faktorů, které se nejspíš podílejí na ukládání amyloidu je vyšší hladina cholesterolu a s ní spojená projekce aterosklerózy9). Přenašečem pro cholesterol je apolipoprotein E vyskytující se v různých izoformách. Předpokládá se, že apolipoprotein E hraje roli v metabolismu beta amyloidu. Podle jedné literárně zveřejněné meta-analýzy, která zkoumala roli dědičné APO-E eta-izoformy, je pravděpodobnost projevu AD 3,2× větší u bílé populace a 2,2× u hispánské populace než u ostatních zástupců těchto populací bez eta-izoformy. Tato meta-analýza zahrnovala 5930 probandů s AD a 8607 probandů bez diagnostikované AD10). Také se uvažuje o tom, zda apolipoprotein E nezpůsobuje progresi AD v dřívějším věku11). Zde se diskutuje o možném riziku u pacientů s vysokým cholesterolem a počínající aterosklerózou.
Tau protein a excitotoxicita
Jedná se o protein, který je kódovaný na 17. chromozomu a v mozku se nachází až 6 izoforem tau proteinu. Zdravé neurony obsahují normální tau protein. Tento protein se podílí na stabilizaci mikrotubulů a udržuje celkovou stavbu neuronálního cytoskeletu. Normální tau protein vznikl fosforylací, problém však nastane, pokud dojde k hyperfosforylaci. Vzniklé fragmenty působí neurotoxicky. Z důvodu hyperfosforylace se začne tvořit abnormální helikální konformace tau proteinu12). Dochází k agregaci nerozpustného abnormálního tau proteinu do tzv. neurofibrilárních klubek. Následně kolabují mikrotubuly a je vážně narušen axonální transport. Následuje apoptický zánik neuronů, a tím se podstatně zhoršuje průběh onemocnění.
Excitotoxicita je patologický proces, který může zásadním způsobem ovlivnit homeostázu nervových buněk. Tento proces je způsoben nadměrnou stimulací nervové membrány neurotransmitery (glutamát a látky jemu podobné). Na excitotoxicitě se podílejí tři základní možné mechanismy poškození: natrium-dependentní, kalcium-dependentní a glutamátová excitotoxicita.
Natrium-dependentní excitotoxicita je spojená s aktivací napěťově řízeného iontového receptoru AMPA/KA, při které dochází k influxu Na+ do buňky. Tato depolarizace a influx iontů způsobí celkovou depolarizaci nervové buňky. Masivní vstup Na+ do nervové buňky je následován pasivním přestupem Cl- k zachování rovnováhy13). V nervové buňce vzniká osmotický gradient, po kterém se do nitra buňky dostává voda, dochází k zvětšení objemu buňky a k nevratnému poškození organel. Tato osmotická excitotoxicita je reverzibilní, pokud je odstraněn stimul a nedojde k cytolýze buňky14).
Kalcium-dependentní excitotoxicita vzniká na základě aktivace napěťově řízených kalciových receptorů. V rámci aktivace se dostává extracelulární Ca2+ do buňky. V dalším případě dochází k aktivaci NMDA receptoru glutamátem, přerušení aktivity sodno-kalciového výměníku a zvýšení intracelulární koncentrace Ca2+. Excitotoxicita je tedy indukovaná nadměrným influxem Ca2+ přes NMDA receptor, aktivací proteinkinas a následnou expresí nežádoucích genů. To vede ke zvýšené apoptóze a k zániku neuronů. Tento mechanismus je v současné době považován za jednu z hlavních příčin vzniku AD15).
Rizikové faktory rozvoje AD
S narůstajícím věkem vzrůstá incidence AD. Tomu odpovídá studie vedená týmem dr. Gurlanda, která byla zaměřena na tři etnické skupiny (bílá, afroamerická a hispánská populace). Vědecký tým u těchto etnik zjišťoval možnou incidenci výskytu AD v závislosti na věku rozdělenou do tří skupin (65–74, 75–84 a 85+). V první věkové skupině 65–74 let byl výskyt AD poměrně nízký, a to u všech třech etnik. Trojnásobný nárůst výskytu byl zaznamenán u druhé skupiny odpovídající věku 75–84 let. Studie prokázala, že hispánská populace je náchylnější k vyšší incidenci AD, a to až 27,9 %. U poslední skupiny populace od 85 let a výše byl prokázán několikanásobný nárůst výskytu AD, a to u všech tří etnických skupin (bílá populace 30,2 %, afroamerická populace 58,6 % a neindisponovanější je hispánská populace 62,9 %), které byly sledovány16).
Další studie udává, že estrogen uvolňuje ACh, a tudíž působí neuroprotektivně. Při substituční terapii estrogenem bylo podle této studie sníženo riziko výskytu AD až o 60,2 %17). Dá se tedy předpokládat určitá závislost na pohlaví. Ženy před menopauzou mají snížené riziko incidence. Po přechodu se toto riziko zvětšuje až dvojnásobně. Tomu odpovídá i studie ADAMS (The aging, demographics and memory study), kde je uveřejněno, že větší procento nemocných jsou ženy. Tato studie však ještě zmiňuje fakt, že se ženy dožívají vyššího věku než muži, a i proto je procento výskytu AD u žen vyšší18).
Z dalších možných rizik se uvažuje dědičnost, možné snížené riziko u alespoň středoškolsky vzdělané populace, riziko kouření spojené s progresí aterosklerózy, abúzus alkoholu, dále to může být i poranění hlavy (udává se až 2× větší výskyt AD u lidí s traumatem hlavy), zdraví (vysoký krevní tlak, cholesterol a lipidy). K možným rizikům způsobujících AD je oxidativní stres vyvolaný chronickými záněty a infekcemi, sníženou imunitou, autoimunitním onemocněním, sklon k metabolickým poruchám, sklonem k hormonálním poruchám a nízká hladina antioxidantů v krvi.
Symptomy Alzheimerovy choroby
Počátky AD se u pacientů různí stejně tak, jako je každý pacient jedinečný. Neexistuje tedy šablona, podle které se dá ihned s určitostí toto onemocnění rozpoznat. Přesto jedním z prvních symptomů, který se objevuje téměř u všech pacientů, je špatné pamatování si nových informací, se kterými se pacient setkává v běžném denním režimu.
Symptomatickými projevy AD jsou narušení kognitivních funkcí mezi něž patří afázie (porucha tvorby a porozumění řeči), apraxie (neschopnost vykonávat složitější a účelné pohyby, např. obout se, odemknout dveře, přičemž vlastní hybnost porušena není), agnózie (neschopnost poznávat a interpretovat smyslové vjemy, přičemž opět není poškozené smyslové ústrojí s příslušnými nervy). Mění se také schopnost rozhodování o sobě samém a pacient bývá často nedůtklivý. Jeho rodina si všímá velmi nápadných změn v jeho osobnosti. Tato choroba postihuje tedy nejen pacienta, ale i jeho blízké okolí. Z předchozího vyplývá, že je nemocný značně omezen v běžných denních aktivitách. Tyto poruchy chování jsou způsobeny především úbytkem ACh, cholinacetyltrasferasy (ChAT) a samotných cholinergních drah. V neposlední řadě je třeba zmínit, že AD vede nejenom k chátrání duše, ale i těla, v důsledku čehož zkracuje očekávanou délku života.
Diagnostika AD
Diagnostika demence je velice komplikovaná a je při ní třeba zohlednit více faktorů. V současnosti se používají tři základní diagnostická kritéria. Mezi ně patří Mezinárodní klasifikace nemoci – verze 10 (MKN-10), Diagnostický a statistický manuál duševních poruch, 4. vydání (DSM-IV) definovaný Americkou psychiatrickou asociací a posledním kritériem je Národní institut pro neurologické poruchy, pro poruchy komunikace a cévní mozkové příhody (CMP) kritéria Asociace pro Alzheimerovu nemoc a související poruchy (NINCDS//ADRDA) definovaná McKhannem19). Existují však i některé jednoduché testy, které mohou na poruchu kognitivních funkcí upozornit.
MMSE je zkratka pro Mini-Mental State Examination a je současným standardem k hodnocení kognitivního postižení20). Odborně česky test kognitivních funkcí, v tomto testu se zkouší paměťové a další funkce mozku vzhledem k možné demenci. Test obsahuje 10 úkolů (orientace, zapamatování, pozornost a počítání, vybavování, pojmenovávání předmětů, opakování, stupňovaný příkaz, čtení a plnění úkolu, psaní a obkreslování). Za jednotlivé splněné úkoly jsou pacientovi přičítány body s maximem 30 bodů. Hodnotící škála je dána bodovým rozmezím, přičemž 3027 bodů značí normální stav, 2625 bodů hraniční nález, 2410 bodů patologický nález mírné až středně těžké demence, 106 bodů střední až těžká demence a skóre 6 a méně bodů svědčí o těžké demenci. Součástí tohoto testu je i tzv. hodinový test (Clock Drawing Test, CDT). V CDT dáme pacientovi nakreslit ciferník se všemi náležitostmi včetně udaného času. Někteří pacienti s normálním testem MMSE v CDT úplně selhávají. Na CDT testujeme vizospaciální dysfunkce, které mohou být prvním kognitivním nedostatkem u počínajícího AD. Mezi další testy prováděné v ambulanci na rozpoznání kognitivních dysfunkcí patří Rey-Osterriethova komplexní figura, Brief Cognitive rating Scale (BCRS) a Global Deterioration Scale (GDS).
K diagnostickým metodám patří i testy určující samostatnost pacienta v běžných denních činnostech. Mezi tyto testy patří test Disability Assessment for Dementia (DAD). Test slouží k ohodnocení schopností provádět běžné aktivity denního života. Tyto schopnosti se při poruše kognitivních funkcí (například při demenci) výrazně mění. V dotazníku se lékař vyptává pacienta například na osobní hygienu, kontingenci, oblékání, jedení, telefonování, placení, chození na procházky, přípravu jídel, užívání léků, volný čas a zvládnutí alespoň některých domácích činností21). Z dalších může být použit dotazník Functional Assessment Staging (FAST) nebo Bristol Acivities of Living Scale (BADL).
Všechny výše zmíněné testy se používají v ambulancích psychiatrů, neurologů a geriatrů. V praxi nejpoužívanějším testem je test MMSE. Prvenství má pro svou časovou náročnost a hlavně také proto, že se od výsledků toho to testu odvíjí farmakoterapie hrazená pojišťovnou. A však díky své nedostatečnosti se u lékařů netěší velké oblibě. Na jeho místo upřednostňují Addenbrookský kognitivní test, který je obsáhlejší (zahrnuje i test MMSE) a daleko přesněji určuje diagnózu. Skládá se z 18 otázek zaměřených na pozornost a orientaci, pozornost při počítání, paměť, slovní produkci, jazyk (psaní, porozumění, pojmenování) a zrakovou-prostorovou orientaci. Jedná se tedy o komplexnější test, ale u nás se běžně neprovádí.
Závěrem diagnostikování by se dalo říci, že u nemocného, který v MMSE testu získá méně než 20 bodů, je vysoce pravděpodobný výskyt neurodegenerativního onemocnění. Diagnóza může být upřesněna podrobnějšími neuropsychologickými testy, případně rozborem vzorku mozkomíšního moku, pozitronovou emisní tomografií, genetickými testy, magnetickou rezonanční volumometrií a dalšími instrumentálními diagnostickými metodami.
Účelná farmakoterapie AD léčivy
Jsou to látky, které prokazatelně zpomalují průběh choroby. Jejich užití je tedy racionální, založené na důkazech získaných z kvalitních, dvojitě zaslepených, placebem kontrolovaných studií. Současná používaná léčiva jsou shrnuta v tabulce 1.
Tab. 1. Přehled registrovaných léčivých přípravků v České republice používaných při léčbě AD (čerpáno z <SUP>21–26)</SUP>) 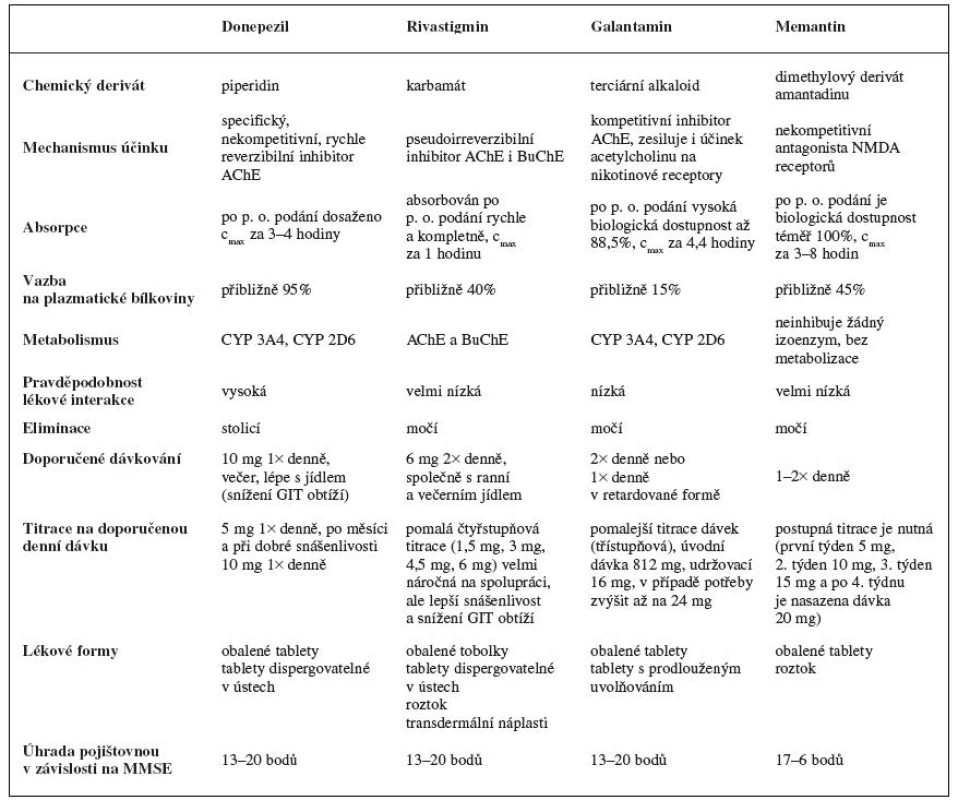
Inhibitory cholinesteras (IChE)
IChE užívané u AD musí dobře pronikat hematoencefalickou bariérou a inhibovat AChE v mozku více než AChE v srdci, střevě nebo neuromuskulární ploténce. Pomalejší odbourávání ACh zvyšuje jeho koncentraci v synaptické štěrbině, a tím se upravuje cholinergní přenos na nervových synapsích v CNS. Mechanismus účinku IChE tedy zasahuje do tvorby i toxicity beta-amyloidu, a brzdí tak neurodegenerativní mechanismy.
Od podávání IChE nelze očekávat vyléčení demence ani dlouhodobé podstatné zlepšení. Hlavní účinek této skupiny léčiv spočívá ve zpomalení demence a v oddálení těžkých stádií nemoci (a to o 2 roky), u některých nemocných se hovoří o delší době22). Prodlužují především období soběstačnosti, běžných denních aktivit a snižují tím zátěž rodiny v péči o takto postiženého pacienta.
V České republice indikaci IChE určuje psychiatr, neurolog a nebo geriatr. Z prostředků zdravotního pojištění je v současnosti hrazena léčba IChE u pacientů mající hodnoty testu MMSE v rozmezí 1320 bodů. Užití léčiv mimo tyto hodnoty (jak nižší, tak vyšší) je možné, ale pacient si musí veškeré náklady na léčbu plně hradit sám. V počátku dávkovacího schématu dochází k přechodnému zlepšení kognitivních funkcí pacienta, které trvá obvykle od 6 do 12 měsíců a pak poklesne na původní hodnotu před podáváním IChE. V léčbě se pokračuje, pokud skóre MMSE v čtvrtletních intervalech setrvává nebo poklesne nejvýše o 2 body a celkově nepoklesne pod 13 bodů. Pokud však dojde ke zlepšení testu nad 20 bodů, musí být léčba vysazena nebo pak hrazena samotným pacientem. Léčba IChE je účinná u 50 % nemocných a používá se u lehkých a středně těžkých forem demence.
Mezi nejčastější nežádoucí účinky patří nevolnost, zvracení, nechutenství a závratě způsobené mírně zvýšenou cholinergní aktivitou v zažívacím ústrojí. Dávkovací schéma se obvykle zahajuje nízkými dávkami, které jsou velmi pomalu titrovány, a doporučuje se užívat po jídle k zmírnění zažívacích obtíží.
Zvýšená opatrnost při užívání je věnována pacientům s bronchiálním astmatem, chronickou obstrukční plicní nemocí a selháváním srdce (nebo podávat současně bradykardizující léky). Kontraindikované jsou potom při poruchách síňokomorového vedení a aktivní gastroduodenální vředové choroby.
Donepezil
Jedná se například o tyto léčivé přípravky, jejichž obchodní názvy zveřejňuje Státní ústav pro kontrolu léčiv (SÚKL) www.sukl.cz: Adonep, Alzhedon, Alzil, Apo-donepezil, Aricept, Calofra, Dobedipil, Donepezil +pharma, Donepezil Accond, Donepezil Actavis, Donepezil Bluefish, Donepezil Mylan, Donepezil ORION, Donepezil Sandoz, Donepezil-ratiopharm, Donpethon, Dospilin, Landex, Promemore, Tolerdilan, Yasnal.
Všechna tato léčiva jsou dostupná ve dvou lékových formách (obalené tablety a tablety dispergovatelné v ústech) a ve dvou sílách (5 a 10 mg).
Donepezil je specifický reverzibilní inhibitor AChE a snižuje tak degradaci ACh v mozku. Zkoušky in vitro ukázaly, že je donepezil 1000× silnějším inhibitorem AChE než BuChE, která převládá mimo centrální soustavu.
Donepezil je po perorálním podání rychle absorbován a maximální plazmatické koncentrace je dosaženo za 3 až 4 hodiny. Jídlo absorpci neovlivňuje a už po třech týdnech léčby se dosahuje ustálených plazmatických hodnot. Po absorbci se 95% donepezilu se váže na plazmatické bílkoviny23).
Donepezil je metabolizován v játrech na cytochromu P450, přesněji na izoenzymech 3A4 a 2D6, čímž se vyskytuje vysoká možnost lékových interakcí. Jeho poločas eliminace je 70 hodin, nicméně jeho distribuce v různých tělesných tkáních nebyla studována. Jenže hodnoty v hmotnostně bilančních studiích na zdravých mužských probandech, po podání 5 mg C14 značeného donepezilu, bylo 28 % zbývající dávky vyloučeno po 240 hodinách. To znamená, že donepezil a jeho metabolity mohou v těle přetrvávat více než 10 dní.
Rivastigmin
Dle SÚKL registrováno pod názvy: Evertas, Exelon, Ivagalmin, Restipon, Nimvastid, Prometax, Ristidic, Rivastigmin + pharma, Rivastigmin apotex, Rivastigmin mylan, Rivastigmin-orion, Rivastigmin pliva, Rivastigmin synthon, Rivastigmin synthin hispania, Rivastigmin teva, Rivastigmin ratiopharm, Rivastigmin pharma, Rivastigmine hexal, Rivastigmin sandoz, Vastigmex.
Léčiva s rivastigminem jsou dostupná ve čtyřech lékových formách v několika sílách, a to jako obalené tobolky 1,5; 3; 4,5; 6 mg, tablety dispergovatelné v ústech 3; 4,5; 6 mg, roztok 2 mg/ml, transdermální náplati 4,6; 9,6 mg/24 hod.
Rivastigmin je inhibitor AChE i BuChE karbamátového typu, který zajišťuje lepší cholinergní přenos tím, že zpomaluje degradaci ACh uvolněného na nervové synapsi. Může zlepšovat poruchy kognitivních funkcí, které jsou spojené s deficitem cholinergního přenosu u Alzheimerovy i Parkinsonovy choroby24).
Rivastigmin se vstřebává rychle a kompletně, plazmatické koncentrace jsou dosaženy přibližně za jednu hodinu. Rivastigmin velice dobře interaguje s cílovým enzymem, a tudíž je biologická dostupnost asi 2× vyšší než se očekávalo. Při podání s jídlem se vstřebávání zpomaluje přibližně o 90 minut. Na bílkoviny se váže asi 40 % podané dávky, snadno přechází přes hematoencefalickou bariéru.
Podléhá rychlému a rozsáhlému metabolismu, primárně hydrolýzou prostřednictvím AChE na dekarbamylovaný metabolit. Z toho vyplývá, že nezměněný rivastigmin se v moči nenachází a vylučování metabolitů močí představuje hlavní cestu eliminace. Do 24 hodin se vyloučí více než 90 % podané látky a méně než 1 % se vyloučí stolicí.
Galantamin
Názvy u nás registrovaných léčivých přípravků podle SÚKL: Apo-galant 8; 12 mg, Galantamin-teva 4; 8; 12 mg, Reminyl 8; 16; 24 mg, Galantamin mylan 8 mg.
První dva léčivé přípravky jsou v lékové formě obalené tablety a další dvě jsou tobolky s prodlouženým uvolňováním.
Jedná se o terciární alkaloid, který je selektivním, kompetitivním inhibitorem AChE. Galantamin mimo jiné také zesiluje účinek ACh na nikotinové receptory, a to nejspíše vazbou na alosterické místo receptoru. Díky této vlastnosti dochází u pacientů s AD zvýšené aktivity cholinergního přenosu a zlepšení kognitivních funkcí.
Absolutní biologická dostupnost galantaminu po perorální podání je vysoká kolem 88,5 %. Vazba na plazmatické bílkoviny je nízká. Potrava prodlužuje vstřebávání o necelých 30 minut. Galantamin je parciálně metabolizován různými cytochromy, zejména CYP2D6 a CYP3A4. To znamená, že je až 75 % galantaminu eliminováno metabolizací. V in vitro studiích se uvádí, že CYP2D6 se podílí na tvorbě O-desmethylgalantaminu a CYP3A4 na tvorbě N-oxid-galantaminu. Pokud se tedy jedná o hlavní formy lidského cytochromu P450, byl ve studiích in vitro prokázán velmi nízký inhibiční potenciál galantaminu25).
Plazmatické koncentrace klesají s výsledným poločasem přibližně 8–10 hodin u zdravých jedinců po intravenózním podání. Po perorálním podání se 18–22 % dávky vyloučilo jako galantamin v nezměněné podobě do moči během 24 hodin. Testování s 3H značeným galantaminem ukázalo, že 7 dní po jednorázové perorální dávce 4 mg bylo 90–97 % radioaktivity zjištěno v moči a 2,2–6,3 % ve stolici.
Antagonisté N-methyl-D-aspartátových receptorů
Memantin
Dostupné v České republice pod obchodními názvy získanými ze SÚKL: Axura 10, 20 a kombinace 5 + 10 + 15 + 20 mg, Ebixa 10, 20 a kombinace 5 + 10 + 15 + 20 mg.
Memantin je dimethylovým derivátem amantadinu. Účinkuje jako nekompetitivní antagonista N-methyl-D--aspartátových (NMDA) receptorů. Brání nadměrnému vstupu Ca2+ do nitra buněk, a tím potlačuje excitotoxické poškození neuronů v CNS a inhibuje indukci apoptózy. Glutamát je hlavním excitačním neurotransmitérem, který umožňuje přenos až na 60 % synapsích v mozku. Mimo jiné též snižuje tvorbu beta-amyloidu a tau proteinu. Za fyziologických podmínek glutamát ovlivňuje schopnost učení se a zlepšuje paměť.
Memantin je kompletně absorbován z trávicího traktu a vyznačuje se vysokou biologickou dostupností. Podání léku není závislé na jídle. Maximálních plazmatických koncentrací dosahuje za 3–8 hodin po podání. Je odhadováno, že 45 % cirkulujícího memantinu je vázáno na plazmatické bílkoviny26). Rychle prostupuje hematoencefalickou membránou, a to většinou do 30 minut od podání.
Tato látka se téměř nemetabolizuje a vylučuje se jí 80 % v nezměněné podobě močí. Vylučovací poločas je udáván mezi 60–100 hodinami. Zvýšení alkalizace moče snižuje vylučování memantinu až devítinásobně27). Memantin neinhibuje žádný z jaterních CYP izoenzymů.
Memantin je podle dosud provedených studií indikován pro léčbu středně těžkých a těžkých forem AD. V dnešní době se však široce diskutuje teorie, že pokud se zastaví poškození mozku excitotoxitou v začátku nemoci, lze zmírnit celkové následky. Aplikace memantinu u pacientů s lehkou formou demence tedy může celkově oddálit stav, kdy se pacient o sebe již nedokáže sám postarat28). Problém je však v jejich úhradě pojišťovnou. Memantin předepisuje neurolog, psychiatr nebo geriatr.
Jak už bylo zmíněno výše, úhrada za léčivé přípravky pro léčení AD je regulována testem MMSE. V současnosti je od zdravotních pojišťoven požadováno rozmezí MMSE od 6–17 bodů, aby byla léčba pacientovy částečně hrazena z prostředků veřejného pojištění. I přes zjištěný fakt, že ve veliké míře prospívá memantin pacientům s diagnostikovanou lehkou demencí, není pro tuto skupinu nemocných lék hrazen. Pokud si pacient přeje být léčen memantinem, musí si všechny náklady na léčbu s ním spojenou hradit z vlastních prostředků.
Memantin se podává jedenkrát denně, nezávisle na jídle a pokud možno ve stejnou denní dobu. Pro snížení nežádoucích účinků této látky je důležitá pomalá titrace až na dávku 20 mg. Postupuje se od 5 mg první týden, 10 mg druhý týden atd. až do dávky 20 mg memantinu v jedné denní dávce. V případě ledvinové insuficience je třeba podávanou dávku snížit na polovinu.
Mezi nejčastější nežádoucí účinky patří nespavost, nebo časté usínání v krátkých periodách, netečnost, závratě, hypertenze. Méně často se objevují potíže s dechem, zácpa a bolesti hlavy.
Nootropika (EGb 761, piracetam, pyritinol, lecithin)
Nootropika jsou látky, které zlepšují činnost mozku a jeho metabolismus. Příznivě působí také na metabolismus neuronů, na využití kyslíku (mají antihypoxický účinek), uvádí se, že zlepšují reologické vlastnosti krve, působí vazodilatačně a mají schopnost likvidovat volné kyslíkové radikály. Nootropika se používají u poruch vědomí, které se projevují jako poruchy pozornosti nebo paměti. Mezi příčiny těchto poruch se řadí stavy větší únavy a vyčerpání, při mozkové arterioskleróze, po úrazech hlavy, při otravách, demencích a lehkých mozkových dysfunkcí u dětí. Použít se dají i u kvantitativních poruch vědomí, kde však o jejich použití rozhoduje lékař.
Z nežádoucích účinků se může vyskytnout zejména nespavost a agitovanost.
Egb 761
Jedná se o standardizovaný a vysoce čištěný extrakt získávaný z listů rostliny Ginkgo biloba z čeledi Ginkgoaceae, který má velmi silné antioxidační vlastnosti a funguje jako vychytávač volných radikálů. Hlavními látkami standardizovaného roztoku jsou flavonidní glykosidy (kvercetin, kaemferol a isorhamnetin) a terpenoidní laktony (ginkgolid A, B a C a bilobalid). Hlavní účinné látky jsou ginkgolid B a bilobalid, z nichž každá tvoří 0,8 až 3 % z celého extraktu29). Princip účinku je charakterizován především ovlivněním reologie krve, snižuje adherenci krevních částic, má projektivní efekt proti ischémii a hypoxii, upravuje energetický metabolismus nervových buněk, působí antiedematózně, chrání myelinovou pochvu nervových vláken a stabilizuje funkci neurotransmitery a jejich působení na receptory30). Princip ovlivňování nervového systému těmito látkami se nabízí pro používání u onemocnění typu AD, vaskulární demence a kombinací těchto dvou.
Po perorálním podání je biologická dostupnost ginkgolidu téměř 90% a bilobalidů je to alespoň 70%. Toxicita je minimální. Doporučená denní dávka je 120–240 mg ve dvou až třech částech. Potahované tablety se podávají celé s přiměřeným množstvím vody po jídle.
Nežádoucí se objevují velmi vzácně a jsou to mírné trávicí obtíže, bolesti hlavy nebo alergické kožní reakce. Po dlouhodobém používání nelze vyloučit interakci s přípravky ovlivňující krevní srážlivost.
Piracetam
Chemicky se jedná o 2-(2-oxopyrrolidin-1-yl) acetamid, cyklický derivát 4-aminomáselné kyseliny (GABA). Jedná se o jeden z racemických produktů GABA. Piracetam příznivě ovlivňuje látkovou výměnu nervových buněk, u zátěžových stavů zvyšuje využití glukosy a kyslíku buňkami centrální nervové soustavy, zvyšuje průtok krve mozkem a zlepšuje tokové vlastnosti krve (snižuje viskozitu krve a usnadňuje průtok krve cévami). Používá se především k podpůrné medikaci příznaků organických onemocnění mozku jako součást léčby demencí. Hlavní indikační skupinou jsou tedy pacienti s demencí u AD, s vaskulární demencí a jejich smíšené formy. Na doporučení lékaře se užívá i u dětí s dyslexií, kterou nelze vysvětlit nedostatkem intelektu, omezeným nadáním, nedostatkem školního vzdělání, dále k usnadnění učení a zlepšení paměťových funkcí a k podpůrné léčbě poruch vědomí a závratí vyvolaných úrazem nebo poruchou prokrvení31).
Z hlavních nežádoucích účinků je třeba zmínit nespavost, zvýšená psychomotorická aktivita, nervozita, depresivní nálady, zvýšení libida, bolesti břicha, průjem a mírná hypertenze. Piracetam by se neměl užívat při možném krvácení do mozku, při snížené funkcí ledvin a u dětí do 6 let.
Doporučené dávkování je 3× denně 1 tobolku 800 mg a nebo 2× denně 1 tobolku 1200 mg. Po případě na doporučení lékaře dávku zdvojnásobit. Jestliže se do 4 týdnů příznaky onemocnění zhorší či se vyskytnou nežádoucí účinky nebo nějaké neobvyklé reakce, poraďte se o užívání léku s lékařem. Délka samoléčby by měla trvat 4 až 6 týdnů, maximálně 3 měsíce. Přípravek se užívá s jídlem a pitím nebo bezprostředně po jídle a zapíjí se sklenicí tekutiny.
Pyritinol
Jedná se o nootropikum, které podporuje látkovou výměnu v nervových buňkách, zlepšuje náladu, schopnost učení a soustředění. Na doporučení lékaře se pak využívá při skleróze mozkových cév a poruchách činnosti mozku u starých osob, údajně zvyšuje koncentraci ACh32). K těmto poruchám patří poruchy paměti, snížená schopnost koncentrace, celkové snížení aktivity a bolesti hlavy. Může se používat při poúrazových stavech, po zánětu mozku nebo mozkových blan a při poruchách intelektu po psychózách. Vzhledem k tomu, že se jedná o vitamín z řady B, je indikován i při neuralgiích, bolesti kloubů a při Parkinsonově chorobě.
Z nežádoucích účinků sem patří nechutenství, nevolnost, zvracení, průjem, alergické reakce po vyšších dávkách agitovanost. Nesmí se používat u osob s přecitlivělostí, poruchou ledvin a systémově imunitním onemocnění.
Dávkuje se ve dvou až třech denních dávkách po 100–200 mg, večerní dávka se podává jenom, pokud neovlivňuje spánek.
Lecithin
Je to přírodní látka získávaná z oleje rostliny Glycine max z čeledi Fabaceae. Lecithin je nepostradatelnou látkou, která je součástí buněk lidského těla. Jeho hlavními složkami jsou cholin a inositol, které působí příznivě především na zlepšení paměťových schopností a koncentrace. Přispívá k lepšímu odbourávání tuků z těla, snižuje hladinu cholesterolu v krvi, omezuje vznik jaterních a žlučových onemocnění a čistí krevní stěny. Podílí se též na celkové regeneraci, uklidnění, pomáhá při výživě mozkových buněk a zlepšuje také paměť. Ovlivňuje kvalitu pleti.
Lecithin se požívá především jako prevence srdečně cévních onemocnění a pro udržení správné funkce nervového systému. Užívá se 1200–1325 mg jednou denně během nebo po jídle.
Doplňková léčba (antidepresiva, neuroleptika, anxiolytika a hypnotika)
Do této skupiny patří léčiva, která snižují nepříjemné projevy nemoci. Jde především o stavy, které jsou pro pacienta nepříjemné až stresující. Jedná se o případy, kdy si pacient uvědomuje vlastní neschopnost a ztrátu paměti. Někdy dokonce nechápe, co se s ním děje a nemůže se s těmito projevy vyrovnat. Často bývají i hlavní léčbou u osob, které pečují o nemocného s AD. Je to velice náročná práce vyžadující velkou fyzickou a psychickou sílu.
K těmto doplňkovým léčivům řadíme: antidepresiva (látky potlačující příznaky deprese a někdy i neurologických bolestí), neuroleptika (látky zmírňující a odstraňující agresivitu, neklid, agitovanost), anxiolytika (tlumí úzkostné stavy) a hypnotika (látky, které se používají při poruchách spánku a na zklidnění před samotným usnutím).
Léčiva ve stadiu klinického zkoušení (tab. 2)
Tab. 2. Vybrané probíhající klinické studie 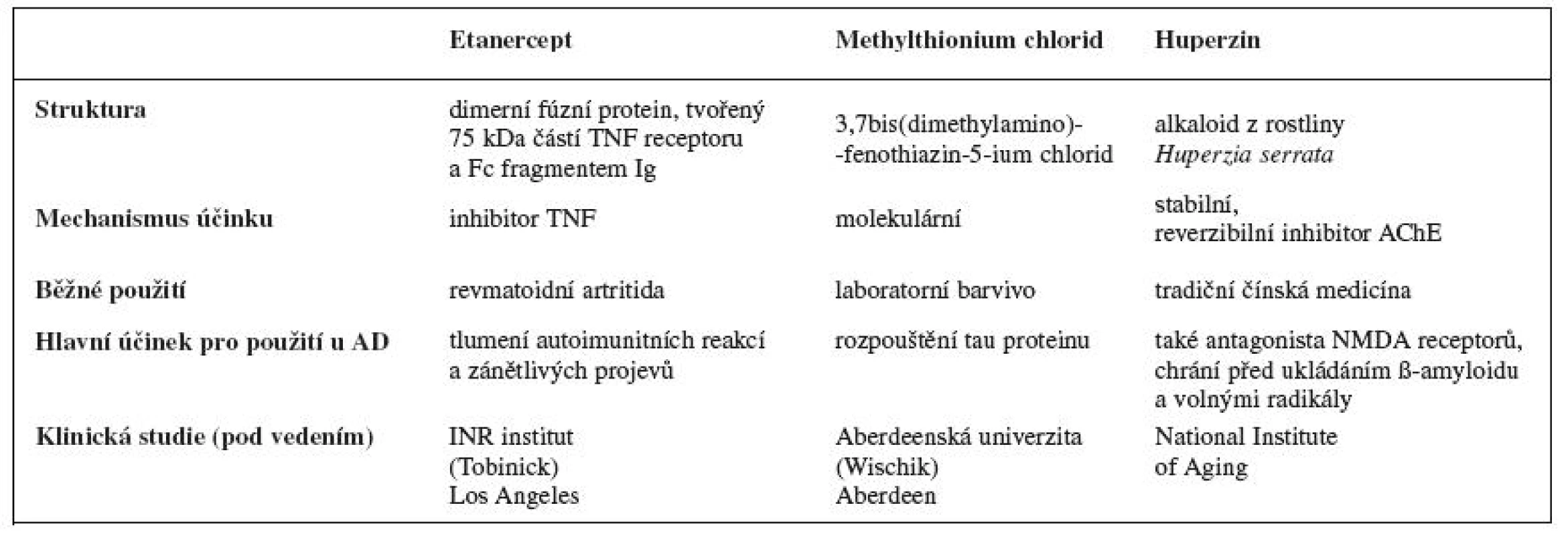
Léčba předpokládaného zánětu mozku a potlačení (auto)imunitní reakce
Etanercept
Jedná se o látku patřící do skupiny inhibitorů tumor nekrotizujícího faktoru (TNF), které mají imunosupresivní, imunomodulační a hlavně protizánětlivý účinek. TNF je významný cytokin podílející se na velkém množství procesů probíhajícím v organismu. Ovlivňuje tedy především regulaci imunitních reakcí vazbou na specifické receptory, a tímto způsobem aktivuje intracelulární signální mechanismy33).
Tento lék, inhibitor TNF, se dnes běžně používá k léčbě revmatoidní artritidy, ankylozující spondylitidy, juvenilní idiopatické artritidy, plakové psoriázy a psoriatické artritidy se zaměřením na nádorové projevy34). Edward Tobinick z INR institutu z Los Angeles využil tyto vlastnosti látky (tlumení autoimunitních reakcí a zánětu) pro léčbu AD. Hlavním problémem léčby je cesta podání. Etanercept je sloučenina s velkou molekulovou hmotností, která by jen těžko mohla sama proniknout hematoencefalickou bariérou. Tobinick vyřešil výše uvedený problém tzv. perispinálním podáním, kdy se dávka etanerceptu podá blízkosti míšního kanálu v oblasti krku. Pacient po aplikaci musí krátkou dobu (cca 5 minut) setrvat v poloze hlavou dolů. Etanecept se aplikuje jednou za 7–14 dní, pokud se do měsíce neobjeví žádný účinek, považuje se léčba udaného pacienta jako neúčinná.
Podle Tobinickova týmu je nástup účinku rychlý, uvádějí hodiny až dny. Kognitivní funkce pacientů s pokročilou demencí se během krátké doby progresivně zlepšují. Pacienti zastávají běžné denní činnosti. Autoři zveřejňují na internetových stránkách institutu videa, která zaznamenávají průběh léčby. Klíčová jsou videa, kde je ukázán pacient před a po aplikaci etanerceptu. Zajímavé jsou taktéž komentáře rodinných příslušníků. Odkaz na stránky: http://www.nrimed.com/breakthrough-videos/.
Nicméně lék neprošel rozsáhlými klinickými studiemi, ale i tak se dá na základě kazuistik říci, že lék naplňuje předpoklad účinku a stává se tak vhodným kandidátem ke klinickému zkoušení. Pokud lék u řady pacientů výrazně zabral, je léčba ukončena.
Léčba eliminující tvorbu amyloidních plaků (tau-proteinů)
Methylthionium chlorid
Látka známá jako modré laboratorní barvivo, kterému se dostalo uznání i na poli léčby AD. Britský profesor Claude Wischik působící na Aberdeenské univerzitě objevil tuto látku jako potenciální léčivo při náhodné kontaminaci roztoku obsahujícího tau protein. Při další zkoumání vzorku prokázal rozpouštění tau proteinu in vitro.
Lék je nyní v klinickém zkoušení a předpokládané uvedení na trh je rok 2012. Lék má výzkumný název Remember. V roce 2008 byla dokončena druhá fáze klinických testů. Ve skupině bylo testováno 321 pacientů s diagnostikovanou lehkou demencí, po 19 měsících nedošlo u více jak 80 % nemocných k žádnému výraznějšímu zhoršení kognitivních funkcí35).
Profesor Wischik při prezentaci výsledků svého výzkumu prohlásil, že se jedná o první lék od objevení této nemoci, který řeší jednu z hlavních příčin jejího vzniku36).
Huperzin
Huperzin je alkaloid získávaný z rosliny Huperzia serrata a dalších rostlin z čeledi Huperzinaceae, Lycopodiaceae a Selaginella. Huperzin se vyskytuje ve dvou formách, a to jako huperzin A a huperzin B.
V těle působí jako velice stabilní, reverzibilní inhibitor AChE vázající se do periferního anionického místa. Dále se této látce připisuje více možných působení na organismus. Mezi možné účinky patří například schopnost vázat se jako antagonista na NMDA-receptor, ochraňuje neurony před ukládáním ß-amyloidu, ochrana před působením toxického glutamátu, ochrana proti volným radikálům, také se spekuluje o účinku při hypoxii nebo mozkové ischémii, proto to všechno by mohl být důležitou látkou při léčbě Alzheimerovy choroby37). Dosud však nebyla provedena žádná rozsáhlejší klinická studie.
Alternativní léčba a rehabilitace
Jedním z nejdůležitějších nefarmakologických aspektů v léčbě AD je péče o nemocného. Pacient s AD je nesoběstačný, úzkostný a občas agresivní, proto je tato péče (ať rodinnými příslušníky nebo ošetřovateli) nezbytná pro udržení dobrého fyzického a hlavně psychického stavu. Ošetřovatel by měl s nemocným trénovat paměť a zvládání denních aktivit (formou jednoduchých úkolů, cvičení a tvorbou vlastních poznámek), dále testovat kognitivní funkce. Tyto pacienty je zbytečné učit se něco nového, jelikož schopnost pro ukládání nových poznatků je znatelně snížena. Navíc uvědomění si vlastní neschopnosti zapamatovat fakta může vést k rozvoji depresí.
Dále je možné využít některých z přírodních zdrojů, pro ovlivnění symptomatických projevů nemoci. Jedná se o účinné látky získávané z rostliny Cannabis sativa čeledi Cannabaceae a nikotin obsažený a získávaný z rostlin čeledi Solanaceae. Tyto látky ovlivňují receptory, na které působí ACh.
Existují i rehabilitační a relaxační procedury, které nemocným přináší úlevu, mezi něž patří například Cayceho odstranění bloků v páteři na začátku, bezkontaktní masáž, magnetické tahy (harmonizace bioenergetické oblasti hlavy a páteře), posílení elektromagnetické tělesné polarizace pomocí stejnosměrného napětí a elektrické masážní křeslo (příznivé působení vibrací v oblasti páteře).
Adresa pro korespondenci:
RNDr. Miroslav Pohanka, Ph.D.
Fakulta vojenského zdravotnictví
Univerzita obrany
Třebešská 1575, 500 01 Hradec Králové
e-mail: miroslav.pohanka@gmail.com, pohanka@pmfhk.cz
Došlo 4. května 2011 / Přijato 30. června 2011
Zdroje
1. Launer, L. J., Fratiglioni, L., Andersen, K., Breteler, M. M. B., Copeland, R. J. M., Dartiques, J. F., Lobo, A., Martinez-Lage, J., Soininen, H., Hofman, A.: Regional differences in the incidence of dementia in Europe: EURODEM collaborative analyses 1999.
2. Colective authors of alzheimer europe organization: Dementia in Europe Yearbook 2008; 20, (1–178).
3. Weiner, M. W., Aisen, P. S., Clifford, R. J. Jr., Jagust, W. J., Trojanowski, J. Q., Shaw, L., Saykin, A. J., Morris, J. C., Cairns, N., Beckett, L. A., Toga, A., Green, R., Walter, S., Soares, H., Snyder, P., Siemers, E., Potter, W., Cole, P. E., Schmidt, M., The Alzheimer’s disease neuroimaging initiative: The Alzheimer’s disease neuroimaging iniviative: Progress report and future plans. Alzheimer’s & Dementia 2010; 6, 202–211.
4. Ikejima, C., Yasuno, F., Mizukami, K., Sasaki, M., Tanimukai, S., Asada, T.: Prevalence and cause sof early-onset dementia in japan: A population-based study. American stroke journal 2009; 40, 2704–2714.
5. Zanetti, O., Solerte, S. B., Cantoni, F.: Life expectancy in Alzheimer’s diseases (AD). Arch. Gerontol. Geriatr. 2009; 49(Suppl 1), 237–243.
6. Wenk, G. L.: Neuropathologic changes in Alzheimer’s disease. J Clin Psychiatry 2003; 64(Suppl 9), 7–10.
7. Furukawa, K., Sopher, B. L., Rydel, R. E., Begley, J. G., Pham, D. G., Martin, G. M., Fox, M., Mattson, M. P.: Increased activity – regulating and neuroprotective efficacy of alpha-secretase-derived secreted amyloid precursor protein conferred by a c-terminal heparin-binding domain. J. Neurochem. 1996; 67(5), 1882–1896.
8. Shankar, G. M., Li, S., Mehta, T. H., Garcia-MuĖoz, A., Shepardson, N. E., Schmidt, J., Brett, F. M., Farrell, M. A., Rowan, M. J., Lemere, C. A., Regan, C. M., Walsh, D. M., Sabatini, B. L., Selkoe, D. J.: Amyloid beta-protein dimers isolated directly from Alzheimer brains impair synaptic plasticity and memory. Nat. Med. 2008; 14, 837–842.
9. Beeri, M. S., Rapp, M., Silverman, J. M., Schmiedler, J., Grossman, M. T., Fallon, J. T., Purohit, D. P., Perl, D. P., Sidpiqui, A., Lesser, G., Rosendorff, G., Haroutunian, V.: Coronary arthery diseases associated wi th AD neurology APO E4 carriers. Neurology 2006; 66, 1399–1404.
10. Alzheimer Association Report.: 2010 Alzheimer’s disease fact and figures. Alzheimer’s & Dementia 2010; 6, 158–194.
11. Jungsu, K., Basak, J. M., Holtzman, D. M.: The role of apolipoproteine in Alzheimer’s disease. Neuron 2009;, 63, 287–303.
12. Wei, Y., Qu, M. H., Wang, X. S., Chen, L., Wang, D. L., Liu, Y., Hua, Q., He, R. S.: Binding to the minor groove of the double-stand, tau protein prevents DNA from damage by peroxidation. PLoS One 2008; 3, e2600.
13. Rothman, S. M.: The neurotoxicity of excitatory aminoacids is produced by passive chloride influx. J. Neurosci. 1985; 5, 1483–1489.
14. Liu, D., Pitta, M., Lee, J. H. et al.: The K-ATP channel activator diazoxide ameliorates amyloid-beta and tau pathologies and improves memory in the 3xTgAD mouse model of Alzheimer’s disease. J. Alzheimers Dis. 2010; 22, 443–457.
15. Salter, M. W., Kalia, L. V.: Src kinase: A hub for NMDA receptor regulation. Nature reviews neuroscience 2004; 5, 317–328.
16. Gurland, B. J., Wilder, D. E., Lantigua, R., Stern, Y., Chen, J., Killerffer, E. H. P. et al.: Rates of dementia in three ethnoracial groups. Int J Geriatr Psychiatry 1999; 14, 481–493.
17. Kim, H., Bang, O. Y., Jung, M. W., Ha, S. D., Hong, H. S., Huh, K., Kim, S. U., Mook-Jung, I.: Neuroprotective effects of estrogen against beta-amyloid toxicity are mediated by estrogen receptors in cultured neuronal cells. Neuroscience Letters 2001; 302, 58–62.
18. Plassman, B. L., Langa, K. M., Fischer, G. G., Heeringa, S. G., Weir, D. R., Ofstedal, M. B. et al.: Prevence of dementia the united states: The aging, demographic and memory study. Neuroepidemiology 2007; 29, 125–132.
19. McKhann, G., Drachman, D., Folstein, M., Katzman, R., Price, D., Stadlan, E. M.: Clinical diagnosis of Alzheimer’s disease: report of NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984; 34, 939–944.
20. Guerrero-Berroa, E., Luo, X., Schmiedler, J. et al.: The MMSE orientation for the time domain is a strong predictor of subsequent cognitive decline in the elderly. Int. J. Geriatr. Psychiatry 2009; 24, 1429–1437.
21. Hodkinson, H. M.: Evaluation of a mental test score for assessment of mental impairment in the elderly. Oxford Journal 2010; 1, 233–238.
22. Bullock, R., Bergman, H., Touchon, J., Gambina, G., He, Y., Nagel, J., Lane, R.: Effect of age on respons on rivastigmine or donepezil in patient with Alzheimer’s disease. Curr Med Res Opin. 2006; 22, 483–494.
23. Birks, J., Harvey, R. J.: Donepezil for dementia due to Alzheimer’s disease. Cochrane Database Syst. Rev. 2003; 3, CD001190.
24. Muller, T.: Rivastigmine in the treatment of pacients with Alzheimer’s disease. Neuropsychiatr. Dis. Treat. 2007; 3, 211–218.
25. Huang, F., Fu, Y.: A review of clinical pharmacokinetics and pharmacodynamics of galantamine, a reversible acetylcholinesterase inhibitor for the treatment of Alzheimer’s disease, in healthy subjects and pacients. Curr Clin Pharmacol. 2010; 5, 115–124.
26. Gomolin, I. H., Smith, C., Jeitner, T. M.: Once-daily memantine: pharmacokinetics and clinical considerations. J. AM Geriatr Soc. 2010; 58, 1812–1813.
27. Drawn form: www.emea.europa.eu/docs/cs_CZ/docu ment_library/EPAR_-_Product_Information/ human/000463/WC500058763.pdf
28. Goertelmeyer, R., Erbler, H.: Memantin in treatment of milf to moderate dementia syndrome. A double-blind placebo-controlled study. Arzneimittelforschung 1992; 42, 904–913.
29. No Authors Listed. EGb 761: Ginkgo biloba extract, Ginkor. Drug RD 2003; 4(3), 188–193.
30. Loew, D.: Value of Ginkgo biloba in treatment of Alzheimer dementia. Wien Med Wochenschr. 2002; 152, 418–422.
31. Keil, U., Scherping, I., Hauptman, S., Schuessel, K., Eckert, A., Muller, W. E.: Piracetam improves mitochondrial dysfunction following oxidative stress. Br. J. Pharmacol. 2006; 147, 199–208.
32. Martin, K. J., Vyas, S.: Increase in acetylcholine concentrations in the brain of „old“ rats following treatment with pyritinol (Encephabol). Br. J. Pharmacol. 1987; 90, 561–565.
33. Mazzon, E., Esposito, E., Di Paola, R., Muia, C., Crisafulli, C., Genovese, T., Caminiti, R., měli, R., Bramanti, P., Cozzocrea, S.: Effect of tumorous necrosis factor-alpha receptor 1 genetic deletion on carrageenan-induced acute imflammation: A comparison with etanercept. Clin. Exp. Immunol. 2008; 153, 136–149.
34. Combe, B.: Update on the use of etanercept across a spectrum of rheumatoid disorders. Biologics 2008; 2, 165–173.
35. Wischik, C., Staff, R.: Challenges in the conduct of disease – modyfying trials in AD: Practical experience from phase 2 trial of Tau-aggregation inhibition therapy. Journal of Nutrition Health & Aging 2009; 13, 367–369.
36. Wischik, C., Edwards, P. C., Lai, R. Y., Roth, M., Harrington, C. R.: Selective inhibition of alzheimer’s disease – like tau aggregation by phenothiazines. Proc. Natl. Acad. Sci. USA 1996; 93, 11213–11218.
37. Ho, Y., So, K., Chuen-Chung Chang, R.: Drug discovery from Chinese medicine against neurodegeneration in Alzheimer’s and vascular dementia. Chin. Med. 2011; 6, 15.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2011 Číslo 5- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
- Alzheimerova demence: aspekty současné farmakologické léčby
- Rhus hirta (L.) Sudw. – fytochemická charakteristika nejčastěji kultivovaného zástupce Anacardiaceae v České republice
- Efekt troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho (Papaver somniferum L.)
- Měření viskozity a konzistence dle ČL 2009
- Cena České farmaceutické společnosti
-
Naše léčivé přípravky na konci 18. století
I. část – úvod a tekuté lékové formy - Prof. RNDr. Viliam Foltán, Csc., jubiluje
- Za doc. DrPh. PhMr. Ladislavom Kňažkom, CSc.
- Farmaceuti rokovali na Donovaloch
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Alzheimerova demence: aspekty současné farmakologické léčby
-
Naše léčivé přípravky na konci 18. století
I. část – úvod a tekuté lékové formy - Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
- Měření viskozity a konzistence dle ČL 2009
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



