-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKolorektální karcinom (část 3)
Vyšlo v časopise: Čas. Lék. čes. 2014; 153: 207-217
Kategorie: Abstrakta
6.–7. prosince 2013, Praha
Vážené kolegyně, vážení kolegové,
následující text představuje třetí, poslední část abstrakt ze 2. národního kongresu o kolorektálním karcinomua 4 postgraduálního kurzu Společnosti pro gastrointestinální onkologii ČLS JEP (SGO), který se konal v prosinci loňského roku. Tato abstrakta jsou zaměřená na chirurgickou a onkologickou léčbu kolorektálního karcinomu (KRK), včetně jaterních metastáz a pragmatické hodnocení kvality péče v digestivní onkologii. V chirurgické části je zmíněno vyšetření sentinelové uzliny, které může zlepšit přesnost určení stadia onemocnění. Problematika tumor infiltrujících lymfocytů (TIL) je zde nahlížena z pohledu dvou pracovišť – plzeňského a pražského. Obě studie potvrdily význam TIL jako významného prognostického faktoru, pomocí kterého lze identifikovat pacienty ohrožené rekurencí KRK. Otázkou lokalizace primárního nádoru se zabývají dvě abstrakta, která souhlasně popisují rozdíl mezi levostranným a pravostranným kolorektálním karcinomem. Z pohledu patologa je důležitá implementace standardního protokolu při vyhodnocování preparátů resekovaného KRK. V sekci onkologická léčba jsou abstrakta zaměřena na terapii metastatického KRK, zejména na vyšetření onkogenů RAS, neadjuvantní terapii a doporučený algoritmus léčby. Generalizací tumoru do jater a plic se zabývají také texty orientované na roli multioborového týmu, a to z pohledu radiologa, chirurga a onkologa. V poslední části jsou popsána kritéria pro hodnocení kvality péče, a to jak v digestivní onkologii obecně, tak i v případě kolorektálního karcinomu.
Věřím, že všechna abstrakta publikovaná v posledních třech číslech tohoto časopisu budou přínosem pro vaši klinickou praxi a budou sloužit jako pozvánka na další ročník Národního kongresu o kolorektálním karcinomu a post-graduálního kurzu SGO v roce 2015.
prof. MUDr. Miroslav Zavoral, Ph.D.
předseda organizačního výboru kongresu
předseda Společnosti pro gastrointestinální onkologii ČLS JEP
CHIRURGICKÁ LÉČBA
Sentinelová uzlina
Duben J., Gatěk J., Dudešek B., Kotoč J., Kosáč P., Vážan P.
Chirurgické oddělení nemocnice Atlas a.s., Univerzita T. Bati, Bioptická a cytologická laboratoř, Zlín
Úvod: Kolorektální karcinom představuje druhou nejčastější malignitu v rozvinutých zemích a je 4. nejčastější malignitou vedoucí k úmrtí pacienta. Standardem chirurgické léčby je segmentální resekce s en-bloc lymfadenektomií. Regionální metastázy v lymfatických uzlinách jsou jedním z nejdůležitějších faktorů indikace k adjuvantní léčbě systémovou chemoterapií. Pětileté přežití u stadia I je 90 %, u stadia II je 75%. Tato stadia jsou definována jako stadia s negativními uzlinami (N0), přesto se u 30 % pacientů v těchto stádiích vyvinou vzdálené metastázy a pacienti umírají na kolorektální karcinom. Jednou z příčin tohoto stavu je chybné zařazení do časnějšího stadia u pacientů během diagnostického procesu včetně rozsahu chirurgického výkonu (nedostatečný rozsah) a histopatologického vyšetření – nedetekované metastázy, mikrometastázy a ITC v lymfatických uzlinách. V případě histopatologického vyšetření se jedná o absolutní počet vyšetřených uzlin a techniku vyšetření. Dnešním histopatologickým standardem je vyšetření lymfatických uzlin jedním 4 μm řezem vedeným každou uzlinou. Ideálním řešením by bylo vyšetření všech odebraných uzlin sériovými řezy, imunohistochemicky či RT-PCR technikami. Vyšetření sériovými řezy či imunohistochemicky by však bylo pro velké množství detekovaných uzlin časově a technicky velmi náročné a drahé. Koncept sentinelové uzliny nabízí řešení jak zlepšit přesnost určení stadia onemocnění. Přínosem biopsie sentinelové uzliny je mimo jiné i možnost podrobného vyšetření pouze několika uzlin.
Lymfogenní metastazování kolorektálního karcinomu: Lymfogenní metastazování u kolorektálního karcinomu nejčastěji probíhá do lymfatických uzlin podél příslušných arterií. Jsou popsány i extraanatomické lymfatické metastázy a lymfatické metastazování podél stěny střevní. Možné je také metastazování podél centrálněji následující arkádové tepny až ke kmeni a. mesenterica superior či inferior a tyto uzliny jsou popisovány jako vzdálené metastázy. U a. mesenterica inferior se jedná o metastazování do oblasti preaortální a levé paraaortální, zřídka také do oblasti interaortokavální. Konečně přes uzliny za pankreatem je možné šíření do hepatoduodenálního ligamenta. Podobně se chová i v případě vzdáleného metastazování a. mesenterica superior. Tyto vzdálené metastázy nejsou objektem standardní lymfadenektomie, ale mají smysl v případě terapeutické lymfadenektomie. Ze studie japonského chirurga Jinaaie vyplývá, že maximum časných metastáz do uzlin se nachází v oblasti podél stěny střevní proximálně ve vzdálenosti 7,5 cm, a proto je nutné se věnovat arteriálním splavům této oblasti. U tumorů v obou flexurách je nezbytné předpokládat metastazování oběma směry. Nádory pravé flexury metastazují v oblasti a. colica dextra (která jen v 15 % odstupuje přímo z a. mesenterica superior), ale také metastazují podél a. ileocolica a stejně tak podél pravého raménka a. colica media. Karcinomy kolon transversum mohou metastazovat v rámci velké sítě i do oblasti arkády a. gastroepiploica dextra. Nádory levé poloviny kolon transversum se mohou šířit také do uzlin při dolní hraně pankreatu. U karcinomů v blízkosti levého kolon se zvětšuje množství metastáz v oblasti kmene a. mesenterica inferior šířící se přes odpovídající arterie a to především přes a. colica sinistra ascendens. Naproti tomu u karcinomů proximální části kolon descendens jsou metastázy nalézány při kmeni a. colica media. Karcinomy sigmoidea metastazují výhradně do uzlin ke kmeni a. mesenterica inferior, což platí i pro karcinomy rekta. Kontroverzní je v současnosti i názor na vysokou ligaturu art. mesenterica inf. Karcinomy horní třetiny rekta metastazují aborálně pouze do vzdálenosti 4 cm, a proto je nutné provést resekci mezorekta 5 cm aborálně od hranice nádoru. Tumory dolních dvou třetin rekta metastazují do jakýchkoli části mezorekta, tudíž je vždy nezbytné provést totální excisi mezorekta. Na rozdíl od Japonska je kontroverzní řešení metastazování tumorů dolní třetiny rekta podél a. iliaca interna. Metastázy zde mohou být nalezeny až ve 40 % u lokálně pokročilých tumorů. Byla publikována anatomická studie laterálních pelvických uzlin se zaměřením na výskyt metastáz a technickými problémy vznikajícími při laterální lymfadenektomii v chirurgické terapii karcinomu rekta. V oblasti malé pánve bylo na 16 kadaverech nalezeno průměrně 28,6 uzlin (16–46) s maximem výskytu ve fossa obturatoria. Hypogastrické uzliny leží převážně v blízkosti dolního hypogastrického plexu, ale zasahují až k hlubokým pánevním žilám. Potíže při pánevní lymfadenektomii jsou spojeny mimo jiné s identifikací hypogastrických nervů a ev. následnou sexuální dysfunkcí. Komplikace spojené s rutinním prováděním pánevní laterální lymfadenektomie mohou být řešeny aplikací techniky značení tumoru radiokoloidem, který označí spádové lymfatické uzliny.
Zásady lymfadenektomie – prognostické faktory, doporučený počet vyšetřených uzlin, lymfatický staging: Po kurativní resekci kolorektálního karcinomu přibližně kolem 50 % pacientů umírá na metastázy v prvních 5 letech. Staging nám umožňuje diferencovat různé skupiny onemocnění s různou prognózou. Současný staging vychází z modifikované Dukesovy klasifikace, resp. z klasifikace TNM. Pacienti klasifikovaní dle Dukes A/stadium I mají pětileté přežití cca 90 %, ve stadiu DukesB/stadium II 70–80 % a ve stadiu Dukes C/stadium III 35–60 %. Studie s adjuvantní chemoterapií potvrdily snížení mortality ve stadiu Dukes B/C o 22 %. Tříleté přežití se zvýšilo z 64 % na 76 % u stadia Dukes C. Přesto u 27 % pacientů s Dukes B2 dojde k relapsu onemocnění do 5 let. Relaps u pacientů ve stadiu B2 je pravděpodobně způsoben okultními metastázami v lymfatických uzlinách či šířením nádoru mimo lymfatika. Pokud by bylo možné tuto rizikovou skupinu pacientů identifikovat, může profitovat z adjuvantní chemoterapie. Současné metody stagingu však nejsou dostatečně citlivé. V případě lymfatického šíření mohou být pozitivní lymfatické uzliny také přehlédnuty, pokud je vyšetřeno jen malé množství uzlin. Studie z osmdesátých a devadesátých let potvrzovaly, že u více než 75 % pacientů s kolorektálním karcinomem je vyšetřeno méně než 10 uzlin. Po celosvětové diskuzi a na základě randomizovaných studií na téma nezbytného počtu vyšetřených uzlin se sešla komise odborníků na kolorektální karcinom v roce 1990 při světovém gastroenterologickém kongresu v Sydney. Výsledkem bylo doporučení ke klinicko-patologickému stagingu a chirurgii kolorektálního karcinomu. Další doporučení (Guidelines 2000 for Colon and Rectal Cancer Surgery) následovala z expertního panelu chirurgů při americkém National Cancer Institute (NCI) a na základě randomizovaných studií byl doporučen při operaci kolorektálního karcinomu jako minimální počet 12 vyšetřených uzlin. Identifikace lymfatických uzlin v resekátu není jednoduchá, a proto byly vyvinuty techniky „fat clearance“ ke zvýšení počtu detekovaných lymfatických uzlin. Technika izolace uzlin pomocí alkoholu zvýšila průměrný počet vyšetřených uzlin na 18,5, resp. na 39 dále až na 52. K upstagingu a migraci ze stádia Dukes B na stádium Dukes C došlo u 8,6 % pacientů. Tato technika je velmi pracná a náročná na čas. Modernější metody popsaly rychlejší rozpouštění tuku s průměrným počtem vyšetřených uzlin až 58 a také se zvýšeným počtem nalezených pozitivních uzlin na 53 %. Ačkoliv techniky rozpuštění tuku vedly k upstagingu pacientů, nedošlo ke zlepšení přežívání u skupiny pacientů s negativními uzlinami. Přes pokrok jsou stále všechny tyto techniky náročné na zpracování preparátu a čas a nejsou proto rutinně používány.
Při určení prognózy onemocnění stejně jako u karcinomu žaludku a jícnu, se však stále více prosazuje názor, že poměr pozitivních uzlin a negativních uzlin má větší prognostický význam než pouze absolutní počet pozitivních uzlin. Stále však platí, že je nezbytný minimální počet vyšetřených uzlin i při hodnocení poměru pozitivních a negativních uzlin. Předmětem výzkumu je nyní vhodné rozdělení vyšetřených uzlin do jednotlivých rizikových skupin podle jejich vzájemného poměru. Pacienti jsou rozdělování nejčastěji do čtyř skupin podle poměru pozitivních a negativních uzlin. LNR skupiny: 1 (0 < LNR ≤ 0,1); 2 (0,1 < LNR ≤ 0,25); 3 (0,25 < LNR ≤ 0,5); a 4 (LNR > 0,5) pětileté přežití u jednotlivých skupin LNR1, LNR2, LNR3 a LNR4 bylo 73 %, 64 %, 44 % a 22 % (Qiu).
Současná doporučení v oblasti lymfadenektomie:
NCCN guidelines 1. 2014:
- Lymfatické uzliny v oblasti vyživujících cév mají být identifikovány pro vyšetření patologem.
- Klinicky pozitivní lymfatické uzliny mimo oblast resekce mají být bioptovány a odstraněny.
- Ponechané pozitivní uzliny pak značí inkompletní resekci (R2).
- Minimum 12 lymfatických uzlin musí být vyšetřeno ke stanoveníN stadia.
AJCC 2010 staging system (TNM 7. edice): Počet postižených uzlin rozdělil odebrané uzliny na N1 a N2 skupinu. Skupina N1 byla dále rozdělena na N1a (metastáza v jedné uzlině) a N1b (metastázy ve 2–3 uzlinách). N2 byla rozdělena na N2a (metastázy ve 4–6 uzlinách) a na skupinu N2b (metastázy ve více než sedmi uzlinách). Obě nové podskupiny reprezentují vždy cca 50 % pacientů.
Minimální počet vyšetřených uzlin je 12.
Modrá kniha České onkologické společnosti 17. vydání (2013): Indikace pro adjuvantní chemoterapii ve stadiu II (pT3, N0, M0 high-risk podskupina).
High-risk skupina: neznámé resekční okraje, obstrukce, perforace střeva nádorem, špatná diferenciace nádoru, mucinózní složka, nedostatečný počet vyšetřených lymfatických uzlin (podmínkou pro přesný patologický staging je vyšetření nejméně 12 lymfatických uzlin). Lymfatická a/nebo vaskulární a/nebo perineuronální invaze.
Sentinelová uzlina – historie: V roce 1977 Cabanas byl první, kdo použil termín „sentinelová uzlina“ u pacientů s karcinomem penisu. V roce 1992 Wong popsal techniku detekce sentinelové uzliny na „feline model“. Ve stejném roce Morton popsal techniku a klinické využití metody u pacientů s melanomem. Morton použil techniku mapování pomocí Blue, další autoři použili k detekci sentinelové uzliny gama sondu. V roce 1994 Guiliano popsal techniku sentinelové uzliny u karcinomu prsu. Od té doby byl koncept sentinelové uzliny použit v mnoha rozličných lokalizacích – karcinomu štítné žlázy, vulvy, jazyku, oezofagu, žaludku, plic, kolon a rekta. V roce 1990 popsal Joosten první použití techniky sentinelové uzliny u kolorektálního karcinomu. U 50 pacientů použil techniku aplikace 1–2 ml Patentblue V, kterou instiloval do okolí tumoru subserózně a submukózně pomocí rektoskopu. Techniku použil u pacientů s karcinomem rekta. Identifikoval sentinelovou uzlinu u 70 % pacientů, se senzitivitou okolo 45 %. Saha a Wiese byli prvními autory, kteří popsali úspěšnou techniku lymfatického mapování s použitím modré barvy (Isosulfan blue = Lymfazurin). Dokázali identifikovat sentinelové uzliny u 99–100 % pacientů s vysokou senzitivitou 91 %, resp. 92 %. Kitagawa popsal odlišnou techniku mapování s použitím radioaktivního nosiče. Endoskopicky aplikoval 99mTc koloid do submukózy několik hodin před operací. Jelikož má nosič větší molekulu a je absorbován makrofágy, přetrvává v sentinelových uzlinách delší dobu a odstraňuje problém s průchodem uzlinou jako je u Patent blue. Wong popsal tzv. ex vivo metodu lymfatického mapování. Po excisi preparátu patolog aplikoval Blue dye do submukózy na antimezenteriální straně. Jelikož i Blue dye aplikována po excisi preparátu také prochází lymfatiky a nabarví uzliny, je možné provést mapování i tímto způsobem. Při použití této techniky však není možné detekovat ektopicky uložené uzliny. Někteří autoři (stejně jako v našem souboru) používají kombinovanou semi ex vivo techniku. Blue dye je aplikována in vivo a uzliny jsou detekovány ex vivo. Bilchik provádí tuto techniku jako doplňkovou při selhání in vivo techniky. Ve všech studiích, jež obsahují karcinom rekta, je zdůrazněno, že identifikace je u karcinomu rekta mnohem složitější a je zatížena vyšším počtem falešně negativních uzlin. Je to způsobeno anatomií mezorekta, jež postrádá serózní obal, je mnohem tlustší a neforemnější než mezokolon a je hladké. Také extraperitoneální pozice mezorekta znesnadňuje přehled a detekci zbarvených uzlin. Principem chirurgického výkonu na kolorektu je odstranění primární léze společně s přilehlou oblastí lymfatické drenáže mezenteria. Biopsie sentinelové uzliny u kolorektálního karcinomu nevede zásadně na rozdíl od melanomu a karcinomu prsu ke změně techniky ani rozsahu výkonu. Typicky je využívána ke zlepšení stagingu. Lymfatické mapování však také může změnit rozsah výkonu, pokud se prokáže aberantní drenáž tumoru, která je definována jako uložení sentinelové uzliny mimo oblast předpokládaného rozsahu resekce. Detekce aberantní lymfatické drenáže je však smysluplná pouze při aplikaci in vivo techniky lymfatického mapování a chirurg, který během výkonu detekuje aberantní lymfatickou drenáž je schopen přizpůsobit rozsah výkonu mapované oblasti. Nejčastěji se aberantní lymfatická drenáž vyskytuje u karcinomů pravého kolon a sigmatu.
Histologické vyšetření lymfatických uzlin u kolorektálního karcinomu: Standardem histologického vyšetření lymfatických uzlin u karcinomu kolorekta je vyšetření všech odebraných uzlin jedním 4 μm řezem každou odebranou uzlinou. Preparát je barven hematoxylin eosinem a metastázy jsou detekovány mikroskopicky. Standardem vyšetření sentinelových uzlin je metodika sériových řezů a ev. imunohistochemické a RT-PCR vyšetření. Upstaging je definován jako metastázy či mikrometastázy nalezené v sentinelových uzlinách, a to v jiných řezech než ve standardním řezu. Použitím metodiky lymfatického mapování a vyšetřením sentinelových uzlin dochází k upstagingu v cca 5–15 % případů.
Imunohistochemické vyšetření ev. RT-PCR techniky zlepšují staging onemocnění, nicméně jsou příliš technicky a časově náročné, pokudbychom je použili na všechny nalezené uzliny. Zvláště se stává problémem v dnešní době, kdy je kladen důraz na co největší počet vyšetřených uzlin. Problém odpadá, pokud ovšem použijeme těchto moderních technik k vyšetření sentinelových uzlin, u nichž je nejvyšší šance na postižení metastázami. Jsou často jedinými, v nichž je metastáza nalezena. Pokud by byla technika sentinelové uzliny uznána jako ověřená i v případě kolorektálního karcinomu, pak by bylo možné se soustředit pouze na sentinelovou uzlinu (nebo několik) uzlin a detekovat v nich metastázy, mikrometastázy či volné buňky. Technika sentinelové uzliny tudíž má potenciál stát se rychlejší a levnější procedurou při stanovení přesného stagingu kolorektálního karcinomu.
Současná technika lymfatického mapování a biopsie SLN u kolorektálního karcinomu: Ke značení lymfatik jsou nejčastěji používány lymfotropní látky Isosulfan Blue a Patentblau. Látka se aplikuje subserózně – vpichy jsou vedeny tenkou jehlou cirkulárně okolo tumoru. Při extrakci jehly je nutné vytvořit podtlak, jinak dochází k výronu barvy. Po aplikaci je nutné vyčkat 3–10 minut, než dojde k úplnému mapování lymfatického stromu. Aplikace je možná in vivo či ex vivo technikou. In vivo technika je výhodná pro možnost detekce aberantní lymfatické drenáže tumoru a možné korekci výkonu, což odpadá při ex vivo identifikaci.Ex vivo technika je prováděna patologem. K aplikaci je vhodný nefixovaný preparát a je nutné provádět mapování bezprostředně po výkonu. Ex vivo technika má výhodu exaktní aplikace barviva do submukózy na rozstřiženém preparátu a neprodlužuje operační výkon. Obě techniky přinášejí ekvivalentní výsledky, co se týče senzitivity. Další možností je použití 99mTc koloidu. Používá se jednodenní či dvoudenní protokol. Podle velikosti použité molekuly pak radiokoloid zůstává různou dobu v mapovaných uzlinách a je detekovatelný gama sondou. V současné době je preferován především u karcinomu rekta, kde je obtížnější detekce zbarvených uzlin.
Technika sentinelové uzliny je novým pokrokem v kolorektální chirurgii. Kromě dvou iniciálních studií všechny ostatní studie prokázaly úspěšné lymfatické mapování. Je možné s vysokou pravděpodobností identifikovat sentinelové uzliny u většiny pacientů, a předpovědět tak stav uzlin s vysokou přesností. S pomocí aplikace „blue dye“ je technika jednoduchá, levná, rychlá a může být použita na kterémkoli pracovišti. Metodika má krátkou učební dobu, po níž může být dosaženo procento záchytu blížící se 100 %. I když vlastní sentinelová uzlina je prakticky vždy detekována, může být falešně negativní. Důvody falešné negativity SLN:
- Obstrukce lymfatických cest tumorem může změnit směr toku lymfatik do alternativních cest vedoucích do dalších lymfatických uzlin, jež mohou být následně identifikovány jako sentinelové a nemusí v tomto případě obsahovat metastázu (popsáno i u karcinomu prsu). Nádor může také při šíření mimo stěnu střevní ev. rekta prorůstat přímo do přilehlých uzlin a deformovat lymfatickou síť.
- Chyby v samplingu se mohou vyskytnout během standardního patologického vyšetření sentinelové uzliny. Je vyšetřeno asi 0,04 % lymfatické uzliny, a je tak možné přehlédnutí metastázy.
- Během mobilizace kolon nebo rekta je možná destrukce lymfatik, a tím se znemožní nabarvení sentinelové uzliny.
- Procedurální chyba může také vést ke špatné identifikaci sentinelové uzliny. Místo aplikace je velmi důležité. Je třeba aplikovat látku cirkulárně okolo tumoru, jinak může dojít ke špatné identifikaci sentinelové uzliny.
Falešná negativita sentinelové uzliny nicméně většinou neovlivní staging onemocnění. Technika sentinelové uzliny je totiž vždy doprovázena standardní resekcí mezokolon či mezorekta s patologickým vyšetřením všech nalezených uzlin. To znamená, že downstaging není častý. Nicméně jedna uzlina obsahující metastázu menší než 5 mm je těžko k nalezení klasickou patologickou technikou. Pomocí techniky sentinelové uzliny však může být nalezena, a vést tak k upstagingu, tzn. ke správnému zařazení do stadia. Technika sentinelové uzliny může odhalit aberantní lymfatickou drenáž v 2–15 % případů u klasických technik a ve 28–36 % případů u laparoskopických technik, což vede následně k rozšíření resekce. Nálezy ektopických sentinelových uzlin mohou být důležité u karcinomu rekta.
Studie z Japonska ukázaly signifikantně vyšší četnost recidiv a kratší dobu přežití pokud laterální uzliny obsahují mikrometastázy, což může prokázat metodika lymfatického mapování. I když tumory většinou dříve metastazují do perirektálních uzlin, tak v určitých případech (7,7 %) mohou být jedinými uzlinami, do nichž tumor metastazuje. Kitagawa nalezl laterální uzlinu jako sentinelovou v 10 % případů u pacientů s nízkým karcinomem rekta.
Na základě metaanalýzy všech prací zabývajících se tematikou sentinelových uzlin u kolorektálního karcinomu, publikovanou v Lancet Oncology 2011 byl položen základ pro budoucí studie, které jsou nezbytné pro stanovení významu lymfatického mapování a biopsie sentinelové uzliny u kolorektálního karcinomu:
Panel: Recommendations for future studies of sentinel lymph nodes in patients with colorectal cancer
- At least 20 sentinel-lymph-node procedures should be done by each surgeon in charge of dye injection to account for the learning curve.
- Patients with clinical signs of lymph-node involvement or metastatic disease should be excluded.
- The sentinel lymph node should be identified as the first lymph node to accumulate tracer material by the person undertaking the tracer-material injection during the procedure in the resected specimen, which has been freshly harvested and not processed (eg, by fixation in formalin).
- Data for rectal and colon cancer should be analysed and reported separately.
- When all lymph nodes are haematoxylin and eosin negative, the pathological assessment of the sentinel node should at least include multi-sectioning. One section of each ribbon should be assessed with haematoxylin and eosin staining. If no metastases are identified the rest of the sections should be assessed with immunohistochemstry. Based on published works, we recommend the use of at least CAM5.2 (Becton Dickinson, San Jose, CA, USA) at five sections with 250 μm intervals.
- All metastases identified by immunohistochemistry and multi-sectioning should be classified and reported as done by Hermanek and colleagues, occult tumour cells < 0.2 mm, micrometastasis 0.2–2.0 mm, and metastasis > 2.0 mm.
- The number of non-sentinel lymph nodes and sentinel lymph nodes identified should be reported. The pathologist should aim to retrieve a minimum of 12 lymph nodes (including sentinel lymph node).
Závěr: Technika lymfatického mapování a biopsie sentinelové uzliny je novým pokrokem v kolorektální chirurgii. Použití techniky lymfatického mapování je jednoduchá, levná a obecně aplikovatelná metoda s krátkou učební dobou, s možností provádění na jakémkoli pracovišti. Signifikantně zvyšuje počet vyšetřených uzlin a selektuje sentinelové uzliny k podrobnějšímu vyšetření. In vivo aplikovaná metoda lymfatického mapování dále napomáhá peroperační rozvaze ohledně rozsahu resekce. Je viditelně zobrazena oblast možných lymfatických metastáz, což usnadňuje operujícímu chirurgovi rozhodnutí o rozsahu resekce při postižení rizikových částí střeva na rozhraní cévního zásobení (resekce sigmatu či levostranná hemikolektomie, rozsah resekce při tumoru transverza, tumorů flexur – především lienální). Lymfatické mapování usnadňuje výběr uzlin, které jsou nejvíce rizikové pro výskyt metastáz. Těmto uzlinám je pak věnována větší pozornost při patologicko-anatomickém vyšetření.
T infiltrující lymfocyty při kolorektálním karcinomu – pohledem z Plzně
Liška V., Daum O., Novák P., Třeška V., Vyčítal O., Brůha J., Pitule P., Holubec L.
LF UK, Plzeň
Úvod: Hlavním medicínským problémem kolorektálního karcinomu (KRCA) je vysoké riziko recidivy po radikálním chirurgickém výkonu. Tumor infiltrující lymfocyty (TIL) byly popsány jako dobrý prognostický faktor u pacientů s KRCA s vysokým rizikem recidivy onemocnění. Jejich počet, typ a morfologie odráží prognózu maligního onemocnění. TIL jsou důležitým faktorem, který nás informuje o schopnosti organismu potlačit rozvoj malignity.
Cíl: Autoři hodnotili vztah mezi známými klinickými a histopatologickými faktory a TIL za účelem diagnostiky pacientů s vysokým rizikem krátkého celkového přežití (OS) a časné recidivy (krátké bezpříznakové přežití – DFI) po radikální chirurgické terapii.
Metodika: Byl zpracován soubor 150 pacientů elektivně radikálně operovaných pacientů pro KRCA na Chirurgické klinice FN Plzeň v letech 2004–2007. Byla provedena statistická analýza následujících faktorů: předoperační leukocytóza, radikalita, pooperační komplikace, onkologická terapie, grading, staging, morfologická struktura TIL, počty TIL a reaktivní změny lymfatických uzlin (LU) ve vztahu k OS a DFI. Byla hodnocena imunohistopatologická pozitivita lymfocytů (CD4+, CD8+).
Výsledky: Ve studii se nacházelo 93 mužů a 57 žen, OS 1, 3 a 5 let bylo 92,2 %, 76,5 % a 70,2 %, DFI 1,3 a 5 let pak 85,3 %, 64,3 % a 49,4 %. Endovaskulární infiltrace a infiltrace LU metastázami byly prokázány jako negativní prognostické faktory OS. N2 postižení LU snižuje OS 9,3krát a DFI 5krát. Přítomnost Crohn-like peritumorální lymfocytární infiltrace (PTL), PTL a folikulární hyperplazie byla prokázána jako pozitivní (protektivní) faktor.
CD8+ TIL byly prokázány jako pozitivní prognostický faktor OS. CD4+ TIL byly prokázány jako negativní prognostický faktor OS. Poměr CD8+/CD4+ nebyl potvrzen jako signifikantní prognostický faktor. Multivariate Cox Regression Hazard Model prokázal kombinaci závažnosti infiltrace LU metastatickým procesem a LN-FH jako nejlepší prognostický faktor pro predikci vysokého rizika krátkého celkového přežití.
Přítomnost perineurální infiltrace byla prokázána jako prognostický faktor časné recidivy. Zvýšená míra CD8+ TIL byla prokázána jako pozitivní prognostický faktor prodlužující DFI. Negativním prognostickým faktorem bezpříznakového přežití byla prokázána infiltrace lymfatických uzlin metastatickým procesem. Multivariate Cox Regression Hazard Model prokázal kombinaci závažnosti infiltrace LU metastatickým procesem a CD8 pozitivitu jako nejlepší prognostický faktor pro predikci vysokého rizika krátkého bezpříznakového přežití.
Závěr: Provedená studie detekovala charakter a kvantitu morfologického uspořádání TIL jako prognostické faktory ovlivňující prognózu pacienta po radikální chirurgické terapii KRCA.
Podpořeno VZ MSM 0021620819 (Náhrada a podpora funkce některých životně důležitých orgánů) a grantem IGA MZ ČR 14329 a 12025.
T infiltrující lymfocyty při kolorektálním karcinomu – pohled z Prahy
Kocián P.1, Fialová A.1, Šedivcova M.2, Drgáč J.1, Hoch J.1
12. LF UK a FNM, Praha
2Ústav patologie LF, Plzeň
Prognóza kolorektálního karcinomu v současné době vychází z TNM klasifikace, která stratifikuje nemocné do jednotlivých klinických stadií a je zároveň určujícím kritériem pro indikaci adjuvantní onkologické léčby. Nevýhodou TNM klasifikace je skutečnost, že nepřináší žádné informace o biologickém chování nádoru, a proto prognóza pacienta stejného klinického stadia se může do značné míry lišit. Aktuálním tématem je hledání nových prognostických a prediktivních biomarkerů, které povedou k selekci rizikových pacientů napříč klinickými stadii a racionalizaci adjuvantní onkologické léčby. V současné době jediným rutinně používaným biomarkerem je stanovení mutace K-ras. Mutace K-ras se u kolorektálního karcinomu vyvíjí v časné fázi tumorigeneze, během progrese z adenomu na karcinom, a její prevalence se u zmíněné malignity pohybuje mezi 30–50 %. Stanovení mutace K-ras je jednoznačným negativním prediktivním markerem pro použití cílené terapie inhibitory EGFR, tj. cetuximabem či panitumumabem (prediktivní biomarker), naopak prognostický význam této mutace zůstává stále kontroverzní. Vedle molekulárních biomarkerů představuje jednu z dalších možností vyšetření imunitního infiltrátu. Nedávno publikovaná data získaná od pacientů s kolorektálním karcinomem prokazují, že přítomnost efektorových T-lymfocytů (Th1-lymfocyty, cytotoxické T-lymfocyty a paměťové T - lymfocyty) v nádorové tkáni je pozitivním prognostickým faktorem. Význam imunitní reakce mj. v kontrole lokálního růstu nádoru, způsobu a rozsahu jeho lokální invaze a metastazovaní potvrzuje skutečnost, že přítomnost těchto efektorových T-lymfocytů je v korelátu s histopatologickými nálezy vylučujícími časné metastatické šíření nádoru (perineurální šíření, angioinvaze, lymfangioinvaze). Vedle intratumorózních T-lymfocytů je nádorová tkáň infiltrována antigen prezentujícími buňkami (dendritické buňky), které jsou zcela klíčové pro zahájení imunitní odpovědi. Prognostický význam jednotlivých subpopulací dendritických buněk v nádoru není zatím zcela objasněn.
Na našem pracovišti byla provedena retrospektivní studie s cílem určit význam imunitního infiltrátu u kolorektálního karcinomu a jeho korelaci s K-ras mutacemi pro prognózu onemocnění. Výsledky této studie prokázaly, že kombinací molekulárních biomarkerů s imunologickými daty lze získat slibný prognostický faktor, pomocí kterého by bylo možné identifikovat rizikové pacienty ohrožené rekurencí onemocnění. Jedná se o pacienty s mutací K-ras v kodonu 13, nízkou denzitou intratumorózních T-lymfocytů a vysokým poměrem nezralých/zralých (CD1a+/DC–LAMP+) dendritických buněk v nádoru.
Peritonektomie a HIPEC u kolorektálního karcinomu
Vítek P., Antoš F.
Nemocnice Na Bulovce, Praha
U cca 17 % nemocných s metastazujícími nádory kolorekta (CRCA) se nádorové postižení šíří také per continuitatem formou drobnoložiskového peritoneálního rozsevu a u cca 2 % je to jediná forma šíření. Peritoneální karcinomatóza představuje prognosticky nepříznivou formu rozsevu s kratším přežíváním a kratší dobou do progrese, pokud je dosaženo terapeutického efektu. V terapii peritoneální karcinomatózy byla již v devadesátých letech vyvinuta metodika peritonektomie nebo maximální cytoredukce s hypertermickou intraperitoneální peroperační chemoterapií – laváží (HIPEC). Pro HIPEC se u CRCA užívá oxaliplatina nebo mitomycin C se stejnou účinností. Lze pak dosáhnout relativně dlouhého přežívání až přes 24 měsíců. V ojedinělé randomizované studii srovnávající peritonektomii s HIPEC a následnou chemoterapií proti standardní chemoterapii bylo dosaženo signifikantní prodloužení přežívání 22,2 měsíců, resp. 12,6 měsíců. Z těchto zdánlivě jednoznačných výsledků se nyní 15 let po zahájení studie obtížně odvodí závěry. V první řadě standardní chemoterapie ve srovnávacím rameni studie (FUFA) již nyní zdaleka není standardní. Dále soubor zahrnoval nemocné s nádory primárně apendikálního původu, které mají s využitím HIPEC lepší prognózu než primární nádory kolorekta. O několik let později již retrospektivní analýza z klinik s delší erudicí v peritonektomiích a HIPEC již umožňuje stratifikovat soubor 1290 nemocných s karcinomatózou gastrointestinálního původu. Z toho u 523 nemocných s karcinomatózou původu CRCA se dosahuje mediánu přežívání 30 měsíců a doby do progrese přes 18 měsíců. Jako nejvýznamnější prognostické faktory byly v dalších studiích vedle primárního origa shodně identifikovány rozsah postižení v době diagnózy (Peritoneal Cancer Index – PCI) a rozsah chirurgického výkonu (Completness of Cytoreduction – CC).
Metoda peritonektomie a HIPEC má jednoznačnou indikaci a suverénní účinnost s mnohaletým přežíváním v léčbě klinické jednotky pseudomyxoma peritonei (medián přežívání obvykle není ve sledovaných souborech dosažen), která je nejčastěji původu apendikálního. Primární CRCA se formou pseudomyxomatu peritonea šíří jen velmi ojediněle. Přesto je peritonektomie s HIPEC u CRCA racionální, a to jen pokud není vedle karcinomatózy peritonea další viscerální neresekovatelné postižení, zvláště ne extraabdominální. To je splněno pouze u 2 % generalizovaných nádorů kolorekta.
V Nemocnici Na Bulovce je metoda peritonektomie a HIPEC zavedena již 14 let. Bylo léčeno již 230 nemocných. Hlavní indikací k výkonu jsou nádory spadající do klinické jednotky pseudomyxoma peritonei a nádory typu mezoteliomu peritonea epiteliálního typu. Přesto byla peritonektomie provedena i u 35 specifických nemocných s primárním CRCA šířícím se formou peritoneální karcinomatózy. Absence neresekabilních metastáz v parenchymových orgánech a absence extraabdominálního šíření je striktně dodržovaná podmínka. Výkon byl doplněn HIPEC s parametry: doba trvání výkonu 90 min, účinná látka – mitomycin C, izotonický nosný roztok – 0,9% NaCl v celkovém objemu do 3000 ml, teplota 42–43 °C. V časném pooperačním období byla dále aplikována „perioperační intraperitoneální chemoterapie“ (EPIC) 5-fluorouracilem v 5 po sobě následujících dnech. V dalším průběhu byli nemocní léčeni podle úvahy ošetřujícího onkologa, převážně kombinacemi paliativní chemoterapie a biologické léčby.
Dosahujeme intervalu do progrese onemocnění o mediánu nad 20 měsíců. Medián přežívání nepřesahuje 30 měsíců. HIPEC významně nezvyšuje pooperační morbiditu. Neutropenie a trombocytopenie jsou po HIPEC ojedinělé.
I přes náročnost a nákladnost výkonu je interval do progrese onemocnění dlouhý. Pravděpodobně by takové efektivity nebylo možné dosáhnout intenzivní chemoterapií a biologickou léčbou (mj. s významně vyššími náklady), byť přímým srovnáním přirozeně nedisponujeme. Parametr přežívání není reprezentativní s ohledem na chemoterapii a bioterapii nepravidelně aplikovanou v období po výkonu, při progresi onemocnění. Peritonektomie a HIPEC vysoce přínosná metoda, kterou lze u některých pokročilých CRCA dosáhnout významné efekty a pravděpodobně i prodloužit přežívání, a to i přestože CRCA není prioritní indikací metody. Za omezených podmínek, v nichž se v ČR na jediném pracovišti nyní peritonektomie HIPEC provádějí, prokazují vlastní výsledky, jak zásadní význam má správná indikace výkonu pouze u CRCA s dominantním peritoneálním šířením per continuitatem a současně správné provedení cytoredukčního výkonu do maxima možností.
KARCINOM KOLON A KARCINOM REKTA: DVĚ KLINICKÉ ENTITY?
Skutečně dvě entity?
Hoch J.
Chirurgická klinika 2. LF UK a FNM, Praha
Karcinom tlustého střeva a karcinom konečníku je běžně považován za jedno onemocnění, které se liší pouze lokalizací nádoru. Podobnost a současně odlišnost nádoru v obou lokalitách vede k otázce, zda se jedná o jednu či dvě patologické entity.
Etiologie karcinomu je shodná: Až 90 % karcinomů je sporadických a vzniká maligní přestavbou adenomových polypů. Nádory, které nevznikají z polypů, tzv. nonpolypózní karcinom, postihují tlusté střevo, nikoli rektum. Ačkoli progrese nádoru ve střevní stěně a lymfatické a hematogení šíření je podobné, projevy obou nádorů se v pokročilých stadiích liší: Nádory tlustého střeva vedou častěji ke vzdálenému metastatickému postižení, nádory konečníku k postižení lokoregionálnímu.
Anatomické rozdíly jsou zřejmé. Tlusté střevo je uloženo intraperitoneálně, dlouhé mezokolon ponechává všem oddílům tračníku značnou pohyblivost, peritoneem je kryta ventrální plocha celého tlustého střeva. Krevní zásobení pochází z horních i dolních mezenterických cév, lymfatický spád je víceetážový, ve všech úsecích sice směřuje centripetálně, ale v některých úsecích aborálním a v dalších orálním směrem. Rektum je ze dvou třetin uloženo extraperitoneálně v pánvi, jeho uložení nedovoluje dosáhnout pohyblivosti tračníku. Kromě obtížného přístupu při operaci je omezená pohyblivost rekta důležitá pro radioterapii. Krevní zásobení je cestou dolní mezenterické tepny a jen zlomkem z vnitřních ilických tepen. Lymfatický spád směřuje přes mezorektum vertikálně. Pouze orální třetina rekta je kryta peritoneem. Anatomické rozdíly jsou příčinou nestejného šíření nádoru ve střevní stěně a v lymfatickém spádu. Funkčně je postradatelné tlusté střevo i konečník, odstranění konečníku však hrubě narušuje fyziologickou kontinenci a vyžaduje nezřídka stomii.
Zejména anatomické rozdíly jsou důvodem, proč se léčba nádorů tračníku a konečníku a jejich komplikací liší. Operace rekta patří mezi nejnáročnější břišní operace, jednak kvůli nesnadnému přístupu a technické náročnosti, jednak kvůli vysokému riziku závažných časných i pozdních komplikací včetně recidiv. Převažuje shoda, že tyto operace patří na specializovaná pracoviště. Počet operací pro nádor tlustého střeva je v ČR více než 2krát vyšší než pro nádor konečníku, operace na tračníku jsou v mnoha ohledech snáze proveditelné, akutně je operováno až 15 % nemocných. I když onkologická závažnost se neliší od nádorů konečníku, argumentace ve prospěch léčby na specializovaných pracovištích není jednotná. Všechny zmíněné momenty mají vliv na výsledek léčby. Kromě pooperačních komplikací to je onkochirurgická radikalita, která vypovídá o kvalitě chirurgické operace. Vedle dostatečné vzdálenosti proximálního a distálního resekčního okraje o kvalitě operace vypovídá cirkumferenční resekční okraj, rozsah lymfadenektomie vyjádřený mj. počtem získaných lymfatických uzlin a správné odstranění mezokolona, resp. mezorekta. Oba posledně zmíněné anatomické prostory jsou přirozenou lokalizací spádových lymfatik, včetně metastaticky postižených uzlin. Poznání, že tyto celky jsou pokračováním embryonálního vývoje střeva, umožnilo v průběhu posledních dvou desetiletí rozpracovat techniku totální excize mezorekta (TEM) a kompletní excize mezokolon (CME) a zavést je do praxe. Dokonalé zvládnutí a dodržování obou postupů vedlo ke snížení počtu lokálních recidiv a dokonce prodloužení přežití až o 15 %.
Etiopatologická podobnost nádorů tlustého střeva a konečníku svádí je nerozdělovat ve dvě zásadně odlišné entity, naopak prakticky orientované aspekty zaměřené na operační a radiační léčbu z těchto nádorů dvě entity činí.
Histopatologická a molekulárně genetická heterogenita karcinomů tlustého střeva s ohledem na lokalizaci primárního nádoru
Ryška A., Hovorková E., Hadži-Nikolov D., Vošmiková H., Kamarádová K.
Fingerlandův ústav patologie LF UK a FN, Hradec Králové
Levostranný a pravostranný karcinom tlustého střeva jsou dvě diametrálně odlišné choroby, které mají nejen odlišnou klinickou symptomatologii, ale rovněž rozdílnou etiologii, molekulární patogenezi a vyžadují jisté odlišnosti v diagnostickém algoritmu.
Vliv protokolu na kvalitu léčby
Zonča P.1, Ihnát P.1, Dvořáčková J.2, Delongová P.2
1Chirurgická klinika FN a LF, Ostrava
2Ústav patologie FN a LF, Ostrava
Efektivní léčba pacientů s kolorektálním karcinomem je založená na multidisciplinárním přístupu s nutností sestavování individualizovaného léčebného plánu založeného na přesném stagingu onemocnění. Cílem této chirurgicko-patologické studie bylo vyhodnocení vlivu zavedení standardního patologického protokolu na kvalitu hodnocení preparátů resekovaného kolorektálního karcinomu.
Standardní patologický protokol na hodnocení preparátů resekovaného kolorektálního karcinomu byl vytvořen a zaveden ve FNO do praxe od 1. 1. 2013. Protokol byl vytvořen v souladu s platnými NCCN guidelines pro karcinom kolorekta a dle doporučení American Joint Commitee on Cancer (AJCC). Do studie byli zařazení všichni pacienti, kteří podstoupili resekci pro kolorektální karcinom ve FNO v prvním pololetí 2013. Získaná data byla srovnána se souborem pacientů po resekci kolorektálního karcinomu ve FNO v letech 2011–2012, a statisticky testována.
V období od 1. 1. 2013 do 30. 6. 2013 byla ve FNO vykonána resekce kolorekta u 51 pacientů. Kontrolní soubor pacientů po resekci kolorekta v období od 1. 1. 2011 do 31. 12. 2012 byl tvořen 184 pacienty. V resekátech kolorekta byl počet nalezených lymfatických uzlin (LU) 12,5 ± 6,3 (kolon) a 12,6 ± 6,2 (rektum) v kontrolním souboru pacientů. Po zavedení protokolu byl počet LU 15,0 ± 4,6 (kolon) a 16,8 ± 6,7 (rektum); rozdíly jsou statisticky signifikantní.
Před zavedením protokolu nebyl dosažen požadovaný limit 12 LU u 49 pacientů s karcinomem kolon (43,8 %) a u 32 pacientů s karcinomem rekta (44,4 %). Po zavedení standardního protokolu nebyl dosažen limit 12 LU u pěti pacientů s karcinomem kolon (18,5 %) a u čtyř pacientů s karcinomem rekta (16,7 %). Rozdíly jsou statisticky signifikantní.
Byli prokázané rovněž signifikantní rozdíly v početnosti vyhodnocení cirkumferenčního resekčního okraje, početnosti hlášení stupně diferenciace karcinomu (grading) a známek mikroskopické agresivity tumoru (intravaskulární invaze, perineurální šíření) ve prospěch histopatologických zpráv po zavedení standardního protokolu.
Implementace standardního patologického protokolu do praxe při vyhodnocování preparátů resekovaného kolorektálního karcinomu zvyšuje kvalitu definitivní histopatologické zprávy. To má za následek přesnější staging onemocnění, správnou indikaci adjuvantní léčby a zlepšení přežívaní pacientů s kolorektálním karcinomem.
ONKOLOGICKÁ LÉČBA
Možnosti léčby mCRC v závislosti na stavu onkogenů RAS
Tomášek J.
Masarykův onkologický ústav, Brno
Molekulární vyšetření nádorové tkáně pacientů s metastatickým kolorektálním karcinomem (mCRC) se stalo rutinní praxí. Do poloviny roku 2013 jsme stanovovali mutační stav onkogenu KRAS v exonu 2. Průkaz aktivační mutace KRAS predikuje rezistenci k inhibitorům receptoru pro epidermální růstový faktor (EGFR), tedy k cetuximabu a panitumumabu. V roce 2013 byla publikována data z rozšířené molekulární analýzy klinické studie III. fáze PRIME. V této studii byla testována účinnost panitumumabu s chemoterapií FOLFOX4 v 1. linii léčby mCRC proti chemoterapii FOLFOX4 samotné. Výsledky prokazují, že stejný prediktivní význam jako KRAS v exonu 2 má stav KRAS v exonu 3 a 4 a stav NRAS v exonu 2, 3 a 4, hovoříme o rodině onkogenů RAS. U skupiny pacientů s nemutovaným RAS (WT RAS) bylo celkové přežití (OS) delší v rameni s panitumumabem o 5,8 měsíce (26,0 vs. 20,2 měsíce, HR 0,78; 95% CI, 0,62–0,99; p = 0,043), podobně bylo prodlouženo také přežití bez progrese (PFS) (10,1 vs. 7,9 měsíce, HR 0,72; 95% CI, 0,58–0,90; p = 0,004). V případě mutace RAS (MTRAS) vedla kombinace panitumumab s FOLFOX4 k signifikantnímu zkrácení jak OS, tak PFS. V případě panitumumabu platí doslova, že pokud není lék indikován, je kontraindikován. Tyto výsledky vedly ke změně indikačních kritérií v SPC Vectibixu (panitumumab).
Recentně byla v září 2013 na kongresu ECC 2013 v Amsterodamu prezentována data rozšířené molekulární analýzy klinické studie III. fáze FIRE-3, do které byli zařazováni nepředléčení pacienti s mCRC WT KRAS a randomizováni byli do ramene FOLFIRI+ cetuximab nebo FOLFIRI + bevacizumab. Prokázalo se, že pacienti MT RAS nemají z přidání cetuximabu k chemoterapii FOLFIRI žádný prospěch. U pacientů WT RAS bylo v obou ramenech dosaženo obdobné odpovědi na léčbu (ORR) i PFS, přežití bylo signifikantně delší v rameni s cetuximabem (33,1 vs. 25,6 měsíce, HR 0,70; 95% CI, 0,53–0,92; p = 0,011). Nakolik byl výsledek OS ovlivněn léčbou ve druhé a vyšších liniích je předmětem diskuzí.
V případě pacientů s mutací onkogenu RAS (KRAS) je ve většině případů vhodné do 1. linie použít některý intenzivní režim na bázi oxaliplatiny nebo irinotekanu v kombinaci s bevacizumabem. Složitější je situace v případě nemutovaného typu RAS (KRAS). Zde lze zahájit chemoterapií v kombinaci jak s inhibitory EGFR (a použití inhibitorů VEGF nechat do 2. linie), tak s bevacizumabem (a inhibitory EGFR nechat do pozdějších linií). Řadu odpovědí jistě přinesou výsledky a analýzy mimořádně robustní studie III. fáze CALGB 80405. Do studie byli zařazováni pacienti s mCRC WT KRAS (n = 2900), kteří byli léčeni chemoterapií FOLFOX nebo FOLFIRI a randomizovaně cetuximabem nebo bevacizumabem. Primárním sledovaným ukazatelem studie je celkové přežití, sekundárně jsou hodnoceny RR, PFS a dosažení resekability u neresekabilních metastáz. Výsledky lze očekávat v roce 2014. Je jasné, že nebudeme mít nikdy randomizovaná data všech možných režimů léčby a sekvencí, lze však předpokládat, že s širším využitím nových biomarkerů bude možné vybrat účinný režim terapie pro konkrétního pacienta přesněji, což se odrazí v dalším prodloužení života pacientů. Jak se to bude dařit u našich pacientů, to ukáží výsledky z registru CORECT. Do tohoto registru jsou zaznamenávána data dominantní většiny pacientů s mCRC, kterým je podávána cílená léčba v Komplexních onkologických centrech ČR.
Účinnost terapie bevacizumabem u nemocných s mCRC bez průkazu mutace K-RAS
Kubáčková K.1, Hejduk K.2, Bortlíček Z.2, Brabec P.2, Prausová J.1
1FNM, Praha
3IBA MÚ, Brno
Standardním léčebným přístupem pro první linii metastatického karcinomu kolorektálního karcinomu je chemoterapie v kombinaci s monoklonálními protilátkami, bevacizumabem ovlivňujícím nádorovou novotvorbu cév či anti-EGFR monoklonálními protilátkami (panitumumab, cetuximab). Mutační stav KRAS genu je validovaný prediktivní marker odpovědi pro anti-EGFR léčbu. Pro bevacizumab neexistují žádné validizované biomarkery. V naší analýze jsme se zaměřili na hodnocení léčebného efektu u skupiny nemocných s nemutovaným KRAS léčených kombinací bevacizumabu s chemoterapií. Medián doby do progrese byl 11,3 měsíce a medián celkového přežívání 28,4 měsíce. Data o efektivitě této léčebné kombinace jsou konzistentní s léčebným efektem kombinace chemoterapie s anti-EGFR protilátkami a potvrzují účinnost bevacizumabu i u nemocných s nemutovaným KRAS.
Neoadjuvantní terapie karcinomu rektave FN v Motole
Prausová J.
2. LF UK a FNM, Praha
Sdělení se zabývá hodnocením výsledků vlastního souboru pacientů léčených ve FN v Motole v letech 1998–2006 neoadjuvantní konkomitantní chemoradioterapií či samotnou radioterapií.
Z celkového počtu 266 pacientů v souboru bylo po neoadjuvantní léčbě operováno 91,7 %, inoperabilních pacientů zůstalo po neoadjuvanci 8,3 % bez ohledu na typ neoadjuvantní terapie. Nejčastějším typem operace byla resekce rekta s anastomózou, která umožnila zachovat nemocným pasáž. Při histopatologickém hodnocení operovaných pacientů byla u 8,6 % stanovena pCR. Redukce objemu primárního nádoru byla statisticky významně lepší ve prospěch konkomitantní chemoradioterapie oproti samotné radioterapii. Hodnocení uzlinového postižení přesným počtem histologicky pozitivních uzlin infiltrovaných nádorem z počtu vyšetřených uzlin bylo u 168 pacientů a „cut-off“ hodnota pro minimální počet vyšetřovaných uzlin byla více než 5. K lokální recidivě onemocnění došlo u 17,2 % pacientů, to představuje vyšší procento než ve srovnatelných mezinárodních studiích. Četnost recidiv vzrůstá s výší vstupního klinického stadia. Metastatické postižení vzniklo u 19,2 % nemocných s mediánem doby vzniku 15 měsíců. Tento údaj je nižší než u srovnatelných mezinárodních studií. Statisticky významný je ve sledovaném souboru vztah mezi výskytem metastáz a Dukesovou klasifikací, vztah mezi výskytem metastáz přítomností angioinvaze v nádoru.
Medián celkového přežití i bezpříznakového přežití je statisticky významně závislý na velikosti tumoru před zahájením léčby, je statisticky významně závislý na přítomnosti angioinvaze a gradingu nádoru, je statisticky významně závislý na typu léčby ve prospěch konkomitantní chemoradioterapie.
Na našem souboru nemocných bylo prokázáno, že neoadjuvantní léčba je významný posunem v léčebné strategii karcinomu rekta a ve shodě s mezinárodními studiemi potvrzuje správnost zařazení této léčebné modality ke zlepšení výsledků léčby karcinomu rekta i zachování kvality života pacienta. Lepších výsledků je dosaženo konkomitantní chemoradioterapií než samotnou radioterapií. Práce také podtrhuje význam rizikových vstupních faktorů pro výsledek léčby (stadium onemocnění, přítomnost angioinvaze, grading). Pro správnou volbu léčebné strategie je nutná týmová spolupráce diagnostiků, chirurgů, onkologů a radioterapeutů.
Nové léky a jejich postavení v algoritmu léčbymetastatického kolorektálního karcinomu
Kiss I.
Klinika komplexní onkologické péče MOU A LF, Brno
Karcinomy tlustého střeva a konečníku jsou nejčastější nádory trávicího traktu a patří celosvětově mezi nejčastější malignity. Dle údajů získaných ze SVOD1 i v roce 2010 je incidence metastatického onemocnění v ČR stacionární, tj. kolem 23 % a u dalších téměř 50 % pacientů dojde ke generalizaci onemocnění v pozdější době. Nejčastěji metastazuje kolorektální karcinom do jater.
V léčbě metastatického inoperabilního onemocnění hraje nejdůležitější roli systémová chemoterapie, jejíž efekt je v posledních letech potencován „cílenou léčbou“. Léčebná odpověď je příznivým prognostickým faktorem, který se odráží i v prodlouženém přežívání pacientů. Největšího efektu ve smyslu prodlouženého přežití dosahuje farmakoterapie, která sekundárně vede ke konverzi inoperabilního onemocnění v radikálně operabilní a hlavně teprve po završení léčby R0 resekcí.
Základem léčby inoperabilního metastatického karcinomu je chemoterapie (dvojkombinace, trojkombinace) samostatně či v kombinaci s cílenou léčbou VEGF (bevacizumab) či EGFR (cetuximab, panitumumab) inhibitory. V roce 2013 byly do klinické praxe léčby metastatického karcinomu zavedeny další inhibitory angiogeneze – aflibercept a regorafenib.
Aflibercept (Zaltrap) je plně humanizovaný protein, označovaný jako VEGF TRAP, což je rekombinantní fúzní protein, který se skládá z VEGF – vazebných částí tvořených extracelulárními doménami lidských VEGF receptorů 1 a 2 fúzovaných k Fc části lidského IgG1. Aflibercept blokuje VEGF a PlGF, vykazuje silnější vazbu k VEGF než bevacizumab s biologickým poločasem t1/2 ~ 17 dnů. Efekt v léčbě metastatického kolorektálního karcinomu (mKRK) prokázal aflibercept v kombinaci s chemoterapií na bázi irinotekanu (FOLFIRI) ve 2. linii léčby ve fázi III. klinického hodnocení VELOUR. Do studie byli zařazeni pacienti s histologicky potvrzeným metastatickým adenokarcinomem kolon či rekta bez možnosti kurativní terapie. U pacientů byl tolerován jen jeden předchozí chemoterapeutický režim pro metastatické onemocnění na bázi oxaliplatiny. Zařaditelní do klinického hodnocení byli i pacienti s relapsem onemocnění do 6 měsíců od ukončení adjuvantní chemoterapie na bázi oxaliplatiny a byla povolena i předléčenost bevacizumabem. Ve studii VELOUR aflibercept přináší signifikantní zlepšení mediánu celkového přežití (OS) i doby do progrese (PFS). OS byl téměř o 50 % vyšší po 2 letech (28,0 % vs. 18,7 %) a o 86 % vyšší po 30 měsících (22,3 % vs. 12,0 %) pro pacienty léčené afliberceptem v kombinaci s FOLFIRI ve srovnání s režimem FOLFIRI samotným. Analýza podskupin ukazuje zlepšení OS i PFS nezávisle na předchozím předléčení či nepředléčení bevacizumabem, navíc předchozí předléčení bevacizumabem v 1. linii terapie nezvyšuje VEGF nežádoucí účinky afliberceptu v 2. linii terapie. Aflibercept v kombinaci s chemoterapií FOLFIRI je alternativou pro 2. linii léčby mKRK, po selhání chemoterapie na bázi oxaliplatiny. V této indikaci je alternativou ke kombinaci FOLFIRI s bevacizumabem na (studie TML) a stejně tak FOLFIRI s panitumumabem (studie 20050181).
Regorafenib (Stivarga) je prvním perorálním multikinázovým inhibitorem s průkazem účinnosti u metastatického kolorektálního karcinomu (mKRK). Efektivitu prokázal v rámci studie CORRECT, kde regorafenib zvýšil OS a PFS u pacientů s mKRK, kteří selhali na standardní dosavadní terapii (předlétni režimy na bázi irinotekanu i oxaliplatiny). Studie fáze III. splnila primární cíl, OS: 6,4 vs. 5,0 měsíců, HR = 0,77, p = 0,0052, PFS: 1,9 vs. 1,7 měsíců, HR = 0,49, p < 0,000001, DCR (PR + SD): 41,0 % vs. 14,9 %, p < 0,000001. V analýze podskupin regorafenib prokázal benefit OS a PFS u všech vyspecifikovaných podskupin. Účinnost regorafenibu nebyla závislá na mutačním stavu K-RAS a nebyly pozorovány nové či neočekávané závažné nežádoucí účinky. Nejčastějším nežádoucím účinkem stupně 3 byly hand-foot syndrom, únava, průjem, hypertenze a rash.
Regorafenib prokázal svojí účinnost u skupiny těžce předléčených pacientů, kteří profitovali z toho, že se signifikantně oddálila další progrese. Regorafenib je tak na základě studie alternativou šetrné, systémové léčby po selhání chemoterapie na bázi oxaliplatiny a irinotekanu, tedy do 3. nebo 4. linie léčby.
SOUČASNÁ ÚČINNÁ LÉČBA JATERNÍCH METASTÁZ KOLOREKTÁLNÍHO KARCINOMU V RÁMCI MULTIOBOROVÉHO TÝMU
Současný konsenzus v kurativní resekci jater přiléčbě nemocného s metastatickým kolorektálním karcinomem
Ryska M.
Chirurgická klinika 2. LF UK a ÚVN, Praha
Úvod: V incidenci kolorektálního karcinomu (KRK) je ČR trvale na předním místě na světě, zvláště pak u mužů. Trvale narůstá a dosahuje 8500 pacientů za rok. Z větší části se jedná o pacienty s pokročilým onemocněním: asi 25–30 % nemocných má v době stanovení primárního nádoru na střevě již zjistitelné metastatické postižení jater. U dalších cca 35 % se jaterní sekundarity vyvinou s časovým odstupem. Méně často nacházíme postižení plic, raritně mozek. Dříve byla terapie u metastatického postižení jater málo úspěšná. Léčebné možnosti se však u nemocných s diseminovaným onemocněním v průběhu posledních dvou desetiletí výrazně rozšířily. Nejúčinnější léčbou je chirurgicky jaterní metastázy radikálně odstranit, tj. provést kurativní resekci. Tato může být provedena primárně po jejich zjištění, kdy hovoříme o primárně resekabilních jaterních metastázách. V případě primárně neresekabilních metastáz, ať již z důvodů jejich mnohočetného bilobárního výskytu či velkém operačním riziku spojeném s lokalizací, se rozdělí tato skupina na dvě podskupiny v závislosti na léčebné odpovědi podané chemobioterapie. Zatímco po CT(MR) re-stagingu u skupiny bez léčebné odpovědi můžeme pokračovat v paliativní chemobioterapii, ze druhé skupiny s regresí jaterního postižení indikujeme část nemocných, u kterých jsme schopni ložiska odstranit, k operačnímu výkonu opět s cílem kurabilní resekce. U této skupiny, u které došlo po podání chemobioterapie k tzv. konverzi (odtud konverzní chemobioterapie). Poslední skupinu tvoří pacienti, u kterých po resekci došlo v průběhu dispenzárního sledování k opětovnému vytvoření metastatického ložiska a jsou indikováni k reresekci, opět s jejím kurabilním cílem.
Nejlepších výsledků v léčbě nemocných s metastatickým postižením jater při kolorektálním karcinomu lze dosáhnout kombinací resekčního výkonu se systémovou protinádorovou léčbou. U primárně resekabilních s adjuvantní, u části nemocných s primárně neresekabilními metastázami s neoadjuvantní (konverzní) a následně po operačním výkonu s adjuvantní systémovou léčbou. U části pacientů s primárně resekabilními metastázami je přínosné podávat neadjuvantní cytotoxickou léčbu. Přínos biologické léčby u této skupiny nemocných nebyl prokázán. V určitých případech, kdy nelze primárně jaterní resekci indikovat, zvažujeme možnost tzv. etapových výkonů (viz níže). Odstranění ložiska pomocí radiofrekvenční ablace (RFA) nelze v případě metastáz kolorektálního karcinomu považovat za kurabilní resekci. Nicméně z této ablativní metody může pacient v určitých případech výrazně profitovat. U nemocných, u kterých nelze metastatické ložiska odstranit, lze na určitou dobu onemocnění stabilizovat paliativní protinádorovou terapií.
Předpokladem úspěšné léčby jaterních metastáz kolorektálního karcinomu je proto především posoudit jejich resekabilitu s cílem jejich kurabilního odstranění. Podmínky kvalifikovaného rozhodnutí jsou následující:
- kvalitní zobrazení jaterního nálezu a eventuálních extrahepatických metastáz, určení jejich resekability (technicky),
- posouzení kvality nádorem nepostiženého jaterního parenchymu a jeho předpokládaného ponechaného objemu,
- posouzení technické proveditelnosti resekce a rizika výkonu zkušeným jaterním chirurgem (a anesteziologem),
- posouzení načasování resekce a systémové protinádorové léčby.
Vzhledem k tomu, že na léčbě těchto nemocných se podílí několik oborů (onkolog, chirurg, radiolog, radioterapeut, patolog, hepatolog, gastroenterolog, anesteziolog), pacienti jednoznačně profitují z jejich společného rozhodování a výběru optimálního terapeutického postupu u každého z nich v rámci multioborových komisí (MK), z tzv. personalizované medicíny.
Provedení adekvátního zobrazovacího vyšetření je zásadní jak pro stanovení diagnózy a stagingu, tak pro plánování chirurgického výkonu či terapeutického postupu vůbec. Má též význam pro následnou dispenzarizaci. Dalšími podmínkami jsou posouzení funkční kvality jaterního parenchymu a odhad objemu ponechané části jater (remnant). Hlavním smyslem předoperačního vyšetření je:
- definovat počet a segmentární či lobární distribuci metastáz, identifikovat eventuální přítomnost extrahepatických metastáz,
- určit resekabilitu na základě onkologického hlediska a technických možností.
Zobrazení jaterních a extrahepatických metastáz: V současné době je k identifikaci jaterních metastáz používána celá řada moderních metod – od ultrasonografie (US), přes CT, MR až po PET.
Abdominální ultrasonografie má v diagnostice jaterních metastáz KRK význam limitovaný, daný nízkou senzitivitou 50–70 % a významnou závislostí na kvalitě sonografisty („operator-dependent“ vyšetření). Nicméně s použitím mikrobublin (perflubutane ultrasound microbubbles) lze docílit o 20 % vyšší senzitivity. Tato metoda je dnes využívána především u malých lézí, kde může předčít i kontrastní CT vyšetření.
Dnes nejčastěji užívanými zobrazovacími vyšetřeními k detekci jaterních a plicních metastáz jsou multidetektorové CT (MDCT), magnetická rezonance (MR) a fluorodeoxyglukózová pozitronová emisní tomografie – F18-FDG. PET (PET) se senzitivitou 74,4 %, 80,3 % a 81,4 % („per lesion“) a 83,6 %, 88,2 % a 94,1 % („per patient“). Nicméně data z PET jsou obtížně srovnatelná s ostatními metodami. MR prokazuje ve srovnání s CT vyšší senzitivitu u ložisek menších než 10 mm (81,1 % oproti 74,8 % u pacienta, 86,3 % oproti 82,6 % u ložiska). Je však třeba zdůraznit, že tyto údaje opomíjejí zkušenosti konkrétních pracovišť, která dnes nejčastěji používají CT, MR a kontrastní ultrasonografii (CEUS – contrast-enhanced ultrasound) s tím, že MR je v současné době považována v určení charakteru jaterní léze za nejlepší. Nicméně CT v arteriální fázi ukáže chirurgovi vaskulární anatomii a vztah ložiska k těmto strukturám. Zobrazovací vyšetření mají své místo i po ukončení neadjuvantní chemoterapii. Při nekontrastním CT a MR se lze vyjádřit k jaterní steatóze, ale steatohepatitidu zobrazit nelze. Na sinusoidální poškození lze usuzovat na základě nepřímých známek portální hypertenze či použitím kontrastní látky při MR (Eovist). Pomocí CT volumetrie lze s dostatečnou přesností určit objem předpokládaného jaterního remnantu po plánované resekci.
Intraoperační US (IOUS) je v kombinaci s explorací chirurga v současné době nejlepším standardem k upřesnění patologického nálezu v jaterním parenchymu a jeho vztahu se strukturami. Původní operační plán mění u každého čtvrtého pacienta. V sestavě 250 nemocných oproti předoperačnímu nálezu při kontrastním CT vyšetření navíc odhalilo patologickou lézi v jaterním parenchymu u 27 % nemocných.
Pro detekci extrahepatických metastáz se dnes většinou používá kombinace CT a PET. Zatímco s vysoce kvalitním CT u většiny pacientů vystačíme, PET může u části nemocných prokázat metabolicky aktivní ložiska navíc. V současné době je proto PET indikován pouze u nemocných s vysokým rizikem extrahepatálního šíření KRK s tím, že jeho senzitivita je u nemocných po neadjuvantní chemoterapii nižší.
Nálezy při zobrazovacích vyšetření je třeba vždy posuzovat v celém kontextu rozhodovacího procesu MK u konkrétního pacienta. Hrubou chybou je poskytnutí informace na základě přecenění jednoho, mnohdy z kontextu vytrženého, nálezu.
Určení resekability jaterních metastáz: Po vyloučení kontraindikací k provedení velkého nitrobřišního výkonu vzhledem k internímu nálezu ze strany anesteziologa je vhodné determinovat resekabilitu z hlediska onkologického a technického. Z onkologického hlediska je třeba zvážit možnosti léčby eventuálních extrahepatických metastáz a případnou odpověď na neadjuvantní systémovou léčbu. Z technického hlediska musíme posoudit radikalitu resekce s odstraněním všech metastáz do zdravé tkáně při ponechání dostatečného objemu funkčního jaterního parenchymu.
A – Onkologická resekabilita: Z onkologického hlediska je cílem léčby, při současných možnostech účinné systémové protinádorové terapie, dosáhnout úplného odstranění jak jaterních, tak i mimojaterních metastáz.
- I – Při zjištění extrahepatického onemocnění je třeba zhodnotit lokalizaci, multiplicitu, rozsah a možnosti resekce všech ložisek. Pokud nehovoříme o primární lokalizaci KRK a jeho eventuální rekurenci, nejčastější lokalizací jsou intraabdominální lymfatické uzliny a plíce. Extrahepatická diseminace je po provedené resekci jaterních metastáz vedle pozitivní resekční plochy a počtu ložisek nezávislým negativním faktorem výsledku léčby: Zatímco po odstranění izolovaných plicních metastáz či periportální lymfadenopatii pacient přežívá 5 let ve 30–40 % a při rozsahem limitované peritoneální diseminaci v 15–30 %, při mnohočetných aortokaválních ložiscích z jaterní resekce pacient neprofituje a 5 let se dožívá méně než v 15 % případů. Rekurence onemocnění je u nemocných s extrahepatickou diseminací po resekci jater zaznamenána v 84–95 %. Z výše uvedených důvodů plyne, že u pacientů, u kterých lze radikálně extrahepatické metastázy odstranit (např. izolovanou periportální lymfadenopatii či izolovanou plicní metastázu) není jaterní resekce kontraindikována a pětileté přežití u této skupiny nemocných se blíží výsledku u skupiny bez extrahepatických ložisek. Pokud nelze extrahepatická ložiska odstranit, jaterní resekci neindikujeme.
- ,II – U nemocných indikovaných k podání systémové terapie před plánovanou resekcí jater dojde k regresi ložisek ve více než 85 %. U části z nich lze kurabilní jaterní resekci provést. U zbylé skupiny progrese v průběhu terapie svědčí pro agresivní biologické chování nádoru. Vzhledem k nízkému procentu pětiletého přežívání po hepatektomii resekci jaterních ložisek někteří autoři nedoporučují. R. Adam prokázal, že pokud dojde v průběhu protinádorové terapie k progresi u pacienta s více než třemi jaterními ložisky, jeho šance na pětileté přežití po jaterní resekci je pouze 8 %. I když některé pozdější studie tento názor změkčují, je všeobecně přijato, že tvorba nových ložisek v průběhu systémové léčby je významným negativním faktorem výrazně snižujícím přežívání po hepatektomii.
B – Technická resekabilita: Kvalifikovaný odhad resekability závisí na posouzení lokalizace jaterních metastáz, anatomického uspořádání jater, jejich funkce, odhadu velikosti jaterního remnantu v rámci MK. Podmínkou kurabilní resekce je dosažení radikálního odstranění ložisek s negativními okraji při ponechání minimálně dvou sousedících segmentů s adekvátním cévním přítokem a odtokem a s adekvátní biliární drenáží. V současné době jde především o přesné posouzení jaterního remnantu z hlediska objemu a funkce, dále o zvolení vhodné strategie operačního výkonu a dodržení negativních resekčních okrajů. I – Odhad adekvátního objemu ponechaného jaterního parenchymu je umožněn tzv. volumetrií, nejčastěji CT volumetrii. Umožňuje stratifikovat pacienty podle rizika rozvoje poresekčního jaterního selhání. Navíc může být vodítkem, kdy u pacienta provést portální venózní embolizaci (PVE) s cílem dosáhnout hypertrofie předpokládaného jaterního remnantu a umožnit provedení velké jaterní resekce. Zatímco zdravý jaterní parenchymu toleruje snížení objemu až na 25–20 %, volum jater po systémové protinádorové terapii či při fibrotické přestavbě by neměl podkročit 40 % původního objemu.
- II – Odhad ponechaného jaterního objemu nemusí korelovat s adekvátní jaterní funkcí. K objektivizaci funkce jater se používá celá řada funkčních testů: ICG, hodnota sérového bilirubinu či agregovaná skóre – např. MELD. Při chronickém jaterním onemocnění je vhodné provést jaterní biopsii s vyšetřením eventuální histologické abnormality. V každém případě je nutné dát výsledek do korelace s ostatními údaji (absolvovaná chemoterapie, obezita, prodělaná virová hepatitida apod.). Skutečnost, že PVE vede u nemocného ke zjevné hypertrofii, je posuzována jako pozitivní faktor funkce jaterního remnantu. Naopak: nedojde-li po PVE k hypertrofii objemově alespoň o 5 %, můžeme hovořit o vysokém riziku pooperačního jaterního selhání.
- III – Strategie resekčního výkonu odvisí od lokalizace, velikosti a množství jaterních metastáz. V případě malých resekcí je jednodobý výkon bezpečný. V případě biliární lokalizace ložisek existuje několik možností, jak docílit kurabilní resekce. Nejčastěji se provede výkon dvoudobý, kdy v první době odstraníme ložiska v předpokládaném jaterním remnantu na straně kontralaterální následné PVE. Ve druhé době po kontrole hypertrofie remnantu po PVE provádíme resekci jater ipsilaterálně. Dlouhodobé přežití u těchto nemocných se překvapivě blíží skupině po jednodobém výkonu. Perkutánní PVE je považována ve srovnání s prostou ligaturou větve v. portae za efektivnější. Nově se v rámci klinického experimentu analyzuje přínos metody ALPPS (associating liver partition and portal vein ligation for stage hepatectomy), u které je popisována dostatečná hypertrofie v průběhu 2 týdnů. Nicméně řada autorů popisuje s metodou spojenou vysokou morbiditu a mortalitu (40 %, resp. 12 %).
- IV – Podmínky na onkologickou radikalitu stran negativních okrajů resekční plochy se v průběhu posledního desetiletí výrazně změnila. R0 resekce původně znamenala dodržení minimálně 1 cm širokého lemu zdravé tkáně. V současné době je prokázáno, že jedinou podmínkou dodržení pravidla R0 resekce je pouhá negativita okrajů, nikoliv její šíře. Tento závěr je podložen genetickou a patologickou studií.
Léčba tzv. mizejících metastáz kurabilní resekcí: Jaterní ložiska jsou u části nemocných po podání neadjuvantní chemoterapie při kontrolním zobrazovacím vyšetření obtížně detekovatelná či dokonce nedetekovatelná, při PET mohou původní ložiska jevit známky non-viability. Hovoříme o pozitivní odpovědi na podanou systémovou terapii. Nacházíme ji jak u nemocných primárně neresekovatelných, tak i resekovatelných, je spojena především s podáním biologické léčby a je pro pacienta nepochybně pozitivním faktorem. Nicméně kompletní rentgenologická odpověď není totožná s kompletní „sanací“ metastáz a bývá pro následnou léčbu závažným problémem z následujících důvodů:
- Mohou být mylně považována za „vyléčená“ (překvapivě častý omyl).
- Při resekčním výkonů mohou být tato ložiska v jaterním remnantu mylně ponechána, protože nejsou pro chirurga při operaci detekovatelná.
Výskyt mizejících metastáz u 5–38 % pacientů bývá vyšší zejména v případě nekvalitního nebo nekompletního vyšetření před zahájením léčby nebo v situaci, kdy je přesnost kontrastního CT vyšetření snížena přítomností steatózy či steatohepatitidy. U těchto nemocných je indikována MR.
Z výše uvedených důvodů je snahou se této kompletní odpovědi vyvarovat a to omezením počtu cyklů chemo(bio)terapie a časnějším provedením re-stagingového zobrazovacího vyšetření. Při pozitivní odpovědi je třeba rentgenologickému „vymizení“ metastáz předejít včas indikovaným chirurgickým výkonem. V případě, že již tato situace nastane, je doporučeno po provedení hepatektomie pokračovat v lokoregionální chemoterapii intraarteriálním přístupem (HAI – hepatic artery infusion) aplikací oxaliplatiny. Nicméně cílem i u této skupiny nemocných je provést resekční výkon kurabilně.
Zásadní význam resekce jaterních metastáz: Současné výsledky ukazují, že správně indikovaná a provedená resekce jaterních metastáz dokáže signifikantně prodloužit život pacientů. Za prognostické faktory se považuje velikost jaterní metastázy > 5 cm, počet > 4, bilobární charakter postižení, invaze do lymfatických uzlin pediklu a vysoká hladina CEA.
V naší republice bohužel není vždy chirurgická intervence zvažována na prvním místě. Pacienti s jaterními metastázami dostávají většinou primárně systémovou léčbu a možnost provedení resekce je odsunuta. Ne vždy jsou však jaterní metastázy operabilní. Velká retrospektivní studie autorů Kopetz a spol. ukázala na souboru 2470 pacientů přibližně 20 % primární operabilitu jaterních metastáz s tím, že pětiletého přežití se dožilo 55,2 % pacientů v porovnání s 19,5 %, kteří operaci neprodělali. Význam operability jaterních metastáz se jeví jako zásadní pro prognózu onemocnění. Radikální resekce jater u nemocných s jaterními metastázami KRK přináší ve srovnání s jinými léčebnými modalitami signifikantně nejdelší přežívání a to nehledě na výrazný léčebný pokrok biochemoterapie. Až 60 % nemocných, u kterých byla provedena resekce jater R0 s následnou adjuvantní biochemoterapií se dožije 5 let od stanovení diagnózy. Zásadním problémem je nízké procento resekovatelných nemocných nepřevyšující 20 %. U těchto nemocných je nutné využít všech dostupných možností k dosažení downstagingu (downsizingu). Odpověď nádoru a sekundární resekabilita jaterních metastáz KRK po neadjuvantní chemoterapii v kombinaci s cílenou léčbou cetuximabem prokázala randomizovaná studie 2. fáze CELIM u 111 pacientů s primárně neresekovatelnými metastázami (technicky neresekabilní nebo ≥ 5 metastáz). Ve skupině pacientů s neoadjuvantně podávaným cetuximabem v kombinaci s FOLFOX6 došlo ke konverzi u 20 (38 %), ve skupině s FOLFIRI u 16 (30 %) nemocných. Celkově tak byl pokus o konverzi (a tím i k resekci jater) úspěšný u 36 (32,5 %) primárně neresekovatelných nemocných (!). Ve zpětném srovnání léčebné odpovědi převládali nemocní s K-RAS divokého typu oproti mutovanému (70 % vs. 41 %, p = 0,008). Z tohoto důvodu je nejlepších výsledků dosahováno multimodální terapií s uplatňováním personalizovaného přístupu ke každému pacientovi s dodržením kritérií zachování co nejvyšší kvality jeho života. A to nehledě na celou řadu doposud nevyjasněných otázek týkajících se jednotlivých léčebných postupů. Vzniká tak pojem „oncosurge“ postihující celou komplexnost problematiky a především multidisciplinární přístup v léčbě těchto nemocných. „Oncosurge“ systém považuje provedení resekce všech metastatických ložisek za zásadní při ponechání zbytkového parenchymu zdravé tkáně > 20 %. Za prognostické faktory je považován PS a stav nepostiženého jaterního parenchymu. Extrahepatické metastázy nejsou a priori považovány za kontraindikaci resekčního výkonu. Takto lze v případě provedení resekce jater R0 dosáhnout více jak 50% pětiletého přežití.
Závěr: Efektivním diagnosticko-terapeutickým přístupem lze u pacientů s metastatickým postižením jater u kolorektálního karcinomu docílit pětileté přežití přesahující 50 %. Nejúčinnější léčbou je kurabilní resekce jater, kterou lze v současné době indikovat primárně u 20 až 25 % nemocných. U části nemocných lze resekci provést po konverzní systémové protinádorové léčbě. Lze také použít speciálních chirurgických technik (výkony kombinované, dvoudobé) či výkon umožnit po artificiálně vyvolané hypertrofii plánovaného jaterního remnantu. Současnou bezpečnost operačního výkonu, s mortalitou menší než 1 %, umožňuje nejen pokročilá operační technika, ale sofistikovaný odhad velikosti a funkčnosti ponechaného jaterního parenchymu, kvalitní perioperační péče anesteziologa a minimalizací hepatotoxického poškození jater předoperačně podávanou protinádorovou léčbou.
Úspěšná léčba u těchto nemocných závisí na těsné mezioborové spolupráci (multioborové komise), která na principu personalizované medicíny určuje léčebný a dispenzární postup u jednotlivých pacientů.
Poznámka: Upravený text publikován ve Farmakoterapii, Kolorektální karcinom, 2013.
Podpořeno granty IGA MZČR NT 13 660 a ZRO MO 1012.
Současné problémy při radikálním odstraněníjaterních a plicních metastáz a jejich možné řešení
Třeška V., Vodička J., Špidlen V., Liška V., Skalický T., Fichtl J., Sutnar A.
Chirurgická klinika FN, Plzeň
Úvod: Jaterní a plicní metastázy kolorektálního karcinomu se vyvinou přibližně u 20–70 %, resp. u 10–22 % nemocných s kolorektálním karcinomem. Otázka jejich optimální léčby je stále předmětem mnoha diskuzí. Cílem práce proto bylo zhodnocení výsledků chirurgické léčby v rámci multimodálního léčebného postupu.
Materiál a metoda: V rozmezí let 2002 až 4/2013 jsme řešili celkem 30 nemocných s oběma typy metastáz kolorektálního karcinomu. Průměrný věk nemocných byl 62,8 ± 10,7 let. U 19 nemocných se jednalo o metachronní a u jedenácti pak o synchronní metastázy. U metachronních metastáz předcházely jaterní metastázy ve 14 případech plicním a plicní metastázy pak byly diagnostikovány před jaterními u pěti nemocných. U sedmi nemocných se oba typy metastáz vyskytly současně. Jaterní resekci jsme provedli u 23, radiofrekvenční ablaci (RFA) u sedmi nemocných. U 15 nemocných byla provedena laserová metastasektomie, u 14 pak plicní resekce a u jednoho nemocného RFA ložisek. U 25 nemocných jaterní výkon předcházel výkonu plicnímu. 73,3 % nemocných mělo následnou adjuvantní onkologickou léčbu.
Výsledky: Do 30 dní po operaci zemřel 1 nemocný (3,3 %) na aktinomykotickou sepsi komplikovanou infekcí methicillin rezistentním stafylokokem. Morbidita souboru činila 10 %. K recidivě metastáz v játrech došlo u šesti nemocných, u všech byla provedena RFA. Medián celkového a bezpříznakového přežívání nemocných po primární operaci metastáz byl 6,9, resp. 1,1 roku.
Závěr: Chirurgická léčba je jedinou alternativou v rámci multimodální léčby nemocných s jaterními a plicními metastázami kolorektálního původu, která nabízí nemocným dobré dlouhodobé výsledky.
KONTROVERZE DIAGNOSTIKY A LÉČBY KOLOREKTÁLNÍHO KARCINOMU
Je možné vyléčit lokalizovaný karcinom rekta bez chirurgické intervence?
Dytrych P., Krška Z., Hoskovec D.
I. chirurgická klinika1. LF UK a VFN, Praha
Kolorektální adenokarcinom je nejčastější malignitou zažívacího traktu. ČR zaujímá přední místa ve světových statistikách incidence a mortality. Terapie adenokarcinomu rekta je založena na chirurgické resekci a u vyšších stadií nádoru je tato kombinována s radioterapií či chemoradioterapií (CHRT). Zdokonalením chirurgické techniky v druhé polovině minulého století (koncept totální mezorektální excize – TME) se počet lokálních recidiv výrazně snížil. Dlouhodobé přežívání pacientů je determinováno zejména systémovým (vzdáleným), nikoliv lokálním relapsem.
Neoadjuvantní radioterapie či chemoradioterapie u vyšších stadií onemocnění může přispět k regresi tumoru, k tzv. downsizingu a downstagingu, tudíž u nádorů původně dosahujících cirkumferenčního radiálního okraje lze po neoadjuvanci dosáhnout s vyšší pravděpodobností R0 resekce, krom toho dochází také k regresi případné malignity ve spádových uzlinách. Nádory střední a distální třetiny rekta mohou metastazovat v 16–23 % do laterárního lymfatického systému pánve. Kurativní dávka pro adenokarcinom rekta se pohybuje okolo 70 Gy. V neoadjuvanci jsou vzhledem k toxicitě využívány dávky okolo 46–56 Gy. U některých pacientů však mohou mít již tyto nižší dávky kurativní efekt. Řada retrospektivních studií ukázala pětileté přežívání 50–90 % u T1-T2-T3 stadií adenokarcinomu rekta, pacientů léčených pouze radioterapií (bez chirurgického výkonu), řada úmrtí neměla souvislost s malignitou. Je tedy evidentní, že i tyto nižší dávky neadjuvantní terapie mohou u senzitivních karcinomů vést až ke kompletnímu zániku nádoru.
Řada autorů demonstrovala, že právě míra regrese tumoru po neoadjuvantní CHRT je prediktivním ukazatelem přežívání. Nejlepší prognózu mají pacienti s kompletní regresí nádoru (pCR – pathologic complete response) či téměř kompletní odpovědí. Podle použité neoadjuvantní CHRT je pCR dosahována v různé míře (10–36 %). Ve skupinách s nižším stagingem před radioterapií a menšími tumory je pCR dosahována ve větší míře.
Příznivé onkologické výsledky pacientů s pCR zpochybňují nutnost odstranění rekta s mezorektem, případně i análnho kanálu – chirurgickými výkony zatíženými nemalou morbiditou. Úskalím případného „wait and see“ postupu je za prvé potvrzení kompletní odpovědi nádoru na neoadjuvanci (korelace klinické a patologické CR dosahuje jen 25–60 %), za druhé vyloučení metastatického postižení spádových lymfatických uzlin (3–8,7 % s ypT0 je N+). Dostupné literární údaje demonstrují vyšší výskyt lokální rekurence (5–6 %) v případě pacientů vedených „wait and see“ managementem, oproti radikálním chirurgickým výkonům u pacientů s pCR, resp. ypT0 (0,5–3,3 %). V případě srovnání celkového přežívání se však rozdíly mezi těmito soubory stírají. Alternativou „wait and see“ politice je potvrzení ypT0 pomocí lokální excize postradiační jizvy. Revizí výsledků takto vedených pacientů uvedených v dostupné literatuře zjišťujeme u souboru 159 pacientů cca 2 % lokální rekurenci při průměrné délce sledování asi 58 měsíců. Příznivé výsledky experimentálních souborů pacientů, kteří podstoupili CHRT a lokální excizi dokonce pro tumory s nekompletní odpovědí na neoadjuvanci vedenou k zahájení řady randomizovaných studií, kdy pacienti s T1-T3 tumory, kteří dobře odpovídají na neoadjuvantní CHRT, jsou indikováni k lokální excizi, s předpokladem dostatečně radikálního výkonu s menší morbiditou a mortalitou – ACOSOG Z6041 (USA), GRECCAR 1, GREECAR 2 (Francie), CONTEM (UK, Francie, Dánsko, Švédsko), CARTS (Nizozemí).
Teprve výsledky takto designovaných studií s dostatečnou dobou follow-up a dalších, které budou porovnávat časnou ale také pozdní morbiditu, funkční výsledky a kvalitu života jednotlivých terapeutických modalit, by mohly mít potenciál zodpovědět položenou otázku – zda je možné a racionální uplatnit rutinně rektum zachovávající přístup léčby adenokarcinomu rekta u většího množství pacientů.
PRAGMATICKÉ HODNOCENÍ KVALITY PÉČE V DIGESTIVNÍ ONKOLOGII
Pragmatické hodnocení kvality péče v sugestivní onkologii
Žaloudík J.
LF MU, Brno
Pro základní hodnocení kvality péče v onkologii solidních nádorů stačí sledovat osm parametrů, shrnutých do akronymu NoT ResStIng SurGEONs. Pět z nich charakterizuje daný případ nádorového onemocnění (Nodes, Tcathegory/Typing, Resection margins, postoperative Staging, Investigation on Grade), tři parametry vypovídají o pracovišti, zda sleduje výsledky péče (Survival), navrhuje optimální léčbu každého případu v multidisciplinárním indikačním týmu (Guaranted Estimation by Oncologists) a jakou disponuje pro danou diagnózu zkušeností (Numbers). Tyto údaje jsou v ČR k dispozici v Národním onkologickém registru a Systému pro vizualizaci onkologických dat (SVOD). Práce s těmito údaji je demonstrována v případě kolorektálního karcinomu na souboru 75 512 případů z let 2001–2010. Hodnocení kvality péče na základě reálných dat je součástí koncepce specializačního oboru onkochirurgie a podobnou cestou jde od roku 2012 i evropský program EURECCA (European Registration of Cancer Care).
Cirkumferentní resekční okraj a kompletnost mezorektální excize – ukazatele kvality chirurgické léčby karcinomu rekta
Ferko A.
Chirurgická klinika LF UK a FN, Hradec Králové
Cirkumferentní resekční okraj (CRO) a kvalita mezorektální excize dokladují kompletnost totální mezorektální excize (TME) a jsou významnými faktory, bez kterých již nelze hodnotit radikalitu resekčních výkonů na rektu. Ukazuje se, že pCRO lze využít jako bezprostřední ukazatel onkologické radikality, který významně ovlivňuje výsledek léčby. Podle některých, pozitivní patologický cirkumferentní okraj (pCRO) je významnějším nezávislým prediktivním faktorem než samotné pT stadium nádoru. Laparoskopický přístup k resekci rekta byl 15 let opakovaně podrobený analýze. V současnosti dominuje otázka, zda jsme cirkumferentně dostatečně, tj. srovnatelně radikální s otevřeným přístupem. Nejde o výkony na horním konečníku, ale zejména o karcinom do 10 cm. Studie publikované na toto téma jsou zatíženy metodickými nedostatky. Buď zahrnují do studie pacienty včetně karcinomu horního rekta, nebo vylučují karcinom distální třetiny konečníku, nebo jde o selektovanou skupinu pacientů.
Prediktivní data NOR a odhad kvality péče u nemocných s jaterními metastázamikolorektálního karcinomu v ČR
Ryska M.1, Dušek L.2
1Chirurgická klinika 2. LF UK a ÚVN, Praha
2Institut biostatistiky a analýz MU, Brno
Úvod: Kolorektální karcinom metastazuje především do jater: synchronně ve 20–25 %, metachronně až v 35 %. Ostatní lokalizace jsou výrazně méně zastoupeny (plíce cca v 8 %). Současné léčebné postupy umožňují, že více než polovina nemocných této skupiny přežívá 5 let. Podmínkou je provedení radikální resekce metastázami postižené části jater. V souladu se světovou literaturou a našimi statistikami je radikální resekce jaterních metastáz, jako součást komplexní onkologické terapie, nejefektivnější, s nejdelším prodloužením života. Primárně radikálně resekabilních je 20 % nemocných s jaterními metastázami, tj. cca 1850–2000 pacientů. Při použití současných možností konverzní terapie a eventuálně etapových operačních výkonů, lze uvést, že dalších 13–15 % nemocných lze po absolvování neadjuvantní systémové léčby indikovat k radikální resekci. Celkově se tak dostáváme k počtu cca 3000 nemocných, u kterých by měla být v souladu s moderní terapií indikována resekce jater s kurabilním cílem. V souladu se současným konsenzem léčby je proto nutné u každého nemocného nejprve zvážit resekabilitu.
Metoda: Ke kvalifikovanému odhadu počtu provedených jaterních resekcí vyjadřujících dodržení současného konsenzuálního postupu v komplexní onkologické péči o nemocného s metastazujícím kolorektálním karcinomem jsme srovnali kumulativní počet predikovaných nemocných ve 4. stadiu onemocnění pro rok 2013 s výsledkem dotazníkové akce z chirurgických pracovišť zabývajících se jaterní chirurgií z roku 2008. Do předpokládané resekability jsou zahrnuti primárně resekovatelní nemocní s navýšením o 13 % dosažené resekability konverzní léčbou (celkově 33 %). Poměrem provedených resekcí s jejich předpokládanou potřebou vyjadřujeme odhad současné kvality dostupné péče u nemocných s metastatickým postižením jater při kolorektálním karcinomu v ČR při předpokládaném pětiletém přežívání 40–50 %. Toto procento bylo z velkých chirurgických pracovišť potvrzeno v průběhu jednodenního sympozia v roce 2011.
Výsledky: Z údajů Národního onkologického registru z roku 2010 plyne, že narůstající incidence kolorektálního karcinomu v ČR znamenala 9200 nových případů/rok, při prevalenci 49 000 osob. Predikované údaje na rok 2013 tato čísla potvrzují a dokládají, že můžeme očekávat 7557 nemocných ve IV. stadiu onemocnění (tab. 1).
Tab. 1. Prediktivní údaje incidence a prevalence KRK v ČR pro rok 2013 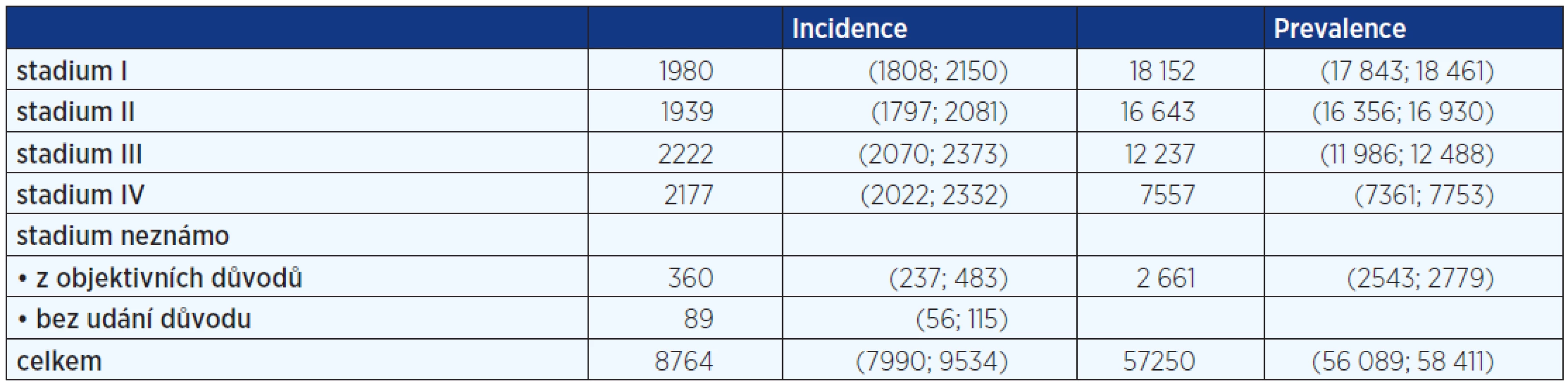
Data IBA 2013 Vezmeme-li v úvahu, že část nemocných v neznámém stádiu onemocnění (n = 2661) patří do IV. stadia onemocnění, lze dovodit, že u přibližně 9000 nemocných můžeme diagnostikovat jaterní metastázy, ať již synchronně nebo metachronně. Z tohoto počtu je 20 % nemocných, tj. 1800, u kterých je indikována jaterní resekce při primární resekabilitě. Následných 13 % nemocných po predikované úspěšné konverzní terapii představuje dalších 1170 pacientů. Celkově lze dovodit, že z poolu prevalence nemocných s metastazujícím KRK by měla být provedena jaterní resekce u 2970 pacientů.
Z počtu nově diagnostikovaných nemocných s KRK lze očekávat u 25 % synchronní metastázu, tj. u 2200 pacientů. Dvacet procent z nich činí 440 pacientů s primárně resekabilním nálezem a 286 s predikcí resekability po konverzní terapii. Celkově 726 nemocných.
Na základě dotazníkové akce dosáhl roční kumulativní počet provedených jaterních resekcí na 35 chirurgických pracovištích zabývajících se jaterní chirurgií, včetně všech pracovišť fakultního typu, čísla 466.
Diskuze: Je zřejmé, že kvalitu péče u nemocných s metastazujícím kolorektálním karcinomem lze posuzovat v přímém vztahu poměru počtu provedených jaterních resekcí k počtu predikovaných resekcí. Tuto úvahu lze podpořit následujícími argumenty:
A – optimálního výsledku pětiletého přežití lze dosáhnout pouze u pacienta, u kterého je v rámci komplexní onkologické péče provedena radikální jaterní resekce,
B – současná perioperační mortalita jaterních resekcí se na high volume chirurgických pracovištích pohybuje v rozmezí 0–3 %),
C – současná účinná systémová terapie a možnost tzv. etapových výkonů zvyšuje signifikantně resekabilitu. V této skupině nemocných je udáváno pětileté přežití vyšší než 30 %,
D – personalizovaná medicína s rozhodováním v multioborové komisi umožňuje v rámci dispenzáře indikovat k jaterní resekci nemocné opakovaně, aniž by bylo výše uvedené pětileté přežívání významně sníženo.
V rámci ČR lze na základě prediktivních dat IBA MU v Brně uvést následující kvalifikovaný odhad požadavku na jaterní resekci.
Synchronní metastázy (u 25 % nemocných s KRK):
- Nutné provést jaterní resekci u 440 pacientů v návaznosti na resekci primárního ložiska.
- Nutné provést jaterní resekci po konverzní terapii u 286 nemocných.
Celkově je jaterní resekce indikována u skupiny nemocných s KRK se synchronními jaterními metastázami u 726 nemocných/rok.
Metachronní metastázy (u cca 30–35 % nemocných po resekci primárního karcinomu):
- Celá skupina čítá téměř 3000 nemocných, u kterých je v průběhu jejich dispenzáře indikována jaterní resekce.
- Odhad počtu nemocných, který je z této skupiny nemocných indikován k jaternímu výkonu v průběhu 1 roku, se musí pravděpodobně odvíjet od jejich průměrného přežívání, tj. počet každoročně indikovaných musí být výsledkem celkového počtu nemocných s metastazujícím KRK v prevalenci vyděleného délkou jejich průměrného přežívání v letech. Vzhledem k tomu, že u této skupiny nemocných se bez jaterní resekce udává přežívání 22–30 měsíců, spekulativně lze mluvit o intervalu 2–2,5 roku, po kteréžto období by měla být jaterní resekce provedena. Znamenalo by to, opět spekulativně, že každoročně by z počtu indikovaných nemocných ze skupiny prevalence měla být jaterní resekce provedena u více než 1000 nemocných. Tento odhad není literárně uváděn. Srovnáme-li celkové údaje získané z dotazníkové akce s predikovaným počtem nemocných se synchronními a metachronními jaterními metastázami KRK, lze odvozovat, že je adekvátní ošetření v ČR, tj. provedení radikální resekce jaterních metastáz, provedeno přibližně u 27 % indikovaných pacientů.
Závěr: Odhad stávající kvality dostupné péče u nemocných s metastazujícím kolorektálním karcinomem, vyjádřený poměrem provedených resekcí jater s jejich předpokládanou potřebou, dosahuje v ČR 27 %. U většiny nemocných tak není indikovaná radikální resekce jater provedena a tím jim není dána šance dlouhodobého přežití. Kvalita péče o tyto nemocné je u nás nedostačující. Detailní rozbor bude možné provést po dokončení plánované statistické studie.
Podpořeno granty IGA MZ ČR NT 13 660 a ZRO MO 1012.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Přerušovaný půst může mít významná zdravotní rizika
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
-
Všechny články tohoto čísla
- MikroRNA a ledviny
- PLÁNOVANÉ AKCE SLOŽEK ČLS JEP
- Genetické pozadí běžných forem obezity – od studií identických dvojčat po studium kandidátních genů obezity*
- Postgraduální školení v obezitologii
- Monogenně podmíněná obezita – současný stav molekulárně genetického výzkumu a význam v klinické praxi*
- Kolorektální karcinom (část 3)
- Cenzura v medicíně – jeden příběh
- MEDTEL – mezinárodní konference o zdravotní informatice a telematice
- Účinná kontrola tabáku nemusí být nákladná ani cílená na děti
- Prof. MUDr. Jan Petrášek, DrSc. jubiluje
- Doc. MUDr. Petr Bartůněk, CSc. 75letý
- Spolek českých lékařů v Praze pořádá v září a říjnu 2014 pravidelné přednáškové večery s diskuzí
- Právní poradna pro lékaře v Časopisu lékařů českých
- Stanovisko předsednictva České lékařské společnosti J. E. Purkyně k systému atestačního (specializačního) vzdělávání
- Podzimní jednodenní kurzy Klinická andrologie v praxi
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Monogenně podmíněná obezita – současný stav molekulárně genetického výzkumu a význam v klinické praxi*
- Kolorektální karcinom (část 3)
- Genetické pozadí běžných forem obezity – od studií identických dvojčat po studium kandidátních genů obezity*
- Doc. MUDr. Petr Bartůněk, CSc. 75letý
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



