-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaZávažné bunečné imunodeficience
31. 8. 2018
Buněčné imunodeficience patří k těm vzácnějším, ale bohužel též závažnějším poruchám imunity, při nichž zejména imunitní buňky, ale sekundárně též i tvorba protilátek selhávají, a pro něž mezinárodní klasifikace vyčleňuje samostatnou skupinu „imunodeficiencí postihujících buněčnou a protilátkovou imunitu“ (1). Ve většině případů se jedná zejména o postižení T či B lymfocytů, ač v některých případech mohou být postiženy i natural killer (NK) buňky či být snížen počet granulocytů.
Nejzávažnější skupinu tvoří takzvané těžké kombinované imunodeficience (severe combined immunodeficiency, SCID). Jedná se o vzácná onemocnění s incidencí cca 1–2 : 100 000 nově narozených dětí (2), která – nejsou-li včas odhalena – mohou mít extrémně špatnou prognózu.
Patofyziologie
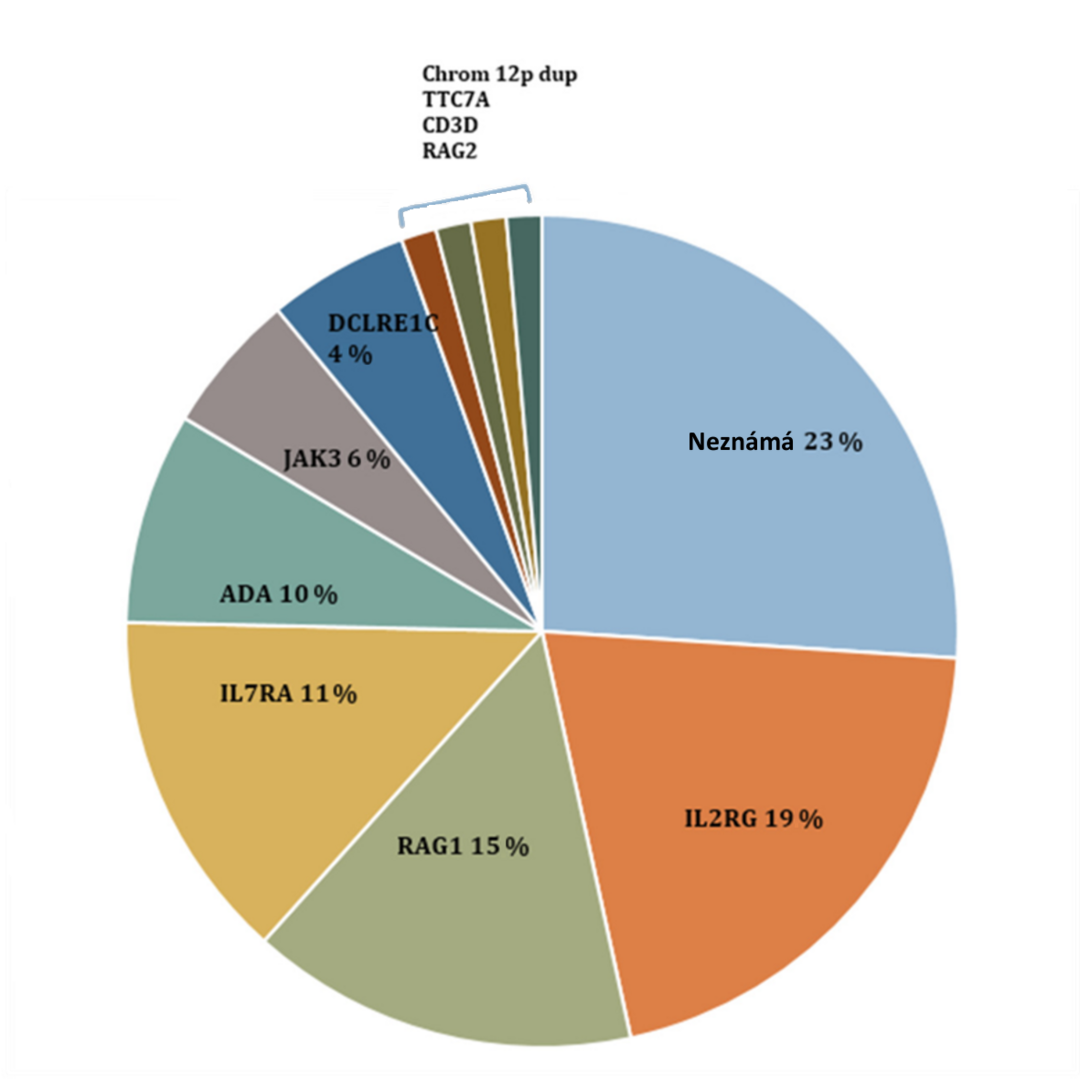
Mechanismus vzniku SCID onemocnění ve většině případů zasahuje zásadní procesy vývoje lymfocytů. Nejčastější formou je tzv. X-vázaný SCID, způsobený mutací v genu IL2RG na X chromozomu, která vede k chybění gamma-řetězce přítomného v celé řadě receptorů pro cytokiny, jež jsou kritické pro vývoj T lymfocytů, jako jsou např. IL-2, IL-7 a další. Výsledkem je T-B+ SCID s úplným chyběním T lymfocytů a nízkými NK buňkami, avšak s přítomnými B lymfocyty. Jiným příkladem příčiny mohou být mutace v genech RAG1 či RAG2, které kódují enzymy potřebné pro vznik specifických T a B buněčných receptorů, či mutace v genu ADA pro adenosindeaminázu, enzym odbourávající toxické produkty buněčného metabolismu. V těchto případech pak chybí jak T, tak i B lymfocyty. V posledních letech se též díky lepší dostupnosti genomických technologií, zejména celoexomového sekvenování (whole exome sequencing, WES), objevila celá řada tzv. „hypomorfních“ mutací v genech, dříve spojovaných s onemocněním SCID a velmi těžkým klinickým obrazem, které však byly identifikovány u pacientů s méně závažnou formou imunodeficience až ve starším dětství či dospělosti (3).
InzerceObr 1: Prevalence mutací způsobujících SCID, zachycených v rámci screeningu více než 3 milionů novorozenců v USA, který odhalil 52 případů SCID. Adaptováno z Dorsey et al., 2017 (2).
Klinický obraz
Zásadní problém vyplývající z chybění či špatné funkce lymfocytů je zvýšená náchylnost k infekcím, která v případě dětí se SCID nabývá život ohrožujících rozměrů. Pacienti mohou trpět všemi druhy bakteriálních, virových i mykotických infekcí, včetně infekcí oportunními patogeny. Ač první cca 3 měsíce života přetrvává částečný protektivní vliv mateřských imunoglobulinů, které plod obdrží od matky transplacentárním přenosem in utero, infekce se mohou rozvinout již v tomto období a bývají často doprovázeny poruchou prospívání a perzistentním průjmem. V některých případech může též dojít k nekontrolované proliferaci malého množství lymfocytů, které potom v těle způsobí de facto reakci štěpu proti hostiteli, projevující se obrazem těžké erytrodermie, lymfadenopatie a hepatosplenomegalie. V takové situaci mluvíme o tzv. Omennově syndromu, kdy hladiny lymfocytů v krvi mohou být normální, či dokonce zvýšené –, jedná se však o oligoklonální populaci, která není schopna zajistit dobrou obranyschopnost organismu a způsobuje více škody než užitku.
Screening
Vzhledem k závažnosti těchto onemocnění a nutnosti jejich rychlé identifikace a následných izolačních a terapeutických kroků byl např. ve Spojených státech, Kanadě a pilotně též v řadě zemí EU zaveden screeningový program novorozenců testující správnou tvorbu T a B lymfocytů pomocí tzv. TREC/KREC metody, která je schopna v suché kapce krve detekovat excizní kroužky DNA vznikající při vývoji lymfocytů, a odhalit tak řadu forem SCID (4, 5). Toto vyšetření je dostupné i v České republice, momentálně ve 2 laboratořích v Praze a v Brně (6), a je připravován i pilotní projekt novorozeneckého screeningu.
Diagnostika, přístup k pacientovi
V případě podezření na závažnou buněčnou imunodeficienci, ať již na základě klinického obrazu, rodinné anamnézy, či laboratorních nálezů, je nejdůležitějším prvním krokem izolace pacienta od všech potenciálních zdrojů infekce. Pro riziko přenosu CMV infekce od matky se též doporučuje přerušit kojení a samozřejmě neočkovat živými vakcínami, jako např. proti rotavirům. Dalším krokem je detailní vyšetření imunologem, který se soustředí na osobní i rodinnou anamnézu včetně možné konsangvinity, přítomnost vyrážky a syndromických rysů a stav dýchacích cest. Následovat musí podrobnější laboratorní vyšetření včetně subpopulací lymfocytů, naivních T lymfocytů včetně jejich nejmladších forem, tzv. recent thymic emmigrants (RTE), a jejich schopnosti proliferace. Další přístup se bude lišit dle podezření na konkrétní formy SCID, avšak prakticky ve všech případech bude zahrnovat genetické vyšetření k upřesnění příčiny. Prvním stadiem terapie je zpravidla substituce imunoglobulinů k podpoře obranyschopnosti organismu a profylaktické podávání antibiotik a antimykotik. Pacienti s Omennovým syndromem mohou vyžadovat imunosupresivní léčbu.
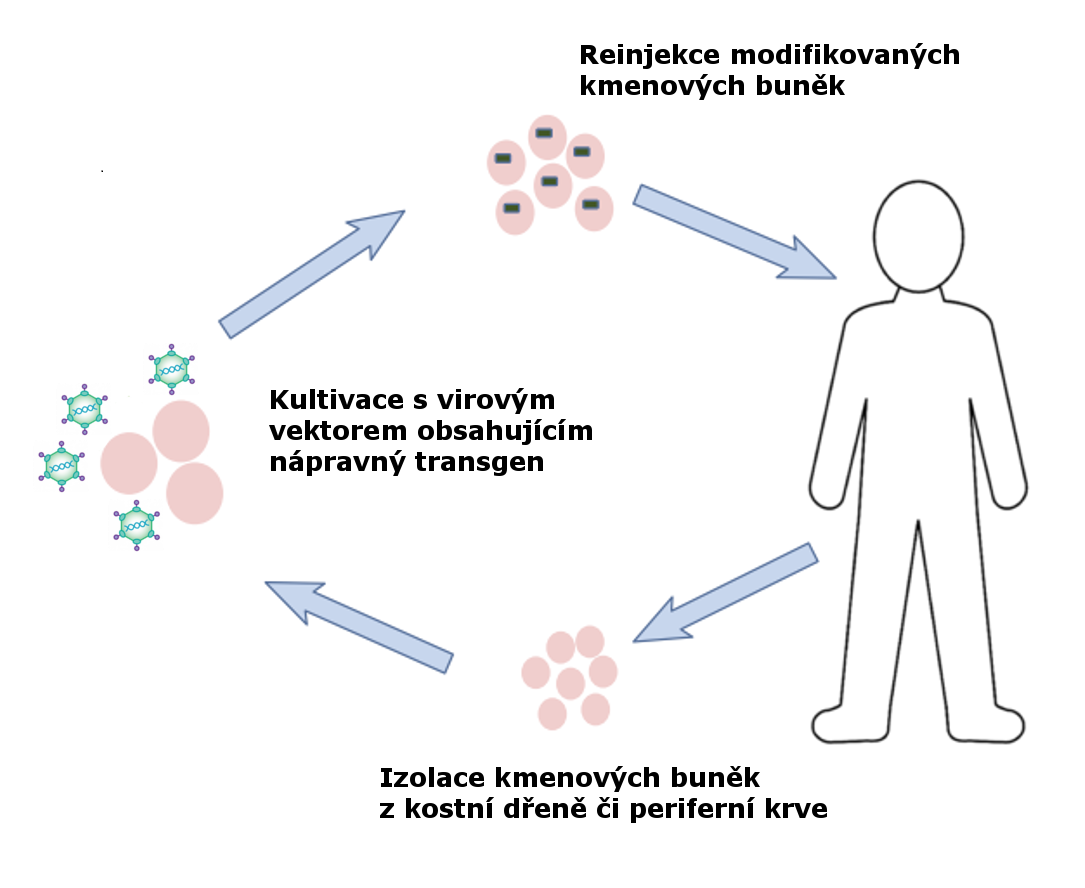
Obr 2: Schéma genové terapie, adaptováno z Booth et al., 2016 (7).
Terapie
U většiny forem SCID je jediným kurativním řešením transplantace kostní dřeně, která umožní pacientovi tvorbu nových, zdravých lymfocytů. Průměrná doba přežití se liší dle centra, věku a množství komplikací v okamžiku záchytu a dle genetické příčiny, avšak pohybuje se nad hranicí 70 % po 5 letech (8).
U některých forem SCID se v posledních letech objevily vzrušující možnosti specifické léčby metodami genové terapie, kdy jsou pacientovi odebrány buňky kostní dřeně, in vitro pomocí virových vektorů opraven genetický defekt a následně jsou buňky navráceny zpět do těla pacienta. Tato metoda je nyní dostupná pro mutace v genech ADA a IL2RG (9, 10) a dle dostupných údajů se zdá, že do budoucna bude nabízet lepší prognózu a menší množství komplikací než tradiční transplantace kostní dřeně.
Závěr
Závažné buněčné imunodeficience patří mezi nejzávažnější a nejvíce potenciálně život ohrožující situace, na něž je v pediatrické péči nutno pomýšlet. Komplexita jejich diagnostiky, terapie, následného sledování a péče si vyžaduje týmový přístup řady specialistů a dobře vybavená zdravotnická zařízení. V České republice je o tyto pacienty skvěle postaráno a díky mezinárodní spolupráci našich imunologů a hematologů je jim dostupná péče na světové úrovni.
MUDr. Adam Klocperk
Ústav imunologie 2. LF UK a FN Motol, V Úvalu 84, Praha 5, 150 00Literatura:
- Picard C., Bobby Gaspar H., Al-Herz W., Bousfiha A., Casanova J. L., Chatila T., et al. International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity. J Clin Immunol. Journal of Clinical Immunology; 2018; 38 (1): 96–128.
- Dorsey M., Puck J. Newborn Screening for Severe Combined Immunodeficiency in the US: Current Status and Approach to Management. Int J Neonatal Screen. 2017; 3 (2): 15.
- De Villartay J. P., Lim A., Al-Mousa H., Dupont S., Déchanet-Merville J., Coumau-Gatbois E., et al. A novel immunodeficiency associated with hypomorphic RAG1 mutations and CMV infection. J Clin Invest. 2005; 115 (11): 3291–9.
- Barbaro M., Ohlsson A., Borte S., Jonsson S., Zetterström R. H., King J., et al. Newborn Screening for Severe Primary Immunodeficiency Diseases in Sweden—a 2-Year Pilot TREC and KREC Screening Study. J Clin Immunol. Journal of Clinical Immunology; 2017; 37 (1): 51–60.
- King J. R., Hammarström L. Newborn Screening for Primary Immunodeficiency Diseases: History, Current and Future Practice. J Clin Immunol. Springer; 2018 Jan; 38 (1): 56–66.
- Šedivá A. Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC. http://www.imunodeficience.cz/wp-content/uploads/2017/04/SCID-TREC-KREK-pro-Pediatrie-pro-praxi_2017_unor-2017.doc. 2017.
- Booth C., Gaspar H. B., Thrasher A. J. Treating Immunodeficiency through HSC Gene Therapy. Trends Mol Med. 2016; 22 (4): 317–27.
- Heimall J., Puck J., Buckley R., Fleisher T. A., Gennery A. R., Neven B., et al. Current Knowledge and Priorities for Future Research in Late Effects after Hematopoietic Stem Cell Transplantation (HCT) for Severe Combined Immunodeficiency Patients: A Consensus Statement from the Second Pediatric Blood and Marrow Transplant Consortium International Conference on Late Effects after Pediatric HCT. Biol Blood Marrow Transplant. Elsevier Inc.; 2017; 23 (3): 379–87.
- Gaspar H. B., Cooray S., Gilmour K. C., Parsley K. L., Adams S., Howe S. J., et al. Long-Term Persistence of a Polyclonal T Cell Repertoire After Gene Therapy for X-Linked Severe Combined Immunodeficiency. Sci Transl Med. 2011; 3 (97): 97ra79-97ra79.
- Cicalese M. P., Ferrua F., Castagnaro L., Rolfe K., De Boever E., Reinhardt R. R., et al. Gene Therapy for Adenosine Deaminase Deficiency: A Comprehensive Evaluation of Short - and Medium-Term Safety. Mol Ther. Elsevier Ltd.; 2018; 26 (3): 917–31.
Další informace naleznete na webových stránkách o primární imunodeficienci, které můžete doporučit svým pacientům.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Alergologie a imunologie Dětská otorinolaryngologie Dětská pneumologie Otorinolaryngologie Pediatrie Pneumologie a ftizeologie
Nejnovější kurzy
Autoři: MUDr. Jana Hanzlíková, MUDr. Marta Sobotková, MUDr. Roman Hakl
Přejít do kurzů
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



