-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
Autoři: B. Kousal 1,2; Ľ. Ďuďáková 2; L. Hlavatá 2,3; P. Lišková 1,2
Působiště autorů: Oční klinika, 1. lékařská fakulta, Univerzita Karlova v Praze a Všeobecná fakultní nemocnice v Praze, přednostka doc. MUDr. Bohdana Kalvodová, CSc. 1; Ústav dědičných metabolických poruch, 1. lékařská fakulta, Univerzita Karlova v Praze a Všeobecná fakultní nemocnice v Praze, přednosta prof. MUDr. Viktor Kožich, CSc. 2
Vyšlo v časopise: Čes. a slov. Oftal., 72, 2016, No. 1, p. 293-297
Kategorie: Původní práce
Souhrn
Cíl:
Cílem práce je poskytnout informace o probíhajících klinických studiích testujících účinnost a bezpečnost nových terapeutických postupů u Stargardtovy choroby.Metody:
Po zadání hesla „Stargardt“ byl prohledán mezinárodní registr klinických studií (www.clinicaltrials.gov) a vytvořen seznam aktivních studií.Výsledky:
V současné době je registrováno osm klinických studií, které pacientům se Stargardtovou chorobou nabízejí možnost zařazení. Všechny studie jsou ve fázi I nebo II a podle mechanismu účinku zkoušeného přípravku je lze rozdělit do čtyř skupin: zabránění vzniku toxických dimerů vitaminu A, genová terapie obnovující funkčnost genu ABCA4, ochrana buněk sítnice před oxidativním poškozením a náhrada poškozeného pigmentového epitelu sítnice a fotoreceptorů pomocí kmenových buněk. Základní podmínkou pro zařazení do většiny těchto studií je potvrzení klinické diagnózy na molekulárně genetické úrovni, tedy znalost příčinných mutací.Závěr:
Registrované klinické studie testující nové metody léčby Stargardtovy choroby dávají naději, že průběh této choroby bude možno již v blízké budoucnosti aktivně ovlivnit.Klíčová slova:
Stargardtova choroba, terapie, ABCA4, mutaceÚVOD
Stargardtova choroba a její varianta fundus flavimaculatus jsou dědičnými onemocněními sítnice, která postihují retinální pigmentový epitel (RPE) a fotoreceptory s přibližným výskytem 1 postižený na 10 000 obyvatel. Onemocnění se projevuje snížením centrální zrakové ostrosti, které typicky vzniká již v dětství nebo v časné dospělosti, k manifestaci ale může dojít i v pozdějším věku (25). Charakteristickým klinickým nálezem je přítomnost žlutavých skvrn v makule i difúzně po celém fundu spolu se ztenčováním vrstev sítnice v makule (13, 16). Makula nabývá vzhledu tepaného kovu a postupně vzniká jizva se žlutými skvrnami charakteru lipofuscinových depozit při okrajích. Za nejspolehlivější klinickou metodu umožňující rozpoznání Stargardtovy choroby je dnes považováno vyšetření autofluorescence očního pozadí, která vykazuje poruchu distribuce. V místech hromadění lipofuscinových depozit je autofluorescence zvýrazněna, naopak chybí v oblastech atrofie RPE, okolo kterých jsou nepravidelně zrnité oblasti (12). Optická koherenční tomografie, fluorescenční angiografie, vyšetření zorného pole a elektroretinografie se v diagnostice také používají a mohou poskytnout další užitečné informace.
Stargardtova choroba vykazuje recesivní typ dědičnosti. Je podmíněna mutacemi v genu ABCA4, který kóduje protein podílející se na transportu použitých částí fotoreceptorů. Mutace v této, pro fotoreceptory specifické, lipáze ovlivňují zpracování vitaminu A, což vede k akumulaci toxického bisretinoidu A2E, tzv. dimeru vitaminu A. Následkem tohoto stavu dochází k odumírání retinálního pigmentového epitelu a fotoreceptorů (22). Mutace v genech ELOVL4 a PROM1 jsou velmi vzácné a jsou spojovány s onemocněními podobnými Stargardtově chorobě (19, 23).
Účinná léčba pro Stargardtovu chorobu není zatím k dispozici. Pacientům se doporučuje chránit oči pomocí slunečních brýlí před intenzivním modrým světlem a ultrafialovým zářením, které může způsobovat zvýšené hromadění toxických sloučenin v sítnici. Není vhodná zvýšená konzumace potravin bohatých na vitamin A či suplementace vitaminem A (14).
Intenzivně jsou vyvíjeny nové léčebné metody. Některé již pokročily do stadia klinického testování, které má zpravidla několik fází. Ve fázi I se sleduje bezpečnost a stanovuje se maximálně tolerovaná dávka. Provádí se většinou na jedné nerandomizované skupině dobrovolníků. Ve fázi II se zjišťuje účinná dávka léku, opět většinou v rámci nerandomizované studie, již na pacientech. Fáze III porovnává účinnost nového léku se standardní léčbou a testování se provádí na dvou skupinách pacientů. Jedna skupina je léčena standardními léčebnými postupy, druhé skupině je podávána léčba nová a zařazení i hodnocení bývají dvojitě zaslepené. Na základě výsledků této fáze pak může být lék zaregistrován. V poslední fázi IV se sledují nežádoucí účinky léčiva po registraci a při dlouhodobém užívání (https://clinicaltrials.gov/ct2/about-studies/learn) (10).
CÍL
Cílem práce je podat přehled o nově vyvíjených metodách léčby Stargardtovy choroby, u kterých již bylo započato klinické testování na pacientech.
METODY
Prohledali jsme mezinárodní registr klinických studií www.clinicaltrials.gov po zadání hesla „Stargardt”.
VÝSLEDKY
K datu 9. 9. 2015 jsme nalezli celkem 20 záznamů o klinických zkouškách testujících nové léky a metody léčby Stargardtovy choroby, souhrn aktivních studií podává tabulka 1.
Tab. 1. Registrované klinické zkoušky testující nové terapie pro Stargardtovu makulární degeneraci (STGD) 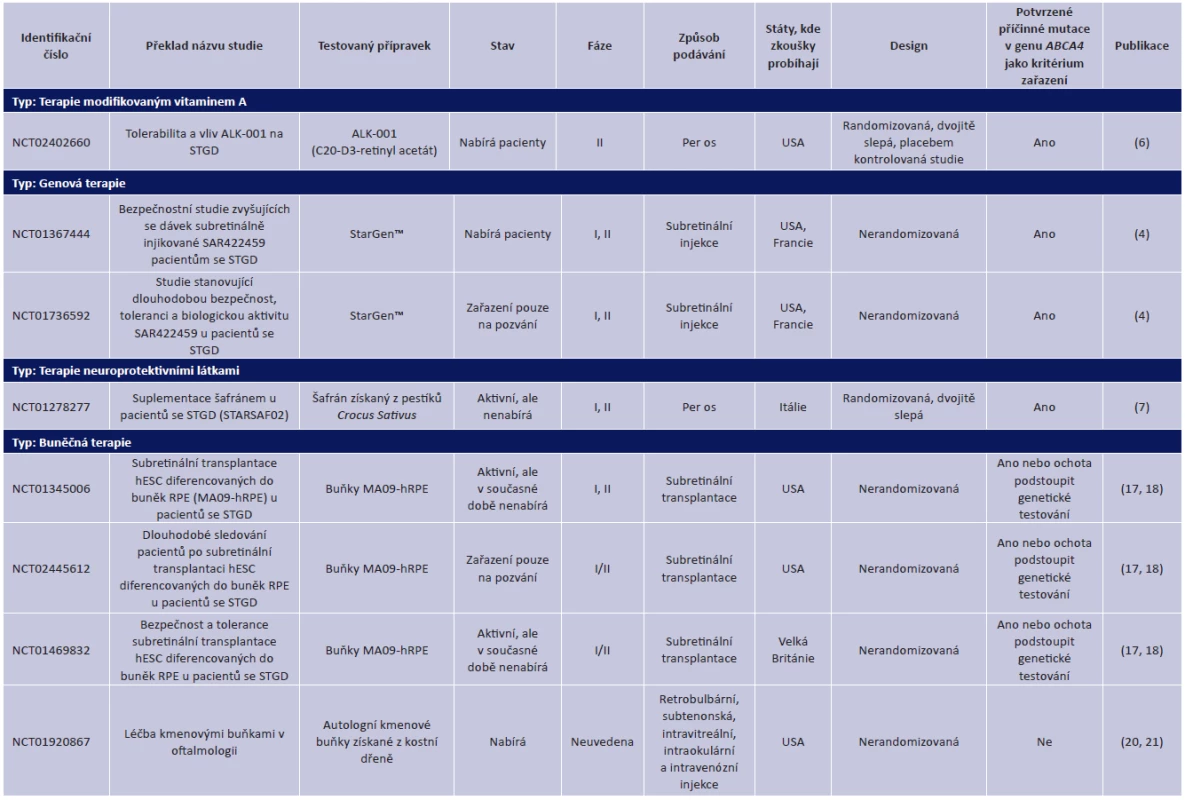
hESC = lidské embryonální kmenové buňky, RPE = retinální pigmentový epitel Klinicky zkoušené terapeutické postupy se zaměřují na několik různých biologických mechanismů. První si klade za cíl zabránit vzniku toxických dimerů vitaminu A v oku, aniž by byl zároveň ovlivněn fyziologický proces přeměny vitaminu A, který je nezbytný pro správnou funkci sítnice. Pacientům se podává látka C20-D3-retinyl acetát (ALK-001). Jedná se o chemicky modifikovaný vitamin A nahrazující přirozený vitamin A.
Druhým postupem je genová terapie, která si klade za cíl nahradit sníženou či nulovou funkci mutovaného genu ABCA4 vnesením jeho plně funkční kopie pomocí vektorů.
Zkouší se také látky působící neuroprotektivně, tj. chránící buňky sítnice před poškozením fotooxidací, jako např. šafrán. Probíhající klinická studie zjišťuje vliv krátkodobé suplementace šafránem na funkce sítnice u pacientů se Stargardtovou chorobou či fundus flavimaculatus. Tyto tři výše uvedené postupy se týkají pacientů s relativně dobře zachovanými funkcemi sítnice s cílem zpomalit nebo zastavit progresi onemocnění.
Posledním postupem jsou terapie kmenovými buňkami, které jsou vyvíjeny pro pacienty s pokročilým nálezem, tj. s odumřením velké části buněk retinálního pigmentového epitelu a fotoreceptorů, cílem je nahradit již zaniklé buňky.
DISKUSE
Nově vyvíjené terapie Stargardtovy choroby cílí na řadu různých přístupů, od zamezení tvorby toxických metabolitů (6) přes náhradu funkce vadného genu (2), neuroprotekci sítnice (5) až k nahrazování odumřelých buněk sítnice kmenovými buňkami, které byly reprogramovány do fenotypu retinálního pigmentového epitelu (24).
Pomocí výměny tří atomů vodíku za deuterium ve vitaminu A byl vyvinut deuterovaný vitamin A nazvaný ALK-001, který zabraňuje vzniku toxických dimerů vitaminu A, což vede ke snížení tvorby lipofuscinu bez ovlivnění funkce sítnice (6). Mechanismus tvorby lipofuscinu v sítnici jako odpadního cytotoxického produktu metabolismu zevních segmentů fotoreceptorů není plně objasněn. Míní se, že vzniká v zevních segmentech tyčinek jako vedlejší produkt reakce, do které je zavzat sítnicový chromofor rhodopsin. Lipofuscin je směs částečně natrávených proteinů a lipidů a hromadí se v endozomálním kompartmentu RPE. Jeho jedinou známou komponentou jsou bis-retinoidy, kondenzační produkty dvou molekul retinalu (1).
Stargardtova choroba vzniká na podkladě přítomnosti mutací v jednom genu, jedná se tedy o monogenní onemocnění, které je vhodné pro genovou terapii. Úskalí ABCA4, jehož mutace zapříčiňují Stargardtovu chorobu u naprosté většiny pacientů, však tkví v tom, že se jedná o velký gen nehodící se pro přenos pomocí adeno-asociovaných virových (AAV) vektorů, které byly dosud shledány jako nejúspěšnější při genové terapii jiných monogenních onemocnění oka (2). Vyvíjeny jsou proto nové AAV vektory, lentivirové vektory a nevirové kompaktní DNA nanočástice (9). Obzvláště poslední dva mají velkou kapacitu a jejich použití vedlo k pozitivnímu ovlivnění průběhu choroby u Abca4 (-/-) myšího modelu (8, 11).
Vzhledem k tomu, že Stargardtova choroba vzniká na základě oxidativního poškození buněk sítnice, třetí léčebný přístup vychází ze studií, které naznačily, že šafrán působí jako neuroprotektivum (5, 15). Konkrétně bylo zjištěno, že blizny šafránu setého obsahují vysoké koncentrace různých chemických sloučenin včetně krocinu a krocetinu, jehož mnohočetné C=C vazby mají antioxidační potenciál. O těchto sloučeninách se navíc ví, že nemají vedlejší účinky a jejich podávání je bezpečné (7).
Do terapie kmenovými buňkami, které mají schopnost přeměnit se na jiný buněčný typ, se vkládá mnoho nadějí i v řadě jiných oborů než je oftalmologie. Pro Stargardtovu chorobu byly registrovány klinické studie aplikující lidské embryonální kmenové buňky terminálně diferencované do buněk pigmentového epitelu sítnice. Pacientům jsou subretinálně transplantovány různé dávky buněk řádově v desítkách tisíc a sleduje se jejich přihojení, zrakové funkce pacienta a komplikace léčby (17, 18). Další studie testuje využití kmenových buněk derivovaných z kostní dřeně v oftalmologii. Kandidáty jsou pacienti s celou řadou onemocnění, kromě Stargardtovy choroby také různé hereditární či získané retinopatie a optické neuropatie (20, 21). U Stargardtovy choroby se zkouší aplikace buněk retrobulbárně, subtenonsky a intravitreálně, na horším oku je provedena vitrektomie a aplikace buněk subretinálně. Lokální oční léčbu následuje podání buněk intravenózně (S. Levy, Margate, USA, osobní komunikace).
Je třeba podotknout, že proces využití kmenových buněk má řadu úskalí, mimo jiné i imunitní odpověď, která může představovat významný problém ovlivňující výsledky léčby. Proto také probíhá výzkum využití indukovaných pluripotentních kmenových buněk spočívající v tom, že pacientovi jsou odebrány jeho vlastní buňky, např. fibrocyty z kůže, které jsou v tkáňových kulturách přeprogramovány přes mezistupeň kmenových buněk na buňky retinálního pigmentového epitelu či fotoreceptorů. Zahájení klinických zkoušek využívající indukované pluripotentní kmenové buňky se očekává ve velmi blízké budoucnosti (24).
S vývojem nových cílených terapií nabývá na významu diagnostika na molekulárně genetické úrovni. Z důvodu rizika selhání léčby nebo i možného poškození, zejména u invazivních genových terapií, je stanovení příčinných mutací potvrzujících klinickou diagnózu až na jednu výjimku podmínkou pro zařazení do aktivních klinických studií (tabulka 1).
Pro všechny nově testované terapie platí, že ani sebelepší výsledky na zvířecích modelech předcházející klinickým zkouškám testujících daný lék či metodu léčby, nezaručují úspěšnost u lidí. Například zcela nedávno bylo prokázáno, že genová terapie zmutovaného genu RPE65 nemá oproti psímu modelu u lidí trvalý efekt. Zkoušející se domnívají, že aplikovaná dávka byla u lidí nejspíše příliš nízká (3).
ZÁVĚR
I přes úskalí spojená s novými léčebnými postupy vede dosavadní vývoj k naději, že se účinné léčby onemocnění podmíněných mutacemi v genu ABCA4 v blízké budoucnosti dočkáme.
Práce byla podpořena granty SVV UK 260148/2015 a UNCE 204011.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Doc. MUDr. P. Lišková, MD, Ph.D.
Ústav dědičných metabolických poruch
1. lékařská fakulta, Univerzita Karlova v Praze a VFN
Ke Karlovu 2
128 00 Praha 2
e-mail: petra.liskova@lf1.cuni.cz
Do redakce doručeno dne 25. 9. 2015
Do tisku přijato dne 22. 1. 2016
Zdroje
1. Adler L 4th, Boyer NP, Chen C, et al.: The 11-cis retinal origins of lipofuscin in the retina. Prog Mol Biol Transl Sci, 134; 2015: e1–12.
2. Al-Saikhan, FI.: The gene therapy revolution in ophthalmology. Saudi J Ophthalmol, 27; 2013 : 107-11.
3. Bainbridge, JWB., Mehat, MS., Sundaram, V., et al.: Long-term effect of gene therapy on Leber’s congenital amaurosis. N Engl J Med, 372; 2015 : 1887–97.
4. Binley K, Widdowson P, Loader J, et al.: Transduction of photoreceptors with equine infectious anemia virus lentiviral vectors: safety and biodistribution of StarGen for Stargardt disease. Invest Ophthalmol Vis Sci, 54; 2013 : 4061–71.
5. Bisti, S., Maccarone, R., Falsini B.: Saffron and retina: neuroprotection and pharmacokinetics. Vis Neurosci, 31; 2014 : 355-61.
6. Charbel Issa, P., Barnard, AR., Herrmann, P., et al.: Rescue of the Stargardt phenotype in Abca4 knockout mice through inhibition of vitamin A dimerization. Proc Natl Acad Sci U S A, 112; 2015 : 8415–20.
7. Falsini, B., Piccardi, M., Minnella, A., et al.: Influence of saffron supplementation on retinal flicker sensitivity in early age-related macular degeneration. Invest Ophthalmol Vis Sci, 51; 2010 : 6118–24.
8. Han, Z., , Conley, SM., Makkia, RS., et al.: DNA nanoparticle-mediated ABCA4 delivery rescues Stargardt dystrophy in mice. J Clin Invest, 122; 2012 : 3221–6.
9. Han, Z., Conley, SM., Naash, MI.: Gene therapy for Stargardt disease associated with ABCA4 gene. Adv Exp Med Biol, 801; 2014 : 719–24.
10. Kao, LS., Tyson, JE., Blakely ML., et al.: Clinical research methodology I: introduction to randomized trials. J Am Coll Surg, 206; 2008 : 361–9.
11. Kong, J., Kim, SR., Binley, K., et al.: Correction of the disease phenotype in the mouse model of Stargardt disease by lentiviral gene therapy. Gene Ther, 15; 2008 : 1311–20.
12. Kousal, B., et al.: Molekulárně genetická příčina a klinický nález u dvou probandů se Stargardtovou chorobou. Čes a slov Oftal, 70; 2014 : 228–33.
13. Lois, N., Holder, GE., Bunce, C., et al.: Phenotypic subtypes of Stargardt macular dystrophy-fundus flavimaculatus. Arch Ophthalmol, 119; 2001 : 359–69.
14. Mihai, DM., Washington, I.: Vitamin A dimers trigger the protracted death of retinal pigment epithelium cells. Cell Death Dis, 5; 2014: e1348.
15. Purushothuman, S., Nandasena, C., Peoples, CL., et al.: Saffron pre-treatment offers neuroprotection to Nigral and retinal dopaminergic cells of MPTP-Treated mice. J Parkinsons Dis, 3; 2013 : 77–83.
16. Rivera, A., White, K., Stöhr. H., et al.: A comprehensive survey of sequence variation in the ABCA4 (ABCR) gene in Stargardt disease and age-related macular degeneration. Am J Hum Genet, 67; 2000 : 800–13.
17. Schwartz, SD., Hubschman, JP., Heilwell, G., et al.: Embryonic stem cell trials for macular degeneration: a preliminary report. Lancet, 379; 2012 : 713–20.
18. Schwartz, SD., Regillo, CD., Lam, BL., et al.: Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt’s macular dystrophy: follow-up of two open-label phase 1/2 studies. Lancet, 385; 2015 : 509–16.
19. Vasireddy, V., Wong, P., Ayyagari, R.: Genetics and molecular pathology of Stargardt-like macular degeneration. Prog Retin Eye Res, 2010; 29 : 191–207.
20. Weiss JN, Levy S, Malkin A.: Stem Cell Ophthalmology Treatment Study (SCOTS) for retinal and optic nerve diseases: a preliminary report. Neural Regen Res, 10; 2015 : 982–8.
21. Weiss JN, Levy S, Benes SC.: Stem Cell Ophthalmology Treatment Study (SCOTS) for retinal and optic nerve diseases: a case report of improvement in relapsing auto-immune optic neuropathy. Neural Regen Res, 10; 2015 : 1507–15.
22. Weng, J., Mata, NL., Azarian, SM., et al.: Insights into the function of Rim protein in photoreceptors and etiology of Stargardt’s disease from the phenotype in abcr knockout mice. Cell, 98; 1999 : 13–23.
23. Yang, Z., Chen, Y., Lillo, C., et al.: Mutant prominin 1 found in patients with macular degeneration disrupts photoreceptor disk morphogenesis in mice. J Clin Invest, 2008; 118 : 2908–16.
24. Zahabi, A., Shahbazi, E., Ahmadieh, H., et al.: A new efficient protocol for directed differentiation of retinal pigmented epithelial cells from normal and retinal disease induced pluripotent stem cells. Stem Cells Dev, 21; 2012 : 2262–72.
25. Zernant, J., Schubert, C., Im, KM., et al.: Analysis of the ABCA4 gene by next-generation sequencing. Invest Ophthalmol Vis Sci, 52; 2011 : 8479–87.
Štítky
Chirurgie maxilofaciální Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2016 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
-
Všechny články tohoto čísla
- Oznámení
-
Perspektivy buněčné terapie v oftalmologii
1. Využití kmenových buněk v regeneraci poškozeného povrchu oka -
Perspektivy buněčné terapie v oftalmologii
2. Potenciál kmenových buněk pro léčbu onemocnění sítnice - Klinické projevy experimentální autoimunitní uveitidy
- Oční jizevnatý pemfigoid – retrospektivní studie
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Drúzy papily zrakového nervu a jejich komplikace
- Bilaterální makulární edém na podkladě drúzových papil
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Drúzy papily zrakového nervu a jejich komplikace
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Bilaterální makulární edém na podkladě drúzových papil
- Oční jizevnatý pemfigoid – retrospektivní studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



