-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť III
Metal complexes in medicine and pharmacy – the past and the present III
Bioactive metal complexes represent a promising and rapidly evolving area of pharmacotherapy. After the first part of our survey on metallopharmaceuticals dealing with antimicrobial activity of metal complexes and their application in diagnostics and the second part dedicated to anticancer properties of these compounds, this third and last part of the review focuses on several other applications of metals in therapy (mainly on the therapy of rheumatoid arthritis, some mental diseases, diabetes, as well as on chelation therapy). Following a brief account of the historical development of clinical use of the respective category of drugs, their chemical properties, toxicity, clinical applications and mechanism of action are discussed. The aim of this brief survey is to provide basic outline of the area of metallopharmacy, aimed at specialists in pharmacy and chemistry as well as at the general educated public.
Keywords:
bioinorganic chemistry – metal complexes – metallopharma-ceuticals – Gold – vanadium – Lithium – chelation therapy
Autoři: Ladislav Habala; Jindra Valentová
Působiště autorů: Katedra chemickej teórie liečiv, Farmaceutická fakulta UK
Vyšlo v časopise: Čes. slov. Farm., 2020; 69, 121-129
Kategorie: Přehledy a odborná sdělení
Souhrn
Komplexy kovov s biologickou aktivitou predstavujú perspektívnu a rýchle sa rozvíjajúcu oblasť farmakoterapie. Po prvej časti prehľadu o metalofarmakách venovanej antimikróbnym účinkom komplexov kovov a ich využitiu v diagnostike ochorení a druhej časti zaoberajúcej sa úlohou týchto zlúčenín v liečbe rakoviny sa táto tretia a záverečná časť prehľadu zameriava na vybrané ďalšie aplikácie kovov v terapii (predovšetkým na terapiu reumatoidnej artritídy, niektorých psychických ochorení, diabetu, ako aj na chelatačnú terapiu). Popri stručnom náčrte historického vývoja klinického využitia danej kategórie liečiv sú diskutované tiež ich chemické vlastnosti, toxicita, klinické aplikácie a mechanizmus účinku. Tento stručný prehľad má za cieľ poskytnúť základnú orientáciu v tejto problematike pre farmaceutov, chemikov a ostatných záujemcov o danú oblasť z radov odbornej verejnosti, ako aj motivovať k ďalšiemu štúdiu tejto atraktívnej oblasti farmaceutického výskumu.
Klíčová slova:
bioanorganická chémia – metalofarmaká – komplexy kovov – zlato – vanád – lítium – chelatačná terapia
Zlato v liečbe reumatických ochorení
Zlato je ušľachtilý kov, známy už najstarším civilizáciám. Vzhľadom k tomu, že sa v prírode vyskytuje prakticky len vo svojej najstabilnejšej, teda elementárnej forme, bolo zrejme prvým používaným kovom. Napriek svojej chemickej inertnosti vytvára veľký počet komplexných zlúčenín, predovšetkým v jeho najstabilnejších oxidačných stupňoch I a III. Na rozdiel od iných prechodných kovov sú „voľné“ ióny Au+ a Au3+ (t. j. akvakomplexy zlata) vo vodnom roztoku nestabilné a majú tendenciu podliehať redukcii až na elementárne zlato, je však možné tieto oxidačné čísla stabilizovať komplexáciou vhodnými ligandmi1). Zlato ako mäkký akceptor podľa teórie HSAB prednostne koordinuje s mäkkými donorovými atómami, najmä so sírou. Kým centrálne atómy zlata v oxidačnom stupni I majú najčastejšie koordinačné číslo 2 s lineárnou koordinačnou geometriou, zlatité komplexy sú prevažne tetrakoordinované v štvorcovo-planárnej geometrii.
Moderné využitie zlata v terapii vychádza z objavu in vitro antimikróbnej účinnosti zlatitých kyanidokomplexov koncom 19. storočia. Napriek tomu, že sa táto aktivita nepotvrdila in vivo, sa zlúčeniny zlata používali v terapii tuberkulózy ešte v 20. a 30. rokoch 20. storočia2). Jednalo sa najmä o komplexy s tiolátovými ligandmi, so zlatom v oxidačnom stupni III. V tomto období tiež dochádza k objavu protizápalových účinkov týchto zlúčenín. Francúzsky lekár Jacques Forestier skúmal účinnosť komplexných zlúčenín zlata v reumatoidnej artritíde, pôvodne využívaných v terapii tuberkulózy, považujúc tieto dve ochorenia za príbuzné3, 4).
Reumatoidná artritída je zápalové ochorenie, ktoré postihuje značnú časť populácie5). Jedná sa o autoimunitné ochorenie. Postihuje najprv kĺby, neskôr aj iné orgány a v súčasnosti má negatívnu dlhodobú prognózu. Jej prvotná príčina nie je jednoznačne známa. Mechanizmus ochorenia je komplexný a zahrňuje aktiváciu makrofágov, T - a B-lymfocytov, ktoré produkujú cytokíny a protilátky proti vlastným tkanivám. Najprv je poškodená synoviálna membrána, neskôr nastáva deštrukcia chrupavky a kosti v kĺbe. To vedie k úbytku kostnej hmoty, protiľahlé kĺby sa spoja a kĺb sa stáva nepohyblivým.
V liečbe reumatoidnej artritídy zlúčeninami zlata (tiež chryzoterapii) sa uplatnili komplexné zlúčeniny zlata v koordinačnom stupni I a s ligandmi typu tiolov, napr. tiosíran (aurotiosulfát) a tiojablčnan (aurotiomalát)6). Tento typ zlatných komplexov dominoval v terapii artritídy od jej počiatkov až do začiatku 90. rokov, kedy dochádza k postupnému nástupu nových antireumatík. Až koncom 70. rokov 20. storočia sa presadil zlatný komplex iného typu – auranofin, umožňujúci perorálnu administráciu liečiva7). Pri tiolátokomplexoch zlata sa napriek zdanlivo jednoduchému zloženiu nejedná o nízkomolekulové monomérne komplexy s jedným centrálnym atómom zlata, ale o oligomérne až polymérne štruktúry s lineárnym reťazcom, tvoreným atómami zlata premostenými atómami síry. Auranofin (2,3,4,6-tetra-O-acetyl-1-tio-β-D-glukopyranozáto)(trietylfosfán)zlatný komplex (obr. 1) je jednojadrový komplex s vlastnosťami odlišnými od komplexov tiolátového typu.
Obr. 1. Štruktúrny vzorec auranofinu 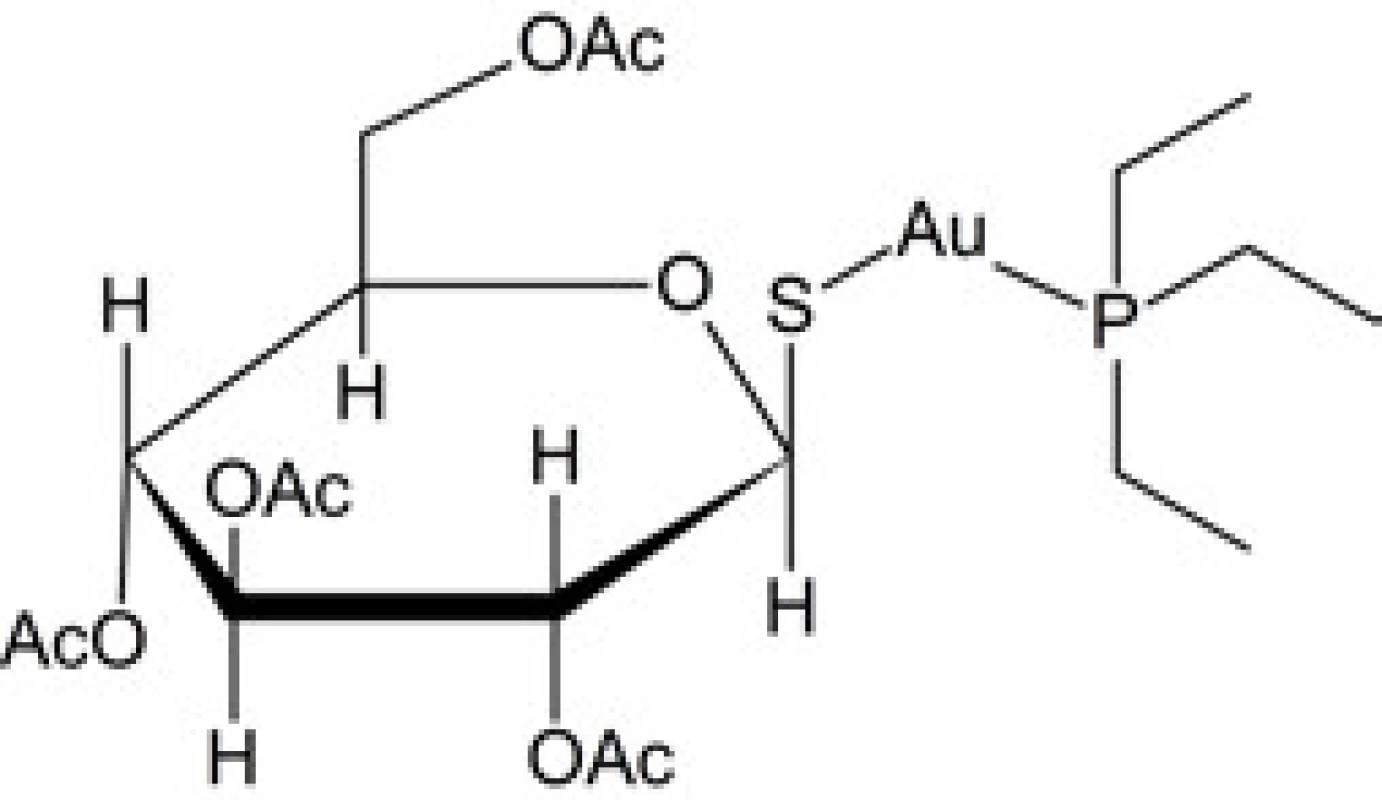
Mechanizmus aktivity zlata v terapii reumatoidnej artritídy nie je doposiaľ uspokojivo preskúmaný. K celkovému imunosupresívnemu účinku zrejme prispieva viacero molekulárnych mechanizmov. Patria k nim modifikácia biosyntézy prostaglandínov a homeostázy medi v organizme, inhibícia lyzozomálnych enzýmov, ovplyvnenie homeostázy reaktívnych foriem kyslíka (ROS), imunomodulačná aktivita – inhibícia fagocytózy, exkrécie histamínu, zníženie hladiny imunoglobulínov a viaceré ďalšie.
Liečivá na báze komplexov zlata prejavujú pomerne vysokú reaktivitu v reakciách zámeny ligandov, predovšetkým voči ligandom obsahujúcim síru a tiež voči redukcii/oxidácii. V priebehu farmakologických experimentov sa ukázalo, že tieto komplexy podliehajú rýchlej metabolizácii in vivo, a fungujú teda ako prekurzory aktívnej formy liečiva8). Už v priebehu krátkej doby po administrácii sa značná časť viaže na zložky krvi, predovšetkým na albumín (cysteínové zvyšky). Zostávajúca časť nepozmenených molekúl liečiva len ťažko preniká do bunky, avšak môže sa viazať na povrchové štruktúry bunky obsahujúce sulfhydrilové skupiny. Výnimku predstavuje auranofin, ktorý na rozdiel od polymérnych tiolátokomplexov vykazuje výraznú a rýchlu resorpciu cez cytoplazmatickú membránu. Na druhej strane, tieto komplexy reagujú s kyanidovými aniónmi prítomnými v organizme za vzniku spoločného metabolitu, Au(CN)2–, u ktorého bol pozorovaný podstatne ľahší prestup do bunky.
Zlúčeniny zlata v oxidačnom stupni I aj III majú výraznú tendenciu podliehať v prítomnosti vhodných redukčných činidiel redukcii až na elementárne zlato. Bolo experimentálne potvrdené, že za vhodných podmienok môže k takejto redukcii dochádzať aj in vivo. Zaujímavým zistením bolo, že vznikajúce čiastočky zlata (nanočastice) samy o sebe vykazujú značnú protizápalovú aktivitu9).
Chryzoterapia je charakteristická individuálnou odozvou pacientov na liečbu. Údaje o klinickej účinnosti sa značne líšia, pričom maximálne hodnoty sa pohybujú okolo 70 %. V priebehu terapie sa môžu vyskytnúť rôzne nežiadúce účinky, vyžadujúce si predčasné ukončenie liečby, avšak tieto majú len v zriedkavých prípadoch závažnejší charakter. Jedná sa napr. o kožné prejavy ako vyrážky (exantém), zhoršenie krvného obrazu, zápaly gastrointestinálneho traktu (enterokolitída), pľúcna fibróza, renálne a neurologické komplikácie, u perorálne aplikovaného auranofinu tiež diarea a iné10). Taktiež môže dochádzať k akumulácii zlata v pokožke a niektorých orgánoch, čo vedie k zmenám farby pokožky na sivú až fialovú (chryziáza), podobne ako v prípade striebra (argýria). Polymérne komplexy zlata (ako aurotiomalát) sa spravidla aplikujú intramuskulárne v týždňových intervaloch, pričom typická dávka je do 50 mg/týždeň. Auranofin môže byť kvôli svojej vyššej biodostupnosti (20–30 %) podávaný perorálne, s dennou dávkou 6–9 mg. Vzhľadom k svojmu špecifickému mechanizmu účinku si tieto liečivá uchovávajú určitý význam v terapii reumatoidnej artritídy i dnes, napriek postupnému ústupu od 90. rokov 20. storočia v súvislosti so zavedením nových metód liečby – nesteroidových antiflogistík, glukokortikoidov a najmä tzv. liečiv modifikujúcich ochorenie (DMARDs – disease modifying antirheumatic drugs). Ich prednosťou je i relatívna cenová výhodnosť v porovnaní s najnovšími DMARDs. V poslednej dobe je badateľná obnova záujmu o tieto liečivá, často v rámci novokoncipovaných kombinačných terapií. Predmetom výskumu je tiež využitie komplexov zlata pôvodne určených pre liečbu reumatoidnej artritídy v iných oblastiach terapie11).
Komplexy vanádu ako antidiabetiká
Vanád, napriek svojej značnej rozšírenosti v prírode, patrí k menej preskúmaným prechodným prvkom. Jedná sa o redoxne aktívny prvok vyskytujúci sa vo viacerých oxidačných stupňoch (II, III, IV, V), pričom najstabilnejšími oxidačnými číslami pri fyziologickom pH sú IV a V. V súčasnosti je považovaný za esenciálny stopový prvok pre niektoré organizmy12). Vanád v bunke ovplyvňuje činnosť viacerých enzýmov (napr. ATPáz, fosfatáz, proteínkináz a ribonukleáz), ako aj nimi riadených signálnych kaskád. Má osobitný význam v metabolizme určitých druhov organizmov13), vyskytuje sa napr. v nitrogenázach pôdnych baktérií (Azotobacter) alebo v rôznych haloperoxidázach katalyzujúcich oxidáciu halogenidov peroxidom vodíka za vzniku organických halogénderivátov. Niektoré organizmy akumulujú vanád vo forme komplexných zlúčenín. Vzhľadom k relatívne vysokému zastúpeniu v morskej vode sa jedná najčastejšie o morské organizmy, ako sú ascídie (Ascidiacea) a plášťovce (Tunicata), ale vo forme amavadínu, oktakoordinovaného komplexu štvormocného vanádu, sa vyskytuje aj v niektorých hubách, napr. v muchotrávke červenej (Amanita muscaria).
Zlúčeniny vanádu vykazujú viaceré druhy farmakologickej aktivity14). Už pomerne veľmi skoro (koniec 19. storočia) bola rozpoznaná ich biologická aktivita, keď bol skúmaný vplyv perorálne podávaných vanadičnanov na rôzne ochorenia, medzi nimi aj na diabetes mellitus15). Ukázalo sa, že zlúčeniny vanádu v oxidačnom stupni V spôsobujú zníženie hladiny glukózy v krvi u pacientov. V nasledujúcich desaťročiach antidiabetická aktivita komplexov vanádu upadla na dlhú dobu do zabudnutia a bola znovu objavená až v 90. rokoch 20. storočia v súvislosti s testovaním látok účinných v terapii diabetu 2. typu. Tento typ diabetu je charakteristický zníženou odozvou buniek na prísun inzulínu (toleranciou), následne vedúcou k strate účinnosti externej suplementácie inzulínu.
Zlúčeniny vanádu nemôžu úplne nahradiť nedostatok inzulínu v diabete 1. typu, avšak môžu znížiť jeho potrebu a potenciálne aj nahradiť hypoglykemiká používané pri diabete 2. typu. Vzhľadom k svojej aktivite, podobnej účinku inzulínu, sa nazývajú tiež inzulínové mimetiká. Dôležitým zistením bolo, že komplexy vanádu obsahujúce organické ligandy vykazujú vo všeobecnosti vyššiu efektivitu než anorganické (iónové) soli vanádu. Nevýhodou jednoduchých anorganických zlúčenín vanádu (síran vanadylu, vanadičnan amónny) je nízka resorpcia z tráviaceho traktu po perorálnej administrácii, čo vedie k potrebe použitia pomerne vysokých dávok16). V pokusoch na zvieratách sa ukázalo, že v prípade jednorázovej dávky síranu vanadylu (VOSO4) dochádza k gastrointestinálnej resorpcii len asi 10 % látky. Následkom vyšších dávok potrebných na dosiahnutie terapeutického účinku boli tiež pozorované prípady podráždenia tráviaceho traktu u pacientov. Cieľom ďalšieho výskumu bol preto vývoj komplexných zlúčenín vanádu s vhodnými organickými ligandmi, umožňujúcimi zlepšenú resorpciu z tráviaceho traktu. Zatiaľ najúspešnejšími z týchto komplexov sú bis(maltoláto)-oxidovanadičitý komplex (BMOV) a bis(etylmaltoláto)-oxidovanadičitý komplex (BEOV)16) (obr. 2). Druhá z uvedených látok sa dostala do II. štádia klinického skúmania, hoci klinický výskum ešte nie je ukončený. Miera resorpcie z tráviaceho traktu dosahuje až trojnásobok v porovnaní s VOSO4, teda okolo 30 %.
Obr. 2. Štruktúra komplexu vanádu BMOV 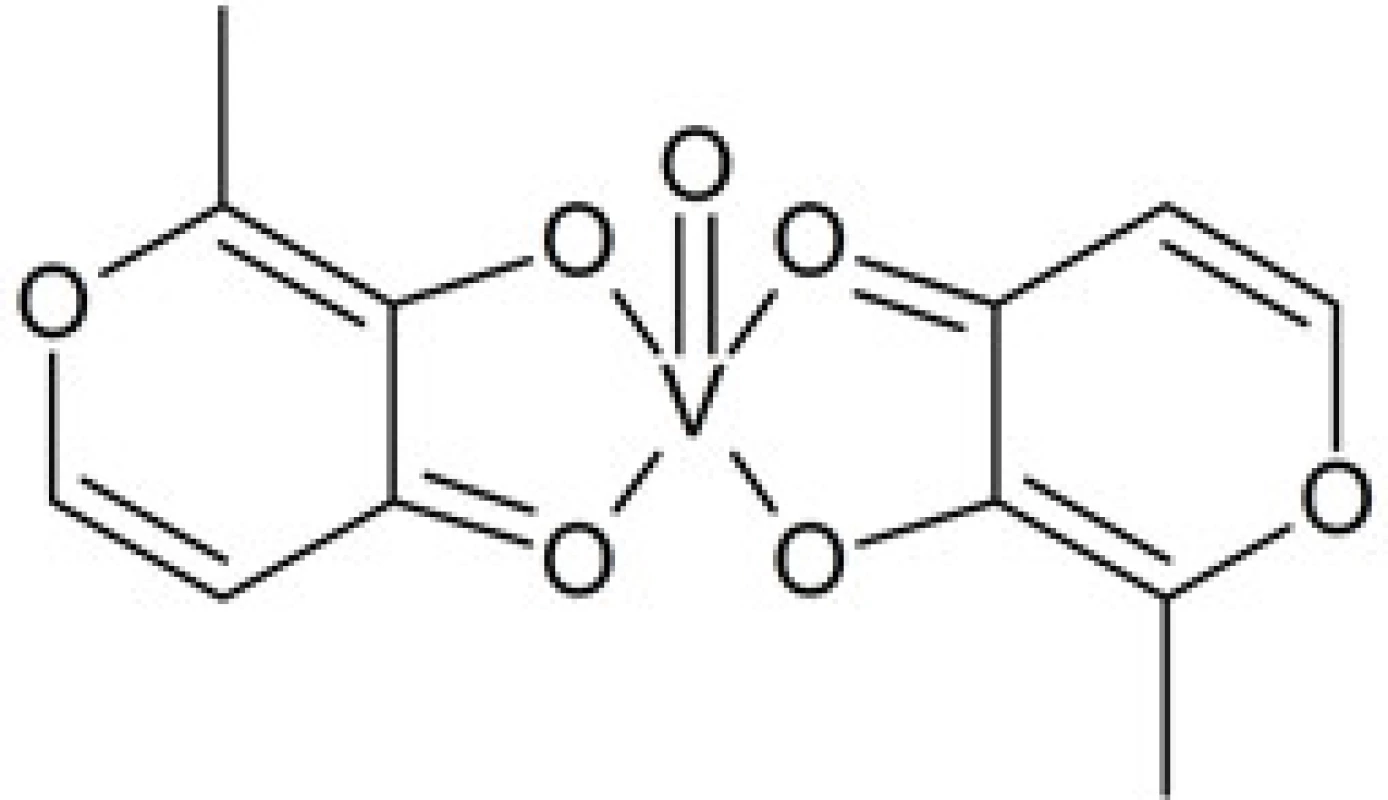
Vzhľadom k tomu, že zlúčeniny vanádu sú schopné interagovať s mnohými signálnymi dráhami v bunke, je mechanizmus ich biologickej aktivity komplexný a nie úplne preskúmaný17). V konkrétnom prípade ich antidiabetického účinku je možné uvažovať dva hlavné spôsoby účinku, v závislosti od oxidačného stupňa vanádu. Kým v prípade päťmocného vanádu prevažuje vnútrobunková aktivita, najmä vplyv na metabolizmus glukózy a lipidov, štvormocný vanád účinkuje prevažne v krvnej plazme, inhibíciou lipolýzy a aktiváciou transportu glukózy cez plazmatickú membránu. Celkovo je možné konštatovať, že zlúčeniny vanádu v oxidačnom stupni IV sú terapeuticky účinnejšie než zodpovedajúce komplexy v oxidačnom stupni V alebo III. Na druhej strane oxidačné stupne IV a V sú energeticky blízke a je možná ich vzájomná premena za fyziologických podmienok v bunke. Vanadičnanový anión (spravidla vo forme H2VO4–) je z hľadiska svojej geometrie (tetraéder), elektrónovej štruktúry a čiastočne tiež chemických vlastností, analógom fosforečnanového aniónu (H2PO4–). Vanadičnanový anión má preto schopnosť zastupovať fosforečnan v enzýmoch regulovaných týmto aniónom a príslušných signálnych kaskádach.
U komplexov typu BEOV dochádza pomerne skoro po ich resorpcii v tráviacom trakte k disociácii na VO2+ a voľný ligand. Katión vanadylu následne vytvára stabilný adukt so sérovým transferínom a v tejto podobe je potom vanád transportovaný do rôznych tkanív. Pritom dochádza k reverzibilnej akumulácii vanádu v kostnom tkanive, ktoré slúži ako zásobáreň (depot) vanádu, a predlžuje tak jeho biologický polčas v organizme.
Hlavným mechanizmom antidiabetického účinku vanádu sa javí byť inhibícia proteínovej tyrozínfosfatázy (PTPázy). PTPáza zohráva významnú úlohu v regulácii prísunu glukózy do bunky prostredníctvom glukózového transportéra. Tento transportér je aktivovaný väzbou inzulínu na inzulínový receptor nachádzajúci sa v bunkovej membráne, v dôsledku ktorej dochádza k fosforylácii tyrozínu v bunke. V neprítomnosti inzulínu je glukózový transportér inhibovaný účinkom PTPázy, zabraňujúcej autofosforylácii. Vanadičnanový ión je schopný koordinácie v aktívnom centre PTPázy, čo vedie k inhibícii tohoto enzýmu, následne k spusteniu autofosforylácie a iniciácii transportu glukózy do bunky.
Počas klinických štúdií demonštrovali viaceré zlúčeniny vanádu pozitívny vplyv na metabolizmus glukózy. Typická denná dávka komplexu BEOV v priebehu fázy II klinického skúmania bola 20 mg. Prejavy systémovej toxicity v priebehu klinických experimentov boli minimálne. Napriek tomu treba podotknúť, že publikované klinické štúdie boli realizované na malom počte dobrovoľníkov s pomerne krátkym trvaním a z tohoto dôvodu sa skúmané komplexy zatiaľ nepresadili v klinickej praxi18). Napriek týmto čiastočným úspechom teda pokračuje výskum nových zlúčenín s antidiabetickým účinkom, s cieľom pripraviť komplexy vanádu s vyššou aktivitou, ako aj klinické štúdie známych komplexov za účelom spresnenia údajov o ich účinnosti, mechanizme farmakologickej aktivity a možnej toxicite. Anorganické soli vanádu taktiež našli použitie v komplementárnej liečbe diabetes a v rôznych výživových doplnkoch.
Antidiabetický účinok bol pozorovaný aj u zlúčenín niektorých iných prechodných kovov, najmä chrómu, molybdénu, wolfrámu a zinku19). Vyššie dávky komplexov chrómu (v oxidačnom stupni III) pôsobia pozitívne na metabolizmus glukózy. V prípade komplexu chrómu s pikolinátovými ligandmi bola zhruba u polovice pacientov trpiacich diabetom 2. typu pozorovaná terapeutická účinnosť20). Okrem znižovania hladiny glukózy v krvi majú chromité komplexy aj vplyv na metabolizmus lipidov. Napriek týmto výsledkom je použitie zlúčenín chrómu kontroverzné, vzhľadom k ich možnému mutagénnemu a teratogénnemu účinku. Zlúčeniny molybdénu a wolfrámu sú účinné vo forme zodpovedajúcich molybdénanových, resp. wolfrámanových aniónov, hoci ich efekt je podstatne menej preskúmaný v porovnaní so zlúčeninami vanádu či chrómu (iba preklinické štúdie). V pokusoch na zvieratách bola dokázaná taktiež účinnosť komplexov zinku pri diabete 2. typu. Výhodou komplexov uvedených kovov je ich relatívne nižšia toxicita v porovnaní so zlúčeninami chrómu.
Lítium v liečbe psychických ochorení
Využitie zlúčenín lítia predstavuje zásadný pokrok v liečbe niektorých psychických ochorení a napriek nástupu moderných psychofarmák zohráva naďalej významnú úlohu v terapii. Je nutné zdôrazniť, že v prípade týchto zlúčenín sa nejedná o koordinačné zlúčeniny (komplexy kovov), ale o jednoduché soli (podobne ako u niektorých iných zlúčenín uvedených v tomto prehľade). Tematicky sa však spadá pod medicínsku anorganickú chémiu, vzhľadom k tomu, že pre biologický účinok je určujúca prítomnosť kovu a až v druhom rade jeho väzbový charakter.
Lítium je alkalický kov s relatívne jednoduchou chémiou, vyskytujúci sa v prírode len vo forme svojich zlúčenín. Nachádza sa v malých množstvách vo všetkých druhoch živých organizmov, kde však nemá žiadnu preukázateľnú fyziologickú funkciu. Mnohé minerálne vody obsahujú lítium, aj keď jeho koncentrácia je spravidla nízka. Svojimi vlastnosťami sa podobá ostatným alkalickým kovom. Podobne ako tieto tvorí jednomocný katión, hoci na rozdiel od nich vytvára väzby s pomerne výrazným podielom kovalentnosti. Lítny katión má mimoriadne malý iónový polomer a vysokú hustotu náboja, čo spolu s rozsiahlou hydratačnou sférou vedie k nízkej iónovej mobilite lítia vo vodnom roztoku. Vzhľadom k diagonálnej podobnosti v rámci periodickej sústavy prvkov vykazuje niektoré analógie s horčíkom (napr. podobný atómový a iónový polomer) a čiastočne tiež s vápnikom. Na základe tejto podobnosti môže interagovať so signálnymi dráhami v organizme sprostredkovanými horčíkom a vápnikom.
Lítium bolo objavené v roku 1817 a už v nasledujúcich desaťročiach dochádza k prvým pokusom o jeho využitie v terapii21). Lítna soľ kyseliny močovej vykazuje značnú rozpustnosť vo vode, ako jedna z mála solí tejto kyseliny. Na základe tohoto pozorovania bola snaha dosiahnuť podávaním solí lítia rozpustenie depozitov kyseliny močovej, vznikajúcich v dôsledku dny (arthritis urica), zápalového ochorenia kĺbov22). Následne bolo lítium aplikované v terapii ďalších ochorení, ako sú reumatizmus, infekcie, obličkové kamene a podobne, avšak bez systematického experimentálneho základu. V roku 1886 zverejnil dánsky fyziológ monografiu pojednávajúcu o depresii a jej terapii23). V tejto práci popísal aj použitie prípravkov obsahujúcich lítium v liečbe recidivujúcej depresívnej poruchy. Väčšina týchto aplikácií sa však zakladala na mylnej domnienke o hromadení kyseliny močovej v organizme ako základnej príčiny liečených ochorení a o ľahšom vylučovaní tejto kyseliny z tela vo forme jej lítnej soli. V dôsledku vyvrátenia tejto hypotézy dochádza neskôr k ústupu použitia zlúčenín lítia v terapii.
Dejiny využitia lítia v modernej terapii začínajú koncom 40. rokov 20. storočia, keď publikoval austrálsky psychiater John Cade prvé práce o vplyve lítia na priebeh depresie a bipolárnej poruchy24). V priebehu experimentov na zvieratách aplikoval lítnu soľ kyseliny močovej morčatám a pozoroval upokojujúci účinok a zníženie dráždivosti bez sedatívneho efektu. Neskôr zistil rovnaký účinok aj pri použití uhličitanu lítneho, z čoho usúdil, že farmakologický účinok je viazaný na lítium, nie na kyselinu močovú. Na základe týchto uzáverov pristúpil následne k testovaniu uhličitanu lítneho na psychiatrických pacientoch trpiacich manickou epizódou bipolárnej poruchy, pričom zaznamenal všeobecný ústup symptómov.
Použitie lítia v terapii bipolárnej poruchy a depresie sa spočiatku presadzovalo len pomaly, predovšetkým kvôli nedostatočnej úrovni východiskových klinických štúdií a tiež vzhľadom na viaceré závažné prípady intoxikácie lítiom, zaznamenané v tomto období. Situáciu zmenili až následné podrobné klinické a toxikologické štúdie, napr. práce dánskych lekárov Baastrupa, Strömgrena a Schoua25). V priebehu týchto štúdií bola dostatočne preukázaná efektivita lítia v liečbe depresie a bipolárnej poruchy (manických aj depresívnych epizód). V ďalšom období boli uskutočnené aj pokusy o rozšírenie aplikácie zlúčenín lítia aj na terapiu iných psychických ochorení, avšak výsledky ukázali podstatne nižšiu účinnosť.
Dnes sú zlúčeniny lítia všeobecne používané v terapii depresie a bipolárnej afektívnej poruchy (manických aj depresívnych epizód), a taktiež schizofrénie21). Sú klasifikované ako tzv. stabilizátory nálady26). Ich obzvlášť ceneným účinkom je zníženie incidencie suicídu pri týchto ochoreniach, považovaný za unikátnu vlastnosť liečiv na báze lítia. Sú aplikované perorálne, najčastejšie ako uhličitan lítny, pričom celková dávka môže dosahovať až 2 g/deň. Vzhľadom k pomerne úzkemu terapeutickému rozmedziu lítia musí byť jeho dávkovanie starostlivo kontrolované. Štandardne sa používa monitorovanie hladiny lítia v krvi 12 h po administrácii liečiva. V počiatkoch aplikácie bolo lítium používané v terapii akútnych fáz ochorení s použitím vyšších dávok lítia, neskôr sa začalo aplikovať dlhodobo v menších dávkach v rámci profylaxie. Lítium vykazuje celý rad nežiadúcich účinkov, obzvlášť pri prekročení odporúčanej dávky27, 28). Patria k nim napr. ovplyvnenie funkcie štítnej žľazy, zvýšenie telesnej hmotnosti, tremor, nevoľnosť, diarea a ataxia. Pri dlhodobom používaní vyšších dávok liečiva môže dôjsť k poškodeniu obličiek. Vzhľadom k širokému spektru nežiadúcich účinkov bolo terapeutické použitie zlúčenín lítia po dlhú dobu kontroverzné. Na druhej strane jeho nespornou výhodou je jeho nízka cena a všeobecná dostupnosť ako generikum.
Lítium je po perorálnej aplikácii vo veľkej miere resorbované a následne distribuované do všetkých orgánov tela. Zvýšená akumulácia lítia v tele je pozorovaná najmä v endokrinných žľazách, napr. v hypofýze a štítnej žľaze, a taktiež v kostiach. V organizme interaguje s mnohými biochemickými procesmi a súčasťami bunky, preto je identifikácia potenciálneho farmakologického mechanizmu a miesta účinku mimoriadne komplikovaná29). Biologická aktivita lítneho katiónu môže byť spojená s jeho analógiou s horčíkom, resp. s vápnikom, napr. v enzýmoch aktivovaných horečnatými katiónmi. Lítium interferuje s metabolizmom fosfatidylinozitolov, pričom akompetitívne inhibuje inozitolmonofosfatázu. V dôsledku toho dochádza k zníženiu koncentrácie myoinozitolu v bunkách, čo môže byť príčinou nižšej odozvy mozgu na vonkašie stimuly.
Okrem vyššie uvedeného použitia sú v súčasnosti predmetom výskumu aj aplikácie lítia v terapii ďalších ochorení30). Ako príklad môžeme uviesť neuroprotektívne účinky lítia (Alzheimerova choroba), potenciáciu imunitnej odpovede, antivirálne účinky, topikálne aplikácie v liečbe kožných ochorení (napr. seboroická dermatitída) a pod.
Chelatačná terapia
Chelatačná terapia sa odlišuje od iných aplikáciií komplexov kovov vo farmácii, keďže pri nej nedodávame do organizmu kovy, ale naopak, odstraňujeme ich31). V rámci tejto terapie aplikujeme vhodné ligandy, ktoré vytvárajú in vivo stabilné komplexy s kovmi a v tejto forme môžu byť následne z organizmu vylúčené. Klasickou aplikáciou chelatačnej terapie je odstraňovanie toxických kovov pri otravách, najmä tzv. „ťažkými“ kovmi. Ako príklady môžeme uviesť intoxikácie zlúčeninami olova, ortuti, arzénu či železa. V závislosti od druhu chelatačného činidla, toxického kovu, ako aj charakteru otravy môžu byť tieto liečivá aplikované perorálne, intravenózne alebo intramuskulárne.
Počiatky chelatačnej terapie siahajú do medzivojnového obdobia a súvisia s objavom kyseliny etyléndiaminotetraoctovej (EDTA), látky tvoriacej mimoriadne stabilné komplexy s iónmi kovov. K ďalšiemu rozvoju dochádza v priebehu 2. svetovej vojny v dôsledku hľadania vhodných antidot (protijedov) pri intoxikáciách chemickými bojovými látkami, najmä lewisitom (bojová látka obsahujúca arzén)32). Výsledkom výskumu bol dimerkaprol, 2,3-bis(sulfanyl)propan-1-ol (BAL – British anti-Lewisite). Neskôr sa ukázalo, že táto látka vykazuje značnú účinnosť pri otravách olovom.
V nasledujúcom období bola aplikácia dimerkaprolu rozšírená aj na liečbu otráv inými kovmi. Časom sa však ukázalo, že takáto terapia môže viesť k viacerým nežiadúcim účinkom, často aj so závažným priebehom (v niektorých prípadoch dokonca letálnym). Medzi príčinami vysokej toxicity dimerkaprolu môže byť aj jeho výrazný lipofilný charakter, preto boli skúmané ďalšie chelátory s hydrofilnejšími vlastnosťami33, 34). Medzi tieto látky patria napr. kyselina dimerkaptojantárová (DMSA) (obr. 3) a dimerkaptopropánsulfónová (DMPS), vykazujúce podstatne nižšiu toxicitu. Samotná EDTA je napriek svojmu hydrofilnému charakteru pri intravenóznej administrácii vysoko toxická, čo môže byť spôsobené (podobne ako aj u dimerkaprolu) tendenciou k mobilizácii kovov v pôvodných miestach depozície a ich transportu (ako komplexov) do iných tkanív a orgánov, napr. do mozgu.
Obr. 3. Štruktúra DMSA (kyseliny dimerkaptojantárovej) 
Zlúčeniny vhodné ako ligandy pre chelatačnú terapiu by mali spĺňať viaceré podmienky:
- vysoká afinita k toxickému kovu – donorové atómy by mali vykazovať zodpovedajúcu tvrdosť alebo mäkkosť voči tvrdým/mäkkým centrálnym atómom kovov v zmysle teórie HSAB
- nízka toxicita
- vhodná farmakokinetika
- výsledný chelát vykazuje rýchlu elimináciu/detoxikáciu
- vyššia afinita voči toxickým kovom v porovnaní s esenciálnymi kovmi v organizme
- nemali by podporovať redistribúciu toxických kovov do iných orgánov
Pri otravách olovom sa často využíva kombinácia EDTA (najmä vo forme CaNa2EDTA) s lipofilnejšími chelátormi, napr. s BAL. EDTA je tiež prvou voľbou pri otravách kadmiom. V prípade intoxikácie zlúčeninami ortuti sú používané najmä DMSA a DMPS.
Chelatačná terapia má tiež značný význam v terapii metabolických ochorení vyznačujúcich sa narušením homeostázy kovových prvkov v organizme35). Tieto ochorenia majú väčšinou genetický základ a vedú k nadmernej akumulácii kovových prvkov v bunkách. Pri Wilsonovej chorobe sa jedná o poruchu transportu medi, ktorá má za následok akumuláciu tohto prvku v niektorých orgánoch, predovšetkým v pečeni a mozgu36). Typickým príznakom ochorenia je ukladanie medi v očnej rohovke. Najčastejšie aplikovaným chelátorom pri Wilsonovej chorobe je D-penicilamín, často v kombinácii so soľami zinku, ktoré inhibujú intestinálnu resorpciu medi.
Dedičným ochorením je i hemochromatóza, charakteristická zvýšenou intestinálnou resorpciou železa a jeho nadmernou akumuláciou v tkanivách, napr. v pečeni a pankrease. Ďalšími ochoreniami prejavujúcimi sa hyperakumuláciou železa sú β-talasémia, kosáčikovitá anémia a ďalšie poruchy metabolizmu hemoglobínu. Vzhľadom k nízkej exkrécii železa z organizmu vedie jeho nadmerná akumulácia v konečnom dôsledku k zlyhaniu dôležitých orgánov a k smrti37). Štandardnou chelatačnou terapiou pri týchto ochoreniach je podávanie deferoxamínu, prírodného liečiva izolovaného z huby Streptomyces pilosus. Vzhľadom k svojej nízkej biodostupnosti musí byť aplikovaný formou subkutánnej infúzie.
Chelatačná terapia by mohla predstavovať potenciálny prínos aj v liečbe Alzheimerovej choroby35). Pri tomto ochorení dochádza k akumulácii viacerých kovov (najmä medi, železa a zinku) v neuropiloch mozgu, obzvlášť v depozitoch amyloidu, čo vedie k nárastu oxidatívneho stresu a poškodeniu tkanív. Dôležitou vlastnosťou potenciálnych chelátorov je v takomto prípade schopnosť preniknúť hematoencefalickou bariérou. Napriek viacerým pozitívnym výsledkom je táto aplikácia stále v štádiu výskumu, podobne ako antineoplastická terapia založená na redukcii množstva železa dostupného rakovinovým bunkám38).
Kontroverznou oblasťou využitia chelatačnej terapie je liečba aterosklerózy, založená na predpoklade odstraňovania depozitov vápnika z koronárnych artérií. Podobne spornou je aj terapia autizmu aplikáciou chelatačných činidiel, ktorej terapeutický benefit nebol potvrdený v klinickej praxi. Napriek istej popularite tejto terapie v alternatívnej medicíne je jej použitie značne rizikové, vzhľadom k tomu, že najčastejšie sa ako chelátor aplikuje EDTA vykazujúca množstvo závažných nežiadúcich účinkov39). Na druhej strane niektoré publikované výsledky výskumu naznačujú reálny klinický prínos chelatačnej terapie v liečbe kardiovaskulárnych ochorení (infarkt myokardu a pod.)40).
Niektoré ďalšie oblasti aplikácie kovov vo farmakoterapii
K aktuálnym témam výskumu metalofarmák patrí ich inhibičná aktivita voči mnohým enzýmom41). Komplexy kovov ako inhibítory enzýmov vykazujú viaceré vlastnosti odlišné od čisto organických inhibítorov. Boli tu už spomenuté inhibítory ureázy typu komplexných zlúčenín kovov, antidiabetické zlúčeniny vanádu ako inhibítory proteíntyrozínfosfatáz, ako aj zlúčeniny kovov s protinádorovým účinkom, ktorých aktivita súvisí s inhibíciou niektorých enzýmov. Spomedzi viacerých ďalších enzýmov inhibovaných zlúčeninami kovov stojí za zmienku inhibícia β-laktamáz, enzýmov s centrálnym významom pri rozvoji získanej rezistencie mikroorganizmov voči β-laktámovým antibiotikám (napr. penicilínom a karbapenemom). Tieto antibiotiká patria k základnému arzenálu antibakteriálnej chemoterapie a ich účinnosť je v posledných desaťročiach čoraz viac znižovaná výskytom rezistencie, spôsobenej najmä zvýšenou expresiou β-laktamáz, schopných katalyzovať hydrolýzu štvorčlenného β-laktámového kruhu. V súvislosti s týmto javom sa v čoraz vyššej miere presadzuje kombinačná terapia, pri ktorej sú spolu s β-laktámovými antibiotikami podávané tiež inhibítory β-laktamáz. Medzi najúčinnejšie takéto inhibítory patria rôzne deriváty alkylboritých kyselín, napr. vaborbaktám (obr. 4), cyklický monoester alkylboritej kyseliny, ktorý našiel uplatnenie v klinickej praxi v kombinácii s antibiotikom meropenémom42). Alkylborité zlúčeniny majú často širšie spektrum účinnosti, t. j. sú účinné aj pri β-laktamázach, odolných voči čisto organickým inhibítorom, ako je napr. kyselina klavulánová. Samotný vaborbaktám nevykazuje antibiotické účinky, vo vývoji sú však ďalšie organoborité zlúčeniny, ktoré spájajú inhibíciu β-laktamáz s antimikróbnou aktivitou.
Obr. 4. Štruktúra vaborbaktámu 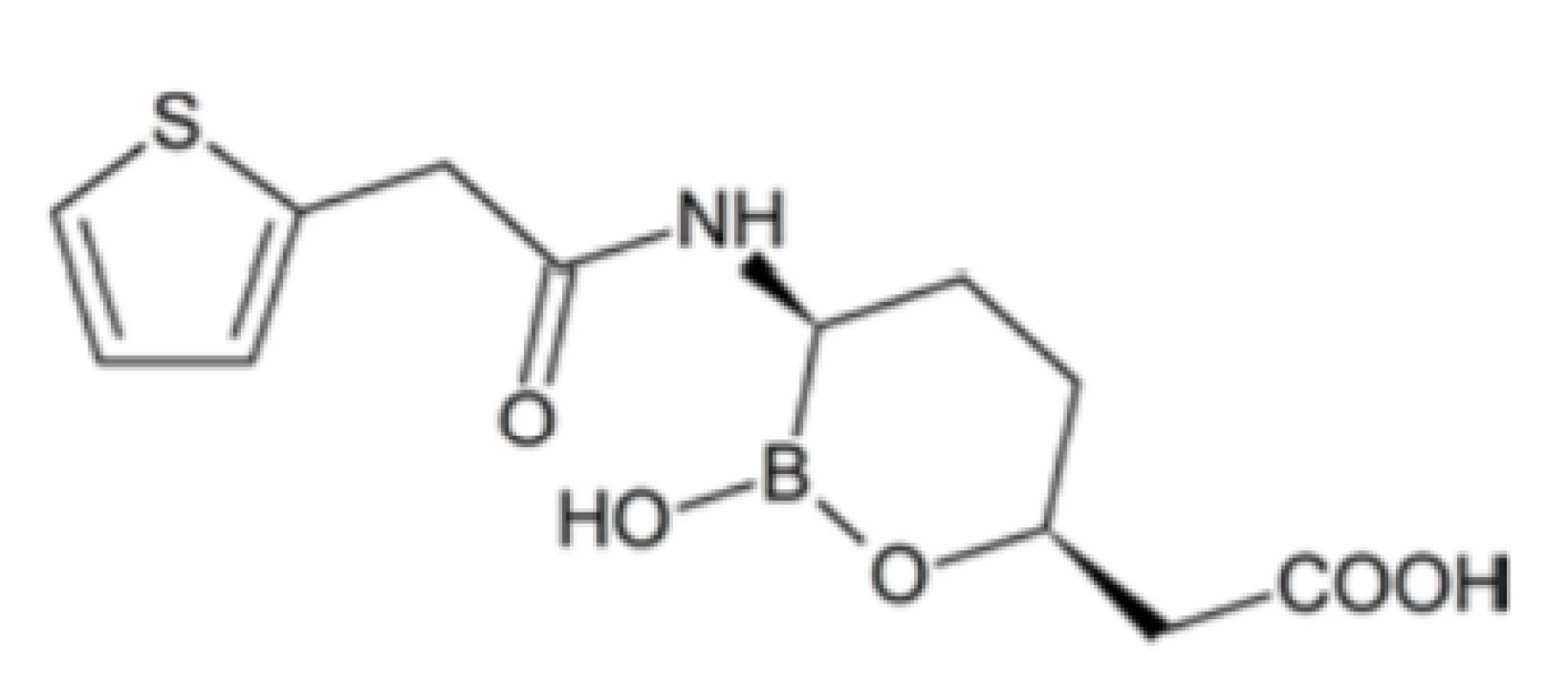
Oxid dusnatý (NO) zohráva významnú úlohu vo viacerých biochemických procesoch. Je súčasťou signálnych dráh zapojených do regulácie fyziologických dejov v organizme, napr. riadi vazodilatáciu (rozšírenie ciev) v kardiovaskulárnom systéme. Jeho nadbytok môže viesť k závažným patofyziologickým javom, ako je hypotenzia, prípadne až kardiovaskulárny kolaps. V takom prípade by mohlo byť zmysluplné podávanie komplexov kovov schopných viazať oxid dusnatý. Naopak, ak je žiadúca zvýšená vazodilatácia, je vhodné použitie liečiv – donorov oxidu dusnatého. Medzi takéto látky patria aj komplexy niektorých kovov obsahujúce ako ligand oxid dusnatý, tzv. nitrozylové komplexy. Najčastejšie sa jedná o komplexy kovov, ako sú ruténium43) či železo. V klinickej praxi je už dlhodobo etablovaným liečivom nitroprusid sodný, pentakyanido-nitrozylželezitan sodný (obr. 5), používaný na radikálne zníženie krvného tlaku pri niektorých indikáciách44). Jeho výhodou je veľmi rýchly nástup účinku. Je aplikovaný pomocou intravenóznej infúzie. Problémom pri jeho použití je čiastočná disociácia komplexu in vivo a uvoľňovanie kyanidových iónov do okolitého prostredia, prejavujúcich toxické účinky najmä pri vyššej koncentrácii liečiva. Z tohoto dôvodu prebieha výskum ďalších nitrozylových komplexov, neobsahujúcich kyanidové ligandy.
Obr. 5. Štruktúra komplexného aniónu nitroprusidu sodného 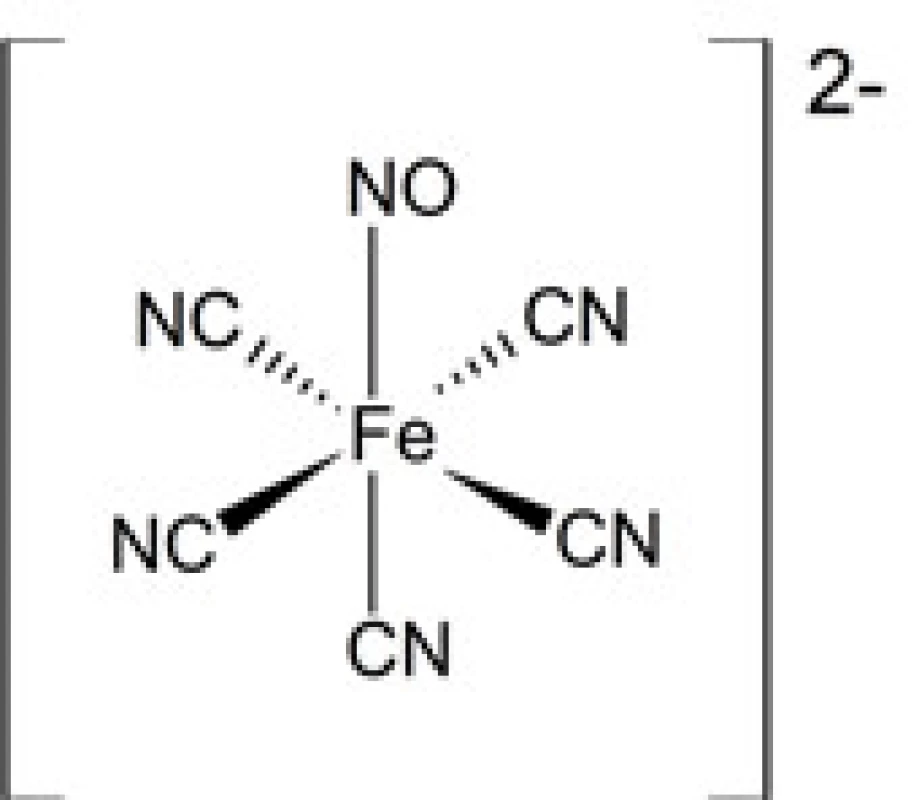
Reaktívne formy kyslíka, medzi ktorými zaujíma prominentné miesto superoxidový (hyperoxidový) anión-radikál O2.–, sú vedľajšími produktmi normálneho metabolizmu a ich hladina je trvale udržiavaná na nízkej úrovni prostredníctvom bunkových detoxikačných mechanizmov. Za istých okolností, ako napríklad v prípade infarktu myokardu a iných patologických stavov, však môže dochádzať k zvýšeniu koncentrácie superoxidu a v dôsledku toho k následnému poškodeniu okolitých tkanív týmto vysokoreaktívnym radikálom. Superoxid je tiež spájaný s patogenézou ochorení, ako sú reumatoidná artritída, Alzheimerova a Parkinsonova choroba. Základom bunkovej detoxikácie superoxidu je jeho premena na peroxid vodíka a molekulový kyslík za katalýzy enzýmom superoxiddizmutáza. Superoxiddizmutáza je metaloenzým obsahujúci v svojom aktívnom centre ióny kovov, ktoré majú zásadný význam pre jeho katalytickú funkciu. V závislosti od konkrétnej kategórie superoxiddizmutázy sa jedná hlavne o meď spolu so zinkom (v cytosóle väčšiny eukaryotických buniek), prípadne o mangán alebo železo (v mitochondriách eukaryotov, ako aj u nižších organizmov). V súčasnosti prebieha výskum funkčných mimetík tohoto enzýmu, t. j. komplexov vyššie uvedených kovov (najmä Cu, Mn a Fe) vykazujúcich analogickú aktivitu ako superoxiddizmutáza45, 46). Cieľom je príprava katalyticky aktívnych komplexov s vysokou aktivitou a selektivitou pre tento typ reakcie. Nemenej dôležitými sú i nízka toxicita a vhodná farmakokinetika potenciálneho liečiva. Z tohoto dôvodu nie je vhodné použitie jednoduchých solí kovov, napriek tomu, že predovšetkým voľný meďnatý katión (t. j. akvakomplex medi) je veľmi aktívnym katalyzátorom dizmutácie superoxidových radikálov. Vzhľadom k zložitosti štruktúry aktívneho centra samotnej superoxiddizmutázy je imitácia jeho štruktúry pomocou komplexných zlúčenín taktiež problematická. V súčasnosti sa ako najsľubnejšie mimetiká superoxiddizmutázy javia komplexy mangánu.
Špecifickým typom biologicky aktívnych zlúčenín kovov sú polyoxometaláty – klastre tvorené prechodnými kovmi vo vysokých oxidačných stupňoch (najmä V, Mo a W), premostenými navzájom atómami kyslíka47). Tieto klastre nesú spravidla záporný náboj. Polyoxometaláty vytvárajú veľmi pestrú paletu trojrozmerných štruktúr pozostávajúcich z rôzne usporiadaných základných polyédrov. Prvá takáto látka, fosfomolybdénan amónny, bola objavená už v roku 1826, avšak k rozvoju prípravy a aplikácie polyoxometalátov dochádza až relatívne nedávno. Tieto zlúčeniny majú množstvo zaujímavých potenciálnych použití, popri aplikáciách v katalýze či elektronike tiež rôzne druhy biologickej aktivity48), napr. antibakteriálnu, antivirálnu a antineoplastickú aktivitu. Predmetom výskumu je aj ich potenciálne využitie ako enzýmových mimetík49).
Zaujímavým aspektom interakcie kovov s biomolekulami je vplyv iónov kovov (predovšetkým medi a zinku) na bioaktivitu niektorých antibiotík50). K takejto interakcii dochádza buď priamou väzbou na molekuly antibiotík, alebo ovplyvnením bakteriálnej odozvy na antibiotiká (vznik rezistencie).
Ióny kovov sú rozšírenou súčasťou prírodného prostredia, či už z prírodných zdrojov, alebo ako dôsledok environmentálneho znečistenia (environmentálne stresory). Významným zdrojom je aj poľnohospodárstvo, vo forme aditív do krmív pre hospodárske zvieratá (Cu, Zn). Tieto kovy, napriek ich esenciálnemu charakteru, majú vo vyšších koncentráciách výrazný toxický účinok voči mikroorganizmom. Zvýšená expozícia buniek mikroorganizmov iónom kovov má za následok adaptáciu postihnutých buniek a aktiváciu mechanizmov rezistencie, najmä znížený príjem a zvýšený eflux kovov, ktoré sú z fyziologického aj genetického hľadiska príbuzné rezistenčným mechanizmom proti antibiotikám. Dôsledkom je teda zvýšená odolnosť mikroorganizmov voči obom stresorom – iónom kovov aj antibiotikám. Takto bola napríklad potvrdená závislosť medzi používaním krmív obohatených zinkom a zvýšeným výskytom meticilín-rezistentných kmeňov Staphylococcus aureus v hospodárskych zvieratách51). Podobne sa uvádza spojitosť medzi meďou v krmivách a nárastom rezistencie proti glykopeptidovým a makrolidovým antibiotikám v rôznych enterokokových baktériách51). Tento jav predstavuje obzvlášť závažný problém vzhľadom k možnosti zoonózy – prenosu multirezistentných mikroorganizmov zo zvierat na človeka.
Ióny kovov môžu ovplyvňovať aktivitu antibiotík taktiež priamou koordináciou vo forme komplexných zlúčenín. Už od roku 1946 je známy fenomén inaktivácie penicilínu52), spôsobený koordináciou zinku na toto antibiotikum a následnou hydrolýzou jeho β-laktámového kruhu (podobný účinok bol pozorovaný aj u tetracyklínu). Podobne ako zinok aj meď vytvára komplexné zlúčeniny s radom antibiotík. Väčšinou pritom dochádza k zníženiu účinnosti použitých antibiotík, avšak tento efekt je kvalitatívne aj kvantitatívne závislý od druhu mikroorganizmu ako aj od samotného antibiotika. V niektorých prípadoch je možné pozorovať synergický efekt iónu kovu a antibiotika, teda lepšiu celkovú účinnosť terapie (napr. kombinácia zinku a karbapenemových, resp. fluorochinolónových antibiotík proti Pseudomonas aeruginosa)53).
Záver
Výskum bioaktívnych komplexov kovov nadobúda čoraz väčší význam, o čom svedčí aj neustále rastúci počet vedeckých publikácií v tejto oblasti. Okrem najvýznamnejšej oblasti využitia metalofarmák – antimikróbnej a protinádorovej chemoterapie – stúpa počet aplikácií aj v ďalších oblastiach terapie, akými sú napríklad liečba diabetu, zápalových ochorení či inhibícia rôznych enzýmov. Komplexné zlúčeniny kovov majú spravidla výhodu špecifického mechanizmu účinku, odlišného od čisto organických liečiv, čo umožňuje v mnohých prípadoch dosiahnuť účinnosť aj v prípadoch ochorení rezistentných voči štandardnej terapii. Flexibilita štruktúrnych parametrov koordinačných zlúčenín taktiež umožňuje vo veľmi veľkej miere optimalizovať štruktúru týchto látok v zmysle analýzy závislosti štruktúra – biologická účinnosť. Na druhej strane, vzhľadom k inherentnej toxicite iónov mnohých kovov, vyvstáva potreba jej účinného obmedzenia vhodným výberom ligandov a spôsobu koordinácie. Všetky tieto faktory si do budúcna vyžiadajú intenzívny interdisciplinárny výskum v oblasti chemickej syntézy (príprava nových metalofarmák) a analýzy (skúmanie štruktúry pripravených komplexov kovov, ich speciácia in vivo), ako aj v oblasti biochémie a farmakológie (vzťahy medzi štruktúrou a aktivitou, mechanizmy účinku, rezistencie a toxicity).
Práca bola podporovaná Vedeckou grantovou agentúrou MŠVVaŠ SR a SAV, grant VEGA 1/0346/16.
Konflikt záujmov: žiaden.
Ing. Ladislav Habala, PhD. (∗) • J. Valentová
Katedra chemickej teórie liečiv
Farmaceutická fakulta UK
Odbojárov 10, 832 32 Bratislava, Slovak Republic
e-mail: habala@fpharm.uniba.sk
Zdroje
1. Raubenheimer H. G., Schmidbaur H. The late start and amazing upswing in gold chemistry. J. Chem. Ed. 2014; 91, 2024‒2036.
2. Faa G., Gerosa C., Fanni D., Lachowicz J. I., Nurchi V. M. Gold – old drug with new potentials. Curr. Med. Chem. 2018; 25, 75‒84.
3. Forestier R. L’aurothérapie dans les rhumatismes chroniques. Bulletins et memoires de la Société medicale des hôpitaux de Paris 1929; 44, 323‒327.
4. Forestier R. The treatment of rheumatoid arthritis with gold salts injections. Lancet 1932; 219, 441‒444.
5. Bullock J., Rizvi S. A. A., Saleh A. M., Ahmed S. S., Do D. P., Ansari R. A., Ahmed J. Rheumatoid arthritis: a brief overview of the treatment. Med. Princ. Pract. 2018; 27, 501‒507.
6. Naggar M. E., Shehadi I., Abdou H. E., Mohamed A. A. Gilded hope for medicine. Inorganics 2015; 3, 139‒154.
7. Kean W. F., Hart L., Buchanan W. W. Auranofin. Br. J. Rheumatol. 1997; 36, 560‒572.
8. Eisler R. Chrysotherapy: a synoptic review. Inflamm. Res. 2003; 52, 487‒501.
9. Brown C. L., Whitehouse M. W., Tiekink E. R. T., Bushell G. R. Colloidal metallic gold is not bio-inert. Inflammopharmacology 2008; 16, 133‒137.
10. Rovenský J., Rybár I., Mičeková D., Žlnay D., Lukáč J., Poprac P. Farmakoterapeutické postupy pri reumatoidnej artritíde. Via Pract. 2005; 2, 66‒74.
11. Roder C., Thomson M. J. Auranofin: repurposing an old drug for a golden new age. Drugs R. D. 2015; 15, 13‒20.
12. Mukherjee B., Patra B., Mahapatra S., Banerjee P., Tiwari A., Chatterjee M. Vanadium – an element of atypical biological significance. Toxicol. Lett. 2004; 150, 135‒143.
13. Rehder D. The role of vanadium in biology. Metallomics 2015; 7, 730‒742.
14. Rehder D. Vanadium in health issues. ChemTexts 2018; 4, 1‒7.
15. Lyonett B., Martz M., Martin E. Ľ emploi therapeutique des derivés du vanadium. La Presse Médicale 1899; 32, 191‒192.
16. Thompson K. H., Lichter J., LeBel C., Scaife M. C., McNeill J. H., Orvig C. Vanadium treatment of type 2 diabetes: A view to the future. J. Inorg. Biochem. 2009; 103, 554‒558.
17. Pessoa J. C., Etcheverry S., Gambino D. Vanadium compounds in medicine. Coord. Chem. Rev. 2015; 301–302, 24–48.
18. Scior T., Guevara-Garcia J. A., Do Q.-T., Bernard P., Laufer S. Why antidiabetic vanadium complexes are not in the pipeline of “Big Pharma” drug research? A critical review. Curr. Med. Chem. 2016; 23, 2874‒2891.
19. Levina A., Lay P. A. Metal-based anti-diabetic drugs: advances and challenges. Dalton Trans. 2011; 40, 11675‒11686.
20. Wang Z. Q., Cefalu W. T. Current concepts about chromium supplementation in type 2 diabetes and insulin resistance. Curr. Diabetes Rep. 2010; 10, 145‒151.
21. Bauer M., Gitlin M. The Essential Guide to Lithium Treatment. Springer International Publishing Switzerland 2016.
22. Garrod A. B. The Nature and Treatment of Gout and Rheumatic Gout. London: Walton and Maberly 1859.
23. Lange C. Om Periodisk e Depressionstilstande og deres Patogenese. Copenhagen: Jacob Lunds Forlag 1886.
24. Cade J. F. Lithium salts in the treatment of psychotic excitement. Med. J. Aust. 1949; 2, 349–351.
25. Baastrup P. C., Schou M. Lithium as a prophylactic agent: its effect against recurrent depression and manic-depressive psychosis. Arch. Gen. Psychiatry 1967; 16, 162–172.
26. Herman E., Praško J., Hovorka J. Místo stabilizátorů nálady v léčbě bipolární poruchy. Psychiat. pro Praxi 2006; 4, 161–164.
27. Makara-Studzińska M., Koślak A., Morylowska-Topolska J., Urbańska A. Lithium therapy – the effectiveness of the medicine, side symptoms, complications and their influence on the quality of the life in affective diseases. J. Elementol. 2010; 15, 393–403.
28. Virčík Ľ., Rusínová E. Vedľajšie účinky liečby lítiom, ich mechanizmy a zvládnutie. Čes. a slov. Psychiat. 2005; 101, 36‒39.
29. Birch N. J. Inorganic pharmacology of lithium. Chem. Rev. 1999; 99, 2659‒2682.
30. Kiełczykowska M., Musik I. Lithium and the application of its compounds in different fields of medicine. J. Elementol. 2014; 19, 1167–1178.
31. Crichton R., Ward R. J., Hider R. C. (ed.) Metal Chelation in Medicine. Cambridge: Royal Society of Chemistry 2017.
32. Baran E. J. Chelation therapies: A chemical and biochemical perspective. Curr. Med. Chem. 2010; 17, 3658‒3672.
33. Aaseth J., Skaug M. A., Cao Y., Andersen O. Chelation in metal intoxication – principles and paradigms. J. Trace Elem. Med. Biol. 2015; 31, 260‒266.
34. Kim J.-J., Kim Y.-S., Kumar V. Heavy metal toxicity: an update of chelating therapeutic strategies. J. Trace Elem. Med. Biol. 2019; 54, 226‒231.
35. Scott L. E., Orvig C. Medicinal inorganic chemistry approaches to passivation and removal of aberant metal ions in disease. Chem. Rev. 2009; 109, 4885‒4910.
36. Litwin T., Dusek P., Skowrońska M., Członkowska A. Treatment of Wilson’s disease – an update. Expert Opin. Orphan Drugs 2019; 7, 287‒294.
37. Nurchi V. M., Crisponi G., Lachowicz J. I., Medici S., Peana M., Zoroddu M. A. Chemical features of in use and in progress chelators for iron overload. J. Trace Elem. Med. Biol. 2016; 38, 10‒18.
38. Yu Y., Gutierrez E., Kovacevic Z., Saletta F., Obeidy P., Suryo Rahmanto Y., Richardson D. R. Iron chelators for the treatment of cancer. Curr. Med. Chem. 2012; 19, 2689‒2702.
39. Crisponi G., Nurchi V. M., Lachowicz J. I., Crespo-Alonso M., Zoroddu M. A., Peana M. Kill or cure: misuse of chelation therapy for human diseases. Coord. Chem. Rev. 2015; 284, 278‒285.
40. Moreno C. R., Navas-Acien A., Escolar E., Nathan D. M., Newman J., Schmedtje J. F., Diaz D., Lamas G. A., Fonseca V. Potential role of metal chelation to prevent the cardiovascular complications of diabetes. J. Clin. Endocrinol. Metab. 2019; 104, 2931‒2941.
41. Kilpin K. J., Dyson P. J. Enzyme inhibition by metal complexes: concepts, strategies and applications. Chem. Sci. 2013; 4, 1410‒1419.
42. Krajnc A., Lang P. A., Panduwawala T. D., Brem J., Schofield C. J. Will morphing boron-based inhibitors beat the β-lactamases? Curr. Opin. Chem. Biol. 2019; 50, 101‒110.
43. Tfouni E., Truzzi D. R., Tavares A., Gomes A. J., Figueiredo L. E., Franco D. W. Biological activity of ruthenium nitrosyl complexes. Nitric Oxide 2012; 26, 38‒53.
44. Friederich J. A., Butterworth J. F. Sodium nitroprusside: twenty years and counting. Anesth. Analg. 1995; 81, 152‒162.
45. Riley D. P. Functional mimics of superoxide dismutase enzymes as therapeutic agents. Chem. Rev. 1999; 99, 2573‒2588.
46. Salvemini D., Muscoli C., Riley D. P., Cuzzocrea S. Superoxide dismutase mimetics. Pulm. Pharmacol. Ther. 2002; 15, 439‒447.
47. Hasenknopf B. Polyoxometalates: introduction to a class of inorganic compounds and their biomedical applications. Front. Biosci. 2005; 10, 275‒287.
48. Rhule J. T., Hill C. L., Judd D. A., Schinazi R. F. Polyoxometalates in medicine. Chem. Rev. 1998; 98, 327‒358.
49. van Rompuy, L. S., Parac-Vogt, T. N. Interactions between polyoxometalates and biological systems: from drug design to artificial enzymes. Curr. Opin. Biotech. 2019; 58, 92‒99.
50. Poole K. At the nexus of antibiotics and metals: the impact of Cu and Zn on antibiotic activity and resistance. Trends Microbiol. 2017; 25, 820‒832.
51. Yazdankhah S., Rudi K., Bernhoft A. Zinc and copper in animal feed – development of resistance and co-resistance in antimicrobial agents in bacteria of animal origin. Microb. Ecol. Health Dis. 2014; 25, 25862.
52. Eisner H., Porzecanski B. Inactivation of penicillin by zinc salts. Science 1946; 103, 629‒630.
53. Elkhatib W., Noreddin A. In vitro antibiofilm efficacies of different antibiotic combinations with zinc sulfate against Pseudomonas aeruginosa recovered from hospitalized patients with urinary tract infection. Antibiotics (Basel) 2014; 3, 64‒84.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2020 Číslo 3- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Ingavirín môže byť sľubnou zlúčeninou v boji proti koronavírusu 2 vyvolávajúcemu ťažký akútny respiračný syndróm (SARS-CoV-2)
- Léčivé přípravky s řízeným uvolňováním léčiva pro terapii nespecifických střevních zánětlivých onemocnění z pohledu farmaceutické technologie
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť III
- Protizánětlivý potenciál kompozitů kvasinkových glukanových částic a geranylovaného flavonoidu diplakonu
- Studium hypoglykemické a hypolipidemické aktivity extraktů z Camelina sativa (L.) Crantz u potkanů s dietou s vysokým obsahem fruktózy
- Farmakodynamická studie nového gelu obsahujícího extrakt z Aloe vera a extrakt z dubové kůry pro potenciální léčbu onemocnění parodontu
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčivé přípravky s řízeným uvolňováním léčiva pro terapii nespecifických střevních zánětlivých onemocnění z pohledu farmaceutické technologie
- Ingavirín môže byť sľubnou zlúčeninou v boji proti koronavírusu 2 vyvolávajúcemu ťažký akútny respiračný syndróm (SARS-CoV-2)
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť III
- Farmakodynamická studie nového gelu obsahujícího extrakt z Aloe vera a extrakt z dubové kůry pro potenciální léčbu onemocnění parodontu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



