-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam vyšetření mutace BRAF u pacientů s melanomem
9. 10. 2018
Před 10 lety měli pacienti s metastatickým melanomem velmi špatnou prognózu, 5letého přežití dosáhlo jen 6 % z nich a medián celkového přežití (OS) činil 7,5 měsíce. Biologická léčba a imunoterapie však prognózu těchto nemocných výrazně změnily. Pacient s prokázanou přítomností mutace BRAF je vhodný pro biologickou léčbu, v současné době reprezentovanou kombinací inhibitorů BRAF a MEK, ale může být i kandidátem pro imunoterapii. Co bychom tedy měli vědět o mutaci BRAF a jaký je její význam u melanomu, shrnuje následující text v 5 hlavních bodech.
prim. MUDr. Eugen Kubala
Onkologická klinika 1. LF UK a Thomayerovy nemocnice, PrahaÚvod
Před 10 lety měli pacienti s metastatickým melanomem velmi špatnou prognózu, 5letého přežití dosáhlo jen 6 % z nich a medián celkového přežití (OS) činil 7,5 měsíce. Biologická léčba a imunoterapie však prognózu těchto nemocných výrazně změnily. Pacient s prokázanou přítomností mutace BRAF je vhodný pro biologickou léčbu, v současné době reprezentovanou kombinací inhibitorů BRAF a MEK, ale může být i kandidátem pro imunoterapii. Co bychom tedy měli vědět o mutaci BRAF a jaký je její význam u melanomu, shrnuje následující text v 5 hlavních bodech.
Inzerce1. Co je to mutace BRAF a jak působí
BRAF je lidský gen, který kóduje protein nazývaný B-Raf. Gen je také označován jako protoonkogen B-Raf a V-Raf myšího sarkomového virového onkogenního homologu B. Protein je známý jako serin/threonin proteinkináza B-Raf. Mutace se vyskytuje nejčastěji u melanomu a její výskyt můžeme mapovat již od přeměny pigmentového névu v dysplastický névus, ve kterém je již tato mutace přítomna (viz obr. 1).
Obr. 1 Patogeneze melanomu je řízena genetickými mutacemi včetně mutací BRAF
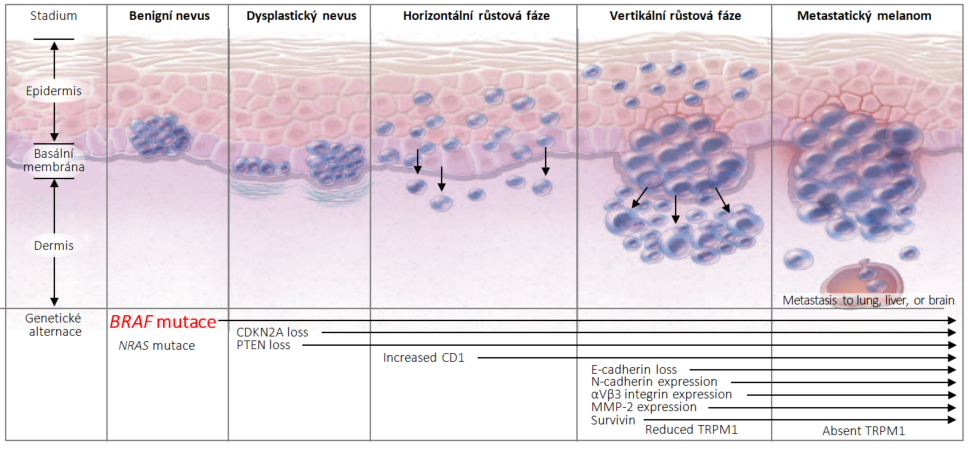
aIn the majority of cases, these mutations are non-overlapping and occur exclusively of each other.
CD1 = cluster of differentiation 1; CDKN2A = cyclin-dependent kinase inhibitor 2A; MMP-2 = matrix metalloproteinase 2; PTEN = phosphatase and tensin homolog; TRPM1 = melanocyte-specific gene melastatin 1.Na základě přítomnosti různých klíčových mutací melanomu, především mutovaných genů RAS/MAPK a jejich produktů, rozlišujeme 4 podtypy melanomu:
- BRAF-mutovaný (B-Raf proto-oncogene, serine/threonine kinase),
- NRAS-mutovaný (neuroblastoma RAS viral oncogene homolog),
- NF1-mutovaný (neurofibromin 1),
- triple wild-type melanom (NRAS/BRAF/NF1 wild type).
Mutace BRAF se nejčastěji vyskytují u melanomu, kde tvoří až 50 % ze všech přítomných mutací (1, 2). Jedná se o skupinu mutací, nejčastějším podtypem je pak mutace BRAF V600E, která tvoří 72–90 % všech mutací BRAF. Méně častá je mutace BRAF V600K, která tvoří 10–23 % všech mutací. Ostatní mutace jsou vzácné (viz tab. 1) (2–4).
Tab. 1 Nejčastější mutace BRAF u melanomu

Mutace BRAF se vyskytuje nejčastěji u mladých pacientů. Do věku 30 let se jedná o 70 %, zatímco ve věku nad 70 let pouze o 25 %. Podle lokalizace se nejčastěji vyskytuje u melanomů lokalizovaných na trupu. Z hlediska histopatologického dělení melanomu na superficiálně se šířící (SSM) a nodulární (NM) nebyl zaznamenán žádný rozdíl ve výskytu. Každý melanom s prokázanou mutací BRAF se vyznačuje vysokou mitotickou aktivitou a nacházíme ji také u melanomů, u kterých neznáme primární tumor, pouze metastázy.
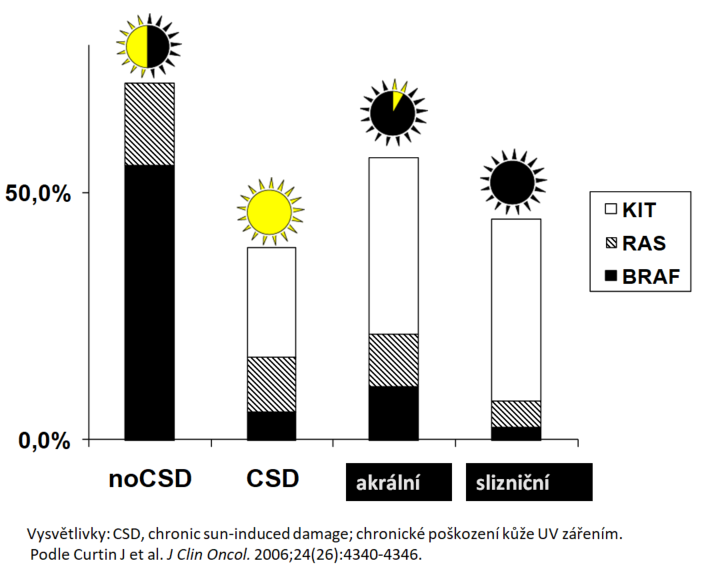
Výskyt mutace BRAF je rovněž spojen s poškozením kůže na základě intenzity a délky expozice UV záření (5). Stupeň této expozice a typ UV záření spolu s anatomickou lokalizaci melanomu považujeme za faktory, které určují charakter somatických mutací. Na základě těchto poznatků pak rozdělujeme podtypy melanomu na 4 hlavní kategorie:
- Melanom v terénu chronického poškození kůže sluncem (CSD – chronic sun-induced damage), který se v patologických vzorcích vyznačuje solární elastózou.
- Melanom bez chronického poškození sluncem (non-CSD).
- Slizniční melanom.
- Akrální melanom.
Rozdělení výskytu mutace BRAF podle těchto kategorií je znázorněno na obr. 2. Nejvyšší výskyt je zaznamenán u melanomu bez chronického poškození sluncem (non-CSD).
Obr. 2 Výskyt mutace BRAF a jednotlivé podtypy melanomu
2. Prognostický význam mutace BRAF
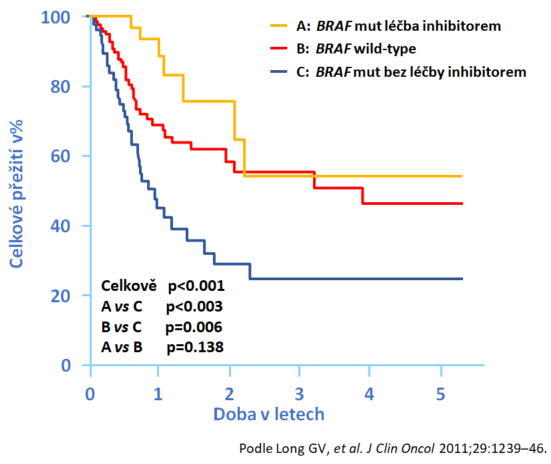
Jak ovlivňuje celkové přežití u pacientů s BRAF-mutovaným melanomem, jasně napovídá již spojení s vysokou proliferační aktivitou buněk melanomu. In vitro preklinická data jasně prokázala, že inhibice mutovaného BRAF V600E má jasný antiproliferativní účinek oproti BRAF divokého typu. Pokud není provedena inhibice, je prognóza výrazně horší než u skupiny pacientů s divokým typem, tedy nemutovanou formou BRAF (viz obr. 3). Prospektivní studie prokázaly jednoznačně negativní prognostický význam této mutace (3).
Obr. 3 Vliv mutace BRAF na celkové přežití
3. Prediktivní význam mutace BRAF
O významu mutace BRAF se vědělo již delší dobu, ale látky, které byly úspěšné jakožto inhibitory BRAF u renálního karcinomu (jako sorafenib), v této léčbě selhávaly. Až přesné odhalení a specifikování cíle pro inhibici, tedy mutace BRAF V600E a V600K, umožnilo najít inhibitor, který patologicky změněnou kinázu BRAF inhibuje. Přítomnost těchto změn je zásadní pro zahájení cílené biologické léčby. Cílem je farmakologická inhibice mitogenem aktivované proteinkinázové signální dráhy (MAPK).
Klíčovou roli v ní hraje produkt mutovaného genu – kináza BRAF V600E (6), jež je součástí signální dráhy MAPK. Ta zahrnuje kinázy RAS/RAF/MEK/ERK, které hrají důležitou roli v buněčné aktivitě u melanomových buněk (viz obr. 4). Dabrafenib a vemurafenib a encorafenib jsou reverzibilní ATP-kompetitivní inhibitory, jež selektivně inhibují mutovanou kinázu BRAFV600. Encorafenib je ATP-kompetitivní inhibitor BRAF, který je schopen blokovat několik mutovaných forem kinázy BRAF (např. V600E, V600D a V600K) v nádorových melanomových buňkách s mnohem větší účinností a až 10násobně vyšším poločasem rozpadu, tj. má o více než 30 hodin delší účinek než dabrafenib nebo vemurafenib. Umožňuje tak téměř trvalou inhibici mutované formy kinázy BRAF (7).
Obr. 4 Signální dráha RAS-RAF u melanomu
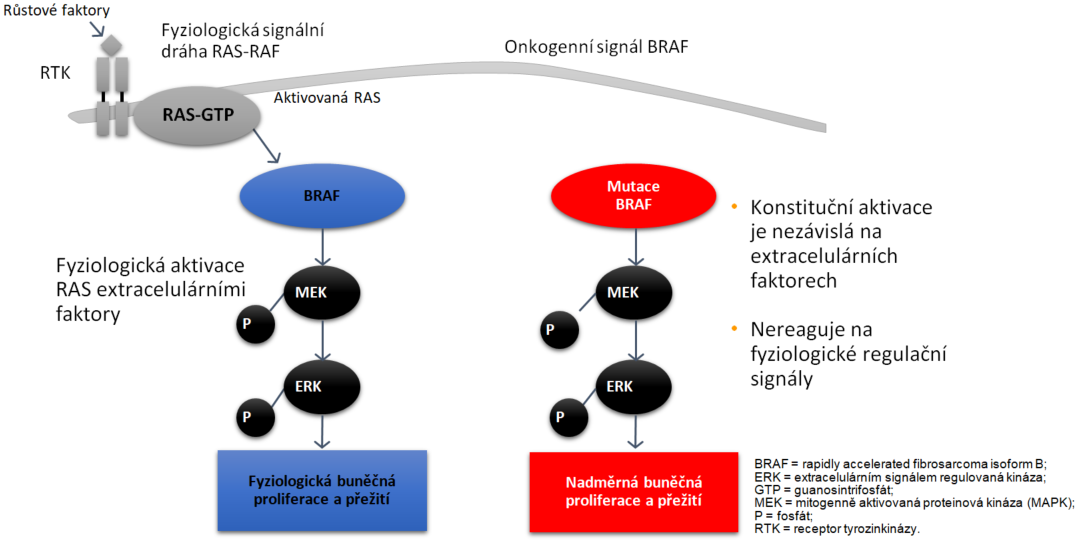
BRAF = rapidly accelerated fibrosarcoma isoform B;
ERK = extracelulárním signálem regulovaná kináza;
GTP = guanosintrifosfát;
MEK = mitogenně aktivovaná proteinová kináza (MAPK);
P = fosfát;
RTK = receptor tyrosinkinázy.Nevýhodu je, že u všech inhibitorů BRAF vzniká rezistence a také vyvolávají vnik sekundárních kožních nádorů.
4. Možnosti překonání negativního dopadu mutace BRAF
Řešením je podání inhibitorů MEK (trametinib, kobimetinib, binimetinib), jež významně oddálily vznik rezistence na inhibitory BRAF. Jedná se o perorálně dostupné non-ATP-kompetitivní alosterické inhibitory MEK1 a MEK2. Díky této kombinaci bylo dosaženo významného prodloužení blokády MAPK v melanomových buňkách.
Klinickým výsledkem této blokády je zásadní prodloužení doby do progrese (PFS) a celkového přežití (OS) u pacientů s metastatickým melanomem. Duální blokáda se vyznačuje velmi rychlým navozením celkové odpovědi až v 70 % případů, ale velkou nevýhodou je vznik rezistence prakticky u 100 % pacientů.
Dosud byly publikovány 4 velké randomizované studie fáze III – Combi-v (8), Combi-d (9), coBRIM (10) a COLUMBUS (11) – hodnotící nadřazenost kombinované inhibice BRAF a MEK oproti samotné inhibici BRAF. Duální blokáda je považována za standardní léčbu. Zůstává potřeba zodpovědět, která z dvojic inhibitorů BRAF a MEK je efektivnější. Nejdůležitějším úkolem je pak určit skupinu pacientů, jež bude mít z dané léčby největší prospěch (obr. 5 a tab. 2).
Obr. 5 Studie zkoumající účinnost monoterapie a duální blokády u BRAF-mutovaného melanomu
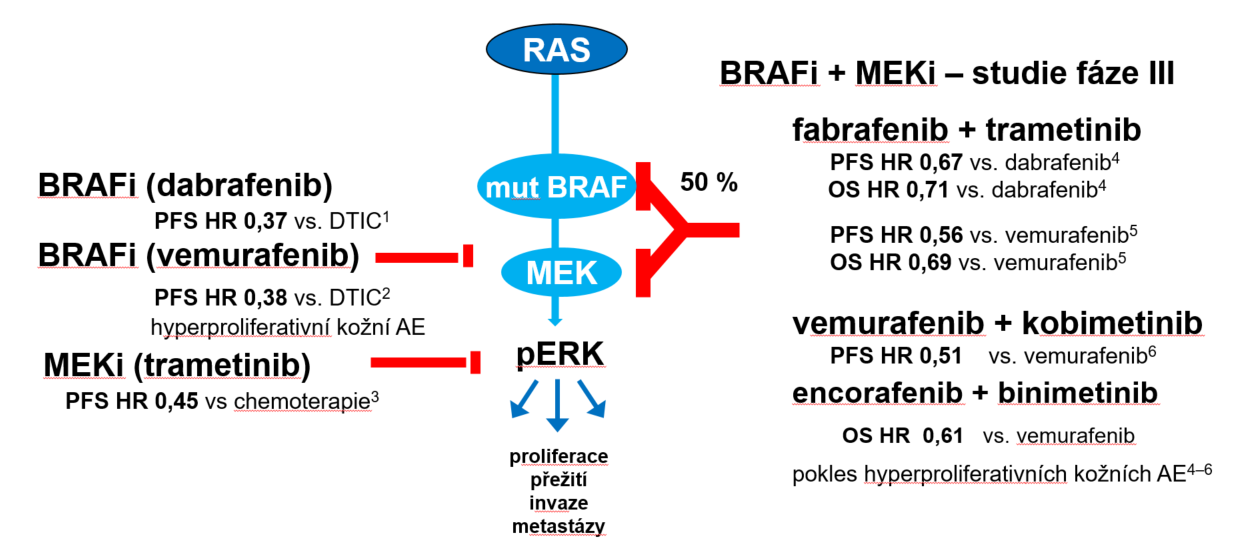
AE = nežádoucí příhoda; BRAF = B-Raf murine sarcoma viral oncogene homolog B; BRAFi = inhibitor BRAF; DTIC = dakarbazin; HR = poměr rizik; MEK = mitogenem aktivovaná proteinkináza; MEKi = inhibitor MEK; OS = celkové přežití; pERK = phospho-extracellular signal-regulated kinase; PFS = přežití bez progrese onemocnění.
Tab. 2 Odpovědi na léčbu BRAFi + MEKi
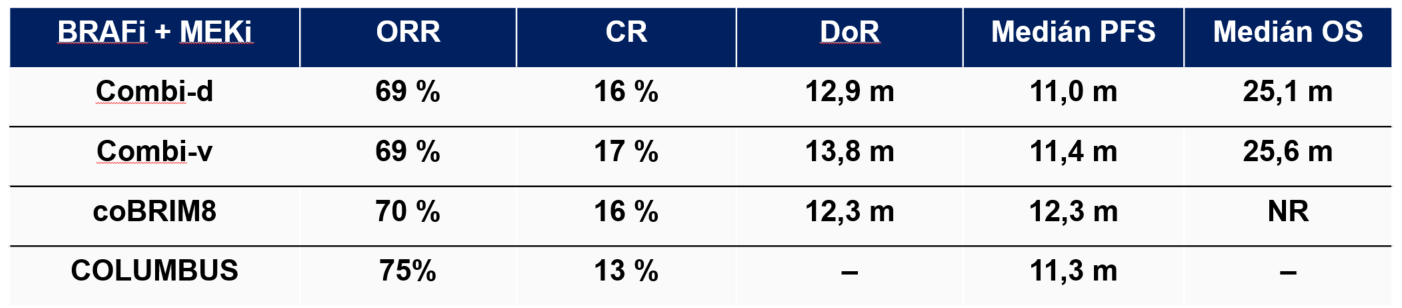
BRAFi = inhibitor BRAF; MEKi = inhibitor MEK; ORR = léčebná odpověď; CR = kompletní odpověď; DoR = trvání odpovědi; PFS = přežití bez progrese onemocnění; OS = celkové přežití; m = měsíc; NR = nedosaženo
Podle: Curtin J et al. J Clin Oncol 2006; 24 (26): 4340–4346.5. Vztah mutací BRAF a imunitního stavu
Mutace v nádorových buňkách přímo ovlivňují vrozenou imunitní odpověď. Mutace BRAF v nádorové buňce: vyvolává produkci prozánětlivých cytokinů: VEGF, IL-10, IL-6. Potlačuje tvorbu antitumorózních cytokínů IL-2 a podporuje produkci interleukinů IL-1α a IL-1β (vrozených zánětlivých mediátorů), jež ochrání nádorové buňky před cytotoxickými lymfocyty (12). Ovlivňuje mikroprostředí tumoru tím, že podporuje zvýšenou infiltraci nádoru myeloidními supresorovými buňkami (MDSC) a T-regulačními lymfocyty (Treg) v mikroprostředí nádorů.
Přítomnost mutace BRAF snižuje expresi hlavního histokompatibilního komplexu (MHC) I. třídy jeho zvýšenou internalizací a sekvestrací uvnitř buňky a tím blokují rozpoznávání antigenů T lymfocyty ve spolupráci s molekulami MHC. Bez přítomnosti MHC-I T lymfocyty neumějí rozpoznávat antigeny.
Výsledkem komplexního působení mutace BRAF je navození imunitního supresivního fenotypu, který je charakterizovaný přítomností inhibičních imunitních buněk, jako jsou regulační T buňky, myeloidní supresorové buňky nebo s nádorem asociované makrofágy (TAMs). Ty mohou inhibovat funkci tumor infiltrujících lymfocytů.
Závěr
Mutace BRAF je významným prognostickým faktorem a prediktorem pro cílenou léčbu u pacientů s melanomem. Rezistenci na léčbu lze překonat kombinací s dalšími inhibitory – MEKi, MAPKi. Mutace BRAF má přímý vliv a imunitní stav melanomu ovlivňuje jeho mikroprostředí. Rozpoznání mechanismů ovlivnění imunitního mikroprostředí nádoru umožní kombinaci MAPKi a imunoterapie.
Literatura:
- Sullivan RJ (ed.). BRAF Targets in Melanoma: Biological Mechanisms, Resistance, and Drug Discovery. Springer, New York, 2015.
- Jakob JA et al. Cancer 2012; 118 : 4014–4023.
- Long GV et al. J Clin Oncol 2011; 29 : 1239–1246.
- Hauschild A et al. Lancet 2012; 380 : 358–365.
- Curtin J et al. J Clin Oncol 2006; 24 (26): 4340–4346.
- Haluska FG et al. Clin Cancer Res 2006; 12 : 2301–2307.
- Delord JP et al. Clin Cancer Res 2017; 23 : 5339–5348.
- Robert C et al. N Engl J Med 2015; 372 : 30–39.
- Long GV et al. J Clin Oncol 2015; 33 (Suppl.): abstr. 102.
- Ascierto PA et al. Lancet Oncol 2016; 17 (9): 1248–1260.
- Dummer R et al. Lancet Oncol 2018; 19 (5): 603–615.
- Harris TJ et al. J Immunother Cancer2013; 1 : 12.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Dermatologie Dětská dermatologie Dětská onkologie Onkologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




