-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaZkušenosti se zvládáním nežádoucích účinků imunoterapie jaterní selhání po jediné dávce Nivolumabu
27. 8. 2020
Úvod
Moderní imunoterapie založená na protilátkách proti kontrolním bodům imunitní reakce (tzv. checkpoint inhibitory) znamenala revoluci v terapii mnohých nádorů včetně maligního melanomu. Dnes stále více používaná anti PD-1 protilátka Nivolumab dosáhla dlouhodobé objektivní odpovědi u mnohých nádorů včetně maligního melanomu. Nová léčba s sebou přináší nejenom revoluční výsledky, ale i zcela nové nežádoucí účinky. V následujícím sdělení bude popsán případ pacientky léčené anti PD-1 protilátkou, u které se objevila imunitně podmíněná hepatitida grade 4 po jediné dávce Nivolumabu.
Kazuistika
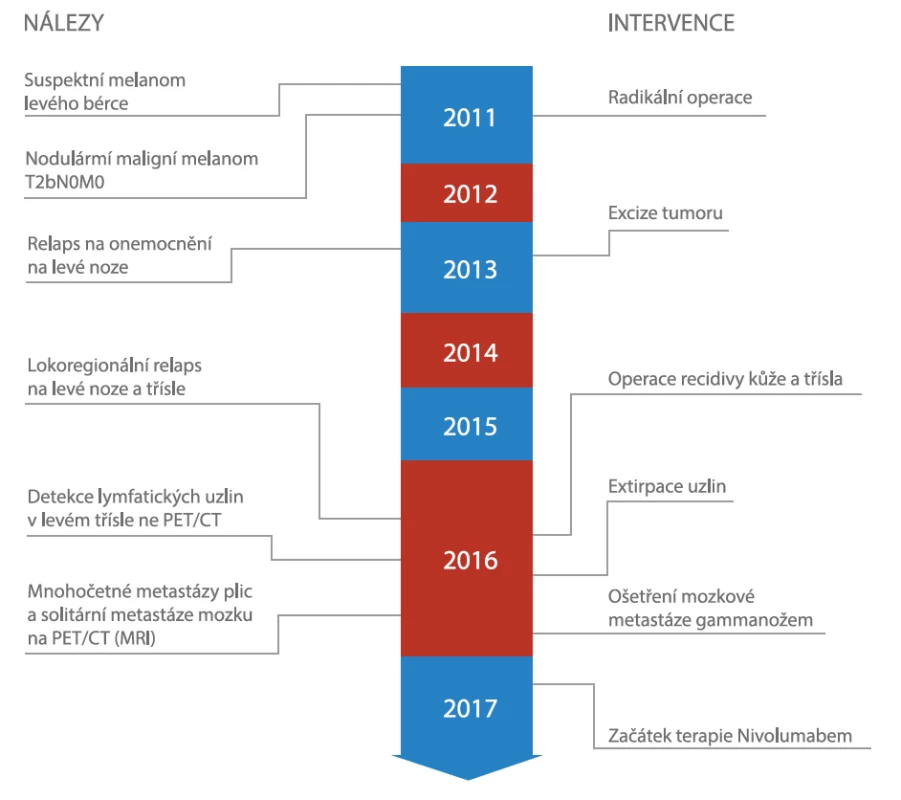
38letá pacientka léčená pro metastazující maligní melanom levého bérce od roku 2011 (viz obrázek č. 1) byla přijata na naše pracoviště 14 dní po aplikaci první dávky Nivolumabu (3 mg/kg). Pacientka před zahájením terapie nevykazovala známky jaterního onemocnění, elevace jaterních enzymů nebo jiná autoimunitní onemocnění. Rodinná anamnéza byla z pohledu autoimunitních a nádorových onemocnění nevýznamná.
InzerceOkamžitě při příjmu bylo zahájeno vyšetřování v rámci diferenciální diagnostiky jaterní léze ve spolupráci s hepatologem. Pacientka popírala užívání drog, alkoholu nebo potravinových doplňků. Chronicky neužívala žádné hepatotoxické léky kromě 1500 mg/den Levetiracetamu nasazeného jako profylaxe sekundární epilepsie. Vzhledem k popsaným případům jaterního selhaní po Levetiracetamu byla pacientka dle doporučení neurologa postupně převáděna na Lamotrigin. Po vysazení Levetiracemu nedošlo ke zlepšení jaterních funkcí, a proto byl Levetiracetam vyloučen jako příčina jaterního onemocnění. K vyloučení strukturálního onemocnění jsme provedli ultrazvukové vyšetření břicha, kde byla popsána incipientní steatóza jater, žlučové cesty byly bez dilatace, jaterní parenchym bez ložiskového postižení. Testovaný panel virových infekcí (HIV, CMV, EBR, HSV-1, HSV-2, HAV, HBV, HCV, HEV) byl negativní. Normální hladina železa a mědi v séru vyloučila metabolické střádavé onemocnění. Vzhledem k věku pacientky jsme provedli screening na autoimunitní onemocnění jater, panel protilátek (ANCA, AMA, ANA, SMA, anti-LKM, anti-SLA, anti-LC-1, revmatoidní faktor) byl zcela v normě. Diagnózu imunitně podmíněné hepatitidy po anti PD-1 terapii jsme ještě konfirmovali provedením necílené jaterní biopsie. V histopatologickém nálezu byl obraz smíšeného zánětu s nevýraznou příměsí eosinofilních a granulofilních neutrofilů. Dominantním nálezem byla nápadná a převážně intracelulární cholestáza.
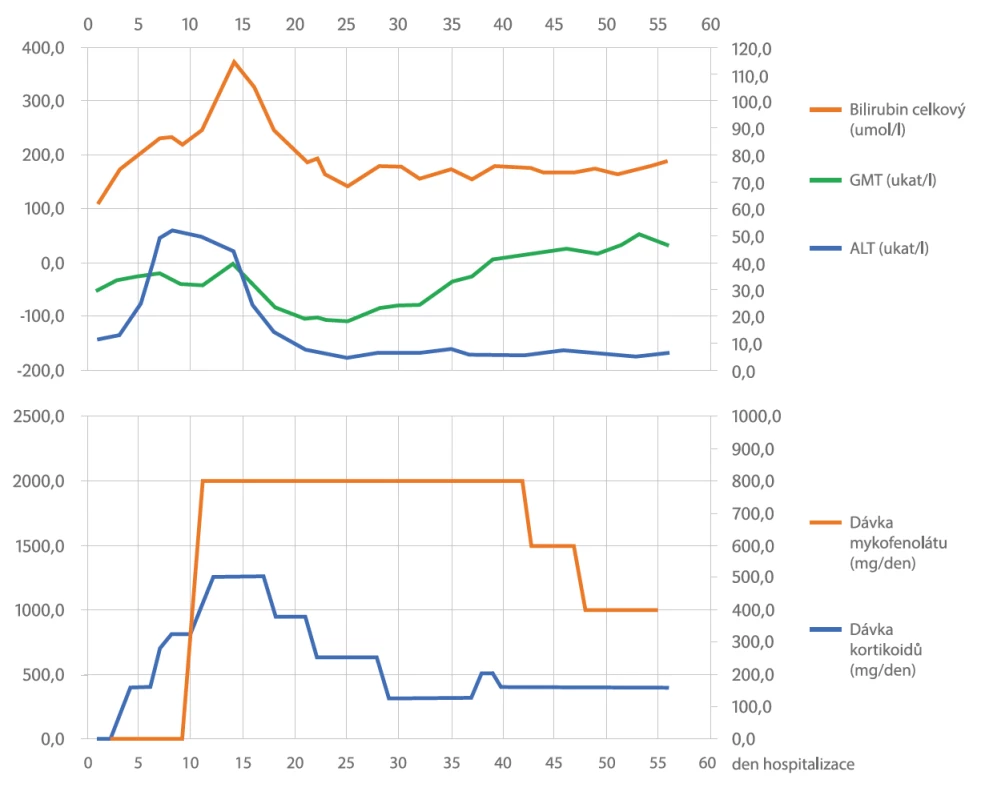
Terapie Nivolumabem byla přerušena a třetí den hospitalizace jsme zahájili léčbu methylprednisolonem i.v. 2 mg/kg/den. Vzhledem k tomu, že se laboratorní a klinické příznaky nezlepšily během týdne léčby, zvýšili jsme dávku methylprednisolonu na 4 mg/kg/den a později až na 6 mg/ kg/den. Z důvodu dalšího zhoršování laboratorních testů bez dostatečné odpovědi na kortikoterapii jsme dle doporučení managementu nežádoucích účinků imunoterapie nasadili nesteroidní imunosupresivum mykofenolát mofetil v dávce 2000 mg/den. Dle doporučení hepatologa byla do terapie přidána kyselina ursodeoxycholová v dávce 1500 mg/den. Během celé doby imunosupresivní terapie byla pacientka zajištěna antibiotickou a antiulcerózní profylaxí. Po zahájení kombinované imunosupresivní terapie došlo k rychlé reparaci jaterních testů (viz obrázek č. 2) s možností pomalého vysazování dávky i za účelem minimalizace nežádoucích účinků kortikoidů. Avšak po předchozím zlepšení jaterních funkcí došlo opět k postupnému zhoršování hepatogramu s predominancí enzymu GMT. Souběžně se zhoršením laboratorních testů došlo i k deterioraci výkonnostního stavu pacientky. Z těchto důvodů jsme provedli restagingové CT trupu a MR mozku. MR mozku ukázalo stacionární solitární ložisko po ošetření gammanožem, avšak na CT trupu byla nepochybná progrese velikosti i počtu metastatických ložisek plic a nově mnohočetné postižení jater a jedno metastatické ložisko v nadledvině. Nové nálezy na CT trupu a nepříznivá prognóza byla důkladně projednána s pacientkou a její rodinou s cílem poskytnutí nejlepší podpůrné péče. Pacientka zemřela 74 dní po první dávce Nivolumabu v důsledku progrese nádoru.
Závěr
I když střední doba nástupu jaterní toxicity po Nivolumabu je 7 týdnů, jak ukazuje naše kazuistika, je nutné myslet na imunitně podmíněné nežádoucí účinky i po prvním podání imunoterapie.
Jako u všech imunitně podmíněných nežádoucích účinků je diagnostika založena na principu „per exclusionem“. Vzhledem k široké diferenciální diagnostice jaterních onemocnění je vhodné stanovovat diagnosu ve spolupráci s dalšími specialisty (hepatolog, patolog a radiolog).
U prezentované pacientky nebyla odpověď na kortikoterapii dostatečná. V takových případech je nutné eskalovat imunosupresivní terapii, jako např. mykofenolát mofetil nebo infliximab, pokud není přítomno jaterní postižení.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Dětská onkologie Onkologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání