-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNádorová duplicita
16. 9. 2020
Kazuistika popisuje případ 70leté pacientky, bývalé kuřačky – maximálně 10 cigaret denně po dobu 30 let. V produktivním věku pacientka pracovala jako prodavačka. Pacientka je sledována pro arteriální hypertenzi, hyperlipidemii a diabetes mellitus 2. typu na PAD. V roce 1987 pacientka podstoupila endoskopickou polypektomii tlustého střeva a v roce 2005 hysteroskopii se snesením benigního polypu z děložní dutiny a děložního čípku.
Popis případu
Kazuistika popisuje případ 70leté pacientky, bývalé kuřačky – maximálně 10 cigaret denně po dobu 30 let. V produktivním věku pacientka pracovala jako prodavačka. Pacientka je sledována pro arteriální hypertenzi, hyperlipidemii a diabetes mellitus 2. typu na PAD. V roce 1987 pacientka podstoupila endoskopickou polypektomii tlustého střeva a v roce 2005 hysteroskopii se snesením benigního polypu z děložní dutiny a děložního čípku.
V roce 2005 si pacientka při samovyšetření prsů nahmatala bulku na hranici horních kvadrantů levého prsu. V core-cut biopsii z prsní rezistence byl prokázán nízce až středně diferencovaný invazivní duktální karcinom s pozitivní expresí hormonálních receptorů (ER 90 %, PR 80 %). Vzhledem k rozsahu nádorového ložiska na vstupní mamografii a nejednoznačnému postižení jedné lymfatické uzliny v levé axile (T2N1) bylo přistoupeno k podání neoadjuvantní sekvenční chemoterapie ve složení 4 cykly adriamycin + cyklofosfamid, 4 cykly docetaxel. Poté byla provedena ablace levé mammy s exenterací levé axily. V resekátu byl zastižen středně diferencovaný invazivní duktální karcinom s pozitivními hormonálními receptory (ER 100 %, PR 75 %), s nízkou proliferační aktivitou (MIB1 5 %) a negativitou HER2, staging pT2 (velikost tumoru 3×2×2 cm) pN0 (16/0+). Hormonoterapie tamoxifenem byla zahájena adjuvantně.
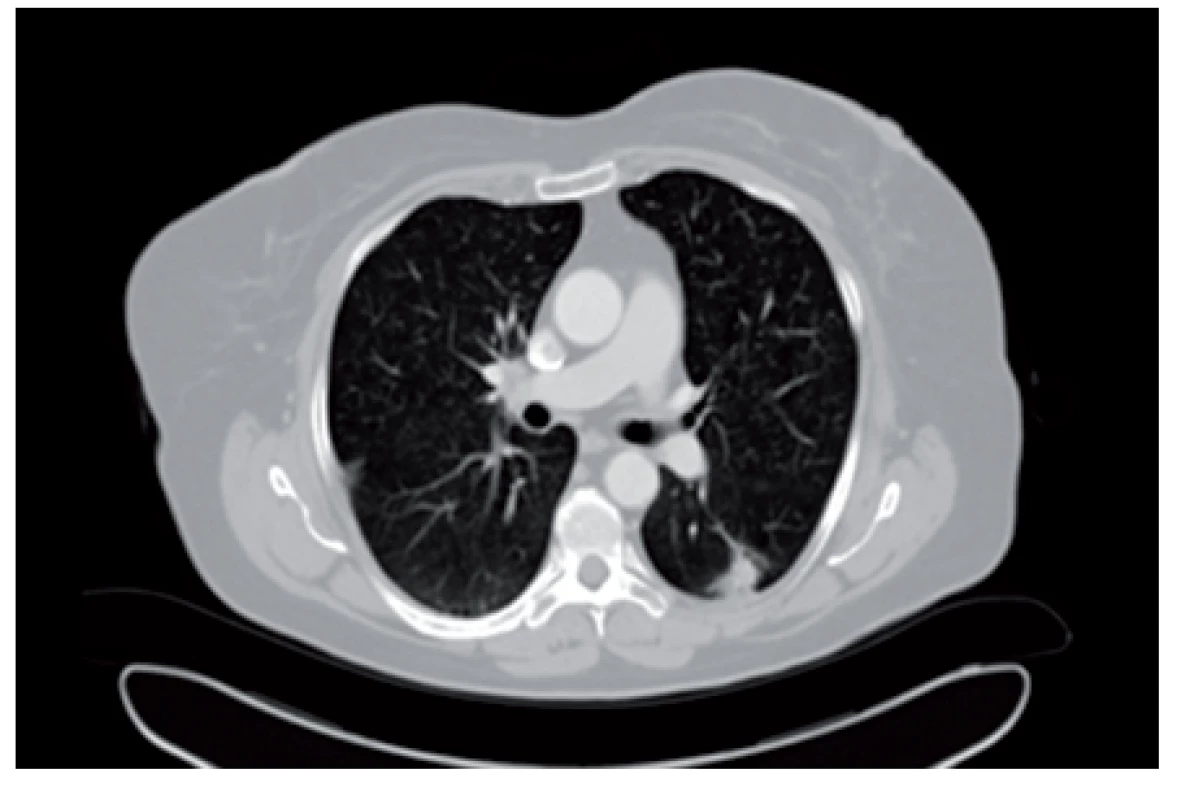
InzerceV rámci stagingových vyšetření v roce 2005 byl proveden skiagram hrudníku, na kterém bylo zobrazeno ložisko v levém dolním plicním poli. Doplněné CT trupu potvrdilo přítomnost cípatého ložiska velikosti 15 mm subpleurálně v apikálním segmentu levého dolního plicního laloku (S6) (obr. 1) a dále byla zachycena nejasná patologie v obratli L4. Scintigrafie kostí neprokázala zvýšenou kumulaci radiofarmaka v popisovaném bederním obratli. Bronchoskopické biopsii nebylo ložisko přístupné, provedený výplach z S6 byl bez nálezu nádorových buněk. Oba výše uvedené nálezy byly dále sledovány v rámci pravidelných zobrazovacích kontrol.
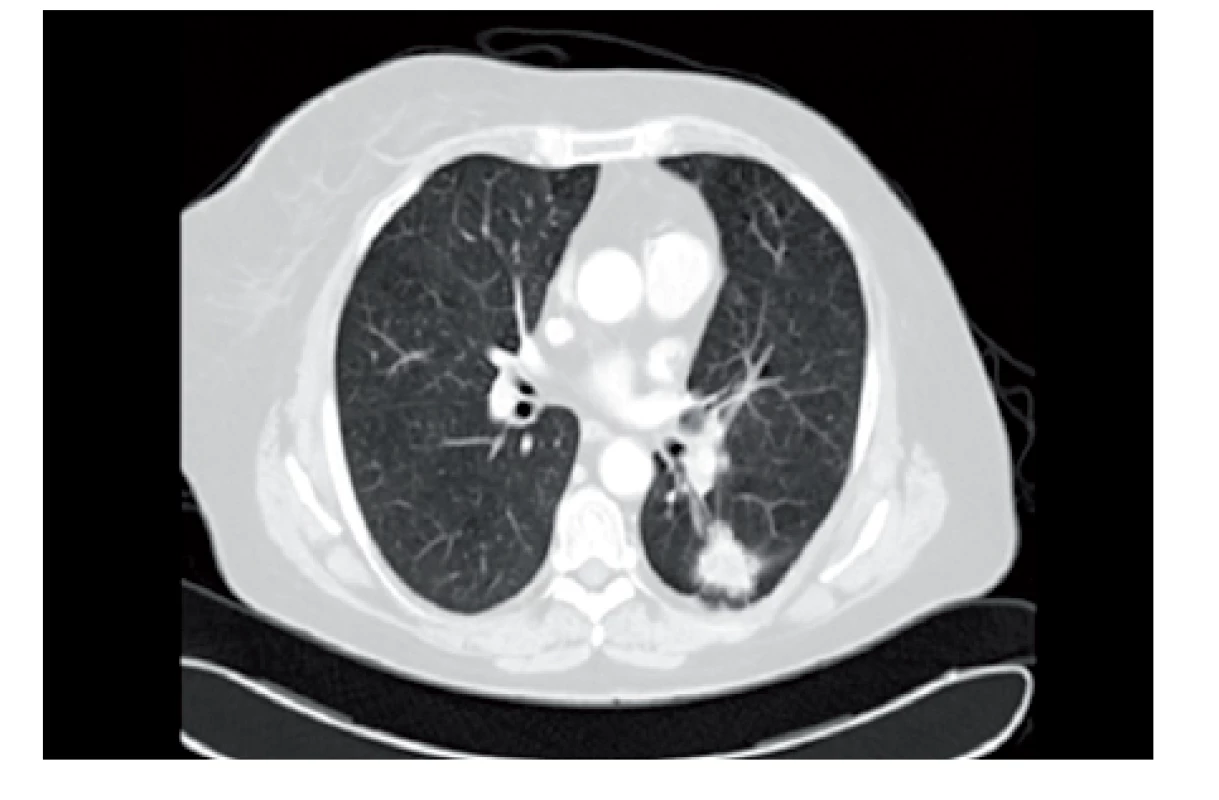
V říjnu 2008 byla na CT trupu zaznamenána progrese velikosti plicního ložiska – 27×20 mm (obr. 2). PET/CT v prosinci 2008 prokázalo vysoce FDG avidní korelát v dané oblasti a současně dvě FDG avidní ipsilaterální mediastinální lymfatické uzliny velikosti 15 mm. Pro subpleurální lokalizaci plicního nálezu byla indikována transparietální biopsie pod CT kontrolou. Cytologickým hodnocením bioptovaného vzorku byla nalezena nádorová tkáň adenokarcinomu, částečně tvořeného cylindrickými buňkami. Imunocytochemickým vyšetřením byla prokázala pozitivita TTF-1. BRST2 stejně jako estrogenové a progesteronové receptory byly negativní. Imunocytochemické vyšetření tedy podporovalo diagnózu primárního plicního adenokarcinomu.
Na multioborovém indikačním semináři bylo rozhodnuto o levostranné dolní lobektomii se samplingem mediastinálních uzlin. Operace byla realizována dne 10. 2. 2009. Během operace byly kromě očekávaného tumoru v S6 levé plíce překvapivým nálezem splývající objemné lymfatické uzliny nad kmenem pulmonální artérie pokračující subpleurálně do horního laloku, dále objemné tuhé hmoty pod obloukem aorty a nádorová infiltrace napříč obloukem aorty. Pro tento nečekaný nález rozsáhlé ipsilaterální mediastinální lymfadenopatie byla provedena pouze resekce tumoru v S6 levé plíce a excize z mediastinálních lymfatických uzlin k určení nádorového původu. Tedy nekurativní výkon. Histologicky byla v plicním resekátu zachycena plicní tkáň infiltrovaná adenokarcinomem různé histologické úpravy (struktury tubulární, papilární, solidní, v některých úsecích bronchioloalveolární ca). V excizi mediastinální infiltrace byla nalezena fibrotizovaná kulatobuněčně celulizovaná tkáň, v které již nebyla zachovalá architektonika lymfatické uzliny, nádorové struktury nebyly zde zachyceny. Staging nemalobuněčného bronchogenního adenokarcinomu byl uzavřen jako pT3 N2 bulky (PET/CT avidní nález a zejména makroskopický nález během operace) M0, klinické stadium IIIA a byla indikována chemoterapie I. linie (4 cykly cisplatina + gemcitabine). PET/CT v září 2009 neprokázalo nádorovou aktivitu. Vzhledem k neradikalitě operace nelze brát danou chemoterapii za adjuvantní, nýbrž za paliativní.
Na zobrazovacích vyšetřeních, prováděných následně v období 2/2010 – 3/2011 byla pozorována nepatrná progrese mediastinální lymfadenopatie (pretrachealní LU, pravostranné hilové LU), bez přítomností metastáz v jiných lokalitách. Jednalo se o progresi velikosti lymfatických uzlin v řádu několika milimetrů, tedy byl zvolen postup dispenzarizace. V dubnu 2011 však pro významnou elevaci onkomarkerů (CEA, CYFRA 21.1) byla i přes EGFR negativitu zahájena II. linie – terapie erlotinibem v rámci specifického léčebného programu.
Po 3 měsících biologické léčby však pro PET/CT zobrazenou nádorovou progresi (patologická drobná ložiska v pravé plíci, plicní ložisko při dolním pólu levého plicního hilu, progrese bilaterální mediastinální lymfadenopatie, pravostranná krční lymfadenopatie, nápadná oboustranná nadklíčková lymfadenopatie, zvýšená akumulace FDG ve ventrální části I. žebra vlevo) byla indikována III. linie pemetrexed v monoterapii s dosažením parciální remise. Pemetrexed byl podáván do dubna 2013, kdy byla vzhledem k opětovnému vzestupu onkomarkerů (CEA, CYFRA 21.1) a potvrzené nádorové progresi s nově prokázaným metastatickým postižením jater na CT indikována IV. linie docetaxel beweekly, vedoucí ke stabilizaci nádorového onemocnění. Následně byla pacientka po dobu 21 měsíců bez systémové onkologické léčby, pouze dispenzarizována a kontrolována zobrazovacími metodami.
V lednu 2016 byla na PET/CT zachycena opětovná nádorová progrese (progrese velikosti i počtu jaterních metastáz, nově podbrániční a retroperitoneální lymfadenopatie) a byla zahájena V. linie nivolumab v monoterapii v rámci specifického léčebného programu. Současně byla pro elevaci onkomarkeru Ca 15–3 indikována hormonoterapie fulvestrant. Rebiopsie se stanovením exprese PD-L1 nebyla provedena. Při imunoterapii bylo dosaženo nejvýše parciální remise. Imunoterapie byla pacientkou velmi dobře tolerována. Z nežádoucích účinků dominoval nečetný průjem s frekvencí maximálně 4× týdně a symptomatická hypotyreóza G2 korigována přidáním levothyroxinu do medikace. Po dvou letech byla terapie nivolumabem v rámci specifického léčebného programu ukončena. Nyní je pacientka bez onkologické léčby, dispenzarizována. Na kontrolním CT z března 2018 trvá léčebná odpověď – dosaženo další parciální regrese jaterních metastáz.
Diskuze
N2 onemocnění tvoří heterogenní skupinu zahrnující neočekávané, tzv. „překvapivé“ postižení N2 uzlin zjištěné při operaci, intranodální či extrakapsulární postižení lymfatických uzlin, jedno nebo víceetážové postižení N2 uzlin po tzv. bulky N2 uzliny.1 Přes podrobný předoperační staging se zjištěny pozitivní ipsilaterální mediastinální uzliny.2 Nutno zdůraznit, že neexistuje jednotná a odbornou veřejností široce akceptovaná definice potencionálně resekabilních N2 uzlin.3 Obecně je chirurgická terapie indikována u stadia IIIA tam, kde lze očekávat dosažení kompletní resekce (R0 resekce) a je-li postižena pouze jedna anatomická skupina ipsilaterálních LU, bez extrakapsulárního postižení.4
Z podané systémové onkologické léčby pouze terapie erlotinibem nevedla k léčebné odpovědi. Dle současně platných doporučení je léčba erlotinibem přípustná i v léčbě lokálně pokročilého nebo generalizovaného nemalobuněčného adenokarcinomu s negativní mutací EGFR po selhání 1. linie chemoterapie.5 Daná indikace vzešla na základě výsledků studie BR.21 (randomizovaná, placebem kontrolovaná klinická studie fáze III, lokálně pokročilý nebo generalizovaný NSCLC po selhání alespoň 1 chemoterapeutického režimu, randomizace 2 : 1 – erlotinib 150 mg 1× denně versus placebo, medián celkové doby přežití 6,7 měsíců ve skupině s erlotinibem versus 4,7 měsíců ve skupině s placebem, medián doby bez známek progrese (PFS) 2,2 měsíce × 1,8 měsíce).5, 6 Hypotyreóza patří mezi nejčastější imunoterapií indukované endokrinopatie. Četnost hypotyreózy se u pacientů léčených nivolumabem, pembrolizumabem nebo atezolizumabem pohybuje v rozmezí 3,8 – 13,2 %, při kombinaci nivolumab + ipilimumab až 20 %.7,8
Hypertyreóza podmíněná imunoterapií se vyskytuje s nižší frekvencí.7 V patogenezi tyreoidální dysfunkce se uplatňuje PD-1/PD-L1 protilátkou nebo CTLA-4 protilátkou zapříčiněná, vystupňovaná, T lymfocyty mediovaná imunitní reakce namířená proti vlastním antigenům štítné žlázy. Ve studiích s checkpoint inhibitory byly detekovány protilátky proti tyreoglobulinu a tyreoidální peroxidáze.9 Před zahájením imunoterapie je nutné stanovit profil hormonů štítné žlázy (TSH, fT4) a doporučují se i antityreoidální protilátky, při léčbě poté monitoring TSH a fT4 jedenkrát měsíčně.10 Klinická manifestace primární hypotyreózy zahrnuje únavu, zimomřivost, obezitu, myxedém, zácpu, snížení tepové frekvence a srdeční kontraktility a neuropsychiatrické příznaky (svalová slabost, parestézie, zpomalené psychomotorické tempo, deprese) s elevací koncentrace TSH a naopak snížením fT4. V případě snížené koncentrace fT4 a současně nezvýšené TSH (normální nebo snížené) se jedná o sekundární hypotyreózu při hypofyzitidě. Management terapie probíhá v součinnosti s endokrinologem a odvíjí se od stupně závažnosti (viz tabulka 1).10 Zahrnuje dispenzarizaci při subklinické hypotyreóze, substituci levothyroxinem (0,5 – 1 mg/kg/den) při symptomatické hypotyreóze a od toxicity stupně 3 přerušení imunoterapie a glukokortikoidy (prednison 0,5–1 mg/kg/den). Klinický obraz hypertyreózy čítá hubnutí, zvýšené pocení, PM neklid, agitovanost, nespavost, průjmy, supraventrikulární arytmie, exoftalmus. Terapie hypertyreózy zahrnuje tyreostatika, beta blokátory a glukokortikoidy.10
Tab. 1. Hypotyreóza – stupeň toxicity dle NCI CTCAE
(National Cancer Institute Common Terminology Criteria for Adverse Events), verze 4.03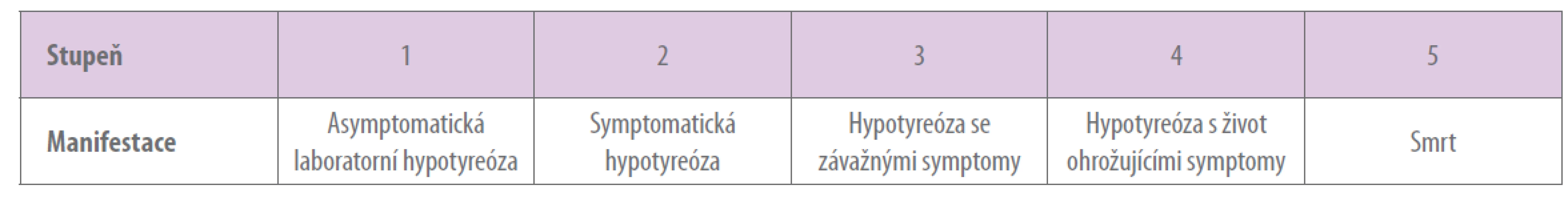
Reference
1. Vansteenkiste J, Crino L, Dooms C, Douillard JY, Faivre-Finn C, Lim E, et al. 2nd ESMO Consensus Conference on Lung Cancer: early-stage non-small-cell lung cancer consensus on diagnosis, treatment and follow-up. Ann Oncol (2014) 25(8):1462–74.10.1093/annonc/mdu089
2. Al-Sarraf N, Aziz R, Gately K, Lucey J, Wilson L, McGovern E, Young V. Pattern and predictors of occult mediastinal lymph node involvement in non-small cell lung cancer patients with negative mediastinal uptake on positron emission tomography. Eur J Cardiothorac Surg. 2008 Jan; 33(1):104-9.
3. Van Schil PE, Berzenji L, Yogeswaran SK, Hendriks JM, Lauwers P. Surgical Management of Stage IIIA Non-Small Cell Lung Cancer. Frontiers in Oncology. 2017;7 : 249. doi:10.3389/ fonc.2017.00249.
4. Baltayiannis N, Chandrinos M, Anagnostopoulos D, et al. Lung cancer surgery: an up to date. Journal of Thoracic Disease. 2013;5(Suppl 4):S425-S439. doi:10.3978/j.issn.2072 - 1439.2013.09.17.
5. http://www.sukl.cz/modules/medication/detail.php?code=0172941&tab=texts
6. Shepherd FA, Rodrigues Pereira J, Ciuleanu T, Tan EH, Hirsh V, Thongprasert S, Campos D, Maoleekoonpiroj S, Smylie M, Martins R, et al. Erlotinib in previously treated non–small-cell lung cancer. N Engl J Med. 2005;353 : 123–32.
7. Barroso-Sousa R, Barry WT, Garrido-Castro AC, et al. Incidence of Endocrine Dysfunction Following the Use of Different Immune Checkpoint Inhibitor Regimens: A Systematic Review and Meta-analysis. JAMA Oncol 2018; 4 : 173.
8. Larkin J, Chiarion Sileni V, Gonzalez R et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373 : 23–34.
9. Osorio JC, Ni A, Chaft JE et al. Antibody-mediated thyroid dysfunction during T-cell checkpoint blockade in patients with non-small-cell lung cancer. Ann Oncol 2017; 28 : 583–589.
10. https://www.eortc.be/services/doc/ctc/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf
MUDr. Petra Zemanová
I. klinika tuberkulózy a respiračních nemocí, VFN Praha
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Dětská onkologie Onkologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání