-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Lorlatinib jako možnost cílené léčby pokročilého NSCLC s rezistencí na TKI 1. a 2. generace – kazuistika
1. 7. 2021
Příchod inhibitorů tyrosinkináz (TKI) znamenal významný posun u pacientů s pokročilým nemalobuněčným karcinomem plic (NSCLC). Při jejich podávání je ovšem nutné počítat s nástupem rezistence, proto jsou vyvíjeny přípravky vyšších generací. Mezi ně patří také lorlatinib, jenž byl v květnu 2019 schválen Evropskou lékovou agenturou (EMA) k léčbě dospělých pacientů s pokročilým NSCLC v přesně stanovených indikacích.
Úvod
Cílená léčba pomocí TKI výrazně zlepšuje výsledky u těch pacientů s pokročilým NSCLC, u nichž byly prokázány genetické změny, které predikují účinnost této terapie. V Česku se v současné době reflexně testují mutace genu pro receptor epidermálního růstového faktoru (EGFR) a přestavba genů ALK a ROS1, především pak u neskvamózního NSCLC.
Přestavba genu ALK se vyskytuje poměrně vzácně, asi v 4–5 % případů NSCLC. Nejčastěji se jedná o pacienty s adenokarcinomem, nekuřáky nebo slabé kuřáky, mladší pacienty, s mírnou převahou žen. Přestavba genu ROS1 se vyskytuje u podobné skupiny pacientů a ještě vzácněji, odhaduje se na 1–2 % případů NSCLC. Až u 40 % pacientů s NSCLC s pozitivitou ALK a ROS1 nacházíme již při stanovení diagnózy metastázy v mozku, u zbývající skupiny často dochází k progresi do CNS v dalším průběhu onemocnění.
InzerceRezistence na TKI při pokročilém NSCLC
Inhibitor ALK/ROS1 první generace krizotinib sice změnil léčebné schéma u ALK - a ROS1-pozitivních pacientů s pokročilým NSCLC, ovšem v důsledku vzniku rezistence a také jeho omezeného průniku do CNS musíme po iniciální odpovědi počítat s progresí onemocnění. Rezistence se vytváří i při léčbě 2. generací inhibitorů ALK.
Na vzniku rezistence se podílí řada mechanismů, včetně rezistentních mutací. V analýze biopsií nádoru pacientů ALK+, u kterých došlo k progresi, byly rezistentní mutace ALK nalezeny v 56 % případů (u ceritinibu v 54 %, alektinibu v 53 % a brigatinibu v 71 %). Na každý inhibitor ALK bylo rezistentní jiné spektrum mutací ALK, což pravděpodobně odráží rozdíly ve struktuře mezi jednotlivými přípravky (viz obr. 1)
Obr. 1. Přehled ALK-rezistentních mutací 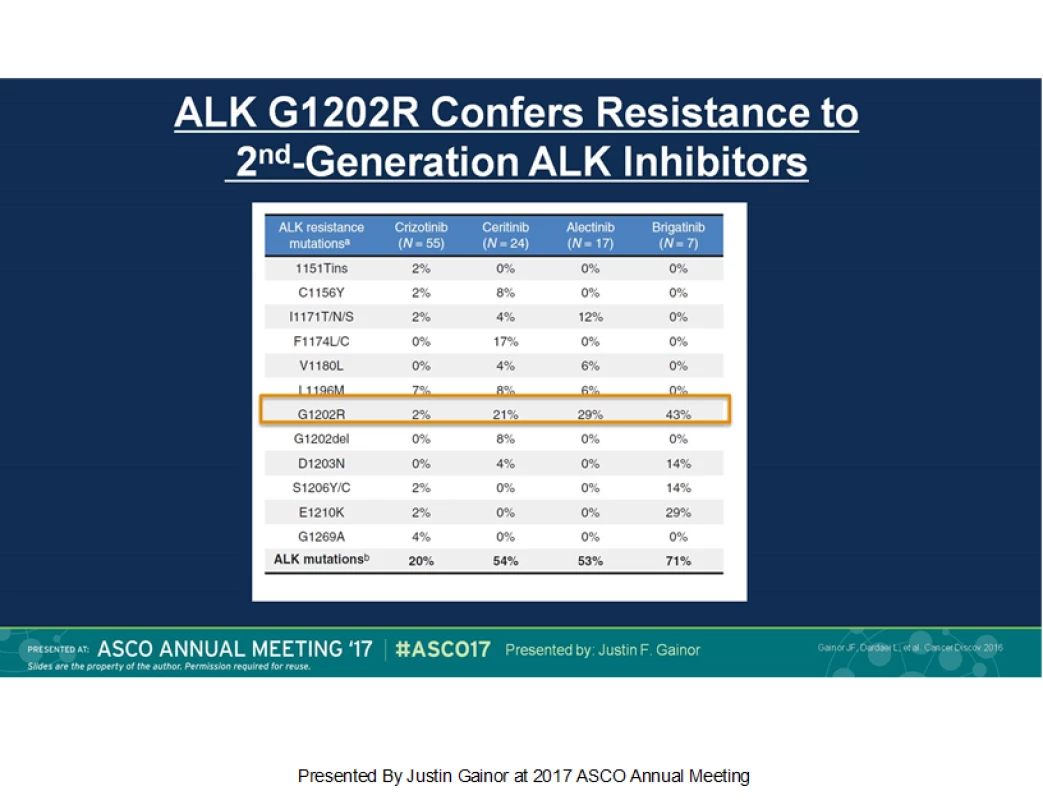
Lorlatinib a jeho výsledky ve studiích
Lorlatinib (Lorviqua) je selektivní TKI 3. generace, který působí kompetitivně ve vazebných místech tyrosinkináz ALK a ROS1 pro adenosintrifosfát (ATP). V květnu 2019 jej schválila EMA pro použití v monoterapii při léčbě dospělých pacientů s pokročilým NSCLC s pozitivitou ALK, u nichž došlo k progresi onemocnění po léčbě alektinibem či ceritinibem nebo po léčbě krizotinibem a nejméně jedním dalším ALK TKI.
V preklinických studiích tato látka vykazovala značnou protinádorovou aktivitu u myší s nádorovými xenografty exprimujícími protein EML4 fúzovaný s ALK, včetně následujících mutací ALK: L1196M, G1269A, G1202R a I1171T. Mutace ALK G1202R a I1171T prokazatelně souvisejí s rezistencí nádoru na alektinib, brigatinib, ceritinib a krizotinib (viz obr. 2). Lorlatinib byl také schopen pronikat hematoencefalickou bariérou.
Postupně jsou prezentovány aktualizované výsledky studie fáze I/II s ALK+ a ROS1+ metastazujícím NSCLC. V rámci virtuálního kongresu Evropské společnosti pro lékařskou onkologii (ESMO) byla v roce 2020 prezentována data ze studie fáze III CROWN, v níž u pacientů s NSCLC a prokázanou přestavbou genu ALK lorlatinib významně zlepšil dobu bez progrese nemoci (PFS) v porovnání s krizotinibem v 1. linii léčby.
Obr. 2. Široké spektrum účinnosti lorlatinibu proti ALK-rezistentním mutacím 
Kazuistika
Na naší klinice jsme měli možnost v rámci specifického léčebného programu společnosti Pfizer získat první zkušenosti s léčbou lorlatinibem.
Jedná se o pacientku, které bylo v době stanovení diagnózy v květnu 2015 39 let. Na naší klinice byl diagnostikován bronchogenní karcinom levého horního laloku, histologicky adenokarcinom, T4N3M1b, st. IV, s generalizací do plic bilaterálně, jater, mozku, kalvy, páteře, ledvin a ovarií.
Mutace EGFR negativní, ALK imunohistochemicky (IHC) suspektně pozitivní, při použití fluorescenční in situ hybridizace (FISH) pozitivní, ROS1 FISH pozitivní (zlom v oblasti 6q22.1).
Léčba
Pacientka na spádovém onkologickém oddělení absolvovala zevní ozáření krania, byla nasazena léčba bisfosfonáty. Protože v době diagnózy nebyla v Česku hrazena terapie inhibitory ALK v 1. linii, dostávala v období od 24. června 2015 do 7. října 2015 kombinaci chemoterapie (CHT) ve složení paklitaxel + karboplatina s anti-VEGF protilátkou bevacizumabem. Po 6 cyklech byla na PET/CT popsána částečná regrese. Pacientka proto pokračovala v udržovací léčbě bevacizumabem. Po 6. cyklu byla na PET/CT 4. března 2016 popsána progrese plicního tumoru, přibylo plicních nodulů a tekutina v levé pleurální dutině, progredoval nález v děloze (viz obr. 3)
Obr. 3. PET/CT 4. března 2016 při progresi před zahájením léčby krizotinibem 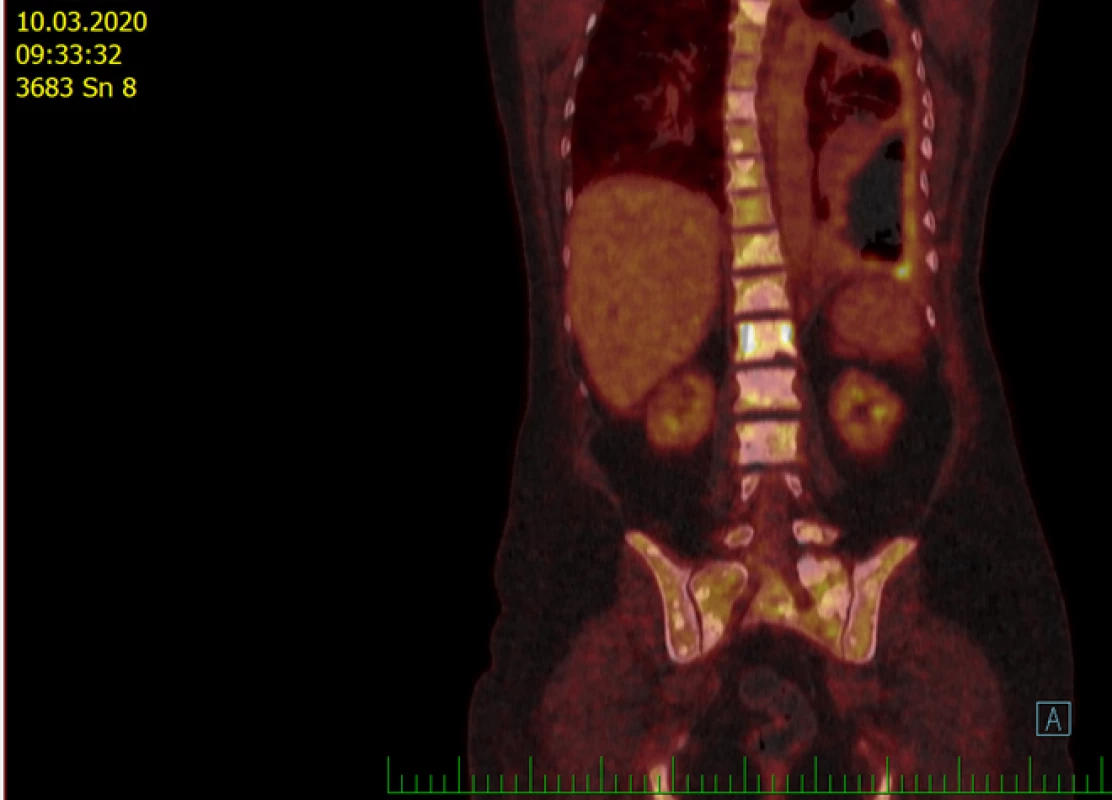
Inhibitory tyrosinkináz
Krizotinib
Dne 7. března 2016 byla zahájena léčba krizotinibem, která vedla k výraznému zlepšení klinického stavu pacientky a částečné regresi na PET/CT.
V září 2017 ovšem progredoval ložiskový nález v bederních obratlech, byla objevena další četná ložiska hypermetabolismu glukózy ve skeletu, lymfatické uzlině v mediastinu vpravo, v horním vnitřním kvadrantu pravého prsu, v dutině děložní a obou ovariích.
Scintigrafické vyšetření skeletu v říjnu 2017 odhalilo mnohočetná metastatická ložiska indikovaná k aplikaci samaria.
Pacientka proto 6. prosince 2017 ukončila léčbu krizotinibem.
Alektinib
V rámci specifického léčebného programu byla nemocná léčena ALK TKI 2. generace alektinibem, a to od 24. ledna do 25. dubna 2018.
PET/CT v dubnu 2018 ovšem ukázala výraznou progresi, proto byla 4. května 2018 zahájena CHT pemetrexedem.
Na kontrolním PET/CT vyšetření provedeném v srpnu 2018 byla patrná výrazná částečná regrese. Ta trvala do února 2019, kdy byla opět popsána progrese – mnohočetná kostní ložiska.
Lorlatinib
Vzhledem k tomu, že pacientka byla stále ve velmi dobrém klinickém stavu (PS 1), 19. března 2019 zahájila v rámci specifického léčebného programu léčbu lorlatinibem.
Kontrolní PET/CT v červnu 2019 ukázalo výraznou částečnou regresi: vymizel hypermetabolismus glukózy v levé plíci a parasternálních uzlinách vlevo, zřetelně ubylo hypermetabolických ložisek ve skeletu, FDG-avidní neoplazie perzistovala při levém acetabulu a v obratli L1, mírně susp. i v kostech kyčelních a L3, sternu, levé klavikule, nebyla nalezena nová patologická ložiska hypermetabolismu glukózy.
Pro ametabolický hrudní výpotek pacientka opakovaně podstoupila hrudní punkci a následně hrudní drenáž, maligní buňky nebyly zachyceny.
Na PET/CT byla opakovaně popsána trvající částečná regrese – v březnu 2020 (viz obr. 4) i září 2020 – a pacientka v léčbě lorlatinibem pokračuje, a to při velmi dobré kvalitě života více než 5 let od stanovení diagnózy.
Z nežádoucích účinků jsme zaznamenali pouze hypercholesterolémii zvládnutelnou běžnou medikací hypolipidemiky.
Obr. 4. PET/CT 10. března 2020 při léčbě lorlatinibem 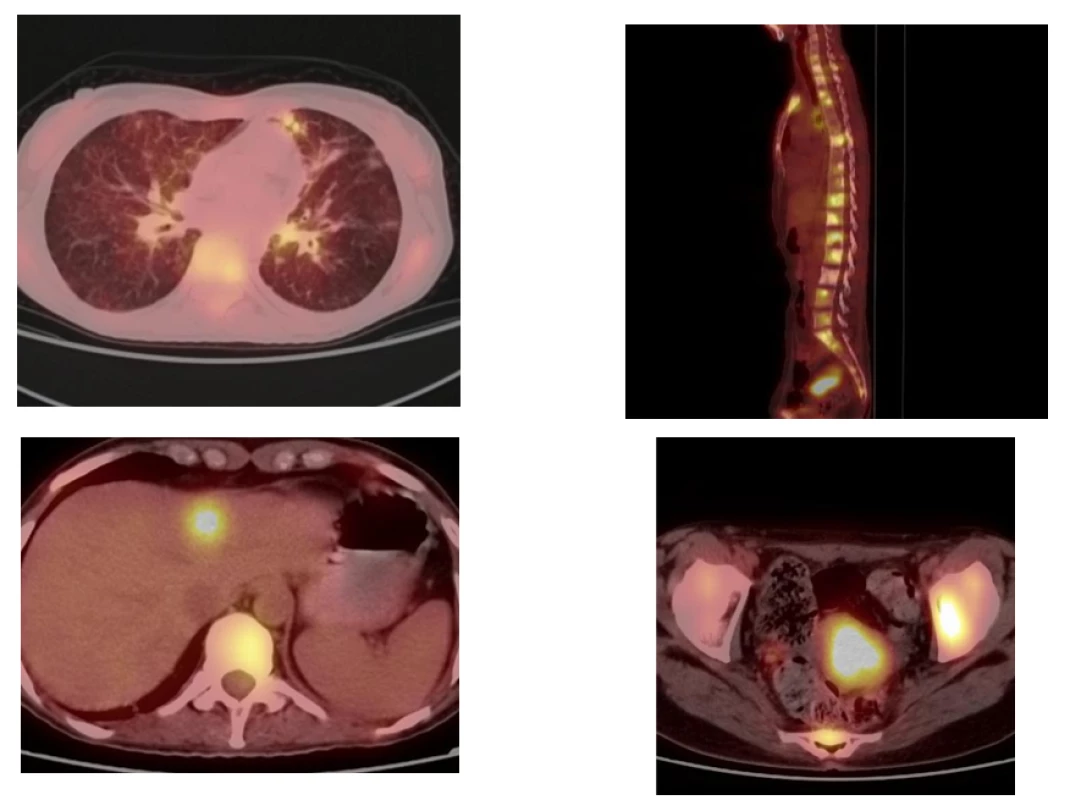
Závěr
Prezentovaná kazuistika jednoznačně ukazuje na nutnost testování prediktorů cílené léčby ve spolupráci s patology a molekulárními genetiky. Z klinické praxe je zřejmé, že při nedostatečném množství tkáně k tomuto vyšetření, je nutné v indikovaných případech (zvláště v případě neskvamózní histologie, u nekuřáků či bývalých kuřáků a mladších pacientů) zvažovat opakování odběru.
Lorlatinib významně zlepšuje léčebné výsledky pacientů, u kterých došlo k progresi onemocnění při vzniku rezistence na inhibitory ALK 1. a 2. generace, a to při velmi dobré kvalitě života. Nejnovější výsledky prezentované během virtuálního kongresu ESMO 2020 naznačují, že lorlatinib by mohl prodloužit dobu bez progrese v 1. linii léčby u ALK-pozitivních pacientů s NSCLC.
MUDr. Leona Koubková
Pneumologická klinika 2. LF UK a FN Motol, PrahaLiteratura:
1. Kwak E. L., Bang Y. J., Camidge D. R. et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N Engl J Med2010; 363 (18): 1693–1703, doi: 10.1056/NEJMoa1006448.
2. Bergethon K., Shaw A. T., Ou S.-H. I. et al. ROS1rearrangements define a unique molecular class of lung cancers. J Clin Oncol 2012; 30 (8): 863–870, doi: 10.1200/JCO.2011.35.6345.
3. Gainor J. F., Dardaei L., Yoda S. et al. Molecular mechanisms of resistance to first - and second-generation ALK inhibitors in ALK-rearranged lung cancer. Cancer Discov 2016; 6 (10): 1118‒1133, doi: 10.1158/2159-8290.CD-16-0596.
4. Choi Y. L., Soda M., Yamashita Y. et al.; ALK Lung Cancer Study Group. EML4-ALK mutations in lung cancer that confer resistance to ALK inhibitors. N Engl J Med 2010; 363 (18): 1734‒1739, doi: 10.1056/NEJMoa1007478.
5. Solomon B. J., Besse B., Bauer T. M. et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study. Lancet Oncol 2018; 19 (12): 1654–1667, doi: 10.1016/S1470-2045(18)30649-1.
6. Besse B., Shaw A. T., Solomon B. J. et al. Preliminary efficacy and safety of lorlatinib in patients with ROS1-positive non-small cell lung cancer (NSCLC). Abstract 1308PD. ESMO 2017 Sep 8–12, Madrid.
7. Solomon B., Bauer T. M., De Marinis F. et al. LBA2 Lorlatinib vs crizotinib in the first-line treatment of patients (pts) with advanced ALK-positive non-small cell lung cancer (NSCLC): results of the phase 3 CROWN study. ESMO Virtual Congress 2020 Sep 19. Ann Oncol 2020; 31 (suppl_4): S1142–S1215, doi: 10.1016/annonc/annonc325.
8. SPC Lorviqua. Dostupné na: www.pfizer.cz/sites/pfizer.cz/files/g10058801/f/201908/Lorviqua-SPC.pdf
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Onkologie Pneumologie a ftizeologie Laboratoř
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




