-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Přenašečky hemofilie – nepřehlížíte je náhodou?
Datum publikace: 8. 1. 2019
Hemofilie je relativně vzácná vrozená porucha krevního srážení, jejímž podkladem je v případě hemofilie A (HA) nedostatečná aktivita koagulačního faktoru VIII (FVIII) či u hemofilie B (HB) nedostatečná aktivita faktoru IX (FIX). Incidence choroby je přibližně 1 případ na 5 000–10 000 narozených chlapců pro hemofilii A a 1 případ na 30 000–50 000 pro hemofilii B [1, 2]. V České republice bylo v roce 2017 registrováno celkem 1 077 pacientů s hemofilií – 936 s HA a 141 s HB (report Českého svazu hemofiliků pro World Federation of Haemophilia – WFH).
Dědičnost u hemofilie
Dědičnost je v obou případech hemofilie gonozomálně recesivní (vázaná na chromozom X) – viz obr. 1.
Žena je jistá přenašečka hemofilie, pokud je:
- biologickou dcerou otce s hemofilií,
- biologickou matkou více než jednoho syna s hemofilií,
- biologickou matkou jednoho syna s hemofilií a má alespoň jednoho dalšího pokrevního příbuzného s touto nemocí.
Žena může být přenašečkou hemofilie, pokud:
- je biologickou matkou jednoho syna s hemofilií,
- má bratra s hemofilií,
- je biologickou babičkou jednoho vnuka s hemofilií,
- má v rodině z matčiny strany synovce, bratrance nebo strýce s hemofilií.
Obr. 1.: Genetický přenos hemofilie v rodině
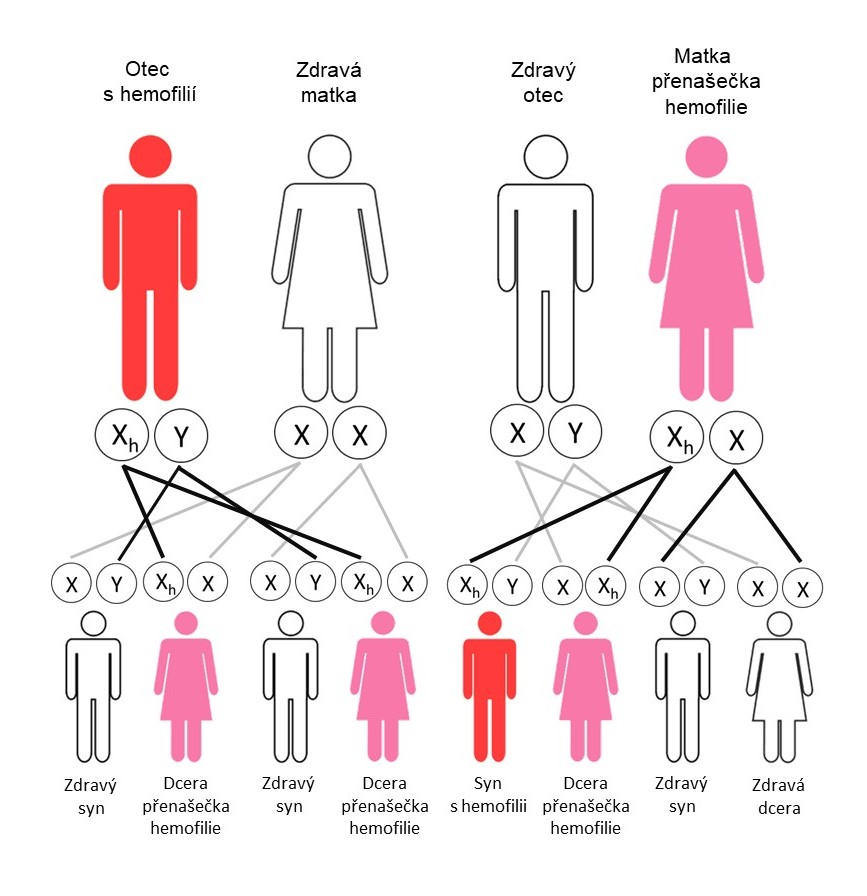
U více než 1/3 osob s hemofilií je ale rodinná anamnéza negativní. Může se jednat buď o nově vzniklou mutaci, nebo bylo postižení po generace přenášeno pouze po ženské linii. Je odhadováno, že na jednoho muže s hemofilií připadá průměrně 3–5 žen přenašeček [3]. Vzhledem ke způsobu genetického přenosu mohou nastat i velmi vzácné situace, kdy se závažnější forma hemofilie vyskytne i u ženy – např. pokud je pacientčina matka přenašečka (XhX) a otec hemofilik (XhY), mohou mít polovinu dcer hemofiliček (dvojitý heterozygot XhXh). Jiným příkladem je žena hemizygot pro chromozom X – např. Turnerův syndrom (X0, v našem případě tedy Xh0). Laboratorně i fenotypově se může jako lehká/středně těžká hemofilie chovat i autozomálně přenosné vrozené krvácivé onemocnění von Willebrandova choroba nebo vzácný kombinovaný deficit koagulačních faktorů V + VIII.
Klinické projevy a diagnostika
Podle laboratorně naměřené aktivity FVIII a FIX rozlišujeme těžkou formu hemofilie (FVIII či FIX < 1 %), středně těžkou formu (FVIII či FIX 1–5 %) a lehkou formu hemofilie (FVIII či FIX 5,1–40 %). U mužů s postiženým chromozomem Xh se onemocnění může projevit naplno – krvácením do kloubů, svalů, vnitřních orgánů (CNS, gastrointestinálního traktu, urogenitálního traktu), delším krvácením po poraněních, operacích apod. U žen přenašeček hemofilie jsou projevy méně nápadné a mnohdy stojí stranou zájmu odborné lékařské veřejnosti. Poněkud neprávem. Mnohé přenašečky zejména těžké formy hemofilie samy splňují i laboratorní kritérium lehké formy hemofilie (FVIII či FIX 5,1–40 %), a je proto doporučeno WFH tyto ženy označovat správněji „ženy s lehkou formou hemofilie A (B)“. Krvácivé projevy významně zhoršující kvalitu života se mohou objevit dokonce i u některých žen přenašeček hemofilie s aktivitou FVIII/IX v hodnotách spodní normy. Podle klinických projevů nelze jednoduše odlišit přenašečku hemofilie od jiných vrozených krvácivých onemocnění. Na tuto diagnózu je třeba myslet zejména u žen se subjektivně udávanou menoragií s následnou sideropenickou anémií, zvýšeným krvácením po operačních výkonech nebo úrazech nebo krvácením po porodu a v šestinedělí.
Na rozdíl od pacientů s poruchou primární hemostázy se tak často neobjevují podkožní hematomy a epistaxe, případně bývají potencovány užitím nesteroidních antirevmatik. Ženy z rodin se zvýšeným výskytem přenašeček mohou mít někdy zkreslené představy o normálním krvácení a své příznaky nevědomky bagatelizovat. Při odebírání anamnézy je nutno se aktivně ptát na délku silné menstruace ve dnech odcházející krevní sraženiny a jejich velikost, celkový počet použitých vložek za den, potřebu měnit je během noci či používání dvojí ochrany. U žen užívajících hormonální antikoncepci je nutno hodnotit situaci před zahájením hormonální terapie, případně hodnotit efekt této léčby. Pokud je menoragie jediným krvácivým příznakem u přenašečky hemofilie, může nasazení hormonální antikoncepce a její pozitivní efekt vést k „zamaskování“ projevů a odložení stanovení diagnózy krvácivého onemocnění.
Laboratorní vyšetření je indikováno, kdykoliv je podezření na vrozené krvácivé onemocnění. U pacientky se známou rodinnou anamnézou hemofilie (zejména těžké formy) by mělo být vyšetření provedeno ideálně v dětství – vzhledem k možným hemostatickým výzvám při operacích a úrazech, kdy mohou tyto pacientky vyžadovat i hematologickou substituční léčbu koagulačními faktory. Genetický status pacientky by měl být znám nejpozději před plánovaným rodičovstvím. V základních laboratorních testech se může objevit sideropenická anémie z opakovaných krevních ztrát (není pravidlem) a u některých přenašeček hemofilie prodloužení testu aPTT (aktivovaného parciálního tromboplastinového času, rovněž není pravidlem). Častěji a výrazněji je aPTT prodloužen u žen přenášejících těžkou formu hemofilie B, kde snížení FIX je výraznější a obvykle již v rámci citlivosti reagencie aPTT na deficit koagulačních faktorů.
Normální hodnota aPTT nevylučuje přenašečství hemofilie! Speciální koagulační testy již indikuje hematolog – stanovení aktivity FVIII/FIX, v případě snížení FVIII i testy k vyloučení těžší formy von Willebrandovy choroby (VWCH), zejména jejího subtypu Normandy, ale i těžké formy VWCH typu 1 nebo VWCH typu 3 (VWF:Ag, VWF:RCo, agregace trombocytů po ristocetinu, VWF:FVIIIB – vazebná kapacita FVIII k VWF). Hemofilie A ovlivňuje produkci FVIII, ale ne jeho transportního proteinu von Willebradova faktoru (VWF). Hladiny VWF jsou u hemofiliků i u přenašeček v normě. Normální výsledek vyšetření FVIII/FIX nevylučuje diagnózu přenašečství hemofilie! V případě podezření, že se jedná o ženu přenášející hemofilii, je možné a doporučené odeslat ji na vyšetření přímo do hemofilického centra, kde zajistí i další genetické došetření pacientky. V České republice pracuje osm hemofilických center pro děti a devět hemofilických center pro dospělé pacienty, obvykle při fakultních (případně krajských) nemocnicích.
Léčba
Hemofilie A/B je geneticky podmíněná diagnóza a kauzální terapie ve smyslu genové terapie je v současné době záležitostí výzkumu a klinických studií. Krvácivé projevy u přenašeček lze ovlivnit jinými postupy. Jako podpůrná léčba při nadměrných menstruačních krevních ztrátách či jiném slizničním krvácení se často s velmi dobrým efektem používají antifibrinolytika, nejčastěji kyselina tranexamová (v dávce 1 g každých 6–8 h) nebo kyselina paraaminobenzoová (250 mg 2–3× denně). Menoragie obvykle dobře reaguje na hormonální antikoncepci nebo na intrauterinní tělísko uvolňující levonorgestrel, který redukuje endometriální proliferaci. U přenašeček hemofilie A lze využít desmopresin (DDAVP) aplikovaný v dávce 0,3 μg/kg hmotnosti (max. 20 μg) intravenózně, subkutánně nebo intranazálně jako sprej. Desmopresin uvolňuje endogenní zásoby VWF a FVIII a zvyšuje tak hladinu FVIII 2–3×. Během léčby je doporučeno monitorovat ionty (Na, Cl) a osmolalitu séra pacientky. Dávka může být opakována, ale tato léčba je efektivní, pouze dokud se nevyčerpají všechny zásoby VWF v organismu. U žen s nízkou hladinou FVIII/FIX lze pro zajištění hemostázy k operačnímu či invazivnímu výkonu použít substituci koncentráty FVIII/FIX. U přenašeček upřednostňujeme vzhledem k (dnes již spíše hypotetickému) riziku přenosu krví přenosných infekčních chorob rekombinantní faktory nad plazmatickými. U některých přenašeček může dojít ke zvýšenému krvácení po užití nesteroidních antirevmatik. V tom případě se snažíme těmto lékům v budoucnosti vyhnout.
Plánování těhotenství, těhotenství a porod
Gravidní žena, která je přenašečkou hemofilie, má v případě plodu ženského pohlaví 50% pravděpodobnost, že se jí narodí děvčátko přenášející hemofilii, a v případě plodu mužského pohlaví 50% pravděpodobnost, že se narodí chlapec s hemofilií. Je proto nanejvýš žádoucí, aby v době gravidity již žena s rodinnou anamnézou hemofilie věděla, zda sama přenašečkou je, a měla informace o riziku přenosu hemofilie na své děti. Ženám přenašečkám je doporučena konzultace s lékařem hemofilického centra s vysvětlením rizik a seznámením s možnostmi preimplantační (PGD) a prenatální genetické diagnostiky a v případě jejího zájmu tyto výkony lékař zprostředkuje. Při samotné PGD se jedná o metodu asistované reprodukce umožňující výběr embrya bez konkrétní genetické zátěže u ženy s prokázaným postižením genu pro FVIII. Z prenatálních genetických metod lze ženě nabídnout neinvazivní stanovení pohlaví plodu z fetální DNA volně kolující v krvi matky s přesností > 99 % v 9.–14. týdnu gravidity, odběr choriových klků v 11.–14. týdnu gravidity a amniocentézu s vyšetřením získaných fetálních buněk v 15.–20. týdnu gravidity. Pokud genetické testování nebylo informativní, lze zvážit i eventuální přínos kordocentézy – aspirace plodové pupečníkové krve k vyšetření aktivity faktorů u plodu od 18. gestačního týdne [4, 5]. V případě, že je žena rozhodnutá donosit i plod postižený hemofilií, je doporučeno určení pohlaví plodu ultrazvukem, protože tato informace může mít vliv i na způsob vedení porodu.
V hemofilickém centru je ženám opakovaně vyšetřena aktivita FVIII/FIX, jejíž základní hladina je v optimálním případě známá již před těhotenstvím. Během gravidity dochází k hemostatickým změnám a obvykle i normalizaci FVIII u většiny přenašeček HA, u přenašeček HB ale k větším změnám FIX nedochází [6]. Vyšetření FVIII/FIX je doporučeno opakovat ve 28. a 34.–36. týdnu, zejména pak u žen, které měly před otěhotněním aktivitu faktorů sníženou. Již v prvním trimestru gravidity jsou přenašečky (především těžké hemofilie) ohroženy zvýšeným krvácením, např. při samovolném potratu, invazivních prenatálních diagnostických metodách nebo v případě ukončení gravidity. V těchto situacích musí být informován lékař hemofilického centra a doporučena hematologická léčba! U přenašeček hemofilie je zvýšené riziko peripartálního krvácení.
K porodu je doporučena substituce koagulačních faktorů u všech přenašeček, které mají aktivitu FVIII/FIX nižší než 50 %, a v substituci pokračovat dále 3–4 dny u vaginálního porodu a 5–7 dní u porodu císařským řezem (SC) [7]. U rodiček s hraničními hodnotami faktorů jsou doporučena antifibrinolytika, DDVAP pouze u přenašeček hemofilie A. Graviditou zvýšená aktivita koagulačních faktorů se začíná kolem 3. dne po porodu opět pomalu vracet k hodnotám před otěhotněním, a proto se zvýšené krvácení může u přenašečky hemofilie objevit i s odstupem několika dnů, případně 2–3 týdnů po porodu, a rodička by na to měla být upozorněna. Způsob vedení porodu je stále diskutován bez jednoznačného závěru. Je třeba zohlednit tíži přenášené hemofilie i jiná rizika na straně matky, genetickou zátěž hemofilií u plodu či mužské pohlaví plodu, pokud prenatální vyšetření nebylo např. na přání rodičů provedeno. Na zřetel je brán i výsledek diskuze o porodu s rodičkou a otcem dítěte. Přenašečství lehké formy hemofilie není indikací k SC z důvodu krvácivého onemocnění. Shoda názorů ale nepanuje v případě rodičky přenášející těžkou formu hemofilie.
U vaginálního porodu je doporučeno pokud možno šetrné vedení porodu s vyloučením vakuumextrakce, forcepsu a protrahovaného porodu, případně časná indikace SC. V Evropě a USA je u známých přenašeček těžké hemofilie preferován porod SC, protože šetrný vaginální porod nelze předem zaručit. Z údajů amerického registru vyplývá vyšší riziko krvácení do CNS u chlapců s hemofilií porozených vaginálně (2,8 %) ve srovnání s porodem SC (0,2 %) [8]. Tato data je však třeba hodnotit i s vědomím toho, že ne všechny rodící přenašečky hemofilie (zejména pak prvorodičky) o svém stavu vědí a u těchto neinformovaných žen je instrumentální porod častější [9]. Novorozence je doporučeno považovat za hemofilika, dokud nemáme výsledky FVIII/IX ze vzorku krve odebraného ihned z pupečníku, eventuálně další laboratorní kontroly z periferní krve. Péče o novorozeného hemofilika již přesahuje obsah tohoto kurzu. Péče o gravidní přenašečku, zajištění jejího porodu a péče o novorozeného hemofilika jsou v České republice směřovány do hemofilických center, vyžadují úzkou spolupráci gynekologa, hematologa, neonatologa, genetika a anesteziologa s přípravou multidisciplinárního plánu porodu k minimalizaci krvácivých komplikací na straně matky i novorozence.
Shrnutí a závěr
Přenašečky hemofilie, zejména ty s nízkou aktivitou FVIII/FIX, by měly být registrovány a sledovány v hemofilických centrech, kde mají zajištěný přístup k podobné hemostatické léčbě a mezioborové péči jako muži s hemofilií. Lékaři hemofilických center aktivně vyhledávají přenašečky hemofilie na základě rozboru rodokmenu svých pacientů a doporučují a nabízí vyšetření vytipovaným rodinným příslušníkům. Přenašečky s nízkou aktivitou FVIII/FIX jsou považovány za osoby s vrozeným krvácivým onemocněním – lehkou formou hemofilie A/B – a měly by být registrovány v hemofilickém centru a opatřeny průkazkou krvácivé choroby s vyznačením typu hemofilie a aktivitou FVIII/FIX a telefonickým kontaktem na lékaře hemofilického centra s možností konzultace 24 hodin 7 dní v týdnu.
V situacích se zvýšeným rizikem krvácení mohou tyto ženy vyžadovat i hemostatickou podporu koagulačními faktory VIII/IX. Řada přenašeček hemofilie ale stále zůstává neodhalená – nejčastější příčinou bývá nedostatečná komunikace v rodině, nedostatečná informovanost o způsobu genetického přenosu hemofilie, odmítání diagnózy na straně pacientky či jejích rodičů nebo přenos hemofilie v rodině po ženské linii po několik generací. Na vrozenou krvácivou poruchu může upozornit sideropenická anémie, menoragie nebo prodloužené a zvýšené krvácení po invazivním výkonu a operaci.
- Pracovní skupina ČNHP pro standardy: Smejkal P., Blatný J., Hluší A. et al. Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 2., rok 2017. Transfuze a hematologie dnes. 2017; 23 : 82–89.
- Bolton-Maggs P. H. B., Pasi K. J. Haemophilia A and B. Lancet. 2003; 361 : 1801–1809.
- Street A. M., Ljung R., Lavery S. A. Management of carriers and babies with haemophilia. Haemophilia. 2008; 14 (Suppl. 3): 181–187.
- Hermans C., Kulkarni R. Women with bleeding disorders. Haemophilia. 2018; 24 (Suppl. 6): 29–36.
- Kadir R. A., Davies J., Winikoff R. et al. Pregnancy complications and obstetric care in women with inherited bleeding disorders. Haemophilia. 2013; 19 (Suppl. 4): 1–10.
- Huq F. Y., Kadir R. A., Management of pregnancy, labour and delivery in women with inherited bleeding disorders. Haemophilia 2011; 17 (Suppl. 1): 20–30.
- Lee C. A., Chi C., Povard S. R. et al. The obsteric and gynaecological management of women with inherited bleeding disordes – review with guidelines produced by a taskforce of UK Haemophilia Centre Doctors’ Organization. Haemophilia. 2006; 12 : 301–36.
- Kulkarni R. et al. Sites of initial bleeding episodes, mode of delivery and age of diagnosis in babies with haemophilia diagnosed before the age of 2 years: a report from The Centers for Disease Control and Prevention’s (CDC) Universal Data Collection (UDC) project. Haemophilia. 2009; 15 : 1281–90.
- Maclean P. E., Fijnvandraat K., Beijlevelt M., Peters M. The impact of unaware carriership on the clinical presentation of haemophilia. Haemophilia. 2004; 10 : 560–564.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



