-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRoboticky asistovaná radikální prostatektomie – výsledky u 1500 operací
Robotic-assisted radical prostatectomy – results of 1500 surgeries
Introduction:
Prostate cancer is the most common malignant disease in men. The number of cases of prostate cancer has increased dramatically in recent 20 years. Radical prostatectomy is a surgical method for the first-line treatment of localised prostate cancer. We performed the first robotic-assisted radical prostatectomy on December 16th, 2005, achieved the boundary of 1000 robotic-assisted radical prostatectomies in 2012, and in 2015, we successfully completed the 1500th robotic-assisted operation on the prostate.Method:
We retrospectively evaluated the oncological and functional results in 1,500 consecutive patients who underwent robotic-assisted radical prostatectomy at our institution between 2005−2015. The robotic system da Vinci Standard was used for the operations until November 2013, and subsequently the robotic system da Vinci Si HD. Mean age of the patients was 63.7 years (40 to 86); mean BMI was 27.7 (19.4 to 41.4); and mean preoperative PSA was 6.7 ng/ml (0.4 to 112.0).Results:
Pathological stage of the localised prostate cancer was found in 1125 (75%) men, and the stage of locally advanced cancer was found in 363 (24.2%) patients. We determined the Gleason score ≥ 7 in surgical specimens of 1150 (76.7%) men. 171 (11.4%) men underwent pelvic lymphadenectomy; metastases in the pelvic lymph nodes were detected in 36 (21.1%) patients. Urinary continence in the period of up to 1 year after the surgery was evaluated in 1218 (81.2%) patients in the group. 1119 (91.9%) men needed no incontinence pads or one safety pad one year from the surgery. Postoperative erectile function was evaluated in 447 (29.8%) men. One year from the surgery, 247 (55.3%) men were capable of a sufficient erection for sexual intercourse without any supportive therapy. Intraoperative complications according to the Clavien-Dindo classification were observed in 20 (1.3%) patients; complications within 3 months from the surgery were observed in 127 (8.5%) patients.Conclusion:
Robotic-assisted radical prostatectomy is a clearly defined, safe and reproducible minimally invasive treatment of localised prostate cancer.Key words:
prostate cancer − robotic surgery − radical prostatectomy − complications
Autoři: J. Kočárek 1,2; J. Heráček 1,2; M. Čermák 1; F. Chmelík 1; M. Matějková 1
Působiště autorů: Urologické oddělení, Ústřední vojenská nemocnice - Vojenská fakultní nemocnice Praha primář: MUDr. J. Kočárek, Ph. D. 1; Urologická klinika, 1. LF Univerzity Karlovy v Praze přednosta: prof. MUDr. T. Hanuš, DrSc. 2
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 2, s. 75-81.
Kategorie: Původní práce
Souhrn
Úvod:
Karcinom prostaty je nejčastější zhoubné onemocnění u mužů. Počet případů nádorů prostaty za posledních 20 let dramaticky vzrostl. Radikální prostatektomie je chirurgickou metodou první volby léčby lokálně ohraničeného karcinomu prostaty. První roboticky asistovanou radikální prostatektomii jsme provedli 16. 12. 2005, přelomové hranice 1000 roboticky asistovaných radikálních prostatektomií jsme dosáhli v roce 2012 a v roce 2015 jsme úspěšně dokončili 1500. roboticky asistovaný výkon na prostatě.Metoda:
Retrospektivně jsme vyhodnotili výsledky u 1500 po sobě jdoucích pacientů, kteří podstoupili roboticky asistovanou radikální prostatektomii na našem pracovišti v období 2005−2015. Při operaci jsme používali do roku 2013 robotický systém da Vinci Standard, poté robotický systém da Vinci Si HD. Průměrný věk pacientů byl 63,7 roku (40−86), hodnota BMI byla 27,7 (19,4−41,4) a předoperační hodnota PSA byla 6,7 ng/ml (0,4−112,0).Výsledky:
Patologické stadium lokálně ohraničeného karcinomu prostaty jsme zjistili u 1125 (75 %) mužů, u 363 (24,2 %) pacientů pak stadium lokálně pokročilého karcinomu. Hodnotu Gleasonova skóre ≥7 jsme stanovili z operačního preparátu u 1150 (76,7 %) mužů. Pánevní lymfadenektomii podstoupilo 171 (11,4 %) mužů, metastázy v pánevních uzlinách jsme zaznamenali u 36 (21,1 %) pacientů. Kontinenci moče v období do jednoho roku po operaci jsme vyhodnotili u 1218 (81,2 %) pacientů. Bez potřeby vložky nebo s jednou pojistnou vložkou bylo 12 měsíců po operaci 1119 (91,9 %) mužů. Pooperační erektilní funkci jsme vyhodnotili u 447 (29,8 %) operovaných. Rok po operaci bylo erekce dostatečné k pohlavnímu styku bez nutnosti podpůrné terapie schopno 247 (55,3 %) mužů. Intraoperační komplikace jsme dle Clavien-Dindo klasifikace zaznamenali u 20 (1,3 %) operovaných, komplikace do tří měsíců po operaci u 127 (8,5 %) pacientů.Závěr:
Roboticky asistovaná radikální prostatektomie je jasně definovaná, bezpečná a reprodukovatelná miniinvazivní metoda léčby lokalizovaného karcinomu prostaty.Klíčová slova:
karcinom prostaty − robotická chirurgie − radikální prostatektomie − komplikaceÚVOD
Karcinom prostaty je nejčastějším zhoubným onemocněním u mužů. Počet případů nádorů prostaty za posledních 20 let dramaticky vzrostl (Graf 1). V České republice byl v roce 1990 počet nových případů 1607, v roce 2000 pak 2876 nových případů, v roce 2013 již 6846 nových případů a letos se očekává, že tuto diagnózu lékaři sdělí okolo 7800 mužům [1].
Graf 1. Vývoj incidence a mortality karcinomu prostaty v České republice Graph 1: Trends of incidence and mortality related to prostate cancer in the Czech Republic 
Radikální prostatektomie je pro pacienty s ohraničeným nádorem prostaty metodou volby s vysokou pravděpodobností kurativní léčby. Většina nevýhod otevřeného přístupu a laparoskopie při operaci prostaty odpadá při použití roboticky asistované chirurgie. Hlavními výhodami roboticky asistovaného výkonu oproti otevřenému nebo laparoskopickému přístupu jsou precizní odstranění nádorem postižené prostaty, výrazně menší poškození okolních tkání při zachování vlastní radikality výkonu, rychlejší návrat kontinence po operaci, nižší riziko dlouhodobé inkontinence moče, nižší výskyt poruchy erekce a také nižší riziko hluboké žilní trombózy [2].
Urologické oddělení ÚVN-VFN Praha se dlouhodobě specializuje na endoskopické, laparoskopické a miniinvazivní operační výkony. První roboticky asistovanou radikální prostatektomii jsme provedli 16. 12. 2005, přelomové hranice 1000 roboticky asistovaných radikálních prostatektomií jsme dosáhli v roce 2012 a v roce 2015 jsme úspěšně dokončili 1500. roboticky asistovaný výkon na prostatě.
METODA
Do souboru jsme zařadili 1500 po sobě jdoucích pacientů, kteří podstoupili v období 2005−2015 roboticky asistovanou radikální prostatektomii. Při operaci jsme používali do roku 2013 robotický systém da Vinci Standard (1209 výkonů), poté robotický systém da Vinci Si HD (291 výkonů). K výkonu jsme indikovali pacienty s klinicky lokálně ohraničeným nebo lokálně pokročilým karcinomem prostaty. Oboustranně nervy šetřící postup jsme indikovali u pacientů s klinickým stadiem cT1c, PSA (prostatický specifický antigen) ≤10 ng/ml a GS (Gleason) skóre ≤6. U pacientů s GS skóre 7–8 jsme podle peroperačního nálezu provedli šetření nervově-cévní pleteně na kontralaterální straně prostaty. Pánevní lymfadenektomii jsme indikovali u pacientů s GS skóre ≥8 a/nebo hodnotou PSA ≥20 ng/ml. Při standardním pooperačním průběhu jsme 2. den po operaci odstraňovali drén, u pacientů po pánevní lymfadenektomii jsme drén ponechávali 3−4 dny po operaci. Pacienty jsme standardně propouštěli do domácího léčení 4. pooperační den, v případě provedené pánevní lymfadenektomie pak 6. pooperační den. Močový katétr jsme odstraňovali 10. pooperační den v ambulantním režimu. Tab. 1 shrnuje základní předoperační charakteristiku souboru. Demografická a klinická data pacientů jsme zpracovali metodami popisné statistiky.
Chirurgická technika roboticky asistované radikální prostatektomie
Při výkonu je pacient uložen v 30° Trendelenburgově poloze s lehce abdukovanými dolními končetinami. Výkon provádíme nejčastěji extraperitoneálním přístupem, kdy nejdříve z incize pod pupkem digitálně disekujeme preperitoneální prostor. Pod kontrolou prstu následně zavádíme dva 8mm robotické porty do pravého podbřišku. V levém podbřišku zavádíme jeden 8mm robotický a jeden 12mm asistentský port, videoport pak incizí pod pupkem. Po založení kapnopreperitonea za robotické asistence nastřihujeme endopelvickou fascii po obou stranách prostaty. Komplex dorzální žíly zajišťujeme propichovou ligaturou, kterou fixujeme ke sponě (Obr. 1). Prostatu oddělujeme od hrdla močového měchýře (Obr. 2), preparací za hrdlem uvolňujeme semenné váčky (Obr. 3). Chámovody před přerušením ošetřujeme bipolární koagulací (Obr. 4). Pedikly zajišťujeme titanovými klipy a přerušujeme (Obr. 5). Prostatu poté uvolňujeme od rekta. Nervově-cévní svazky šetříme bilaterálně/unilaterálně nebo provádíme jejich širokou excizi. Těsně pod apexem přerušujeme uretru (Obr. 6). Prostatu poté vkládáme do extrakčního sáčku. Veziko-uretrální anastomózu šijeme pokračujícím V-Loc stehem v jedné vrstvě (Obr. 7). Po kontrole krvácení do pánve vkládáme trubicový drén 21F a rušíme preperitoneum (Obr. 8). Preparát v sáčku odstraňujeme rozšířenou incizí pod pupkem a poté uzavíráme ránu po vrstvách.
Obr. 1. Podvaz komplexu dorzální žíly s fixací ke sponě Fig. 1: Ligation of the dorsal venous complex with its fixation to the pubic bone 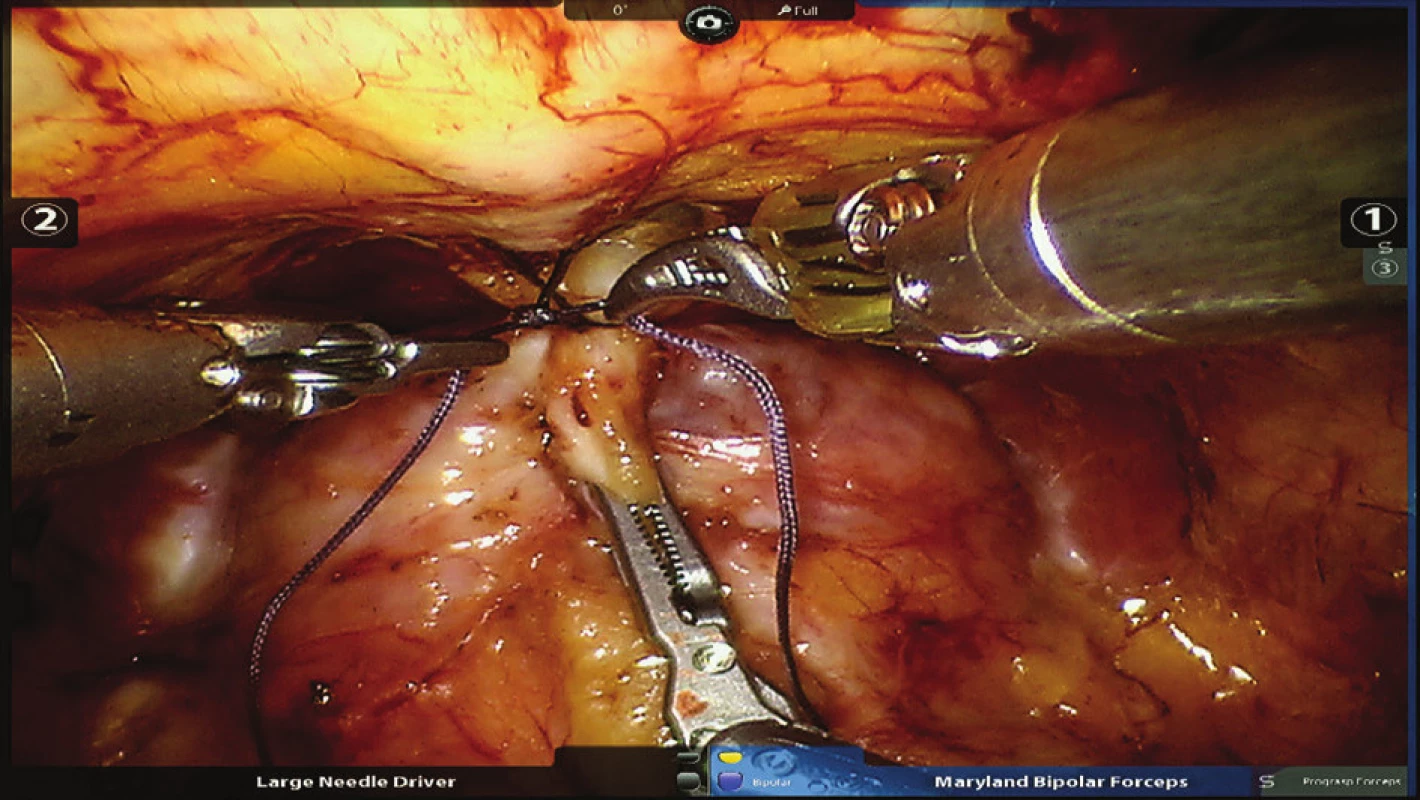
Obr. 2. Identifikace hranice hrdla močového měchýře a prostaty Fig. 2: Identification of the borderline of the bladder neck and the prostate 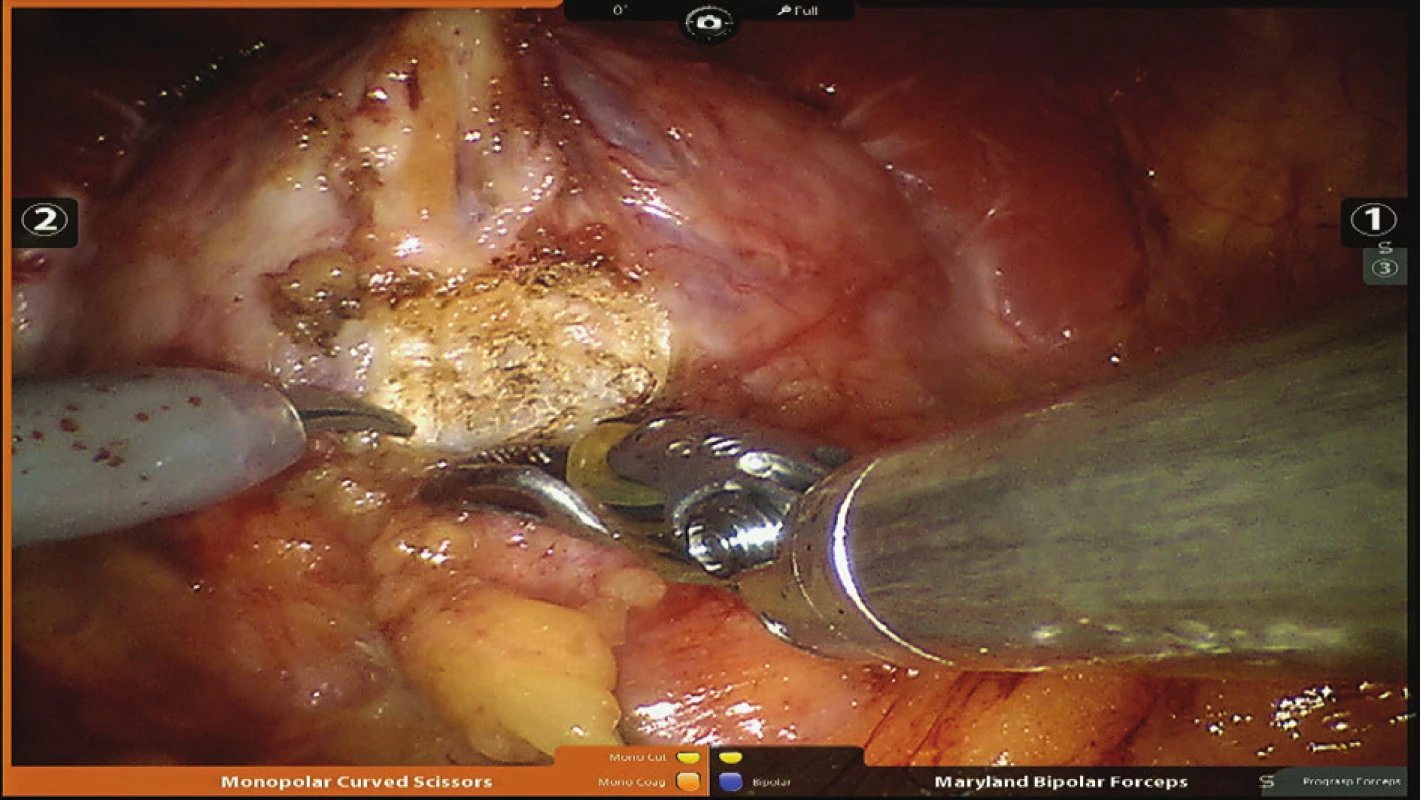
Obr. 3. Preparace levého semenného váčku Fig. 3: Preparation of the left seminal vesicle 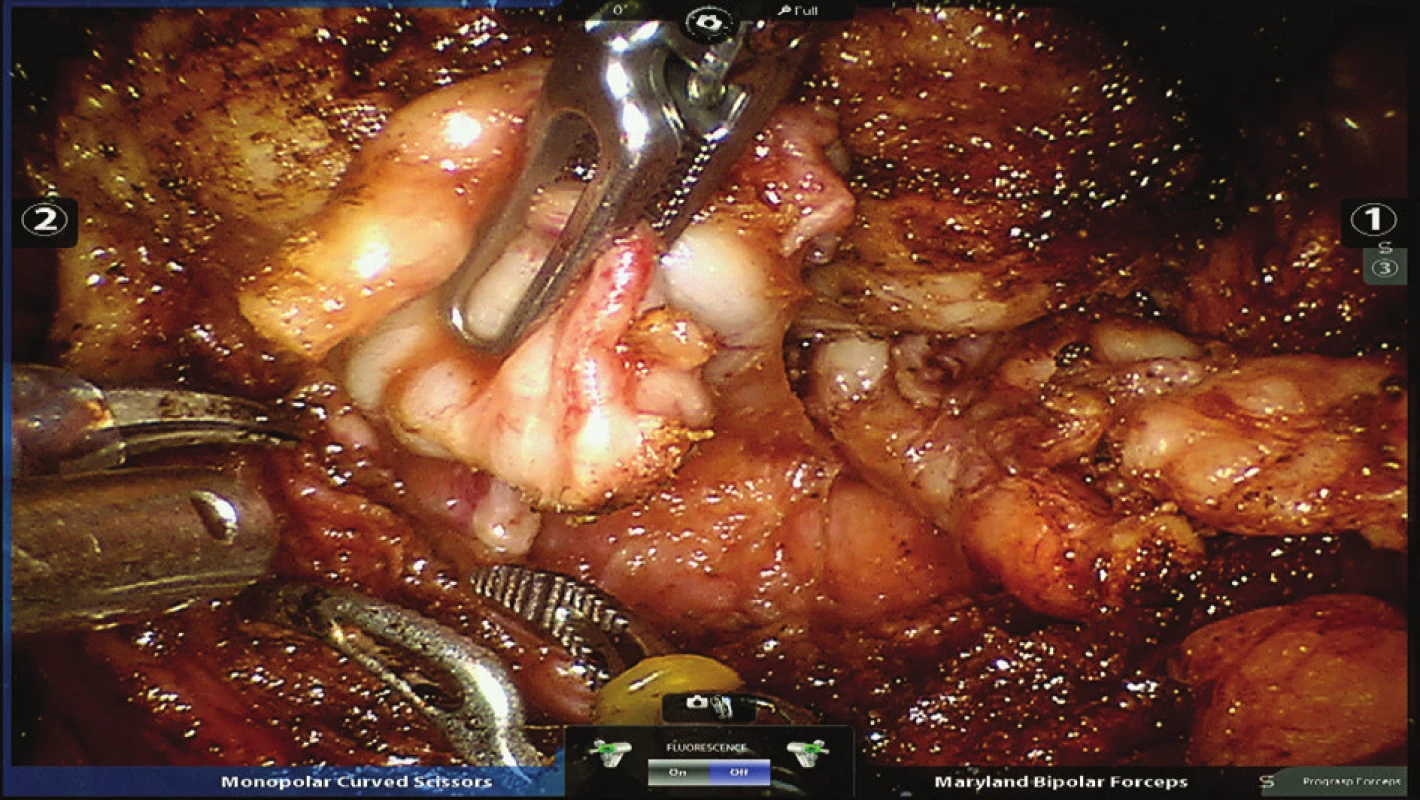
Obr. 4. Koagulace levého chámovodu Fig. 4: Coagulation of the left vas deferens 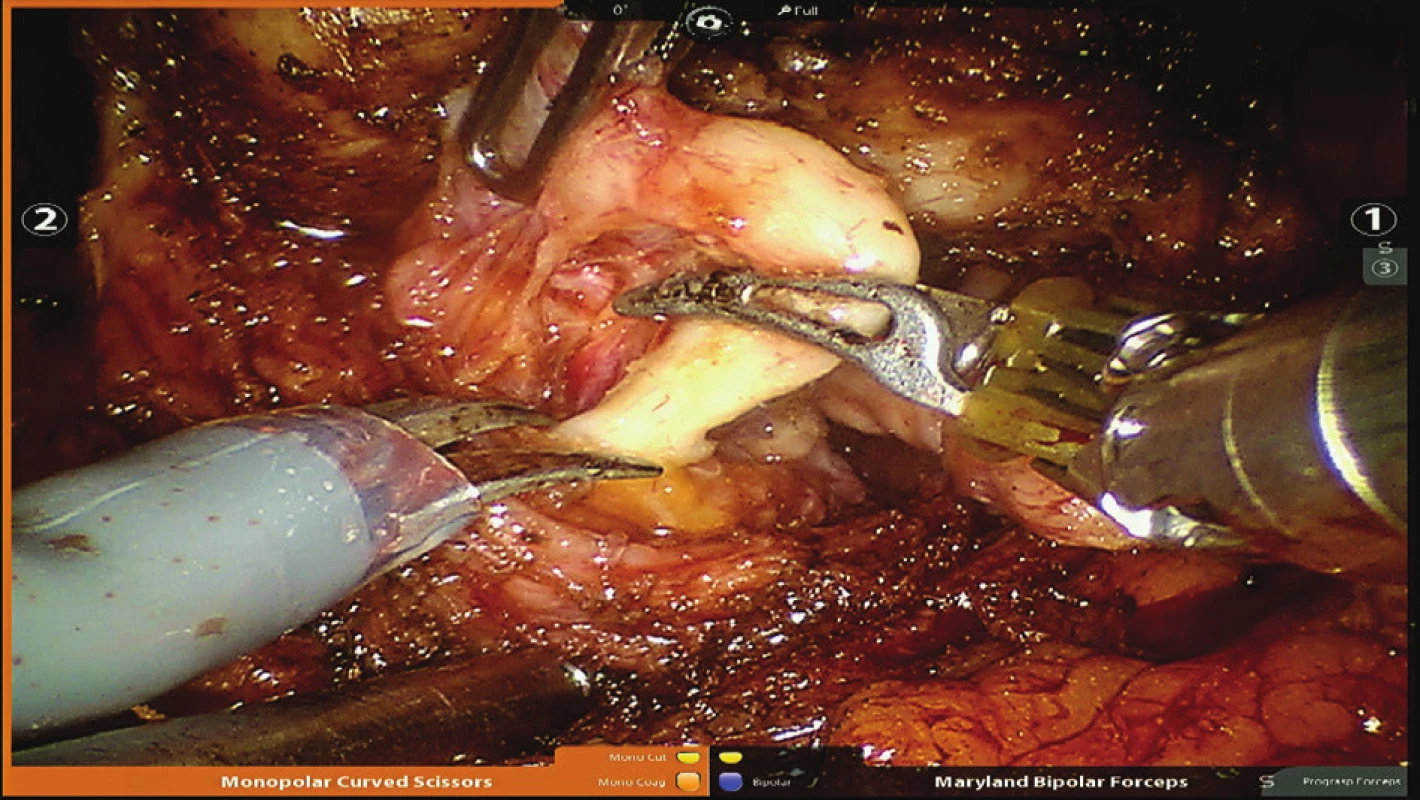
Obr. 5. Nasazení titanového klipu na pravý pedikl Fig. 5: Clipping of the right pedicle with a titanium clip 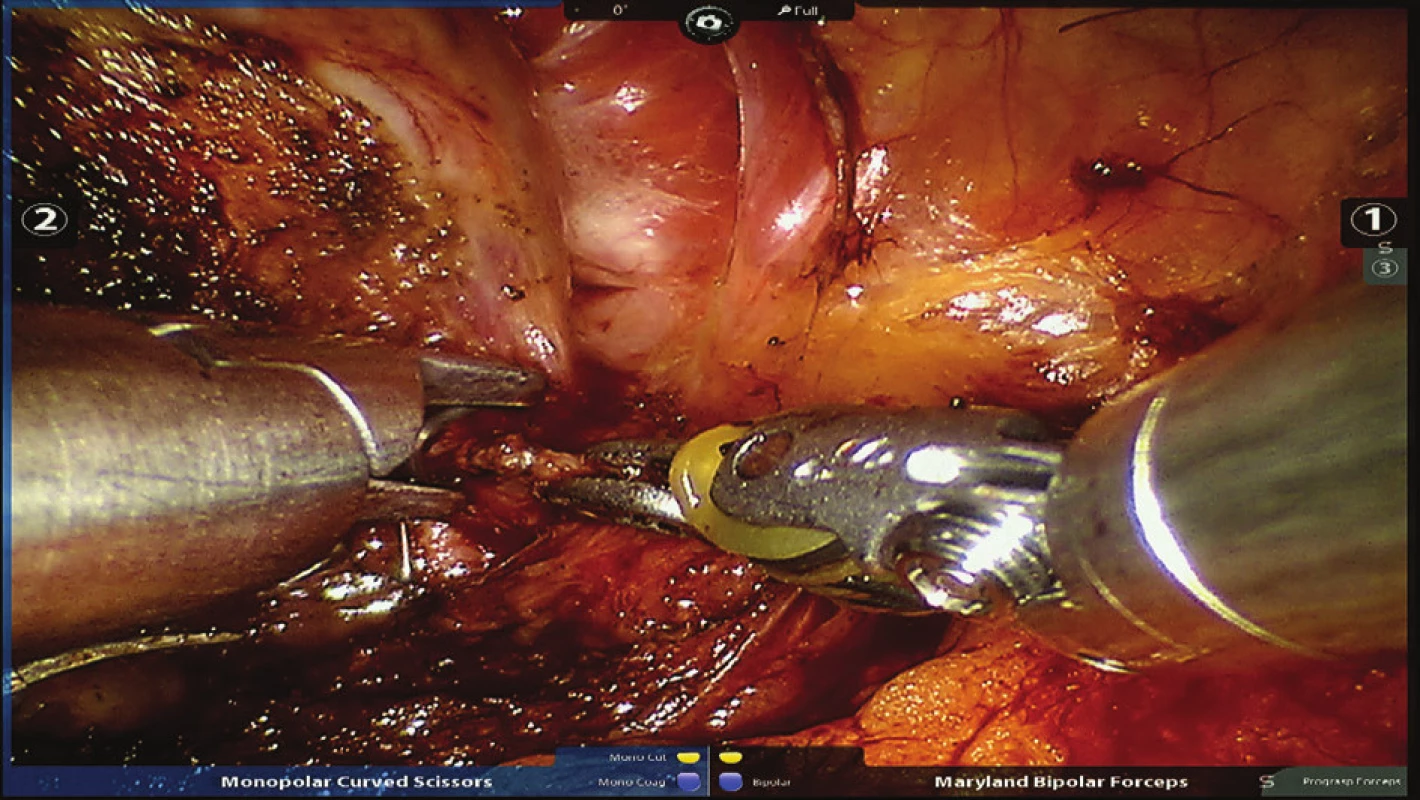
Obr. 6. Přerušení uretry těsně pod apexem prostaty Fig. 6: Interruption of the urethra just below the apex of the prostate 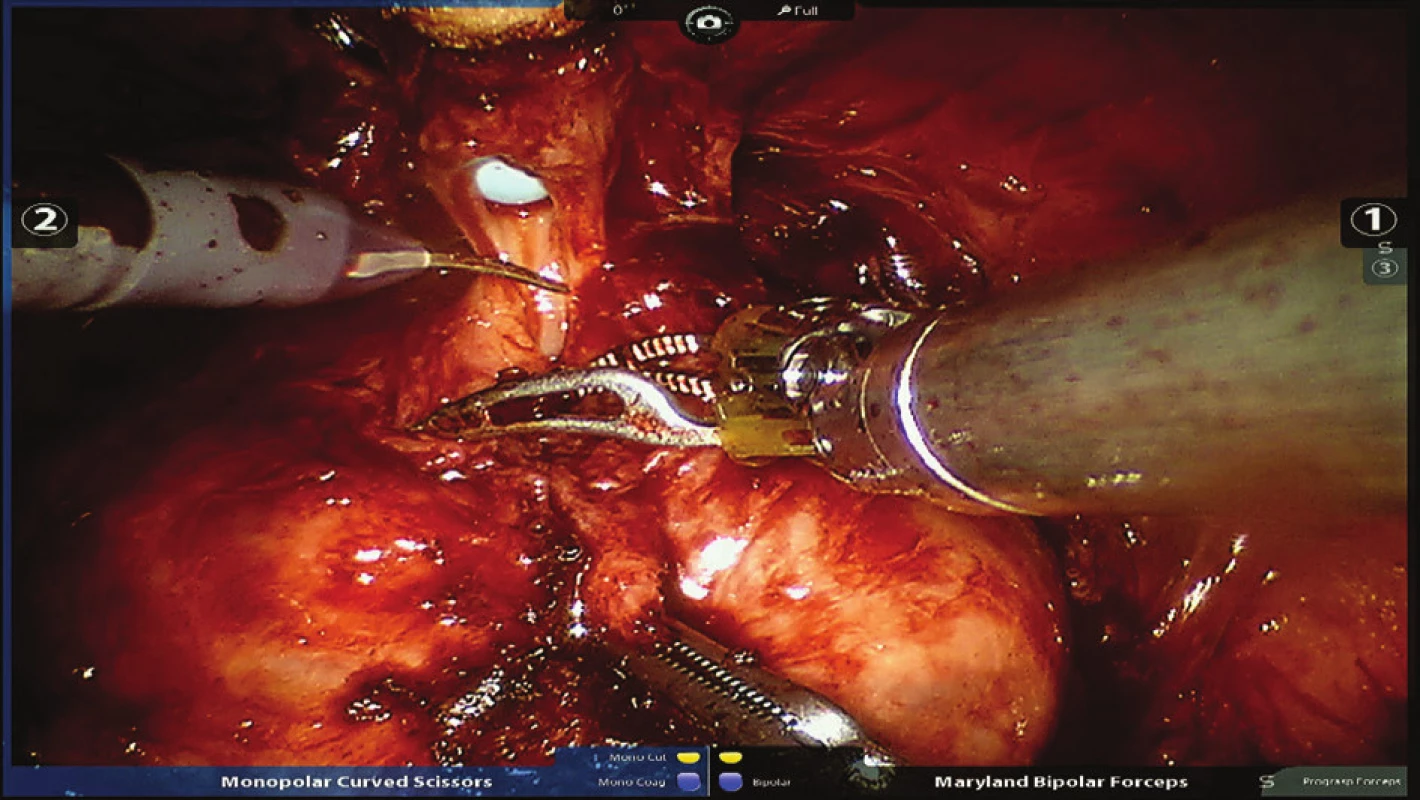
Obr. 7. Nasazení prvních stehů při šití veziko-uretrální anastomózy Fig. 7: Placing the first sutures on the vesicourethral anastomosis 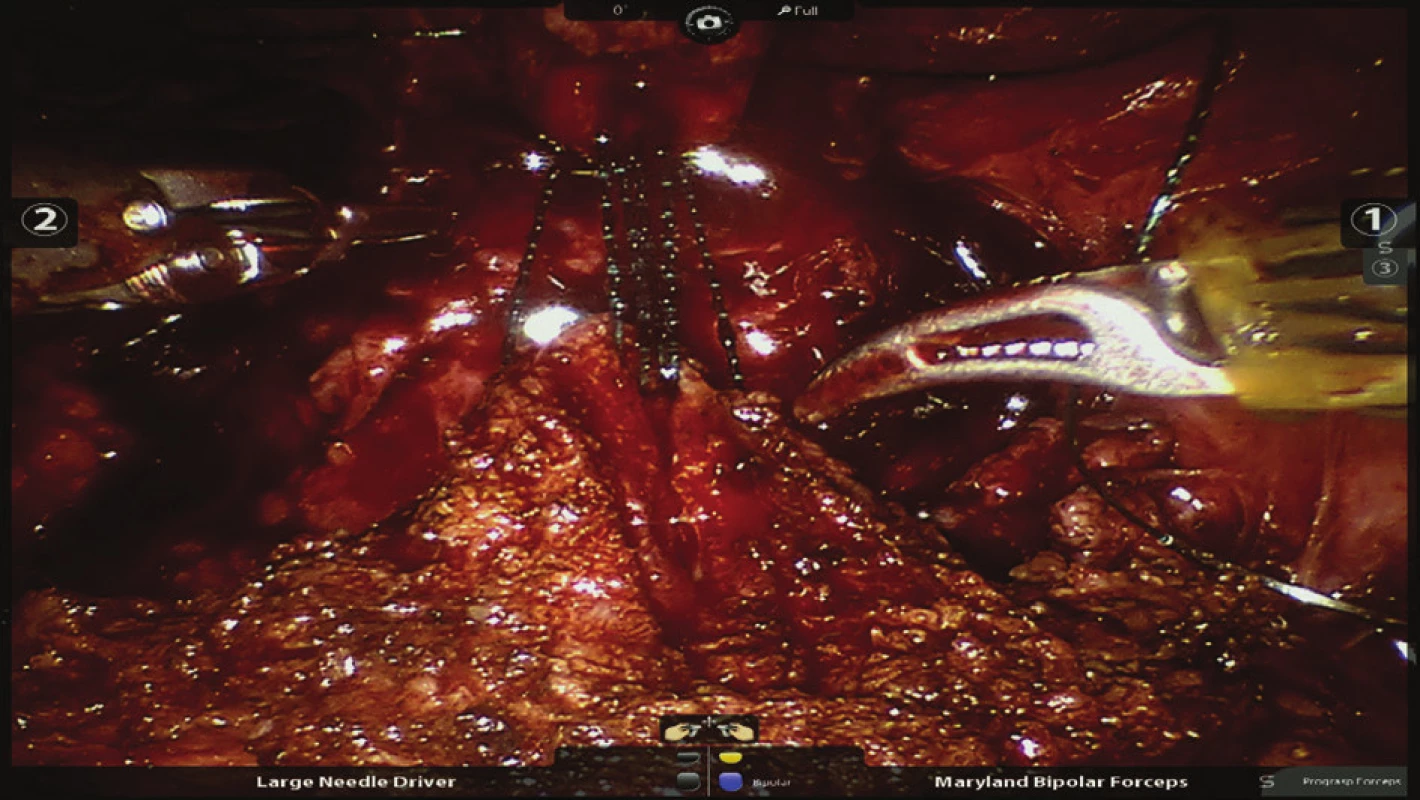
Obr. 8. Zavedení pojistného drénu k vodotěsné anastomóze Fig. 8: Introduction of a drain near the watertight anastomosis 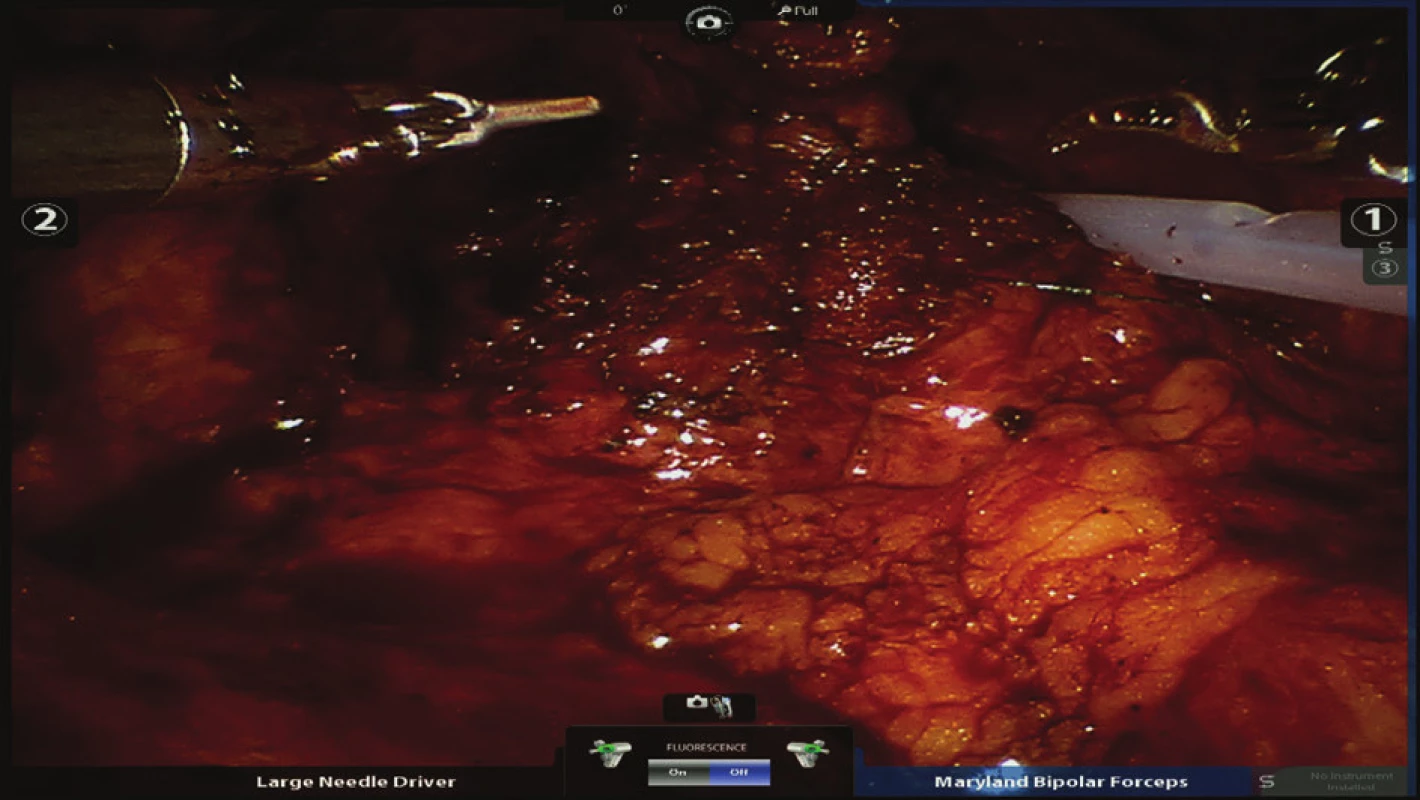
Pokud pacienta indikujeme k pánevní lymfadenektomii, používáme transperitoneální přístup, při kterém nejprve zakládáme kapnoperitoneum Veressovou jehlou. Pod optickou kontrolou následně zavádíme robotické porty a asistentský port. Po provedení bilaterální pánevní lymfadenektomie pokračujeme výše popsaným postupem operací na prostatě.
VÝSLEDKY
Tab. 1 až 5 shrnují charakteristiku, výsledky a perioperační komplikace souboru. Nejmladšímu operovanému pacientovi bylo 40 roků, nejstaršímu pak 86 roků, celkově 1221 (81,4 %) mužů bylo v době operace mladších 70 roků. BMI v normě mělo 323 (21,5 %) pacientů, 1177 (78,5 %) operovaných mělo BMI v hodnotách nadváhy, obezity nebo morbidní obezity. Předoperační hodnotu PSA nižší než 10 ng/ml jsme zaznamenali u 1179 (78,6 %) mužů, 321 (21,4 %) pacientů mělo hodnotu PSA před operací vyšší než 10 ng/ml.
Tab. 1. Předoperační charakteristika souboru, n=1500 Tab. 1: Preoperative characteristics, n=1500 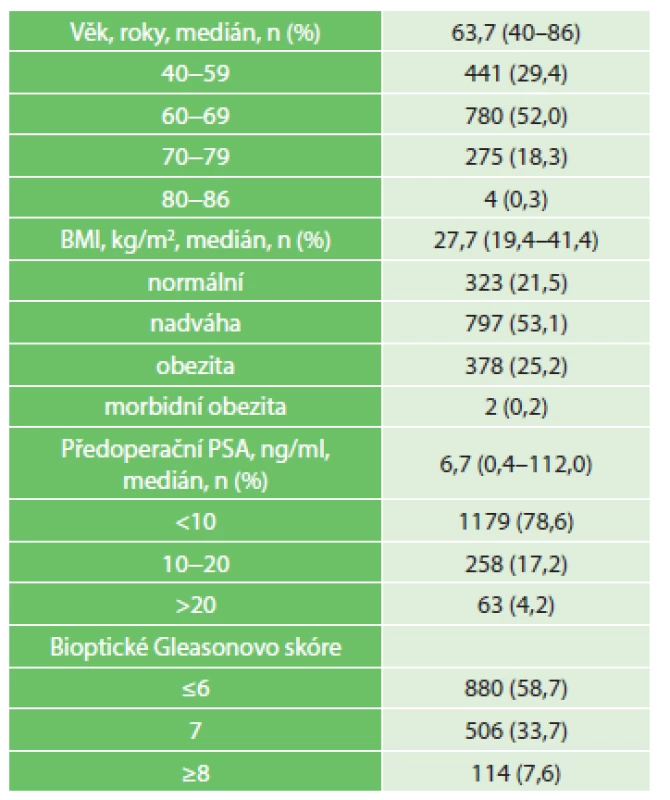
Vysvětlivky: BMI – body mass index; PSA – prostatický specifický antigen Tab. 2. Pooperační charakteristika souboru, n=1500 Tab. 2: Postoperative characteristics, n=1500 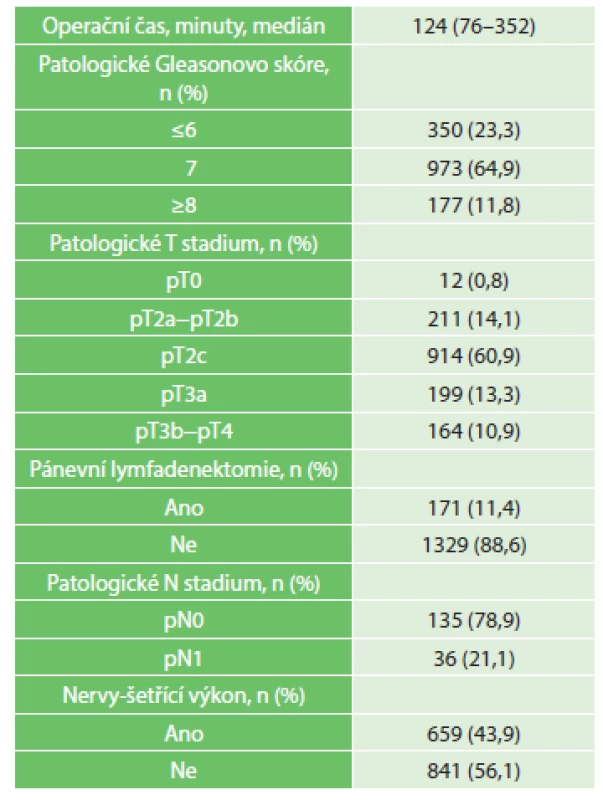
Tab. 3. Vyhodnocení kontinence po 1, 3, 6 a 12 měsících po operaci, n=1218 Tab. 3: Evaluation of continence after 1, 3, 6 and 12 months from the surgery, n=1218 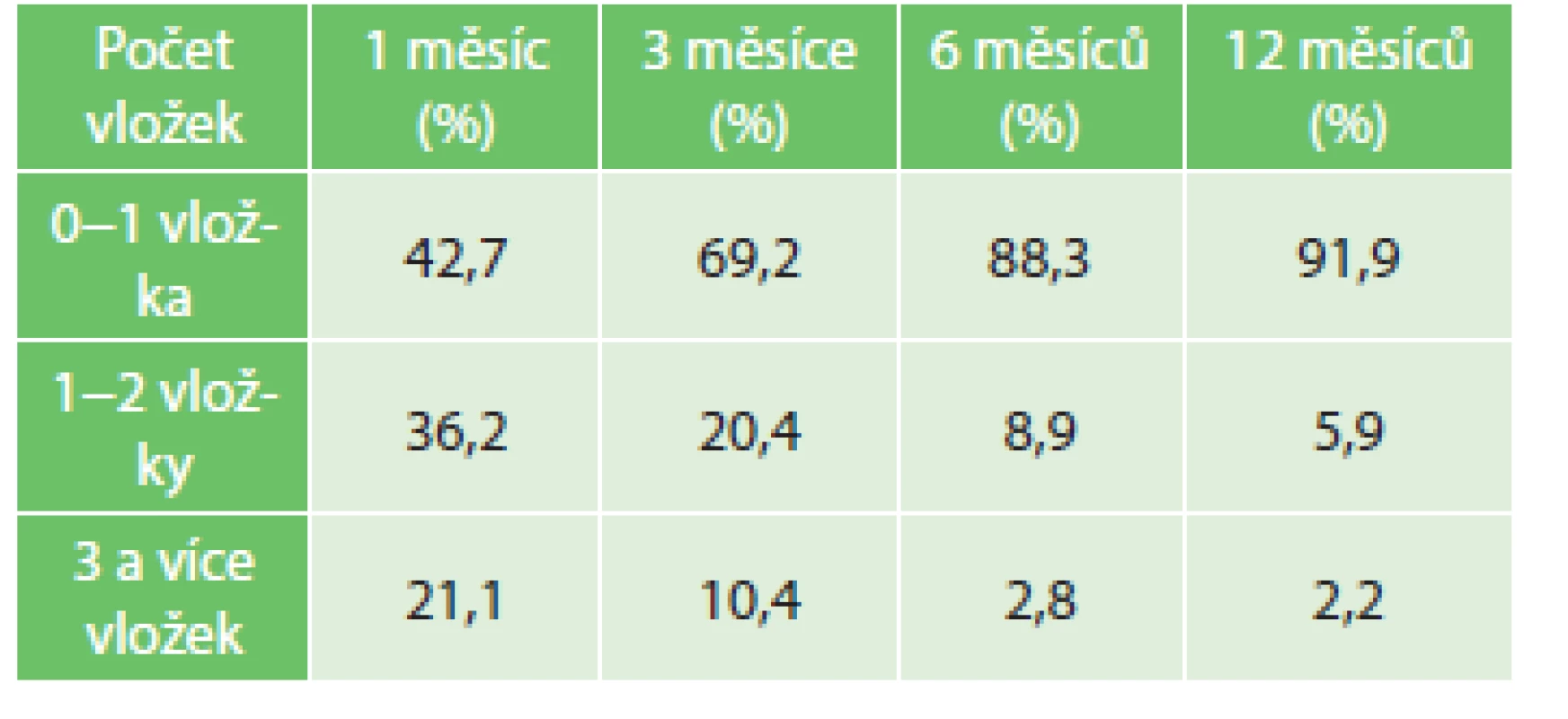
Tab. 4. Vyhodnocení erektilní funkce po 1, 3, 6 a 12 měsících po operaci, n=447 Tab. 4: Evaluation of erectile function after 1, 3, 6 and 12 months from the surgery, n=447 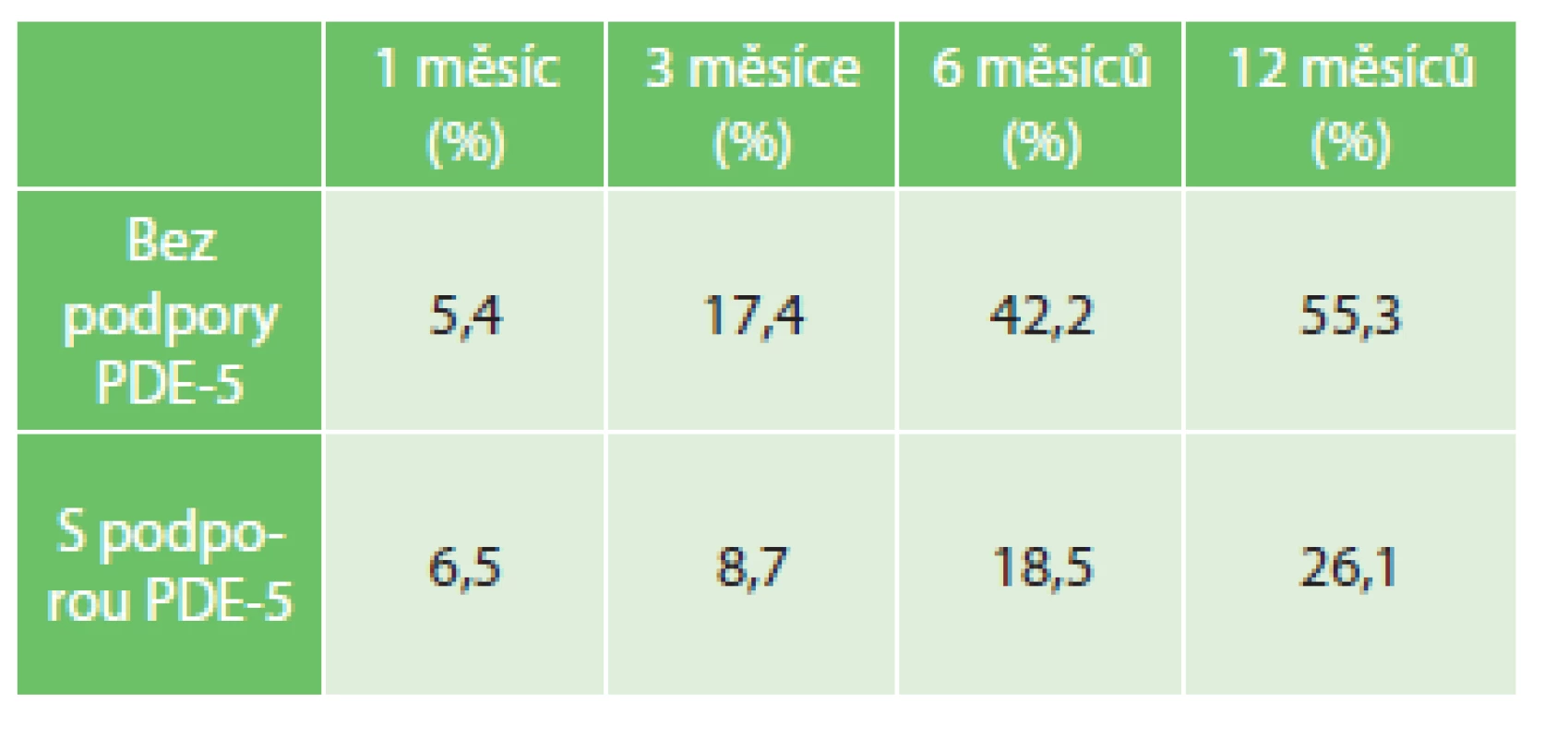
Tab. 5. Perioperační komplikace dle Clavien-Dindo klasifikace, n=1500 Tab. 5: Perioperative complications according to the Clavien-Dindo classification, n=1500 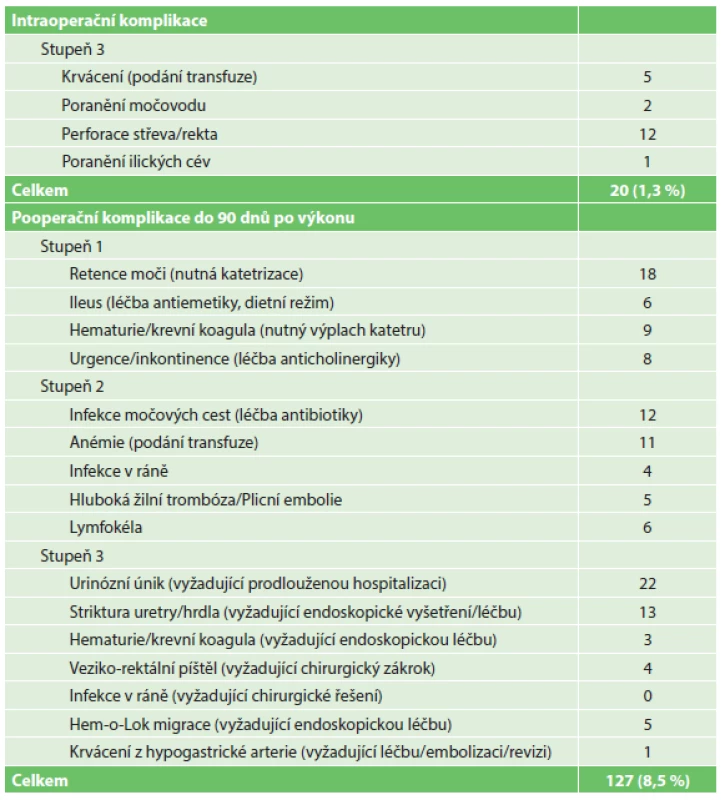
Medián délky operace byl 124 minut (76−352), operační čas se zkracoval s rostoucím počtem výkonů. Z důvodu kritické chyby robotického systému jsme u 3 (0,2 %) pacientů nemohli pokračovat ve výkonu, u jednoho pacienta jsme výkon dokončili laparoskopicky, u druhého otevřeným přístupem, u třetího pacienta jsme výkon odložili.
U 880 (58,7 %) mužů byla z předoperační biopsie prostaty hodnota GS ≤6, naopak u 1150 (76,7 %) pacientů jsme stanovili z operačního preparátu hodnotu GS ≥7. Patologické stadium lokálně ohraničeného karcinomu prostaty jsme diagnostikovali u 1125 (75 %) mužů, u 363 (24,2 %) pacientů pak stadium lokálně pokročilého karcinomu. U 12 (0,8 %) pacientů jsme v operačním preparátu prostaty nepotvrdili histopatologickým vyšetřením diagnózu karcinomu.
Pánevní lymfadenektomii jsme z důvodu vysoce rizikového karcinomu prostaty indikovali u 171 (11,4 %) mužů, uzlinové metastázy jsme z nich zaznamenali u 36 (21,1 %) pacientů.
Kontinenci moče v období do 1 roku po operaci jsme dotazníkovou formou vyhodnotili u 1218 (81,2 %) pacientů v souboru. Kontinence byla definována jako schopnost udržet moč bez potřeby vložky nebo s jednou „pojistnou“ vložkou. Rok po operaci bylo bez potřeby vložky nebo s jednou pojistnou vložkou celkem 1119 (91,9 %) mužů.
Vyhodnocení pooperační erektilní funkce bylo obtížné vzhledem k věkové heterogenitě souboru, u 447 (29,8 %) mužů jsme použili Dotazník sexuálního zdraví muže (IIEF-5). Rok po operaci bylo erekce dostatečné k pohlavnímu styku bez nutnosti podpůrné terapie schopno 247 (55,3 %) mužů.
Intraoperační a pooperační komplikace jsme vyhodnotili dle Clavien-Dindo klasifikace [3,4]. Intraoperační komplikace byly výlučně 3. stupně. Nejčastěji se jednalo o poranění rekta nebo střeva, močovodu a ilických cév u 15 (1,0 %) pacientů, krvácení s nutným převodem transfuze jsme zaznamenali u 5 (0,3 %) mužů. Z celkem 11 poranění rekta jsme 9 případů zaznamenali při operacích na robotickém systému da Vinci Standard, dvě poranění při použití systému da Vinci Si HD. Osm z těchto poranění jsme zjistili peroperačně při tlakové zkoušce rekta, komplikaci jsme řešili sešitím postižené části rekta ve dvou vrstvách. Tři poranění rekta s následnou tvorbou píštěle jsme diagnostikovali v pooperačním období, nejčastěji zjištěním plynu nebo příměsí stolice v močovém katétru. U těchto pacientů jsme založili odlehčovací kolostomii, s odstupem 3–6 měsíců řešili píštěl z perineálního přístupu a 3 měsíce poté zanořili kolostomii. U jednoho pacienta jsme při zavádění portu poranili střevo, pacienta jsme 1. pooperační den revidovali pro ileózní stav a střevo sešili ve dvou vrstvách. Komplikace do 3 měsíců po operaci byly nejčastěji 3. stupně, především jsme zaznamenali urinózní únik vyžadující prodlouženou hospitalizaci a strikturu hrdla léčenou endoskopickým výkonem. Především počet pacientů s urinózním únikem výrazně poklesl při použití V-Locu při šití veziko-uretrální anastomózy, steh používáme od roku 2012. V 1. a 2. stupni převažovaly retence moče léčené přechodnou katetrizací, hematurie a tvorba koagul s nutnými výplachy katétru, infekce močových cest léčené antibiotickou terapií a anémie léčené krevními převody.
DISKUZE
Operační technika radikální prostatektomie prošla za posledních 30 roků četnými modifikacemi. Standardní operační postup retropubické radikální prostatektomie popsal poprvé Walsh v roce 1979 [5]. První laparoskopickou radikální prostatektomii provedl Schuessler v roce 1997 [6]. O rozvoj laparoskopické prostatektomie se zásadně zasloužili Guillonneau a Abbou [7−8]. První roboticky asistovanou radikální prostatektomii provedl Abbou v roce 2000 [9].
Pánevní lymfadenektomii podstoupilo v našem souboru 171 mužů, metastázy jsme nalezli u 36 (21,1 %) pacientů. Freicke et al. [10], Ham et al. [11], a Menon et al. [12] vyhodnotili patologické nálezy ze zevních a vnitřních ilických a obturátorových uzlin odstraněných při pánevní lymfadenektomii u pacientů s karcinomem prostaty a nalezli metastázy u 11−24 % pacientů, v závislosti na různých charakteristikách souborů.
Kontinenci moče rok po operaci jsme vyhodnotili u 1218 (81,2 %) pacientů, bez potřeby vložky nebo s jednou pojistnou vložkou bylo 1119 (91,9 %) mužů. Výskyt inkontinence moče je ovlivněn předoperační charakteristikou pacienta, zkušenostmi chirurga a chirurgickou technikou. Ficarra et al. ve své rozsáhlé metaanalýze stanovili výskyt inkontinence moče 12 měsíců po operaci mezi 4−31 % s definicí „žádná vložka“, resp. 8−11 % s definicí „vložka pro jistotu“. Výskyt inkontinence moče po 24–36 měsících stanovili v rozmezí 5−12 % [13]. Studie hodnotící rizikové faktory ukázaly, že pooperační inkontinenci moče významně ovlivňují věk pacienta, BMI, komorbidity a objem prostaty [14−18]. Především objem prostaty nad 70 g je spojován s významně vyšším rizikem inkontinence moče po radikální prostatektomii [16−18].
Pooperační návrat erekce jsme vyhodnotili u 447 pacientů, 247 (55,3 %) mužů bylo 12 měsíců po operaci schopno pohlavního styku. Ficarra et al. stanovují výskyt erektilní dysfunkce 12 a 24 měsíců po nervy šetřícím výkonu v rozmezí 10−46 %, resp. 6−37 %. Podrobné rozbory zahrnující jednostranné i bilaterálně nervy šetřící postupy ukázaly obnovení erekce v období 3, 6, 12 a 24 měsíců po operaci u 32 %, 53 %, 69 % (62−90 %), resp. 63 % pacientů [19]. Rozporuplné výsledky jsou udávány u mužů s vyšším BMI, např. Wiltz a kol. zaznamenali výrazně nižší návrat pooperační erekce u obézních mužů po 12 a 24 měsících po operaci [19−20]. Menon a kol. srovnáním onkologických a funkčních výsledků robotické a otevřené retropubické radikální prostatektomie prokázali, že robotický postup je bezpečný a přináší výrazně nižší krevní ztráty. Průkopníkem robotické operativy v USA byl právě Menon, který popsal techniku VIP (Vattikuti Institute Prostatectomy) a stejně tak velmi elegantní metodu preparace nervově-cévního svazku v oblasti apexu prostaty (pro takto ošetřenou prostatickou fascii se někdy používá termín Afroditin závoj) [21]. Po tomto typu výkonu udávají autoři zachovanou erekci až v 97 % [22]. Broul a kol. prokázali ve svém souboru rok po operaci návrat k předoperačním hodnotám IIEF skóre v závislosti na typu provedené operace [23].
Intraoperační komplikace jsme zaznamenali u 1,3 % operovaných, do 3 měsíců po operaci u 8,5 % pacientů. Agarwal et al. analyzovali více než 320 komplikací u velkého souboru 3300 pacientů. Prokázali, že předoperační hodnota PSA a nemoci srdce a cév byly nezávislé prediktory nechirurgických komplikací jakéhokoli stupně, zatímco věk, GS skóre z biopsie, hyperlipidemie a refluxní choroba souvisely s vyšším výskytem chirurgických komplikací jakéhokoli stupně [24]. Největší studie uvádějí výskyt komplikací roboticky asistované prostatektomie mezi 8−20 %, pro nechirurgické komplikace mezi 5−9 %, pro chirurgické komplikace mezi 1,4−4,7 %, pro krevní převody pak pod 2 % [25−29].
Onkologické a funkční výsledky roboticky asistované radikální prostatektomie jsou plně srovnatelné s ostatními chirurgickými technikami operace prostaty (otevřená, laparoskopická), což bylo prokázáno na velkých souborech pacientů [30−32].
V následujících letech můžeme očekávat rychlý rozvoj nových robotických center. Tomu bude napomáhat také stoupající zájem našich pacientů o využití robotické technologie při operačních zákrocích a konečně také vstup konkurence do tohoto odvětví chirurgie, což nepochybně přinese rychlejší rozvoj robotický asistovaných operačních technik.
ZÁVĚR
Roboticky asistovaná radikální prostatektomie je minimálně invazivní, spolehlivá a bezpečná metoda léčby indikovaných pacientů s karcinomem prostaty. Onkologické a funkční výsledky jsou plně srovnatelné s ostatními chirurgickými technikami operace prostaty.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Jiří Kočárek, Ph.D.
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: jiri.kocarek@uvn.cz
Zdroje
1. Uroweb.cz
2. Kočárek J, Belej K, Chmelík F, et al. Nervy šetřící roboticky asistovaná antegrádní radikální prostatektomie se šetřením prostatické fascie (Afroditina závoje). Ces Urol 2014;18(Suppl 1):58.
3. Dindo D, Demartines N, Clavien PA. Classification of surgical complications. Ann Surg 2004;240 : 205−13.
4. Clavien PA, Barkun J, Oliveira ML, et al. The Clavien-Dindo classification of surgical complications: five year experience. Ann Surg 2009;250 : 187−96.
5. Reiner WG, Walsh PC. An anatomical approach to the surgical management of the dorsal vein and Santorini´s plexus during radical retropubic surgery. J Urol. 1979;121 : 198−200.
6. Schuessler WW, Schulman PG, Clayman RV, et al. Laparoscopic radical prostatectomy: initial short-term experience. Urology 1997;50 : 854−7.
7. Guillonneau B, Vallancien G. Laparoscopic radical prostatectomy: initial experience and preliminary assessment after 65 operations. Prostate 1999;39 : 71−5.
8. Abbou CC, Salomon L, Hoznek A, et al. Laparoscopic radical prostatectomy: preliminary results. Urology 2000;55 : 630−4.
9. Abbou CC, Hoznek A, Salomon L, et al. Remote laparoscopic radical prostatectomy carried out with a robot. Report of a case. Prog Urol 2000;10 : 520−3.
10. Feicke A, Baumgartner M, Talimi S, et al. Robotic-assisted laparoscopic extended pelvic lymph node dissection for prostate cancer: surgical technique and experience with the first 99 cases. Eur Urol 2009; 55 : 876−84.
11. Ham WS, Park SY, Rha KH, et al. Robotic radical prostatectomy for patients with locally advanced prostate cancer is feasible: results of a single-institution study. J Laparoendosc Adv Surg Tech A 2009;19 : 329−32.
12. Menon M, Shrivastava A, Bhandari M, et al. Vattikuti Institute prostatectomy: technical modifications in 2009. Eur Urol 2009;56 : 89−96.
13. Ficarra V, Novara G, Rosen R, et al. Systematic review and meta-analysis of studies reporting urinary continence recovery after robot-assisted radical prostatectomy. Eur Urol 2012;62 : 405−17.
14. Novara G, Ficarra V, D’Elia C, et al. Evaluating urinary continence and preoperative predictors of urinary continence after robot assisted laparoscopic radical prostatectomy. J Urol 2010;184 : 1028−33.
15. Shikanov S, Desai V, Razmaria A, et al. Robotic radical prostatectomy for elderly patients: probability of achieving continence and potency 1 year after surgery. J Urol 2010;183 : 1803−7.
16. Link BA, Nelson R, Josephson DY, et al. The impact of prostate gland weight in robot assisted laparoscopic radical prostatectomy. J Urol 2008;180 : 928−32.
17. Skolarus TA, Hedgepeth RC, Zhang Y, et al. Does robotic technology mitigate the challenges of large prostate size? Urology 2010;76 : 1117−21.
18. Boczko J, Erturk E, Golijanin D, et al. Impact of prostate size in robot-assisted radical prostatectomy. J Endourol 2007;21 : 184−8.
19. Ficarra V, Novara G, Ahlering T, et al. Systematic review and meta-analysis of studies reporting potency rates after robot-assisted radical prostatectomy. Eur Urol 2012;62 : 418−30.
20. Wiltz AL, Shikanov S, Eggener SE, et al. Robotic radical prostatectomy in overweight and obese patients: oncological and validated functional outcomes. Urology 2009;73 : 316−22.
21. Menon M, Tewari A, Peabody JO, et al. Vattikuti Institute prostatectomy, a technique of robotic radical prostatectomy for management of localized carcinoma of the prostate: experience of over 1100 cases. Urol Clin North Am 2004;31 : 701−7.
22. Menon M, Kraul S, Bhandari A, et al. Potency following robotic radical prostatectomy: a questionnaire based analysis of outcomes after conventional nerve sparing and prostatic fascia sparing techniques. J Urol 2005;174 : 2291−6.
23. Broul M, Štrbavý M, Skála P. Hodnocení erektilní dysfunkce po roboticky asistované radikální prostatektomii. Ces Urol 2014;18 : 324–33.
24. Agarwal PK, Sammon J, Bhandari A, et al. Safety profile of robot assisted radical prostatectomy: a standardized report of complications in 3317 patients. Eur Urol 2011;59 : 684−98.
25. Novara G, Ficarra V, Rosen R, et al. Systematic review and meta-analysis of perioperative outcomes and complications after robot-assisted radical prostatectomy. Eur Urol 2012;62 : 431−52.
26. Kowalczyk KJ, Levy JM, Caplan CF, et al. Temporal national trends of minimally invasive and retropubic radical prostatectomy outcomes from 2003 to 2007: results from the 100% Medicare sample. Eur Urol 2012;61 : 803−9.
27. Trinh Q-D, Sammon J, Sun M, et al. Perioperative outcomes of robot assisted radical prostatectomy compared with open radical prostatectomy: results from the Nationwide Inpatient Sample. Eur Urol 2012;61 : 679−85.
28. Schmitges J, Trinh Q-D, Abdollah F, et al. A population-based analysis of temporal perioperative complication rates after minimally invasive radical prostatectomy. Eur Urol 2011; 60 : 564−71.
29. Doležel J, Tvarůžek J, Staník M, et al. Časné zkušenosti s roboticky asistovanou laparoskopickou radikální prostatektomií - prvních 153 pacientů. Ces Urol 2009;13 : 168–77.
30. Haglind E, Carlsson S, Stranne J, et al. Urinary incontinence and erectile dysfunction after robotic versus open radical prostatectomy: a prospective, controlled, nonrandomised trial. Eur Urol 2015;68 : 216−25.
31. Diaz M, Peabody JO, Kapoor V, et al. Oncologic outcomes at 10 years following robotic radical prostatectomy. Eur Urol 2015;67 : 1168−76.
32. Abdollah F, Sood A, Sammona JD, et al. Long-term cancer control outcomes in patients with clinically high-risk prostate cancer treated with robot-assisted radical prostatectomy: results from a multi-institutional study of 1100 patients. Eur Urol 2015;68 : 497−505.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Aneuryzma vena poplitea
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2017 Číslo 2- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- Robotická abdominální chirurgie
- Praktický průvodce pro úspěšný rozvoj programu robotické břišní chirurgie: cesta k realizaci
- Robotická chirurgie v gynekologii
- Uplatnění robotického systému da Vinci v cévní chirurgii
- Může robotická asistence při chirurgické léčbě karcinomu rekta zlepšit kvalitu totální mezorektální excize?
- Roboticky asistovaná radikální prostatektomie – výsledky u 1500 operací
- Vzácné případy napodobující akutní apendicitidu: tři kazuistiky a přehled literatury
- Aneuryzma vena poplitea
- Resekce sterna pro metachronní metastázu karcinomu ledviny
- Pracovní dny Koloproktologické sekce ČCHS ČLS JEP – Praha
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Roboticky asistovaná radikální prostatektomie – výsledky u 1500 operací
- Aneuryzma vena poplitea
- Robotická chirurgie v gynekologii
- Uplatnění robotického systému da Vinci v cévní chirurgii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



