-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hodnotenie rizika osteoporózy u pacienta s diabetes mellitus 2. typu – keď meranie kostnej hustoty nepostačuje
Assessment of the osteoporosis risk in patients with type 2 diabetes mellitus – when bone mineral density measurement is not sufficient
Introduction: Osteoporosis is an increasingly widespread disease, as well as diabetes mellitus. It is now accepted that osteoporotic fractures are a serious co-morbidity and complication of diabetes. The risk of fracture is elevated in patients with Type 1 Diabetes (T1DM), in which bone mineral density is reduced, but also in Type 2 Diabetes (T2DM) patients, in which is the change of bone quality. Objective: To determine changes in bone mineral density (BMD) in patients with T1DM and T2DM, and to compare these changes with the control group without diabetes. Patients and methods: We analyzed a cohort of postmenopausal women with diabetes and a matched control group. The cohort consisted of 145 women, 76 of whom had diabetes mellitus (25 with T1DM, 51 with T2DM), and 69 were without glucose metabolism. For all patients, central bone density (spinal and lumbar spine) was tested by DXA methodology, glycemic control parameters were assessed, and anthropometric parameters were measured. Bone quality was analyzed using TBS software. We then processed the results statistically. Results: In T1DM was the BMD significantly (p = 0.01) lower than in control group (LS: 0.71 ± 0.13 g/cm2 vs. 0.98 ± 0.13 g/cm2; hip: 0.61 ± 0.10 g/cm2 vs. 0.81 ± 0.13 g/cm2). Patients with T2DM had a higher BMD than patients with T1DM (LS: 0.91 ± 0.16 g/cm2 vs. 0.71 ± 0.13 g/cm2; hip: 0.79 ± 0.17 g/cm2 vs. 0.61 ± 0.13 g/cm2). There was no difference between BMD in T2DM versus the control group. Patients with T1DM had a higher incidence of osteoporosis (35 % versus 11 %) compared to patients with T2DM. In diabetes with T2DM up to 76 % had osteopenia. Conclusion: We confirmed that postmenopausal women with T1DM have significantly reduced bone mineral density compared to the control group. Patients with T2DM have higher BMD than T1DM, results of BMD are comparable to non-diabetic population. This fact makes it difficult to identify risk groups (for osteoporotic fractures) in T2DM. Therefore, other modalities, to improve the risk assessment of osteoporosis in T2DM, are discussed. One of them is the combination of densitometry and trabecular bone score.
Keywords:
bone quality – diabetes mellitus – fractures – glycemic compensation – osteoporosis
Autoři: Peter Jackuliak; Magdaléna Kovářová; Martin Kužma; Juraj Payer
Působiště autorů: V. interná klinika LF UK a UNB, Nemocnica Ružinov, Bratislava
Vyšlo v časopise: Forum Diab 2021; 10(1): 10-16
Kategorie: Prehľadové práce
Souhrn
Úvod: Osteoporóza je čoraz rozšírenejším ochorením, rovnako ako diabetes mellitus (DM). V súčasnosti je už akceptovaný fakt, že osteoporotické zlomeniny sú závažnou komorbiditou a komplikáciou DM. Riziko fraktúr je zvýšené jednak u pacientov s DM 1. typu (DM1T), u ktorých je znížená kostná denzita, avšak aj u pacientov s DM 2. typu (DM2T), a to napriek normálnym hodnotám kostnej denzity. Cieľ: Zistiť zmeny kostnej denzity u pacientok s DM1T a DM2T a porovnať s kontrolnou skupinou bez poruchy metabolizmu sacharidov. Súbor a metodika: Analyzovali sme kohortu postmenopauzálnych žien s DM a matchovanou kontrolnou skupinou. Súbor tvorilo 145 žien, pričom 76 malo DM (25 malo DM1T, 51 malo DM2T) a 69 žien bolo bez poruchy metabolizmu glukózy. U všetkých pacientok bola vyšetrená centrálna kostná denzita (v oblasti chrbtice a bedra) metodikou DXA, boli vyšetrené parametre glykemickej kompenzácie, boli zmerané antropometrické parametre. Následne sme výsledky štatisticky spracovali. Výsledky: Hodnota kostnej denzity bola u DM1T signifikantne (p = 0,01) nižšia oproti kontrolnej skupine v oblasti chrbtice (0,71 ± 0,13 g/cm2 vs 0,98 ± 0,13 g/cm2) aj v oblasti bedra (0,61 ± 0,10 g/cm2 vs 0,81 ± 0,13 g/cm2). Pacientky s DM2T mali vyššiu hodnotu BMD oproti pacientkam s DM1T (LS 0,91 ± 0,16 g/cm2 vs 0,71 ± 0,13 g/cm2; bedro: 0,79 ± 0,17 g/cm2 vs 0,61 ± 0,13 g/cm2). Rozdiel v BMD pacientok s DM2T oproti kontrolnej skupine bol nesignifikantný. Pacientky s DM1T mali oproti pacientkam s DM2T vyšší výskyt osteoporózy (35 % vs 11 %). U diabetičiek s DM2T až 76 % tvorili práve pacientky s osteopéniou. V kontrolnej skupine až 65 % pacientok nemalo ani osteoporózu a ani osteopéniu, 32 % pacientok malo osteopéniu a 3 % osteoporózu. Záver: Postmenopauzálne ženy s DM1T majú výrazne zníženú kostnú denzitu oproti kontrolnej skupine. Pacientky s DM2T majú vyššie hodnoty BMD než u DM1T porovnateľné s nediabetickou populáciou. Tento fakt sťažuje identifikáciu rizikových skupín diabetikov s DM2T. Preto sa v klinickej praxi diskutujú ďalšie modality na zlepšenie hodnotenia rizika osteoporózy u DM2T, jedným z nich je kombinácia denzitometrie a stanovenia trabekulárneho kostného skóre (TBS).
Klíčová slova:
diabetes mellitus – fraktury – glykemická kompenzácia – kvalita kosti – osteoporóza
Úvod
Osteoporóza a metabolické ochorenia kostí sa považujú za komorbidity, ktoré sa často vyskytujú u pacientov s diabetes mellitus (DM). Podľa niektorých údajov je osteoporóza jednou z chronických komplikácií DM. Tak samotný DM ako aj diabetické komplikácie ovplyvňujú kosť a vedú ku kostným zmenám [1,2]. U oboch typov DM (1. aj 2. typ – DM1T, DM2T) je dokázaný zvýšený výskyt osteoporotických fraktúr, čo môže tiež ovplyvňovať morbiditu a mortalitu, ako aj kvalitu života diabetikov [3,4].
U diabetikov je možné nájsť rôzne typy metabolického postihnutia kostí, okrem osteoporózy aj osteomaláciu, osteopetrózu či osteodystrofiu. Typické komplikácie nedostatočne kontrolovaného DM postihujúce skelet sú syndróm diabetickej nohy a Charcotova neuroartropatia, ktoré vedú k vysokému počtu chirurgických intervencií u diabetikov a častokrát aj amputáciám [5–7]. Avšak fraktúry v dôsledku nízkej kostnej denzity (fragility fractures) sa stali tiež často pozorovanou komplikáciou DM [8].
V klinickom manažmente osteoporózy je základom včasná identifikácia rizikových pacientov. Zlatým štandardom v diagnostike osteoporózy je denzitometrické stanovenie hodnoty kostnej hustoty, vyjadrenej ako T-skóre [9]. Preto sme sa v našej práci zamerali na hodnotenie zmien kostnej hustoty u diabetikov.
Vlastná práca
V našej prierezovej štúdii sme sa zamerali na zistenie zmien kostnej hustoty u pacientov s DM1T aj DM2T a porovnali sme tieto zmeny s nediabetickou populáciou. Ciele boli nasledovné:
- zistiť zmeny kostnej denzity u pacientok s DM1T a porovnať tieto zmeny s kontrolnou skupinou t. j. pacientmi bez DM či poruchy glukózovej tolerancie
- zistiť zmeny kostnej denzity u pacientok s DM2T a porovnať tieto zmeny s kontrolnou skupinou t. j. pacientmi bez DM či poruchy glukózovej tolerancie
- porovnať zmeny kostnej denzity u pacientok s DM1T so zmenami u pacientok s DM2T
Súbor a metodika
Súbor tvorilo 145 žien, pričom 76 malo DM (25 malo DM1T, 51 malo DM2T) a 69 žien bolo bez poruchy metabolizmu glukózy (kontrolná skupina). Základnú charakteristiku celého súboru uvádza tab. 3. Zo všetkých skupín boli vylúčené pacientky s endokrinnými ochoreniami (poruchy funkcie štítnej žľazy, či poruchy prištítnych teliesok), chronickými gastrointestinálnymi ochoreniami (malabsorpcia, nešpecifické zápalové ochorenia čreva), známym chronickým ochorením obličiek a pacientky dlhodobo imobilizované. Jednalo sa výlučne o pacientky, u ktorých nebola v minulosti (v anamnéze) zistená osteopénia či osteoporóza. Pacientky s DM a ani pacientky v kontrolnej skupine neužívali žiadne suplementy vitamínu D a vápnika.
Kostná denzita bola meraná DXA metodikou v štandardných oblastiach (lumbálna chrbtica a proximálny femur) pomocou denzitometra firmy Hologic, typ Discovery. Výskyt osteopénie alebo osteoporózy sa hodnotil podľa štandardne používanej WHO definície [10].
Diagnóza diabetes mellitus bola zistená z dokumentácie a bola prehodnotená podľa American Diabetes Association 2015 kritérií (tab. 1) na základe údajov o glykémii a glykovanom hemoglobíne v čase stanovenia diagnózy [11].
Pacienti v kontrolnej skupine boli hodnotení aj na prediabetické stavy (tab. 2). V prípade, že mali prítomnú poruchu glukózovej tolerancie či iný prediabetický stav, boli vylúčení zo sledovania.
Tab. 1. Kritéria na diagnostiku diabetes mellitus. Upravené podľa [11] ![Kritéria na diagnostiku diabetes mellitus. Upravené podľa [11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/7da8a5a937ac4710c60113f59fc790fa.jpeg)
Tab. 2. Kritériá na diagnostiku rizikových prediabetických stavov 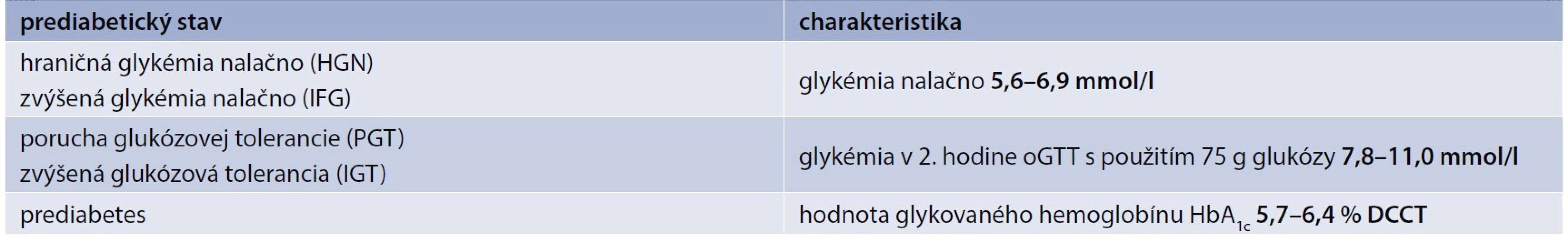
IFG – zvýšená glykémia nalačno/Impaired Fasting Glucose, IGT – zvýšená glukózová tolerancia/Impaired Glucose Tolerance, oGTT – orálny glukózo-toleračný test Na vyšetrenie biochemických parametrov sme odobrali venóznu krv. Odbery krvi sme realizovali za štandardných podmienok ráno nalačno. Ako laboratórium sme využili MEDIREX a.s. Glykovaný hemoglobín (HbA1c) bol vyšetrovaný chromatograficky, metódou HPCL (High-Performance Liquid Chromatography) [12,13]. Sérová hladina glykémie bola vyšetrovaná enzymatickou metodikou s využitím hexokinázy.
Na štatistické spracovanie sme použili štatistický program IBM SPSS Statistics 19 software. Pre deskripcii súboru sme použili základné štatistické metódy – medián, aritmetický priemer, štandardnú odchýlku, minimum, maximum, konfidenčné intervaly. Pre porovnávanie základných premenných medzi skupinami sme použili Studentov párový t-test u číselných premenných a χ2-test pre kategorické premenné. Pre porovnávanie spojitých premenných (ako BMD) sme používali nepárový t-test, jednosmerný ANOVA test. Za signifikantný rozdiel sa považovala pravdepodobnosť nulovej hypotézy < 5 % (hladina štatistickej významnosti p < 0,05).Na vyhodnotenie korelácie medzi parametrami sme využili Pearsonov alebo Spearmanov model.
Výsledky
Súbor tvorilo 25 pacientok s DM1T, 51 pacientok s DM2T. V kontrolnej skupine bolo zaradených 69 žien bez DM či iného prediabetického stavu. Ako vidieť z tab. 3, pacientky s DM2T boli v priemere o 2,8 roka staršie než pacientky s DM1T. Hodnota BMI bola vyššia u pacientok s DM2T. Výskyt fraktúr v osobnej anamnéze v skupine pacientok s DM bol 10,5 %, jednalo sa najmä o fraktúry zápästia (4), fraktúr krčka femuru (1) a fraktúru členka (3). V kontrolnej skupine bol výskyt fraktúr 2,9 %. Rozdiel ale nevyšiel štatisticky signifikantný. Jednalo sa len o anamnestický údaj fraktúry v osobnej anamnéze, fraktúry neboli verifikované inými diagnostickými metódami. Čo sa týka dĺžky trvania DM, snažili sme sa vytvoriť skupiny pacientok s pomerne podobnou dĺžkou trvania DM. Priemerné trvanie DM2T (14,9 rokov) bolo počítané na základe dátumu stanovenia diagnózy, avšak je pravdepodobné, že minimálne o 6 až 12 mesiacov skôr mali pacientky už nepoznaný DM. Glykemická kompenzácia pacientov bola hraničná, avšak podľa posledných doporučení s ohľadom na individualizáciu kompenzácie pacientov (dĺžka trvania DM, komorbidity, vek a pod) mohla byť u pacientov hodnotená ako uspokojivá.
Hodnota kostnej hustoty (graf) bola štatisticky signifikantne nižšia u pacientok s DM1T v porovnaní s pacientkami s DM2T (p = 0,01) ako aj s kontrolnou skupinou bez DM (p = 0,007 v oblasti HIP, resp. p = 0,01 v LS oblasti). Hodnoty kostnej hustoty pacientok s DM2T boli tiež nižšie ako v kontrolnej skupine, aj keď tento vzťah nebol štatisticky signifikantný.
Najvyšší výskyt osteoporózy definovanej podľa T-skóre bol u pacientok s DM1T (tab. 4). U oboch skupín pacientok s DM bol vysoký výskyt osteopénie. Najmä v skupine s DM2T mali pacientky hlavne osteopéniu.
Tab. 3. Základná charakteristika súboru 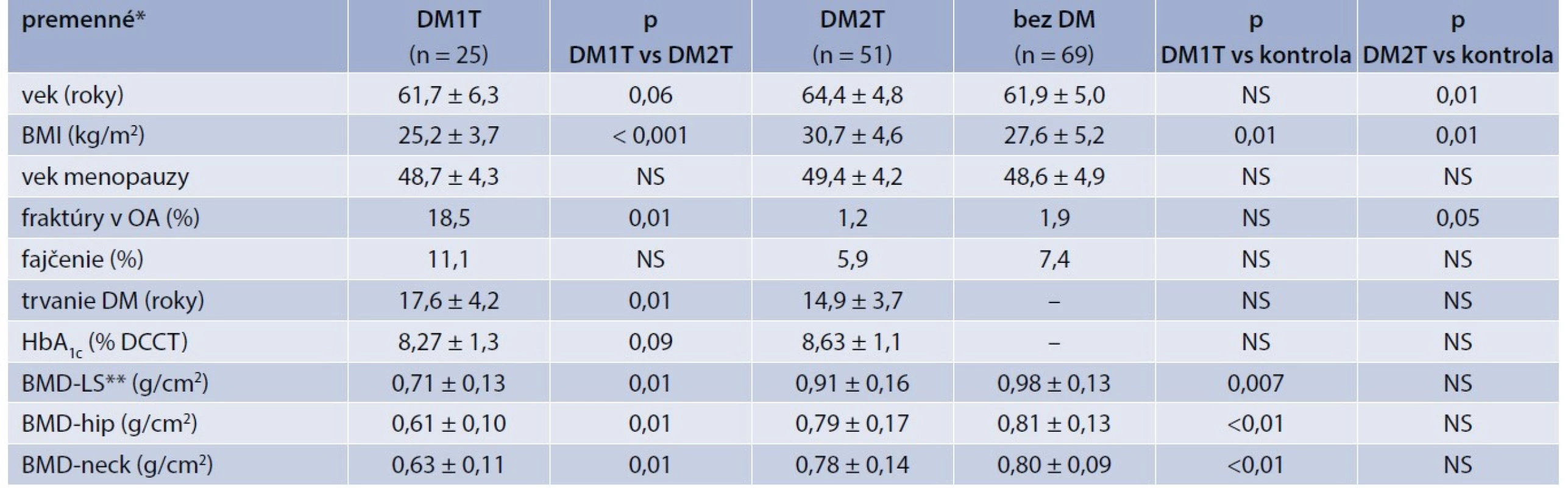
* mean ± SD ** BMD v oblasti L2–4, OA – osobná anamnéza Tab. 4. Výskyt osteoporózy a osteopénie podľa WHO klasifikácie a T-skóre 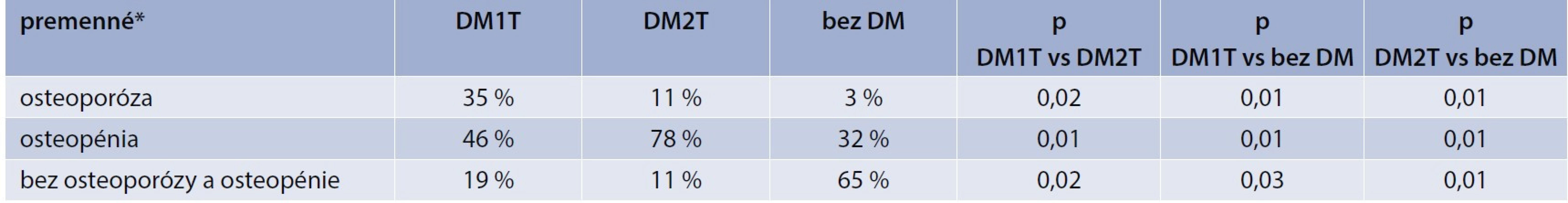
Graf 1. Kostná denzita u jednotlivých skupín 
Vyhodnotenie
V súbore sme zistili, že pacientky s DM1T majú nižšie hodnoty kostnej hustoty oproti pacientkam s DM2T ako aj oproti kontrolnej skupine. Tým je vysvetliteľné vyššie riziko osteoporózy a fraktúr u DM1T.
Pacientky s DM2T majú vyššie hodnoty BMD než u DM1T. Tieto hodnoty sú porovnateľné s kontrolnou skupinou, u ktorej rozdiel medzi DM2T a pacientkami bez DM je nesignifikantný. Hodnoty „normálneho“ BMD vedú k problémovej identifikácii rizikových skupín u pacientok s DM2T.
Pacientky s DM1T mali oproti pacientkam s DM2T vyšší výskyt osteoporózy (35 % vs 11 %). U diabetičiek s DM2T až 76 % tvorili práve pacientky s osteopéniou. V kontrolnej skupine až 65 % pacientok nemalo ani osteoporózu a ani osteopéniu, 32 % pacientok malo osteopéniu a 3 % osteoporózu.
Diskusia
Nálezy zmien kostného metabolizmu u diabetikov sú nehomogénne, zhoda panuje len v tom, že tak u pacientov s DM1T ako aj DM2T je zvýšené riziko fraktúr. Najväčšie riziko majú postmenopauzálne ženy s DM. Hlavným poškodzujúcim mechanizmom je pokles kostnej formácie a znížený kostný obrat. Znížená koncentrácia inzulínu je tiež považovaná za nezávislý prediktor rizika fraktúr [14,15]. Inzulín spolu s amylínom majú anabolický efekt na kosť a ich pokles poškodzuje kostnú novotvorbu predovšetkým poklesom IGF1. Avšak DM2T, pri ktorom je kostná hmota naopak zvýšená, je paradoxne tiež asociovaný so zvýšením rizika fraktúr [2].
V našej práci sme dokázali výskyt zníženej kostnej denzity u pacientov s DM1T. Táto znížená kostná denzita predstavuje závažný rizikový faktor vzniku osteoporotickej fraktúry a nemala by byť prehliadaná. Poukázali sme hlavne na rozdiely v kostnej hustote u pacientov s DM1T a pacientov s DM2T. Našimi výsledkami zmenenej kostnej denzity sme chceli upozorniť na to, že v rámci komplexného metabolického manažmentu pacienta s DM1T (ale aj DM2T) treba myslieť aj na riziko osteoporózy a zvážiť ďalšie diagnostické, preventívne a eventuálne aj terapeutické opatrenia. Meranie BMD z DXA poskytuje robustný odhad rizika zlomenín aj vo všeobecnej (nediabetickej) populácii, pričom sa zvyšuje o 1,4 - až 2,6-násobok pri každom znížení BMD [16]. Denzitometrické vyšetrenie u diabetikov s DM1T je tým hlavným diagnostickým nástrojom na zistenie prítomnosti osteoporózy.
DM2T bol v minulosti považovaný za ochranný faktor osteoporózy, pretože u pacientov s DM2T je normálna až zvýšená kostná hustota (Bone Mineral Density – BMD). Hodnoty T-skóre sú o 0,3 až 0,8 SD vyššie než u nediabetikov (adjustované na vek a hmotnosť) [17]. Aj v našej práci mali pacientky s DM2T hodnoty BMD porovnateľné s nediabetickou populáciou. Pacientky s DM2T mali vyššiu hodnotu kostnej denzity než pacientky s DM1T [18]. Najviac pacientok malo BMD znížené do pásma osteopénie. Napriek týmto faktom a „dobrému“ BMD sa v štúdiách dokázalo zvýšené riziko osteoporotických fraktúr aj u pacientov s DM2T. Títo pacienti sú jednak vekovo starší, majú pridružené rizikové faktory a zvýšené riziko pádov. Zvýšená hmotnosť (Body Mass Index – BMI) sa považovala za ochranný faktor vzniku osteoporózy. Avšak aj to sa v súčasnosti prehodnocuje [19]. Výsledky štúdie GLOW preukázali, že BMI je signifikantne inverzne asociovaný so zlomeninami bedra, chrbtice a zápästia, avšak je signifikantne pozitívne asociovaný so zlomeninami členka, horných končatín, ramena a kľúčnej kosti, panvy a zlomeninami rebier [20].
V súčasnosti pozorujeme v osteológii snahu o komplexné hodnotenie rizika fraktúry, nakoľko viac ako polovica fraktúr vzniká u pacientov s hodnotou BMD v pásme osteopénie (stav charakteristický pre DM2T), čo ale ešte nie je indikácia k nasadeniu antiporotickej terapie. Svetová zdravotnícka organizácia vyvinula kalkulátor FRAX (Fracture Risk Assessment Tool), ktorý dokáže stanoviť absolútneho 10-ročné riziko fraktúry aj u diabetikov [21]. FRAX poskytuje možnosť výpočtu rizika aj bez použitia hodnoty BMD, čo je perspektívne využiteľné pri indikácii osteologického, ev. denzitometrického vyšetrenia aj pri manažmente pacientov s DM. FRAX čiastočne dokáže predpovedať zvýšené riziko zlomenín u diabetikov v porovnaní s nediabetickou populáciou. Problémom je ale u pacientov s DM2T, pretože FRAX nezohľadňuje DM2T ako rizikový faktor, a tak môže podhodnotiť riziko fraktúry [22,23]. Ako jedno z možných riešení sa diskutuje označenie rizikového faktora „reumatoidná artritída“ u všetkých pacientov s DM2T [24].
Z pohľadu rizika osteoporotickej fraktúry u pacienta s DM nemožno hodnotiť len jednu kvalitu – BMD a podľa nej usudzovať na úroveň rizika vzniku fraktúry. Kosť má aj charakteristickú štruktúru (architektúru) a tá je tvorená z komplikovaných organických a anorganických zlúčenín, ktoré podmieňujú biomechanické vlastnosti kosti. Limitáciou využitia BMD je nepomer medzi počtom pacientov s osteoporotickou fraktúrou a ich hodnotou BMD (čo preukázala štúdia EPISEM). Až 50 % pacientok s osteoporotickou fraktúrou má hodnotu T-skóre < -2,5 SD. Za hlavný dôvod, prečo je to tak, môžeme považovať fakt, že osteoporóza je multifaktorálnej genézy a zníženie kostnej denzity je len časťou celej patogenézy. Poškodenie mikroarchitektoniky kosti ako aj zmeny kvality kosti nevie denzitometria odhaliť [25].
Novou a v klinickej praxi dostupnejšou metodikou je Trabecular Bone Score (TBS), ktoré analyzuje farebnú – šedú úroveň textúry DXA skenov s využitím experimentálnych variogramov projekcií 2D-snímok a ktorá je zároveň schopná rozlíšiť dve 3D-mikroarchitektúry, ktoré vykazujú rovnakú kostnú denzitu (BMD), ale inú trabekulárnu charakteristiku. A práve TBS má dokázaný vzťah ku kostnej mikroarchitektonike. TBS má pozitívnu koreláciu s počtom trabekúl, ich konektivitou a naopak negatívne koreluje s priemerným počtom otvorom medzi kostnými trámcami. Čiže vyššia hodnota TBS znamená „hustejšiu“ mikroarchitektúru, lepšiu konektivitu trámcov s malými priestormi medzi trámcami, a tým lepšiu kvalitu kosti. Naopak nízka hodnota TBS znamená, že mikroarchitektonika je porušená a priestory medzi trámcami sú väčšie [26].
Zo súčasnej úrovne vedomostí je možné odporučiť stanovovanie TBS ako komplementárnu klinickú aplikáciu k denzitometrickému stanovovaniu BMD. Údaje o TBS-LS u DM1T sú len ojedinelé. U DM2T ale TBS je podstatne nižšie v porovnaní s kontrolami bez DM, dokonca aj po úprave na BMI. Zistilo sa, že TBS je silným prediktorom zlomeniny u žien s DM nezávisle od BMD (RR 1,27; 95% CI 1,10–1,46) [27].
Schéma. Algoritmus Bone and Diabetes Working Group of IOF pre diagnostiku osteoporózy u pacienta s DM. Upravené podľa [28] ![Schéma. Algoritmus Bone and Diabetes Working Group of IOF pre diagnostiku osteoporózy u pacienta s DM.
Upravené podľa [28]](https://pl-master.mdcdn.cz/media/image_pdf/b7c8de45452669a4954081b30a159aa4.jpeg?version=1628588335)
DXA – denzitometria, FRAX – nástroj pre výpočet rizika zlomenín/Fracture Risk Assessment Tool, TBS – trabekulárne kostné skóre/Trabecular Bone Score, VFA – hodnotenie vertebrálnych fraktúr/Vertebral Fracture Assessment
Pre diabetes špecifické rizikové faktory: trvanie DM > 5 rokov; liečba DM: inzulín, glitazóny, gliflozíny; HbA1c > 7 %; mikrovaskulárne komplikácie: periférna a autonómna neuropatia, retinopatia, nefropatiaZáver
Základným diagnostickým kritériom v osteológii je denzitometrické vyšetrenie alebo prítomnosť osteoporotickej fraktúry. Na identifikáciu rizika osteoporózy u diabetikov s DM2T avšak nepostačuje len zhodnotenie kostnej denzity. Napriek relatívne dobrým hodnotám BMD majú alterovanú kvalitu kosti, čo už v súčasnosti vieme identifikovať využitím tzv. TBS (schéma). [28].
Pri zistení osteoporózy je základom adekvátna suplementácia kalcia a vitamínu D. U zrejmej osteoporózy (T-skóre ≤ -2,5 SD) alebo prítomnej osteoporotickej fraktúry je indikovaná aj antiporotická liečba [29]. Podľa dostupných údajov bisfosfonáty a raloxifén sa javia ako účinné antiporotiká pre pacientov s DM [30]. Taktiež v súlade s výsledkami post-hoc analýzy štúdie DANCE (The Direct Assessment of Nonvertebral Fractures in Community Experience) je osteoanabolická liečba teriparatidom vhodná aj u diabetickej populácie [31].
Autori prehlasujú, že nemajú konflikt záujmov.
doc. MUDr. Peter Jackuliak, PhD., MPH | peter.jackuliak@fmed.uniba.sk | www.fmed.uniba.sk
Doručené do redakcie 13. 4. 2021
Prijaté po recenzii 26. 4. 2021
Zdroje
- Kurra S, Siris E. Diabetes and bone health: the relationship between diabetes and osteoporosis-associated fractures. Diabetes Metab Res Rev 2011; 27(5): 430–435. Dostupné z DOI: <http://dx.doi.org/10.1002/dmrr.1197>.
- Jackuliak P, Payer J. Osteoporosis, Fractures, and Diabetes. Int J Endocrinol 2014; 2014 : 820615. Dostupné z DOI: <http://dx.doi.org/10.1155/2014/820615>.
- Nazrun AS, Tzar MN, Mokhtar SA et al. A systematic review of the outcomes of osteoporotic fracture patients after hospital discharge: morbidity, subsequent fractures, and mortality. Ther Clin Risk Manag 2014; 10 : 937–48. Dostupné z DOI: <http://dx.doi.org/10.2147/TCRM.S72456>.
- Ferrari S. Diabetes and Bone. Calcif Tissue Int 2017; 100(2): 107–108. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–017–0234-y>.
- Carnevale V, Romagnoli E, D‘Erasmo E. Skeletal involvement in patients with diabetes mellitus. Diabetes Metab Res Rev 2004; 20(3): 196–204. Dopstupné z DOI: <http://dx.doi.org/10.1002/dmrr.449>.
- Hingorani A, LaMuraglia GM, Henke P et al. The management of diabetic foot: A clinical practice guideline by the Society for Vascular Surgery in collaboration with the American Podiatric Medical Association and the Society for Vascular Medicine. J Vasc Surg 2016; 63(2 Suppl): 3S-21S. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jvs.2015.10.003>.
- Vestergaard P, Rejnmark L, Mosekilde L. Diabetes and its complications and their relationship with risk of fractures in type 1 and 2 diabetes. Calcif Tissue Int 2009; 84(1): 45–55. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–008–9195–5>.
- Dytfeld J, Michalak M. Type 2 diabetes and risk of low-energy fractures in postmenopausal women: meta-analysis of observational studies. Aging Clin Exp Res 2017; 29(2): 301–309. Dostupné z DOI: <http://dx.doi.org/10.1007/s40520–016–0562–1>.
- The International Society for Clinical Densitometry (ISCD) Official Positions 2019 for Adults. 2019. Dostupné z WWW: <https://iscd.org/learn/official-positions/adult-positions>.
- Jackuliak P. Základné princípy osteoporózy. In: Payer J, Borovský M (eds). Osteoporóza u vybranných ochorení. Herba: Bratislava 2014 : 11–42. ISBN 9788089631193.
- [American Diabetes Association]. (2) Classification and Diagnosis of Diabetes. Diabetes Care 2015; 38(Suppl): S8-S16. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15-S005>.
- Nathan DM, Genuth S, Lachin J et al. [The Diabetes Control Complications Trial Research Group]. The Effect of Intensive Treatment of Diabetes on the Development and Progression of Long-Term Complications in Insulin-Dependent Diabetes Mellitus. N Engl J Med 1993; 329(14): 977–986. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199309303291401>.
- Rohlfing CL, Wiedmeyer HM, Little RR et al. Defining the relationship between plasma glucose and HbA(1c): analysis of glucose profiles and HbA(1c) in the Diabetes Control and Complications Trial. Diabetes Care 2002;25(2): 275–278. Dostupné z DOI: <http://dx.doi.org/10.2337/diacare.25.2.275.>.
- Pscherer S, Kostev K, Dippel FW et al. Fracture risk in patients with type 2 diabetes under different antidiabetic treatment regimens: a retrospective database analysis in primary care. Diabetes Metab Syndr Obes 2016; 9 : 17–23. Dostupné z DOI: <http://dx.doi.org/10.2147/DMSO.S101370>.
- Starup-Linde J, Vestergaard P. Diabetes and osteoporosis: cause for concern? Eur J Endocrinol 2015; 173(3): R93-R99. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-15–0155>.
- Johnell O, Kanis JA, Oden A et al. Predictive Value of BMD for Hip and Other Fractures. J Bone Miner Res 2005; 20(7): 1185–1194. Dostupné z DOI: <http://dx.doi.org/10.1359/JBMR.050304>.
- Melton LJ, Leibson CL, Achenbach SJ et al. Fracture risk in type 2 diabetes: update of a population-based study. J Bone Miner Res 2008; 23(8): 1334–1342. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.080323>.
- Jackuliak P, Payer J. Fracture risk in type 2 diabetes and trabecular bone score. Diabetes. 2014; 63(Suppl 1): A380.
- Compston JE, Watts NB, Chapurlat R et al. Obesity is Not Protective Against Fracture in Postmenopausal Women: GLOW. Am J Med 2011; 124(11): 1043–1050. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2011.06.013>.
- Compston JE, Flahive J, Hosmer DW et al. Relationship of Weight, Height, and Body Mass Index with Fracture Risk at Different Sites in Postmenopausal Women: The Global Longitudinal study of Osteoporosis in Women (GLOW). J Bone Miner Res 2014; 29(2): 487–493. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.2051>.
- Schwartz AV, Vittinghoff E, Bauer DC et al. Association of BMD and FRAX Score with Risk of Fracture in Older Adults with Type 2 Diabetes. JAMA 2011; 305(21): 2184–2192. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2011.715>.
- Giangregorio LM, Leslie WD, Lix LM et al. FRAX underestimates fracture risk in patients with diabetes. J Bone Miner Res 2012; 27(2): 301–308. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.556>.
- Leslie WD, Morin SN, Lix LM et al. Does diabetes modify the effect of FRAX risk factors for predicting major osteoporotic and hip fracture? Osteoporos Int 2014; 25(12): 2817–2824. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–014–2822–2>.
- Russo GT, Giandalia A, Romeo EL et al. Fracture Risk in Type 2 Diabetes: Current Perspectives and Gender Differences. Int J Endocrinol 2016; 2016 : 1615735. Dostupné z DOI: <http://dx.doi.org/10.1155/2016/1615735>.
- Kanis JA, Oden A, Johnell O et al. The use of clinical risk factors enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and women. Osteoporos Int 2007; 18(8): 1033–46. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–007–0343-y>.
- Roux JP, Wegrzyn J, Boutroy S et al. The predictive value of trabecular bone score (TBS) on whole lumbar vertebrae mechanics: an ex vivo study. Osteoporos Int 2013; 24(9): 2455–2460. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–013–2316–7>.
- Ferrari L, Jiang G, Adams J et al. Identification of vertebral fractures: An update. Osteoporos Int 2005;16(7): 717–728. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–005–1880-x>.
- Ferrari SL, Abrahamsen B, Napoli N et al. Diagnosis and management of bone fragility in diabetes: an emerging challenge. Osteoporos Int 2018; 29(12): 2585–2596. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–018–4650–2>.
- Starup-Linde J, Vestergaard P. Biochemical bone turnover markers in diabetes mellitus – A systematic review. Bone 2016; 82 : 69–78. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2015.02.019>.
- Vestergaard P, Rejnmark L, Mosekilde L. Are antiresorptive drugs effective against fractures in patients with diabetes? Calcif Tissue Int 2011; 88(3): 209–214. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–010–9450–4>.
- Schwartz AV, Pavo I, Alam J et al. Teriparatide in patients with osteoporosis and type 2 diabetes. Bone 2016; 91 : 152–158. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2016.06.017>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseForum Diabetologicum
Nejčtenější tento týden
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Hodnotenie rizika osteoporózy u pacienta s diabetes mellitus 2. typu – keď meranie kostnej hustoty nepostačuje
- Manažment osteoporózy u diabetika
- Prínos liečby metformínom v liekových formách s predľženým uvoľňovaním
- Deintenzifikácia liečby pacienta s diabetes mellitus 2. typu môže mať benefitný účinok
- Populačné rozdiely v prevalencii diabetes mellitus, jeho rizikových faktorov a komplikácií
- Osteoporóza pri endokrinopatiách
- Bazálne analógy inzulínu 2. generácie v klinických štúdiách s využitím kontinuálneho monitorovania koncentrácie glukózy
- Skúsenosti z praxe potvrdzujú výsledky štúdií RCT a RWE s empagliflozínom: kazuistiky
- Liečba diabetického edému makuly intravitreálnym dexametazónom: kazuistika
- Forum Diabetologicum
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Osteoporóza pri endokrinopatiách
- Bazálne analógy inzulínu 2. generácie v klinických štúdiách s využitím kontinuálneho monitorovania koncentrácie glukózy
- Deintenzifikácia liečby pacienta s diabetes mellitus 2. typu môže mať benefitný účinok
- Populačné rozdiely v prevalencii diabetes mellitus, jeho rizikových faktorov a komplikácií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



