-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Co možná nevíte o přípravku HEMLIBRA®
11. 7. 2019
Komerční sdělení:
 Inzerce
Inzerce
Jeden den před první aplikací přípravku HEMLIBRA® je nutné ukončit léčbu (včetně rutinní profylaxe) bypassovými přípravky (aPCC a rFVIIa).1 S profylaxí faktorem VIII lze pokračovat ještě 7 dnů od první aplikace přípravku HEMLIBRA®.1
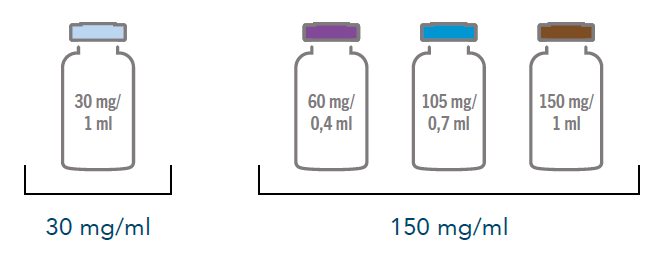
Viskozita léčivého roztoku v lahvičce je u koncentrace 30mg/ml rozdílná, než v lahvičkách s koncentrací 150mg/ml. Proto je nutné, aby se tyto dvě koncentrace nesmíchaly v jedné aplikační stříkačce. Pokud potřebujete v rámci jedné aplikace celé dávky použít kombinaci lahviček obou koncentrací, aplikujte zvlášť koncentraci 30mg/ml a ve druhém vpichu obsah lahviček s koncentrací 150mg/ml, které už mohou být nataženy do jedné stříkačky společně. Není však žádoucí, aby v jedné stříkačce bylo aplikováno více než 2ml roztoku.1
Variabilita frekvence dávkování a kombinace různých balení přípravku Hemlibra Vám poskytuje možnost zvolit optimální léčebný režim tak, aby jste minimalizovali počet vpichů, ale také nevyužitý roztok v lahvičce. Pro usnadnění výpočtu optimální dávky jsme pro vás připravili kalkulátor dostupný na www.mojemedicina.cz.


 DÁVKOVÁNÍ PŘÍPRAVKU HEMLIBRA®1
DÁVKOVÁNÍ PŘÍPRAVKU HEMLIBRA®1- Nasycovací dávka:
- 3 mg/kg 1× týdně subkutánně po dobu prvních 4 týdnů
- Udržovací dávka:
- 1,5 mg/kg 1× týdně subkutánně
- 3 mg/kg 1× za 2 týdny subkutánně
- 6 mg/kg 1× za 4 týdny subkutánně
 SKLADOVÁNÍ PŘÍPRAVKU HEMLIBRA®1
SKLADOVÁNÍ PŘÍPRAVKU HEMLIBRA®1
Názor předního českého odborníka v léčbě hemofilie
 MUDr. Vladimír Komrska, CSc., Klinika dětské hematologie a onkologie FN Motol a 2. LF UK v Praze
MUDr. Vladimír Komrska, CSc., Klinika dětské hematologie a onkologie FN Motol a 2. LF UK v Praze„Význam Hemlibry je v tom, že dokáže nastavit dokonalou profylaxi. Při běžném dávkování totiž u pacientů dosahujeme hladin, které odpovídají 10–15 % faktoru VIII, což už je rozmezí, kdy hovoříme o tzv. subklinické hemofilii.“
Abyste mohli shlédnout toto video, musíte povolit cookies.
Edukační video, jak správně aplikovat přípravek HEMLIBRA®. Pro edukaci vašich pacientů si ho můžete stáhnout na www.mojemedicina.cz.
Abyste mohli shlédnout toto video, musíte povolit cookies.
Reference: 1. Souhrnná informace o přípravku HEMLIBRA, datum poslední revize textu 11.4.2019
HEMLIBRA 30 mg/ ml injekční roztok, HEMLIBRA 150 mg/ ml injekční roztok – Zkrácená informace o přípravku
Účinná látka: emicizumab. Držitel rozhodnutí o registraci: Roche Registration GmbH, Grenzach-Wyhlen, Německo. Registrační číslo: EU/ 1/ 18/ 1271/ 001 - 004. Indikace: Přípravek Hemlibraje indikován k rutinní profylaxi krvácivých epizod u pacientů s hemofilií A s inhibitory faktoru VIII a u pacientů s těžkou hemofilií A (vrozená deficience koagulačního faktoru VIII, FVIII < 1 %) bez inhibitorů faktoru VIII.* Přípravek Hemlibra mohou používat všechny věkové kategorie. Dávkování a způsob podání: Léčba musí být zahájena pod dohledem lékaře se zkušeností s léčbou hemofilie a/ nebo krvácivých poruch. Den před zahájením léčby přípravkem Hemlibra musí být ukončena léčba (včetně rutinní profylaxe) bypassovými přípravky. Profylaxe faktorem VIII (FVIII) může pokračovat během prvních 7 dnů léčby přípravkem Hemlibra. Doporučená dávka je 3 mg/ kg jednou týdně během prvních 4 týdnů (nasycovací dávka), po kterých následuje udržovací dávka buď 1,5 mg/ kg jednou týdně, nebo 3 mg/ kg každé dva týdny nebo 6 mg/ kg každé čtyři týdny, všechny dávky podávané formou subkutánní injekce.* Režim nasycovací dávky je vždy stejný bez ohledu na režim udržovací dávky. Při sestavování celkového objemu pro podání nesměšujte různé koncentrace roztoku Hemlibra (30 mg/ ml a 150 mg/ ml). Nepodávejte objem větší než 2 ml na jedno aplikační místo. Přípravek Hemlibra je určen k dlouhodobé profylaktické léčbě. Nejsou doporučeny žádné úpravy dávkování přípravku Hemlibra. Přípravek Hemlibra je určen pouze k subkutánnímu použití a musí být aplikován pomocí vhodné aseptické techniky. Během léčby přípravkem Hemlibra mají být jiné léčivé přípravky k subkutánní aplikaci aplikovány přednostně v jiných místech. Přípravek Hemlibra je určen k používání pod vedením zdravotnického pracovníka. Po důkladném zaškolení v aplikaci subkutánní injekce jej může aplikovat pacient nebo pečovatel, uzná‑li to lékař za vhodné. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Významné interakce: Nebyly provedeny žádné adekvátní ani dostatečně kontrolované studie interakcí. Klinické zkušenosti naznačují, že emicizumab interaguje s aPCC. Emicizumab zvyšuje koagulační potenciál; dávka koagulačního faktoru potřebná k zajištění hemostázy může být proto nižší než bez profylaxe přípravkem Hemlibra. Zkušenosti se souběžným podáváním antifibrinolytik s aPCC nebo rFVIIa u pacientů léčených emicizumabem jsou omezené. Při podávání systémových antifibrinolytik v kombinaci s aPCC nebo rFVIIa u pacientů léčených emicizumabem je však třeba vzít v úvahu možnost trombotických příhod. Hlavní klinicky významné nežádoucí účinky: Nejzávažnějšími nežádoucími účinky hlášenými v klinických studiích s přípravkem Hemlibra byly trombotická mikroangiopatie (TMA) a trombotické příhody včetně trombózy kavernózního splavu (CST) a trombóza povrchových žil s kožní nekrózou. Nejčastějšími nežádoucími účinky u pacientů léčených přípravkem Hemlibra byly reakce v místě vpichu, bolest hlavy a bolest kloubů. Celkem čtyři pacienti na profylaxi přípravkem Hemlibra v klinických studiích ukončili léčbu kvůli nežádoucím účinkům, ke kterým patřila TMA, kožní nekróza a povrchová tromboflebitida a reakce v místě vpichu. Druh obalu a dostupná balení: Injekční lahvička 3ml, Hemlibra s koncentrací 30 mg/ ml obsahuje emicizumabum 30 mg v 1ml injekčního roztoku. Injekční lahvička 3 ml, Hemlibra s koncentrací 150 mg/ ml obsahuje emicizumabum 60 mg v 0,4 ml injekčního roztoku, nebo obsahuje emicizumabum 105 mg v 0,7 ml injekčního roztoku, nebo obsahuje emicizumabum 150 mg v 1 ml injekčního roztoku. Balení obsahuje vždy jednu injekční lahvičku. Podmínky uchovávání: Uchovávejte v chladničce (2 – 8 °C). Neotevřené injekční lahvičky lze po vyjmutí z chladničky uchovávat při pokojové teplotě (do 30 °C) až po dobu 7 dnů. Chraňte před mrazem a před světlem. Datum poslední revize textu: 11. 4. 2019.Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoliv podezření na nežádoucí účinky na www.sukl.cz/nahlasit-nezadouci-ucinek.
Výdej léčivého přípravku je vázán na lékařský předpis. Léčivý přípravek je v indikaci rutinní profylaxe krvácivých epizod u pacientů s hemofilií A s inhibitory faktoru VIII hrazen z prostředků veřejného zdravotního pojištění. Léčivý přípravek zatím není hrazen u pacientů s těžkou hemofilií A bez inhibitoru. Podmínky úhrady viz www.sukl.cz. Další informace o přípravku získáte z platného Souhrnu údajů o přípravku Hemlibra, nebo na adrese Roche s.r.o., Sokolovská 685/ 136f, 186 00 Praha 8, Tel: +420 220 382 111. Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské lékové agentury (EMA) http://www.ema.europa.eu/.
Edukační materiály v tištěné formě: návod pro lékaře, návod pro laboratorní pracovníky, návod pro pacienty a karta pacienta jsou u zástupců firmy Roche k dispozici na vyžádání. Jejich účelem je informovat o tromboembolických příhodách (spojených s emicizumabem a aPCC), o trombotické mikroangiopatii (spojené s emicizumabem a aPCC) a o život ohrožujícím krvácení způsobeném nesprávným výkladem standardních koagulačních testů.
* Všimněte si, prosím, změn v informacích o léčivém přípravku.
CZ/HEM/0419/0048a
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Hematologie a transfuzní lékařství
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




