-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antiemetická profylaxe a léčba při protinádorové terapii
Datum publikace: 6. 1. 2016
1. Úvod
Moderní antiemetika významně snížila výskyt nevolnosti a zvracení po emetogenní protinádorové chemoterapii, ale stále zůstává přibližně polovina nemocných, kteří tyto potíže za celou dobu své léčby zažijí. Důsledky vzniku nevolnosti a zvracení po chemoterapii jsou pro nemocného často nejen psychicky stresující, ale mohou vést k dehydrataci, akutní renální insuficienci a běžně mají za následek i pokles příjmu stravy a prohloubení malnutrice.
Standardní doporučení pro antiemetickou profylaxi vycházejí z výsledků velkých klinických studií, a jsou tak založena na velmi silném vědeckém průkazu o efektu této léčby. Je zřejmé, že preventivní použití antiemetik je účinnější než léčba již vzniklých potíží. Je také prokázáno, že pokud nejsou standardní doporučení z nějakého důvodu dodržována, významně se zvyšuje riziko selhání a vznik nevolnosti a zvracení, které se pak nezřídka opakují i v dalších cyklech chemoterapie.
V následujícím textu je zdůrazněn praktický přístup k používání dostupných standardních doporučení s cílem zvýšit efektivitu antiemetické profylaxe a léčby v běžné klinické praxi.
2. Typy nevolnosti a zvracení po chemoterapii
Nevolnost a zvracení po protinádorové chemoterapii (chemotherapy-induced nausea and vomiting, CINV) se mohou vyskytovat v různém časovém odstupu od léčby. Vzhledem k tomu je třeba rozlišovat různé typy CINV, protože jim odpovídají i různé způsoby léčby (tab. 1).
Tab. 1. Typy zvracení po chemoterapii
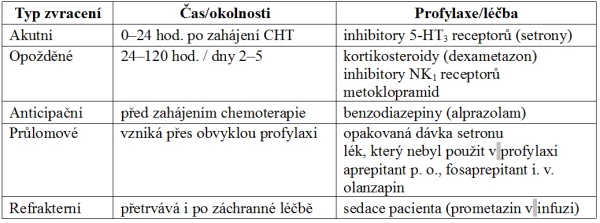
Akutní zvracení je zprostředkováno náhlým uvolněním serotoninu vlivem cytotoxických léků a jeho vazbou na 5-HT3 receptory, k čemuž dochází jak na periferii zažívacího traktu, tak i v oblasti chemorecepční spouštěcí zóny na spodině IV. mozkové komory. Nastává v době od několika minut po zahájení chemoterapie až do 24 hodin s maximem výskytu většinou za 5–6 hodin (po cyklofosfamidu za 9–18 hodin).
Opožděné zvracení má jiný mechanismus vzniku, na němž významně participují nově rozpoznané NK1 receptory se svým přirozeným mediátorem – substancí P –, ale mohou se podílet i jiné receptory a mediátory.
Působení serotoninu na 5-HT3 receptorech představuje zřejmě časnou fázi emetické odpovědi, zatímco NK1 receptory mají úlohu v pozdější fázi emetické dráhy a jejich spektrum účinku může být širší.
Anticipační nevolnost a zvracení se dříve vyskytovaly u 20 % pacientů s opakovanou chemoterapií. V posledních letech s účinnější antiemetickou profylaxí výskyt tohoto typu potíží poklesl. Riziko se zvyšuje s narůstajícím počtem cyklů chemoterapie s nedostatečnou kontrolou CINV a symptomy mohou přetrvávat ještě dlouho po jejím skončení.
Nevolnost po chemoterapii je sice ve svém výskytu částečně vztažena ke zvracení, ale mechanismus jejího vzniku je odlišný, podílejí se tu i jiné oblasti centrálního nervového systému, včetně mozkové kůry. Proto je také samotná nevolnost po chemoterapii častější než zvracení a její léčba je obtížnější.
Průlomové zvracení vzniká navzdory standardní antiemetické profylaxi.
Refrakterní zvracení je charakterizováno přetrvávajícími potížemi i při optimální profylaxi v dalším cyklu léčby a navzdory farmakologické intervenci.
3. Výskyt nevolnosti a zvracení po protinádorové léčbě
Přes významné pokroky v prevenci a léčbě patří CINV i dnes mezi časté a závažné nežádoucí účinky protinádorové chemoterapie. Reálný výskyt CINV v éře nových, vysoce účinných antiemetik je nejlépe patrný z hodnocení velkých klinických studií, které mají v posledních patnácti letech jednotné uspořádání.
Za kompletní léčebnou odpověď (complete response, CR) po profylaktickém podání antiemetik je považována úplná zábrana zvracení bez jakékoliv potřeby záchranné medikace proti nevolnosti a zvracení. Kompletní kontrolou CINV (complete control, CC) je označován průběh bez jakéhokoliv zvracení a bez významné nevolnosti (> 25 mm ve škále 0–100 mm).
Oba tyto parametry jsou obvykle posuzovány zvlášť v akutní fázi 0–24 hodin po zahájení chemoterapie, v opožděné fázi 24–120 hodin a v celkové fázi 0–120 hodin, tedy 5 dnů po zahájení chemoterapie.
Z pohledu klinické praxe je rozhodující zhodnocení celé doby 0–120 hodin po chemoterapii. Kompletní odpovědi za tuto dobu je dosahováno v případě podání starších setronů s dexametazonem pouze u 50 % léčených, po palonosetronu s dexametazonem u 60 % a po trojkombinaci starších setronů s aprepitantem a dexametazonem u 70 % pacientů. V nedávné studii netupitantu s palonosetronem a dexametazonem bylo CR za celou dobu 0–120 hodin dosaženo po různých typech chemoterapie v průměru u 80 % nemocných.
Vyšší výskyt CINV je nadále zjišťován především v opožděné fázi, přičemž výskyt nevolnosti je častější než výskyt zvracení. Podle šestidenních záznamů pacientů léčených emetogenní chemoterapií při dnešní standardní antiemetické profylaxi byl reálný výskyt opožděného zvracení podle typu chemoterapie 30–50 %, opožděnou nevolnost mělo 50–60 % léčených.
Z těchto údajů je zřejmé, že reálný výskyt CINV nemůže být posuzován podle dojmu, který vzniká první den chemoterapie.
4. Příčiny přetrvávajícího výskytu CINV
Inhibitory 5-HT3 receptorů jsou velkým přínosem v profylaxi CINV, tato skutečnost však na druhé straně může vytvářet dojem, že nevolnost a zvracení již dnes onkologickým pacientům příliš nehrozí. Méně je známo, že tato setronová antiemetika mají vysokou účinnost pouze při předcházení akutnímu zvracení, charakterizovanému serotoninovým mechanismem vzniku potíží, zatímco jejich efekt proti opožděnému zvracení již není významně vyšší než efekt metoklopramidu nebo dexametazonu.
Dokonce i v profylaxi akutního zvracení mají samotné setrony úplnou účinnost jen u poloviny nemocných, což dokumentuje nezbytnost kombinovat je s dalšími antiemetiky.
Protože se na vzniku CINV podílejí různé nervové dráhy a receptory periferního i centrálního nervového systému (5-HT3 receptory, dopaminové D2 receptory, neurokininové NK1 receptory a další), není možné najít jediný lék, který by byl plně účinný. Standardním doporučením u každé emetogenní chemoterapie je proto použití kombinace antiemetik.
Antiemetika jsou nejúčinnější, pokud jsou podána preventivně, zatímco léčba již vzniklých potíží je méně účinná. Proto všechna standardní doporučení zahrnují důraznou antiemetickou profylaxi od prvního cyklu chemoterapie, pokud je tato klasifikována jako emetogenní. Cílem je zabránit vzniku jakéhokoliv zvracení, které kromě jiného představuje významné zvýšení rizika opakování CINV v dalších cyklech chemoterapie.
Všechny tyto zásady jsou obsaženy v široce publikovaných standardních doporučeních, která je třeba respektovat také proto, že u jednotlivého pacienta není možno přesně předpovědět vznik CINV.
Pro antiemetickou profylaxi jsou dnes dostupná mezinárodní nebo národní standardní doporučení (guidelines) nejméně čtyř velkých odborných společností (MASCC, Multinational Association for Supportive Care in Cancer, ESMO, European Society of Medical Oncology, ASCO, American Society of Clinical Oncology a NCCN, National Comprehensive Cancer Network). Vědecký průkaz pro toto doporučení je založen na řadě velkých kontrolovaných klinických studií a je silnější než u mnoha jiných způsobů podpůrné léčby.
Přestože jsou mezinárodní standardy dnes již běžně dostupné, zůstává stále významný rozdíl mezi těmito doporučeními a klinickou praxí. Častým příkladem je nepřiměřené spoléhání na účinek samotného inhibitoru 5-HT3 receptorů nebo nedostatečné krytí opožděné fáze nebo snaha nepodat moderní, dražší antiemetika. Je prokázáno, že pokud pacient z nějakého důvodu nedostane léčbu podle těchto doporučení, má významně vyšší pravděpodobnost vzniku CINV.
Avšak i když je postupováno podle standardů, je dobré si uvědomit, že v běžné praxi je situace často horší, než je tomu v klinických studiích. Převážná většina dnešních vědeckých důkazů se totiž týká nemocných, kteří dostávali své první cykly chemoterapie, často s jednodenní aplikací cytotoxických léků. V běžné praxi je však většina nemocných léčena mnoha cykly kombinované léčby, přičemž je známo, že účinnost antiemetické profylaxe s pokračujícími cykly klesá. Nedostatečné doklady se týkají také vícedenních režimů cytotoxické léčby, kdy dochází k překrývání akutního, opožděného, a dokonce i anticipačního zvracení a nevolnosti.
Příčinou nedodržování standardních doporučení může být sklon k podhodnocení skutečného výskytu CINV, především v opožděné fázi po podání chemoterapie, kdy tyto potíže již nemusí být přičítány cytotoxické léčbě, zvláště když jimi ambulantní pacient trpí doma. Jindy může být příčinou snaha vyvarovat se vedlejším účinkům dexametazonu.
Protože moderní antiemetika, především palonosetron a aprepitant, jsou několikanásobně dražší než starší léky, může být příčinou jejich nepodání snaha o snížení finančních nákladů na léčbu. V tomto smyslu by však bezproblémový průběh po podání chemoterapie neměl být vnímán jako zbytečné použití drahých antiemetik, ale naopak jako dosažení optimálního efektu, který se může vyplatit snížením nákladů na léčbu komplikací nejen v aktuálním, ale i v dalších cyklech chemoterapie.
5. Důsledky CINV v praxi
Nevolnost a zvracení indukované chemoterapií jsou i dnes mnoha nemocnými vnímány jako stresující a obávané nežádoucí účinky protinádorové léčby. Z pohledu ošetřujícího personálu by takové potíže ani při krátkodobém výskytu neměly být vnímány jako nevýznamná epizoda, kterou není třeba řešit.
Klinické studie dokladují, že CINV významně zhoršují kvalitu života nemocných a že tento důsledek mají i jednotlivé epizody zvracení, a dokonce i samotná nevolnost. Opakované zvracení může mít za následek dehydrataci, renální insuficienci, metabolický rozvrat, může vést i k nutnosti hospitalizace a není výjimkou, že nemocný pro tyto potíže dostává úplnou parenterální výživu. Už i mírná několikadenní nauzea zřetelně snižuje příjem stravy, což může být závažné zejména pro pacienty, kteří ztrácejí na hmotnosti. Pro další cyklus chemoterapie se významně zvyšuje riziko opakování těchto potíží, a to i při plné profylaxi. Pokud se vyvine anticipační zvracení, je často neovlivnitelné všemi moderními antiemetiky.
Je evidentní, že takový stav kontrastuje s optimální situací, kdy nemocný po chemoterapii žádnou nevolností ani zvracením netrpí a zvládá opakované cykly léčby v plných dávkách bez odkladů. To je také cílem profylaxe podle standardních doporučení.
6. Emetogenita protinádorových léků
Emetogenita jednotlivých protinádorových léků je dnes hodnocena podle pravděpodobnosti výskytu zvracení za podmínek nepodání antiemetické profylaxe. Vysoce emetogenní lék by při samostatném podání vyvolal zvracení u více než 90 %, zatímco středně emetogenní u 30–90 % léčených. V širším slova smyslu jsou obě tyto kategorie považovány za emetogenní léčbu, a představují tak indikaci k preventivnímu podání antiemetik u všech nemocných od prvního cyklu chemoterapie.
Řazení léků do jednotlivých kategorií se podle doporučení různých odborných společností poněkud liší a prodělává změny v čase, zejména s příchodem nových léků. Emetogenita závisí nejen na typu léku, ale i na jeho dávce, a právě pokud se týká dávky, nejsou standardní doporučení jednotná ani příliš konzistentní. Kategorie střední emetogenity je také příliš široká, takže zahrnuje léky s různým rizikem CINV. Navíc jsou protinádorové léky často používány v kombinacích, což emetogenitu většinou zvyšuje. Proto je třeba klasifikaci protinádorových léků podle emetogenity používat uvážlivě s ohledem na konkrétní situaci (tab. 2).
Tab. 2. Intravenózní protinádorové léky s vysokou a střední emetogenitou
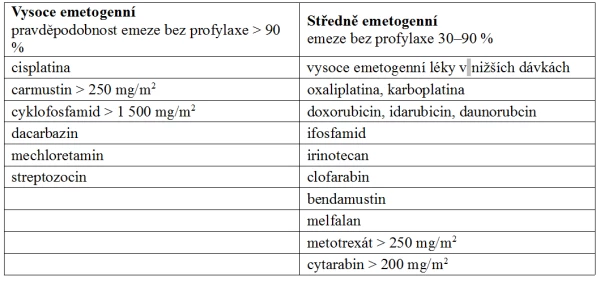
Při současném podání několika protinádorových léků rozhoduje o emetogenitě takové kombinace nejvíce emetogenní lék, je však třeba počítat s faktem, že riziko zvracení může být u kombinované léčby vyšší. Autoři klasifikace také uvádějí, že pro některé pacienty mohou být léky ze skupiny střední emetogenity ve skutečnosti vysoce emetogenními.
Naopak podání stejné dávky léku v kontinuální infuzi je obvykle podstatně méně emetogenní než bolusová aplikace.
Protinádorové léky s nižší emetogenitou mají podstatně nižší riziko vzniku CINV. Informace o nízké emetogenitě je však také důležitá, protože snižuje potřebu antiemeze, a umožňuje tak racionální farmakoterapii (tab. 3).
Tab. 3. Intravenózní protinádorové léky s nižší emetogenitou
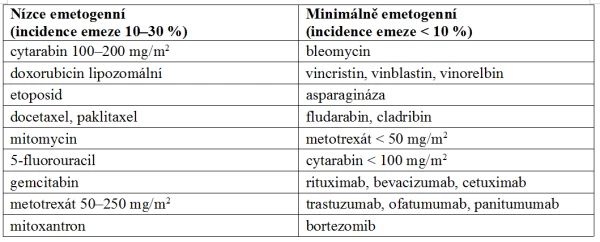
Poslední verze klasifikací nově vyčleňují perorální protinádorové léky. Zde patří mezi emetogenní léky procarbazin, busulfan v dávce 4 mg/kg/den a vyšší, cyklofosfamid 100 mg/m2/den a více, etoposid, temozolomid, lomustin a některé další.
7. Individuální faktory rizika CINV
Vznik CINV nezávisí pouze na emetogenitě cytotoxických léků, ale také na faktorech nemocného.
Obecně je toto riziko vyšší u mladých jedinců a u žen. Významnou roli hraje anamnestický údaj o zvracení v minulosti, zejména při jízdě dopravním prostředkem, na kolotoči nebo i v těhotenství. Zvýšené riziko mají nemocní, kteří trpí úzkostí nebo i abnormální únavou. Pokud je přítomna deprese, zvyšuje se riziko nespolupráce pacienta při antiemetické profylaxi a tím i pravděpodobnost vzniku CINV. Naopak zvláštní výhodu v této souvislosti představuje pravidelná konzumace alkoholu (tab. 4).
Tab. 4. Rizikové faktory nevolnosti a zvracení po chemoterapii podle typu pacienta
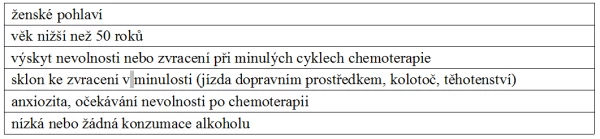
Při opakovaných cyklech protinádorové léčby je jedním z nejdůležitějších faktorů anamnestický údaj o toleranci předchozího cyklu, se zohledněním podané antiemetické profylaxe a případně i efektu léčby průlomového zvracení a nevolnosti. Toto zhodnocení však musí zahrnout nejen akutní, ale i opožděné zvracení nejméně do 3 dnů po skončení chemoterapie a musí také vedle zvracení posoudit i žaludeční nevolnost co do jejího výskytu, intenzity a trvání.
8. Antiemetika
8.1. Inhibitory 5-HT3 receptorů
Blokují účinek uvolněného serotoninu v akutní fázi po podání cytotoxických léků, a to jak v centrálním nervovém systému, tak i na periferních zakončeních nervu vagu v oblasti zažívacího traktu.
Starší léky z této skupiny, ondansetron a granisetron, jsou dnes považovány za I. generaci inhibitorů 5-HT3 receptorů (dolasetron a tropisetron nejsou dnes u nás běžně používány). Jednotlivé léky této skupiny jsou ekvivalentní ve svém účinku. Efekt setronů I. generace je výrazný v akutní fázi, ale podstatně slabší v opožděné fázi, kde již není vyšší než efekt metoklopramidu nebo dexametazonu.
Biologická dostupnost perorálně podaných setronů je kolem 60 %, přesto není významný rozdíl v antiemetické účinnosti mezi aplikací stejné perorální a intravenózní dávky. I když ondansetron má poměrně krátký biologický poločas, většina klinických studií jej používala v jedné denní dávce. Podle standardních doporučení je ondansetron i granisetron možno podávat buď v jedné denní dávce, nebo rozděleně do dvou dávek.
Palonosetron (Aloxi) je vysoce selektivní kompetitivní antagonista 5-HT3 receptorů II. generace, dostupný původně pouze v intravenózní formě, nově však také v tabletách. Proti dosud používaným lékům této skupiny má až stokrát vyšší afinitu a podstatně delší terminální plazmatický eliminační poločas, který činí přibližně 40 hodin.
Na molekulární úrovni působí, na rozdíl od ostatních inhibitorů 5-HT3 receptorů, jako alosterický antagonista s pozitivní kooperací. Vazbou do nesubstrátového místa receptoru (alosterická vazba) usnadňuje vazbu druhé molekuly palonosetronu do samotného vazebného místa pro serotonin (ortosterická vazba), což způsobuje vysokou afinitu léku k receptoru. Výsledkem je internalizace 5-HT3 receptorů s dlouhodobou inhibicí jejich funkce, což se jeví jako zdánlivě ireverzibilní účinek. Tyto vlastnosti částečně vysvětlují fakt, že palonosetron se stal prvním 5-HT3 inhibitorem s účinností prodlouženou do opožděné fáze.
Standardní dávka je 0,25 mg i. v., podaná jednorázově před chemoterapií pro celý cyklus léčby. Vzhledem k tomu, že byla testována i trojnásobná dávka (0,75 mg) bez závažných nežádoucích účinků, je považováno za možné a bezpečné opakovat u vícedenních cyklů chemoterapie podávání palonosetronu i v dalších dnech léčby, například v odstupu 48 hodin (tab. 5).
Tab. 5. Doporučené jednotlivé dávky setronů a intervaly jejich podávání

1 Granisetron je k dispozici také ve formě náplastí s pomalým uvolňováním se 7denní účinností.
Setronová antiemetika včetně palonosetronu mohou vyvolávat bolesti hlavy a zácpu, většinou však jen mírného stupně, přičemž výskyt nepřesahuje 10 % léčených. Setrony I. generace mohou prodlužovat QT interval na EKG a způsobit tak závažnou arytmii, což je významné především u pacientů se srdečním onemocněním, při vrozeném prodloužení QT intervalu a při současném užívání léků, které také prodlužují tento interval. Riziko arytmií se týká především vyšších intravenózních dávek setronů I. generace, a proto dnes není doporučeno překračovat doporučené nitrožilní dávkování.
Předností palonosetronu proti starším setronům je nepřítomnost elektrokardiografického prodloužení intervalu QT a téměř žádné riziko významných srdečních arytmií.
Výhodou palonosetronu je také jeho nízký potenciál pro vznik lékových interakcí, protože je metabolizován izoenzymem 2D6 CYP450, a nikoliv izoenzymem 3A4, který je zodpovědný za přeměnu mnoha různých léků.
8.2. Kortikosteroidy
Mají vlastní antiemetický účinek, jehož mechanismus není zcela jasný. Potencují účinek inhibitorů 5-HT3 receptorů a navíc mají významný efekt proti opožděnému zvracení a nevolnosti.
Přednostně je doporučen dexametazon, ale pokud je součástí schématu protinádorové léčby jiný kortikosteroid v adekvátní dávce, dexametazon se již nepřidává. Antiemetické dávky dexametazonu se pohybují v rozmezí 4–20 mg. Plně účinnou dávkou v profylaxi akutního zvracení po vysoce emetogenní chemoterapii je 20 mg perorálně nebo nitrožilně, ale při kombinaci s aprepitantem je vzhledem k prokázané interakci, která vede ke zvýšení hladiny steroidů při jejich současném podávání, doporučeno snížení dávky na 12 mg.
Nežádoucí účinky kortikosteroidů jsou všeobecně známé a je třeba s nimi počítat i při antiemetické léčbě. Vzhledem ke krátkodobému podávání je nejčastějším problémem hyperglykémie, která se netýká jen diabetiků, ale i nemocných s porušenou tolerancí glukózy a často i obézních pacientů. Při ranní dávce kortikosteroidů glykémie většinou narůstá až v odpoledních a večerních hodinách a do rána opět klesá k normě. Optimálním řešením při vícedenní terapii kortikoidy je večerní kontrola glykémie. U mnoha nemocných je namístě přechodné omezení příjmu jednoduchých sacharidů ve stravě a u diabetiků krátkodobé zvýšení dávky antidiabetik. Vyvarování se steroidní hyperglykémii přispívá ke snížení rizika vzniku infekce. U špatně kompenzovatelných diabetiků by bylo možno nahradit dexametazon aprepitantem.
I při krátkodobém podání dexametazonu je třeba počítat s možností vzniku insomnie nebo škytavky, zatímco ostatní vedlejší účinky steroidů se objevují spíše při delším podávání a při vyšším dávkování.
8.3. Inhibitory NK1 receptorů
Léky této nové skupiny antiemetik působí blokádu substance P na NK1 receptorech. Tyto receptory jsou hojně exprimovány v mozkovém kmeni v oblastech, které regulují reflex pro zvracení, ale také periferně na vagových zakončeních v oblasti zažívacího traktu.
Aprepitant (Emend) je prvním klinicky účinným inhibitorem NK1 receptorů, původně dostupným pouze v perorální formě. Jeho biologická dostupnost je přibližně 60 % a navíc má velmi dobrý průnik do mozku, což je podstatné pro jeho antiemetický účinek. Významným přínosem je především vliv na zvracení v opožděné fázi, který je vyšší než u všech dosud používaných antiemetik. Vzhledem k odlišnému mechanismu účinku s výhodou doplňuje antiemetickou kombinaci blokátorů 5-HT3 receptorů s kortikosteroidy (trojkombinace).
Za standardní dávkování je dnes považován třídenní perorální režim, první den 125 mg a další dva dny vždy 80 mg. S úspěchem bylo testováno také alternativní podání všech tří tablet naráz (285 mg) před zahájením chemoterapie. Je možné i prodloužené podávání tablety 80 mg čtvrtý a pátý den léčby.
V současné době je již k dispozici také intravenózní forma, prekurzor fosaprepitant, jehož dávka 115 mg je ekvivalentní 125 mg perorálního aprepitantu. Jednorázovou intravenózní dávkou pro celý cyklus je 150 mg před zahájením chemoterapie.
Blokátory NK1 receptorů vykazovaly pouze v některých studiích proti placebu častější výskyt únavy a škytavky, většinou však byly jen mírného stupně.
Vzhledem k metabolismu aprepitantu cestou izoenzymu 3A4 cytochromu P je třeba počítat s možností lékových interakcí. Zatím nebyly zjištěny významné interakce s cytotoxickými léky, až na několik případů neurotoxicity při současném podávání ifosfamidu.
Netupitant je druhým inhibitorem NK1 receptorů, který bude v nejbližší době dostupný v podobě fixní kombinace s palonosetronem v jedné tabletě. Netupitant má na rozdíl od aprepitantu dlouhý poločas eliminace, který činí více než 90 hodin.
Rolapitant jako nový NK1 inhibitor zatím u nás není dostupný, jeho výhodou však bude nízký potenciál k tvorbě lékových interakcí. Rolapitant je již součástí amerických standardních doporučení NCCN.
8.4. Fixní kombinace netupitantu s palonosetronem, NEPA
Předností NEPA (netupitant 300 mg a palonosetron 0,5 mg v jedné tabletě) je ovlivnění obou hlavních mediátorů, které zprostředkovávají vznik zvracení po chemoterapii, serotoninu na 5HT3 receptorech a substance P na NK1 receptorech. Obě látky se vyznačují dlouhým biologickým poločasem eliminace, což umožňuje podat tabletu jednorázově pro celý cyklus chemoterapie, a to jednu hodinu před jejím zahájením.
Efektivita byla potvrzena klinickou studií III. fáze, vedlejší účinky byly převážně mírné intenzity a odpovídaly lékům z kategorie setronů a NK1 inhibitorů. Také NEPA je již doporučena v nové verzi NCCN Guidelines.
8.5. Blokátory dopaminových D2 receptorů
Metoklopramid tlumí dopaminové receptory na periferní i centrální úrovni, má prokinetický účinek na zažívací trakt a v dávkách 10–20 mg podávaných každé 4–6 hodin působí také proti CINV.
Jeho nejčastějším závažným nežádoucím účinkem jsou okulomotorické a křečové projevy, které nejednou znemožní další podávání. V těchto případech je možno využít blokády dopaminových receptorů haloperidolem v dávkách 0,5–2 mg perorálně nebo intravenózně opakovaných každých 4–6 hodin.
8.6. Benzodiazepiny
Nemají sice přímý antiemetický účinek, ale u anxiózních pacientů představují účinný doplněk profylaxe při emetogenní chemoterapii. Přednostně je doporučen lorazepam nebo alprazolam v jednotlivých dávkách 0,25–0,5 mg podávaných čtyřikrát denně. U starších a oslabených pacientů je doporučena dávka nižší.
8.7. Olanzapin
Olanzapin (thiobenzodiazepin, Zyprexa) je atypické psychofarmakum schválené pro léčbu schizofrenie. Působí blokádu četných neurotransmiterů na dopaminergních, serotoninergních, histaminergních i muskarinových receptorech. V klinických studiích u nemocných s emetogenní chemoterapií byla potvrzena jeho bezpečnost a účinnost proti akutnímu i opožděnému zvracení, ale také proti nevolnosti, která je obecně hůře ovlivnitelná než zvracení.
O podání olanzapinu je možno uvažovat při léčbě průlomového a refrakterního zvracení, zatím ovšem mimo standardní indikace. Předpis na recept s úhradou pojišťovny je vázán na odbornost psychiatra, ale pro úhradu pacientem je postačující recept od onkologa.
8.8. Olanzapinový režim
Trojkombinace palonosetronu, dexametazonu a olanzapinu je alternativou profylaxe vysoce emetogenní nebo středně emetogenní chemoterapie. Olanzapin je v této kombinaci srovnatelnou náhradou za aprepitant, což je doloženo jednou klinickou studií fáze III. Výhodou tohoto režimu je účinné krytí opožděné fáze olanzapinem i palonosetronem, což umožňuje zkrátit podávání dexametazonu a také je zde minimální riziko prodloužení QT intervalu vzhledem k použití palonosetronu (tab. 6).
Tab. 6. Olanzapinový antiemetický režim

9. Standardní přístup k antiemetické profylaxi
Každé podání protinádorové léčby by dnes mělo být provázeno posouzením celkového rizika CINV (tab. 7).
Tab. 7. Posouzení emetogenity protinádorové léčby

U každého cyklu vysoce nebo středně emetogenní léčby je standardním přístupem profylaktické podání kombinace antiemetik každý den aplikace chemoterapie a následně pak pokračování v antiemetické profylaxi 2–4 dny po skončení této léčby. V praxi to znamená, že nestačí podání samotného setronového antiemetika a nestačí ani podání pouze ve dny, kdy pacient dostává protinádorové léky.
Ambulantní pacient musí dostat léky k profylaxi opožděného zvracení a současně by měl mít k dispozici doporučení pro případ průlomového zvracení.
Také při chemoterapii s nízkou emetogenitou je indikováno paušální podání antiemetika před každým cyklem chemoterapie, není však rutinně nutno zajišťovat opožděnou fázi.
U jednotlivých pacientů je třeba přihlédnout ke skutečnosti, že podávaná protinádorová léčba může mít pro konkrétního pacienta o stupeň vyšší emetogenitu, než by odpovídalo obsaženým cytotoxickým lékům.
Při rozpisu antiemetické kombinace je třeba brát do úvahy možné nežádoucí účinky antiemetik. Zásady profylaxe CINV shrnuje tab. 8.
Tab. 8. Zásady profylaxe CINV podle ESMO a MASCC (uvedeny denní dávky léků)
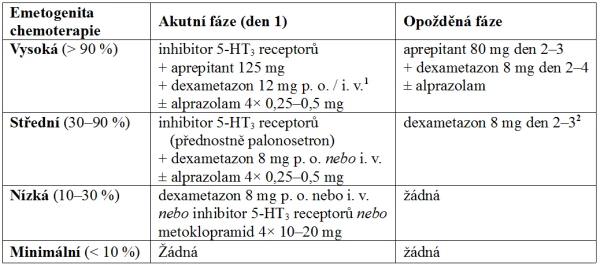
1 Pokud není podán aprepitant, je doporučena dávka dexametazonu 20 mg.
2 Při profylaxi palonosetronem je možno zkrátit podání dexametazonu.
9.1. Zásady antiemetické profylaxe u vysoce emetogenní chemoterapie
Standardním postupem v profylaxi akutního zvracení při vysoce emetogenní chemoterapii je trojkombinace obsahující inhibitor 5-HT3 receptorů, aprepitant a dexametazon. Tato trojkombinace zabraňuje akutnímu zvracení přibližně u 90 % léčených, zatímco setron s dexametazonem bez aprepitantu jen u 70 % a samotný setron jen u 50 % léčených. Výhodou přidání NK1 inhibitoru je zvýšení efektu profylaxe nejen v akutní, ale zejména v opožděné fázi.
Všechny tři léky je třeba podat 30–60 minut před zahájením chemoterapie a u vícedenních režimů pokračovat každý další den podání emetogenní léčby. Riziko CINV však trvá i po jejím skončení, a proto je třeba pokračovat s profylaxí opožděného zvracení ještě 3 dny po poslední dávce emetogenního léku.
Poslední klinické studie ukazují, že i u vysoce emetogenní léčby má palonosetron vyšší účinnost ve srovnání s inhibitory 5-HT3 receptorů I. generace, a proto se palonosetron stává preferovaným inhibitorem 5-HT3 receptorů také u vysoce emetogenní chemoterapie.
U anxiózních nemocných je možno zvýšit efekt antiemetické kombinace přidáním anxiolytika, přednostně alprazolamu. Někteří nemocní mají po chemoterapii i dyspeptické potíže, těžko odlišitelné od nevolnosti, které často reagují na inhibitory kyselé žaludeční sekrece.
9.2. Zásady profylaxe u středně emetogenní chemoterapie
Standardním přístupem k profylaxi akutního zvracení u středně emetogenní chemoterapie je podávání kombinace inhibitoru 5-HT3 receptorů s dexametazonem každý den aplikace emetogenních léků. Preferovaným setronem je palonosetron, který významně snižuje výskyt zvracení nejen v akutní, ale i opožděné fázi. Zvláštní výhodu má u vícedenních režimů chemoterapie. Přitom je třeba zdůraznit, že ani palonosetron není doporučeno podávat bez dexametazonu, protože ve většině studií byla podávána tato kombinace léků.
Nedávná velká randomizovaná klinická studie s trojkombinací s aprepitantem prokázala i u středně emetogenní léčby signifikantní zvýšení efektu, pokud je přidán aprepitant. Podle standardních doporučení (guidelines) aprepitant zatím není rutinní součástí profylaxe od prvního cyklu, ale je doporučeno podávat jej vybraným nemocným se zvýšeným rizikem opožděného zvracení (např. léčba karboplatinou nebo cyklofosfamidem nebo doxorubicinem, ale také při přítomnosti rizikových faktorů pacienta).
Také u středně emetogenní chemoterapie je indikováno pokračování antiemetické profylaxe i po skončení aplikace emetogenních cytotoxických léků, a to další 2 dny. Je možno použít buď samotný dexametazon 8 mg p. o. nebo i. v. denně, nebo aprepitant, nebo kombinaci obou těchto léků.
9.3. Zásady profylaxe u chemoterapie s nízkou emetogenitou
U nízce emetogenní chemoterapie je indikována profylaxe akutního zvracení jedním lékem podávaným v každý den chemoterapie, přičemž není nutné krýt opožděnou fázi. U některých disponovaných nemocných však může být skutečná emetogenita i v tomto případě vyšší, než by jinak bylo očekáváno.
Obecně jsou vědecké doklady pro antiemezi při nízce emetogenní chemoterapii velmi omezené.
9.4. Zásady profylaxe u chemoterapie s minimální emetogenitou
Při chemoterapii s minimální emetogenitou není u nemocných s negativní anamnézou doporučena rutinní profylaxe akutního ani opožděného zvracení.
9.5. Antiemetická profylaxe při perorální emetogenní léčbě
Při perorální emetogenní léčbě je indikován samotný inhibitor 5-HT3 receptorů před každou dávkou léku s možností přidat alprazolam nebo i inhibitor kyselé žaludeční sekrece. Primární profylaxe však není indikována při dlouhodobé léčbě, jakou je např. imatinib.
10. Antiemetická profylaxe při vysokodávkované chemoterapii před transplantací krvetvorných buněk
Navzdory vysoké emetogenitě většiny přípravných režimů před transplantací krvetvorných buněk nemáme v současné době dostatek údajů z klinických studií o antiemetické profylaxi u transplantační léčby. Ani mezinárodní guidelines v tomto smyslu neobsahují potřebná doporučení. Problémem je, že nevolnost a zvracení při transplantační léčbě mohou být kromě chemoterapie způsobeny řadou faktorů, jako jsou radioterapie, podávané antimikrobiální a jiné léky, lékové interakce, anxiozita nemocných a další. Nepochybně se CINV může vyskytovat v opožděné fázi i více dnů po skončení přípravného režimu.
Podle názoru expertů je doporučována kombinace 5-HT3 inhibitoru s dexametazonem. Preferovaným lékem je palonosetron, který je podle typu přípravného režimu možno bezpečně a účinně opakovat k zajištění prodlouženého efektu buď obden, nebo i dva dny po sobě. Dexametazon, podobně jako u vysoce emetogenní chemoterapie, by měl být podáván ještě 2–4 dny po skončení chemoterapie, ovšem za přísné kontroly glykémie včetně večerních hodin s cílem snížit riziko infekčních komplikací.
Ve většině případů je namístě přidat do kombinace alprazolam v dostatečné dávce. Často je podáván také blokátor kyselé žaludeční sekrece a někdy i metoklopramid.
Aprepitant vzhledem ke svému metabolismu cestou CYP 3A4, často rozsáhlé medikaci a vysokodávkované chemoterapii přináší riziko interakcí. Interakce aprepitantu jsou však výraznější spolu s perorálními léky a nebyly prokázány spolu s vysokou dávkou intravenózních cytotoxických léků. V posledních letech přibývá menších studií s použitím trojkombinace s aprepitantem při transplantační terapii.
Vhodným způsobem antiemetické profylaxe by mohl být olanzapinový režim.
11. Antiemetická profylaxe při radioterapii
Také v případě radioterapie rozlišujeme různé stupně emetogenity podle charakteru léčby a tomu odpovídá i způsob antiemetické profylaxe (tab. 9).
Tab. 9. Antiemetická profylaxe při radioterapii (denní dávky)
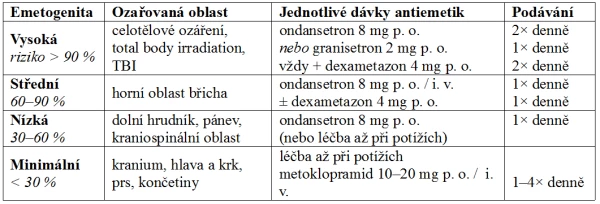
Emetogenita radioterapie je vyšší u vyšší jednotlivé dávky záření a při ozáření většího objemu tkáně. Profylakticky se antiemetikum podává před každou dávkou záření.
12. Průlomové a refrakterní zvracení
Pokud při standardní antiemetické profylaxi vznikne průlomové zvracení nebo nauzea, může být u části nemocných účinná druhá dávka téhož inhibitoru 5-HT3 receptorů, což se může týkat i palonosetronu (při vícedenní chemoterapii byla účinnou záchrannou antiemetickou léčbou druhá dávka palonosetronu podaná za 72 hodin po první dávce).
Selhání léčby setronem však nemusí být způsobeno nedostatečnou blokádou 5-HT3 receptoru, ale také zapojením jiných neurotransmiterů do mechanismu zvracení. Proto může být účinné podání léku s jiným mechanismem účinku, jako jsou kortikosteroidy, antagonisté D2 receptorů, aprepitant, antihistaminika nebo benzodiazepiny.
Zvracení po chemoterapii vyžaduje také vyloučit jiné možné příčiny, jakými jsou obstrukce střeva nádorem, mozkové metastázy, metabolické poruchy a další komplikace. Průlomové zvracení nezřídka vyžaduje úpravu hydratace a iontové dysbalance.
Jednotlivé možnosti léčby průlomového zvracení ukazuje tab. 10.
Tab. 10. Možnosti léčby průlomového zvracení

Zásady léčby průlomového zvracení
Léčba průlomového zvracení je obtížná a obvykle méně úspěšná než prevence nevolnosti a zvracení. Perorální cesta podání většinou není schůdná, ale v některých případech je možná.
Všeobecně je doporučeno podat lék z jiné skupiny, s jiným mechanismem antiemetického účinku proti lékům použitým v profylaxi.
Novou možností léčby průlomového zvracení je atypické antipsychotikum olanzapin, který je možno podat 3 dny po sobě v denní dávce 5–10 mg.
V mnoha případech je třeba současně zajistit hydrataci a korigovat elektrolytovou dysbalanci.
Je třeba zhodnotit, zda průlomové zvracení nemá jinou příčinu než chemoterapii či ozařování (nádorové postižení střeva, obstrukce střeva, mozkové metastázy, elektrolytové poruchy, gastroparéza, léčba opioidy a jiné).
U refrakterního zvracení je ve zvláště obtížných případech alternativou léčby podat sedativa s navozením lehkého spánku, který často umožní výraznou redukci dávky klasických antiemetik. Tohoto cíle lze u hospitalizovaných pacientů dosáhnout kontinuální infuzí chlorpromazinu s prometazinem.
13. Úprava profylaxe v dalším cyklu chemoterapie po předchozím selhání
U nemocných s nedostatečnou kontrolou nevolnosti a zvracení v předchozím cyklu chemoterapie je nutno v dalším cyklu profylaktickou léčbu změnit (tab. 11).
Tab. 11. Možnosti zesílení antiemetické profylaxe při dalším cyklu chemoterapie

Nemocní nereagující na konvenční antiemetickou léčbu mohou dostat kanabinoidy, např. dronabinol 5–10 mg perorálně.
Pokud CINV přetrvávají i v dalších cyklech chemoterapie navzdory posílené antiemetické profylaxi, mohou být důvodem ke změně protinádorové léčby.
14. Úhradová omezení nových antiemetik
Nová antiemetika palonosetron a aprepitant signifikantně zlepšují kontrolu zvracení po vysoce i středně emetogenní chemoterapii, ale jejich cena na jeden cyklus chemoterapie je přibližně desetinásobná proti použití starších antiemetik, včetně setronů I. generace, což ovlivňuje podmínky úhrady zdravotními pojišťovnami.
Palonosetron v tabletě je při předpisu na recept hrazen zdravotní pojišťovnou v prevenci nevolnosti a zvracení při středně emetogenní chemoterapii, přičemž má dvojí výši úhrady. Základní částečná úhrada platí od prvního cyklu chemoterapie, zvýšená úhrada až po selhání léčby setrony I. generace.
Palonosetron injekce je hrazen v prevenci nevolnosti a zvracení v důsledku silného uvolnění serotoninu, navozeného cytotoxickou chemoterapií (tedy nejen středně emetogenní), také s dvojí výší úhrady (zvýšená úhrada až po selhání léčby setrony I. generace).
Aprepitant je v současné době při předpisu na recept hrazen zdravotní pojišťovnou jako součást léčebného režimu zahrnujícího kortikosteroid a inhibitor 5-HT3 receptorů při vysoce emetogenní protinádorové chemoterapii založené na bázi cisplatiny a při kombinaci cyklofosfamidu s antracyklinem (AC kombinace), avšak až v další linii antiemeze po selhání léčby setrony I. generace. Také úhradové omezení na chemoterapii na bázi cisplatiny je limitující pro pacienty s jinými typy vysoce emetogenní léčby.
Tato omezení neodpovídají standardním doporučením, která zdůrazňují potřebu primárního předcházení potížím v případech podání vysoce či středně emetogenní chemoterapie, a proto by měla být co nejdříve revidována.
Podíl nemocných s nedostatečnou kontrolou CINV v celé době 0–120 hodin po chemoterapii při profylaxi setrony I. generace s dexametazonem činil ve velkých studiích kolem 50 %. Čekání na selhání tedy zvyšuje výskyt nevolnosti a zvracení po chemoterapii přibližně u poloviny pacientů a snižuje efektivitu antiemeze v dalších cyklech chemoterapie, protože prevence zvracení je účinnější než léčba již vzniklých potíží. Léčba CINV v celém následném průběhu onkologické léčby pak je komplikovanější a nákladnější, než pokud by se podařilo nevolnosti a zvracení zabránit primárně. To potvrzuje i několik publikovaných analýz, podle nichž je použití nových antiemetik farmakoekonomickým postupem.
Pro nejbližší budoucnost se zdá být zřejmé, že maximálně efektivní antiemeze se musí opírat o preventivní přístup s blokádou nejen serotoninových, ale i NK1 receptorů, a to nejen u vysoce, ale i středně emetogenní chemoterapie.
15. Závěr
Předcházení nevolnosti a zvracení při emetogenní chemoterapii je daleko účinnějším postupem než léčba již vzniklých potíží. Proto je dnes zásadním požadavkem důsledná antiemetická profylaxe CINV od prvního cyklu emetogenní léčby.
V posledních dvou desetiletích se s příchodem nových antiemetik významně zlepšily možnosti profylaxe CINV a byly vypracovány standardní postupy pro předcházení těmto stresujícím potížím. Přesto nemalá část onkologických pacientů i nadále zažívá nevolnost nebo i zvracení při onkologické léčbě, zvláště pak při jejím delším trvání a opakovaných cyklech (30–50 %). Jedním z důvodů může být sklon k podhodnocování těchto potíží odborným personálem a nedodržování standardních doporučení.
Samotné inhibitory 5-HT3 receptorů zabraňují zvracení pouze u poloviny nemocných s vysoce emetogenní chemoterapií v akutní fázi a mají ještě menší účinek v opožděné fázi po chemoterapii. Tato skutečnost není překvapením, protože na vzniku zvracení se podílí větší počet různých neurotransmiterů a jejich receptorů.
Zvýšení efektu antiemetické profylaxe vyžaduje postupovat podle standardních doporučení, jejichž cílem je v optimálním případě zabránit vzniku jakékoliv nevolnosti či zvracení. Kromě emetogenity chemoterapie je třeba posuzovat také individuální rizikové faktory pacienta a vyhodnocovat efekt profylaxe v předchozích cyklech léčby.
-
Aapro M., Rugo H., Rossi G. et al. A randomized phase III study evaluating the efficacy and safety of NEPA, a fixed-dose combination of netupitant and palonosetron, for prevention of chemotherapy-induced nausea and vomiting following moderately emetogenic chemotherapy. Ann Oncol 2014; 25 : 1328–33.
-
Aapro M., Schmoll H. J., Jahn F., Carides A. D., Webb R. T. Review of the efficacy of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in a range of tumor types. Cancer Treatment Reviews 2013; 39 : 113–117.
-
Hesketh P. J., Aapro M., Street J. C., Carides A. D. Evaluation of risk factors predictive of nausea and vomiting with current standard-of-care antiemetic treatment: analysis of two phase III trials of aprepitant in patients receiving cisplatin-based chemotherapy. Support Care Cancer 2009.
-
Boccia R., Grunberg S., Franco-Gonzales E. et al. Efficacy of oral palonosetron compared to intravenous palonosetron for the prevention of chemotherapy-induced nausea and vomiting associated with moderately emetogenic chemotherapy: a phase 3 trial. Support Care Cancer 2013; DOI: 10.1007/s00520-012-1691-5.
-
Botrel T. E., Clark O. A., Clark L. et al. Efficacy of palonosetron (PAL) compared to other serotonin inhibitors (5-HT3R) in preventing chemotherapy-induced nausea and vomiting (CINV) in patients receiving moderately or highly emetogenic (MoHE) treatment: systematic review and meta-analysis. Support Care in Cancer 2011; 19 : 823–32.
-
Celio L., Bonizzoni E., Bajetta E. et al. Palonosetron plus single-dose dexamethasone for the prevention of nauzea and vomiting in women receiving anthracycline/cyclophosphamide-containing chemotherapy: meta-analysis of individual patient data examining the effect of age on outcome in two phase III trials. Support Care Cancer 2013; 21 : 565–573.
-
Ettinger D. S. and Pannel Members. NCCN Clinical Practice Guidelines in Oncology. Version I. 2012. //www.nccn.org/professionals/physician_gls/
-
Gralla R. J., Bosnjak S. N., Hontsa A. et al. A phase III study evaluating the safety and efficacy of NEPA, a fixed-dose combination of netupitant and palonosetron, for prevention of chemotherapy-induced nausea and vomiting over repeated cycles of chemotherapy. Ann Oncol 2014; 25 : 1333–9.
-
Gralla R. J., Roila F., Tonato M., Herrstedt J. MASCC/ESMO Antiemetic Guideline 2013. Dostupné z http://www.mascc.org/assets/documents/mascc_guidelies_english_2013.pdf.
-
Hesketh P. J., Rossi G., Rizzi G. et al. Efficacy and safety of NEPA, an oral combination of netupitant and palonosetron, for prevention of chemotherapy-induced nausea and vomiting following highly emetogenic chemotherapy: a randomized dose-raging pivotal study. Ann Oncol 2014; 25 : 1340–6.
-
Hesketh P. J., Warr D. G., Street J. C., Carides A. D. Differential time course of action of 5-HT3 and NK1 receptor antagonists when used with highly and moderately emetogenic chemotherapy (HEC and MEC). Support Care Cancer 2011; 19 : 1297–1302.
-
Howell J. E., Szabatura A. H., Hatfield Seung A., Nesbit S. A. Characterization of the occurence of ifosfamide-induced neurotoxicity with concomitant aprepitant. J Oncol Pharm Pract 2008; 14 : 157–162.
-
JinY., Sun W., Gu D. et al. Comparative efficacy and safety of palonosetron with the first 5-HT3 receptor antagonists for the chemotherapy-induced nausea and vomiting: a meta analysis. Eur J Cancer Care 2013; 22 : 41–50.
-
Navari R. M. Palonosetron for the treatment of chemotherapy-induced nausea and vomiting. Expert Opin Pharmacother 2014; 15 : 2599-2608.
-
Navari R. M., Gray S. E., Kerr A. C. Olanzapine versus aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a randomized phase III trial. J Support Oncol. 2011; 9 : 188–195.
-
Popovic M., Warr D. G., DeAngelis C. et al. Efficacy and safety of palonosetron for the prophylaxis of chemotherapy-induced nausea and vomiting (CINV): a systematic review and meta-analysis of randomised controlled trials. Support Care Cancer 2014; 22 : 1685–1697.
-
Roila F., Herrstedt J., Aapro M. et al. Guideline update for MASCC and ESMO in the prevention of chemotherapy - and radiotherapy-induced nausea and vomiting: results of the Perugia consensus conference. Ann Oncol 2010; 21 (Suppl 5): v232–v243.
-
Roila F., Ruggeri B., Ballatori E. et al. Aprepitant versus dexametazone for preventing chemotherapy-induced delayed emesisin patients with breast cancer: a randomized double-blind study. J Clin Oncol 2014; 32 : 101–106.
-
Rojas C., Thomas A. G., Alt J. et al. Palonosetron triggers 5-HT3 receptor internalization and causes prolonged inhibition of receptor function. European J Pharmacol 2010; 626 : 193–199.
-
Schmitt T., Goldschmidt H., Neben K. et al. Aprepitant, granisetron, and dexametazone for prevention of chemotherapy-induced nausea and vomiting after high-dose melphalan in autologous transplantation for multiple myeloma: results of a randomized, plabeco controlled phase III trial. J Clin Oncol 2014; 32 : 3413–3420.
-
Schwartzberg L., Szabo S., Gilmore J. et al. Likelihood of a subsequent chemotherapy-induced nausea and vomiting (CINV) event in patients receiving low, moderately and highly emetogenic chemotherapy (LEC, MEC, HEC). Curr Med Res Opinion 2011; 27 : 837–845.
-
Tomíška M., Vorlíček J. Palonosetronum. Remedia 2006; 16 : 57–60.
-
Tomíška M. Antiemetická profylaxe chemoterapií indukované nevolnosti a zvracení. Remedia 2011; 21 : 12–17.
-
Tomíška M. Aprepitant. Remedia 2009; 19 : 3–8.
-
Tomíška M. Úloha aprepitantu v antiemetické profylaxi z perspektivy doporučených postupů a úhradového omezení. Antiemetics News 2014; 4 (1): 11–14.
-
Warr D. G., Street J. C., Carides A. D. Evaluation of risk factors predictive of nauzea and vomiting with current standard-of-care antiemetic treatment: analysis of phae III trial of aprepitant in patiečnts receiving adriamycin-cyclophosphamide-based chemotherapy. Support Care Cancer 2011; 19 : 807–813.
-
Yavas C., Dogan U., Yavas G. et al. Acute effect of palonosetron on electrocardiographic parameters in cancer patients: a prospective study. Support Care Cancer 2012; 20 : 2343–2347.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



