-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaChemoterapií indukovaná nauzea a zvracení (CINV)
Datum publikace: 15. 5. 2017
Odhalení centrálního mechanismu vzniku nauzey a zvracení při chemoterapii umožnilo vývoj účinné antiemetické léčby, která výrazně snížila výskyt nevolnosti a zvracení po protinádorové chemoterapii, přesto není zcela úspěšná u každého pacienta. Inhibitory receptorů 5-HT3 podávané samostatně zabraňují potížím jen asi u poloviny nemocných s emetogenní chemoterapií, jejich účinek je ovšem možné zvýšit kombinací s dalšími antiemeticky účinnými léky. Zvláště opožděné zvracení a nevolnost představují nejčastější nežádoucí účinky, které pacienty trápí doma. I z tohoto důvodu je třeba dodržovat standardní doporučení pro antiemetickou profylaxi, vycházející z výsledků velkých klinických studií. Optimálním přístupem je předcházení vzniku jakékoliv nevolnosti či zvracení od počátku podávání chemoterapie, protože léčba již vzniklých potíží je daleko méně úspěšná.
Nevolnost a zvracení po chemoterapii
Nevolnost a zvracení je jedním z nejnepříjemnějších nežádoucích účinků chemoterapie, které snižují kvalitu života nemocných a mohou bránit v pokračování léčby. Nevolnost a zvracení indukované chemoterapií (CINV – chemotherapy-induced nausea and vomiting) mohou mít za následek metabolický rozvrat řešitelný jen za hospitalizace. Už i mírná několikadenní nauzea zřetelně snižuje příjem stravy, což může být závažné zejména pro pacienty, kteří ztrácejí na váze. Použití moderních antiemetik ze skupiny inhibitorů receptorů 5-HT3 předchází vzniku těchto potíží u mnoha onkologických pacientů. Setrony mají vysokou účinnost při předcházení akutnímu zvracení v prvních 24 hodinách po zahájení chemoterapie. Jejich účinek proti opožděnému zvracení není významně vyšší než efekt metoklopramidu nebo dexamethasonu. V profylaxi akutního zvracení jsou samotné setrony účinné jen u poloviny nemocných. Proto je nezbytné kombinovat je s dalšími antiemetiky.
O přesném rozsahu těchto obtíží nemají ošetřující lékaři zcela objektivní představu. Potíže trápí nemocné většinou až doma, s odstupem času po ambulantním podání léčby. Podle klinické studie zaměřené na opožděné zvracení byl přes standardní antiemetickou profylaxi výskyt obtíží v odstupu zjištěn u 50 % nemocných s vysoce emetogenní chemoterapií a u 28 % se středně emetogenní chemoterapií.
Profylaxe CINV
Antiemetická léčba je nejúčinnější, pokud je podána preventivně, protože již vzniklé potíže jsou obvykle daleko hůře ovlivnitelné.
Antiemetická profylaxe se řídí podle doporučení a mezinárodních či národních standardů odborných společností (MASCC – Multinational Association for Supportive Care in Cancer; ESMO – European Society for Medical Oncology; NCCN – National Comprehensive Cancer Network; ASCO – American Society of Clinical Oncology) při každém cyklu emetogenní chemoterapie a jsou založena na výsledcích klinických studií.
Protože vznik CINV je multifaktoriální a podílejí se na něm různé nervové dráhy a receptory periferního i centrálního nervového systému (receptory 5-HT3, dopaminové receptory D2, neurokininové receptory NK1 a další), není možné najít jediný lék, který by byl plně účinný. Standardním doporučením u každé středně nebo vysoce emetogenní chemoterapie je proto použití kombinace antiemetik. I taková prevence však může při dlouhodobé chemoterapii selhávat, stejně jako v případě vícedenních režimů cytotoxické léčby, kdy dochází k překrývání akutního, opožděného i anticipačního zvracení a nevolnosti.
Tab. 1 Typy nevolnosti a zvracení po chemoterapii
Různé typy nauzey a zvracení vyžadují také různý terapeutický přístup
Akutní zvracení je zprostředkováno náhlým uvolněním serotoninu vlivem cytotoxických léků a jeho vazbou na receptory 5-HT3, k čemuž dochází jak na periferii v zažívacím traktu, tak i v oblasti chemorecepční spouštěcí zóny na spodině IV. mozkové komory.
Opožděné zvracení má jiný mechanismus vzniku, na němž se významně podílejí receptory NK1 se svým přirozeným mediátorem – substancí P.
Anticipační nevolnost a zvracení se dříve vyskytovaly u 20 % nemocných s opakovanou chemoterapií. V posledních letech, s účinnější antiemetickou profylaxí, se vyskytují přibližně u 10 % pacientů. Riziko se zvyšuje s narůstajícím počtem cyklů chemoterapie a nedůslednou profylaxí. Průlomové zvracení vzniká navzdory standardní antiemetické profylaxi. Refrakterní zvracení je charakterizováno přetrvávajícími potížemi i při optimální profylaxi v dalším cyklu léčby a navzdory farmakologické intervenci.
Mechanismus vzniku nauzey je ještě složitější a komplexnější, a její ovlivnění je proto často komplikovanější.
Emetogenita protinádorových léků
Emetogenita jednotlivých protinádorových léků je hodnocena podle pravděpodobnosti výskytu zvracení, pokud není pacient preventivně léčen antiemetiky. Vysoce emetogenní lék by při samostatném podání vyvolal zvracení u > 90 % léčených, zatímco středně emetogenní u 30–90 %. V širším slova smyslu jsou obě tyto kategorie považovány za emetogenní léčbu, a představují tak indikaci k preventivnímu podání antiemetik u všech nemocných.
O emetogenitě kombinované léčby rozhoduje zpravidla lék s největší emetogenitou. Kombinace léků a jejich bolusové podání emetogenitu zvyšuje, kontinuální pomalá infuze naopak snižuje.
Tab. 2 Vysoce a středně emetogenní protinádorová léčiva
Rizika CINV
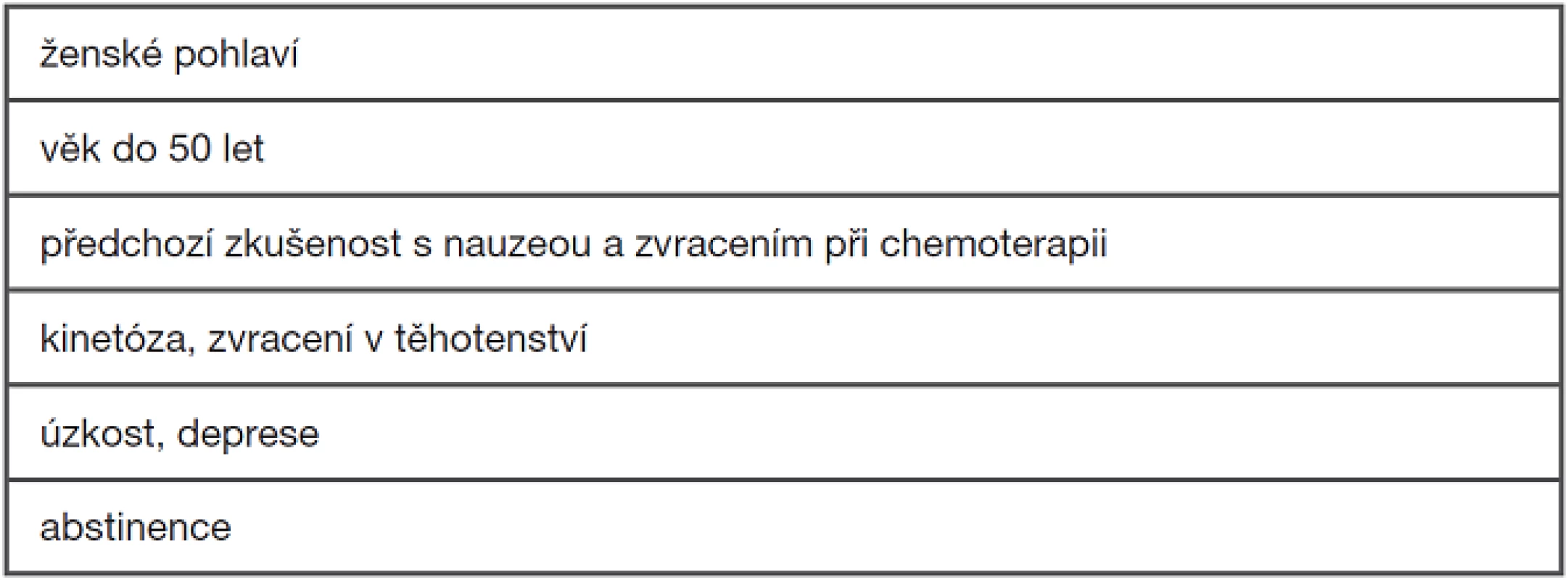
Sklon k CINV se také liší u jednotlivých pacientů. Vyšší riziko mají mladí lidé a především ženy. Významnou roli hraje anamnestický údaj o zvracení v minulosti, zejména kinetóza v anamnéze nebo nauzea a zvracení v těhotenství. Zvýšené riziko mají nemocní, kteří trpí úzkostí či depresí. Naopak protektivně působí pravidelná konzumace alkoholu. Důležitou informací je tolerance předchozí chemoterapie s ohledem na všechny fáze nauzey a zvracení a účinnost použité profylaxe i případné léčby.
Tab. 3 Rizikové faktory CINV
Inhibitory receptorů 5-HT3
Setrony blokují účinek serotoninu v akutní fázi po podání cytostatik v centrálním nervovém systému, ale i na periferních zakončeních nervu vagu v zažívacím traktu.
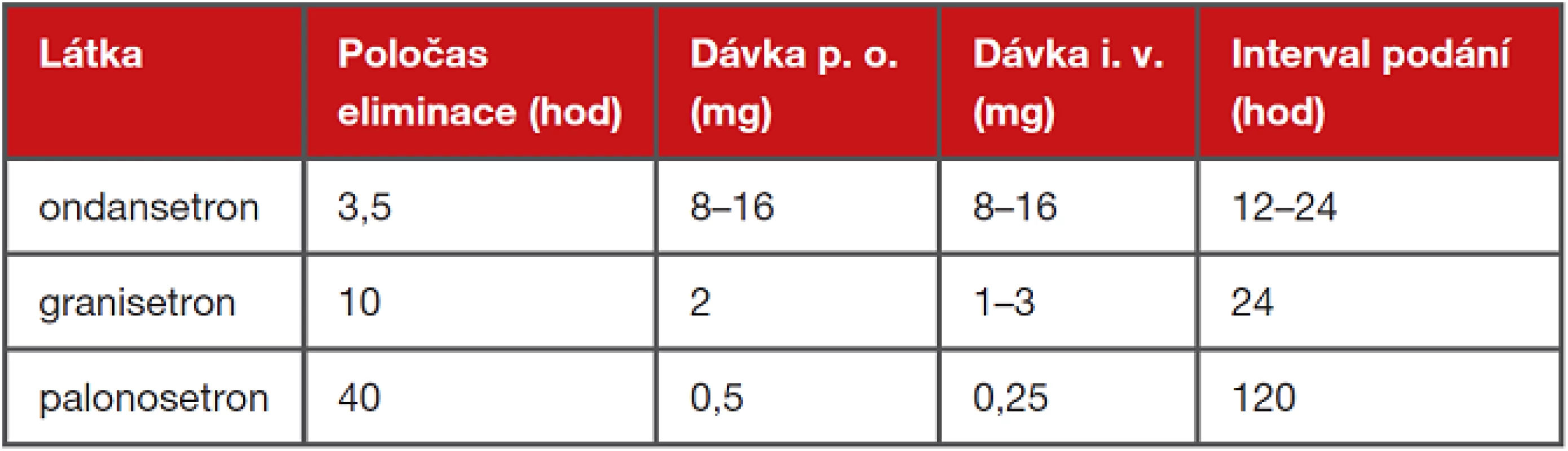
První generací inhibitorů receptorů 5-HT3 (ondansetron, granisetron) jsou antiemetika s dobrou biologickou dostupností (60 %) i v perorální podobě. Podle standardních doporučení je ondansetron i granisetron možno podávat buď v 1 denní dávce, nebo rozděleně do 2 dávek.
Palonosetron je vysoce selektivní kompetitivní antagonista receptorů 5-HT3 2. generace. Proti lékům první generace má až 100× vyšší afinitu k receptoru a podstatně delší terminální plazmatický eliminační poločas, zhruba 40 hodin.
Na molekulární úrovni působí, na rozdíl od ostatních inhibitorů receptorů 5-HT3, jako alosterický antagonista s pozitivní kooperací. Vazbou do nesubstrátového místa receptoru (alosterická vazba) usnadňuje vazbu druhé molekuly palonosetronu do samotného vazebného místa pro serotonin (ortosterická vazba), což způsobuje vysokou afinitu léku k receptoru. Výsledkem je internalizace receptorů 5-HT3 s dlouhodobou inhibicí funkce receptoru, což se zdánlivě jeví jako ireverzibilní účinek. U pacientů užívajících vysoce a středně emetogenní chemoterapii je palonosetron proti 1. generaci inhibitorů receptorů 5-HT3 účinnější v prevenci zvracení v opožděné fázi.
Tab. 4 Dávkování a poločas eliminace setronů
Premedikace i léčba setrony jsou bezpečné, jak prokázaly klinické studie. Mohou se vyskytnout mírné bolesti hlavy a zácpa (asi u 10 % nemocných).
Kortikosteroidy
Ačkoliv není mechanismus jejich antiemetického účinku zcela jasný, je prokázáno, že potencují účinek inhibitorů receptorů 5-HT3 a dobře ovlivňují opožděné zvracení a nevolnost.
Nejvhodnější je dexamethason, u něhož je prokázána závislost účinku na dávce v rozmezí 4–20 mg. Plně účinnou dávkou v profylaxi akutního zvracení po vysoce emetogenní chemoterapii je 20 mg podaných perorálně nebo nitrožilně. Při kombinaci s aprepitantem či netupitantem je ale doporučeno snížit dávku na 12 mg, neboť aprepitant i netupitant hladinu steroidů zvyšují. Při podávání kortikoidů je třeba nezapomínat na jejich nežádoucí účinky, jakými jsou hyperglykemie, možné poškození žaludeční sliznice, retence tekutin, při delším podávání osteoporóza a rozvoj moon face.
Inhibitory receptorů NK1
Inhibitory NK1 působí blokádu substance P na receptorech NK1. Tyto receptory jsou exprimovány v mozkovém kmeni v oblastech, které regulují reflex pro zvracení, ale také periferně na vagových zakončeních v oblasti dolního jícnového svěrače.
Aprepitant je prvním klinicky účinným inhibitorem receptorů NK1, který dobře proniká do mozku. Významné je především úspěšné ovlivnění zvracení v opožděné fázi. Vzhledem k odlišnému mechanismu účinku výhodně doplňuje antiemetickou kombinaci blokátorů receptorů 5-HT3 s kortikosteroidy.
Za standardní dávkování je dnes považován třídenní perorální režim, první den 125 mg a další dva dny vždy 80 mg.
Intravenózní forma, proléčivo (prodrug) fosaprepitant, u nás není k dispozici. Modrá kniha České onkologické společnosti ČLS JEP (24. aktualizace, platná od 1. 3. 2018) ovšem fosaprepitant uvádí a v ČR je možné si nechat dovézt a použít i u nás neregistrovaný léčivý přípravek.
Blokátory receptorů NK1 vykazovaly v některých studiích proti placebu častější výskyt únavy a škytavky, většinou však byly jen mírného stupně. Aprepitant se metabolizuje cestou izoenzymu 3A4 cytochromu P450, jehož aktivitu může ovlivnit, a zároveň má schopnost indukovat CYP2C9, čímž vzniká určitý potenciál pro lékové interakce.
Netupitant je vysoce selektivní antagonista receptoru NK1. Je substrátem a mírným inhibitorem CYP3A4, a může proto interagovat s jinými jeho substráty, například s dexamethasonem. Doporučenou perorální dávku dexamethasonu je při souběžném podávání netupitantu potřeba snížit přibližně o 50 %.
Fixní kombinace netupitantu a palonosetronu (NEPA)
NEPA je nová perorální fixní kombinace 300 mg netupitantu a 0,5 mg inhibitoru receptoru 5-HT3 2. generace palonosetronu. Lék v kombinaci s dexamethasonem dobře kontroluje akutní, ale i oddálené zvracení, dokonce lépe než podání kombinace palonosetronu a aprepitantu s dexamethasonem, což potvrdily výsledky klinických studií.
Studie fáze II porovnávala u 694 pacientů léčených chemoterapií založenou na platině 3 různé dávky netupitantu v kombinaci s palonosetronem proti samotnému palonosetronu. Pacienti byli randomizováni do celkem 5 skupin: 3 skupin léčených netupitantem v dávce 100, 200 anebo 300 mg v kombinaci s 0,5 mg palonosetronu první den, skupiny léčené samotným palonosetronem a skupiny zařazené jako exploratorní rameno, ve které byli pacienti léčeni kombinací aprepitantu s ondansetronem ve standardním 3denním režimu. Nemocní ve všech skupinách zároveň dostávali od 1. do 4. dne dexamethason. Nejlepší ochranu před zvracením s vyloučením jakékoliv potřeby záchranné antiemetické léčby vykazovala kombinace NEPA s nejvyšší dávkou netupitantu (87%, 88% a 90% ochrana pro 100, 200 a 300 mg NEPA, 77% pro palonosetron samotný a 87% pro aprepitant a ondansetron). Nežádoucí účinky byly ve všech ramenech podobné.
Účinek fixní kombinace NEPA ve více cyklech chemoterapie byl posuzován ve studii fáze III se 413 pacienty léčenými středně nebo vysoce emetogenní chemoterapií. Nemocní byli randomizováni k léčbě NEPA s dexamethasonem 1. den chemoterapie nebo k 3dennímu režimu aprepitant + palonosetron s dexamethasonem, který byl v obou skupinách podáván 4 dny u vysoce emetogenní a 1 den u středně emetogenní chemoterapie. V prvním cyklu nezvracelo a nepotřebovalo žádnou antiemetickou léčbu 81 % nemocných v rameni s NEPA a 76 % v kontrolním rameni. V průběhu všech dalších cyklů si NEPA udržovala 2–7% výhodu proti aprepitantu s palonosetronem. Nežádoucí účinky byly obdobné.
Ve třetí studii, u 1455 nemocných léčených cyklofosfamidem s antracyklinem, byl posuzován dopad premedikace pomocí fixní kombinace NEPA v porovnání se samotným palonosetronem. Pacienti v obou skupinách dostali rovněž 1 dávku dexamethasonu. Kompletní odpověď v průběhu 120 hodin byla v rameni s NEPA 74 % vs. 67 % v rameni s palonosetronem.
Na základě výsledků těchto 3 studií byla fixní kombinace NEPA v USA schválena pro prevenci a léčbu nauzey a zvracení již v říjnu 2014.
Doplňková terapie
Především u úzkostných pacientů, ale nejen u nich představují benzodiazepiny účinný doplněk emetogenní chemoterapie. U nás je doporučen alprazolam v jednotlivých dávkách 0,25–0,5 mg podávaných 4× denně pro léčbu zvracení či anticipačního zvracení a 0,5–1,0 mg 4× denně v případě průlomového zvracení.
Olanzapin je psychofarmakem schváleným pro léčbu schizofrenie. Působí blokádu četných neurotransmiterů na dopaminergních, serotoninergních, histaminergních i muskarinových receptorech. V klinických studiích u nemocných s emetogenní chemoterapií byla potvrzena jeho bezpečnost a účinnost proti akutnímu i opožděnému zvracení, ale také proti nevolnosti, která je obecně hůře ovlivnitelná než zvracení. Trojkombinace palonosetronu, dexamethasonu a olanzapinu je alternativou profylaxe vysoce emetogenní nebo středně emetogenní chemoterapie (HEC i MEC). O podání olanzapinu je možno uvažovat také při léčbě průlomového a refrakterního zvracení. Olanzapin je při předpisu na recept s úhradou pojišťovny vázán na odbornost psychiatra. Doporučené dávkování činí 10 mg denně.
Metoklopramid (blokátor receptorů D2) tlumí dopaminové receptory na periferní i centrální úrovni, má prokinetický účinek na zažívací trakt a v dávkách 10–20 mg podávaných každých 4–6 hodin působí také proti CINV. Další možností je využít blokády dopaminových receptorů haloperidolem v dávkách 0,5–2 mg podávaných perorálně nebo intravenózně, opakovaných každých 4–6 hodin.
Standardní přístup k antiemetické profylaxi
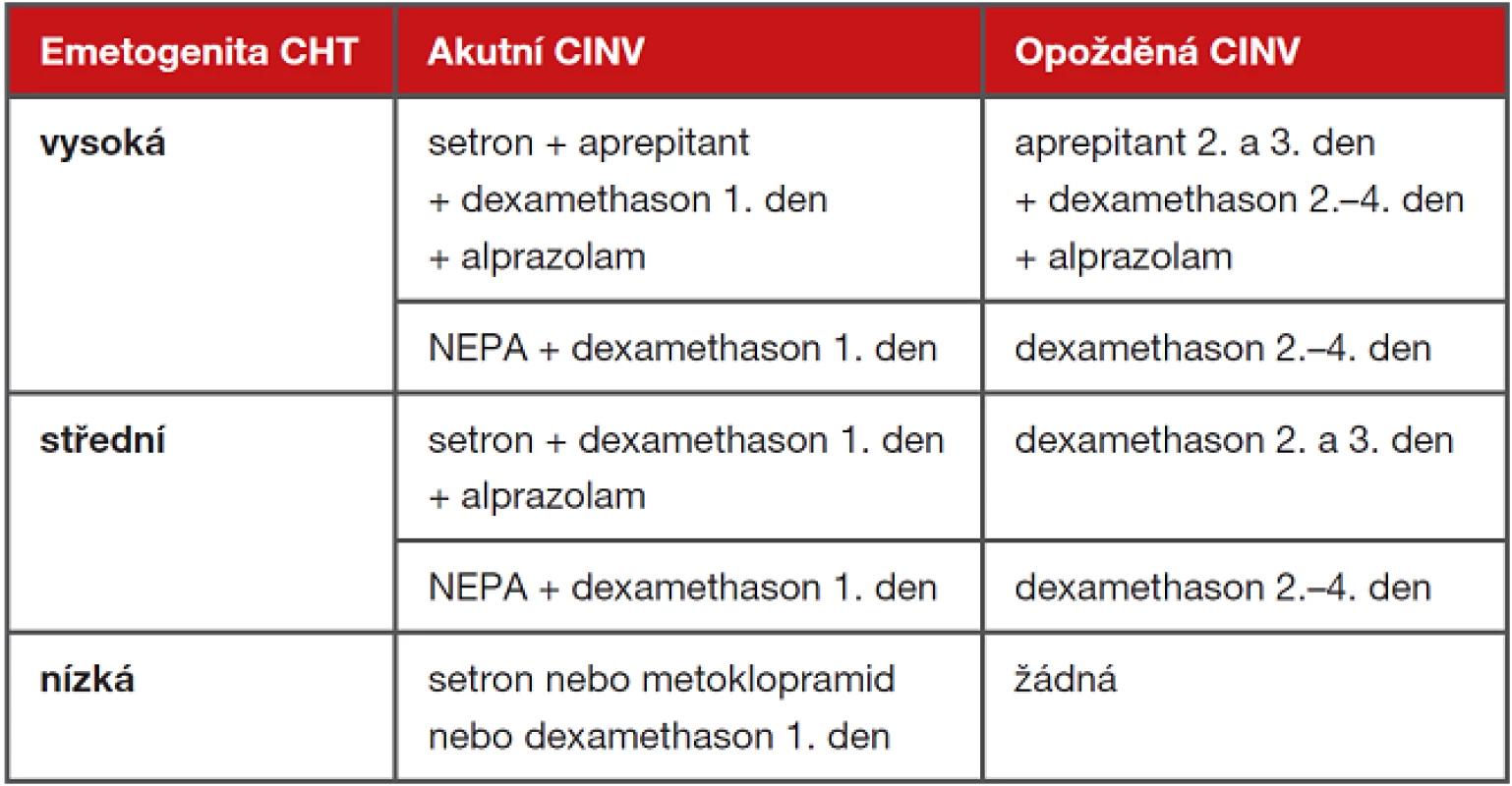
Každé podání protinádorové léčby by dnes mělo být provázeno posouzením rizika CINV podle všeobecně přijatých standardních postupů. V úvahu je třeba vzít emetogenitu protinádorových léků a rizikové faktory konkrétního pacienta a zhodnotit toleranci předchozího cyklu chemoterapie. Ambulantní pacient musí dostat léky k profylaxi opožděného zvracení a současně by měl mít k dispozici doporučení pro případ průlomového zvracení. Při chemoterapii s nízkou emetogenitou je také doporučeno podání antiemetika před každým cyklem chemoterapie, není však rutinně nutné zajišťovat opožděnou fázi.
Tab. 5 Zásady profylaxe CINV dle doporučení ESMO 2017 (upraveno pro dostupné preparáty)
Průlomové a refrakterní zvracení
Průlomové zvracení je takové, které vzniká i přes optimální antiemetickou profylaxi. Všeobecně je doporučeno podat lék z jiné skupiny, s jiným mechanismem antiemetického účinku, než mají látky, které byly užity. Je možné použít metoklopramid, ondansetron, granisetron, haloperidol, dexamethason, prometazin či alprazolam. Novou možností léčby průlomového zvracení je olanzapin, který je možno podat 3 dny po sobě v denní dávce 10 mg. Nemocní nereagující na konvenční antiemetickou léčbu mohou dostat kanabinoidy, např. dronabinol 5–10 mg p. o. Při průlomovém zvracení je třeba pacienta dostatečně hydratovat a kontrolovat a upravit iontové dysbalance. Nezvladatelné zvracení po chemoterapii je také důvodem k vyloučení jiných příčin, například obstrukce střeva nádorem, mozkových metastáz, metabolických poruch a dalších komplikací.
U nemocných s nedostatečnou kontrolou nevolnosti a zvracení v předchozím cyklu chemoterapie je nutno v dalším cyklu profylaktickou léčbu změnit.
Závěr
Předcházení nevolnosti a zvracení při emetogenní chemoterapii je daleko účinnějším postupem než léčba již vzniklých potíží. Proto je dnes zásadním požadavkem důsledná antiemetická profylaxe CINV od prvního cyklu emetogenní léčby. Se zavedením nových antiemetik se významně zlepšily možnosti profylaxe CINV a byly vypracovány standardní postupy pro předcházení těmto stresujícím potížím.
Samotné inhibitory receptorů 5-HT3 zabraňují zvracení pouze u poloviny nemocných s vysoce emetogenní chemoterapií v akutní fázi a ještě menší účinek mají v opožděné fázi po chemoterapii. Zvýšení efektu antiemetické profylaxe vyžaduje postupovat podle standardních doporučení, jejichž cílem je kompletní ochrana před vznikem jakékoliv nevolnosti či zvracení. Kromě emetogenity chemoterapie je nutné posuzovat také individuální rizikové faktory pacienta a vyhodnocovat efekt profylaxe v předchozích cyklech léčby.
- Hesketh P. J., Bohlke K., Lyman G. H. et al. Antiemetics: American Society of Clinical Oncology Focused Guideline Update. J Clin Oncol 2016; 34 : 38
- Roila F., Molassiotis A., Herrstedt J. et al. 2016 MASCC and ESMO guideline update for the prevention of chemotherapy - and radiotherapy-induced nausea and vomiting and of nausea and vomiting in advanced cancer patients. Ann Oncol 2016; 27: v119.
- Di Renzo N., Montanini A., Mannina D. et al. Single-dose palonosetron for prevention of chemotherapy-induced nausea and vomiting in patients with aggressive non-Hodgkin's lymphoma receiving moderately emetogenic chemotherapy containing steroids: results of a phase II study from the Gruppo Italiano per lo Studio dei Linfomi (GISL). Support Care Cancer 2011; 19 : 1505.
- Grunberg S., Deuson R. R., Mavros P. et al. Incidence of chemotherapy-induced nausea and emesis after modern antiemetics. Cancer 2004; 100 : 2261–2268.
- Warr D., Wilan A., Venner P. et al. A randomised, double-blind comparison of granisetron with high-dose metoclopramide, dexamethasone and diphenhydramine for cisplatin-induced emesis. An NCI Canada Clinical Trials Group Phase III Trial. Eur J Cancer 1992; 29A: 33.
- Chevallier B., Cappelaere P., Splinter T. et al. A double-blind, multicentre comparison of intravenous dolasetron mesilate and metoclopramide in the prevention of nausea and vomiting in cancer patients receiving high-dose cisplatin chemotherapy. Support Care Cancer 1997; 5 : 22.
- del Giglio A., Soares H. P., Caparroz C., Castro P. C. Granisetron is equivalent to ondansetron for prophylaxis of chemotherapy-induced nausea and vomiting: results of a meta-analysis of randomized controlled trials. Cancer 2000; 89 : 2301.
- Mason J. W., Selness D. S., Moon T. E. et al. Pharmacokinetics and repolarization effects of intravenous and transdermal granisetron. Clin Cancer Res 2012; 18 : 2913.
- Mason J. W., Moon T. E., O’Boyle E., Dietz A. A randomized, placebo-controlled, four-period crossover, definitive QT study of the effects of APF530 exposure, high-dose intravenous granisetron, and moxifloxacin on QTc prolongation. Cancer Manag Res 2014; 6 : 181.
- Likun Z., Xiang J., Yi B. et al. A systematic review and meta-analysis of intravenous palonosetron in the prevention of chemotherapy-induced nausea and vomiting in adults. Oncologist 2011; 16 : 207.
- Saito M., Aogi K., Sekine I. et al. Palonosetron plus dexamethasone versus granisetron plus dexamethasone for prevention of nausea and vomiting during chemotherapy: a double-blind, double-dummy, randomised, comparative phase III trial. Lancet Oncol 2009; 10 : 115.
- Aapro M. S., Grunberg S. M., Manikhas G. M. et al. A phase III, double-blind, randomized trial of palonosetron compared with ondansetron in preventing chemotherapy-induced nausea and vomiting following highly emetogenic chemotherapy. Ann Oncol 2006; 17 : 1441.
- dos Santos L. V., Souza F. H., Brunetto A. T. et al. Neurokinin-1 receptor antagonists for chemotherapy-induced nausea and vomiting: a systematic review. J Natl Cancer Inst 2012; 104 : 1280.
- Nygren P., Hande K., Petty K. J. et al. Lack of effect of aprepitant on the pharmacokinetics of docetaxel in cancer patients. Cancer Chemother Pharmacol 2005; 55 : 609.
- Aapro M., Rugo H., Rossi G. et al. A randomized phase III study evaluating the efficacy and safety of NEPA, a fixed-dose combination of netupitant and palonosetron, for prevention of chemotherapy-induced nausea and vomiting following moderately emetogenic chemotherapy. Ann Oncol 2014; 25 : 1328.
- Hesketh P. J., Rossi G., Rizzi G. et al. Efficacy and safety of NEPA, an oral combination of netupitant and palonosetron, for prevention of chemotherapy-induced nausea and vomiting following highly emetogenic chemotherapy: a randomized dose-ranging pivotal study. Ann Oncol 2014; 25 : 1340.
- Gralla R. J., Bosnjak S. M., Hontsa A. et al. A phase III study evaluating the safety and efficacy of NEPA, a fixed-dose combination of netupitant and palonosetron, for prevention of chemotherapy-induced nausea and vomiting over repeated cycles of chemotherapy. Ann Oncol 2014; 25 : 1333.
- Česká onkologická společnost. Zásady prevence a léčby nevolnosti a zvracení po protinádorové léčbě. Modrá kniha české onkologické společnosti. 24. aktualizace, 2018. Dostupné na: www.linkos.cz/files/modra-kniha/17/649.pdf
- Chiu L., Chow R., Popovic M. et al. Efficacy of olanzapine for the prophylaxis and rescue of chemotherapy-induced nausea and vomiting (CINV): a systematic review and meta-analysis. Support Care Cancer 2016; 24 : 2381.
- Sallan S. E., Zinberg N. E., Frei E. 3rd. Antiemetic effect of delta-9-tetrahydrocannabinol in patients receiving cancer chemotherapy. N Engl J Med 1975; 293 : 795.
Kurz je již bez kreditace, vhodný k edukaci
Byl pro Vás kurz přínosný? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání