-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
Temporal lobe epilepsy in adults and possibilities of neurosurgical treatment: the role of magnetic resonance
Temporal lobe epilepsy is the most common type of focal epilepsy diagnosed in adult patients. According to the location of seizure generation it is classified as mesial temporal lobe epilepsy and neocortical lateral lobe epilepsy. Diagnosis of temporal lobe epilepsy can be proved by the combination of the clinical manifestation of partial complex seizures, scalp-video EEG monitoring, results of magnetic resonance imaging (MRI) and imaging of interictal fluoro-deoxy-glucose positron emission tomography. Mesial temporal sclerosis is the most common finding on MRI. Temporal lobe epilepsy is the most surgically amenable diagnosis and results of surgery treatments are clearly superior to the prolonged medical therapy; surgical treatment of the mesial temporal epilepsy with mesial temporal sclerosis has the best clinical results. Except for standard microsurgical approaches such as anterior temporal resection and selective amygdalo-hippocampectomy, stereotactic thermocoagulation amygdalo-hippocampectomy is provided in our epilepsy centre. This alternative approach has comparable clinical outcome to the standard surgery approaches in 2 years clinical follow-ups. MRI is important not only in diagnostic procedures, but also in neuronavigation of surgery approaches, per operation control of the extent of resections and postoperative follow-ups, especially in failed epilepsy surgery.
Key words:
temporal lobe epilepsy, surgery, stereotactic, thermocoagulation, magnetic resonance.
Autoři: Hana Malíková 1; Roman Liščák 2; Zdeněk Vojtěch 3; Tomáš Procházka 3; Iva Marečková 3; Vladimír Dbalý 4; Josef Vymazal 1; Miroslav Kalina 3; Vilibald Vladyka 2
Působiště autorů: Radiodiagnostické oddělení Nemocnice Na Homolce, Praha 1; Oddělení stereotaktické a radiační neurochirurgie Nemocnice Na Homolce, Praha 2; Neurologické oddělení Nemocnice Na Homolce, Praha 3; Neurochirurgické oddělení Nemocnice Na Homolce, Praha 4
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 254-259
Kategorie: Přehledový článek
Souhrn
Temporální epilepsie je nejčastějším typem fokální epilepsie u dospělých. Podle místa vzniku epileptické aktivity se rozděluje na mesiální temporální epilepsii a laterální neokortikální temporální epilepsii. Diagnóza temporální epilepsie je stanovena na základě klinického projevu parciálních komplexních záchvatů, skalp video EEG monitoringu, nálezu na magnetické rezonanci (MR) a interiktální fluoro-deoxy-glukóza pozitronové emisní tomografii. Nejčastější nález na MR u mesiální temporální epilepsie je mesiální temporální skleróza. Temporální epilepsie je chirurgicky nejlépe řešitelný typ fokální epilepsie, dlouhodobě je chirurgická léčba úspěšná ve více než 70 %, přičemž efekt léčby mesiální temporální epilepsie s detekovatelnou mesiální temporální sklerózou je nejúspěšnější. Kromě standardních mikrochirurgických resekcí, jako je přední temporální resekce a selektivní amygdalohippokampektomie, se v našem epileptickém centru provádí rovněž stereotaktická termokoagulační amygdalohippokampektomie, která má při dvouletém klinickém sledování srovnatelné klinické výsledky s ohledem na redukci epileptických záchvatů jako klasická mikrochirurgická léčba. MR nemá význam pouze v diagnostice, ale i v neuronavigaci operačního výkonu, perioperační kontrole rozsahu výkonu a pooperačním sledování zejména při případném selhání chirurgické léčby.
Klíčová slova:
temporální epilepsie, chirurgie, stereotaxe, termokoagulace, magnetická rezonance.Temporální epilepsie
Epilepsie je onemocnění definované opakovanými epileptickými záchvaty. Ačkoliv prevalence epilepsie v populaci je odhadována na 1,3–3,1 %, jeden epileptický záchvat v životě prodělá asi 1–10 % populace (1).
Temporální epilepsie (TLE) je nejčastějším typem fokální epilepsie u dospělých pacientů. TLE je klasifikována jako lokalizačně vázaný epileptický syndrom a je obvykle rozdělována na dvě kategorie: mesiální temporální epilepsie (MTLE) a laterální neokortikální temporální epilepsie (NTLE) (2). U MTLE záchvaty vycházejí z mediálních struktur temporálního laloku, u NTLE jsou záchvaty generovány laterálním neokortexem. Ovšem mezi oběma typy TLE se vyskytuje určitý přesah v symptomatologii, léčbě a etiologii záchvatů (3). Pokud nejsme schopni pomocí magnetické rezonance (MR) zobrazit jasnou patologii, pak bez možnosti invazivního EEG‑monitoringu není možné oba typy TLE uspokojivě rozlišit (4). Nejčastěji MR detekovaným substrátem u MTLE je mesiální temporální skleróza (MTS) (obr. 1). MTLE s MTS (5, 6) je chirurgicky nejlépe léčitelný typ epilepsie a výsledky neurochirurgické terapie jednoznačně převyšují dlouhodobou farmakologickou léčbu (7, 8). Po chirurgické léčbě dochází k dlouhodobému odstranění záchvatů přibližně v 70 % případů (9, 10). Histologické zpracování resekovaných mesiálních struktur prokázalo úbytek a reorganizaci neuronů a gliové změny (11, 12). Studie Lencze et al. prokázala, že neuronální úbytek v oblasti hipokampální formace signifikantně koreluje s poklesem objemu hippocampu (13). Jiní autoři prokázali, že atrofie hippocampu koreluje s pooperační redukcí či odstraněním epileptických záchvatů (14). Strukturální a elekrofyziologické změny u MTLE jsou sice nejlépe poznány a popsány v oblasti hipokampální formace, avšak u MTLE dochází k rozsáhlejšímu postižení, které se týká rovněž dalších mediálních struktur temporálního laloku. Mediální temporální lalok u člověka se skládá kromě hippocampální formace ještě z amygdaly, která anatomicky patří mezi bazální ganglia, ale funkčně se řadí k limbickému systému a z okolních kortexů: entorhinálního kortexu (EC), perirhinálního kortexu (PRC), parahipokampálního kortexu a temporopolárního kortexu (15).
Obr. 1. Levostranná MTLE s MTS Levý hippocampus je menší a na T2 WI má zvýšený signál. 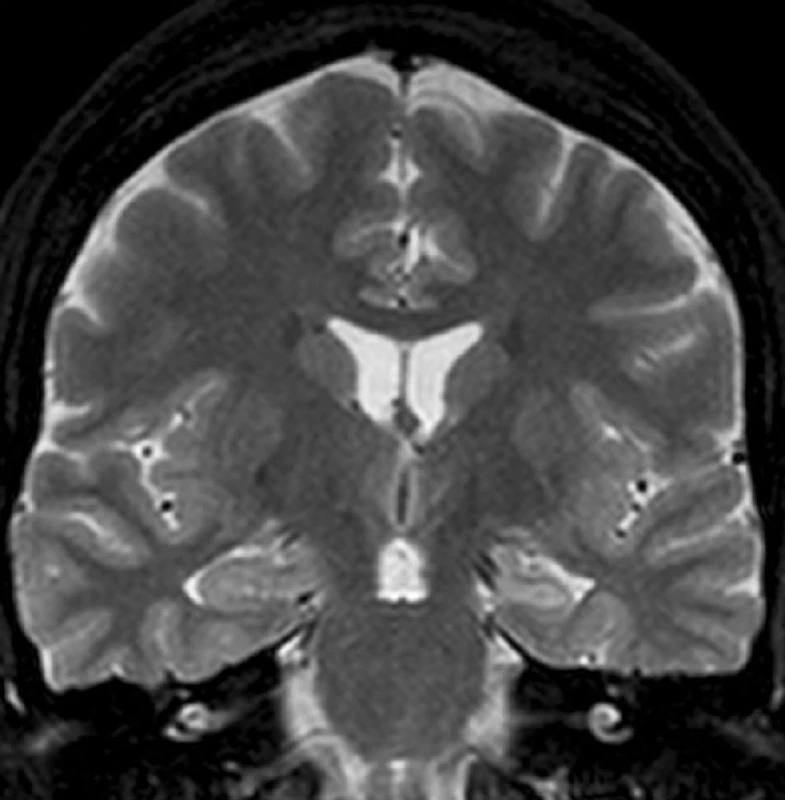
Zobrazovací metody v diagnostice temporální epilepsie
V současné době je MR jistě nejvýznamnější zobrazovací metodou v diagnostice TLE. Standardní epileptologický protokol používaný na našem pracovišti se skládá z následujících sekvencí: TSE T2/PD WI axiálně, T2* axiálně, T1 MPR 3D, T2 WI turbo FLAIR axiálně a koronárně, TSE T2 WI koronárně; koronární roviny zasazujeme kolmo na dlouhou osu hippocampu s maximálním úsilím o zachycení celého rozsahu amygdalohipokampálního komplexu (AHK).
Jak už bylo zmíněno výše, nejčastějším patologickým substrátem nacházeným na MR je MTS. MTS či rovněž hipokampální skleróza se projevuje zmenšeným objemem hipokampální formace s následnou dilatací temporálního rohu postranní komory a zvýšeným signálem na T2 WI (12). Zvýšený signál na T2 vážení je odrazem přítomné astrogliózy, úbytku neuronů a jejich reorganizace. Volumetrická data prováděná u pacientů s MTLE odhalila rovněž změny v objemech amygdaly, PRC a EC (16). Rovněž neuropatofyziologická vyšetření resekčních vzorků potvrdila histologické změny ve smyslu astrogliózy a neuronální ztráty v EC (17). Na MR spektroskopii mají u MTLE postižené struktury sníženou hladinu N-acetylaspartátu (NAA) (18).
Funkční zobrazování, jakožto významná součást diagnostiky MTLE, si také zaslouží krátké představení. Fluoro-deoxy-glukóza pozitronová emisní tomografie (FDG-PET) mozku vykazuje interiktální hypometabolismus přibližně u 80 % pacientů s MTLE. Bylo prokázáno, že tento hypometabolismus postihuje oblast širší, než je vlastní epileptogenní zóna (19). Ačkoliv specificita FDG-PET je nízká, senzitivita je natolik vysoká, že někteří autoři zpochybňují diagnózu MTLE při absenci FDG-PET pozitivity. Odhaduje se, že asi 30 % MTLE nemá známky zjevné MTS na standardním MR vyšetření. Patofyziologický základ FDG-PET hypometabolismu není sice objasněn, ale jasné je, že FDG-PET hypometabolismus excelentně koreluje s MTS zobrazenou na MR v určení lateralizace epileptické zóny. Řada studií se ovšem shoduje v názoru, že závažnost hypometabolismu slabě nebo vůbec nekoreluje s MR volumetrií (20, 21). Carne et al. nalezli v zaslepené vizuální analýze rozsáhlejší hypometabolismus v oblasti temporálního laloku u pacientů na MR MTS negativních než u pacientů na MR MTS pozitivních (22). Úskalím této studie byla samozřejmě vizuální analýza, bez přítomnosti objektivnější kvantifikace.
Z důvodu výše zmíněného překrývání symptomatologie, etiologie a léčby TLE někteří autoři (23) preferují jiné rozlišení TLE do více kategorií na a) mesiální temporální epilepsii rozuměno s přítomností MTS, b) na kryptogenní TLE bez přítomnosti jakékoliv detekovatelné léze na MR a na c) lesionální TLE s detekcí jiné patologie na MR než je MTS. V případě lesionální TLE jsou neoplazie zodpovědné za asi 10–15 % TLE, vrozené vývojové vady za přibližně 20 % a konečně traumata za asi 5–10 % TLE (11). K úplnému dokreslení složitosti diagnostiky TLE je nutné zmínit rovněž duální patologie přítomné součastně s MTS, tedy možnost dalšího patologického fokusu, který je schopen generovat epileptické záchvaty. Duální patologie u TLE se vyskytují přibližně v 15 % případů a může se jednat o vrozené vývojové vady, jako jsou poruchy organizace a diferenciace (dyplázie a dystopie šedé hmoty), cévní malformace (kavernomy a arteriovenózní malformace) a jiné příčiny jako např. tumory (24). Přítomnost duální patologie a její klinické podcenění či nediagnostikování může být příčinou selhání epileptochirurgické léčby.
Ačkoliv je MR jistě jednou z nejdůležitějších zobrazovacích metod v průkazu TLE, nelze se spolehnout pouze na ni. Klinická diagnóza TLE se opírá o komplexní vyšetřovací protokol, který kromě MR zahrnuje FDG-PET a video-EEG monitoraci. Pokud tyto výše zmíněné metody nejsou ve svých výsledcích v souhlase, pak se protokol nezřídka doplňuje ještě invazivní EEG monitorací stereotakticky zavedenými hlubokými elektrodami k rozlišení obou typů TLE. Nezbytnou součástí epileptologické diagnostiky je rovněž neuropsychologické vyšetření a zejména před plánovaným epileptochirurgickým výkonem i WADA testy s intraarteriálním podáním methohexicalu.
Možnosti chirurgické léčby temporální epilepsie
Resekce temporálního laloku byly po řadu let nejčastěji používanou chirurgickou léčbou TLE. Standardní přední temporální lobektomie (ATL), jak byla popsaná Spencerem a Insernim, zahrnuje obvykle resekci hippocampu, amygdaly a parahipokampálního gyru včetně laterálního neokortexu 3–3,5 cm od temporálního pólu se zachováním horního temporálního gyru (25). Tento typ resekce se používá u obou typů TLE. Je známo, že po temporálních resekcích často dochází ke zhoršení neuropsychologických funkcí (26, 27), což je jedním z hlavních důvodů, proč se po léta hledají nové terapeutické možnosti a přístupy, jejichž cílem je co možná nejšetrnější a nejselektivnější zákrok v oblasti temporálního laloku u pacientů s MTLE. Již v roce 1958 Niemeyer představil selektivní transkortikální amygdalohipokampektomii (AHE) (28). Cílem tohoto chirurgického přístupu bylo odstranit mesiální struktury temporálního laloku, tj. hippocampus, amygdalu a část parahipokampálního gyru, a co nejvíce minimalizovat neokortikální resekci. Po Niemeyerovi, Yasargil et al. navrhli striktně mesiální typ resekce transsylvijským přístupem (29). V literatuře se objevila řada studií, které potvrzovaly srovnatelné klinické výsledky s ohledem na kontrolu epileptických záchvatů po ATL i AHE (25, 30–33). Ovšem v literatuře rovněž bylo popsáno, že díky kolaterálním pooperačním změnám je AHE méně selektivní, než se očekávalo (34). Ve studiích srovnávající neuropsychologické postoperační výsledky po ATL a AHE bylo zjevně prokázáno, že neuropsychologické výsledky jsou po AHE lepší než po ATL (30–33).
I přes úspěch neurochirurgické klasické resekční léčby se po desetiletí hledají nové minimálně invazivní metody léčby MTLE, které by dále zvýšily selektivnost výkonu a celkový komfort pacienta. Pokusy se stereotaktickou léčbou MTLE se objevují již od padesátých let 20. století. Průkopníci stereotaktické AHE naráželi v těchto pionýrských dobách na řadu úskalí, jakým byla zejména nemožnost přímé vizualizace struktur, které se pokoušeli terapeuticky postihnout. Metodologie těchto prvních operací byla založena na stereotaktickém zaměření cílové struktury pomocí anatomických stereotaktických atlasů a grafických obrazů získaných ventrikulografií. Logickou konsekvencí této metodologie bylo, že cílové struktury byly často stereotaktickým instrumentariem minuty. Kromě toho léčba narážela i na nedostatečnou diagnostiku MTLE, tudíž řada případů byla jistě poddiagnostikována. Důsledkem výše zmíněných úskalí bylo časté selhání této léčby, jejíž výsledky nedosahovaly úrovně klasické chirurgické léčby. K průkopníkům stereotaktických neurochirurgických metod ve světě patří Talairach (35–37) a rovněž český neurochirurg a propagátor stereotaktické léčby v našich zemích Vladyka (38). Talairach et al. prováděli stereotaktické léze pomocí brachyterapie. Vladyka se touto metodou inspiroval, ale zvolil okcipitální přístup s jednou trajektorií probíhající v dlouhé ose hippocampu a místo brachyterapie zvolil termokoagulaci amygdalohipokampálního komplexu (AHK) (38).
K stereotaktické radiofrekvenční AHE se v roce 1999 vrátili Parrent a Blume, kteří již disponovali veškerými diagnostickými možnostmi. Tito autoři provedli 22 stereotaktických operací u 19 pacientů. Parrent a Blume používali laterální (temporální) přístup s řadou trajektorií a termokoagulační léze prováděli rovnou a zakřivenou sondou. Jejich klinické výsledky léčby byly celkově neuspokojivé: pouze přibližně 10 % pacientů bylo po léčbě bez přítomnosti epileptických záchvatů. Z tohoto důvodu od léčby ustoupili (39).
V naší nemocnici se stereotaktická radiofrekvenční AHE (SAHE) provádí od roku 2004. Naši neurochirurgové zvolili oproti Parrentovi a Blumovi jinou přístupovou cestu z okcipitální krajiny a termokoagulační léze provádějí pouze z jedné trajektorie v dlouhé ose AHK. K této technice je ovšem třeba speciální instrumentárium, u kterého má termokoagulační elektroda flexibilní konec, jenž umožňuje v jednom segmentu provádět několik lézí. Klinicky je tato modifikovaná léčba úspěšná a klinické výsledky po dvouletém sledování jsou srovnatelné s otevřenými mikrochirurgickými přístupy (40–42).
U lesionálních typů TLE (tumory, malformace atd.) je chirurgická léčba modifikována dle velikosti a typu patologické léze.
Možnosti perioperační a postoperační MR
Je známým faktem, že rozsah resekce se u takzvaných standardních operací značně liší mezi jednotlivými epileptickými centry i uvnitř center samotných. Rovněž je známé, že jedna věc je zamýšlený rozsah resekce a druhá opravdový rozsah výkonu (43).
Rozvoj MR výrazně zlepšil přesnost a efektivnost neurochirurgických výkonů obecně. Její význam nespočívá pouze v diagnostickém vyšetření, ale rovněž v možnosti zaměřovacích vyšetření, které jsou používány pro plánování a vlastní provedení chirurgických výkonů za použití neuronavigačních neurochirurgických a stereotaktických systémů. Veškeré neurochirurgické operace jsou v součastné době prováděny pod kontrolou neuronavigačního systému, ke kterému je obvykle používáno T1 MPR 3D zobrazení po aplikaci gadoliniové kontrastní látky intravenózně.
SAHE je plánována a prováděna podle individuální anatomie pacienta, tj. dle zaměřovacího postkontrastního T1 3D vyšetření (obr. 2). V praxi to znamená, že MR vyšetření je prováděno přímo se stereotaktickým rámem připevněným na hlavě pacienta. Plánování trajektorie termokoagulace je pak vysoce přesné a minutí cílových struktur je prakticky nemožné (40–42).
Obr. 2. Plánování trajektorie SAHE a – jediná trajektorie SAHE je plánována z okcipitálního přístupu tak, aby procházela středem AHK a ventrálně začínala v oblasti amygdaly; b – ilustrační obrázek stereotaktického rámu s vyznačením místa „entry“ 
Před operacemi temporálního laloku je v současné době na našem pracovišti prováděna i optická traktografie, která je následně fúzována do navigačního T1 MPR 3D vyšetření (obr. 3). Domníváme se, že tímto postupem budeme schopni omezit procento pooperačního postižení zrakového pole, které nebývá po operacích temporální laloku vzácné. Rozsah resekce temporálních struktur je rovněž v současné době (tj. od 9/2010) v našem epileptickém centru kontrolován přímo na operačním sále perioperační MR (obr. 4).
Obr. 3. Fúze optické traktografie do neuronavigačního vyšetření před pravostrannou ATL 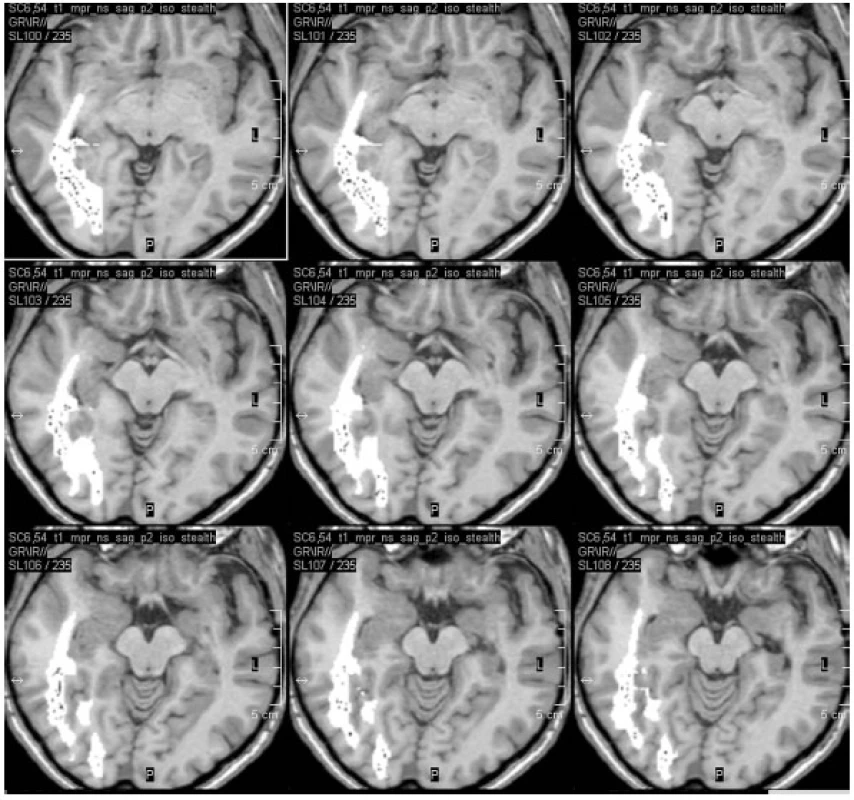
Obr. 4. Obr. 4. Perioperační MR a – vyšetření v TSE T2 WI koronární rovině, b – vyšetření stejnou sekvencí v transverzální rovině (zobrazen je čerstvý operační defekt po právě provedené ATL vpravo vyplněný tekutinou a vzduchem) 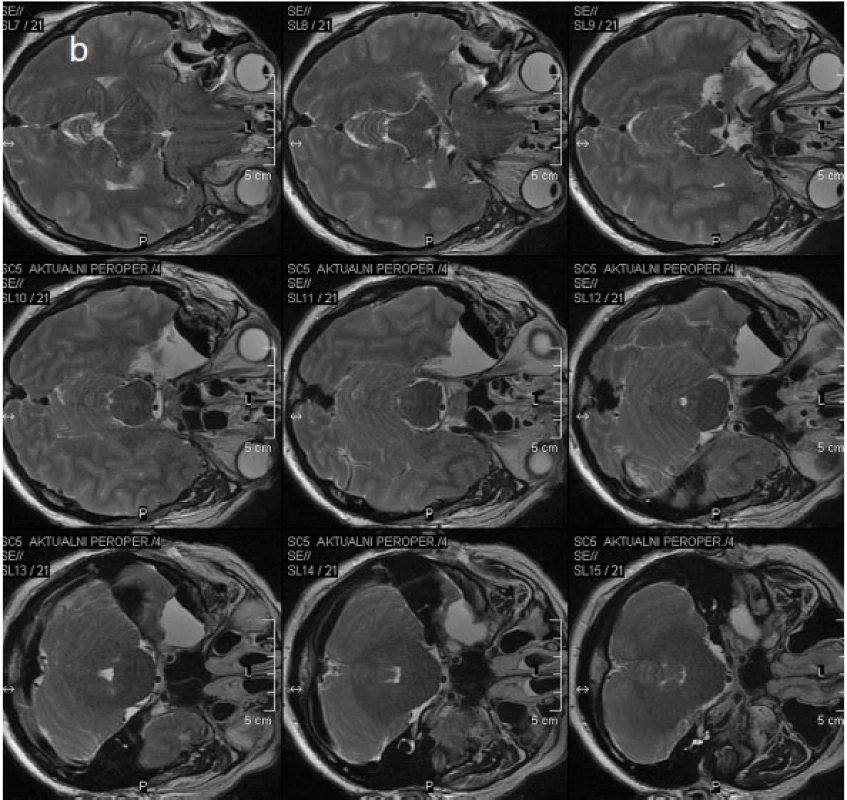
Kontrolní MR vyšetření po neurochirurgických výkonech je prováděno standardně v odstupu jednoho roku, pokud to klinický stav nevyžaduje dříve. Výjimkou jsou pacienti po SAHE, u nichž je prováděna časná MR kontrola 2.–6. den po výkonu. Na časné pooperační kontrole se na MR zobrazuje uniformní termokoagulační léze (obr. 5), která postihuje oblasti hippocampu, amygdaly a částečně i parahipokampálního gyru. Tato léze je typicky heterogenního signálu na T1 i T2 WI a obsahuje hemoragické složky. Po intravenózní aplikaci gadoliniové kontrastní látky dochází k jemnému perifernímu prstencovitému sycení při poruše hematoencefalické bariéry. Typický je malý vazogenní perifokální edém. Během jednoho roku se vytvoří nevelká postnekrotická pseudocysta (obr. 6) obklopená atrofickou tkání a gliózou. Cílové struktury, tj. hippocampus, amygdala a EC a PRC, jsou redukovány přibližně z 50 % (40, 41).
Obr. 5. Čerstvá termokoagulační léze po SAHE (odstup 4 dny po výkonu) V koronární rovině v TSE T2 WI je přítomná prstencovitá kulovitá termokoagulační léze s malým vazogenním perifokálním edémem postihující levý AHK. 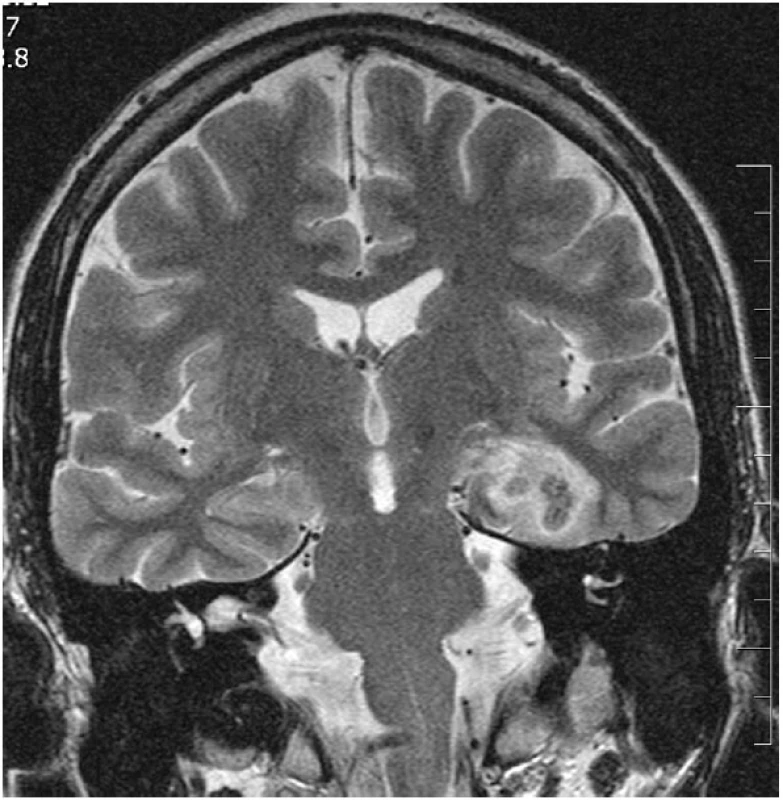
Obr. 6. Posttermokoagulační pseudocysta po proběhlé SAHE (zobrazena drobná postnekrotická pseudocysta v mediálním temporálním laloku vlevo s výraznou okolní atrofií – koronární rovina TSE T2 a FLAIR) 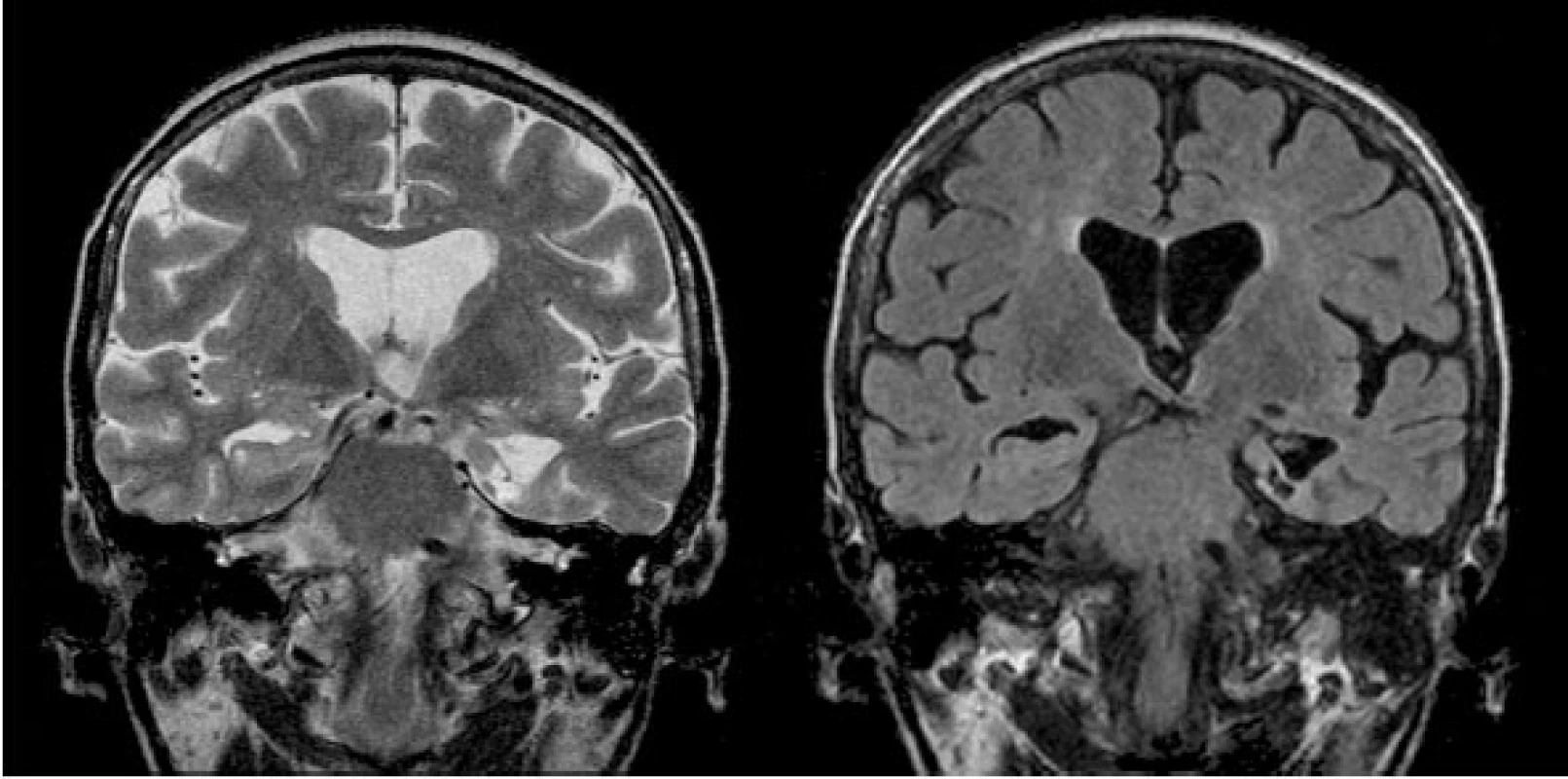
Při selhání chirurgické léčby se v zobrazení MR zaměřujeme na rozsah resekce či termokoagulace, ačkoliv se řada autorů domnívá, že rozsah resekce/termokoagulace u MTLE není podstatná pro klinický efekt operace (43, 44). V případě lesiotomie pátráme po možných zbytcích patologického ložiska či ložisek. Jak již bylo zmíněno výše, možnou příčinou selhání epileptochirurgické léčby může být i duální patologie, která nebyla včas odhalena.
Závěr
Závěrem lze říci, že úloha MR v epileptologii je strategická. MR nemá význam pouze v diagnostice epileptogenních lézí, ale i v neuronavigaci operačního výkonu, perioperační kontrole rozsahu výkonu a pooperačním sledování zejména při případném selhání chirurgické léčby.
Zkratky
3D – trojrozměrná
AHE – amygdalohipokampektomie
AHK – amygdalohipokampální komplex
ATL – přední temporální lobektomie
EC – entorhinální kortex
EEG – elektroencefalografie
FDG – fluorodeoxyglukóza
FLAIR – fluid-attenuated inversion recovery
MPR – multiplanární rekonstrukce
MR – magnetická rezonance
MTLE – mesiální temporální epilepsie
MTS – mediální temporální skleróza
NTLE – neokortikální laterální temporální epilepsie
PET – pozitronová emisní tomografie
PRC – perirhinální kortex
SAHE – stereotaktická amygdalohipokampektomie
SE – spin-echo
SPECT – jednoprotonová emisní tomografie
T1 WI – T1 vážené obrazy
T2 WI – T2 vážené obrazy
TLE – temporální epilepsie
TR – time-to-repeate
TSE – turbo-spin-echo
WADA test – intracarotid sodium amobarbital procedure
Adresa pro korespondenci:
MUDr. Hana Malíková, Ph.D.
Radiodiagnostické oddělení Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
fax: +420 257 272 604, e-mail: hana.malikova@homolka.cz
Zdroje
1. Trescher WH, Lesser RP. The epilepsies. In: Bradley W G, Daroff RB, Fenichel GM, Marsden CD. Neurology in clinical practice. Boston: Butteworth-Heinemann 1996; 1625–1654.
2. Commission on Classification and Terminology of the ILAE, Proposal for revised classification of epilepsies and epileptic syndromes. Epilepsia 1989; 30 : 389–399.
3. Shorvon SD. Introduction to epilepsy surgery and its presurgical assessment. In: The Treatment of Epilepsy, 2nd ed. Oxford: Blackwell 2004; 597–598.
4. Madhavan D, Kuzniecky R. Temporal lobe surgery in patients with normal MR. Curr Opin Neurol 2007; 20 : 203–207.
5. Engel J Jr. Introduction to temporal lobe epilepsy. Epilepsy Res 1996; 261 : 141–150.
6. Sadler RM. The syndrome of mesial temporal lobe epilepsy with hippocampal sclerosis: clinical features and differential diagnosis. Adv Neurol 2006; 97 : 27–37.
7. Wiebe S, Blume WT, Girvin JP, et al. A randomized, controlled trial of surgery for temporal lobe epilepsy. N Engl J Med 2001; 345 : 311–318.
8. Spencer SS, Berg AT, Vickrey BG, et al. Initial outcomes in the multicenter study of epilepsy surgery. Neurology 2003; 61 : 1680–1685.
9. McIntosh AM, Wilson SJ, Berkovic SF. Seizure outcome after temporal lobectomy: current research practice and findings. Epilepsia 2001; 42 : 1288–1307.
10. Wieser HG, Ortega M, Friedman A, et al. Long-term seizure outcomes following amygdalohippocampectomy. J Neurosurg 2000; 98 : 751–763.
11. Babb TL, Brown WJ. Pathological findings in epilepsy. In: Engel J Jr. Surgical treatment of the epilepsies. New York: Raven Press 1987.
12. Babb TL, Brown WJ, Pretorius J, et al. Distribution of pyramidal cell density and hyperexcitability in epileptic human hippocampal formation. Epilepsia 1984; 25 : 721–728.
13. Lencz T, McCarthy G, Bronen RA. Quantitative magnetic resonance imaging in temporal lobe epilepsy: relationship to neuropathology and neuropsychological function. Ann Neurol 1992; 31 : 629–637.
14. Jack CR Jr, Sharbrough FW, Cascino GC, et al. Magnetic resonance image-based hippocampal volumetry: correlation with outcome after temporal lobectomy. Ann Neurol 1992; 31 : 138–146.
15. Amaral DG, Insausti R. The human hippocampal formation. In: Paxinos G. The Human Nervous System. San Diego, Calif: Academic Press 1990; 711–775.
16. Bernasconi N, Bernasconi A, Caramanos Z, et al. Mesial temporal damage in temporal lobe epilepsy: a volumentric MR study of the hippocampus, amygdala and parahippocampal region. Brain 2003; 126 : 462–469.
17. Yilmazer-Hanke DM, Wolf HK, Schramm J, et al. Subregional pathology of the amygdala complex and enthorhinal region in surgical specimens from patients with pharmacoresistant temporal lobe epilepsy. J Neuropathol Exp Neurol 2000; 59 : 907–920.
18. Connelly A, Jackson GD, Duncan JS, et al. Magnetic resonance spectroscopy in temporal lobe epilepsy. Neurology 1994; 44 : 1411–1417.
19. Engel J Jr, Kuhl DE, Phelps ME, Crandall PH. Comparative localisation of epileptic foci in parcial epilepsy by PET and EEG. Ann Neurol 1982; 12 : 529–537.
20. Henry TR, Babb TL, Engel J Jr, et al. Hippocampall neuronal loss and regional hypometabolism in temporal lobe epilepsy. Ann Neurol 1994; 36 : 925–927.
21. O’Brien JT, Newton MR, Cook MJ, et al. Hippocampal atrophy is not a major determinant of regional hypometabolism in temporal lobe epilepsy. Epilepsia 1997; 38 : 74–80.
22. Carne RP, O’Brien TJ, Kilpatrick CJ, et al. MR-negative PET-positive temporal lobe epilepsy: a distinct surgically remediable syndrom. Brain 2004; 127 : 2276–2285.
23. Riederer F, Lanzenberger R, Kaya H, et al. Network atrophy in temporal lobe epilepsy. A voxel-based morphometry study. Neurology 2008; 71 : 419–425.
24. Salanova V, Markand O, Worth R. Temporal lobe epilepsy: analysis of patiens with dual patology. Acta Neurol Scan 2004; 109 : 126–131.
25. Spencer D, Inserni J. Temporal lobectomy In: Luders H. Epilepsy surgery. New York: Raven Press 1991; 533–545.
26. Helmstaedter C, Elger CE, Hufnagel A, et al. Different Effects of Left Anterior Temporal Lobectomy, Selective Amygdalohippocampectomy, and Temporal Cortical Lesionectomy on Verbal learning, Memory, and Recognition. J Epilepsy 1996; 9 : 39–45.
27. Helmstaedter C, Kurthen M. Memory and epilepsy: characteristics, course, and influence of drugs and surgery. Curr Opin Neurol 2001; 14 : 211–216.
28. Niemeyer P. The transventricular amygdalohippocampectomy in temporal lobe epilepsy. In: Baldwin M, Bailey P. Temporal lobe epilepsy. Springfield: Charles C Thomas 1958; 461–482.
29. Yasargil MG, Teddy PJ, Roth P. Selective amygdalohippocampectomy. Operative anatomy and surgical technique. Adv Tech Stand Neurosurg 1985; 12 : 93–123.
30. Yasargil MG, Wieser HG, Valavanis A, et al. Surgery and results of selective amygdalohippocampectomy in one hundred patients with nonlesional limbic epilepsy. Neurosurg Clin North Am 1993; 4 : 243–261.
31. Clusmann H, Schramm J, Kral T, et al. Prognostic factors and outcome after different types of resection for temporal lobe epilepsy. J Neurosurg 2002; 97 : 1131–1141.
32. Lacruz ME, Alarcon G, Akanuma N, et al. Neuropsychological effects associated with temporal lobectomy and amygdalohippocampectomy depending on Wada test failure. J Neurol Neurosurg Psychiatry 2004; 75 : 600–607.
33. Hamberger MJ, Drake EB. Cognitive functioning following epilepsy surgery. Curr Neurol Neurosci Rep 2006; 6 : 319–326.
34. Helmstaedter C, Richter S, Röske S, et al. Differential effects of temporal pole resection with amygdalohippocampectomy versus selective amygdalohippocampectomy on material-specific memory in patients with mesial temporal lobe epilepsy. Epilepsia 2008; 49 : 88–97.
35. Talairach J, David M, Tournoux F. L’exploration chirurgical stéréotaxique du lobe temporal dans l’épilepisie temporal. Paris: Masson 1958.
36. Talaraich J, Szikla G. Destruction partielle amygdalo-hippocampique per l’yttrium 90 dans la traitment de certaines epilepsies á expression rhinencephaliue. Neurochirurgie 1965; 11 : 236–240.
37. Talairach J, Bancaud J, Szikla G, et al. Approche nouvelle de la neurochirurgie de l’epilepsie: méthodologie stéréotaxique et resultants thérapeutiques. Neurochirurgie 1974; 20 : 92–98.
38. Vladyka V. Surgical treatment of epilepsy and its application in temporal epilepsy. Cesk Neurol Neurochir 1978; 41 : 95–106.
39. Parrent AG, Blume WT. Stereotactic amygalohippocampotomy for the treatment of medial temporal lobe epilepsy. Epilepsia 1999; 40 : 1408–1416.
40. Malikova H, Vojtech V, Liscak R, et al. Stereotactic radiofrequency amygdalohippocampectomy for the treatment of mesial temporal lobe epilepsy: correlation of MR with clinical seizure outcome. Epilepsy Res 2009; 83 : 235–242.
41. Malikova H, Vojtech Z, Liscak R, et al. Microsurgical and Stereotactic Radiofrequency Amygdalohippocampectomy for the Treatment of Mesial Temporal Lobe Epilepsy: Different Volume Reduction, Similar Clinical Seizure Control. Stereotact Funct Neurosurg 2010; 88 : 42–50.
42. Liscak R, Malikova H, Kalina M, et al. Stereotactic Radiofrequency Amygdalohippocampectomy in the Treatment of Mesial Temporal Lobe Epilepsy. Acta Neurochir 2010; 152(8): 1291–1298.
43. Schramm J. Temporal lobe epilepsy surgery and the quest for optimal extent of resection: A review. Epilepsia 2008; 49(8): 1296–1307.
44. McKhann GM 2nd, Schoenfeld-McNeill J, Born DE, et al. Intraoperative hippocampal electrocorticography to predict the extent of hippocampal resection in temporal lobe epilepsy surgery. J Neurosurg 2000; 9 : 44–52.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek ZprávyČlánek ZprávyČlánek KnihyČlánek Diagnostika sepseČlánek ZprávyČlánek ZprávyČlánek Pokroky v lékových formáchČlánek Zprávy JCLČlánek Laureáti Nobelovy ceny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Aktualizace doporučení GOLD pro farmakoterapii CHOPN z roku 2026
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
-
Všechny články tohoto čísla
- Úvodník
- Nemocnice Na Homolce – dvacet let špičkové medicíny
- Aplikace moderní mikroneurochirurgie a současných technologií při řešení nádorových a cévních onemocnění mozku
- Zprávy
- Karcinom ledviny v éře nastupujících robotických technologií
- Zprávy
- Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
- Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
- Syndrom časné repolarizace a idiopatická fibrilace komor
- Psychologická péče jako součást interdisciplinární přípravy pacienta k bariatrické operaci
- Minimálně invazivní výkony v cévní chirurgii
- Význam radiochirurgie v léčbě meningiomů
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Zprávy
- Nekonvulzivní status epilepticus
- Význam radiochirurgie v léčbě mozkových metastáz
- Současná farmakoterapie epilepsie
- Knihy
- Diagnostika sepse
- Pedální bypass a jeho role v záchraně kriticky ischemické končetiny
- Zprávy
- Šestileté zkušenosti s operacemi vrozených srdečních vad u dospělých
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
- 24. český a slovenský neurologický sjezd
- X. a XI. česko-slovenská konference laboratorní hematologie
- Onkologie v gynekologii a mammologii
- 19. lipovské dermatovenerologické fórum
- Mezioborový seminář Třeboň ‘11
- Pokroky v lékových formách
- Doc. MUDr. Milan Jaroš, CSc. – osmdesátiletý
- Docent Radim Kočvara šedesátníkem
- Zprávy JCL
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom časné repolarizace a idiopatická fibrilace komor
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Nekonvulzivní status epilepticus
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





