-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznam radiochirurgie v léčbě mozkových metastáz
Significance of radiosurgery in the treatment of brain metastases
Brain metastases are diagnosed in about 30% adult patients with generalized carcinomas, their accompanying severe neurological symptoms cause worsening quality of patient’s life. The development of magnetic resonance imaging and stereotactically guided radiosurgery and radiotherapy enable to apply relatively high doses to well defined intracranial target volumes. Progression free survival after irradiation of brain lesions depends on several prognostic factors. Radiosurgery using gamma knife is an effective treatment with low rate of postradiation complications.
Key words:
brain metastases, progression free survival, tumor response, prognostic factors.
Autoři: Gabriela Šimonová; Roman Liščák
Působiště autorů: Oddělení stereotaktické a radiační neurochirurgie Nemocnice Na Homolce, Praha
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 273-277
Kategorie: Přehledový článek
Souhrn
Mozkové metastázy se objevují až u 30 % nemocných s generalizovanými karcinomy a často způsobují závažnou neurologickou symptomatologii a zhoršují kvalitu života nemocných. Rozvoj magnetické rezonance a rozvoj ozařovací techniky (stereotaktická radiochirurgie a radioterapie) umožňuje aplikovat relativně vysoké dávky do přesně definovaných intrakraniálních cílových objemů. Přežití bez progrese po ozáření mozkových lézí je dáno řadou prognostických faktorů. Radiochirurgie pomocí gama nože je efektivní metoda s nízkou incidencí post radiačních komplikací.
Klíčová slova:
mozkové metastázy, přežití bez progrese, léčebný efekt, prognostické faktory.ÚVOD
Mozkové metastázy jsou závažným projevem hematogenního šíření nádorového onemocnění, jsou rychle rostoucím nejčastějším typem zhoubného mozkového nádoru u dospělých a jejich incidence stále stoupá (1–10). U dětí se vyskytují poměrně vzácně a jedná se převážně o metastázy sarkomů (11). Relativní nárůst mozkových metastáz je způsoben rozvojem diagnostických metod (především magnetické rezonance), jejich větší dostupností a díky pokrokům v terapii zhoubných nádorů. Systémová i lokoreginální léčba zhoubných nádorů výrazně zlepšila přežití nemocných. Mozek má „unikátní postavení v organismu“, je do značné míry chráněn před řadou toxických látek (včetně cytostatik) hemato-encefalickou bariérou. Mozkové metastázy tak zůstávají při systémové léčbě často neovlivněny. Z nejnovějších molekulárně biologických a genetických studií navíc vyplývá, že metastáza má často odlišné charakteristiky než primární nádor. V průběhu dlouhého růstu primární nádorové buněčné populace se do cévního systému dostávají především klonogenní a předchozí léčbou selektované rezistentní buňky s mnoha genovými mutacemi a změnami v povrchových antigenech (jejich vznik je dán délkou růstu nádoru a také léčbou, především chemoterapií a radioterapií). Neléčené mozkové metastázy akutně ohrožují pacienty a výrazně zhoršují kvalitu života, jejich problematika je interdisciplinární a spadá do oborů zobrazovacích metod, onkologie, neurochirurgie, radiochirurgie a radioterapie (6, 12–48).
Mozkové metastázy se klinicky manifestují až u 30 % dospělých pacientů se zhoubnými nádory a v sekčním materiálu se objevují až v 50 % případů (1–8). Podle histologických typů jsou nejčastější mozkové metastázy karcinomů plic, karcinomů prsu a zažívacího traktu, karcinomů ledvin a maligního melanomu (1–12), metastázy jiných nádorů tvoří okolo 5 % (karcinomy močového měchýře, choriokarcinomy, karcinomy ovariální a těla děložního) (1–12).
Zhruba u 10 % nemocných není v době diagnózy mozkového postižení známa primární lokalizace nádorového onemocnění (5). V tomto případě může významně pomoci celotělové vyšetření pozitronovou emisní tomografií s užitím 18-fluoro-deoxyklukózy (FDG), které vykazuje vysokou senzitivitu a specificitu především pro plicní karcinomy, karcinomy prsu a kolorektální karcinomy, tedy nejčastější nádory s tendencí k disseminaci do mozku. PET vyšetření je rovněž přínosné při rozlišení lokálních recidiv od postradiačních nebo postoperačních změn (49, 50). Incidence mozkových metastáz podle věku nemocných odpovídá výskytu jednotlivých nádorů v dospělé populaci s nejvyšším výskytem v rozmezí 45–65 let, u mužů jsou nejčastější mozkové metastázy plicních karcinomů, u žen karcinomů prsu (1–7, 15–48).
Makroskopický vzhled mozkových metastáz je většinou velmi podobný. Jsou zpravidla sférického tvaru, který je dán expanzivním typem růstu, a jsou dobře diferencovatelné od okolní zdravé tkáně. Velmi dobře se postkontrastně zobrazují jak na počítačové tomografii, tak magnetické rezonanci (8–10). Pro tyto své vlastnosti jsou „ideální cíle“ pro stereotaktické ozáření. V současné době jsme schopni detekovat při využití magnetické rezonance léze o průměru 2–3 mm. Doprovodné projevy intratumorálního prokrvácení jsou častější u metastáz karcinomů ledvin, melanomů a choriokarcinomů (51).
Četnost mozkových metastáz závisí na použité vyšetřovací metodě (větší citlivost MR), množství aplikované kontrastní látky, histologickém typu, úspěšnosti systémové léčby a technických možnostech detekovat velmi malé léze (8–10). Mozkové metastázy karcinomů prsu bývají často v době diagnózy častěji vícečetné (až 50 % nemocných), podobně metastázy plicních karcinomů (8–10, 15–42).
Mozkové metastázy bývají nejčastěji lokalizované supratentoriálně, asi 75 %, z toho nejvíce v oblasti fronto-parietální a následně temporo-okcipitální (2–6, 11–13, 15–48). Tomu odpovídá i neurologická symptomatologie. Nejčastějším příznakem je organický psychosyndrom, hemiparéza, fatická porucha a epilepsie. Infratentoriální výskyt metastáz je okolo 20 %, převážně v mozečkových hemisférách, s odpovídající symptomatologií, a častější jsou u kolorektálních karcinomů, nádorů z oblasti malé pánve a karcinomů prsu (2–39).
Léčebné metody zahrnují neurochirurgickou resekci, radioterapii, radiochirurgii nebo stereotaktickou radioterapii, antiedematózní terapii a vzájemné kombinace (10–48). Největší celosvětové i domácí zkušenosti jsou v současné době s ozářením mozkových metastáz na gama noži. Tuto léčbu je dále možné provádět na speciálních urychlovačích a kybernetických nožích.
Neurologická symtomatologie a její hodnocení
Typ neurologických příznaků a jejich závažnost je závislá na lokalizaci metastáz a rozsahu postižení a k jejich hodnocení se užívá široce akceptovaný systém hodnocení doporučený skupinou Radiation Therapy Oncology Group (RTOG) (tab. 1). Pacienti s hodnotou NFC IV, se závažnou, život ohrožující neurologickou symptomatologií zahrnující kóma, nejsou indikováni ke stereotaktickému ozáření na gama noži.
Tab. 1. Stupeň funkčního neurologického poškození 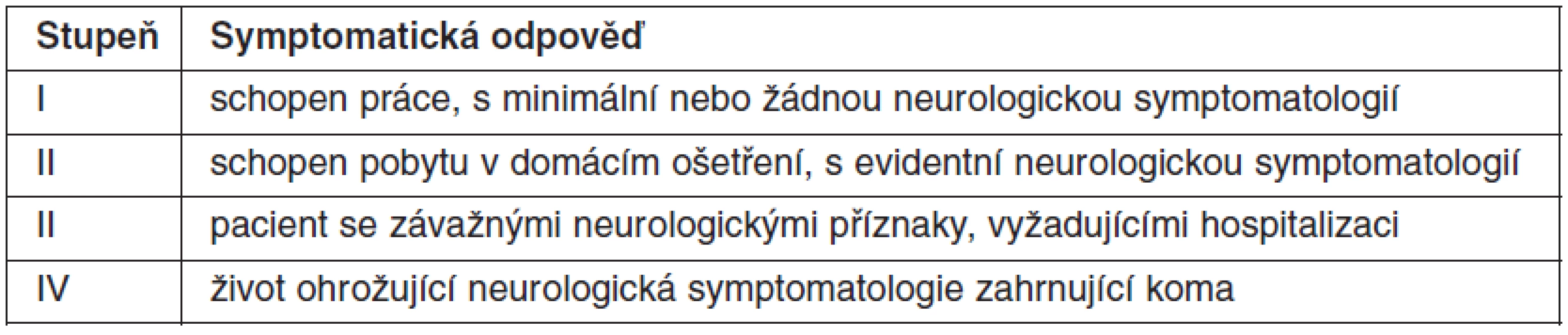
Celkový stav nemocných se zpravidla charakterizuje pomocí Karnofského skóre (KF) (53).
Způsob hodnocení léčebných výsledků (zobrazovací vyšetření) dokumentuje tabulka 2.
Tab. 2. Hodnocení léčebných odpovědí při zobrazovacím vyšetření 
Lokální recidiva je definována jako nová leze v oblasti léčeného cílového objemu po stereotaktickém ozáření, po kompletní regresi nebo další růst po předchozí parciální regresi či stabilizaci. Diagnóza lokální recidivy se stanovuje pomocí PET vyšetření, stereobiopticky, z otevřené operace nebo ze sekčního nálezu. K hodnocení léčebných komplikací se používá skórovací systém, který vznikl rovněž z doporučení skupiny RTOG. Mezi akutní poradiační vedlejší účinky se řadí ty, které vzniknou do 90. dne po ozáření. Po delším časovém období vzniklé komplikace spadají již do kategorie pozdních změn (54). Způsob hodnocení akutní a pozdní toxicity znázorňuje tabulka 3.
Tab. 3. Hodnocení akutní a pozdní toxicity 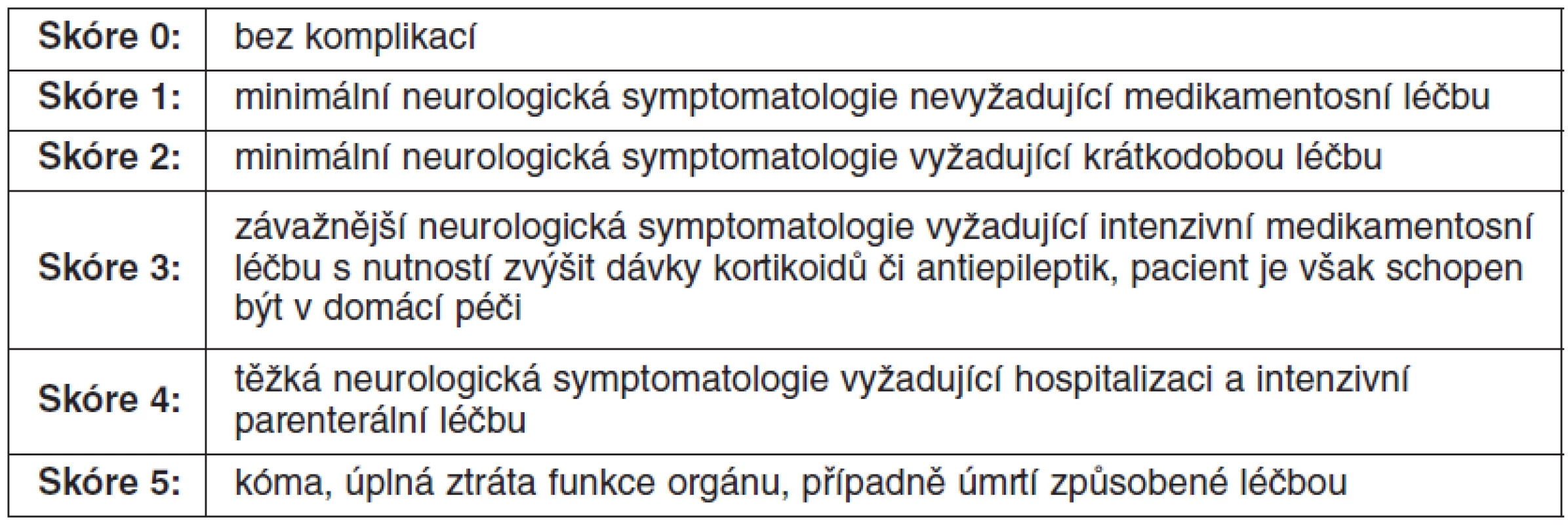
Stereotaktická ozáření
V posledních 20 letech se stereotaktické ozáření na gama noži (izotopický ozařovač) nebo speciálních urychlovačích začalo výrazně uplatňovat také v léčbě maligních intracerebrálních procesů, a to především mozkových metastáz vhodných objemů s maximálním průměrem 30 mm. Největší zkušenosti jsou zatím s léčbou pomocí gama nože, ozařovače se 192–201 zdroji Kobaltu 60 (počet zdrojů v závislosti na typu přístroje) jejichž svazky jsou užitím různých kolimačních systému (o průměru 4, 8 a 16 mm) usměrňovány do jednoho izocentra. Radiochirurgie je spojena s aplikací jedné relativně vysoké dávky záření, stereotaktická radioterapie pak uživá frakcionačních režimů (rozdělení do více dílčích dávek). Radiochirurgické dávky pro mozkové metastázy se pohybují v rozmezí 17–20 Gy pro léze lokalizované infratentoriálně a v rozmezí 18–24 Gy pro léze supratentoriální. Výše zvolené dávky záření závisejí také na histologickém typu: Vyšší dávky jsou vhodné u relativně radiorezistentních nádorů, jako je melanom a karcinom ledviny, dávky nižší u senzitivnjějších nádorů, jako jsou karcinomy prsu, plic a mozkové metastázy testikulárních nádorů. Při volbě výše aplikované dávky záření je nutné respektovat i toleranční dávky pro okolní kritické struktury. Nejvulnerabilnější je optická dráha s jednorázovou tolerančí dávkou v rozmezí 8–10 Gy, ostatní hlavové nervy a mozkový kmen s tolerancí 14 až 16 Gy. Dle výsledků z rozsáhlejší prospektivní studie RTOG je standardní dávka pro jednorázové ozáření 20 Gy pro léze do průměru 2 cm. V případě předchozí zevní frakcionované radioterapie na oblast mozku je nutné dávku ze stereotaktického ozáření na gama noži redukovat zhruba o 20 %.
Prognostické faktory pro přežití
Délku přežití nemocných s mozkovými metastázami ovlivňuje celá řada faktorů a statistická významnost se liší i v závislosti na typu studie.
Mezi nejčastěji uváděné prognostické faktory patří: věk pacienta (horší výsledky pro nemocné nad 65 let), pohlaví (lepší výsledky u žen), Karnofského skóre (lepší výsledky pro KF 70 % a více), neurologický funkční stupeň (nejlepší výsledky u asymptomatických lézí), histologie primárního nádoru (nejlepší výsledky pro metastázy karcinomu ledviny a prsu), disseminace onemocnění mimo mozek (horší výsledky v případě více-orgánové generalizace), stav primárního nádoru (horší výsledky u pokročilého lokoregionálního onemocnění), četnost metastáz (lepší výsledky pro solitární léze), objem plánovacího léčeného objemu (PTV) (lepší výsledky pro léze do průměru 2 cm), výše minimální aplikované dávky (lepší výsledky pro dávky 20 Gy a vyšší), interval od diagnózy základního onemocnění k manifestaci mozkového postižení (lepší výsledky pro interval delší než 24 měsíců). Někteří autoři uvádějí lepší léčebné výsledky pro metastázy lokalizované supratentotiálně než pro léze infratentoriální (31–36). Prospektivní RTOG studie dělily nemocné do tří základních skupin RPA (reccursive partitioning analysis) podle prognostických faktorů, favorizovanou skupinou s nejdelším přežitím bez progrese (PFS) byli nemocní mladší 65 let, s KF 70 % a více, s kontrolovaným základním onemocněním (18, 33). Prognostické faktory napomáhají při volbě adekvátního léčebného postupu. U pacientů s pozitivními prognostickými faktory je tedy vhodné aplikovat vyšší dávky záření k zajištění dlouhodobějšího léčebného efektu (kurativní záměr) a je možné akceptovat i vyšší incidenci léčebně zvládnutelných akutních postradiačních komplikací. Na druhé straně u nemocných s nepříznivými faktory je možné zvolit nižší dávky (na dolní hranici doporučovaných) s nižším rizikem akutních komplikací, které by mohly zhoršit kvalitu zbývajícího života nemocného.
Okolo 8–10 % nemocných přežívá dlouhodobě (více než 5 let po léčbě), jsou to nejčastěji nemocní s mozkovými metastázami původně neprokázaného zdroje nádorového onemocnění a pacienti s karcinomem ledviny, vstupním Karnofského skóre 80 % a více, s kontrolovaným lokoregionáním onemocněním a bez další orgánové disseminace (32–36, 55).
Lokální léčebný efekt
Kompletní a parciální regresi mozkových metastáz po stereotaktickém ozáření na gama noži je možné zaznamenat u 70 % nemocných (obr. 1). Léčebná odpověď nastupuje zpravidla za 2–4 měsíce po ozáření, nejrychleji u mozkových metastáz karcinomů plic, nejpomaleji u metastáz melanomů. Nejvyšší procento kompletních obrazových regresí je pozorováno u mozkových metastáz karcinomů ledvin, nejméně u metastáz adenokarcinomů zažívacího traktu.
Obr. 1. Kompletní regrese ozářené metastázy karcinomu ledviny 12 měsíců po léčbě dokumentovaná na magnetické rezonanci 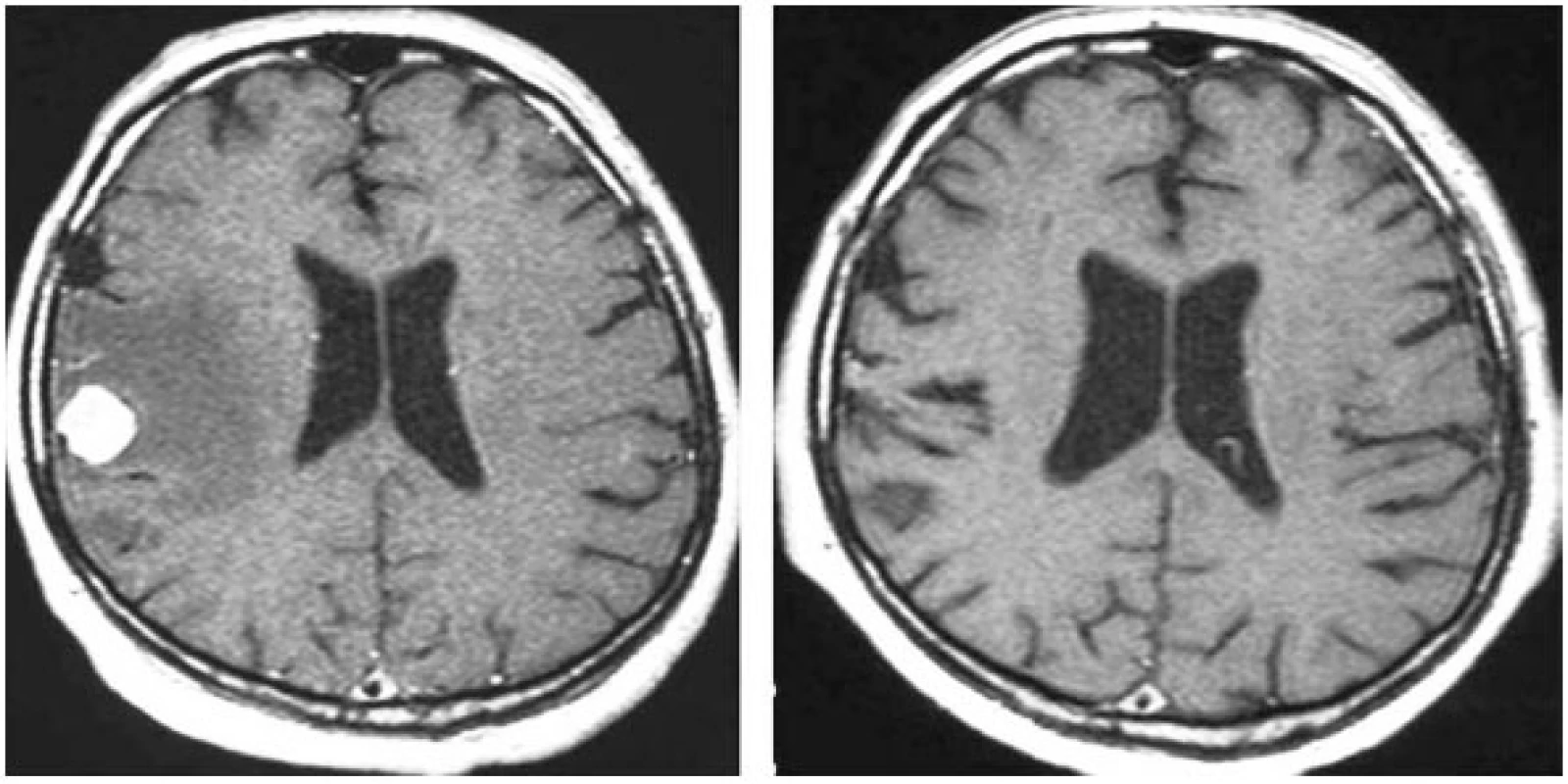
Regrese neurologické symptomatologie
K ústupu neurologických příznaků dochází až u 65–70 % léčených nemocných zpravidla v průběhu 1–2 měsíců po ozáření.
Léčebné komplikace
Mezi nejčastější akutní post radiační reakce patří vznik nebo akcentace kolaterálního edému.
Léčebně lze tuto komplikaci témeř vždy zvládnout přechodnou anti-edematózní terapií kortikoidy (využívá se jejich stabilizující vliv na buněčné membrány) (15). Z pozdních postradiačních změn se mohou vyskytnout demyelinizační změny. K nejzávažnějším komplikacím patří radionekróza, která však zpravidla v hodnocených souborech nepřesahuje 2 %, pokud jsou používány standardní dávky.
Přežití bez lokální progrese mozkových lézí po ozáření na gama noži
Léčebné výsledky jsou srovnatelné s radikálně operovanými pacienty pro mozkové metastázy (17–23, 25–29, 34–36).
Medián přežití bez progrese pacientů se solitárním postižením po ozáření na gama noži se pohybuje od 9 do 14 měsíců, pro vícečetná ložiska 6–7 měsíců.
Příčina úmrtí
Příčina úmrtí je zhruba u 2/3 nemocných dána progresí onemocnění mimo mozek. Nejčastější příčinou úmrtí je mozkové postižení u pacientek s karcinomem prsu – souvisí s vysokou incidencí nové mozkové disseminace zhruba v 50 % případů. Naopak nejméně častá bývá tato příčina úmrtí u melanomu okolo 33 %. Nové mozkové metastázy se v průběhu následného sledování objevují nejčastěji v průběhu prvního roku po ozáření.
Obr. 2. Křivky přežití bez progrese pro solitární mozkové metastázy různých histologických typů (vlastní soubor nemocných) 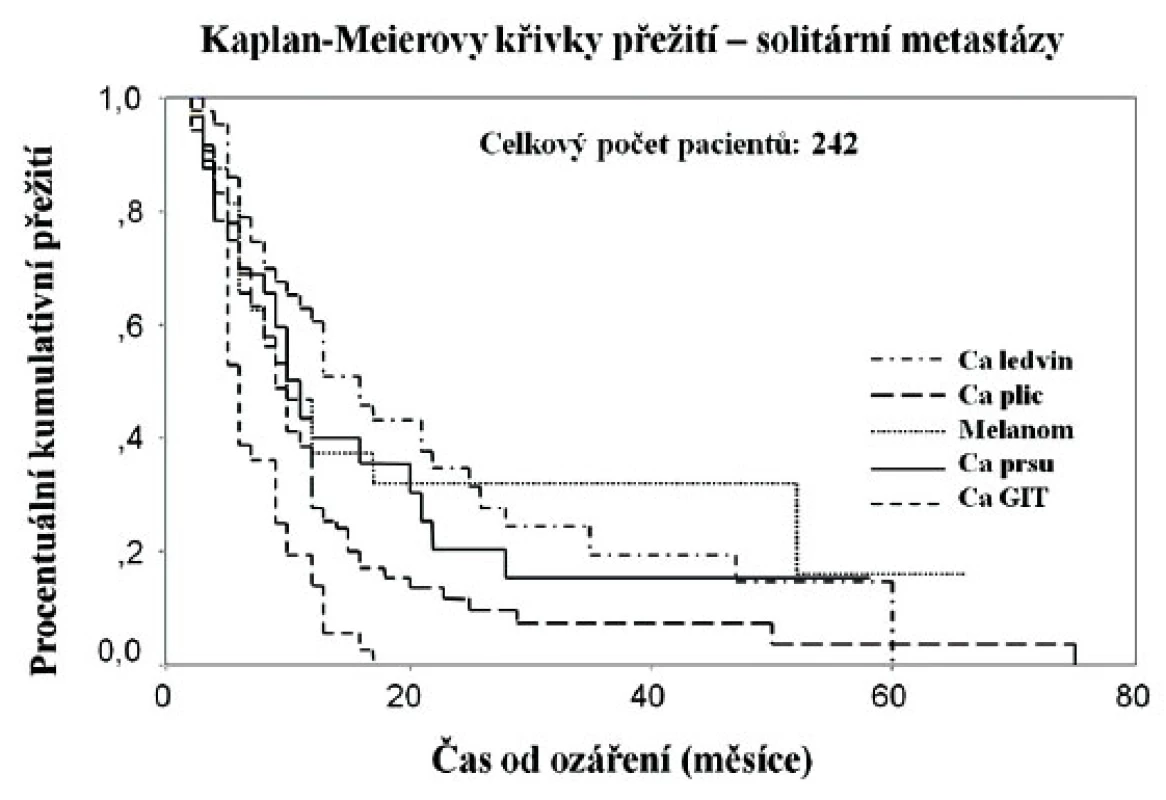
Vlastní zkušenost
V Nemocnici Na Homolce je gama nůž instalován od roku 1992 a do konce roku 2010 bylo léčeno 2710 pacientů s mozkovými metastázami. Výsledky prvních 400 nemocných s mozkovými metastázami (242 nemocných se solitární lézí, 158 pacientů se 2–4 ložisky) byly následující. Parciální a kompletní regresi jsme zaznamenali u 75 % nemocných. Nejrychlejší léčebná odpověď byla u nemocných s metastázami karcinomů plic, nejpomalejší nástup regrese u metastáz melanomů. Progresi nálezu jsme zaznamenali u 7 % nemocných. Akutní postradiační reakce si vyžádala přechodnou léčbu kortikoidy u 1/4 nemocných, pozdní toxicita stupeň 3 se objevila u 10 % pacientů, histologicky verifikovaných radionekróz jsme zaznamenali 2 %. Medián přežití bez progrese pro solitární léze byl 10 měsíců, pro vícečetná ložiska 6 měsíců. V průběhu následného sledování se nové mozkové metastázy objevily nejčastěji v průběhu prvních 12 měsíců po léčbě z toho nejčastěji u pacientek s metastázami karcinomu prsu (50 %). Nejdelší medián přežití měli nemocní se solitárními metastázami karcinmu ledviny (12 měsíců), naopak nejkratší s metastázami kolorektálních karcinomů (5 měsíců).
Provedli jsme statistickou analýzu řady faktorů, které mohly ovlivnit přežití léčených pacientů.
Nejfavorizovanější skupinou s nejdelším přežitím bez progrese v našem souboru tvořili nemocní mladší 65 let, se solitární lézí, bez závažnější neurologické symptomatologie, bez další orgánové disseminace, bez progrese primárního nádoru, s aplikovanou minimální dávkou 20 Gy a více, s časovým intervalem od diagnózy primárního nádoru delším než 19 měsíců a s metastázami karcinomu ledviny (graf 1). Ve skupině nemocných s vícečetnými ložisky byly statisticky významné a příznivé faktory: bez progrese primárního nádoru, bez další orgánové disseminace a s Karnofského skóre vyšším než 70 %. Přežití delší než 5 let mělo v našem souboru 9 % nemocných s mediánem PFS 68 měsíců.
Závěr
Stereotaktická radiochirurgie se postupně stala standardní léčebnou metodou především pro solitární mozkové léze, později se indikace rozšířila i pro vícečetná ložiska především radiorezistentních nádorů. Léčba je minimálně invazivní a lze ji provádět i ambulantně. S ohledem na relativně nízkou integrální dávku pro zdravou mozkovu tkáň je možné i léčbu opakovat pro nově vzniklá ložiska nebo v případě lokální recidivy. Závažnější pozdní toxicita (incidence radionekróz) nepřesahuje při standardních dávkách záření 5 %.
Zkratky
FDG – 18-fluoro-deoxyglukóza
GTV – nádorový objem (gross tumor volume)
Gy – gray
KF – Karnofského skóre
NFC – neurologický funkční stupeň (neurological functional class)
PET – pozitronová emisní tomgrafie
PTV – plánovací léčebný objem (planned treating volume)
RPA – analýza pomocí rekurzivního dělení (reccursive partitioning analysis)
RTOG – Radiation Therapy Oncology Group
Adresa pro korespondenci:
MUDr. Gabriela Šimonová
Oddělení stereotaktické a radiační neurochirurgie Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
fax: +420 257 272 972, e-mail: gabriela.simonova@homolka.cz
Zdroje
1. Boring C, Squires T, Tong T. Cancer statistics. Jour NCI 1991; 41 : 19–37.
2. Delattre J, Krol G, Thaler H. Distribution of brain metastases. Archives of Neurology 1988; 45 : 741–744.
3. Amer M, Al-Sharraf M, Baker L. Malignant melanoma and central nervous system metastases: Incidence, diagnosis, treatment and survival. Cancer 1978; 42 : 660–668.
4. Ask-Upmark E. Metastatic tumors of the brain and their location. Acta Medica Scandinavica 1956; 154 : 1–9.
5. Debevec M. Management of patients with brain metastases of unknown origin. Neoplasma 1990; 37 : 601–606.
6. Nussbaum ES, Djalilian HR, Cho KH. Brain metastases – histology, multiplicity, surgery and survival. Cancer 1996; 78(8): 1781–1788.
7. Caincross JG, PosnerJB. Radiation therapy for brain metastases. Ann neurol 1980; 7 : 529–541.
8. Healy M, Hesselink J, Press G. Increased detection of intracranial metastases with intravenous Gd-GTPA. Radiology 1987; 165 : 619–624.
9. Russell E, Geremia G, Johnson C. Multiple cerebral detectibility with Gd-DTPA – enhanced MR imaging. Radiology 1987; 165 : 609–617.
10. Young B, Patchell RA. Brain metastases. Neurological surgery, ed. J. R. ZouMans 1996; 138 : 382–389.
11. Paulino AC, Thanh XN, Barker JL Jr. Brain metastases in children sarcoma, neuroblastoma and Wilmś tumor. Int J Radiat Oncol Biol Phys 2003; 57(1): 177–183.
12. Posner JB. Management of brain metastasis. Rev Neurol 1992; 148 : 477–487.
13. Egawa S, Tukiyama I, Akine Y. Radiotherapy of brain metastases. Int J Radiat Oncol Biol Phys 1986; 12 : 1621–1625.
14. Horton J, Baxter DH, Olson KB. The management of metastases to the brain by irradiation and corticosteroids. Am J Roentgenol 1971; 11 : 334–336.
15. Sorensen J, Hansen H, Hansen M. Brain metastases in adenocarcinomas of the lung: frequency, risk groups and prognosis. Journal of Clinical Oncology 1988; 9 : 1474–1480.
16. Borgelt B, Gelber R, Kramer S, et al. The palliation of brain metastases. Final results of the first two studies by the Radiation Therapy Oncology Group. Int J Radiat Oncol Phys 1980; 6 : 1–8.
17. Patchell RA, Tibbs PA, Walsh JW. A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med 1990; 322 : 494–500.
18. Shaw E, Scott C, Souhami L, et al. Single dose radiosurgical treatment of recurrent previously irradiated primary brain tumors and brain metastases. Final report of RTOG Protocol 90–05. Int J Radiat Oncol Phys 2000; 47 : 291–298.
19. Hall WA, Djalilian HR, Nussbaum ES, et al. Long-term survival with metastatic cancer to the brain. Med Oncol 2000; 279–286.
20. Takeshima H, Kuratsu J, Nishi T, et al. Prognostic factors in patients who survived more than 10 years after udergoing surgery for metastatic brain tumors: Report of 5 cases and review of the literature. Surg Neurol 20002; 58 : 118–123.
21. Lutterbach J, Barlet S, Ostertag C. Long-term survival in patients with brain metastases. J Cancer Res Clin Oncol 2002; 128 : 417–425.
22. Bindal RK, Sawaya R, Leavens M. Surgical treatment of multiple brain metastases. J Neurosurgery 1993; 79 : 210–216.
23. Wronski M, Arbit E. Resection of brain metastases from colorectal carcinoma in 73 patients. Cancer 1999; 85(8): 1677–1185.
24. Smalley SR, Laws ER Jr, O’Faloon JR. Resection for solitary brain metastasis. Role of adjuvant radiation and prognostic variables in 229 patients. J Neurosurg 1992; 77 : 531–540.
25. Black PM. Solitary brain metastases: Radiation, resection or radiosurgery? Chest 1993; 103 : 3678–3698.
26. Wronski M, Arbit E, McCormick B. Surgical treatment of 70 patients with brain metastases from breast carcinoma. Cancer 1997; 80 : 1746–1754.
27. Wronski M, Arbit E, Russo P, et al. Surgical resections of brain metastases from renal cell carcinoma in 50 patients. Urology 1996; 47 : 187–193.
28. Wronski M, Arbit E. Surgical treatment of brain metastases from melanoma: a retrospective study of 91 patients. J Neurosurg 2000; 93 : 9–18.
29. Soltys SG, Adler JR, Lipani JD, et al. Stereotactis radiosurgery of the Postoperative resection cavity for Brain. Int J Radiat Oncol Biol Phys 2008; 70(1): 187–193.
30. Hsu F, Carolan H, Nichol A, et al. Whole Brain radiotherapy With Hippocampal Avoidance and Simultaneous integrated Boost for 1–3 Brain Metastases: A Feasibility Study Using Volumetric Modulated Arc Therapy. Int J Radiat Oncol Biol Phys 2008; 71(1): 71–78.
31. Franzin A, Snider S, Piccozi P, et al. Evaluation of Different Score Index Prognosis in Gamma Knife radiosurgical Treatment for Brain Metastasis. Int J Radiat Oncol Biol Phys 2009; 74(3): 707–713.
32. Cannady SB, Cvanaugh KA, Lee SY, et al. Results of whole brain radiotherapy and recursive partitioning analysis in patients with brain metastases from renal cell carcinoma: a retrospective study. Int J Radiat Oncol Biol Phys 2004; 58(1): 253–258.
33. Sanghavi SN, Miranpuri SS, Chappell R, et al. Radiosurgery for patients with brain metastases: a multi-institutional analysis, stratified by RTOG recursive partitioning analysis method. Int J Radiat Oncol Biol Phys 2001; 51(1): 426–434.
34. Andrew RJ, Gluck DS, Kochingeri RH. Surgical Resection of Brain metastases from Lung Cancer. Acta Neurochir (Wien), Springer Verlag 1996; 138 : 382–389.
35. Frazier JL, Batra S, Kapor S, et al. Stereotactic Radiosurgery in Management of Brain Metastases: An Institutional Retrospective Analysis of Survival. Int J Radiat Oncol Biol Phys 2010; 76(5): 1486–1492.
36. Chao ST, Barnett GH, Alwyn SW, et al. Five-years survivors of brain metastases: A single Institutional report of 32 patients. Int J Radiat Oncol Biol Phys 2006; 66(3): 801–809.
37. Sneed PK, Lamborm KR, Forstner JM, et al. radiosurgery for brain metastases: is whole brain radiotherapy necessary? Int J Radiat Oncol Biol Phys 1999; 43(3): 549–558.
38. Weltman E, Salvajoli JV, Brandt RA, et al. Radiosurgery for brain metastases: who may not benefit? Int J Radiat Oncol Biol Phys 2001; 51(5): 1320–1327.
39. Kased N, Binder DK, McDemott MW, et al. Gamma Knife Radiosurgery for Brain Metastases from Primary Breast cancer. Int J Radiat Oncol Biol Phys 2009; 75(4): 1132–1140.
40. Niranjan A, Kano H, Khan A, et al. Radiosurgery for Brain Metastases From Unknown Primary Cancers. Int J Radiat Oncol Biol Phys 2010; 77(5): 1457–1462.
41. Barmes EA, Chow E, Tsao MN, et al. Physician Expectations of Treatment Outcomes for Patients With Brain Metastases Reffered for Whole Brain Radiotherapy. Int J Radiat Oncol Biol Phys 2010; 76(1): 187–192.
42. Lunsford LD, Kondziolka D, Flickinger JC. Stereotactic radiosurgery: current spectrum and results, Clinical neurosurgery 1992; 38 : 407–415.
43. Huang F, Kondziolka D, Flickinger JC. Stereotactic radiosurgery for brain metastases. J. Neurosurg 1999; 91 : 563–568.
44. Gaudy-Marqueste C, Regis JM, Muracciole X, et al. Gamma-Knife radiosurgery in the management of melanoma patients with brain metastases: A series of 106 patients. Int J of Radiat Oncol Biol Phys 2006; 65(3): 809–816.
45. Rao G, Klimo P, Thompson CJ, et al. Stereotactic radiosurgery as therapy for melanoma, renal carcinoma and sarcoma brain metastases. Int J of Radiat Oncol Biol Phys 2006; 66(4, Suppl): 20–25.
46. Lester JF, MacBeth, Coles B. Prophylactic irradiation for preventing brain metastases in patients undergoing radical resection for brain metastases. Int J of Radiat Oncol Biol Phys 2005; 63(6): 690–694.
47. Lorenzoni J, Devriendt D, Massager N, et al. Radiosurgery for treatment of brain metastases: Estimation of patient eligibility using three stratification systems. Int J of Radiat Oncol Biol Phys Sep 2004; 60(1): 218–224.
48. O’Niel BP, Iturria NJ, Link MJ, et al. A comparison of surgical resection and stereotactic radiosurgery in the treatment of solitary brain metastases. Int J of Radiat Oncol Biol Phys 2003; 55(5): 1169–1176.
49. Bělohlávek O, Šimonová G, Kantorová I, et al. Brain metastases after stereotactic radiosurgery using the Leksell gamma knife: can FDG PET help to differentiate radionecrosis from tumor progression? Eur J Nucl Med 2003; 30 : 96–100.
50. Davis WK, Boyko O, Hoffman JM. F-18-2-fluoro-1-deoxyglucose positron emission tomography correlation of gadolinium-enhanced MR-imaging of central nervous systém neoplasia. AJNR 1993; 32 : 610–615.
51. Salzman M. Intracranial hemorrhage caused by brain tumor. In: Kaufman H; ed. Intracerebral hematomas. New York: Raven Press 1992; 95–106.
52. Wong J, Hird A, Zhang L, et al. symptoms and Quality of Life in Cancer Patients With Brain Metastases Following Palliative Radiotherapy. Int J Radiat Oncol Biol Phys 2009; 75(4): 1125–1131.
53. Karnofsky DA, Burchenal JH. The clinical evaluation of chemotherapeutic agents in cancer. In. Macleod CM ed. Evaluation of chemotherapeutic agents. New York: Columbia University Press 1949; 191–205.
54. LENT/SOMA tables. Radiotherapy and Oncology 1995; 35 : 19–20.
55. Gaspar L, Scott Ch, Rotman M. Recursive partitioning analysis (RPA) of prognostic factors in three radiation therapy oncology group (RTOG) brain metastases trials. Int J Radiat Oncol Biol Phys 1997; 37(4): 745–751.
56. Curran WJ, Mehta M, Rodrigus P, et al. Predictors of survival for patients with brain metastases: results of a randomized phase III trial. Int J of Radiat Oncol Biol Phys 2002; 54(2, Suppl): 93.
57. Komaki R, Scott CB, Byhardt R, et al. Failure pattersn by prognostic group determined by recursive parttioning analysis (RPA) of 1547 patients. Int J of Radiat Oncol Biol Phys 1998; 42(2): 263–267.
59. Weltman E, Salvajoli V, Brandt RA. Radiosurgery for brain metastases: A score index for predicting prognosis. Int J Radiat Oncol Biol Phys 2000; 46(5): 1155–1161.
60. Sanghavi SN, Miranpuri SM, Chappell R, et al. Radiosurgery for patients with brain metastases: a multi-institutional analysis, stratified by RTOG recursive analysis method. Int J of Radiat Oncol Biol Phys 2001; 51(2): 426–434.
61. Mogard I, Kihlstrom L, Ericson K. Recurrent Tumor vs Radiation Effects after Gamma Knife Radiosurgery of Intracerebral Metastases: Diagnosis with PET-FDG. Journal of Computer Assisted Tomography 1994; 18(2): 177–181.
62. Schultheiss TE, Kun LE, Amg KK - Radiation response of the central nervous system. Int Joncol Biol Phys 1995; 131(5): 1093–1112.
63. Awwad KH. Late reacting tissues: radiation - induced damage to the central nervous system. Radiation Oncology: radiobiological and Physiological Perspectives 1990; edit: KHAwwad. Kluwer Academic Publishers, Dordrecht
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek ZprávyČlánek ZprávyČlánek ZprávyČlánek KnihyČlánek Diagnostika sepseČlánek ZprávyČlánek Pokroky v lékových formáchČlánek Zprávy JCLČlánek Laureáti Nobelovy ceny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Přerušovaný půst může mít významná zdravotní rizika
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- FDA varuje před selfmonitoringem cukru pomocí chytrých hodinek. Jak je to v Česku?
-
Všechny články tohoto čísla
- Úvodník
- Nemocnice Na Homolce – dvacet let špičkové medicíny
- Aplikace moderní mikroneurochirurgie a současných technologií při řešení nádorových a cévních onemocnění mozku
- Zprávy
- Karcinom ledviny v éře nastupujících robotických technologií
- Zprávy
- Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
- Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
- Syndrom časné repolarizace a idiopatická fibrilace komor
- Psychologická péče jako součást interdisciplinární přípravy pacienta k bariatrické operaci
- Minimálně invazivní výkony v cévní chirurgii
- Význam radiochirurgie v léčbě meningiomů
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Zprávy
- Nekonvulzivní status epilepticus
- Význam radiochirurgie v léčbě mozkových metastáz
- Současná farmakoterapie epilepsie
- Knihy
- Diagnostika sepse
- Pedální bypass a jeho role v záchraně kriticky ischemické končetiny
- Zprávy
- Šestileté zkušenosti s operacemi vrozených srdečních vad u dospělých
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
- 24. český a slovenský neurologický sjezd
- X. a XI. česko-slovenská konference laboratorní hematologie
- Onkologie v gynekologii a mammologii
- 19. lipovské dermatovenerologické fórum
- Mezioborový seminář Třeboň ‘11
- Pokroky v lékových formách
- Doc. MUDr. Milan Jaroš, CSc. – osmdesátiletý
- Docent Radim Kočvara šedesátníkem
- Zprávy JCL
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom časné repolarizace a idiopatická fibrilace komor
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Nekonvulzivní status epilepticus
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



