-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Minimálně invazivní výkony v cévní chirurgii
Minimally invasive operations in vascular surgery
Minimally invasive surgery provides an attractive alternative compared with conventional surgical approaches and is popular with patients, particularly because of its favourable cosmetic results. Vascular surgery has taken its inspiration from general surgery and, over the past few years, has also been reducing the invasiveness of its operating methods. In addition to traditional laparoscopic techniques, we most frequently encounter the endovascular treatment of aneurysms of the thoracic and abdominal aorta and, most recently, robot-assisted surgery in the area of the abdominal aorta and pelvic arteries. Minimally invasive surgical interventions also have other advantages, including less operative trauma, a reduction in post-operative pain, shorter periods spent in the intensive care unit and overall hospitalization times, an earlier return to normal life and, finally, a reduction in total treatment costs.
Key words:
minimally invasive operations, laparoscopic techniques, endovascular therapy, robot-assisted vascular surgery.
Autoři: Petr Štádler; Petr Šedivý; Libor Dvořáček; MUDr. Marek Šlais; Petr Vitásek; Khaled El Samman; Pavel Matouš
Působiště autorů: Oddělení cévní chirurgie, Robotické centrum, Radiodiagnostické oddělení Nemocnice Na Homolce, Praha
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 244-249
Kategorie: Přehledový článek
Souhrn
Minimálně invazivní operace představují atraktivní alternativu ve srovnání s klasickými chirurgickými přístupy a u pacientů jsou oblíbeny, zvláště z důvodu příznivého kosmetického efektu. K minimalizaci operačních vstupů dochází řadu let i v cévní chirurgii, která se inspirovala chirurgií všeobecnou. Kromě klasických laparoskopických technik se nejčastěji setkáváme s endovaskulární léčbou výdutí břišní a hrudní aorty a nejnověji i s roboticky asistovanými operacemi v oblasti břišní aorty a pánevních tepen. Miniinvazivní chirurgické zákroky mají i další přednosti, ke kterým patří šetrnější preparace tkání, redukce pooperační bolesti, zkrácení doby pobytu na jednotce intenzivní péče i v nemocnici, časnější návrat k běžnému životu a v konečném důsledku i snížení celkových nákladů na léčbu.
Klíčová slova:
minimálně invazivní operace, laparoskopické techniky, endovaskulární léčba, roboticky asistované cévní operace.ÚVOD
První historické zmínky o léčení cévních chorob pocházejí ze starověkého Egypta a týkají se převážně ošetřování raného krvácení. Řecký chirurg Antyllus ve 2. století našeho letopočtu provedl první racionální zaznamenaný chirurgický zákrok, když podvázal přívodnou a odvodnou tepnu, otevřel vak tepenné výdutě, odstranil tromby a dutinu tamponoval (1). Po dlouhém období temného starověku a středověku byla prvním skutečně rekonstrukčním výkonem v cévní chirurgii až endoaneuryzmorhafie Rudolpha Matase (1860–1957) v roce 1888. Možnosti zobrazení a vyšetření anatomických, a tedy i cévních struktur umožnil vynález paprsků X v roce 1895 Röntgenem (1845–1923). Rekonstrukce nativního tepenného řečiště byly umožněny díky rozvoji techniky šití cévní anastomózy. Od poloviny šedesátých let 20. století Edwars, DeBakey a Szilágyi na svých pracovištích experimentovali s nylonem, teflonem, orlonem a portisanem a uvedli do používání umělou cévní protézu. Cévní protézy se postupně zdokonalovaly, ale k léčení rizikových a pro klasickou operaci neúnosných pacientů bylo zapotřebí jiné spolehlivé metody, která by umožnila vyhnout se velkému operačnímu přístupu a s ním spojené zátěži.
LAPAROSKOPICKÁ LÉČBA
Laparoskopická chirurgie se začínala rozvíjet od roku 1901, kdy byla provedena první laparoskopie na zvířeti. Laparoskopické techniky, které se velice rychle uplatnily ve všeobecné chirurgii, ovlivnily s určitým zpožděním i chirurgii cévní. Hlavním důvodem byla technická obtížnost cévní anastomózy, která vedla k váhavému přijetí laparoskopických přístupů cévními chirurgy. Vzhledem k jednoznačným přednostem miniinvazivních přístupů, mezi které patří redukce pooperační bolesti, časnější návrat k běžnému životu a snížení celkových nákladů na léčbu, se nakonec laparoskopie uplatňuje i v cévní chirurgii. Laparoskopické techniky zahrnují plně laparoskopické výkony, kdy je preparace i anastomóza provedena laparoskopicky, a laparoskopicky asistované zákroky, které zahrnují rukou asistované laparoskopie (speciálním vstupem pro nedominantní ruku je ulehčena vlastní laparoskopická operace), a laparoskopicky asistované výkony (laparoskopická preparace je kombinovaná s minilaparotomií s konvenčně provedenou cévní anastomózou).
Zkušenosti s laparoskopickými výkony na aortě začaly v roce 1993 (Dion), který provedl první laparoskopicky asistovaný aortobifemorální bypass (2). První úspěšná laparoskopická resekce výdutě břišní aorty byla pak provedena v roce 2001 (Dion). V České republice byla první laparoskopická iliakofemorální rekonstrukce provedena v roce 1997 (Dostalík) a první laparoskopická resekce výdutě břišní aorty v roce 2005 (Štádler).
Laparoskopická cévní chirurgie
Všechny typy laparoskopických cévních rekonstrukcí jsou prováděny v pneumoperitoneu, kdy je intraabdominální tlak udržován na hodnotě 12–15 torrů. Při torakoskopii je tlak v hrudníku udržován na hodnotách kolem 6 torrů.
Kromě běžného laparoskopického instrumentária jsou použity speciální cévní laparoskopické nástroje, mezi které patří cévní svorky, raspatorium, háček na dotahování stehů anastomózy, endoskopický skalpel, endoskopické jehelce a další. Mezi základní přístupy patří transperitoneální, retroperitoneální, transperitoneo-retroperitonální nebo nejnověji modifikovaný transperitoneální přístup (3).
Vlastní prezentovaný soubor pacientů v letech 2003–2006 zahrnuje 53 pacientů a od června 2010 dosud pak dalších 10 pacientů operovaných laparoskopicky (tab. 1).
Tab. 1. Soubor pacientů po laparoskopické cévní operaci 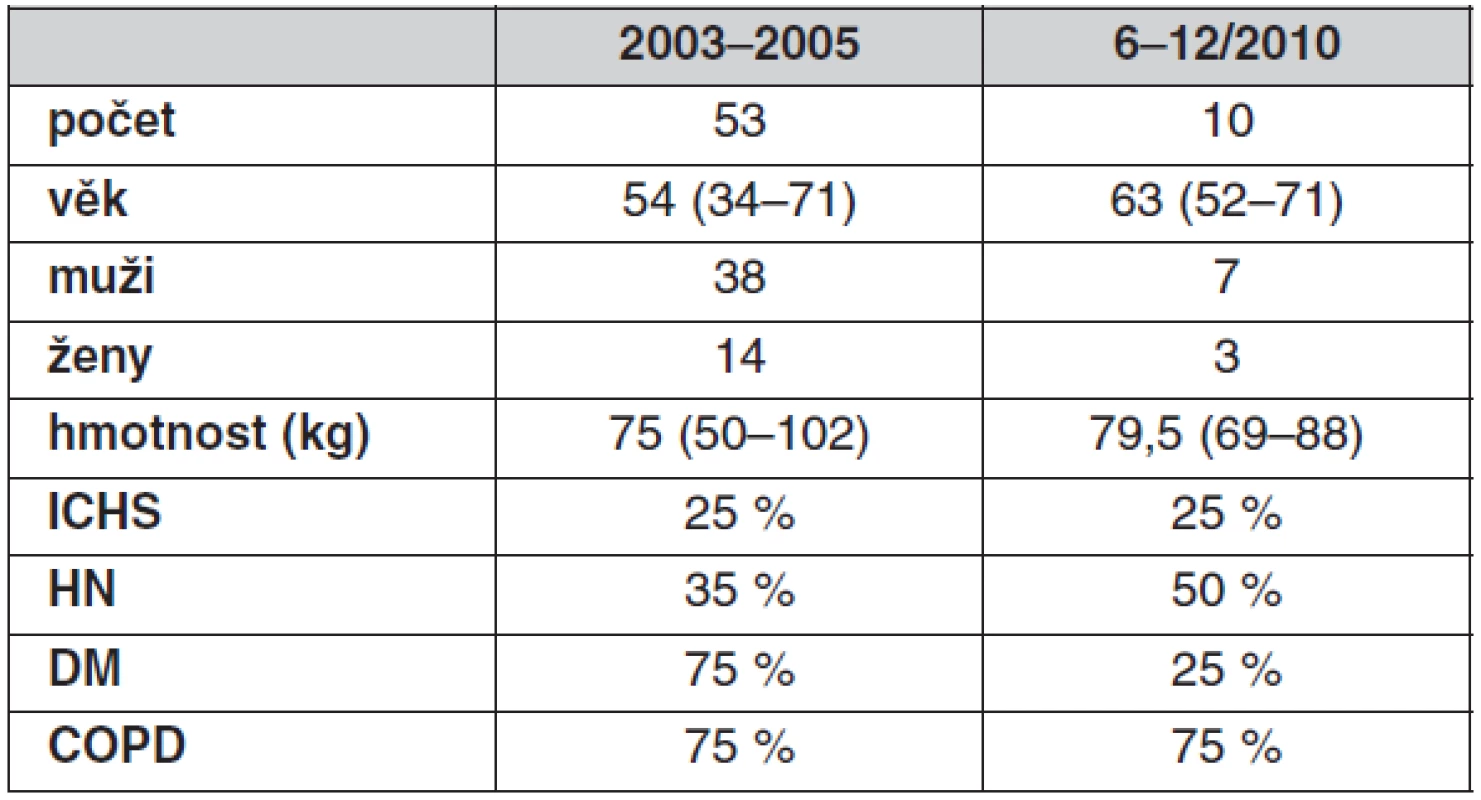
ICHS – ischemická choroba srdeční, HN – hypertenze, DM – diabetes mellitus, COPD – chronická obstrukční nemoc bronchopulmonální Provedli jsme celkem 35 aortofemorálních, 24 ilikofemorálních rekonstrukcí, dvě resekce výdutě břišní aorty (AAA) a dvě endarterektomie aorty (tab. 2).
Tab. 2. Typy laparoskopických cévních operací 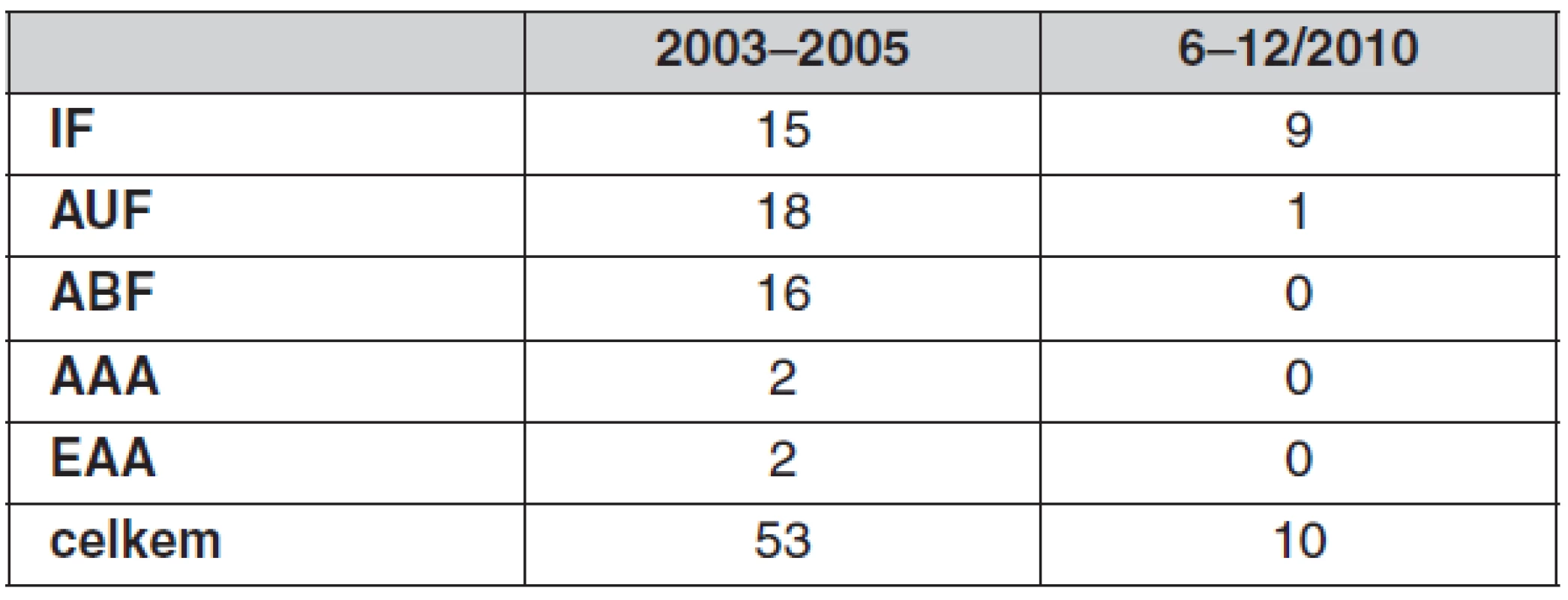
IF – iliakofemorální rekonstrukce, AUF – jednostranná aortofemorální rekonstrukce, ABF – oboustranná aortofemorální rekonstrukce, AAA – resekce výdutě břišní aorty, EAA – endarterektomie aorty Z pacientů indikovaných k této metodě jsme vyřadili pacienty, u kterých je možné endovaskulární řešení, dále pak pacienty s vysokým ASA > III (významné riziko kardiální insuficience při naložení svorky na aortu) a respirační insuficience dané kapnoperitoneem a s ním spojeným útlakem nitrohrudních orgánů. Z dalších kritérií vylučujících tuto metodu jsou předchozí chirurgický výkon na aortoiliackém řečišti, stav po intraabdominálním krvácení, těžká kalcifikace aorty (porcelánová aorta) a morbidní obezita.
V souboru celkem 63 výkonů, které jsou rozděleny časově a s ohledem na dva různé operatéry, jsou sledované parametry srovnatelné (tab. 3). Rozdílné krevní ztráty a počet konverzí je dán komplikací v průběhu jednoho výkonu, kdy došlo k poranění pánevní žíly, které bylo úspěšně ošetřeno.
Tab. 3. Peroperační a pooperační sledování 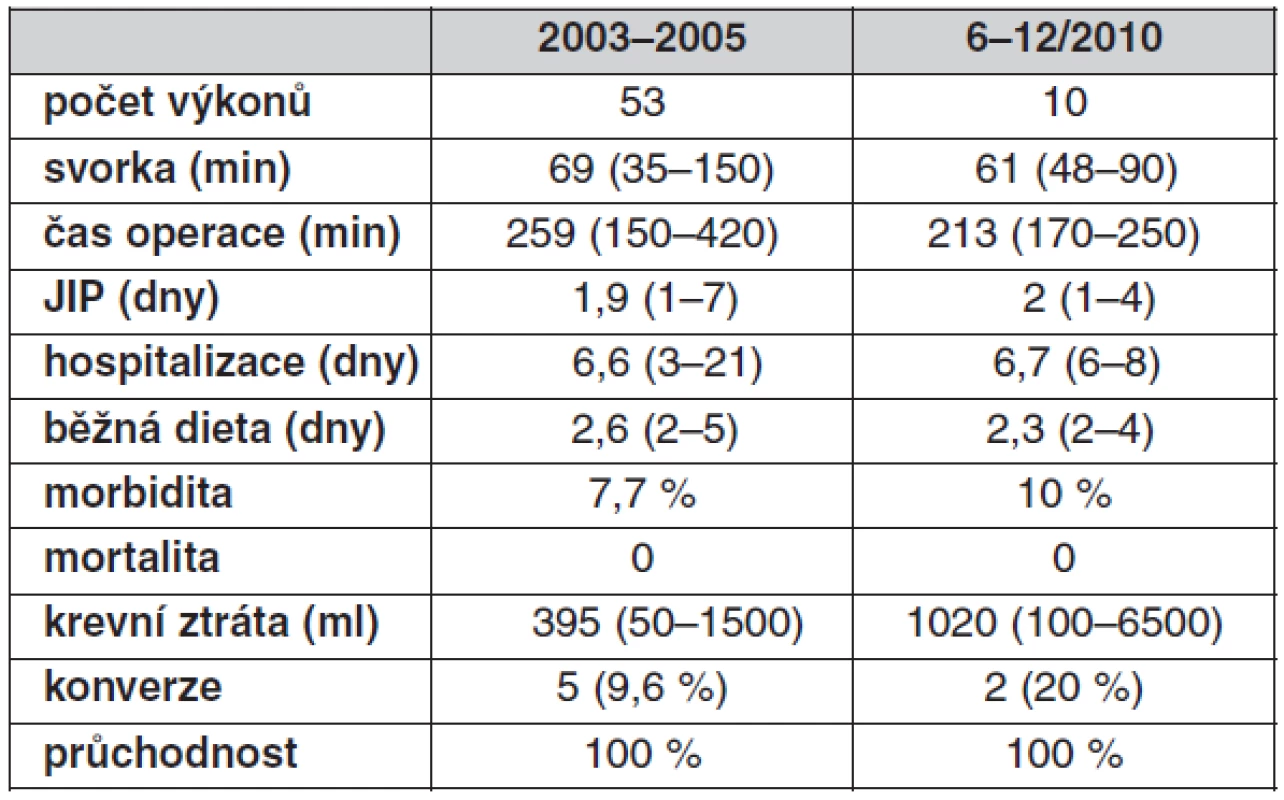
Výsledky souboru 63 operací korespondují s celosvětovými výsledky publikovanými v poslední době (4, 5). Poukazují na miniinvazivitu laparoskopických výkonů a nadále se u tohoto typu výkonů potvrzuje hledisko learning curve a potřeba jejich soustředění na pracoviště a chirurgy se zkušenostmi jak ve všeobecné laparoskopii, tak v cévní chirurgii, zejména při řešení komplikací.
ENDOVASKULÁRNÍ LÉČBA
Sven-Ivar Seldinger (1921–1998) v roce 1953 vymyslel metodu atraumatického zavádění katetru do cévy po vodiči, která poprvé umožnila zobrazení řečiště pomocí vstřiku kontrastní látky. Tímto vynálezem začal rozkvět intervenční radiologie. Charles Dotter (1920–1985) počátkem šedesátých let nejprve úspěšně dilatoval pomocí konického katétru ateroskleroticky zúženou tepnu a později začal do tepen zavádět spirály za účelem remodelace lumina tepny. Různě tvarované drátěné výstuže dokázaly udržet lumen tepny průchodné. Bylo možné je komprimovat do zaváděcího katétru, zavést na místo určení a tam uvolnit. Tyto výstuže byly nazvány stenty podle dentisty Charlese Stenta (1807–1885), jenž podobné používal k napínání kožních transplantátů. Díky tvarové paměti se dokázaly po uvolnění v tepně rozepnout a přitlačit proti stěnám cévy. Odtud už byl jen krůček k nápadu připevnit na povrch stentu cévní protézu, která by po uvolnění v tepně a rozvinutí krevním tlakem vytvořila intraluminální protetickou trubici. První podobné pokusy provedli Balko, Yoshioka a Lawrence, kteří zavedli protézou potahované stenty. Následně, na dvou nezávislých pracovištích, Volodos v Kyjevě (1986) a Parodi v Buenos Aires (1990) zdokonalili postup endovaskulární léčby aneuryzmat pomocí kompozitního materiálu, který poprvé nazvali stentgraftem (SG). Parodi použil jako nosič protézy balonem expandovaný Palmazův stent, nejprve jako kotvení proximální části, takže protéza volně vlála v lumen aorty, a později i jako kotvení distální části. V dalším vývoji stentgraftu se ale podstatně více uplatnila koncepce samoexpandibilního stentu, konstruovaného Gianturcem (1905–1995) a Röschem (1925). Výrobě a dalšímu vývoji stentgraftů se věnuje mnoho renomovaných firem.
Stentgrafty v cévní chirurgii
V posledních 15 letech došlo k mohutnému rozvoji léčení arteriálních onemocnění pomocí stentgraftů. Endovaskulární léčba totiž představuje atraktivní alternativu klasické otevřené operace s výrazně nižší krátkodobou morbiditou a mortalitou. To je zejména významné pro dnešní stárnoucí a významně polymorbidní populaci (6). Mezi choroby indikované k endovaskulární léčbě patří v oblasti hrudní aorty pravá i falešná aneuryzmata, traumatické transekce, disekce a akutní intramurální hematomy. V oblasti subrenální aorty a pánevních tepen jsou to zejména aneuryzmatické dilatace, ale také falešné výdutě infekčního původu.
Původní koncepce tubulárního aortálního stentgraftu je nyní používána zejména v hrudní aortě. Do břišní oblasti se nejčastěji zavádí stentgraft bifurkační. Při neprostupnosti jedné z pánevních tepen, při výrazném vinutí a těsných stenózách pánevního řečiště nebo při urgentním zavádění stentgraftu do prasklé AAA je možno zavést stentgraft aortouniiliakální, krevní přítok pro druhostrannou končetinu je zajištěn pomocí extraanatomického zkříženého bypassu femoro-femorálního nebo iliko-femorálního, který umožňuje zpětné plnění druhostranné zevní a vnitřní pánevní tepny (7). Přítomnost extraanatomického bypassu ovšem přináší určité nevýhody rizika zalomení protézy v anastomózách, infekce v operačních ranách v třísle a trombózy zkříženého bypassu. Bifurkační SG tyto situace řeší nebo jim předchází. Starší generace stentgraftů měla subrenální kotvení, které vyžadovalo nejméně 1,5 cm dlouhou tzv. kotvící zónu. Kotvení SG k vnitřnímu povrchu tepny je částečně zajištěno vztlakem samoexpandibilní kovové kostry, ale zejména radiálně působícím vlastním krevním tlakem. Novější generace s transrenálním kotvením, kde úplet protézy dolehne těsně pod ústím renálních tepen a pevnost spojení s cévní stěnou je zajištěna nekrytým hrdlem stentu přes ústí renálních tepen a nad nimi, umožňuje kotvení do krátkých a nepravidelných subrenálních krčků. Kotvící úseky hrdla stentgraftu se do tepny nevhojí, jsou tedy spojeny nedokonale. Kotvícím mechanismem je zejména krevní tlak a v menší míře i radiální síla vlastního stentu, podpořená většinou u proximálního hrdla zpětnými háčky, které brání distálnímu posunu stentgraftu, tzv. migraci (obr. 1). Výsledná délka a větvení stentgraftu se nastaví až uvnitř tepen skládáním z jednotlivých modulů. Navíc mají nejnovější stentgrafty možnost řízeného kotvení a repozice hrdla již rozvinutého stentgraftu (obr. 2).
Obr. 1. Hrdlo stentgraftu s transrenálním kotvením a zpětnými háčky 
Obr. 2. Hrdlo stentgraftu se definitivně uvolní a zakotví do krčku až po ověření jeho správné polohy 
Postup implantace stentgraftu
Implantace stentgraftu se může provádět v celkové, spinální nebo lokální anestezii. Vzhledem k vysokému věku pacientů a početnosti vedlejších závažných diagnóz je nejčastěji používána anestezie spinální. Pacient je připraven stejně jako na klasickou laparotomickou operaci, protože riziko případného technického neúspěchu při zavádění a vynucenou konverzi na otevřený výkon nelze zcela vyloučit. Přístupovými tepnami pro implantaci SG jsou jedna nebo obě arteria femoralis communis, v případě jejich nedostatečného průsvitu je možné použít arteria iliaca communis nebo arteria iliaca externa. V technicky mimořádně složitých případech je možné použít i tepnu axilární. Výkon se provádí na rentgenovém stole pod fluoroskopickou kontrolou.
Cílem výkonu by mělo být vyřazení celého aneuryzmaticky změněného úseku aorty. K zachycení stentgraftu v tepně je nutné využít zdravou nerozšířenou část tepny nad výdutí, tzv. krček. V hrudní aortě, začíná-li postižení těsně za levou arteria subclavia, je nutné tuto kotvící zónu hledat až v místě odstupů větví oblouku a překryté větve předem přemostit pomocí intratorakálních nebo extratorakálních bypassů. Překrytí samotné a. subclavia sinistra většinou k ischémii levé paže nevede (8). Maximální průměr aorty, do kterého lze hrudní stentgraft zakotvit, je 44 mm.
V abdominální oblasti je kotvicí zóna typicky v subrenálním úseku aorty, který bývá po dlouhou dobu patologickou dilatací nepostižený. Průměry sériově vyráběných stentgraftů umožňují kotvení v proximálním krčku od vnitřního průměru 19 mm do 32 mm. Distální kotvení nožiček běžnými průměry je možné od 8 mm do 19 mm, a díky zvláštnímu rozšířenému zakončení některých extenzí („flared“, „bell bottom“) je kotvení zajištěno až do 25 mm vnitřní šíře pánevních tepen.
Tepenné větve, které ústí do úseku překrytého stentgraftem, je někdy nutné uzavřít pomocí embolizačního materiálu, aby se předešlo zpětnému přítoku krve do vaku výdutě, označovaného jako endoleaku II. typu (9). Endoleak I. typu znamená netěsnost proximálního nebo distálního hrdla stentgraftu, endoleak III. typu netěsnost ve spojení jednotlivých komponent. Výjimečně docházelo u starších výrobků k prosakování úpletu protézy (endoleak IV. typu). Jen velmi vzácně dochází k endotenzi, kdy se endoleak nedá prokázat, ale přesto narůstá tlak ve vaku výdutě, která se pozvolna zvětšuje. Aneuryzmata vyloučená ze systémové cirkulace se po implantaci SG obvykle zmenšují, a to tím ochotněji, čím menší je jejich průměr v době operace. Vak výdutě není po výkonu díky stentgraftu vystaven krevnímu tlaku, riziko ruptury a krvácení je tedy minimalizováno, a to i v případě, že se výduť po operaci nezmenšuje.
Vzhledem k tomu, že přístupovými operačními ranami jsou obvykle dvě malé incize v tříslech, je doba pobytu na intenzivním lůžku omezena na jeden pooperační den a pacient je schopný propuštění do ambulantní péče obvykle od 5. až 7. pooperačního dne. První kontrola správné polohy stentgraftu se provádí CT angiografií za několik dní po implantaci. Ambulantní kontroly se běžně provádějí v intervalu 1, 3, 6 a 12 měsíců, poté jednou ročně. Pro kontroly stentgraftu v abdominální pozici stačí sonografie, v hrudní pozici je zapotřebí CT.
ROBOTIKA V CÉVNÍ CHIRURGII
Robotická chirurgie představuje provádění operací s využitím počítačem řízeného robotického systému. Tato technika nevyžaduje přímý mechanický kontakt operatéra s pacientem. Robotický systém umožňuje výrazně zlepšit přesnost, eliminovat třes rukou, pomocí 3D vjemu zajistit dokonalý obraz operačního pole, minimalizovat invazivitu při zachování maximální efektivity, snižovat rozsah operačního traumatu a v cévní chirurgii může významně ulehčit provedení vlastní cévní anastomózy.
Robotický systém daVinci
Operační robot je založen na principu multimotorického víceramenného systému, vlastního výkonného dílu (systémový počítač) a pracoviště operatéra, který na dálku robota ovládá (10). Robotická ramena s vysoce specializovanými nástroji jsou připojena k počítačem řízenému mechanismu, který je ovládán operatérem sedícím u řídící konzole (obr. 3). Vlastní operace je prováděna přes ovládací konzole, které uvádí v pohyb robotická ramena s instrumenty provádějícími nejjemnější manipulace v klasické laparoskopii nemyslitelné (obr. 4). Všechny pohyby jsou zpracovány a interpretovány počítačem tak, aby zpřesnily a zabezpečily bezpečný pohyb chirurgických nástrojů v pacientově těle. To vše přispívá k eliminaci peroperačních rizik a výrazně překonavá klasickou laparoskopii. Nejedná se o klasického robota v užším slova smyslu, ale operaci provádí chirurg, který využívá této technologie násobící chirurgickou dovednost. První cévní robotem asistovaná rekonstrukce byla provedena v roce 2002 (Wisselink) a v České republice pak v roce 2005 (Štádler).
Obr. 3. Robotický systém da Vinci 
Obr. 4. Robotické rameno s nástrojem a detail robotických nůžek 
Robotické operační systémy zvyšují přesnost, kontrolu a zručnost provedení chirurgického zákroku na úroveň, která není dosažitelná pouhým lidským faktorem. Zároveň umožňuje chirurgovi provádět takové typy minimálně invazivních operací, které nejsou proveditelné s použitím dosud existujících technologií. Pro pacienta pak představují dosažení nejvyšší možné bezpečnosti operace. V současné době se robotické operační systémy používají na předních pracovištích ve světě (11–13). Koncept robotického hybridního operačního sálu je do budoucna považován za standard určitých specializovaných operačních výkonů.
Současné možnosti využití robotického systému v cévní chirurgii
Na základě našich dosavadních zkušeností s více než 190 operacemi lze roboticky úspěšně provádět cévní anastomózu na aortě i na pánevní tepně, a to dokonce snadněji než při klasické laparoskopické operaci. Další možností je odstranění aterosklerotických hmot z lumen aorty nebo pánevních tepen, které mohou způsobit jejich zúžení a robotický systém je tedy možné využít k tromboendarterektomi velkých tepen a následně i pro uzávěr takto desobliterovaných tepen cévní záplatou. Neméně zajímavou oblastí pro robotickou cévní chirurgii jsou operace výdutí břišní aorty (tab. 4). V tomto případě se jedná o provádění cévních anastomóz, odstranění trombotických hmot z vaku výdutě, uzávěru lumbálních tepen, které po otevření vaku výdutě zpětně krvácejí a nakonec i uzávěr vaku výdutě aorty po rekonstrukci. V dutině břišní je pak na závěr u všech výše popsaných výkonů provedena robotická sutura retroperitonea. Velice zajímavé je použití robotického systému při rekonstrukci viscerálních tepen například při operaci výdutě slezinné tepny nebo rekonstrukce ledvinné tepny či první hybridní výkony, které patří také do spektra našich robotických cévních operací (14).
Tab. 4. Spektrum roboticky asistovaných cévních operací, celkem 190 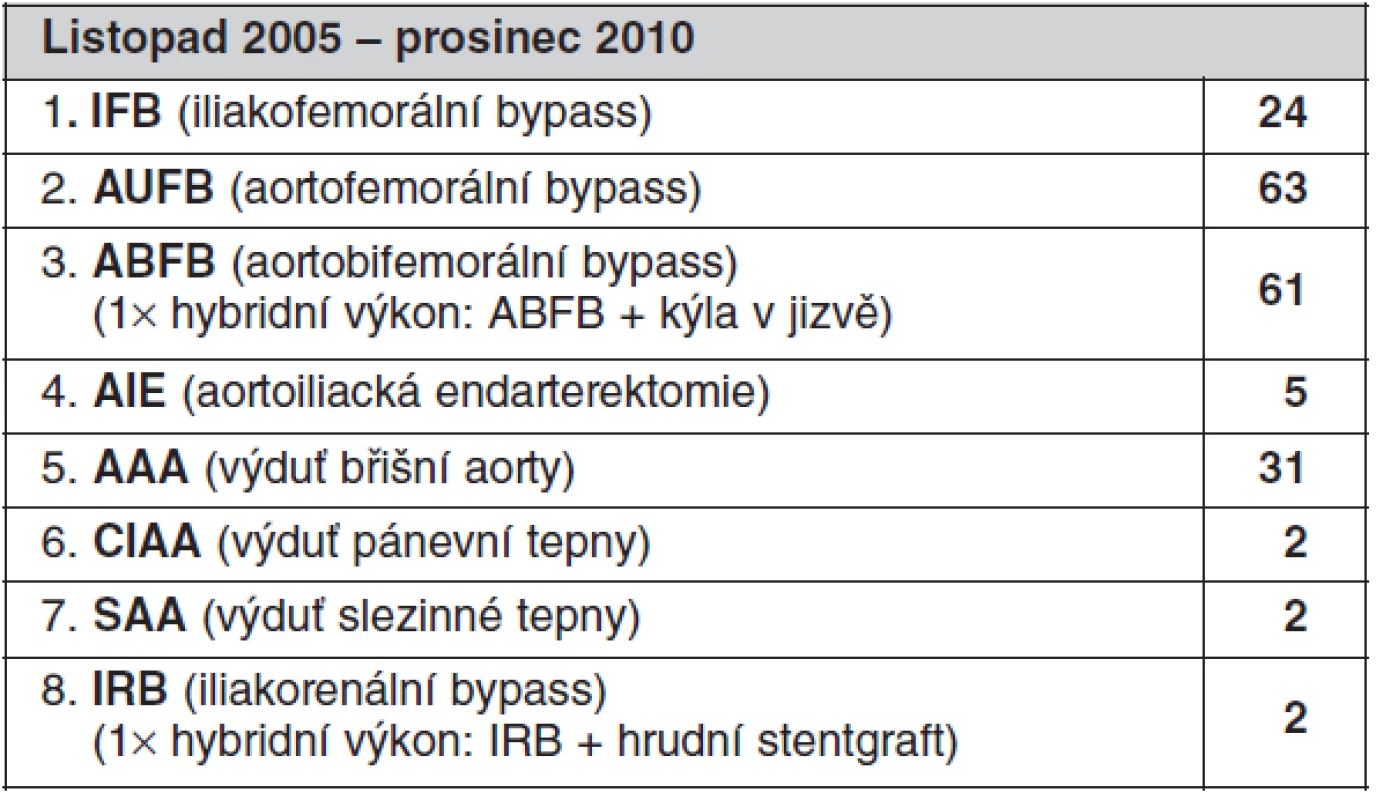
Robotické cévní operace je možné rozdělit podle lokalizace na výkony v pánevní oblasti, na břišní aortě, na viscerálních tepnách nebo na hrudní aortě (obr. 5). Toto rozdělení však neodpovídá stupni obtížnosti, protože na pánevní tepně může být prováděna jednoduchá roboticky asistovaná centrální anastomóza iliakofemorální rekonstrukce nebo poměrně složitější náhrada výdutě aorty nebo pánevní tepny, kdy jsou roboticky našívány obě anastomózy (obr. 6). Příznivější rozdělení se nabízí podle typu onemocnění, kdy se může jednat o robotické operace v aortoiliacké oblasti z důvodu aterosklerotického postižení nebo aneuryzmatického postižení. Obecně náročnější výkony na viscerálních tepnách, hybridní výkony v kombinaci s endovaskulárními technikami a robotické operace hrudní aorty zcela jistě patří jen do rukou zkušených vaskulárních chirurgů s dobrými zkušenostmi laparoskopie a robotiky.
Obr. 5. Robotická centrální anastomóza „end-to-side“ aortobifemorální rekonstrukce 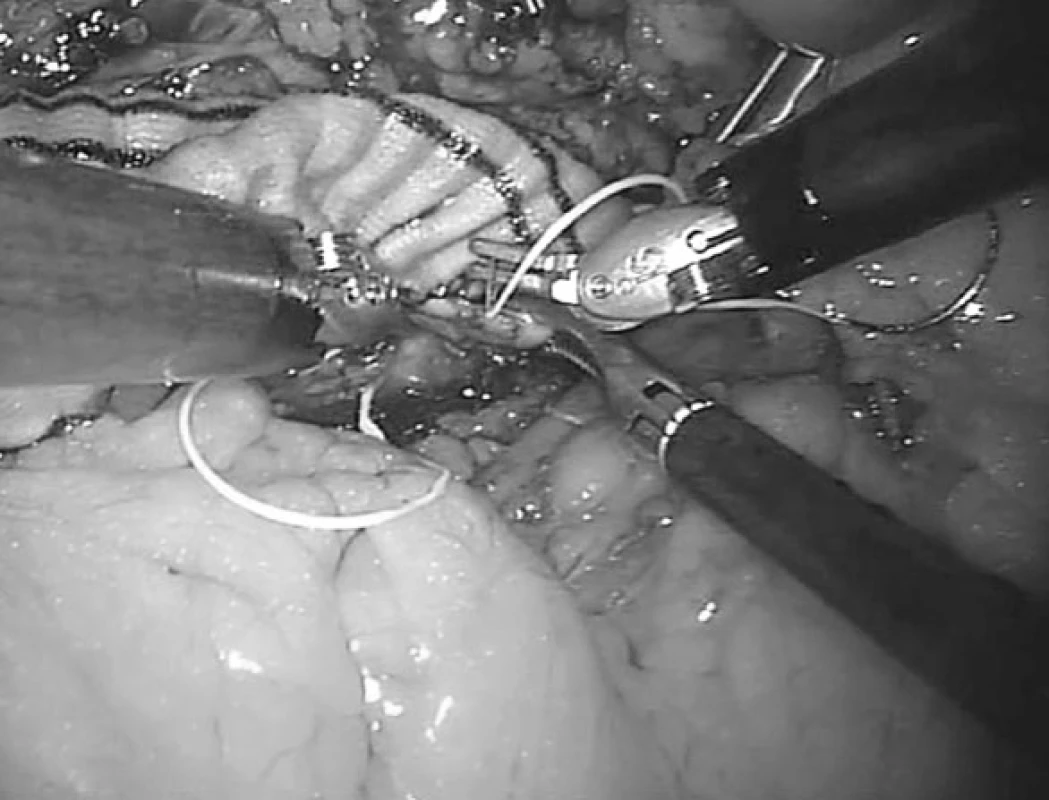
Obr. 6. Robotická periferní anastomoza „end-to-end“ (výduť břišní aorty, aorto-aortální náhrada) 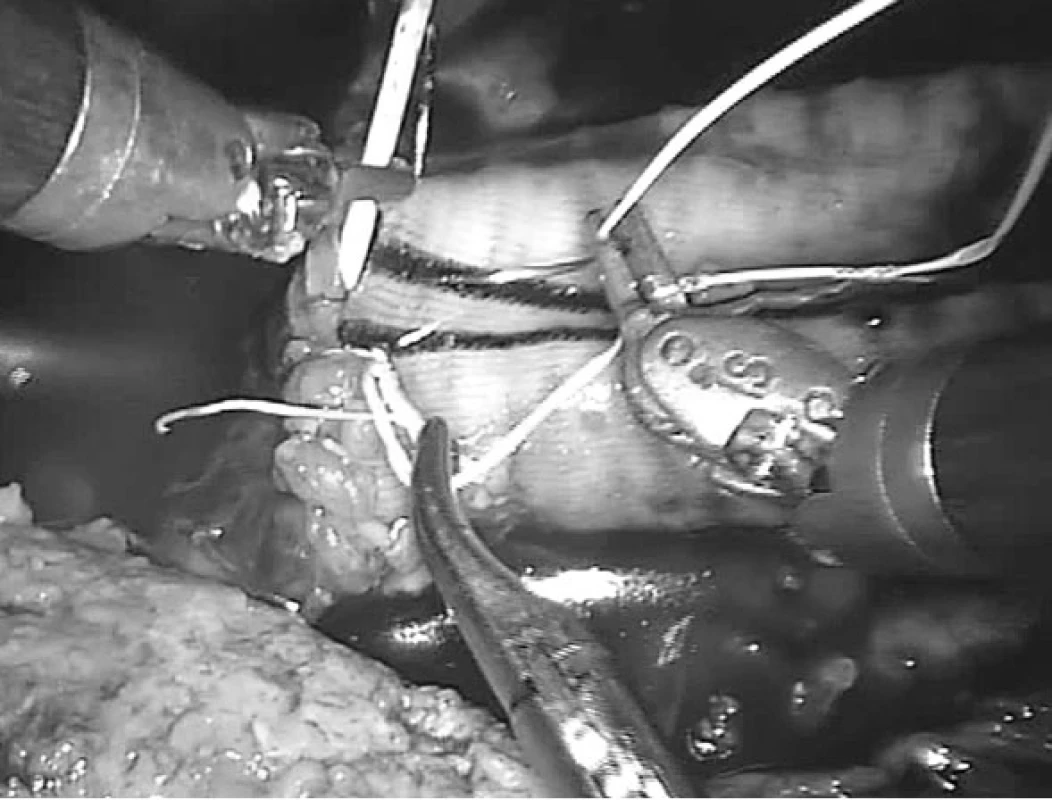
Roboticky asistované cévní operace je možné provádět kombinovaně za použití standardní laparoskopie a robotického systému daVinci anebo plně roboticky. Při kombinovaném postupu je laparoskopicky provedena preparace tepen a následně pak roboticky vlastní cévní anastomóza. V případě plně robotické operace jsou všechny kroky uskutečněny jen roboticky. Při operaci jsou většinou využívána tři robotická ramena, jen při operacích výdutě pánevní tepny bývá čtvrté rameno použito pro robotický nástroj, který slouží jako retraktor k vytvoření dostatečného prostoru pro šití anastomóz.
Robotická chirurgie se dnes většinou vyvíjí jako multidisciplinární obor zahrnující různé operační obory a zároveň využívá veškerých předností minimálně invazivních metod. Jedná se zejména o urologii, kardiochirurgii, cévní chirurgii, všeobecnou břišní chirurgii, gynekologii, hrudní chirurgii a onkochirurgii.
V centrech robotické chirurgie bývá převážně multidisciplinární operační sál, na kterém se střídají jednotlivé chirurgické obory. S dalším rozvojem robotické chirurgie se ale začínají objevovat i jednooborová pracoviště v důsledku prudšího rozvoje určité robotické chirurgické specializace. Do budoucna si lze v oblasti cévní chirurgie jistě představit využití robotických systémů i na hrudní aortě a hlavně v kombinaci s endovaskulárními technikami při tzv. hybridních výkonech, které by mohly nahradit některé typy velice náročných výkonů v oblasti hrudní a břišní aorty (15–17).
ZÁVĚR
Minimálně invazivní výkony v cévní chirurgii splňují obecné výhody miniinvazivní chirurgie. Patří k nim především příznivý kosmetický efekt, snížení pooperační bolestivosti, redukce morbidity a mortality, dále zkrácení pooperační závislosti na ventilátoru i pobytu na JIP, zkrácení celkové doby hospitalizace, snížení nákladů na léčbu a časnější návrat pacienta k běžnému životu. Tyto nové metody představují efektivní zlepšení nebo alternativní náhradu tradičních chirurgických přístupů při zlepšení celkového komfortu pro pacienta.
K nevýhodám laparoskopických a robotických výkonů v cévní chirurgii může patřit delší operační čas, který je ale závislý na zkušenostech chirurga. S narůstajícími zkušenostmi i zde dochází k významné redukci délky operace. Zvláště u laparoskopických a torakoskopických výkonů je důležitý nácvik cévní anastomózy na trenažeru a na zvířeti před zahájením vlastní klinické operativy. Nezanedbatelná není ani laparoskopická zkušenost v obecné chirurgii, která může významně urychlit zvládnutí techniky laparoskopie v cévní chirurgii. Další nevýhodou těchto výkonů jsou i vyšší pořizovací náklady zmíněných technologií i vyšší cena vlastní operace. Na druhé straně ale zkrácení hospitalizace a rychlejší návrat k běžnému životu může v konečném důsledku tyto chirurgické zákroky zlevnit. Hlavní výhodou endovaskulárních technik je možnost použití lokální nebo svodné anestezie, což je důležité hlavně u pacientů s četnými přidruženými chorobami a také doba hospitalizace ve srovnání s klasickými chirurgickými operacemi je kratší. Na druhou stranu jsou tyto přednosti kompenzovány nutnými častějšími kontrolami a větším počtem reintervencí z důvodu endoleaku nebo pokračující dilatace nativního řečiště například v místě viscerálních tepen atd. Technologický vývoj však pokračuje dál a objevují se nově typy stentgraftů s větvením pro tepny zásobující orgány i stentgrafty fenestrované, které se ve zmíněných oblastech začínají také používat.
Komplikace u minimálně invazivních cévních výkonů (zvláště laparoskopických nebo torakoskopických) mohou být obecné a specifické.
Mezi obecné patří komplikace v důsledku insuflace CO2 a zvýšeného tlaku v dutině břišní nebo hrudní. Při obvyklém intraabdominálním tlaku (12–15 torr) používaném při laparoskopii vzniká jen mírná hyperkapnie a respirační acidóza, které jsou dobře tolerovány. Vysoký intraabdominální tlak může způsobit kolaps kapacitních cév, snížit cévní rezistenci a krevní tlak, zapříčinit těžkou hyperkapnii, která má kardiodepresivní efekt popřípadě může být příčinou embolizace plynu. Během endoskopických operací je třeba průběžně kontrolovat přístroj pro insuflaci CO2, zajistit dostatečnou relaxaci břišní stěny, intermitentní desuflaci dutiny břišní a úplnou desuflaci CO2 po operaci. Další možnou komplikací může být poranění v důsledku zavádění trokárů. Instalace prvního trokáru musí být prováděna opatrně a v případě jizvy po předcházející operaci zcela mimo tuto oblast. Další trokáry je nutné již striktně instalovat za přímé vizuální kontroly kamerou. Ke specifickým komplikacím patří krvácení, které může být jednak z oblasti anastomózy, z nedostatečně těsnících cévních svorek, neošetřených drobných větví aorty (např. lumbální tepny) atd. Konverze laparoskopických a torakoskopických výkonů na klasický nebo kombinovaný výkon bývá podle literárních údajů kolem 5–10 %. Nejčastějším důvodem konverze je technická obtížnost nebo peroperační komplikace.
Zavedení pravidelného programu laparoskopické operativy zkrátí „learning curve“ a sníží četnost technických chyb a komplikací.
Zkratky
AAA – výduť břišní aorty
ABF – oboustranná aortofemorální rekonstrukce
ASA – American Society of Anesthesiologists
AUF – jednostranná aortofemorální rekonstrukce
CO2 – oxid uhličitý
COPD – chronická obstrukční nemoc bronchopulmonální
CT – computed tomography
DM – diabetes mellitus
EAA – endarterektomie aorty
HN – hypertenze
IF – iliakofemorální rekonstrukce
ICHS – ischemická choroba srdeční
JIP – jednotka intenzivní péče
SG – stentgraft
Adresa pro korespondenci:
doc. MUDr. Petr Štádler, Ph.D.
Oddělení cévní chirurgie Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
e-mail: petr.stadler@homolka.cz
Zdroje
1. Thompson JE. History of vascular surgery, Surgery, basic science and clinical evidence. Norton JA et al. New York: Springer 2008.
2. Dion YM, Kathouda N, Rouleau C, Aucoin A. Laparoscopy - assisted aortobifemoral bypass. Surg Laparosc Endosc 1993; 3 : 425–429.
3. Štádler P, Šebesta P, Vitásek P, Matouš P, El Samman K. A modified technique of transperitoneal direct approach for totally laparoscopic aortoiliac surgery. Eur J Vasc Endovasc Surg 2006; 3 : 266–269.
4. Cau J, Ricco JB, Corpataux JM. Laparoscopic aortic surgery: Techniques and results, J Vasc Surg 2008; 48 : 37S–45S.
5. Nio D, Diks J, Bemelman WA, Wisselink W, Legemate DA. Laparoscopic Vascular Surgery: A Systematic Review. Eur J Vasc Endovasc Surg 2007; 33 : 263–271.
6. Alberto P, Maddalena G, Giuseppe G, Ilaria Q, Franci B, Campagna MS, Eugenio N, Antonio B, Carlo S, Ranuccio N. Prevalence of risk factors, coronary and systemic atherosclerosis in abdominal aortic aneurysm: comparison with high cardiovascular risk population. Vasc Health Risk Manag 2008; 4(4): 877–883.
7. Hobo R, Sybrandy JE, Harris PL, Buth J, EUROSTAR Collaborators. Endovascular repair of abdominal aortic aneurysms with concomitant common iliac artery aneurysm: outcome analysis of the EUROSTAR Experience. J Endovasc Ther 2008; 15(1): 12–22.
8. Gawenda M, Brunkwall J. When is safe to cover the left subclavian and coeliac arteries. Part I: left subclavian artery. J Cardiovasc Surg (Torino). 2008; 49(4): 471–477.
9. Šedivý P, El Samman K, Bartík K, Mach T, Šlais M, Štádler P, Přindišová H. Prevence endoleaku II. typu pomocí peroperačního coiling vaku aneuryzmatu abdominální aorty během implantace stentgraftu. Rozhl Chir 2010; 89(1): 18–23.
10. Martinez BD, Wiegand CS. Robotic in vascular surgery. Am J Surg 2004; 188 : 57–62.
11. Štádler P, Dvořáček L, Vitásek P, Matouš P. Robotic vascular surgery, 150 cases. Int J Med Robot 2010; 6(4): 394–398.
12. Fernandez JD, Garrett HE Jr, Cal N. Robot-assisted minimally invasive procedure for descending aorta—bifemoral bypass: a case report. Vasc Endovasc Surg 2009; 43(1): 93 – 95.
13. Kolvenbach R, Schwierz E, Wasilljew S, Miloud A, Puerschel A, Pinter L. Total laparoscopically and robotically assisted aortic aneurysm surgery: a critical evaluation. J Vasc Surg 2004; 39(4): 771–776.
14. Štádler P, Vitásek P, Matouš P, Dvořáček L. Hybridní roboticky asistovaná operace, aortobifemorální bypass s rekonstrukcí kýly v jizvě. Rozhl Chir 2008; 11 : 590–592.
15. Ishikawa N, Sun Y S, Nifong LW, Ohtake H, Watanabe G, Chitwood WR Jr. Robotic replacement of the descending aorta in human cadaver. Artif Organs 2006; 30 : 719–721.
16. Wahlgren CM, Skelly C, Shalhav A, Bassiouny H. Hybrid laparorobotic debranching and endovascular repair of thoracoabdominal aortic aneurysm. Ann Vasc Surg 2008; 22 : 285–289.
17. Katz MR, Van Praet F, de Canniere D, Murphy D, Siwek L, Seshadri - Kreaden U, Friedrich G, Bonatti J. Integrated coronary revascularization: percutaneous coronary intervention plus robotic totally endoscopic coronary artery bypass. Circulation 2006; 114: (1 Suppl): 1473–1476.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek ZprávyČlánek ZprávyČlánek KnihyČlánek Diagnostika sepseČlánek ZprávyČlánek ZprávyČlánek Pokroky v lékových formáchČlánek Zprávy JCLČlánek Laureáti Nobelovy ceny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- INFOGRAFIKA: Vzácná diagnóza včas
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Úvodník
- Nemocnice Na Homolce – dvacet let špičkové medicíny
- Aplikace moderní mikroneurochirurgie a současných technologií při řešení nádorových a cévních onemocnění mozku
- Zprávy
- Karcinom ledviny v éře nastupujících robotických technologií
- Zprávy
- Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
- Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
- Syndrom časné repolarizace a idiopatická fibrilace komor
- Psychologická péče jako součást interdisciplinární přípravy pacienta k bariatrické operaci
- Minimálně invazivní výkony v cévní chirurgii
- Význam radiochirurgie v léčbě meningiomů
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Zprávy
- Nekonvulzivní status epilepticus
- Význam radiochirurgie v léčbě mozkových metastáz
- Současná farmakoterapie epilepsie
- Knihy
- Diagnostika sepse
- Pedální bypass a jeho role v záchraně kriticky ischemické končetiny
- Zprávy
- Šestileté zkušenosti s operacemi vrozených srdečních vad u dospělých
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
- 24. český a slovenský neurologický sjezd
- X. a XI. česko-slovenská konference laboratorní hematologie
- Onkologie v gynekologii a mammologii
- 19. lipovské dermatovenerologické fórum
- Mezioborový seminář Třeboň ‘11
- Pokroky v lékových formách
- Doc. MUDr. Milan Jaroš, CSc. – osmdesátiletý
- Docent Radim Kočvara šedesátníkem
- Zprávy JCL
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom časné repolarizace a idiopatická fibrilace komor
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Nekonvulzivní status epilepticus
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



