-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
Deep brain stimulation in movement disorders: a Prague-center experience
Deep brain stimulation (DBS) in the basal ganglia plays an irreplaceable role in the treatment of Parkinson’s disease (PD), essential tremor (ET), and some types of dystonia. Electrodes are typically inserted into the subthalamic nucleus (STN), the internal globus pallidus (GPi) and the ventral intermediate nucleus of the thalamus (VIM). Stimulation of the STN is the main objective in PD, GPi in the treatment of dystonia and PD, and VIM stimulation is effective against tremor. In patients indicated for DBS treatment, stimulation eliminates or reduces rigidity (PD), hypokinesia (PD), tremor (ET, PD) and dyskinesias (dystonia, PD). At the Center for Movement Disorders in Prague, DBS has been performed in 127 patients: in 86 patients for PD, 19 patients for dystonia (11 primary generalized dystonia, 5 primary cervical dystonia, 1 segmental craniocervical dystonia), and in 22 patients for tremor (20 ET, 2 other types of tremor). Intraoperatively we have succeeded in eliminating rigidity in 95% of cases of PD, and tremor in 93% of cases of ET. The positive effect of stimulation on dystonia appeared in 95% with a latency of weeks. Transitory intraoperative morbidity occurred in 8%, intracranial hemorrhage in 1%, infectious complications in 6%, and problems with hardware in 7%.
Key words:
deep brain stimulation, stereotaxy, Parkinson’s disease, tremor, dystonia.
Autoři: Dušan Urgošík 1,2; Robert Jech 2; Evžen Růžička 2; Filip Růžička 1; Roman Liščák 1; Vilibald Vladyka 1
Působiště autorů: Oddělení stereotaktické a radiační neurochirurgie Nemocnice Na Homolce, Praha 1; Univerzita Karlova v Praze, 1. lékařská fakulta, Neurologická klinika a Centrum klinických neurověd VFN 2
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 223-228
Kategorie: Přehledový článek
Souhrn
Hluboká mozková stimulace v bazálních gangliích má své nezastupitelné místo v léčbě extrapyramidových poruch pohybu. Nejčastěji jsou takto léčeni pacienti s Parkinsonovou chorobou (PN), esenciálním třesem (ET) a vybranými typy dystonií. Standardně jsou elektrody zaváděny do nucleus subthalamicus (STN), vnitřního pallida (GPi) a ventrálního intermediálního jádra thalamu (VIM). STN je hlavním cílem stimulace pro PN, GPi je využíváno pro léčbu dystonií a PN, stimulace VIM dobře ovlivňuje třes. Při správné indikaci nemocných a přesně provedené implantaci stimulace odstraňuje nebo snižuje rigiditu (PN), hypokinezi (PN), třes (ET, PN) a dyskinezi (dystonie, PN). V Centru pro extrapyramidové poruchy pohybu v Praze podstoupilo hlubokou mozkovou stimulaci 127 nemocných. Z toho 86 pacientů léčeno pro PN, 19 nemocných pro dystonii (jedenáct primárních generalizovaných dystonií, pět primárních cervikálních dystonií, jedna segmentová dystonie kraniocervikální, dvě sekundární generalizované dystonie) a 22 nemocných pro tremor (20 ET, dva jiné typy tremoru). Intraoperačně se nám podařilo odstranit rigiditu u PN v 95 % případů a třes u ET v 93 %. Pozitivní efekt stimulace se u dystonií objevil v 95 % s latencí týdnů. Přechodná peroperační morbidita se objevila v 8 %, intrakraniální krvácení v 1 %, infekční komplikace v 6 % a problémy se stimulačním materiálem v 7 %.
Klíčová slova:
hluboká mozková stimulace, stereotaxe, Parkinsonova nemoc, tremor, dystonie.Úvod
Hluboká mozková stimulace (DBS – deep brain stimulation) se stala v současné době dominantní chirurgickou léčbou různých forem extrapyramidových poruch pohybu (movement disorders). Jde o funkční stereotaktickou neurochirurgickou metodu, která používá miniinvazivní přístup do nitrolebního prostoru, specifické zařízení – stereotaktický rám (obr. 1) – a zobrazovací metody k přesné lokalizaci místa operačního zásahu. DBS se rozvíjela nejvíce v průběhu posledních dvou dekád zejména při neurochirurgickém řešení Parkinsonovy choroby (PN) a různých forem třesu (1–7). Chronická stimulace bazálních ganglií (STN – nucleus subthalamicus, VIM – ventrální intermediální jádro thalamu a GPi – ventroposterolaterální oblast vnitřního pallida) pomocí intracerebrálně (obr. 2) zavedených elektrod a implantovaného neurostimulátoru (obr. 3) se tak stala rutinní metodou léčby pro vybrané pacienty s PN a esenciálním tremorem (ET). Indikace DBS se záhy rozšířily i pro další extrapyramidové poruchy pohybu, konkrétně na různé formy dystonií. Výběr místa pro implantaci léčebných elektrod vychází ze zkušeností s ablativními (destruktivními) výkony (nejčastěji radiofrekvenční termoléze), které v dané lokalizaci vedly k dobrému efektu, ale často také k nežádoucím příznakům. Ukázalo se, že účinek chronické stimulace o vysoké frekvenci (130 Hz) vede k podobným výsledkům, které jsou však reverzibilní. To se týká jak pozitivních, tak i vedlejších nežádoucích příznaků. Účinek trvá jen po dobu elektrického dráždění. Další výhodou DBS je, že úprava stimulačních parametrů může zvýšit efekt stimulace a snížit vedlejší příznaky. Způsob jak chronická stimulace ovlivňuje jednotlivé projevy nemoci však není zcela jasný. Permanentní stimulace při DBS vede pravděpodobně k aktivaci okruhu mezi daným jádrem, thalamem a kortexem spíše než k lokální inhibici v místě elektrického dráždění (8, 9). Přestože mechanismus účinku chronické elektrické stimulace v bazálních gangliích je stále předmětem diskuze, empirie ukazuje na velmi dobrý efekt této neurochirurgické metody u rozličných extrapyramidových poruch hybnosti.
Obr. 1. Leksellův stereotaktický rám a oblouk 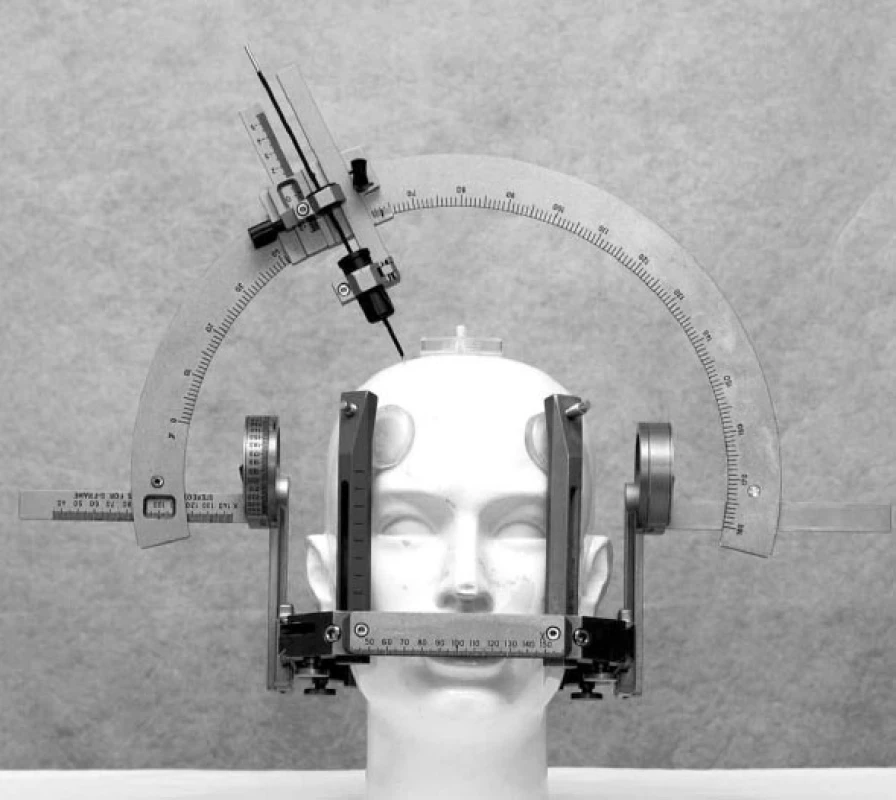
Obr. 2. RTG zobrazení intracerebrálních elektrod 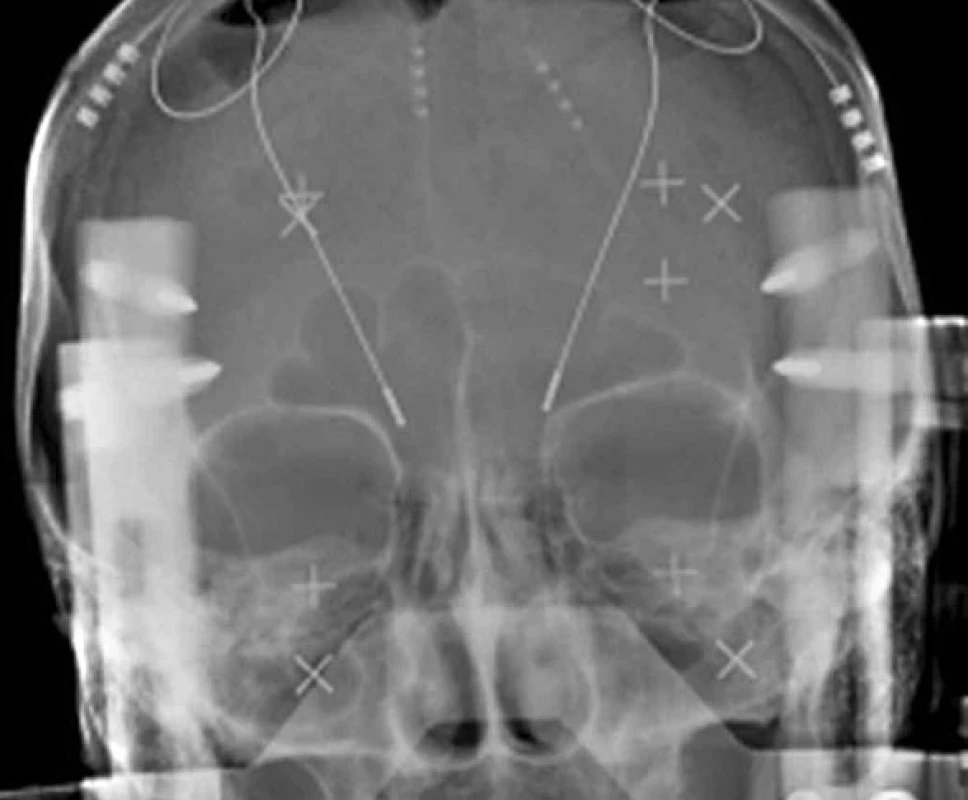
Obr. 3. Intracerebrální stimulační elektroda a implantabilní neurostimulátor 
Hluboká mozková stimulace – operační výkon
Operační výkon se skládá ze dvou fází. V první fázi dochází k implantaci intracerebrálních léčebných elektrod a ve druhé k implantaci neurostimulátoru.
První fáze probíhá většinou (mimo nemocné s těžkými dystonickými příznaky) v lokální anestezii ve spolupráci s nemocným. Operace začíná nasazením stereotaktického rámu, který je v lokálním znecitlivění upevněn transdermálně šrouby do lamina externa kalvy.
Další fází je zaměření cíle. K ní se dnes v naprosté většině neurochirurgických center používá magnetická rezonance (MRI). Společným zobrazením intrakraniálního prostoru a stereotaktického rámu můžeme přesně definovat (stanovením koordinát) libovolný bod v hloubi mozku. K určení, která část mozku je náš cíl (samotná nervová jádra jsou v některých případech obtížně zobrazitelná), slouží tzv. vnitřní vztažné body, anatomicky definované nervové struktury, které jsou pomocí zobrazovacích metod dobře viditelné – nejčastěji commisura anterior (AC) a posterior (PC) (obr. 4). Po zadání jejich polohy do stereotaktického atlasu (10) lze určit, v jaké vzdálenosti se vzhledem ke vztažným bodům nachází cílová struktura (např. GPi, VIM nebo STN), a stanovit její souřadnice. Po stanovení souřadnic cíle dochází k samotné operaci. Z trepanačního návrtu frontálně před koronárním švem jsou do bazálních ganglií stereotakticky zavedeny testovací elektrody, které slouží k funkčnímu potvrzení vypočítaného cíle. Nejlepší pozice pro implantaci chronické léčebné elektrody je pak ověřena elektrofyziologicky pomocí mikroregistrace, tj. snímáním elektrické aktivity neuronové populace v bazálních ganglií a klinickou odpovědí na intracerebrální diagnostickou stimulaci (11). Poté jsou testovací elektrody zaměněny za trvalé.
Obr. 4. Přední (AC) a zadní (PC) komisura na horizontálním řezu magnetické rezonance 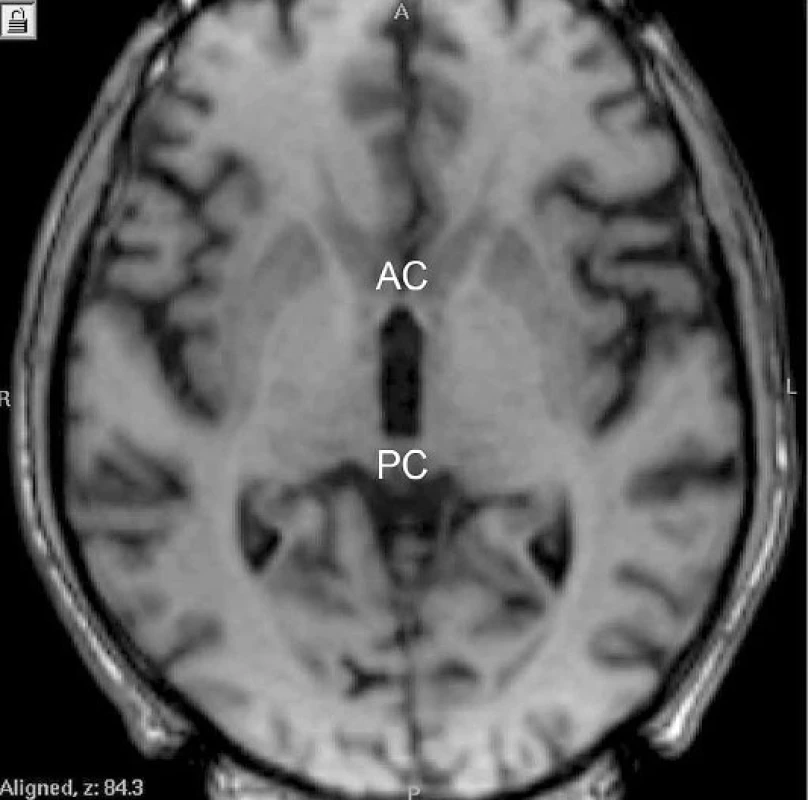
Druhá fáze probíhá v celkové anestezii a spočívá v implantaci neurostimulátoru do podkožní kapsy na hrudníku a jeho spojení s elektrodami pomocí spojovacích kablíků vedených podkožním tunelem přes šíji a skalp. Ve vybraných případech (např. u dystonií) je první i druhá fáze prováděna v jedné době v celkové anestezii (obr. 5).
Obr. 5. Schéma implantovaného stimulačního systému (elektroda, spojovací kablík, neurostimulátor) 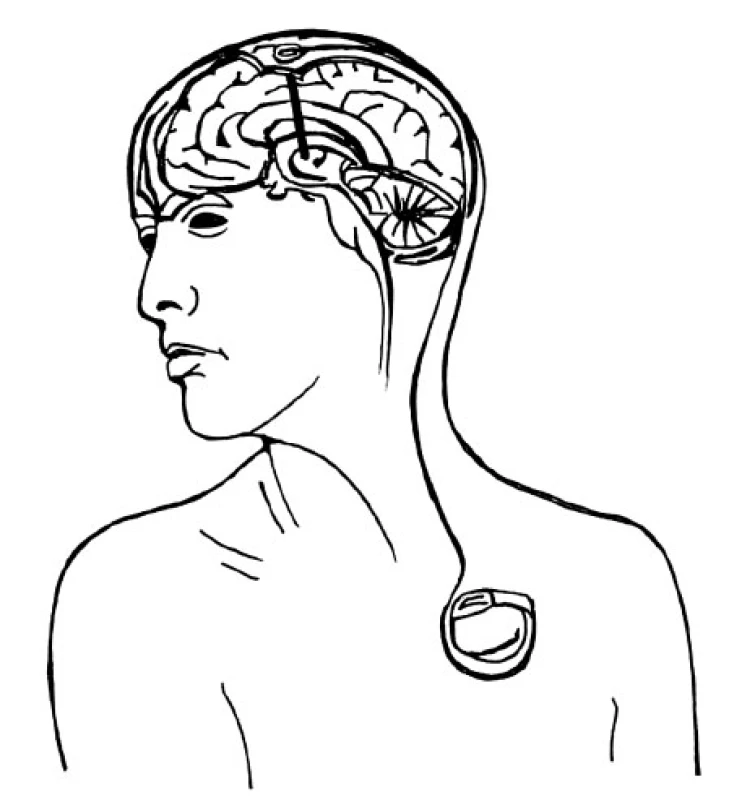
Za třetí fázi operace můžeme považovat nastavení stimulačních parametrů neurostimulátoru, která se provádí transkutánně pomocí magnetické hlavice programovací konzole. Stimulace se zahajuje zpravidla od 4. týdne po implantaci, tj. v době, kdy odezní případný otok mozkové tkáně obkružující stimulační kontakty elektrody. Parametry stimulace se pohybuji v tomto rozmezí: amplituda 0,5 až 4 V, šíře pulzu 60 až 450 μs, frekvence 130–180 Hz. V několika ambulantních sezeních se nastaví dle klinického stavu optimální hodnota stimulace a upraví se farmakologická léčba. Stabilizace stavu se obvykle dosahuje za 3–6 měsíců od implantace. Parametry stimulace a léčby pak zpravidla zůstávají dlouhodobě bez větších změn. Stimulace může pokračovat doživotně, přičemž jediným omezením je kapacita bateriových článků napájejících stimulátor, který proto musí být cca za 4–6 let vyměněn, aniž by bylo nutné manipulovat se stimulační intracerebrální elektrodou.
Výběr pacientů pro DBS
Výběr pacientů u různých chorob se řídí různě složitými kritérii, základem však zůstává pravidlo, že k neurochirurgickému zákroku jsou indikování ti nemocní, u nichž selhává konzervativní léčba. Nejsložitější indikací pro DBS je PN. Mimo tuto chorobu budeme hovořit o tremoru a dystoniích.
Parkinsonova nemoc
Indikace k DBS vzniká především v těch případech, kde farmakoterapie selhává pro výrazné pozdní komplikace, jako je kolísání hybnosti a dyskineze v souvislosti s léčbou L-DOPA. Při rozvaze, zda je nemocný vhodný pro implantaci DBS systému, se řídíme v současné době uznávanými kritérii (12). Protože implantace elektrod je u PN nejčastěji cílena do STN, budeme hovořit o indikacích pro toto jádro.
Hlavní indikační kritéria (v heslech):
- klinicky jistá diagnóza idiopatické PN podle všeobecně přijímaných kritérií,
- trvání onemocnění nejméně 3 roky,
- invalidizující fluktuace hybnosti nebo dyskineze nezvládnutelné všemi dostupnými prostředky farmakoterapie,
- výrazná hybná odpověď na dopaminergní podnět,
- intaktní kognitivní funkce.
Pomocná indikační kritéria:
- věk pacienta do 60 let (relativní kritérium, které zvyšuje úspěšnost a funkční přínos výkonu),
- trvání PN do 10 let (opět relativní kritérium),
- nepřítomnost deprese (anamnestická depresivní epizoda pacienta nevylučuje, ale snižuje úspěšnost výkonu),
- pacient musí být schopen plně pochopit možný přínos a rizika operace, musí chtít a být schopen dokonale spolupracovat před, při a po operaci, včetně dlouhodobého pooperačního sledování a častých kontrol.
Hlavní vylučovací kritéria (stavy a projevy, které jsou neslučitelné s vlastním výkonem nebo prokazatelně vedou k pooperačním komplikacím a k neúčinnosti DBS):
- anamnéza a příznaky svědčící pro jiné onemocnění než je PN,
- demence,
- psychotické projevy včetně polékových,
- nedostatečná odpovídavost PN příznaků na farmakologickou dopaminergní stimulaci.
Pomocná vylučovací kritéria (stavy, které komplikují vlastní výkon a pooperační funkční restituci, některé je ale možno farmakoterapií, psychoterapií upravit):
- ischemické léze či jiné strukturální změny bazálních ganglií nebo výrazná ischémie mozku,
- floridní deprese,
- nepřiměřené očekávání efektu úzdravy,
- nedostatečná vůle pacienta a pečovatelů (rodiny) ke spolupráci.
Tremor (mimo parkinsonský třes)
Indikace k DBS je podstatně méně sofistikovaná než u samotné Parkinsonovy nemoci. Stimulace vybraného cíle pozitivně ovlivňuje třesy různých etiologií (ET, mozečkový třes, Holmesům (rubrální) třes či tremor u periferních neuropatií (např. monoklonální gammapatie IgM a IgG) (13). Nejčastěji se indikuje k operaci ET. Parkinsonský třes se řeší v komplexu celé nemoci a klasický thalamický cíl není vhodným cílem, protože ostatní příznaky na tuto stimulaci příliš nezabírají. Obecně lze říci, že vhodným kandidátem je nemocný s takovým třesem, který mu znemožňuje společenské uplatnění (široký pojem zahrnující obtíže při výkonu zaměstnání i ztrátu samoobsluhy v běžném životě) a adekvátní medikamentózní terapie je bez efektu. Hlavním indikačním kritériem je tedy těžký invalidizující akční třes stupně 3–4 dle příslušné škály (14). Lépe se stimulací odstraňuje třes akrálních částí končetiny než tremor vycházející z proximálních partií, z hlavy a trupu.
Dystonie
Dystonie je heterogenní onemocnění. Jednotlivé formy dystonie jsou klasifikovány na základě etiologie (primární, sekundární – včetně heredodegenerativní příčiny), začátku onemocnění (časný, pozdní nástup) a oblasti postiženého těla (fokální, multifokální, segmentové, hemidystonie, generalizovaná), proto je také obtížené najít společná indikační kritéria. Konzervativní léčba není obecně příliš úspěšná s výjimkou aplikace botulotoxinu, která má především efekt u fokálních dystonií. DBS metoda proto našla své uplatnění i u mnohých typů dystonií, a to především u primárních a některých s heredodegenerativní etiologií nemoci (15). Přestože v literárních odkazech je možné najít úspěšnou aplikaci DBS u různých typů dystonií, kdy počet pacientů s implantací nepřesahuje několik zmíněných případů, nejčastěji je tato metoda používaná u primárních generalizovaných (16) a cervikálních dystonií.
Výběr stereotaktických cílů pro implantaci elektrod
Pro dobrý úspěch operace je důležitý správný výběr místa, kam zavedeme mozkové elektrody. Ačkoliv je patrná snaha mnoha center nacházet nové cíle pro DBS u stávajících indikací a využívat stávající anatomické cíle pro nové nemoci, zůstává zlatým standardem pro stereotaktickou neurochirurgii následná trias anatomických struktur používaných pro implantaci intracerebrálních elektrod u extrapyramidových poruch (10). Každý cíl má možnost ovlivnit jiné příznaky nemoci (tab. 1):
Tab. 1. Ovlivnění příznaků extrapyramidových poruch dle místa DBS stimulace 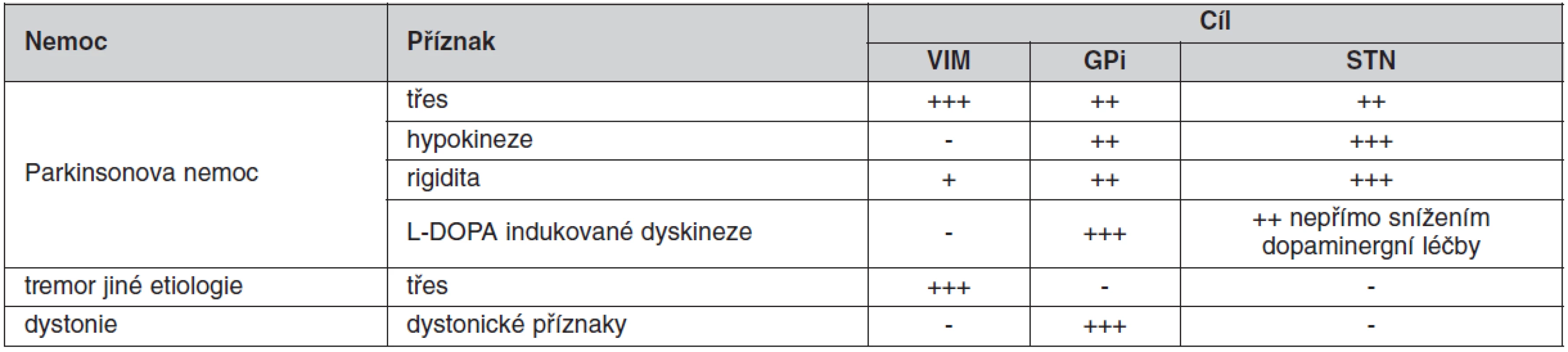
DBS – deep brain stimulation, VIM – ventrální intermediální jádro thalamu, GPi – vnitřní pallidum, STN – nucleus subthalamicus - Nucleus subthalamicus (STN) – univerzální jádro (obr. 6) pro komplexní ovlivnění příznaků PN; velice dobře ovlivňuje, rigiditu, třes i hypokinezi. STN je užíván jako cíl hlavně u PN (5, 7).
- Ventroposterolaterální (VPL) oblast vnitřního pallida (GPi) v blízkosti odstupu ansa lenticularis ze senzomotorické projekční oblasti bazálních ganglií (obr. 7). Zásah v GPi nejlépe ovlivňuje dopaminergně indukované dyskineze u PN, rigiditu, méně pak třes a hypokinezi (17). V současné době je dominantním cílem pro léčbu dystonií (16, 18, 19).
- Ventrální intermediální (VIM) jádro thalamu (obr. 7), které je součástí ventrálního laterálního (VL) jádra. Zásah má suverénní účinek na tremor různé etiologie, lehce ovlivňuje i rigiditu. Nejčastěji používán u léčby ET (3).
Obr. 6. Nucleus subthalamicus (STN): koronální řez T2 vážené sekvence, šipka označuje STN jádro 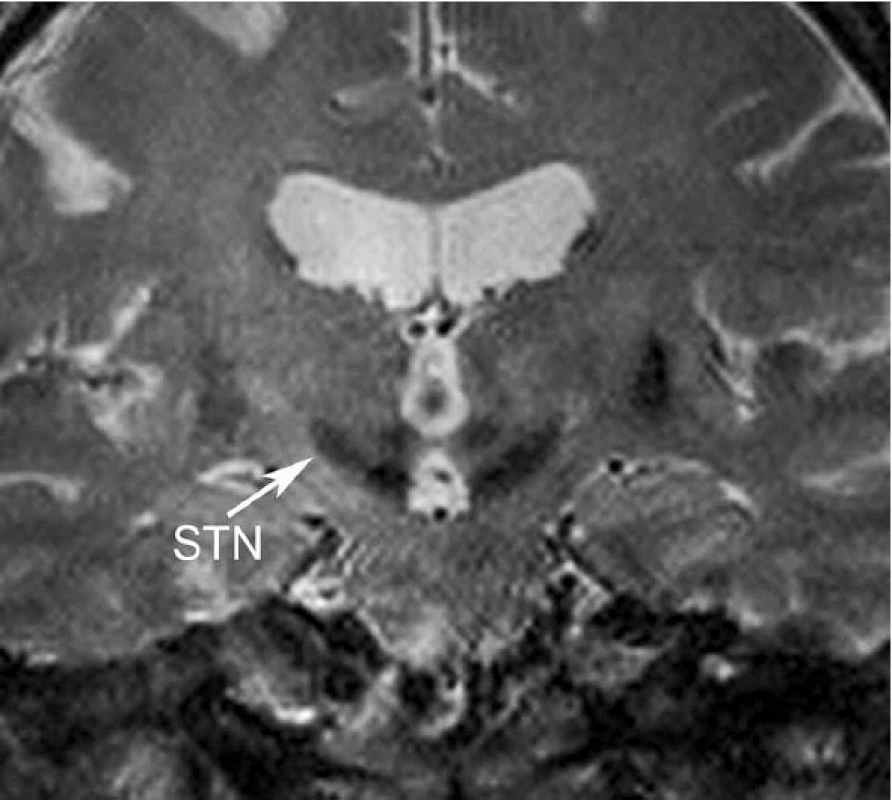
Obr. 7. VIM jádro thalamu a oblast vnitřního pallida v AC – PC rovině Magnetická rezonance – sekvence inversion recovery: levý přední kroužek (z pohledu čtenáře) na hranici vnitřního pallida zobrazuje trajektorii pro zacílení ventroposterolaterální části pallida; pravý zadní kroužek ukazuje cílový bod pro implantaci elektrody do VIM jádra thalamu 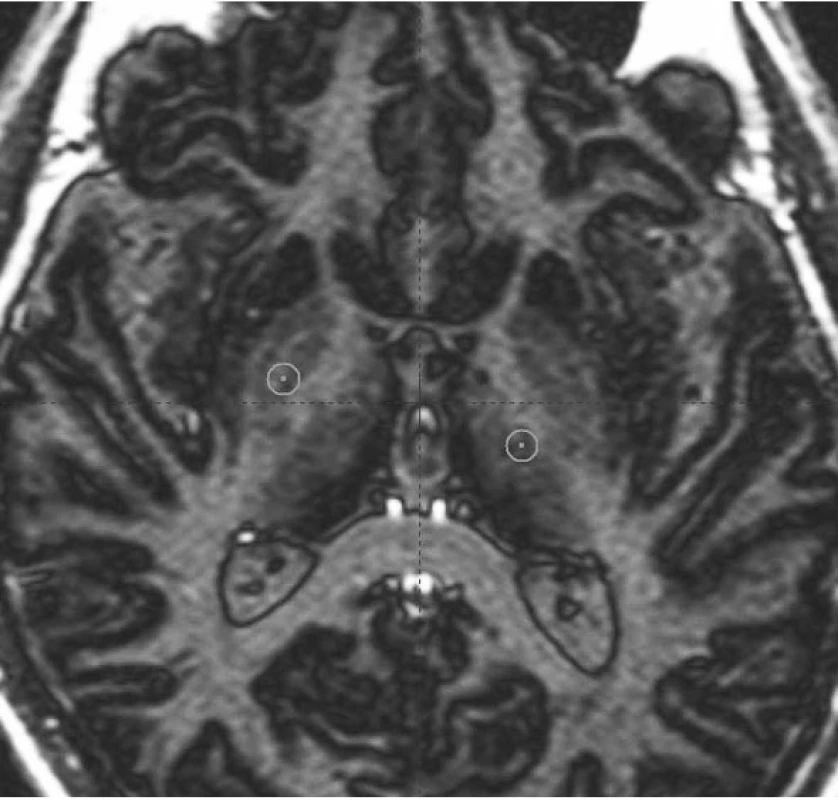
Klinický efekt hluboké mozkové stimulace
Parkinsonova nemoc a esenciální třes
Redukce rigidity, hypokineze a třesu nastává v řádu sekund až hodin po začátku stimulace a relativně velmi rychle je patrný i efekt na komplexní pohyb nemocného. Pro celkové vyhodnocení klinického efektu léčby u PN jsou používány různé škály hodnotící jak motorické, tak nemotorické příznaky. Základem zůstává škála Unified Parkinson’s Disease Rating score (UPDRS), která v podobě jednotlivých podskupin mimo jiné shrnuje hodnocení motorických příznaků včetně dyskinéz (UPDRS III a IV) a denní aktivity nemocného (UPDRS II). Komplexní hodnocení PN nemocných je relativně komplikované, proto pro rychlejší orientaci bývají ve zkratce uváděny především výsledky motorických funkcích nemocných. DBS s cílem v STN a GPi významně redukuje všechny kardinální motorické příznaky (viz tab. 1) až na poruchy chůze a stoje, které před operací nebylo možno ovlivnit L-DOPA preparáty. Dobrý efekt stimulace dokumentují četné práce. Podle různých studií se hybné funkce nemocných (UPDRS III) při DBS zlepšily v průměru o 31 % (20) až 56 % (21) ve srovnání se stavem před operací, dyskinéze (UPDRS IV) se v průměru zredukovaly o 64 % (21) až 76 % (22) a denní aktivita (UPDRS II) zlepšila o 32 % (20) až 50 % (23). Stimulace v STN navíc vedla k významné redukci antiparkinsonské medikace (24).
U ET je hodnocení stavu nemocného jednodušší. Základem je klasifikace intenzity třesu ve škále 0–4. Podle různých autorů DBS u ET vedla k signifikantní dlouhodobé redukci třesu končetin od 86 % (25) do 90 % (26).
Dystonie
Efekt DBS na dystonie nastupuje s latencí několika týdnů až měsíců. Tento fakt spolu s různorodostí obrazů jednotlivých dystonií poněkud komplikuje hodnocení účinku DBS. U některých typů dystonií počet nemocných léčených pomocí DBS nepřesahuje rámec kazuistik a obecně je počet hodnocených nemocných v publikované literatuře malý. Je však i přesto zřejmý až vynikající efekt DBS u primárních generalizovaných (GD) a cervikálních (CD) dystonií hodnocený škálou Burke-Fahn-Marsden dystonia rating scale (BMFDRS) pro generalizované příznaky (27) a Toronto Western Spasmodic Torticollis Rating Scale (TWSTRS) pro cervikální dystonické příznaky (28). Zkušenosti ukazují, že DBS u GD zlepšuje BMFDRS více u dětí než u dospělých. Například Vasques et al. (15) uvedli pozitivní změnu o 79 %, U CD vedla DBS ke zlepšení příznaků cca o 60 % dle TWSTRS (29, 30).
Rizika a vedlejší efekty DBS
DBS je neurochirurgická operace, při které jsou intracerebrálně zaváděny elektrody a implantován další cizorodý materiál. Operace s sebou tedy nese v první řadě rizika vzniku intrakraniálního krvácení a vyšší incidence infekčních komplikací. Intrakraniální hematomy jsou popisovány v 1–5 % (31–33), infekce v 1–15 % (34–36), přechodná intraoperační morbidita až v 21 % (36), komplikace se stimulačním materiálem (hardware) až v 15 % (37).
Vedlejší efekty
Stejně jako léčebné, tak i nežádoucí účinky DBS jsou reverzibilní, trvají jen po dobu stimulace. Navíc se dají ovlivnit změnou stimulačních parametrů. Charakter vedlejších příznaků závisí na poloze stimulační elektrody a jejímu vztahu k funkčně důležitým oblastem mozku, zejména jde o vnitřní kapsulu, optický a okulomotorický nerv. Stimulace příliš blízká k těmto strukturám evokuje typickou kapsulární odpověď, okohybné poruchy či fosfeny. Dalším problémem DBS je skutečnost, že nemocní mají implantované elektronické zařízení, které je může limitovat v dalším životě. Nemocní jsou například omezení při vyšetření MRI, při rehabilitační léčbě mikrovlnou diatermií, při léčebné aplikaci ultrazvuku.
Zkušenosti Centra pro extrapyramidové poruchy pohybu v Praze
Výsledek DBS závisí na správném výběru nemocných a správné implantaci elektrod. Výsledek intraoperační stimulace dobře ukazuje, jaká bude pooperační odezva na elektrické dráždění. Pokud intraoperační pokles rigidity, tremoru či hypokineze při intraoperační stimulaci testovacími elektrodami nejsou uspokojivé, nemůžeme implantovat trvalou léčebnou elektrodu a musíme pro ni najít jinou pozici. Výjimkou jsou nemocní s dystonií operovaní v celkové anestezii. V tomto případě jsou vyhodnocovány jen vedlejší nežádoucí příznaky a z výběru pro implantaci léčebné elektrody je vyloučena ta pozice, kde příliš nízká amplituda stimulu vyvolává závažné vedlejší příznaky.
Od roku 1998 do roku 2010 jsme provedli DBS u 127 nemocných: 86 nemocných s PN, 19 nemocných s dystonií (jedenáct primárních GD, dvě sekundární GD, pět CD a jedna segmentová dystonie šíje a trupu ) a 22 nemocných s třesem (20 s ET a dva s jinou etiologií třesu).
U nemocných s PN a ET můžeme souhlasně s literaturou (viz výše) potvrdit dobrý postoperační klinický efekt. První naše zkušenosti s nemocnými s PN jsme publikovali v našem tisku v roce 2004 (12). Intraoperačně se nám podařilo u PN zcela odstranit jeden z nejdůležitějších příznaků, tj. rigiditu v 95 % případů a u ET třes v 93 % případů. U dystonií se pozitivní efekt stimulace objevil v 95 % případů, ale s latencí několika týdnů až měsíců po operaci. Tyto zkušenosti s první stovkou nemocných jsou přijaty k tisku do Česk Slov Neurol N (38).
Komplikace se v našem souboru objevily ve srovnání s literaturou (viz výše) na dolní hranici výskytu a v závislosti na typu v tomto zastoupení: přechodná intraoperační morbidita v 8 %, intrakraniální krvácení v 1 %, infekce ve 3 %, komplikace se stimulačním materiálem (hardware) v 7 % (38).
Závěr
Hluboká mozková stimulace má své nepochybné místo v léčbě Parkinsonovy nemoci, různých forem třesu a určitých typů dystonií, a to jako speciální symptomatický postup u vybraných nemocných, u nichž je účinek medikamentózní léčby nedostatečný a u nichž vzhledem k charakteru jejich postižení a k celkovému biologickému stavu toto řešení skýtá naději na dlouhodobé zlepšení stavu. Předpokladem úspěšného efektu DBS je správný výběr pacientů dle stanovených indikačních kritérií, adekvátní předoperační vyšetření, provedení operace a pooperační sledování zkušeným multidisciplinárním týmem ve specializovaném centru.
Zkratky
AC – commisura anterior
BMFDRS – Burke-Fahn-Marsden dystonie rating scale
CD – cervikální dystonie
DBS – deep brain stimulation (hluboká mozková stimulace)
ET – esenciální třes
GD – generalizovaná dystonie
GPi – vnitřní pallidum
MRI – magnetická rezonance
PC – commisura posterior
PN – Parkinsonova nemoc
STN – nucleus subthalamicus
TWSTRS – Toronto Western Spasmodic Torticollis Rating Scale
UPDRS – Unified Parkinson’s Disease Rating score
VIM – ventrální intermediální jádro thalamu
Adresa pro korespondenci:
MUDr. Dušan Urgošík, CSc.
Stereotaktická a radiační neurochirurgie Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
fax: +420 257 272 972, e-mail: dusan.urgosik@homolka.cz
Zdroje
1. Benabid AL, Pollak P, Louveau A, Henry S, de Rougemont J. Combined (thalamotomy and stimulation: stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl Neurophysiol 1987; 50 : 344–346.
2. Blond S, Siegfried J. Thalamic stimulation for the treatment of tremor and other movement disorders. Acta Neurochir (Wien) 1991; 52 (Suppl): 109–111.
3. Benabid AL, Pollak P, Gervason C, Hoffmann D, Gao DM, Hommel M, Perret JE, de Rougemont J. Long-term suppression of tremor by chronic stimulation of the ventral intermediate thalamic nucleus. Lancet 1991; 337(8738): 403–406.
4. Siegfried J. Therapeutic stereotactic procedures on the thalamus for motor movement disorders. Acta Neurochir (Wien) 1993; 124 : 14–18.
5. Pollak P, Benabid AL, Gross C, Gao DM, Laurent A, Benazzouz A, Hoffmann D, Gentil M, Perret J. Effects of the stimulation of the subthalamic nucleus in Parkinson disease. Rev Neurol (Paris) 1993; 149 : 175–176.
6. Siegfried J, Lippitz B. Bilateral chronic electrostimulation of ventroposterolateral pallidum: a new therapeutic approach for alleviating all parkinsonian symptoms. Neurosurgery 1994; 35 : 1126–1129; discussion 1129–1130.
7. Benabid AL, Pollak P, Gross C, Hoffmann D, Benazzouz A, Gao DM, Laurent A, Gentil M, Perret J. Acute and long-term effects of subthalamic nucleus stimulation in Parkinson’s disease. Stereotact Funct Neurosurg 1994; 62 : 76–84.
8. Jech R, Urgosik D, Tintera J, Nebuzelsky A, Krasensky J, Liscak R, Roth J, Ruzicka E. Functional magnetic resonance imaging during deep brain stimulation: a pilot study in four patients with Parkinson’s disease. Mov Disord 2001; 16 : 1126–1132.
9. Walker HC, Watts RL, Schrandt CJ, Huang H, Guthrie SL, Guthrie BL, Montgomery EB Jr. Activation of Subthalamic Neurons by Contralateral Subthalamic Deep Brain Stimulation in Parkinson Disease. J Neurophysiol 2010; 105 : 1112–1121.
10. Schaltenbrand G, Wahren W. Atlas for stereotaxy of the human brain. Stuttgart: Georg Thieme Publishers 1977.
11. Benazzouz A, Breit S, Koudsie A, Pollak P, Krack P, Benabid AL. Intraoperative microrecordings of the subthalamic nucleus in Parkinson’s disease. Mov Disord 2002; 17 (Suppl 3): S145–S149.
12. Růžička E, Urgošík D, Jech R, Serranová T, Volfová M, Roth J, Vymazal J, Mečíř P, Nováková L, Nováková O, Ulmanová O, Brožová H, Dušek P, Špačková N, Liščák R, Vladyka V. Hluboká mozková stimulace v léčbě Parkinsonovy nemoci a třesu: Pražská zkušenost 1998–2003. Cesk Slov Neurol N 2004; 67/100 : 423–436.
13. Ruzicka E, Jech R, Zarubova K, Roth J, Urgosik D. VIM thalamic stimulation for tremor in a patient with IgM paraproteinaemic demyelinating neuropathy. Mov Disord 2003; 18 : 1192–1195.
14. Fahn S, Tolosa E, Maria C. Clinical rating scale for tremor. In: Jankovic J, Tolosa E. Parkinson’s disease and movement disorders. Baltimore: Williams and Wilkins 1993; 271–280.
15. Vasques XA, Cif L, Biolsi B, Coubes P. Central procedures for primary dystonia. In: Lozano AM, Gildenberg PL, Tasker RR. Textbook of stereotactic and functional neurosurgery. Berlin-Heidelberg: Springer Verlag 2009; 1801–1834.
16. Coubes P, Cif L, El Fertit H, Hemm S, Vayssiere N, Serrat S, Picot MC, Tuffery S, Claustres M, Echenne B, Frerebeau P. Electrical stimulation of the globus pallidus internus in patients with primary generalized dystonia: long-term results. J Neurosurg 2004; 101 : 189–194.
17. Volkmann J, Sturm V, Weiss P, Kappler J, Voges J, Koulousakis A, Lehrke R, Hefter H, Freund HJ. Bilateral high-frequency stimulation of the internal globus pallidus in advanced Parkinson’s disease. Ann Neurol 1998; 44 : 953–961.
18. Kumar R, Dagher A, Hutchison WD, Lang AE, Lozano AM. Globus pallidus deep brain stimulation for generalized dystonia: clinical and PET investigation. Neurology 1999; 53 : 871–874.
19. Castelnau P, Cif L, Valente EM, Vayssiere N, Hemm S, Gannau A, Digiorgio A, Coubes P. Pallidal stimulation improves pantothenate kinase-associated neurodegeneration. Ann Neurol 2005; 57 : 738–741.
20. Kumar R, et al. Deep brain stimulation of the globus pallidus pars interna in advanced Parkinson’s disease. Neurology 2000; 55(Suppl 6): S34–S39.
21. Volkmann J, et al. Long-term results of bilateral pallidal stimulation in Parkinson’s disease. Ann Neurol 2004; 55 : 871–875.
22. Rodrigues JP, et al. Globus pallidus stimulation improves both motor and nonmotor aspects of quality of life in advanced Parkinson’s disease. Mov Disord 2007; 22 : 1866–1870.
23. Ghika J, et al. Efficiency and safety of bilateral contemporaneous pallidal stimulation (deep brain stimulation. in levodopa-responsive patients with Parkinson’s disease with severe motor fluctuations: a 2-year follow-up review. J Neurosurg 1998; 89 : 713–718.
24. Krause M, et al. Deep brain stimulation for the treatment of Parkinson’s disease: subthalamic nucleus versus globus pallidus internus. J Neurol Neurosurg Psychiatry 2001; 70 : 464–470.
25. Pahwa R, Lyons KE, Wilkinson SB, Simpson RK Jr, Ondo WG, Tarsy D, et al. Long-term evaluation of deep brain stimulation of the thalamus. J Neurosurg 2006; 104 : 506 –512.
26. Benabid AL, Pollak P, Gao D, Hoffmann D, Limousin P, Gay E, et al. Chronic electrical stimulation of the ventralis intermedius nucleus of the thalamus as a treatment of movement disorders. J Neurosurg 1996; 84 : 203–214.
27. Burke RE, Fahn S, Marsden CD, Bressman SB, Moskowitz C, Friedman J. Validity and reliability of a rating scale for the primary torsion dystonias. Neurology 1985; 35 : 73–77.
28. Consky E, Basinki DJ, Ranawaya R, Lang AE. The Toronto Western Spasmodic Torticollis Ratin Scale (TWSTRS): assessment of validity and inter-rater reliability. Neurology 1990; 40(Suppl 1): 445.
29. Krauss JK, Loher TJ, Pohle T, Weber S, Taub E, Bärlocher CB, Burgunder JM. Pallidal deep brain stimulation in patients with cervical dystonia and severe cervical dyskinesias with cervical myelopathy. J Neurol Neurosurg Psychiatry 2002; 72(2): 249–256.
30. Kiss ZH, Doig-Beyaert K, Eliasziw M, Tsui J, Haffenden A, Suchowersky O. The Canadian multicentre study of deep brain stimulation for cervical dystonia. Brain 2007; 130 : 2879–2886.
31. Rezai AR, Kopell BH, Gross RE, Vitek JL, Sharan AD, Limousin P, Benabid AL. Deep brain stimulation for Parkinson’s disease: surgical issues. Mov Disord 2006; 21(Suppl 14): S197–S218.
32. Oh MY, Abosch A, Kim SH, Lang AE, Lozano AM. Long-term hardware-related complications of deep brain stimulation. Neurosurgery 2002; 50 : 1268–1274; discussion 1274–1276.
33. Beric A, Kelly PJ, Rezai A, Sterio D, Mogilner A, Zonenshayn M, Kopell B. Complications of deep brain stimulation surgery. Stereotact Funct Neurosurg 2001; 77 : 73–78.
34. Goodman RR, Kim B, McClelland S 3rd, Senatus PB, Winfield LM, Pullman SL, Yu Q, Ford B, McKhann GM. Operative techniques and morbidity with subthalamic nucleus deep brain stimulation in 100 consecutive patients with advanced Parkinson’s disease. J Neurol Neurosurg Psychiatry 2006; 77 : 12–17.
35. Seijo FJ, Alvarez-Vega MA, Gutierrez JC, Fdez-Glez F, Lozano B. Complications in subthalamic nucleus stimulation surgery for treatment of Parkinson’s disease. Review of 272 procedures. Acta Neurochir (Wien) 2007; 149 : 867–875; discussion 876. Epub 2007 Aug 14.
36. Vesper J, Haak S, Ostertag C, Nikkhah G. Subthalamic nucleus deep brain stimulation in elderly patients – analysis of outcome and complications. BMC Neurol 2007; 7 : 7.
37. Blomstedt P, Hariz MI. Hardware-related complications of deep brain stimulation: a ten year experience. Acta Neurochir (Wien) 2005; 147 : 1061–1064; discussion 1064. Epub 2005 Jul 25.
38. Urgošík D., Jech R., Růžička E. Hluboká mozková stimulace u nemocných s extrapyramidovými poruchami pohybu – stereotaktická procedura a intraoperační nálezy. Cesk Slov Neurol N 2011; 74/107.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodníkČlánek ZprávyČlánek ZprávyČlánek KnihyČlánek Diagnostika sepseČlánek ZprávyČlánek ZprávyČlánek Pokroky v lékových formáchČlánek Zprávy JCLČlánek Laureáti Nobelovy ceny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodník
- Nemocnice Na Homolce – dvacet let špičkové medicíny
- Aplikace moderní mikroneurochirurgie a současných technologií při řešení nádorových a cévních onemocnění mozku
- Zprávy
- Karcinom ledviny v éře nastupujících robotických technologií
- Zprávy
- Hluboká mozková stimulace u extrapyramidových poruch pohybu – pražská zkušenost
- Antitrombotická terapie po operacích chlopní – současná doporučení a budoucí trendy
- Syndrom časné repolarizace a idiopatická fibrilace komor
- Psychologická péče jako součást interdisciplinární přípravy pacienta k bariatrické operaci
- Minimálně invazivní výkony v cévní chirurgii
- Význam radiochirurgie v léčbě meningiomů
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Zprávy
- Nekonvulzivní status epilepticus
- Význam radiochirurgie v léčbě mozkových metastáz
- Současná farmakoterapie epilepsie
- Knihy
- Diagnostika sepse
- Pedální bypass a jeho role v záchraně kriticky ischemické končetiny
- Zprávy
- Šestileté zkušenosti s operacemi vrozených srdečních vad u dospělých
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
- 24. český a slovenský neurologický sjezd
- X. a XI. česko-slovenská konference laboratorní hematologie
- Onkologie v gynekologii a mammologii
- 19. lipovské dermatovenerologické fórum
- Mezioborový seminář Třeboň ‘11
- Pokroky v lékových formách
- Doc. MUDr. Milan Jaroš, CSc. – osmdesátiletý
- Docent Radim Kočvara šedesátníkem
- Zprávy JCL
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom časné repolarizace a idiopatická fibrilace komor
- Temporální epilepsie dospělých a možnosti neurochirurgické léčby: úloha magnetické rezonance
- Nekonvulzivní status epilepticus
- Využití vydechovaného oxidu dusnatého v diagnostice astmatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



