-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPilotní experimentální studie stenóz jícnu po ESD
A pilot experimental study of oesophageal stenosis after ESD
Endoscopic submucosal dissection (ESD) is a challenging therapeutic method used to remove early neoplasms of the digestive tract. Complete circular ESD in the oesophagus is complicated by an extensive occurrence of postoperative strictures. Such strictures could be prevented using a metallic stent using biomaterial.
Method:
The pilot project was carried out over 12 months, using seven adult miniature pigs (bred in the laboratories of the Czech Academy of Science in Libechov). We used a single-channel endoscope. After tracing the edges and performing submucosal under-puncturing, we made a distal circular incision of the mucosa and then an identical oral circular incision 4–6 cm above it. We created three submucosal tunnels in the caudal direction using punctures and dissection. After completing the circular ESD, we pulled the mucosa outwards and the resection area was covered with oesophageal stents (six uncoated and one coated). Five primarily uncoated stents were coated with biodegradable material (Xe-Derma®). Three stents were attached to the wall of the oesophagus using endoscopic hemoclips. One week after the procedure, we conducted a control endoscopy followed by autopsy and histological analysis of the resection area.Results:
All procedures were successfully completed without any major complications. Control endoscopy showed that the stents using biomaterial provide excellent protection to the resection area (i.e. no inflammation, no ulcer or tissue disintegration). Unfortunately, the biomaterial was not positioned optimally in any of the cases, even though the stent had always been deployed and anchored over the resection correctly. In two cases, the biomaterial slid from the stent and the bare-metal stent caused inflammation with fibrotic stenosis of the oesophagus. In animals where no biomaterial was used, the autopsy revealed 1× purulent mediastinitis and 1× para-oesophageal abscess. After one week the stent had migrated into the stomach in 71% (5/7) of the animals. Histological analysis of the resection area covered with biomaterial showed multi-layered re-epithelialization one week after the procedure. Deeper layers showed no signs of inflammation, without dysplasia, or granulomas from foreign cells.Conclusion:
Biomaterial (Xe-Derma®) could be a suitable biological covering of the resection area after circular ESD with a positive effect on re-epithelialization and could hypothetically prevent stenosis. Migration of the stent covered with biomaterial has not yet been resolved.Key words:
circular endoscopic submucosal dissection – complication – oesophageal strictures – submucosal tunnel
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
4. 9. 2015Accepted:
22. 9. 2015
Autoři: R. Doležel 1; O. Ryska 2; Š. Juhás 3; J. Kalvach 1; B. Walterová 4; J. Martínek 5
Působiště autorů: Chirurgická klinika 2. LF UK a ÚVN Praha 1; Chirurgické oddělení, Nemocnice Hořovice 2; Ústav živočišné fyziologie a genetiky AV ČR, v. v. i., Liběchov 3; Gymnázium Jana Palacha, Mělník 4; Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 5
Vyšlo v časopise: Gastroent Hepatol 2015; 69(5): 408-412
Kategorie: Klinická a experimentální gastroenterologie: původní práce
doi: https://doi.org/10.14735/amgh2015408Souhrn
Endoskopická submukózní disekce (ESD) je náročná terapeutická metoda používaná k odstranění časných neoplazií trávicí trubice. Kompletní cirkulární endoskopická submukózní disekce v jícnu je zatížena značným výskytem pooperačních striktur. Těmto strikturám by mohl zabránit metalický stent s biomateriálem.
Metoda:
Pilotní projekt byl proveden na sedmi dospělých miniaturních prasatech z chovu Akademie věd ČR v Liběchově. Byl použit jednokanálový endoskop. Po vytyčení okrajů a submukózním podpichu jsme provedli dolní cirkulární slizniční řez a poté 4–6 cm nad ním identicky orální cirkulární řez. Vytvořili jsme tři submukózní tunely v aborálním směru pomocí podpichů a disekce. Po dokončení ESD jsme sliznici vytáhli navenek a resekční plochu jsme přepažili jícnovými stenty (6× nepotaženým a 1× potaženým). V pěti případech jsme nepotažené stenty povlékli biologickým materiálem (Xe-Derma®). Ve třech případech jsme stent připevnili ke stěně jícnu pomocí endoklipů. Po týdnu jsme provedli kontrolní endoskopii a následně pitvu a histologický rozbor resekční plochy.Výsledky:
Všechny výkony byly dokončeny úspěšně bez závažných komplikací. Kontrolní endoskopie ukázaly, že biomateriál se stentem chrání resekční plochu (tj. bez zánětu, bez vředů či dezintegrace tkání). Ani v jednom případě však nebyl optimálně umístěn, a to i přesto, že stent byl ukotven a rozvinut vždy správně přes defekt. Ve dvou případech biomateriál sklouzl ze stentu a obnažená síť stentu vyvolala zánět s fibrotickou stenózou jícnu. U zvířat bez protekce biomateriálem jsme při pitvě našli 1× hnisavou mediastinitidu a 1× paraezofageální absces. Stent byl při kontrolní endoskopii po týdnu v 71 % (5/7) dislokován v žaludku. Histologický rozbor ukázal, že po kontaktu s biomateriálem dochází v resekční ploše k uspořádané reepitelizaci již po týdnu od aplikace. Hlubší vrstvy byly bez známek zánětu, bez dysplazií a bez granulomů z cizích buněk.Závěr:
Biomateriál (Xe-Derma®) může být vhodným biologickým krytem resekční plochy po cirkulární ESD jícnu s možným vlivem na reepitelizaci a hypoteticky může chránit před vznikem striktur. Migrace stentu krytého biomateriálem není dosud vyřešena.Klíčová slova:
cirkulární endoskopická submukózní disekce – komplikace – striktura jícnu – submukózní tunelÚvod
Endoskopická submukózní disekce (ESD), představená prvně před 17 lety [1], „dospěla“ a její význam i klinické využití roste. V současnosti je již přijímána jako doporučený postup evropské společnosti European Society of Gastrointestinal Endoscopy [2,3]. Tato miniinvazivní metoda v sobě skýtá nemalé riziko perforace trávicí trubice a je právem považována za technicky velmi náročnou. Na druhou stranu v sobě nese velký terapeutický potenciál. Nabízí en-bloc (R0) resekci plošných povrchově uložených neoplazií trávicí trubice.
V současnosti se ohledně ESD nejvíce diskutuje nad její bezpečnou implementací do klinické praxe. Jedná se např. o strukturu tréninku dle incidence neoplazií v dané zemi (Japonsko vs. Evropa) s určením pořadí operovaných úseků trávicí trubice [4]; o získání dovedností na simulátorech (EASIE – erlangen active simulator for interventional endoscopy), na ex vivo modelech [5] či na živých prasatech; o určení learning curve, min. počtu ESD pod vedením experta a počtu provedených ESD za rok na jednoho endoskopistu atd.
Náš projekt byl zaměřen na bezpečnost cirkulární ESD distálního jícnu a především na prevenci rozvoje stenóz jícnovým stentem. Za strikturu považujeme zúžení jícnu (< 1 cm) s neprůchodností endoskopu. Z dosavadních prací vyplývá, že ke vzniku pooperačních striktur dochází v jícnu po ESD v 11,6–16,7 % [6,7]. Rizikové faktory vzniku pooperační striktury jsou: větší cirkulární záběr řezu (> 1/2–3/4 obvodu jícnu – striktury přítomny u > 90 % případů) [8,9] a podélná resekce > 3 cm [9]. Rozhoduje i hloubka disekce, která by neměla narušit celistvost muskulární vrstvy [7]. Bohužel některé léze (karcinomy ze skvamózních buněk či high-grade dysplazie Barrettova jícnu), které by bylo možné odstranit metodou cirkulární ESD, přesahují svou velikostí výše zmíněná kritéria. Aby cirkulární ESD jícnu dosáhla klinického uplatnění, musí být vyřešena plně funkční a spolehlivá prevence vzniku pooperačních striktur. Recentně se k takové prevenci úspěšně používá metalický stent (typu SEMS – self-expandable metallic stent) potažený biodegradabilním materiálem [10,11] pro tlumení lokální zánětlivé reakce. V naší práci jsme vyzkoušeli proveditelnost a účinnost tohoto preventivního opatření s použitím biomateriálu Xe-Derma®. Xe-Derma® je biologický sterilní kryt z prasečí dermis tvořený acelulárním 3D matrixem kolagenních a elastických vláken, který slouží k dočasnému krytí defektu epitelu [12]. Tato unikátní síť vláken stimuluje proliferaci keratinocytů (expresí p63, involucrinu a CD29), a tím vytváří vysoce kvalitní, vícevrstevnou uspořádanou reepitelizaci [13]. Navíc má Xe-Derma® hemostatický ráz a zabraňuje nadměrné tvorbě granulačních tkání.
Metody
Pilotní projekt byl proveden během jednoho roku na sedmi dospělých miniaturních prasatech z chovu Akademie věd ČR v Liběchově. Prasata byla vybrána jako vhodný model vzhledem ke značné podobnosti s lidskou anatomií, fyziologií a patofyziologií jícnu [14]. Zvířata byla premedikována Ketaminem 10 mg/kg (Narkamon 1 %, Spofa) a Atropinem 0,2 mg (BB Pharma). K anestezii byl použit inhalačně Isofluran (1,5 %) kombinovaně s i. v. Fentanylem (3–5 ml/hod). Náš tým měl již před zahájením projektu adekvátní experimentální i klinické zkušenosti s prováděním ESD a POEM [15,16]. Pro všechny výkony jsme použili jednokanálový endoskop (GIF H180J; Olympus). Pro podpich mukózy bylo použito metylenové modře a k insuflaci atmosférický vzduch. K disekci byly použity hybridně dva typy elektrokoagulačních nožů (30-W, monopolar): duální a IT (KD-650L, KD-611L; Olympus Medical). Po výkonu byla prasata 10 dnů pouze na tekuté stravě. Kontrolní endoskopie byla naplánována týden po výkonu a doba přežití byla stanovena max. na měsíc (v závislosti na prospívání zvířete). Projekt byl schválen komisí na ochranu zvířat (oprávnění č. 7779/2004-1020) v souladu s platnými právními předpisy (č. 246/1992, 207/2004).
Cirkulární endoskopická submukózní disekce (ESD)
Začínali jsme s vytvořením dolní cirkulární incize po odměření 10 cm orálně od kardie. Cirkulární incize jsme dosáhli spojením tří submukózních punkcí s podpichem metylenové modře. Horní řez jsme provedli 4–6 cm orálně od dolního řezu. Poté, co se horní okraj sliznice začal evertovat do lumen, jsme pokračovali cíleně v submukózní vrstvě aborálním směrem až do oblasti již vytvořeného dolního kroužku. Vytvořili jsme celkem tři submukózní tunely a ty posléze mezi sebou spojili.
Stenty
K přepažení vzniklých defektů jsme použili 10 cm dlouhé jícnové stenty (6× Ultraflex NG Prox CVD a 1× Wallflex FC (oba s průměrem 18–25 mm), Boston Scientific, Natick, Mass). Ve dvou případech jsme aplikovali stent bez biologického materiálu (1× potažený a 1× nepotažený). Na povrch dalších pěti stentů jsme aplikovali biodegradabilní pláty (5 × 5 cm) Xe-Derma® (Medicem, ČR). Pláty Xe-Derma® jsme před aplikací spojili do tubusu a ponechali je v lázni fyziologického roztoku, aby dokonale přilnuly k zevnímu povrchu stentu a nevyvlékly se z něj během zavedení. Takto připravený stent jsme pod endoskopickou kontrolou aplikovali přes resekční plochu tak, aby biologický kryt přesahoval okraje léze z obou stran. Ve třech případech jsme horní okraj stentu fixovali pomocí endoskopických hemoklipů ke stěně jícnu.
Výsledky
Průměrná váha prasat (n = 7) činila 54,3 ± 8,4 kg. Při prvním pokusu o provedení cirkulární ESD jsme zjistili, že je nutné začít vždy s dolní cirkumcizí. Při opačném postupu nelze totiž dobře odhadnout longitudinální záběr disekce a provedení dolní incize ze submukózní strany je téměř neproveditelné. Výkon včetně zavedení stentu byl vždy úspěšně dokončen bez závažných komplikací a poloha stentu byla optimální s překrytím celého defektu. V průběhu výkonů nedošlo k žádné viditelné perforaci jícnu, ale při pitvě jsme našli 1× hnisavou mediastinitidu a 1× paraezofageální absces. V obou případech šlo o defekty v rigidní stenóze jícnu, která nebyla kryta biomateriálem. Peroperační krvácení se též neukázalo jako významný problém, vyskytlo se ve dvou případech (2/7) a bylo řešitelné elektrokoagulací a opichem adrenalinu. Xe-Derma® byla použita celkem 5×. I při optimální poloze stentu sklouzl biomateriál ve dvou případech ze stentu distálně při jeho postupném rozevírání zdola. Tomu odpovídal horní stenozující cirkulární pás podmíněný zánětlivou reakcí, který stent fixoval in situ (obr. 1). Asi 2 cm pod ním, kde již byl defekt kryt Xe-Dermou®, byla sliznice zcela přehojena (obr. 1). Při pitvách jsme Xe-Dermu® (černé barvy) našli po 7–10 dnech, ale po 18. dnu již detekovatelná nebyla. Navíc stent po týdnu v 71 % (5/7) migroval do žaludku.
Obr. 1. Pitevní nálezy distálního jícnu po týdnu: A. Stent přichycen patologicky ke stěně, distálně pokryt Xe - Dermou<sup>®</sup> (značeno šipkou). B, C. Stěna jícnu po postupném odstranění stentu, který pevně lne k nechráněnému pásu se zánětlivou reakcí. D. Patrné dvě kvality zhojení resekční plochy, s biomateriálem (značeno šipkou) a bez něj. Fig. 1. Autopsy findings from distal oesophagus after one week: A. The stent is pathologically attached to the wall, distally still covered with black Derma<sup>®</sup> (arrow). B, C. Oesophagus wall after removal of the stent, which adheres firmly to the unprotected belt with inflammatory reactions. D. Two qualities of healing of the resection surface, with (arrow) and without biomaterial. 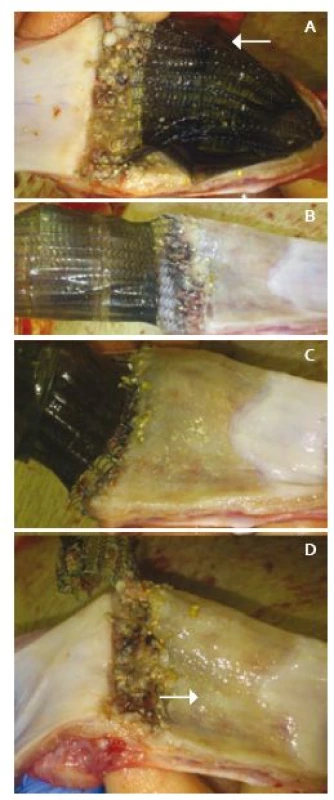
Z našich pozorování vyplynulo, že povlečený i nepovlečený stent bez biologické ochrany submukózy se fixuje do místa defektu a vyvolává značnou zánětlivou reakci s jizvením.
Naopak, když byla submukózní tkáň chráněna Xe-Dermou®, bylo makroskopické hojení hladké, celistvé, bez hypergranulací a vředů. Histologicky jsme na takto ošetřené resekční ploše prokázali uspořádanou reepitelizaci bez ulcerací, defektů či abscesů (obr. 2). Po týdnu byl jako součást hojení přítomen fibrinózně hnisavý exsudát s granulační tkání. Hlubší vrstvy defektu byly bez dysplazií, bez dezintegrace vrstev a bez přítomnosti granulomů z cizích buněk.
Obr. 2. Transverzální řez distálního jícnu v místě resekční plochy s protekcí Xe-Dermou<sup>®</sup> (Hematoxilin-Eosin): A. 1. vrstevnatý dlaždicový epitel nerohovějící – povrchová vrstva s jádry, 2. epitel vrstevnatý dlaždicový nerohovějící – vrstva bazální, 3. tunica submucosa, 4. fibrinózně hnisavý exsudát s granulační tkání (součást hojení). B. Šipky ukazují re-epitelizaci přes submukózu. Fig. 2. Transversal incision of distal oesophagus at the resection site with Xe-Derma cover<sup>®</sup> (Haematoxylin-Eosin): A. 1. non-keratinized stratifi ed squamous epithelium – the superficial layer, 2. non-keratinized stratified squamous epithelium – the basal layer, 3. tunica submucosa, 4. fi brinous-purulent exudate with granulation tissue (as a healing component). B. The arrows show the re-epithelialization over submucosa. 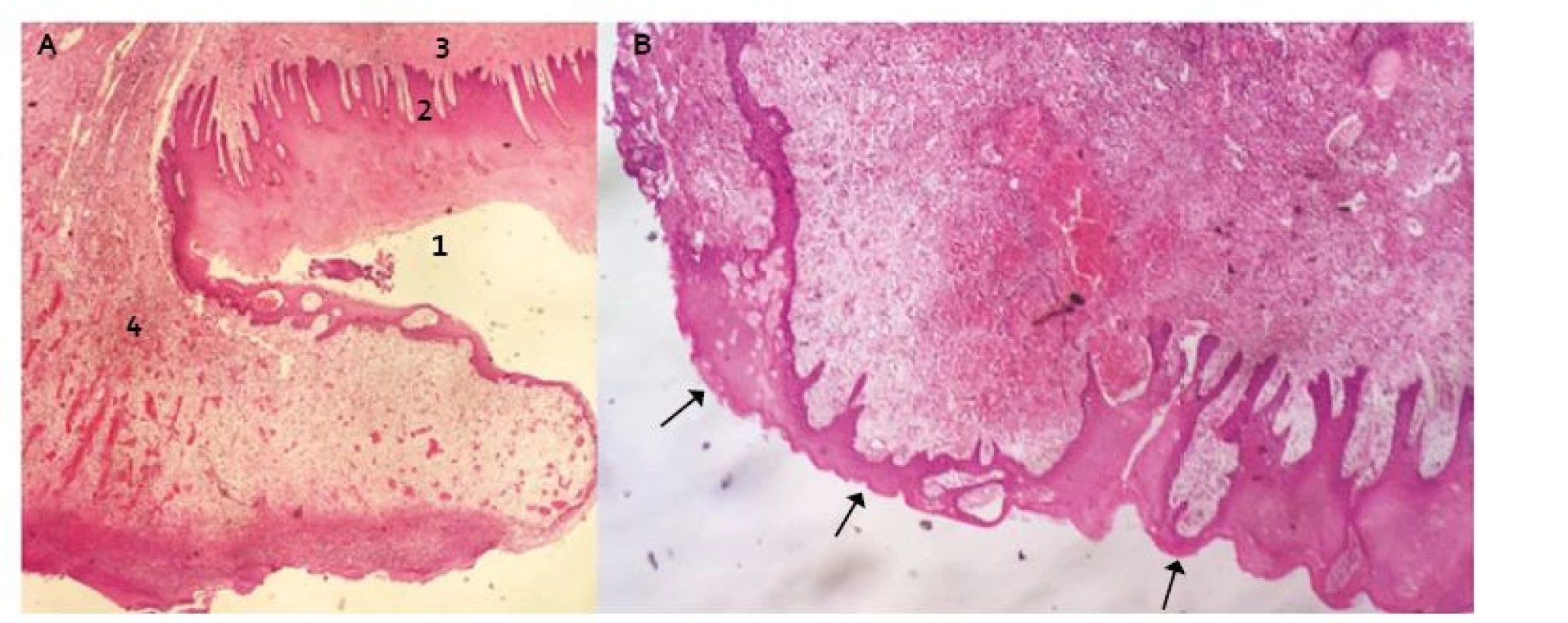
Diskuze
Naše studie ukázala, že cirkulární ESD jícnu je na experimentálním modelu proveditelná. Prevence následných striktur rozsáhlého cirkulárního defektu je důležitá, jelikož obnažená submukózní tkáň se sama nedokáže reparovat a její hojení vede ke strikturám. Na lokální reakci submukózy se podílí: 1. opožděné hojení mukózy, 2. těžký zánět a dezorganizace fibrózy s nadbytkem extracelulární hmoty a 3. atrofie muskulární vrstvy.
K prevenci striktur se používaly přípravky proti tvorbě jizev a pooperační dilatace, ale neměly dostatečný efekt [17]. Větší úspěch zaznamenaly steroidy podávané jak lokálně, tak systémově [18]. Zdaleka největší úspěch zaznamenaly implantace autologních buněk hojně propagované japonskými autory [19,20]. U těchto auto-transplantací se nejprve odebírá vlastní epitel orální sliznice. Pláty epitelu se poté několik týdnů izolovaně kultivují ex vivo s cílem nahradit jimi resekční plochu po ESD. Jelikož je tkáňové inženýrství této úspěšně metody finančně značně náročné, hledají se další alternativy. Nově se využívají xeno-biologické degradabilní kryty, které mají potenciál urychlit hojení epitelu a přitom tlumit zánětlivou reakci v resekční ploše [10,11]. Naše předběžné výsledky tato zjištění potvrzují.
Problém není s výběrem biomateriálu, ale spíše se jedná o to, aby biomateriál nemigroval mimo resekční zónu a chránil ji do vzniku časné reepitelizace. V naší studii došlo dvakrát ke zcela nechtěnému připevnění při kontaktu obnaženého stentu se submukózou. Vyvolaný zánět přegranuloval mřížku stentu a vytvořil rigidní strikturu jícnu. Díky této komplikaci jsme měli de facto možnost ověřit působení fixovaného biomateriálu na resekční plochu, protože stent v ostatních případech migroval do žaludku.
Migrace potažených stentů se obecně uvádí od 38 do 58 % [21], v naší malé skupině činila až 71 %. Stent se dá teoreticky fixovat buď lokálně ke stěně jícnu, nebo lze též zavěsit tzv. Shimovou metodou na „laso“ či na dvě silné nitě (např. dentální) vyvedené nozdrami s extrakorporální fixací [22]. Bohužel pro stenty v jícnu nelze adoptovat transkutánní fixaci biodegradabilních tracheálních stentů [23].
Endoskopicky lze stenty fixovat pomocí klipů (hemoklipy, OTSC – over-the-scope-clip) nebo různými suturami (ESSF – endoscopic suture stent fixation, Apollo). V naší studii se fixace horního okraje stentu pomocí hemoklipů ani v jednom případě (3/3) neosvědčila. Swanstromova skupina prokázala ex vivo, že k uvolnění potaženého stentu bez fixace je nutno vyvinout sílu 4,8 N (Newtonů), k překonání ukotveného stentu pomocí hemoklipů je potřeba 6,1 N a metodou ESSF až 20,4 N [21]. Netradičně se dá k fixaci jícnového stentu použít systém OTSC (OVESCO Endoscopy GmbH, Tübingen, Germany) pomocí nitinolového klipu [24]. V pilotním projektu u velmi malé skupiny [25] byl též použit s úspěchem Apollo systém (Apollo Endosurgery, Inc., Austin, TX, US). Toto zařízení umožňuje endoskopicky zakládat stehy jednotlivě i kontinuálně s uzlením. Z naší zkušenosti Apollo systém vyžaduje více operačního prostoru (směr jehly je kolmý na optiku a směřuje centripetálně do středu endoskopu).
Závěr
Naše pilotní studie má tři závěry: 1. cirkulární ESD distálního jícnu je bezpečně proveditelná na zvířecím modelu, 2. Xe-Derma® je vhodným biologickým krytem a dostatečně chrání resekční plochu submukózy jícnu, 3. migrace stentu není dosud vyřešena.
Podpořeno grantem NT 13634-4/2012 Ministerstva zdravotnictví ČR,projektem EXAM (Experimental Animal Models) – CZ.1.05/2.1.00/03.0124 a institucionální podporou RVO 67985904 (IAPG, AS CR, v.v.i.).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 4. 9. 2015
Přijato: 22. 9. 2015
MUDr. Radek Doležel
Chirurgická klinika 2. LF UK a ÚVN Praha
U Vojenské nemocnice 1 200
169 02 Praha 6
dolezrad@uvn.cz
Zdroje
1. Hosokawa K, Yoshida S. Recent advances in endoscopic mucosal resection for early gastric cancer. Gan To Kagaku Ryoho 1998; 25(4): 476–483.
2. Rahmi G, Hotayt B, Chaussade S et al. Endoscopic submucosal dissection for superficial rectal tumours: prospective evaluation in France. Endoscopy 2014; 46(8): 670–676. doi: 10.1055/s-0034-1365810.
3. Urban O, Fojtik P, Falt P et al. Krátkodobé výsledky léčby povrchových neoplastických lézí žaludku endoskopickou submukózní disekcí. Gastroent Hepatol 2015; 69(1): 65–69. doi: 10.14735/amgh201565.
4. Coman RM, Gotoda T, Draganov PV et al. Training in endoscopic submucosal dissection. World J Gastrointest Endosc 2013; 5(8): 369–378. doi: 10.4253/wjge.v5.i8.369.
5. Martinek J, Stefanova M, Suchanek S et al. Training of different endoscopic skills on ex-vivo animal model. Simul Healthc 2014; 9(2): 112–119. doi: 10.1097/SIH.0b013e31829be99e.
6. Shi Q, Ju H, Yao LQ et al. Risk factors for postoperative stricture after endoscopic submucosal dissection for superficial esophageal carcinoma. Endoscopy 2014; 46(8): 640–644. doi: 10.1055/s-0034-1365648.
7. Mizuta H, Nishimori I, Kuratani Y et al. Predictive factors for esophageal stenosis after endoscopic submucosal dissection for superficial esophageal cancer. Dis Esophagus 2009; 22(7): 626–631. doi: 10.1111/j.1442-2050.2009.00954.x.
8. Ono S, Fujishiro M, Niimi K et al. Predictors of postoperative stricture after esophageal endoscopic submucosal dissection for superficial squamous cell neoplasms. Endoscopy 2009; 41(8): 661–665. doi: 10.1055/s-0029-1214867.
9. Katada C, Muto M, Manabe T et al. Esophageal stenosis after endoscopic mucosal resection of superficial esophageal lesions. Gastrointest Endosc 2003; 57(2): 165–169.
10. Kobayashi S, Kanai N, Ohki T et al. Prevention of esophageal strictures after endoscopic submucosal dissection. World J Gastroenterol 2014; 20(41): 15098–15109. doi: 10.3748/wjg.v20.i41.15098.
11. Ye LP, Zheng HH, Mao XL et al. Complete circular endoscopic resection using submucosal tunnel technique combined with esophageal stent placement for circumferential superficial esophageal lesions. Surg Endosc 2015. In press.
12. Zajicek R, Matouskova E, Broz L et al. New biological temporary skin cover Xe-Derma® in the treatment of superficial scald burns in children. Burns 2011; 37(2): 333–337. doi: 10.1016/j.burns.2010.07.009.
13. Koster MI, Roop DR. The role of p63 in development and differentiation of the epidermis. J Dermatol Sci 2004; 34(1): 3–9.
14. Vodicka P, Smetana K Jr, Dvoránková B et al. The miniature pig as an animal model in biomedical research. Ann N Y Acad Sci 2005; 1049 : 161–171.
15. Martinek J, Suchanek S, Stefanova M et al. Training on an ex vivo animal model improves endoscopic skills: a randomized, single-blind study. Gastrointest Endosc 2011; 74(2): 367–373. doi: 10.1016/j.gie.2011.04.042.
16. Doležel R, Martínek J, Švecová H et al. Efekt učení perorální endoskopické myotomie (POEM) během prvního roku ověřování metody v České republice. Gastroenterol Hepatol 2014; 68(4): 294–298.
17. Uno K, Iijima K, Koike T et al. Useful strategies to prevent severe stricture after endoscopic submucosal dissection for superficial esophageal neoplasm. World J Gastroenterol 2015; 21(23): 7120–7133. doi: 10.3748/wjg.v21.i23.7120.
18. Kataoka M, Anzai S, Shirasaki T et al. Efficacy of short period, low dose oral prednisolone for the prevention of stricture after circumferential endoscopic submucosal dissection (ESD) for esophageal cancer. Endosc Int Open 2015; 3(2): E113–117. doi: 10.1055/s-0034-1390797.
19. Kanai N, Yamato M, Ohki T et al. Fabricated autologous epidermal cell sheets for the prevention of esophageal stricture after circumferential ESD in a porcine model. Gastrointest Endosc 2012; 76(4): 873–881. doi: 10.1016/j.gie.2012.06.017.
20. Ohki T, Yamato M, Ota M et al. Prevention of esophageal stricture after endoscopic submucosal dissection using tissue-engineered cell sheets. Gastroenterology 2012; 143(3): 582–588. doi: 10.1053/j.gastro.2012.04.050.
21. Rieder E, Dunst CM, Martinec D et al. Endoscopic suture fixation of gastrointestinal stents: proof of biomechanical principles and early clinical experience. Endoscopy 2012; 44(12): 1121–1126. doi: 10.1055/s-0032-1325730.
22. Martins B da C, Retes FA, Medrado BF et al. Endoscopic management and prevention of migrated esophageal stents. World J of Gastrointest Endosc 2014; 6(2): 49–54. doi: 10.4253/wjge.v6.i2.49.
23. Hytych V, Horazdovsky P, Stehlik L et al. Our own method of fixation of biodegradable tracheal stent. Bratisl Lek Listy 2015; 116(5): 340–342.
24. Toshniwal J, Zabielski M, Fry LC et al. Combination of the “bear claw” (over-the-scope-clip system) and fully covered stent for the treatment of post-operative anastomotic leak. Endoscopy 2012; 44 (Suppl 2): E288–E289. doi: 10.1055/s-0032-1310033.
25. Kantsevoy SV, Bitner M. Esophageal stent fixation with endoscopic suturing device (with video). Gastrointest Endosc 2012; 76(6): 1251–1255. doi: 10.1016/j.gie.2012.08.003.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2015 Číslo 5- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Odcházení
- Pneumoperitoneum
- Pilotní experimentální studie stenóz jícnu po ESD
- Variabilní endoskopický obraz časného dlaždicobuněčného karcinomu jícnu
- Prvé skúsenosti s digitálnym Spyglass™ DS na Slovensku z gastroenterologického pracoviska FN Trnava
- Endoskopická histologizace diminutivních polypů tračníku. Jsme připraveni na změnu?
- Kvalita biopsií u pacientů s Barrettovým jícnem – jumbo vs. large capacity kleště
- Screeningové kolonoskopie u seniorů starších 70 let
- Nové přístupy u pacientů trpících nespecifickými střevními záněty
- Domáca parenterálna výživa – význam a využitie v klinickej praxi
- Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C
- Ledipasvir/ sofosbuvir – rychlý vývoj poznatků vede ke zkrácení léčby u cirhotických pacientů s chronickou hepatitidou C
- Recenze knihy
- Hands-on trénink pokročilých endoskopických metod – mezinárodní workshop v Aténách
-
XXIX. Hildebrandovy Bardějovské gastroenterologické dny
Střevní záněty v kazuistických obrazech a přehledných přednáškách - Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Endoskopická histologizace diminutivních polypů tračníku. Jsme připraveni na změnu?
- Pneumoperitoneum
- Screeningové kolonoskopie u seniorů starších 70 let
- Domáca parenterálna výživa – význam a využitie v klinickej praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



