-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPneumonie spojené se zdravotní péčí u pacientů v intenzivní péči – optimální nastavení iniciální empirické antimikrobiální terapie: výsledky multicentrické observační studie
Healthcare associated pneumonia in intensive care patients – optimal choice of initial empirical antimicrobial therapy: Results of a multicenter, observational study
Objective:
This study aimed to obtain recent epidemiological data on hospital-acquired pneumonia (HAP) in intensive care patients and to determine adequate empirical antimicrobial therapy.Setting:
Department of Anaesthesiology, Resuscitation and Intensive Care Medicine.Patients and methods:
The prospective, multicenter, observational study assessed the spectrum of detected bacterial pathogens and their resistance to antimicrobial agents. It was compared with a reference approach to initial antibiotic therapy in early - and late-onset HAP.Results:
Total 317 patients were included in the study. The final patient sample comprised 201 subjects (159 males and 42 females) with a mean age of 59.9 years. Total 260 valid samples of lower respiratory tract secretions were obtained. Early - and late-onset HAP was detected in 26 (12.9%) and 175 (87.1%) patients, respectively. A total of 22 bacterial species were identified as etiological agents, with detection rates higher that 5% being noted in only 6 of them (Klebsiella pneumoniae 20.4%, Pseudomonas aeruginosa 20.0%, Escherichia coli 10.8%, Enterobacter spp. 8.1%, Staphylococcus aureus 6.2% and Burkholderia cepacia complex 5.8%). Gram-negative bacteria were most prevalent (86.1%). Patients with early-onset HAP had considerably higher prevalence of strains of Staphylococcus aureus (26.9%) and Haemophilus influenzae (15.4%). In late-onset HAP, most dominant were the strains of Pseudomonas aeruginosa (21.8%) and Klebsiella pneumoniae (21.4%). Most pathogens causing HAP (74.0%) were shown to have a unique restriction profile. Adequate initial empirical antibiotic therapy was noted in 59.7% of patients.Conclusion:
The reference approach to initial empirical antibiotic therapy of early - and late-onset HAP was consistent with the spectrum of bacterial pathogens and their susceptibility to antimicrobial agents.KEYWORDS:
nosocomial infections – hospital acquired pneumonia – initial empirical antibiotic therapy – epidemiology – pneumonia
Autoři: T. Herkeľ 1; R. Uvízl 1; M. Kolář 2
; M. Htoutou Sedláková 2; M. Adamus 1; L. Doubravská 1; T. Gabrhelík 3; V. Pudová 2; K. Langová 4
; R. Zazula 5
; T. Řezáč 5; M. Moravec 5
; P. Čermák 6; P. Ševčík 7,8; J. Stašek 9; A. Ševčíková 10; M. Hanslianová 10; Z. Turek 11; V. Černý 11,12; P. Paterová 13
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Olomouc a Lékařská fakulta Univerzity Palackého v Olomouci 1; Ústav mikrobiologie, Fakultní nemocnice Olomouc a Lékařská fakulta Univerzity Palackého v Olomouci 2; Anesteziologicko-resuscitační oddělení, Krajská nemocnice Tomáše Bati 3; Ústav lékařské biofyziky, Lékařská fakulta Univerzity Palackého v Olomouci 4; Anesteziologicko-resuscitační klinika 1. lékařské fakulty Univerzity Karlovy v Praze a Thomayerovy nemocnice Praha 5; Oddělení klinické mikrobiologie, Thomayerova nemocnice Praha 6; Katedra intenzivní medicíny, urgentní medicíny a forenzních oborů, Lékařská fakulta Ostravské univerzity v Ostravě 7; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava 8; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity Brno 9; Mikrobiologický ústav, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity Brno 10; Centrum pro výzkum a vývoj, Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové a Lékařská fakulta Univerzity Karlovy v Hradci Králové 11; Department of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Canada 12; Ústav klinické mikrobiologie, Fakultní nemocnice Hradec Králové a Lékařská fakulta Univerzity Karlovy v Hradci Králové 13
Vyšlo v časopise: Anest. intenziv. Med., 28, 2017, č. 3, s. 154-162
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl:
Studie je zaměřena na získání recentních epidemiologických údajů o „Hospital Acquired Pneumonia (HAP)“ u pacientů v intenzivní péči pro určení vhodného postupu pro empirickou antimikrobiální terapii.Typ pracoviště:
Klinika anesteziologie, resuscitace a intenzivní medicíny; Anesteziologicko resuscitační oddělení.Typ studie a metoda:
Studie byla navržena jako prospektivní, multicentrická a observační. Zachycené spektrum bakteriálních původců, včetně určení citlivosti k antimikrobiálním přípravkům, bylo porovnáno s referenčním postupem iniciální empirické antibiotické terapie u časné a pozdní HAP.Výsledky:
Bylo zařazeno 317 pacientů, po zhodnocení úplnosti dat soubor obsahoval 201 pacienta, 159 mužů a 42 žen. Průměrný věk 59,9 roku let. Získáno bylo 260 validních vzorků sekretu z dolních cest dýchacích. Časná HAP byla zachycena u 26 (12,9 %), pozdní u 175 (87,1 %) pacientů. DNA analýzou byl u většiny původců HAP (74,0 %) prokázán jedinečný restrikční profil. Adekvátní empirická iniciální antibiotická terapie byla zaznamenána u 59,7 % pacientů. Bylo identifikováno celkem 22 bakteriálních species jako etiologických agens, pouze u 6 z nich byla četnost záchytu vyšší než 5 % (Klebsiella pneumoniae – 20,4 %, Pseudomonas aeruginosa – 20,0 %, Escherichia coli – 10,8 %, Enterobacter spp. – 8,1 %, Staphylococcus aureus – 6,2 % a Burkholderia cepacia komplex – 5,8 %). Převažovaly gramnegativní bakterie (86,1 %). U pacientů s časnou HAP byl významně vyšší výskyt kmenů Staphylococcus aureus (26,9 %) a Haemophilus influenzae (15,4 %). U pozdní HAP dominovaly kmeny Pseudomonas aeruginosa (21,8%) a Klebsiella pneumoniae (21,4 %).Závěr:
Referenční postup iniciální empirické antibiotické terapie časné a pozdní HAP vyhovuje zachycenému spektru bakteriálních původců a jejich citlivosti k antimikrobiálním přípravkům u sledované skupiny pacientů.Klíčová slova:
infekce spojené se zdravotní péčí – hospital acquired pneumonia – iniciální empirická antibiotická terapie – epidemiologie – pneumonieÚVOD
Včasná a správná identifikace etiologického agens bakteriální infekce spojené se zdravotní péčí (Hospital Associated Infections – HAI) a určení jeho citlivosti či rezistence k antibiotikům je základní podmínkou racionální cílené antibioterapie. Stejně tak adekvátně zvolená empirická antibioterapie zvyšuje úspěšnost léčby, zkracuje ji, snižuje náklady [1, 2] a v konečném důsledku i mortalitu ve skupině nemocných s tímto typem infekce [3]. V nemocnicích členských zemí EU získá HAI průměrně každý dvacátý pacient. Podle evropské bodové prevalenční studie provedené v roce 2012 je situace ve výskytu HAI v České republice srovnatelná. Odhaduje se, že přibližně 20–30 % HAI by bylo možno zabránit jen tím, že budou zintenzivněna hygienická a protiepidemická opatření [4]. Jednou z nejčastějších HAI u pacientů v intenzivní péči (JIP) je pneumonie – Hospital Acquired Pneumonia (HAP), která tvoří 10–47 % HAI nákaz [5, 6] s udávanou mortalitou 20–60 % [7, 8, 9, 10]. HAP je nejčastěji spojena s invazivním zajištěním dýchacích cest a umělou plicní ventilací jako ventilátorová pneumonie [11]. Z epidemiologického hlediska rozlišujeme pneumonii komunitní, která vzniká mimo nemocniční prostředí nebo do 48 hodin od přijetí pacienta do nemocnice. Naproti tomu HAP je asociována s pobytem v nemocničním zařízení a je definována vznikem nejdříve 48 hodin od přijetí, nejdéle však do 14. dne od propuštění pacienta z nemocnice. Nástup klinických a laboratorních projevů časné HAP spadá do období 48–96 hodin od přijetí a u pozdní HAP je interval posunut do období od 5. dne po přijetí do nemocnice [12]. Patogeneze HAP je závislá na množství a virulenci mikroorganismů vstupujících do dolních dýchacích cest a na reakci pacienta – mechanické, imunitní – humorální nebo buněčné. Primárním způsobem přenosu bakteriálních patogenů do dýchacích cest je nejčastěji mikroaspirace mikrobů kolonizujících orofaryngeální oblast, eventuálně horní část gastrointestinálního traktu [10], případně přenos kapénkovou infekcí z okolního prostředí.
U skupiny pacientů s HAP jsme na základě výsledků pilotní studie z roku 2011 prokázali, že převažujícími původci jsou endogenní patogeny pocházející z bakteriální mikroflóry jedince, v menší míře exogenní patogeny se zdrojem v nemocničním prostředí a s horizontálním šířením mezi pacienty. Mezi původci měly nejvyšší záchyt gramnegativní bakterie, především Klebsiella pneumoniae a Pseudomonas aeruginosa. U těchto kmenů byl zaznamenán vyšší výskyt multirezistence k antibiotikům [6].
Cílem předkládané multicentrické studie bylo popsat v širším republikovém měřítku epidemiologii patogenů HAP u pacientů JIP. Získaná data byla použita ke kritické analýze platnosti současných klinických doporučení pro empirickou antibioterapii HAP.
Dříve užívaný termín nozokomiální nákazy byl nově nahrazen termínem infekce spojené se zdravotní péčí, tak aby terminologie byla v souladu s platnou legislativní úpravou – ustanovením zákona č. 258/2000 Sb., o ochraně veřejného zdraví, § 15.
METODY
Studie byla navržena jako prospektivní, multicentrická a observační. Se souhlasem Etické komise Fakultní nemocnice Olomouc a Lékařské fakulty Univerzity Palackého v Olomouci nebyl u této neintervenční studie vyžadován informovaný souhlas osob zařazených do sledovaného souboru. Studie byla registrována v databázi ClinicalTrials.gov pod číslem NCT02614144. Projekt byl podpořen grantem IGA MZ ČR č. NT 14263-3/2013.
Participanti. Do studie se zapojila 4 klinická centra v České republice:
- Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové, Lékařská fakulta Univerzity Karlovy v Hradci Králové
- Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Brno, Lékařská fakulta Masarykovy univerzity Brno
- Klinika anesteziologie, resuscitace a intenzivní medicíny, Thomayerova nemocnice, Praha, 1. lékařská fakulta Univerzity Karlovy
- Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Olomouc, Lékařská fakulta Univerzity Palackého v Olomouci
Do studie byli zařazeni pacienti starší 18 let hospitalizovaní na uvedených pracovištích intenzivní péče v období od 1. 5. 2013 do 31. 12. 2014, u kterých byla naplněna kritéria HAP. Těmito kritérii byly: přítomnost nově vzniklého nebo progredujícího infiltrátu na skiagramu hrudníku zachyceného u pacienta po minimálně 48 hodinách hospitalizace + nejméně dvě další známky infektu respiračního traktu: teplota >38 oC, hnisavé sputum, leukocytóza >12 × 103/mm3 nebo leukopenie < 4 × 103/mm3, zánětlivý poslechový nález na plicích, kašel nebo respirační insuficience s hodnotou oxygenačního indexu PaO2/Fio2 < 300 mmHg. Klinicky probíhající plicní zánět byl verifikován pomocí CT nebo RTG plic.
V případě invazivního zajištění dýchacích cest orotracheální nebo tracheostomickou kanylou byl vzorek endosekretu k mikrobiologické kultivaci získán necílenou aspirací z dolních dýchacích cest. U pacientů bez zajištění dýchacích cest byl vyšetřovaným materiálem vzorek sputa. Všechny vzorky byly zpracovány semikvantitativně rutinními mikrobiologickými postupy. Pro průkaz etiologického agens byl stanoven práh kultivační kvantity ≥ 105 CFU/ml. Identifikace bakteriálních izolátů byla provedena na základě hmotnostní spektrometrie (MALDI-TOF, Bruker Daltonics, Germany). V případě opakované kultivace stejného agens u jednoho pacienta byl do studie zařazen pouze první izolát. Citlivost k antimikrobním přípravkům byla určena standardní mikrodiluční metodou podle EUCAST [13]. Pro stanovení identity bakteriálních izolátů byla použita metoda PFGE, založená na separaci makrorestrikčních fragmentů celogenomové DNA. Identifikovaný bakteriální kmen byl na základě restrikčního profilu považován za jedinečný, pokud byl přítomen u jediného pacienta. Jako mikroepidemie byl označen záchyt identického kmene u dvou až pěti pacientů a jako epidemie u více než pěti pacientů.
Referenční iniciální empirická antibiotická terapie
Ze čtyř zdravotnických zařízení zúčastněných ve studii měla 2 pracoviště zpracován protokol empirické antibiotické léčby HAP, zbylá 2 pracoviště se řídila klinickou zkušeností. Vzhledem k absenci konsenzuálního doporučení na úrovni ČR pro iniciální antibioterapii HAP jsme na základě obecně platných doporučení [14] stanovili protokol empirického nasazení antibiotik pro jednotlivé typy HAP (tab. 1). Vytvořený protokol jsme použili jako referenční a podrobili jej kritické revizi s ohledem na získané údaje o původcích HAP a jejich citlivosti k antibiotikům.
Tab. 1. Referenční iniciální empirická antibiotická léčba hospital acquired pneumonia (HAP) včetně standardního dávkování 
Cíle
Primárním cílem byla identifikace etiologických agens HAP, určení jejich citlivosti k antibiotikům a zhodnocení účinnosti iniciální empirické antibiotické (ATB) terapie. Sekundárním cílem bylo porovnání zjištěného spektra původců HAP s protokolem referenční iniciální empirické antibiotické léčby HAP.
Hodnocené veličiny
Typ HAP (časná/pozdní). Etiologické agens HAP a jeho citlivost k antibiotikům. Iniciální empirická ATB terapie a její účinnost (adekvátnost) na zachycené etiologické agens v den zařazení pacienta do studie. Za adekvátní ATB terapii byla považována taková, kdy bylo pacientovi iniciálně podáno alespoň jedno antibiotikum, které bylo následně prokázáno jako účinné k léčbě etiologického agens HAP. Z deskriptivních dat jsme sledovali: pohlaví (mužské/ženské), věk, APACHE II skóre.
Statistické metody
Pacienti s neúplnými daty u klíčových proměnných byli vyloučeni z analýzy. Rozhodujícím časovým bodem byl okamžik, kdy byla splněna kritéria HAP. Abychom minimalizovali pravděpodobnost vzniku chyb změnou obsahu retrospektivních klinických záznamů, nenahrazovali jsme chybějící data nebo odlehlé hodnoty. Předpoklady pro použité statistické metody byly ověřeny vizuální grafickou inspekcí dat a testy normality. Primární data byla popsána ukazateli popisné statistiky a sumarizována v četnostních tabulkách; spojité proměnné jako průměry s 95% intervaly spolehlivosti nebo medián a variační rozpětí; kategoriální proměnné byly popsány pomocí absolutních a relativních četností. Multivariantní logistická regrese byla použita kvůli adjustaci výsledků vzhledem k věku a skóre APACHE II a pro nalezení výsledného mnohorozměrného modelu. Výběr proměnných pro multivariantní model byl založen na univariantních analýzách (p < 0,1) a analýze redundance prediktorů. Všechny testy byly provedeny na hladině významnosti 0,05. Statistická analýza byla provedena pomocí software IBM SPSS v. 22.
VÝSLEDKY
Pacienti
Vstupní kritéria HAP splnilo 317 pacientů. Následně bylo 116 vyřazeno, neboť vzorek sekretu z dolních dýchacích cest obsahoval buď negativní kultivační nález, nebo nepatogenní mikroflóru z horních cest dýchacích (viridující streptokoky, nepatogenní neisserie a koaguláza-negativní stafylokoky), případně etiologické agens nedosáhlo prahové kultivační kvantity. Hodnocený soubor obsahoval 201 pacienta, 159 mužů (79,1 %) a 42 žen (20,9 %), od kterých bylo získáno 260 izolátů etiologických agens. HAP časná byla prokázána u 26 pacientů (12,9 %) a bylo získáno 26 bakteriálních patogenů. HAP pozdní byla diagnostikována u 175 pacientů (87,1 %) s 234 etiologickými agens. Monomikrobiální etiologie HAP byla zjištěna u 149 (74,1 %) pacientů. Polymikrobiální etiologie u 52 (25,8 %) pacientů, přičemž se jednalo vždy o HAP pozdní – Flow chart obrázek 1.
Obr. 1. Zařazování pacientů v průběhu studie 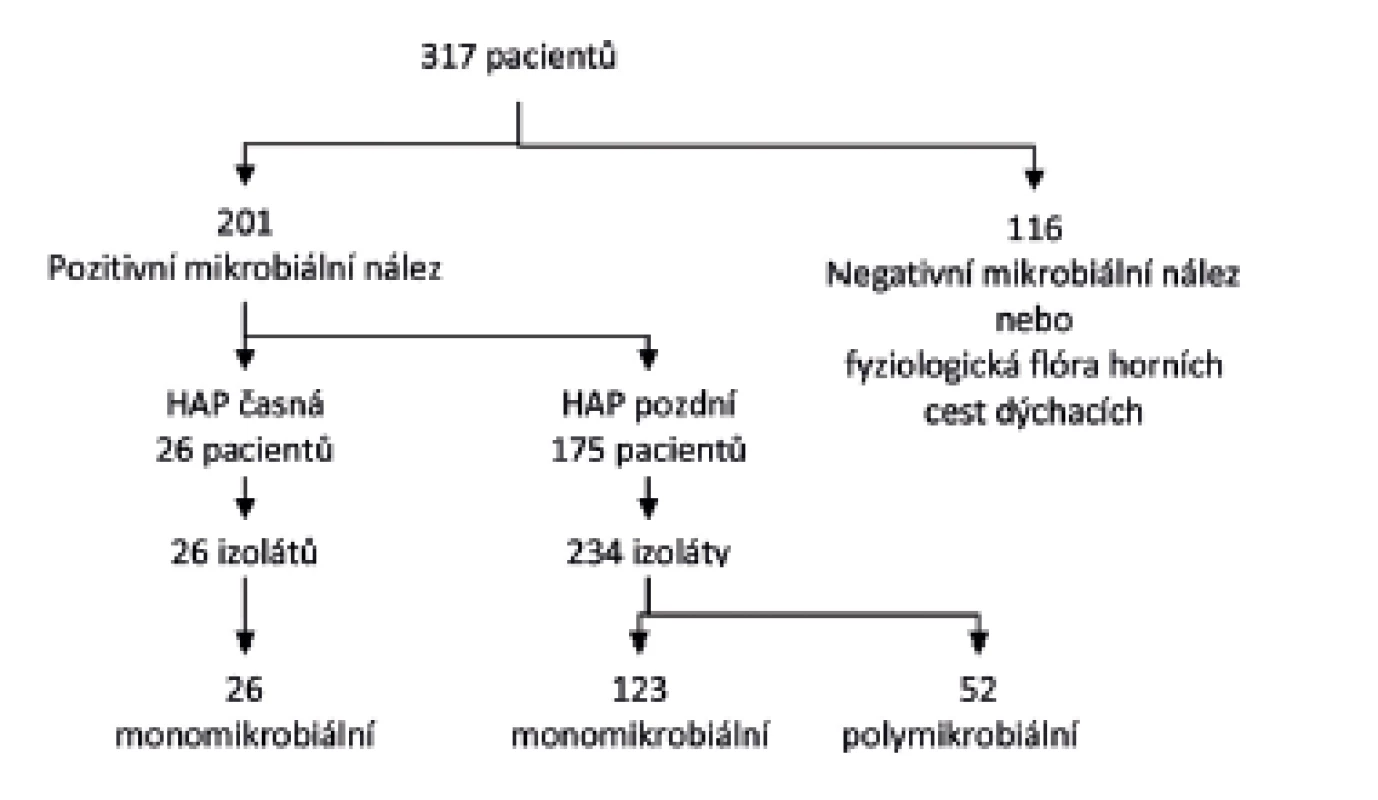
DeskriptivnÍ data
Průměrný věk pacientů byl 59,9 ± 17,6 let (medián 64 let), ženy 64,1 ± 18,1 (medián 68,5 let), muži 58,7 ± 17,4 (medián 63 let). Ženy byly statisticky významně starší, p = 0,021.
Nebyl prokázán statisticky významný vztah mezi typem HAP a pohlavím pacienta, p = 1,000. Podařilo se prokázat signifikantní vztah mezi typem HAP a věkem pacienta (u pacientů s časnou HAP byl věkový průměr 54,7 let a u pacientů s pozdní HAP 60,8 let), p = 0,049.
Průměr APACHE II skóre při přijetí byl 21 (rozmezí 8–43, medián 20,0), ženy 22,7 (rozmezí 8–43, medián 23,0), muži 20,7 (rozmezí 8–40, medián 20,0). Rozdíl mezi muži a ženami nebyl statisticky významný, p = 0,061. Závislost mezi hodnotou vstupního APACHE II skóre a typem pneumonie prokázána nebyla.
Hlavní výsledky
Bakteriální původci a jejich jedinečnost
Bylo identifikováno 22 bakteriálních species jako původců HAP (Appendix 1). Pouze u 6 z nich byla zaznamenána četnost záchytu vyšší než 5 % (Klebsiella pneumoniiae – 20,4 %, Pseudomonas aeruginosa – 20,0 %, Escherichia coli – 10,8 %, Enterobacter spp. – 8,1 %, Staphylococcus aureus – 6,2 % a Burkholderia cepacia komplex – 5,8 %). Gramnegativní bakterie tvořily 87,6 % izolátů.
Appendix 1 Četnost etiologických agens HAP (mono i polymikrobiální etiologie) 
Byl prokázán statisticky významný vztah mezi etiologickým agens a typem HAP, p = 0,046. Ve skupině pacientů s časnou HAP byl statisticky významně vyšší výskyt Haemophilus influenzae (15,4 %) a Staphylococcus aureus (26,9 %), naopak nižší výskyt Pseudomonas aeruginosa (3,8 %) a Escherichia coli (7,7 %). Ve skupině pacientů s pozdní HAP byl zaznamenán statisticky významně vyšší výskyt Pseudomonasaeruginosa (21,8 %) a Klebsiella pneumoniae (21,4 %), nižší výskyt Haemophilus influenzae (1,7 %) a Staphylococcus aureus (3,8 %), (tab. 2 a Appendix 1).
Tab. 2. Vztah mezi etiologickým agens a typem HAP (Etiologická agens u pacientů s monomikrobiální etiologií s četností výskytu ve sledovaném souboru nad 5 %) 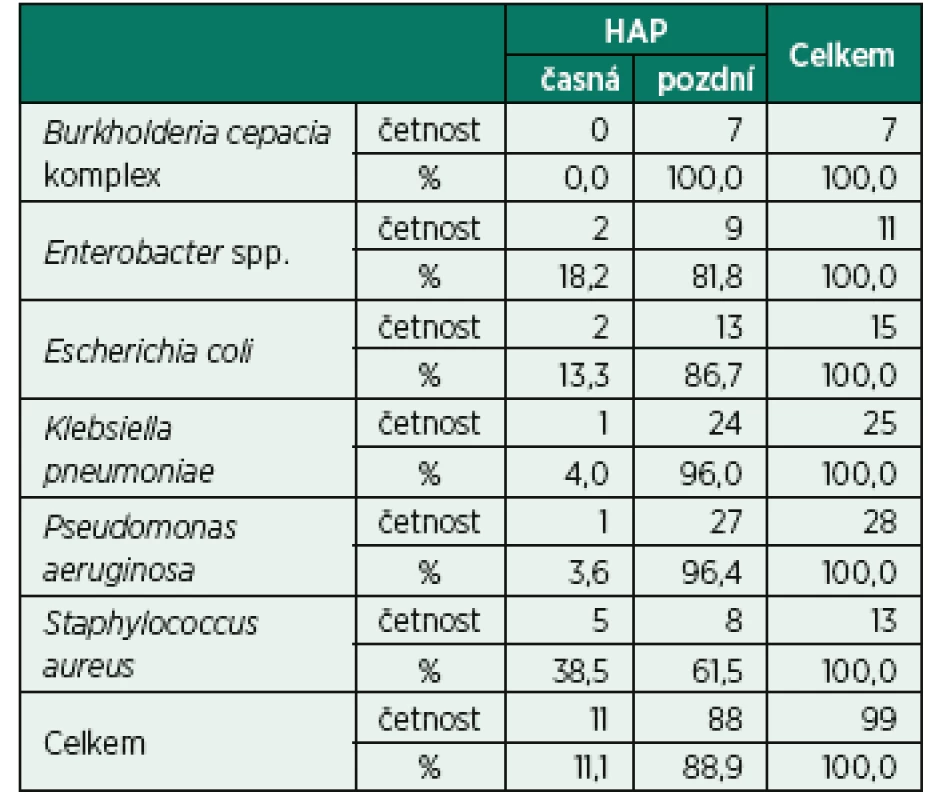
Adekvátnost iniciální antibiotické terapie
K empirické antibiotické terapii bylo použito 19 různých antibiotik v monoterapii nebo v kombinaci (Appendix 2). Adekvátní iniciální antibioterapie byla zaznamenána u 120 (59,7 %) pacientů, z toho u 15 (57,7 %) pacientů s HAP časnou a u 105 (60,0 %) pacientů s HAP pozdní. V případě monomikrobiální etiologie HAP byla adekvátní iniciální antibioterapie evidována u 93 pacientů (62,4 %), p = 0,301, zatímco v případě polymikrobiální etiologie pouze u 23 pacientů (44,2 %), p = 0,219. Bylo prokázáno, že ve skupině pacientů s adekvátní empirickou antibiotickou léčbou byl statisticky významně vyšší výskyt kmenů Escherichia coli a Serratia marcescens, naopak nižší výskyt Stenotrophomonas maltophilia ve srovnání se skupinou pacientů bez adekvátní iniciální ATB terapie. V této skupině byl zaznamenán vyšší výskyt Stenotrophomonas maltophilia, naopak nižší výskyt Escherichia coli a Serratia marcescens nebyla zastižena vůbec, p = 0,010.
Appendix 2 Četnost podání antibiotik v iniciální empirické terapii (monoterapie nebo kombinace) 
Vztah mezi etiologickým agens HAP a adekvátní iniciální antibiotickou léčbou nebyl prokázán, p = 0,084. Nebyl prokázán ani statisticky významný vztah mezi typem HAP a adekvátní iniciální empirickou antibioterapií jak u monomikrobiální (p = 0,301), tak u polymikrobiální (p = 0,219) etiologie. Dále nebyl prokázán vztah mezi typem HAP a mono - či polymikrobiální etiologií, p = 0,809.
Citlivost nejčastějších bakteriálních původců HAP k antimikrobním přípravkům
Citlivost Klebsiella pneumoniae k ampicilinu se sulbaktamem, cefalosporinům, fluorochinolonům, gentamicinu, kotrimoxazolu a piperacilin/tazobaktamu nedosahuje ani 50 % (tab. 3). Na druhou stranu dobrou účinnost si zachovávají cefalosporiny 3. a 4. generace, piperacilin s tazobaktamem a gentamicin v případě Escherichia coli. Souhrnně z výsledků vyplývá, že dobrou citlivost si enterobakterie zachovávají pouze k meropenemu, kolistinu, amikacinu a tigecyklinu. V případě Pseudomonas aeruginosa jakožto druhého nejčastějšího agens je více než polovina kmenů citlivých k testovaným antibiotikům, nicméně 90% hranice byla překročena pouze u amikacinu. Nejčastějším a jediným grampozitivním species s četností nad 5 % je Staphylococcus aureus, který vykazuje výbornou citlivost ke všem testovaným antibiotikům. Nebyl zachycen ani jeden kmen fenotypu MRSA (methicilin-rezistentní Staphylococcus aureus).
Tab. 3. Citlivost nejčastějších bakteriálních původců HAP k antimikrobním přípravkům uvedená v procentech 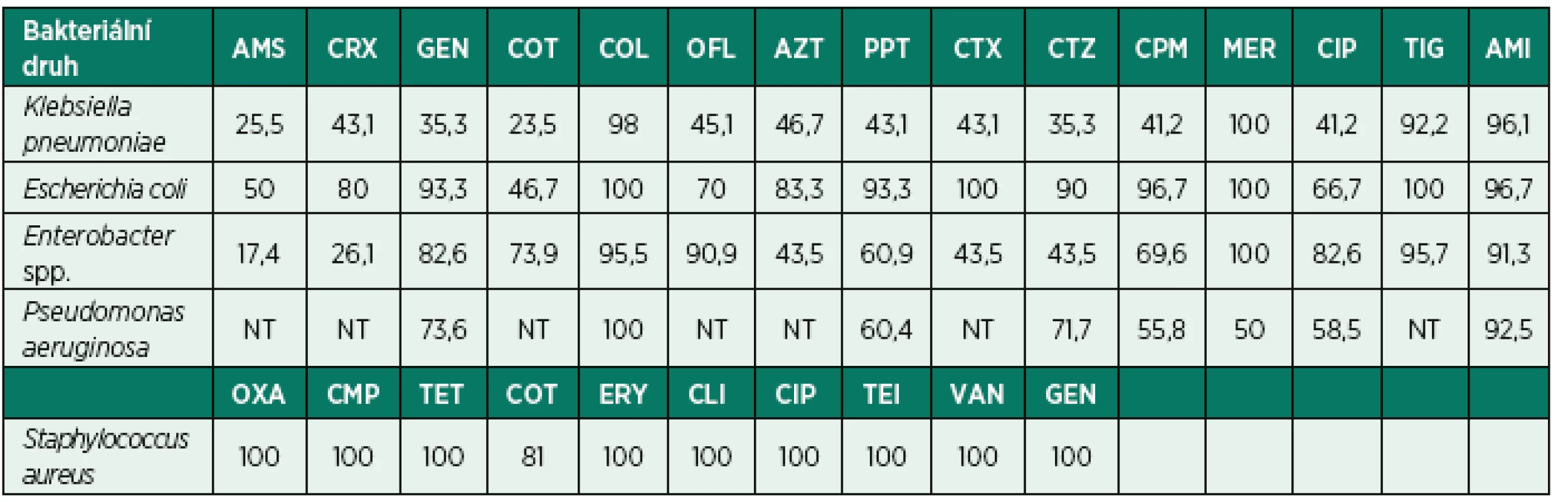
Legenda: AMS – ampicilin/sulbaktam, CRX – cefuroxim, GEN – gentamicin, COT – kotrimoxazol, COL – kolistin, OFL – ofloxacin, AZT – aztreonam, PPT – piperacilin/tazobaktam, CTX – cefotaxim, CTZ – ceftazidim, CPM – cefepim, MER – meropenem, CIP – ciprofloxacin, TIG – tigecyklin, AMI – amikacin, OXA – oxacilin, CMP – chloramfenikol, TET – tetracyklin, ERY – erytromycin, CLI – klindamycin, TEI – teikoplanin, VAN – vankomycin, NT – netestováno Klonální šíření patogenů
Celkem 74,0 % izolátů bylo identifikováno jako jedinečných, tedy s odlišným restrikčním profilem DNA. Srovnání bakteriálních izolátů na základě genetické analýzy odhalilo pouze jeden kmen, který by mohl být charakterizován v lokálním měřítku jako epidemie. Konkrétně se jednalo o 7 izolátů Pseudomonas aeruginosa získaných od různých pacientů v jednom z center. Nicméně celkem 14 mikroepidemií bylo zaznamenáno ve všech zúčastněných centrech, kde byly prokázány totožné izoláty od dvou až pěti pacientů současně. Počty HAP mikroepidemií a epidemie způsobené totožnými nebo velmi podobnými izoláty uvádí tabulka 4.
Tab. 4. Počty identických izolátů jako zdroje epidemie a mikroepidemií 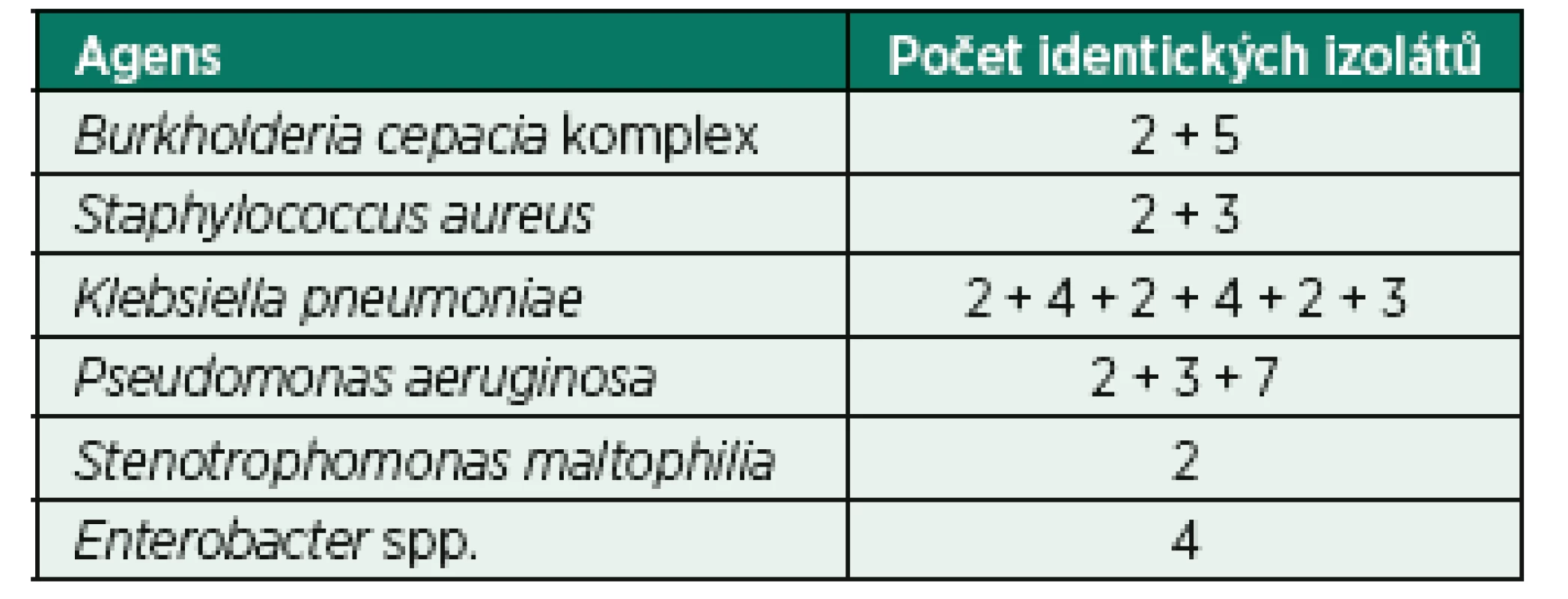
DISKUSE
Prezentovaná studie je příspěvkem k zajištění Programu prevence a kontroly infekcí ve zdravotnických zařízeních poskytovatelů akutní lůžkové péče tak, jak jej formuluje metodický pokyn MZ ČR [15]. Studie jako první přináší multicentricky získaná data o epidemiologii HAP v České republice a zabývá se klinickým impaktem třech základních oblastí ovlivňování rizika vzniku HAI:
- zajištění základních hygienických požadavků pro provoz zdravotnického zařízení,
- zajištění standardních opatření k eliminaci rizika přenosu infekčních agens při poskytování zdravotní péče a
- provádění cílené, klinicky orientované prevence a kontroly infekcí.
První hodnocenou oblastí studie bylo spektrum původců HAP. Výsledky naší studie dokazují, že většina HAP je pozdních (87 %) a je způsobena gramnegativními bakteriemi (88 %), především enterobakteriemi a kmeny Pseudomonas aeruginosa, Burkholderia cepacia komplex a Stenotrophomonas maltophilia. Obdobnou incidenci referuje více studií [16–20], asijská studie Chung et al. se zapojením 73 JIP dokumentuje 82% incidenci gramnegativních bakterií [21] a studie Forrel et al. 78% [22]. V naší studii byla Pseudomonas aeruginosa v 98 % svého záchytu identifikována jako původce pozdní HAP a ve srovnání s jinými patogeny je u tohoto patogenu dokumentováno vysoké procento selhání antibioterapie z důvodu rezistence. V předkládané studii byla terapie hodnocena jako neadekvátní v 54 % případů HAP s etiologickou rolí Pseudomonas aeruginosa. Záchyt Klebsiella pneumoniae jako etiologického agens pozdní HAP činil v naší studii 21,4 %, a je tedy vyšší v porovnání s publikovanými údaji, které uvádí 4–12 % [2, 22, 23]. Role grampozitivních bakterií, zejména Staphylococcus aureus, je v etiologii HAP v České republice na rozdíl od studií s vyšší incidencí methicilin-rezistentního Staphylococcus aureus MRSA [24] méně významná. V naší studii bylo zastoupení grampozitivních bakterií pouze 12 % a z toho Staphylococcus aureus v 7 % případů. Zajímavým zjištěním je, že tato bakterie byla ve 100 % citlivá na methicilin. Zastoupení Staphylococcus aureus v etiologii pozdní HAP je signifikantně nižší ve srovnání s gramnegativními bakteriemi. SENTRY program (1997–2008) dokumentoval prevalenci Staphylococcus aureus v etiologii HAP ve 28 % a práce Ionas et al. uvedla 16% podíl methicilin-rezistentních kmenů Staphylococcus aureus [2, 25].
Druhou hodnocenou oblastí byla adekvátnost iniciální empirické antibiotické terapie HAP. V prezentované studii bylo neadekvátně léčeno 40 % pacientů. Vyšší záchyt neadekvátní terapie jsme zaznamenali v nemocnicích, kde nebylo k dispozici lokální metodické doporučení pro iniciální empirickou antibioterapii HAP. Procento neadekvátní léčby považujeme za vysoké, i když se liší v závislosti na jednotlivých pracovištích. Nicméně např. Luna et al. ve studii z roku 2006 uvádí neadekvátní iniciální antibiotickou léčbu až v 68 % [26]. Španělská studie Alvarez-Lerma et al., která prospektivně zhodnotila 244 kriticky nemocných pacientů na 24 JIP, referovala o neadekvátní iniciální empirické antibioterapii jen u 14 % pacientů (mortalita 28%) a adekvátní iniciální antibioterapii u 39 % pacientů (mortalita 19%), avšak etiologické agens HAP se nepodařilo prokázat u 47 % pacientů [27].
Třetí hodnocenou oblastí byl popis eventuálního horizontálního šíření identických bakteriálních kmenů v rámci jednotlivých pracovišť. Většina izolátů (74 %) byla identifikována jako jedinečná a původ většiny epizod HAP lze tedy považovat za endogenní. Přesto byla v rámci 4 center zaznamenána jedna epidemie HAP s identickým etiologickým agens (7 pacientů) a čtrnáct mikroepidemií (2–5 pacientů). V těchto případech byl prokázán přenos identické bakterie mezi pacienty a tedy exogenní zdroj HAP. Zjištěná skutečnost potvrzuje nutnost důsledného dodržování protiepidemických opatření v průběhu ošetřovatelského procesu.
Čtvrtou a zásadní hodnocenou oblastí bylo určení optimálního schématu pro iniciální empirickou antibiotickou terapii HAP. Ta by měla vycházet ze znalosti aktuální epidemiologické situace pracoviště [28] a respektovat incidenci rizikových bakteriálních kmenů nejen v rámci oddělení či nemocnice, ale i v rámci regionu. V řadě Evropských zemí přesto existují národní doporučení pro iniciální empirickou terapii HAP, Healthcare-associated pneumonia (HCAP) nebo VAP [29–31]. V iniciální fázi terapie, v době, kdy není k dispozici stanovení etiologického agens, informace o jeho kvantitě a citlivosti k antibiotikům, je nutné zvolit k empirické léčbě antibiotikum s předpokládaným spektrem citlivosti vůči pravděpodobnému původci HAP. Významnou úlohou ve volbě primární empirické ATB terapie hraje délka pacientova pobytu v nemocnici (časná/pozdní HAP), a tedy eventuální riziko přítomnosti multirezistentních kmenů [27, 29–31]. Úspěšnost antibiotické léčby je dále podmíněna nejen včasností jejího zahájení – antibiotikum je nutné nasadit ihned po zjištění diagnózy, v případě ventilátorových pneumonií do 1 hodiny, ale také optimálním dávkováním. Doporučení ATS (American Thoracic Society) z roku 2004 doporučuje v případě pozdní HAP nebo při riziku přítomnosti MDR (Multi Drug Resistance) kmenů širokospektrou terapii s aplikací antipseudomonádového cefalosporinu (cefepim, ceftazidim), karbapenemu (imipenem, meropenem) nebo širokospektrého penicilinu s inhibitorem betalaktamáz (piperacilin/tazobactam) v kombinaci s fluorochinolonem (ciprofloxacin, levofloxacin) nebo aminoglykosidem (amikacin, gentamicin, tobramycin) a v kombinaci s linezolidem nebo vankomycinem. V případě časné HAP doporučuje antibioterapii s limitovaným spektrem [29]. Guideline v UK z roku 2008 považuje za dostačující u časné HAP bez předešlé antibiotické terapie monoterapii aminopenicilinem s inhibitorem betalaktamáz nebo cefalosporinem druhé generace (cefuroxim). U pozdní HAP, případně s rizikem MDR etiologie doporučuje cefalosporin třetí generace (cefotaxim, ceftriaxon), fluorochinolon nebo piperacilin/tazobactam [30].
Doporučení Německé společnosti anesteziologie a intenzivní péče z roku 2012 uvádí u časných HAP bez rizika přítomnosti multirezistentních bakterií monoterapii založenou na použití cefalosporinu 3. generace, aminopenicilinu s inhibitorem betalaktamáz, ertapenemu nebo fluorochinolonu. V případě rizika MDR etiologie je doporučován piperacilin/tazobactam, karbapenem nebo cefalosporin 3. generace v kombinaci s fluorochinolonem nebo aminoglykosidem. V případě pozdní HAP by se měla zohlednit epidemiologická situace jednotlivých pracovišť a u pacienta s vyšším rizikem MDR etiologie nebo u septického šoku zahájit kombinovanou antibioterapii. Po uplynutí 48–72 hodin je doporučeno zhodnocení a eventuální deeskalace na monoterapii podle primokultivace [29, 31].
Většina zdravotnických zařízení v ČR postupuje v empirické antibioterapii nejčastějších typů infekcí na základě metodických pokynů či doporučených postupů, eventuálně lokálních standardů zpracovaných právě s ohledem na regionální mikrobiologickou situaci. Některá zdravotnická zařízení takové standardy nemají a lékaři postupují na základě vlastních znalostí a klinických zkušeností. Přesto však je možno na základě naší studie definovat obecná doporučení u HAP, která mohou být nápomocna v prvních hodinách či dnech před určením etiologického agens a zahájením cílené antibioterapie (viz tab. 1). Navržené režimy jsou platné pro iniciální antibiotickou léčbu, kdy nejsou k dispozici výsledky stanovení etiologického agens a jeho citlivosti/rezistence k antimikrobním přípravkům. Pokud jsou tyto údaje stanoveny, je nutná cílená antibiotická léčba. V případě efektu a v souladu s mikrobiologickým vyšetřením je vhodné realizovat deeskalační terapii, tedy cílenou léčbu na základě stanovení etiologického agens a jeho citlivosti k antimikrobním přípravkům [29, 31]. Tento postup snižuje riziko vývoje bakteriální rezistence a současně snižuje ekonomické náklady. Celková délka antibiotické léčby se obvykle pohybuje v rozmezí 7–10 dní. Delší antibiotická léčba výrazně zvyšuje možnost selekce rezistentních bakteriálních kmenů, a je tedy riziková [14].
Nedostatkem předkládané studie je absence protokolu empirické ATB terapie ve všech centrech participujících na studii.
ZÁVĚR
Nejčastějšími etiologickými agens časné HAP byly Staphylococcus aureus, Escherichia coli a Haemophilus influenzae, pozdní HAP způsobily především kmeny Pseudomonas aeruginosa a Klebsiella pneumoniae. Uvedený referenční postup iniciální empirické antibiotické terapie časné a pozdní HAP vyhovuje zachycenému spektru bakteriálních původců a jejich citlivosti k antimikrobiálním přípravkům u sledované skupiny pacientů v intenzivní péči.
Práce byla podpořena grantem IGA MZČR NT 14263-3/2013)
Do redakce došlo dne 20. 7. 2016.
Do tisku přijato dne 28. 12. 2016.
Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Adresa pro korespondenci:
MUDr. Radovan Uvízl, Ph.D.
e-mail: radovan.uvizl@seznam.cz
Zdroje
1. Joseph NM, Sistla S, Dutta TK, et al. Ventilator-associated pneumonia: a review. Eur J Intern Med 2010;21 : 360–369.
2. Jones RN Microbial etiologies of hospital-acquired pneumonia and ventilator-associated bacterial pneumonia. Clin Index Dis 2010;51 : 81–87.
3. Rello J, Torres A, Ricart M, et al. Ventilator-associated pneumonia by Staphylococcus aureus. Comparison of methicillin-resistant and methicillin-sensitive episodes. Am J Respir Crit Care Med 1994;150 : 1645–1549.
4. http://ecdc.europa.eu/en/healthtopics/Healthcare-associated_infections/Pages/index.aspx
5. Vincent JL, Bihari DJ, Suter PM, et al. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of Infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA 1995;23–30,274 : 639–644.
6. Uvizl R, Hanulik V, Husickova V, et al. Hospital-acquired pneumonia in ICU patients. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2011;155 : 373–378.
7. Guideline for prevention of nosocomial pneumonia. Centers for Disease Control and Prevention. Respir Care 1994;39 : 1191.
8. American Thoracic Society, Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005;171 : 388.
9. Craven DE, Palladino R, McQuillen DP. Healthcare-associated pneumonia in adults: management principles to improve outcomes. Infect Dis Clin North Am 2004;18 : 939.
10. Scheld WM. Developments in the pathogenesis, diagnosis and treatment of nosocomial pneumonia. Surg Gynecol Obstet 1991;172 Suppl:42.
11. Ibrahim EH, Ward S, Sherman G, et al. A comparative analysis of patients with early-onset vs late-onset nosocomial pneumonia in the ICU setting. Chest 2000;117 : 1434–1442.
12. Langer M, Cigada M, Mandelli M et al. Early onset pneumonia: a multicenter study in intensive care units. Intensive Care Med 1987;13 : 342–346.
13. The European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 4.0, 2014. http://www.eucast.org.
14. Standard iniciální antibiotické terapie HAP ve FN Olomouc. https://altus.fnol.loc/Default.aspx?page=p831750607 Směrnice č. Sm-L034.
15. http://www.mzcr.cz/Verejne/obsah/program-prevence-a-kontroly-infekci-v-zdravotnickych-zarizenich_2917_5.html.
16. Esperatti M, Ferrer M, Theessen A, et al. Nosocomial pneumonia in the intensive care unit acquired by mechanically ventilated versus nonventilated patients. Am J Respir Crit Care Med 2010;182 : 1533-1539.
17. Burgmann H, Hiesmayr JM, Savey A, et al. Impact of nosocomial infections on clinical outcome and resource consumption in critically ill patients. Intensive Care Med 2010;36 : 1597–1601
18. Hortal J, Muñoz P, Cuerpo G, et al. Ventilator-associated pneumonia in patients undergoing major heart surgery: an incidence study in Europe. The European Study Group of Nosocomial Infections, the European Work Group of Cardiothoracic Intensivists. Crit Care 2009;13 : 80.
19. Lambiase A, Rossano F, Piazza O, et al. Typing of Pseudomonas aeruginosa isolated from patients with VAP in an intensive care unit. New Microbiol 2009;32 : 277–283.
20. Pravin ChMV, Easow JM, Joseph NM, et al. Role of Appropriate Therapy in Combating Mortality among the Ventilated Patients. J Clin Diagn Res 2014;8:DC01–DC03.
21. Chung RD, Song JH, Kim SH, et al. High prevalence of multidrug-resistant nonfermenters in hospital-acquired pneumonia in Asia. American Journal of Respiratory and Critical Care Medicine 2011;184 : 1409–1417.
22. Forel JM, Voillet F, Pulina D, et al. Ventilator-associated pneumonia and ICU mortality in severe ARDS patients ventilated according to a lung-protective strategy. Crit Care 2012;16 : 65.
23. Crouch Brewer S, Jones CB, Leeper KV, et al. Ventilator-associated pneumonia due to Pseudomonas aeruginosa. Chest 1996;109 : 1029.
24. Valle’s J, Martin-Loeches I, Torres A. Epidemiology, antibiotic therapy and clinical outcomes of healthcare-associated pneumonia in critically ill patients: a Spanish cohort study. Intensive Care Med 2014;40 : 572–581.
25. Ioanas M, Cavalcanti M, Ferrer M. Hospital-acquired pneumonia: coverage and treatment adequacy of current guidelines. Eur Respir J 2003;22 : 876–882.
26. Luna CM, Aruj P, Niederman MS, et al. Grupo Argentino de Estudio de la Pneumonia Asociada el Respirador group. Appropriateness and delay to initiate therapy in ventilator-associated pneumonia. Eur Respir J 2006;27 : 158–164.
27. Alvarez-Lerma F, Alvarez B, Luque P, et al. ADANN Study Group. Empiric broad-spectrum antibiotic therapy of nosocomial pneumonia in the intensive care unit: a prospective observational study. Crit Care 2006;10 : 78.
28. Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated Ppeumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis 2016, in press.
29. American Thoracic Society. Guidelines for the management of adults with hospital-acquired, ventilator-associated pneumonia. Am J Respir Crit Care Med 2005;171 : 388–416
30. Masterton RG, Galloway A, French G, et al. Guidelines for the management of hospital-acquired pneumonia in the UK: Report of the Working Party on Hospital-Acquired Pneumonia of the British Society for Antimicrobial chemotherapy J Antimicrob Chemother 2008.
31. Dalhoff K, Abele-Horn M, Andreas S, et al. Epidemiology, diagnosis and treatment of adult patients with nosocomial pneumonia. Guideline of the German Society for Anaesthesiology and Intensive Care Medicine, the German Society for Infectious Diseases, the German Society for Hygiene and Microbiology, the German Respiratory Society and the Paul-Ehrlich-Society for Chemotherapy. Pneumologie 2012;66 : 707–765.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Zajímavosti, tipy a triky
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2017 Číslo 3- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Prohlášení výboru ČSIM na období 2017–2020
- Vybrané aspekty mezioborové spolupráce na porodním sále
- Pneumonie spojené se zdravotní péčí u pacientů v intenzivní péči – optimální nastavení iniciální empirické antimikrobiální terapie: výsledky multicentrické observační studie
- Energotrauma a ventilátorem indukované plicní poškození
- Jak do praxe aplikovat výsledky klinických studií?
- Epidemiologie mimonemocniční náhlé zástavy oběhu v České republice – národní výsledky studie EuReCa ONE
- Statistika v biomedicínském výzkumu II
- Alergie, anafylaxe, anafylaktický šok
- Klinická fyziologie vazopresinu
- Doporučený postup pro pooperační delirium
- Sepsis, it's been a hard year now…
- Mezinárodní doporučení pro postup u pacientů se sepsí a septickým šokem
- Stanovisko výboru České společnosti intenzivní medicíny ČLS JEP k používání nové definice sepse („Sepsis-3“)
-
Anestezie v Rakousko -Uhersku během I. světové války a po vzniku samostatného československého státu
Část I - Úvod - Zajímavosti, tipy a triky
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mezinárodní doporučení pro postup u pacientů se sepsí a septickým šokem
- Doporučený postup pro pooperační delirium
- Epidemiologie mimonemocniční náhlé zástavy oběhu v České republice – národní výsledky studie EuReCa ONE
- Alergie, anafylaxe, anafylaktický šok
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



