-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Transanální minimálně invazivní resekce rekta s totální mezorektální excizí po endoskopické mukózní resekci
Transanal minimally invasive rectal resection with total mesorectal excision after endoscopic mucosal resection
Rectal cancer constitutes a serious oncological problem, and treatment of this disease involves a multidisciplinary team. Nowadays, rectal cancer constitutes more than a quarter of newly diagnosed colorectal cancers in the Czech Republic. Almost 70% of colorectal cancers develop from adenomatous polyps. Benign lesions such as adenoma or hyperplastic polyps can be treated endoscopically. In addition, in non-invasive malignant lesions (which are limited to the mucosa), endoscopic resection is considered curative. If certain criteria are met, endoscopic local excision can be considered a fully curative procedure, even in invasive cancer (cut-off limit: submucosa layer SM2). In patients with an unfavourable tumour grade, with carcinoma invading the submucosal layer (SM3), the cancer cannot be treated endoscopically by endoscopic mucosal resection (EMR) or endoscopic submucosal dissection and surgery is indicated. In some cases, endoscopic treatment can be inadequate and a surgical procedure has to be performed. During 2014–2015, four patients in our department underwent EMR to treat flat mucosal lesions 4–8 cm from the anal verge; however, local excision was not oncologically radical enough, and the patients were indicated for surgical resection. In these patients, a rectal resection with coloanal anastomosis was performed by transanal minimally invasive surgery (TAMIS), a new method that combines mini-invasive surgery with radical surgery resection without a permanent stoma, while meeting oncological radicality criteria. TAMIS can be beneficially used in patients after EMR if histology is promptly evaluated. Total mesorectal excision (TME), i.e., the removal of the fat coating surrounding the rectum along with its lymphatic nodes, has already become a standard surgical treatment for rectal cancer. TAMIS can be used for rectal resection with TME without the need for a stoma, even in low rectal cancer. Adverse histological results after EMR do not necessarily need to lead to an indication for rectal resection with a permanent stoma, but there is a possibility of intersphincteric resection with total lymphadenectomy.
Key words:
rectal cancer – endoscopic mucosal resection – rectal surgery – transanal minimally invasive surgery – total mesorectal excision
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
7. 9. 2016Accepted:
4. 1. 2017
Autoři: L. Kunovsky 1,2; Z. Kala 1
; R. Svatoň 1; M. Dastych 2; R. Kroupa 2
; Jiří Dolina 2
; T. Grolich 1
; V. Čan 1; V. Procházka 1
Působiště autorů: Chirurgická klinika LF MU a FN Brno 1; Interní gastroenterologická klinika LF MU a FN Brno 2
Vyšlo v časopise: Gastroent Hepatol 2017; 71(3): 208-214
Kategorie: Digestivní endoskopie: přehledová práce
doi: https://doi.org/10.14735/amgh2017208Souhrn
Karcinom rekta představuje závažný onkologický problém, jehož řešení vyžaduje multidisciplinární tým. V současné době tvoří karcinom rekta v ČR více než 1/4 ze všech nově diagnostikovaných nádorů kolorektálního karcinomu. Téměř 70 % kolorektálních karcinomů vzniká na podkladě adenomových polypů. Benigní léze typu adenomu či hyperplastického polypu lze řešit endoskopicky. Také u neinvazivních maligních lézí (omezené na sliznici) se endoskopická resekce považuje za dostatečnou. Za určitých kritérií může však být endoskopická lokální excize považována za plně kurativní výkon i u invazivního karcinomu (cut-off limit vrstva sm2). Při nepříznivém gradingu tumoru u invazivního karcinomu pronikajícího do submukózní vrstvy sm3 nelze nález řešit endoskopicky metodou endoskopické mukózní resekce (EMR) či endoskopické submukózní disekce a pacient je indikován k radikální chirurgické léčbě. V některých případech může nastat situace, kdy je endoskopické ošetření léze nedostatečné a musí být proveden operační zákrok. V období let 2014–2015 na našem pracovišti podstoupili čtyři pacienti EMR pro ploché slizniční léze ve vzdálenosti 4–8 cm od anokutánního přechodu, kdy lokální excize nebyla dostatečně onkologicky radikální metodou a pacienti byli následně indikováni k chirurgické léčbě. U pacientů byla provedena resekce rekta s koloanální anastomózou metodou transanální minimálně invazivní chirurgie (TAMIS). Jde o novou metodu kombinující miniinvazivní chirurgii, kdy je možné provést resekční zákrok bez trvalého střevního vývodu a zároveň jsou splněny zásady onkologické radikality. S výhodou ji lze uplatnit i u pacientů po EMR za předpokladu včasného vyhodnocení histologického preparátu. Totální mezorektální excize (TME), tedy odstranění tukového obalu rekta s příslušnými lymfatickými uzlinami, se již stala standardem při chirurgické léčbě karcinomu rekta. Metodou TAMIS je možné provést kontinuitu záchovnou resekci rekta s TME i u nízko uložených tumorů. Nepříznivý histologický výsledek po EMR nemusí nutně být indikací k amputaci rekta s trvalou stomií, ale je zde i možnost sfinkter záchovné resekce s totální lymfadenektomií.
Klíčová slova:
karcinom rekta – endoskopická mukózní resekce – chirurgie rekta – transanální minimálně invazivní chirurgie – totální mezorektální excizeÚvod
Kolorektální karcinom (CRC – colorectal cancer) patří mezi nejčastější onkologická onemocnění na světě s vysokou incidencí zvláště ve vyspělých státech [1]. Dle nejnovějších dat z roku 2012 stojí česká mužská populace v evropském přehledu na 3. místě za Slovenskem a Maďarskem, u žen obsazujeme 10. místo v Evropě [1,2]. Karcinom rekta tvoří v ČR více než 1/4 ze všech nově diagnostikovaných nádorů CRC [3]. Zhoubné nádory konečníku jsou považovány za závažný onkologický problém, jehož řešení vyžaduje komplexní a multidisciplinární přístup. Strategie léčby je volena na základě kompletního stagingu (onkomarkery, rentgen či CT hrudníku, CT břicha, koloskopie, transrektální ultrasonografie (TRUS) a magnetická rezonance (MR)).
Časné karcinomy (T1–2 N0, T3 N0) jsou indikovány k primární chirurgické léčbě, naproti tomu u lokálně pokročilých tumorů (T3–4 N+) a s dalšími rizikovými faktory (nízký grading, extramurální lymfovaskulární invaze, perineurální šíření) se preferuje neoadjuvantní (předoperační) onkologická léčba [4–6]. O typu a délce neoadjuvantní terapie rozhoduje staging a dále celkový stav nemocného a jeho komorbidity [6,7]. Důvodem neoadjuvantní terapie je zvýšení pravděpodobnosti provedení radikálního chirurgického výkonu a zároveň sfinkter záchovného výkonu a také snížení rizika vzniku lokální recidivy [6].
Endoskopická léčba
Endoskopická mukózní resekce (EMR) se stala standardem k lokální excizi premaligních neoplazií kolorekta (nepolypoidních či velkých přisedlých), neinvazivního karcinomu a v určitých případech, pokud splňují daná kritéria, i invazivního karcinomu.
Před endoskopickým ošetřením slizniční léze by měla být vyhodnocena povrchová struktura a průběh slizničních kapilár k určení konkrétního typu NICE klasifikace [8]. Dle typu NICE klasifikace můžeme předurčit histologii dané léze (hyperplastický polyp, adenom, karcinom) a hloubku invaze [9]. V případě typu 3 je velké riziko invaze karcinomu do hlubších vrstev submukózy, a léze by proto měla být řešena chirurgicky [10]. Zhodnocení elevace léze („lifting sign“) je zásadní k určení hloubky invaze do submukózy. V případě non-liftingu je infiltrována vrstva sm3, léze by neměla být snášena endoskopicky a je indikováno chirurgické řešení [11].
Dle pařížsko-japonské klasifikace z roku 2005 rozlišujeme povrchové neoplastické léze: polypoidní typ I (jehož výška je > 2,5 mm nad úroveň okolní sliznice), ploché léze typ II (jejichž výška je < 2,5 mm) a léze vyhloubené typ III. Polypoidní léze dále dělíme na stopkaté, polopřisedlé a přisedlé (sesilní) [12]. Ploché slizniční léze (typ 0–IIa + event. možné kombinace) o velikosti v průměru > 10 mm se označují jako LSTs (laterally spreading tumours) [13,14]. Příklad LST léze na obr. 1A (smíšeného granulárně-nodulárního typu, IIa + Is, velikosti 3,5 cm), obr. 1B znázorňuje spodinu po následném snesení léze piecemeal EMR (EPMR), kdy spodina je neostrá a lze předpokládat pozitivní resekční linii či nedostatečnou vzdálenost od tumoru.
Obr. 1. A. LST léze smíšeného granulárně-nodulárního typu, IIa + Is, v průměru 3,5 cm, uložená 6 cm od anokutáního přechodu, B. neostrá spodina po piecemeal EMR. Fig. 1. A. LST mixed granular-nodular type, IIa + Is, 3.5 cm in size, located 6 cm from the anal verge, B. unclear bottom layer after piecemeal EMR. 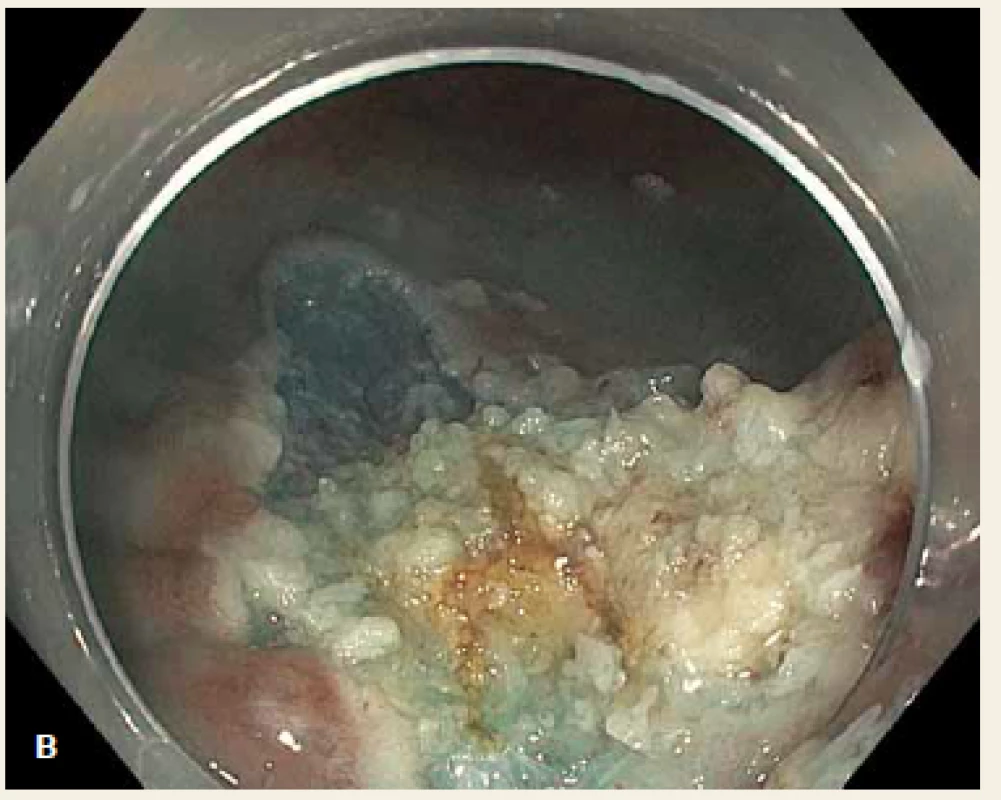
V případě polypoidních stopkatých lézí s invazivním karcinomem, omezených jen na submukózu, splňujících Morsonova kritéria (grading, angio-a lymfoinvaze, vzdálenost resekční linie od tumoru) [15–17] a Haggittova kritéria (hloubka invaze do stopky polypu) [18] se považuje jejich endoskopické odstranění za plně kurabilní.
U plochých slizničních lézí v případě histologicky zjištěného karcinomu je další terapeutický postup určen hloubkou invaze do submukózy. Pokud invaze nepřesahuje vrstvu sm1 a karcinom je dobře diferencovaný, je endoskopické řešení přijatelné. V případě invaze do vrstvy sm2 či sm3 a nepříznivého gradingu je indikováno chirurgické řešení [19].
Léze větší než 20 mm lze většinou kompletně odstranit pouze EPMR či metodou endoskopické submukózní disekce (ESD) [20]. Výhoda ESD oproti EPMR je především ve snesení velké plošné léze en bloc a byla také potvrzena větší efektivita v dosažení R0 resekce. Léze nad 20 mm, pokud jsou snášeny metodou EMR, jsou snášeny EPMR, tedy po částech. Vzniká tak určité riziko zanechání rezidua tkáně a vyšší riziko vzniku lokální recidivy [21,22].
Chirurgická léčba
Chirurgickou léčbu tumorů rekta lze rozdělit na lokální excize a radikální resekce.
- Lokální excize per anum a excize pomocí operačního rektoskopu – transanální endoskopická mikrochirurgie (TEM).
- V rámci radikálních resekcí můžeme provádět zákroky zachovávající kontinuitu – nízká přední resekce rekta, intersfinkterická resekce a výkony natrvalo odstraňující kontinentní aparát – abdominoperineální amputace rekta, extralevátorová amputace rekta či až multiorgánová resekce.
V současnosti je na rozdíl od lokální excize standardní součástí radikálního chirurgického zákroku totální mezorektální excize (TME). Relativně novou metodou umožňující radikální resekci rekta je transanální minimálně invazivní chirurgie (TAMIS) využívající transanální speciálně upravený port s konvenční laparoskopickou optikou a nástroji [23]. Tato metoda kombinuje miniinvazivitu s možností sfinkter záchovného výkonu bez nutnosti trvalé stomie a zároveň splňující onkologickou radikalitu vč. TME.
Význam TME
TME se již stala standardem v chirurgické léčbě karcinomu rekta. Hodnocení vztahu nádoru k jednotlivým resekčním okrajům a kompletnost excize mezorekta jsou brány za důležitá kritéria kvality chirurgického výkonu [24] a patří zároveň k jednomu z nejdůležitějších prognostických faktorů.
V současnosti je u karcinomu distálního rekta doporučen distální resekční okraj (DRM – distal resection margin) jako vzdálenost min. 1 cm od tumoru (0,5 cm u pacientů po neoadjuvanci). Za negativitu cirkumferenčního resekčního okraje (CRM – circumferential resection margin), a tedy R0 resekci, je definována vzdálenost > 1 mm [23].
Celkovou kvalitu TME hodnotí patolog nezávisle na chirurgovi dle Quirkeho protokolu [25]. Kvalita kompletní TME, spolu s negativním CRM, má významný vliv na riziko vzniku lokální recidivy a celkovou prognózu onemocnění [26,27].
TAMIS-TME
Operace se skládá z fáze transanální a abdominální. Distální resekční linie je vytyčena transanálním protětím rekta v dostatečné vzdálenosti od distálního okraje tumoru. Rektum se cirkulárně uzavře a následně probíhá preparace radiálně do hloubky 2–3 cm po dosažení mezorektální fascie. Poté je vložen port pro TAMIS (obr. 2) a za pomoci laparoskopických nástrojů a pneumodisekce je provedena perineální TME (obr. 3). Princip down to up stategie je znázorněn na obr. 4. Navazuje laparoskopicky prováděná abdominální fáze, kdy je přerušena dolní mezenterická tepna a žíla a uvolněna lienální flexura k zajištění beztahové anastomózy. Dokončí se uvolnění abdominální části rekta s mezorektem. Nakonec je ručně našita koloanální anastomóza (obr. 5) a vyvedena dočasná (protektivní) ileostomie. Zrušení ileostomie a obnovení kontinuity gastrointestinálního traktu (GIT) je na našem pracovišti prováděno s odstupem 6–8 týdnů.
Obr. 2. A. Detail na transanálně zavedený port, B. pozice operatéra během transanální fáze TAMIS. Fig. 2. A. Detail of a transanally inserted port, B. surgeon position during the transanal phase of TAMIS procedure 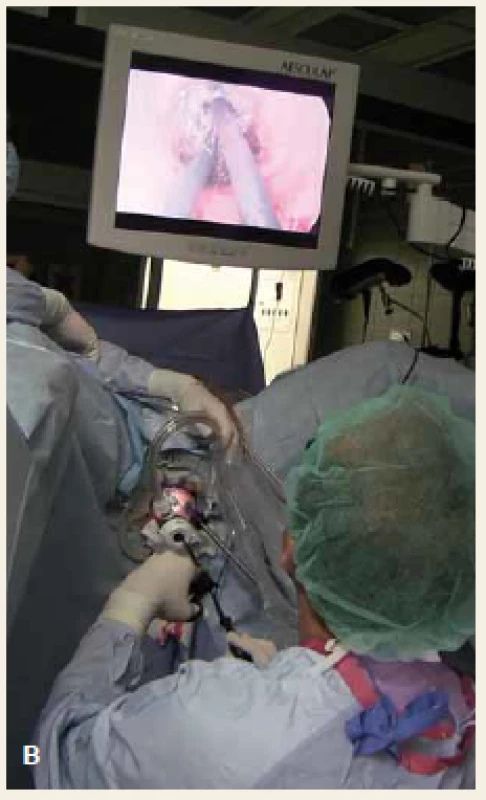
Obr. 3. Transanální fáze – preparace rekta od Denonvillierovy fascie: cirkulárně uzavřené rektum (červená šipka), mezorektum – okolní tukový obal rekta (modrý kruh), Denonvillierova fascie (černá hvězda). Fig. 3. Transanal phase – preparation of the rectum from Denonvilliers’ fascia: circular closure of the rectum (red arrow), mesorectum – fat coating surrounding the rectum (blue circle), Denonvilliers’ fascia (black star). 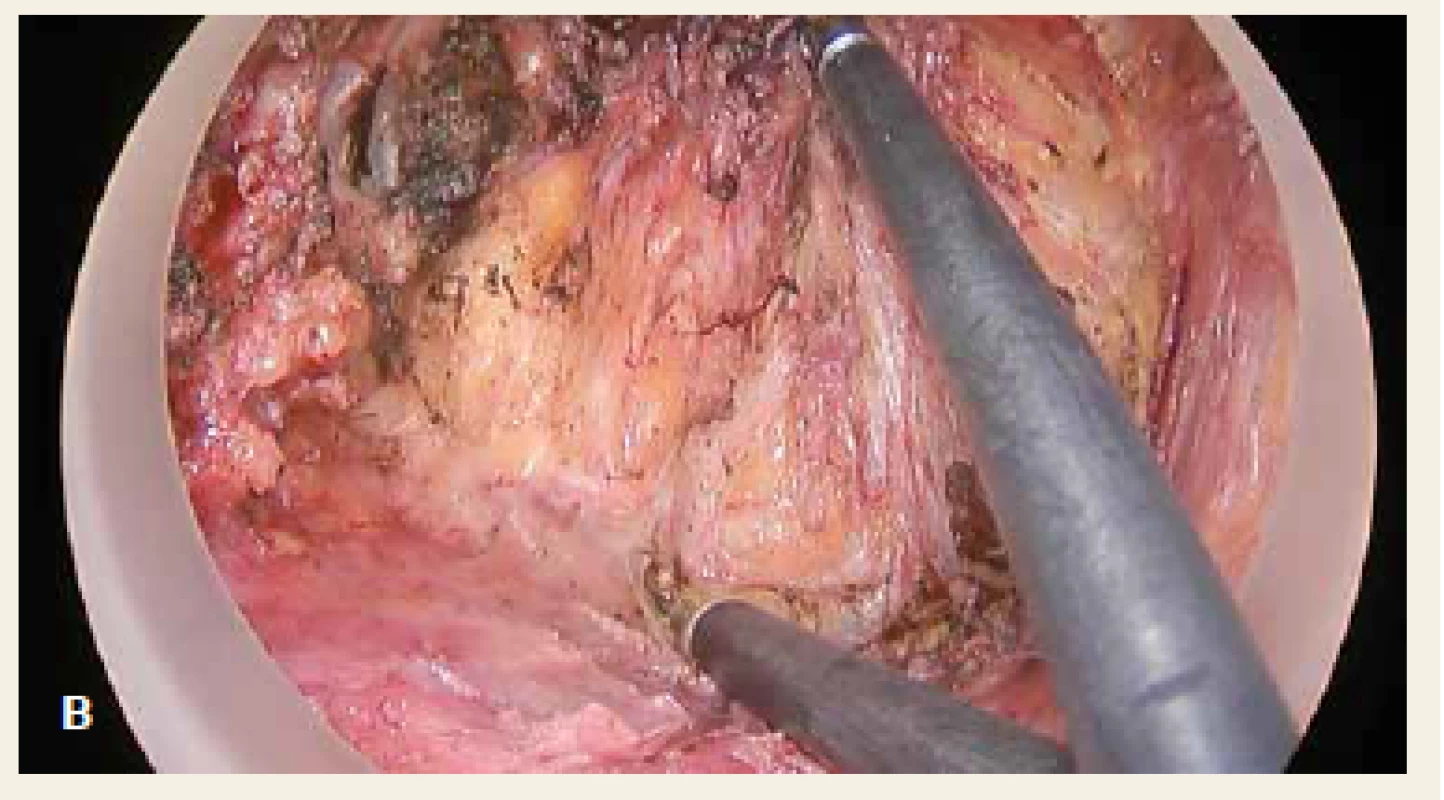
Obr. 4. Princip resekce rekta metodou TAMIS-TME – down to top strategie Fig. 4. Rectal resection using the TAMIS-TME method – a down-to-top strategy 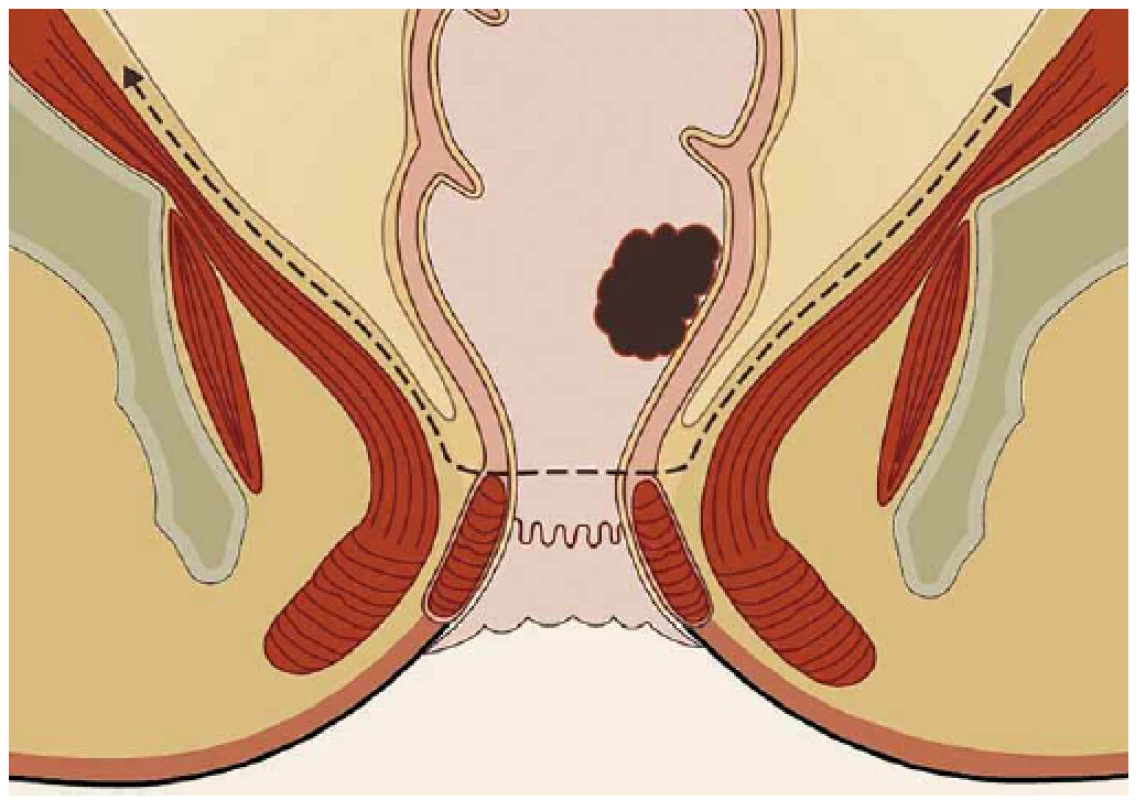
(upraveno ve spolupráci se servisním střediskem pro e-learning MU dle [28]). (edited in cooperation with the Masaryk University e-learning service centre accord ing to [28]). Obr. 5. Ruční šití koloanální anastomózy. Fig. 5. A hand-sewn coloanal anastomosis. 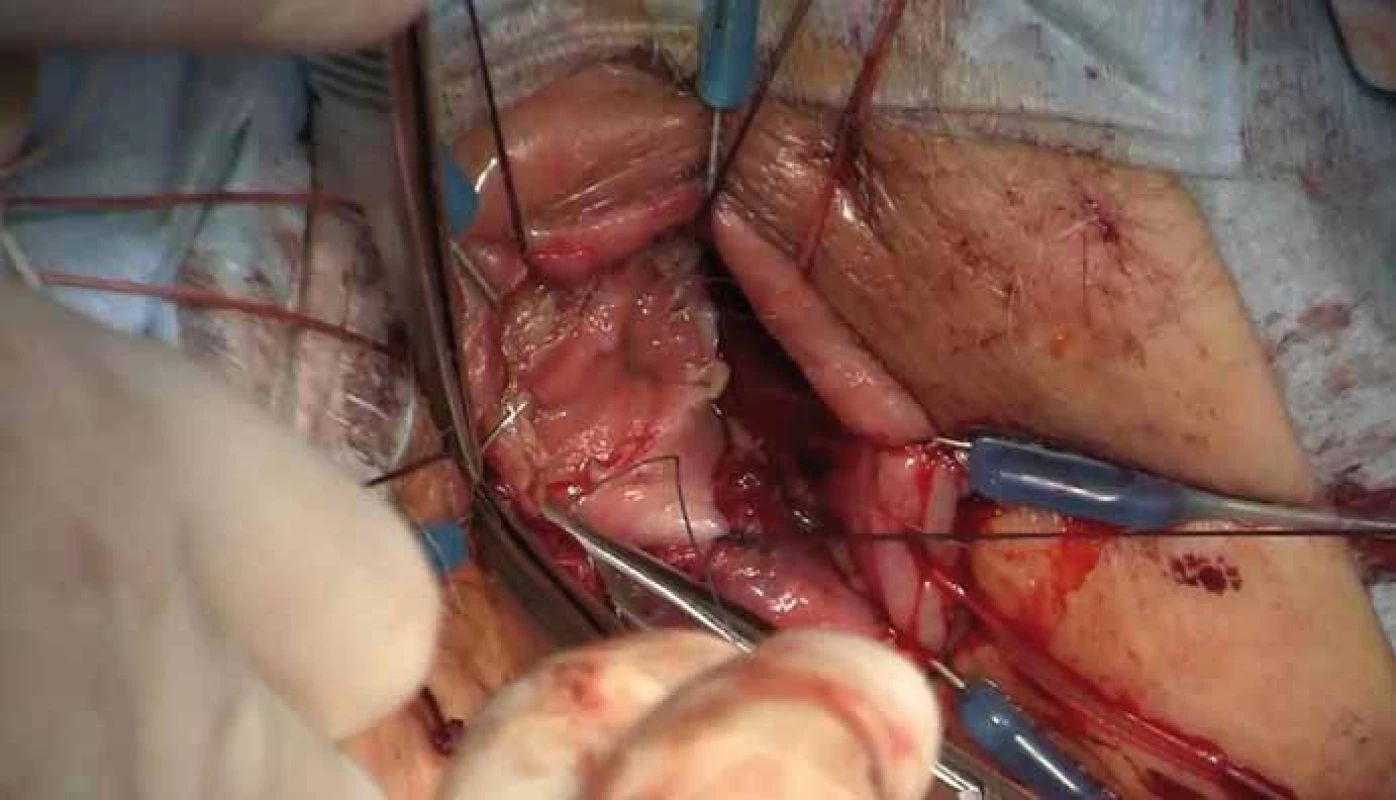
Obr. 6. Resekát rekta s totální mezorektální excizí. Fig. 6. Rectal specimen with total mesorectal excision. 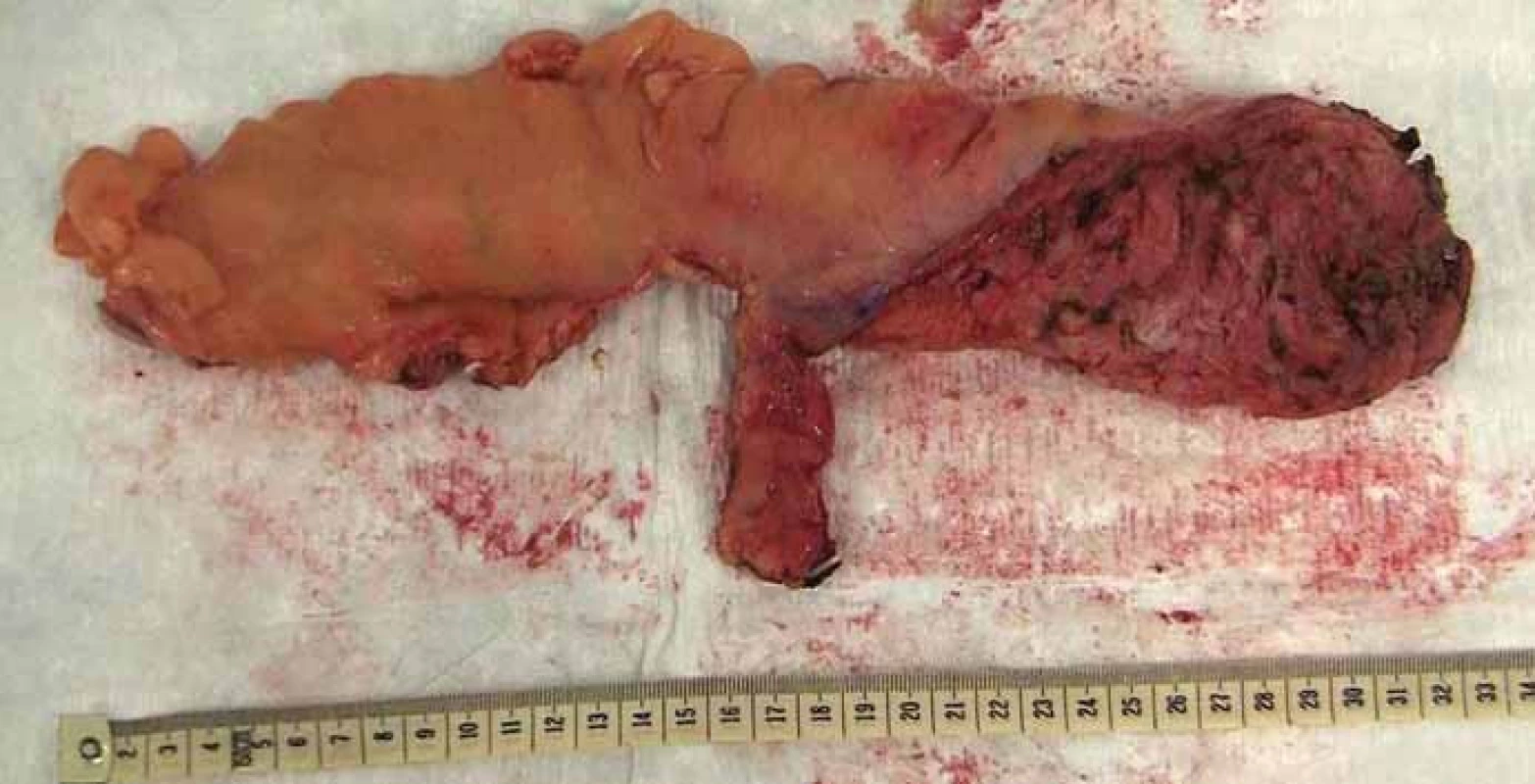
Soubor pacientů
V období let 2014–2015 podstoupili čtyři pacienti EMR plochých slizničních neoplazií (obr. 1), kdy endoskopická resekce nebyla dostatečně kurativní metodou. Neoplazie byly lokalizovány v rektu ve vzdálenosti 4–8 cm od anokutánního přechodu. Ze všech snesených povrchových lézí byly po včasném histologickém vyšetření potvrzeny adenokarcinomy. Ve třech případech byla zaznamenána pozitivní resekční linie a v jednom nediferencovaný karcinom. Charakteristika jednotlivých pacientů je uvedena v tab. 1. U pacientů byla vyloučena diseminace onemocnění a dokončen kompletní staging (onkomarkery, rentgen či CT hrudníku, CT břicha, TRUS a MR). Pacienti byli předvedeni na onkologické indikační komisi a indikováni k radikální resekci. Pacientům byla také doplněna rektální manometrie k ověření funkčnosti svěračů. Následně pacienti podstoupili resekci rekta metodou TAMIS s TME (TAMIS-TME) ve snaze zachovat kontinenci a miniinvazivitu výkonu, ale zároveň zachovat dostatečnou onkologickou radikalitu (obr. 2–6). U všech pacientů byla provedena R0 resekce a preparáty dosahovaly kvality kompletní TME, tedy nejvyšší kvality (obr. 6). Pacienti se zhojili bez komplikací a byli propuštěni v průměru 8. pooperační den. U žádného pacienta nebyla následně indikována adjuvantní chemoterapie, a protektivní ileostomie byla tedy navrácena v rozmezí 6–8 týdnů od operace.
Tab. 1. Základní charakteristika pacientů. Tab. 1. Basic patient characteristics. 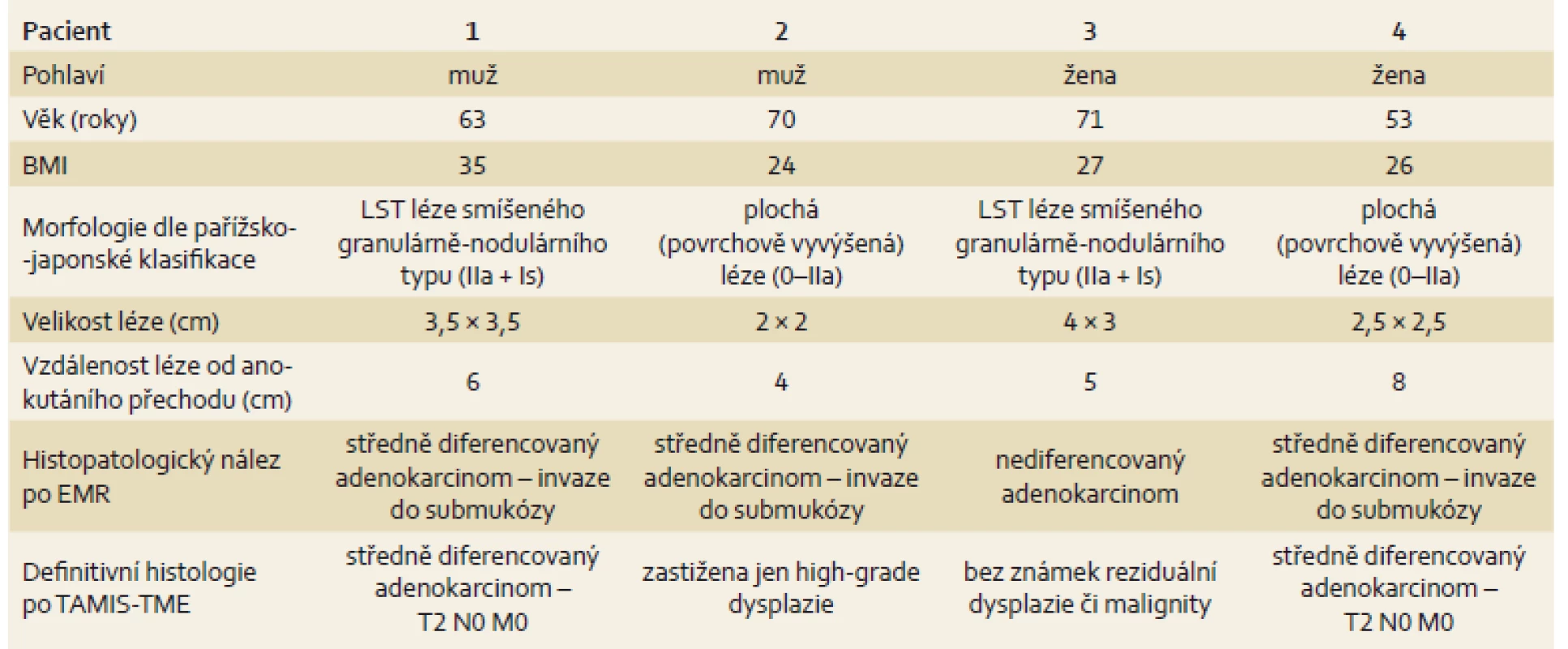
BMI – body mass index, EMR – endoskopická mukózní resekce Diskuze
CRC je jedním z nejčastějších onkologických onemocnění v ČR. Zhruba 70 % CRC vzniká na podkladě adenomových polypů a 30 % vzniká de novo [19].
U maligního stopkatého polypu je endoskopické řešení léze dostatečné v případě, že jsou splněna Morsonova kritéria (příznivý grading, nepřítomnost vaskulární a lymfatické angioinvaze a vzdálenost tumoru od resekční linie je min. 2 mm) [15–17] a léze splňuje kritéria stupně 1–3 Haggittovy klasifikace (odpovídá povrchové invazi do submukózy vrstvy sm1). Haggittova klasifikace (stupeň 1–4) zohledňuje invazi do stopky polypu a hodnotí riziko následné hloubky invaze do submukózy u stopkatých maligních polypů [18]. Při splnění výše uvedených kritérií u stopkatého maligního polypu je riziko lymfatických metastáz do 2 % [29,30].
Lymfatické cévy v tlustém střevu nezasahují do slizniční vrstvy, proto maligní léze omezené na slizniční vrstvu nemetastazují. V případě invazivního karcinomu u přisedlých a plochých lézí zasahujících do submukózy se zvyšuje riziko metastazování do lymfatických uzlin dle hloubky invaze do jednotlivých vrstev submukózy – sm1 (3 %), sm2 (8 %), sm3 (23 %) [31].
U plochých maligních slizničních lézí je další terapeutický postup určen hloubkou invaze do submukózy. Pokud invaze nepřesahuje vrstvu sm1 a karcinom je dobře diferencovaný, je endoskopické řešení akceptovatelné. Jistě je ale vhodná časná endoskopická kontrola (do 3 měsíců). Při invazi do hlubších vrstev submukózy (sm2 či sm3) a nepříznivého gradingu je indikováno chirurgické řešení [19].
Dalším významným faktorem je lifting sign – zhodnocení elevace léze po aplikaci submokózní injekce. V případě non-liftingu je zřejmá infiltrace submukózy vrstvy sm3 a je indikována chirurgická resekce [11].
TEM neboli transanální operační technika pomocí operačního rektoskopu je metodou volby u benigních lézí rekta a časných karcinomů, které nelze snést klasickou chirurgickou transanální excizí per anum či endoskopicky [32].
V roce 2012 Park et al [33] porovnávali ESD a TEM v řešení nepolypoidních rektálních high-grade dysplazií a do submukózy zasahujících invazivních karcinomů. Obě metody se ukázaly jako efektivní a onkologicky dostačující v léčbě těchto typů lézí. U techniky ESD vyzvedávají autoři práce miniinvazivitu a vyhnutí se celkové anestezii. Podobnou studii provedli Kawaguti et al [34] v roce 2014 se stejným závěrem, kdy ESD a TEM hodnotí jako efektivní v léčbě časných karcinomů rekta.
Relativně nová metoda TAMIS s užitím speciálně upraveného transanálního portu může být také použita jako alternativa k TEM k lokální excizi benigních lézí či T1 karcinomů rekta.
Tuto metodu lze také použít u lokálně pokročilých, ale chirurgicky radikálně resekabilních tumorů, jejichž léčba vyžaduje totální lymfadenektomii, tedy TME. Hovoříme o TAMIS-TME resekci rekta. I u nízko uložených tumorů rekta lze pomocí této metody provést sfinkter záchovnou resekci a zároveň provést TME. Další nespornou výhodou u metody TAMIS-TME je miniinvazivita výkonu.
U TAMIS-TME je předoperačně nutné provedení rektální manometrie. Při špatné funkci svěračů je sfinkter záchovná operace s koloanální anastomózou kontraindikována.
Zatím jsou ohledně pooperačních funkčních výsledků po transanální TME jen omezená data a chybí dlouhodobé výsledky. První výsledky se ale jeví jako akceptovatelné [35].
Buchs et al [36] v letošním roce shrnují ve své práci zkušenosti s metodou TAMIS-TME, kdy hodnotí pooperační komplikace a krátkodobé onkologické výsledky jako dobré, i když další studie s větším souborem pacientů a delším onkologickým sledováním jsou dle jeho doporučení nutné.
V našem souboru pacientů po TAMIS-TME resekci dosahovaly resekáty rekta v patologickém hodnocení nejvyšší kvality, tedy kompletní TME. Dosáhnout nejvyšší kvality TME u takto nízko uložených tumorů rekta abdominálním přístupem by bylo velmi obtížné. V roce 2015 dosáhli Muratore et al [37] pomocí TAMIS-TME ve svém souboru 26 pacientů negativní resekční okraje u všech pacientů a u 88,5 % pacientů bylo dosaženo kompletní TME. Vynikajících výsledků dosáhli stejnou technikou také Lacy et al [38] ve svém souboru 140 pacientů, kdy kompletní TME byla dosažena v 97,1 %. Kvalita TME má stěžejní vliv na výskyt lokální recidivy, celkovou prognózu onemocnění a přežívání pacienta [26,27].
Radikální resekci rekta s TME technikou TAMIS lze s výhodou použít u pacientů s rizikovými faktory jako vysoký body mass index, mužské pohlaví (úzká pánev, objemná prostata), objemné mezorektum a nízko uložené tumory. Výhodou TAMIS techniky je dobrý celkový přehled při distální preparaci rekta a makroskopická kontrola vzdálenosti tumoru od DRM. Všechny tyto faktory by mohly vést k tomu, že metodou TAMIS by bylo možné dosáhnout zlepšení celkové kvality TME a intaktnosti resekční linie, a tedy zlepšení výsledků stran rizika lokálních recidiv a celkového přežívání pacientů. K vyhodnocení funkčních a onkologických výsledků je však nutný dlouhodobější follow-up [35].
Závěr
Benigní slizniční léze kolorekta lze s výhodou řešit endoskopicky. Také povrchové slizniční neoplazie vč. invazivního karcinomu bez podezření na postižení spádových lymfatických uzlin lze řešit endoskopickou technikou EMR či event. ESD.
Nepříznivý histologický výsledek (invazivní karcinom zasahující do vrstvy sm2–3) po endoskopické lokální excizi na distálním rektu nemusí pro pacienta nutně znamenat amputaci rekta s trvalým střevním vývodem. Prezentovaná metoda TAMIS-TME představuje minimálně invazivní techniku, kdy i u distálně uložených tumorů rekta lze provést radikální resekci se zachováním kontinuity GIT a zároveň splňovat onkologickou radikalitu ve smyslu totální lymfadenektomie (TME). Lze ji s výhodou aplikovat i u pacientů po lokální excizi např. EMR, ESD či TEM.
Článek vznikl za podpory grantu MZ VES 2016, projektové číslo 16-31765A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 7. 9. 2016
Přijato: 4. 1. 2017
MUDr. Lumír Kunovský
Chirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
kunovsky.lumir@fnbrno.cz
Zdroje
1. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136 (5): E359–E386. doi: 10.1002/ijc.29210.
2. Dušek L, Májek O, Mužík J et al. Objektivní potřeba a stav nádorové prevence v České republice a v Evropě. Klin Onkol 2014; 27 (Suppl 2): 2S7–2S18. doi: 10.14735/amko20142S7.
3. Bláha M, Hoch J, Ferko A et al. Technické zajištění sběru dat pro parametrické sledování totální mezorektální excize (TME) pro karcinom rekta. Rozhl Chir 2016; 95 (7): 272–279.
4. Nussbaum N, Altomare I. The neoadjuvant treatment of rectal cancer: a review. Curr Oncol Rep 2015; 17 (3): 434. doi: 10.1007/s11912-014-0434-9.
5. Valentini V, Aristei C, Glimelius B et al. Multidisciplinary rectal cancer management: 2nd European rectal cancer consensus conference (EURECA-CC2). Radiother Oncol 2009; 92 (2): 148–163. doi: 10.1016/j.radonc.2009.06.027.
6. Dušek T, Ferko A, Blaha M et al. Současný stav strategie léčby karcinomu rekta v České republice s ohledem na výskyt kompletní patologické odpovědi při neoadjuvantní léčbě – studie PATOD C20 2011–2012. Rozhl Chir 2015; 94 (7): 276–282.
7. van Leersum NJ, Janssen-Heijnen ML, Wouters MW et al. Increasing prevalence of comorbidity in patients with colorectal cancer in the South of the Netherlands 1995–2010. Int J Cancer 2013; 132 (9): 2157–2163. doi: 10.1002/ijc.27871.
8. Tanaka S, Sano Y. Aim to unify the narrow band imaging (NBI) magnifying classification for colorectal tumors: current status in Japan from a summary of the consensus symposium in the 79th Annual Meeting of the Japan Gastroenterological Endoscopy Society. Dig Endosc 2011; 23 (Suppl 1): 131–139. doi: 10.1111/j.1443-1661.2011.01106.x.
9. Hewett DG, Kaltenbach T, Sano Y et al. Validation of a simple classification system for endoscopic diagnosis of small colorectal polyps using narrow-band imaging. Gastroenterology 2012; 143 (3): 599–607. doi: 10.1053/j.gastro.2012.05.006.
10. Hayashi N, Tanaka S, Hewett DG et al. Endoscopic prediction of deep submucosal invasive carcinoma: validation of the Narrow-band imaging international colorectal endoscopic (NICE) classification. Gastrointest Endosc 2013; 78 (4): 625–632. doi: 10.1016/j.gie.2013.04.185.
11. Uno Y, Munakata A. The non-lifting sign of invasive colon cancer. Gastrointest Endosc 1994; 40 (4): 485–489.
12. Endoscopic Classification Review Group. Update on the paris classification of superficial neoplastic lesions in the digestive tract. Endoscopy 2005; 37 (6): 570–578.
13. Kudo Se, Lambert R, Allen JI et al. Nonpolypoid neoplastic lesions of the colorectal mucosa. Gastrointest Endosc 2008; 68 (Suppl 4): S3–S47. doi: 10.1016/j.gie.2008.07.052.
14. Lambert R, Tanaka S. Laterally spreading tumors in the colon and rectum. Eur J Gastroenterol Hepatol 2012; 24 (10): 1123–1134. doi: 10.1097/MEG.0b013e328355e2d9.
15. Morson BC, Bussey HJ, Samoorian S. Policy of local excision for early cancer of the colorectum. Gut 1977; 18 (12): 1045–1050.
16. Morson BC, Whiteway JE, Jones EA et al. Histopathology and prognosis of malignant colorectal polyps treated by endoscopic polypectomy. Gut 1984; 25 (5): 437–444.
17. Pizarro-Moreno A, Cordero-Fernández C, Garzón-Benavides M et al. Malignant colonic adenomas. Therapeutic criteria. Long-term results of therapy in a series of 42 patients in our healthcare area. Rev Esp Enferm Dig 2009; 101 (12): 830–836.
18. Haggitt RC, Glotzbach RE, Soffer EE et al. Prognostic factors in colorectal carcinomas arising in adenomas: implications for lesions removed by endoscopic polypectomy. Gastroenterology 1985; 89 (2): 328–336.
19. Dastych M, Kroupa R. Možnosti endoskopického řešení polypoidních a nepolypoidních lézí v kolon. Vnitř Lék 2015; 61 (7–8): 698–702.
20. Tanaka S, Oka S, Chayama K. Colorectal endoscopic submucosal dissection: present status and future perspective, including its differentiation from endoscopic mucosal resection. J Gastroenterol 2008; 43 (9): 641–651. doi: 10.1007/s00535-008-2223-4.
21. Cao Y, Liao C, Tan A et al. Meta-analysis of endoscopic submucosal dissection versus endoscopic mucosal resection for tumors of the gastrointestinal tract. Endoscopy 2009; 41 (9): 751–757. doi: 10.1055/s-0029-1215053.
22. Chao G, Zhang S, Si J. Comparing endoscopic mucosal resection with endoscopic submucosal dissection: the different endoscopic techniques for colorectal tumors. J Surg Res 2016; 202 (1): 204–215. doi: 10.1016/j.jss.2015.12.027.
23. Kala Z, Skrovina M, Procházka V et al. Transanální totální mezorektální excize pro karcinom rekta – jen módní trend? Rozhl Chir 2014; 93 (12): 564–567.
24. Hoch J, Ferko A, Bláha M et al. Parametrické sledování kvality totální mezorektální excize a chirurgické léčby karcinomu rekta – výsledky multicentrické studie. Rozhl Chir 2016; 95 (7): 262–271.
25. Nagtegaal ID, van de Velde CJ, van der Worp E et al. Macroscopic evaluation of rectal cancer resection specimen: clinical significance of the pathologist in quality control. J Clin Oncol 2002; 20 (7): 1729–1734.
26. Nagtegaal ID, van de Velde CJ, Marijnen CA et al. Low rectal cancer: a call for a change of approach in abdominoperineal resection. J Clin Oncol 2005; 23 (36): 9257–9264.
27. West NP, Finan PJ, Anderin C et al. Evidence of the oncologic superiority of cylindrical abdominoperineal excision for low rectal cancer. J Clin Oncol 2008; 26 (21): 3517–3522. doi: 10.1200/JCO.2007. 14.5961.
28. Rullier E, Denost Q, Vendrely V et al. Low rectal cancer: classification and standardization of surgery. Dis Colon Rectum 2013; 56 (5): 560–567. doi: 10.1097/DCR. 0b013e31827c4a8c.
29. Cranley JP, Petras RE, Carey WD et al. When is endoscopic polypectomy adequate therapy for colonic polyps containing invasive carcinoma? Gastroenterology 1986; 91 (2): 419–427.
30. Nivatvongs S, Rojanasakul A, Reiman HM et al. The risk of lymph node metastasis in colorectal polyps with invasive adenocarcinoma. Dis Colon Rectum 1991; 34 (4): 323–328.
31. Nascimbeni R, Burgart LJ, Nivatvongs S et al. Risk of lymph node metastasis in T1 carcinoma of the colon and rectum. Dis Colon Rectum 2002; 45 (2): 200–206.
32. Noura S, Ohue M, Miyoshi N et al. Transanal minimally invasive surgery (TAMIS) with a GelPOINT® path for lower rectal cancer as an alternative to transanal endoscopic microsurgery (TEM). Mol Clin Oncol 2016; 5 (1): 148–152.
33. Park SU, Min YW, Shin JU et al. Endoscopic submucosal dissection or transanal endoscopic microsurgery for nonpolypoid rectal high grade dysplasia and submucosa-invading rectal cancer. Endoscopy 2012; 44 (11): 1031–1036. doi: 10.1055/s-0032-1310015.
34. Kawaguti FS, Nahas CS, Marques CF et al. Endoscopic submucosal dissection versus transanal endoscopic microsurgery for the treatment of early rectal cancer. Surg Endosc 2014; 28 (4): 1173–1179.
35. Hasegawa S, Takahashi R, Hida K et al. Transanal total mesorectal excision for rectal cancer. Surg Today 2015; 46 (6): 641–653. doi: 10.1007/s00595-015-1195-2.
36. Buchs NC, Nicholson GA, Ris F et al. Transanal total mesorectal excision: a valid option for rectal cancer? World J Gastroenterol 2015; 21 (41): 11700–11708. doi: 10.3748/wjg.v21.i41.11700.
37. Muratore A, Mellano A, Marsanic P et al. Transanal total mesorectal excision (taTME) for cancer located in the lower rectum: short-and mid-term results. Eur J Surg Oncol 2015; 41 (4): 478–483. doi: 10.1016/j.ejso.2015.01.009.
38. Lacy AM, Tasende MM, Delgado S et al. Transanal total mesorectal excision for rectal cancer: outcomes after 140 patients. J Am Coll Surg 2015; 221 (2): 415–423. doi: 10.1016/j.jamcollsurg.2015.03.046
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Digestivní endoskopieČlánek Spánková endoskopie – cílená endoskopická diagnostika u pacientů s obstrukční spánkovou apnoíČlánek Význam nutričního poradenství při léčbě obézních pacientů endoskopickými restrikčními metodamiČlánek XXI. hradecké gastroenterologické a hepatologické dny a XI. mezinárodní endoskopický workshopČlánek Správná odpověď na kvízČlánek Rifaximin
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2017 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Digestivní endoskopie
- Jaká byla příčina masivní enteroragie?
- Spánková endoskopie – cílená endoskopická diagnostika u pacientů s obstrukční spánkovou apnoí
- Endoskopická drenáž pankreatických tekutinových kolekcií – 6-ročná skúsenosť v terciárnom gastroenterologickom centre v období rokov 2006–2012
- Transanální minimálně invazivní resekce rekta s totální mezorektální excizí po endoskopické mukózní resekci
- Kolonické dekomprese v běžné praxi
- Prvé skúsenosti s katétrovou konfokálnou laserovou endomikroskopiou (pCLE) v biliodigestívnej endoskopii
- Granulárnobunkový tumor pažeráka – kazuistika a prehľad
- Odporúčania Pracovnej skupiny pre IBD Slovenskej gastroenterologickej spoločnosti pre liečbu ulceróznej kolitídy
- Problematická diagnostika a závažné biliárne komplikácie echinokokózy pečene
- Význam nutričního poradenství při léčbě obézních pacientů endoskopickými restrikčními metodami
- Problematika tuberkulózy a latentní tuberkulózní infekce u pacientů s idiopatickými střevními záněty léčenými biologickou léčbou
- Výměna koeditorů na pozici zástupce šéfredaktora pro Slovenskou republiku
- 21st Days of Gastroenterology and Hepatology and 11th International Endoscopic Workshop in Hradec Králové
- Report of the 16th Slovak-Czech IBD day in Nitra
-
Novel developments in pancreatic disorders
Peter Layer Lecture – Gastro Update Europe 2016, Prague - Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Vyhlášení soutěže o dvě nejlepší původní práce 2016
- Kreditovaný autodidaktický test: digestivní endoskopie
- Rifaximin
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rifaximin
- Kolonické dekomprese v běžné praxi
- Odporúčania Pracovnej skupiny pre IBD Slovenskej gastroenterologickej spoločnosti pre liečbu ulceróznej kolitídy
- Problematická diagnostika a závažné biliárne komplikácie echinokokózy pečene
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání






