-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaGuidelines EAU pro karcinom močového měchýře (TAT1 – neinvadujícího svalovinu)
VERZE 2007
Autoři: W. Oosterlinck; A. Van Der Meijden; R. Sylvester; A. Böhle; E. Rintala; E. Solsona Narvón; B. Lobel
Vyšlo v časopise: Urol List 2008; 6(2): 121-131
Kategorie: Guidelines
OBSAH
- ÚVOD 122
- 1.2 Úvod 122
- Klasifikace 122
- 2.1 ‑ Histologická klasifikace stupně diferenciace 122 povrchových tumorů močového měchýře
- 2.1.1. Klasifikace WHO/ISUP 123
- 2.2 Sporná definice povrchových a infiltrujících tumorů 123
- 2.3 „Inter - a intra-observer“ variabilita při určování stadia a stupně diferenciace tumoru 123
- 2.3.1 Doporučení pro užívání klasifikačního systému stupně diferenciace 124
- 2.1 ‑ Histologická klasifikace stupně diferenciace 122 povrchových tumorů močového měchýře
- RIZIKOVÉ FAKTORY 124
- DIAGNOSTIKA 124
- 4.1 Symptomy tumoru močového měchýře TaT1 124
- 4.2 Fyzikální vyšetření 124
- 4.3 Zobrazovací vyšetření 124
- 4.3.1 Intravenózní urografie 124
- 4.3.2 Ultrasonografie 124
- 4.4 Cytologie 124
- 4.5 Močové molekulární testy 124
- 4.6 Cystoskopie 124
- 4.7 Transuretrální resekce tumoru močového měchýře TaT1 124
- 4.8 Biopsie močového měchýře 125
- 4.9 Fluorescenční cystoskopie 125
- 4.10 Opakovaná resekce 125
- 4.11 Doporučení pro hodnocení tumorů TaT1 125
- ADJUVANTNÍ LÉčBA 125
- 5.1 Jednorázová instilace prováděná hned po operaci 125
- 5.2 Doplňující adjuvantní intravezikální instilace 126
- 5.3 Optimalizace intravezikální chemoterapie 126
- 5.4 Intravezikální instilace bacilu Calmette-Guerin (BCG) - imunoterapie 126
- 5.4.1 Indikace pro BCG 126
- 5.4.2 BCG umožňuje oddálení nebo prevenci vzniku svalovinu invadujícího onemocnění 126
- 5.4.3 Pro dosažení nejlepšího výsledku je nutné provádět udržovací terapii 127
- 5.4.4 Toxicita BCG 127
- 5.4.5 Nejvhodnější režim aplikace BCG 127
- 5.4.6 Nejvhodnější dávkování BCG 127
- 5.4.7 Doporučení pro aplikaci BCG 127
- 5.5 Predikce recidivy a progrese tumorů TaT1 127
- 5.5.1 Doporučení pro intravezikální chemoterapii nebo BCG 127
- 5.6 Léčba po selhání instilační terapie 128
- 5.7 Sledování pacientů s tumorem močového měchýře TaT1 128
- 5.7.1 Doporučení pro sledování pomocí cystoskopie 128
- LITERATURA 129
- ZKRATKY POUŽITÉ V TEXTU 131
1. ÚVOD
Evropská urologická společnost (EAU) publikovala své první Guidelines pro karcinom močového měchýře v roce 2002 [1]. Později se však rozhodla vytvořit samostatné guidelines pro různé kategorie tumorů močového měchýře:
- TaT1 papilární tumory (svalovinu neinvadující karcinomy močového měchýře)
- tumory horních cest močových
- karcinom in situ (CIS)
- prognostické faktory ovlivňující vznik tumorů TaT1)
- tumory močového měchýře invadující svalovinu
Všechny samostatné guidelines byly publikovány v časopise European Urology [2-4]. Tento přehled nabízí aktualizovanou verzi guidelines EAU pro léčbu TaT1 (neinvadujícího svalovinu) karcinomu močového měchýře.
1.2 Úvod
Přibližně u 75–85 % pacientů s karcinomem močového měchýře je detekováno onemocnění ohraničené na sliznici (stadium Ta-CIS) nebo podslizniční podpůrnou tkáň (stadium T1). Vyšetřovací metody, léčba a sledování pacientů s karcino-mem močového měchýře neinvadujícího svalovinu jsou více komplexní nežli v minulosti.
2. KLASIFIKACE
Klasifikace tumor – uzliny – metastázy (TNM) z roku 2002 schválená Union International Contre le Cancer (UICC) byla všeobecně přijata (tab. 1) [5]. Tato klasifikace se odlišuje od verze TNM z roku 1997 a z roku 1992 kategorií stadia T2, která zahrnuje infiltraci stěny močového měchýře různé hloubky (T2a vnitřní polovina, T2b vnější polovina).
Tab. 1. TNM klasifikace karcinomu močového měchýře z roku 2002. 
2.1 Histologická klasifikace stupně diferenciace povrchových tumorů močového měchýře
Světová zdravotnická organizace (WHO) a Mezinárodní společnost urologické patologie (ISUP) uvedly v roce 1998 novou klasifikaci neinvazivních uroteliálních tumorů (1998 WHO/ISUP klasifikace) [6]. WHO uveřejnila tento nový klasifikační systém v roce 2004 [7] (tab. 2). Hlavní přínos WHO/ISUP klasifikace spočívá v detailní histologické charakteristice různých grade tumoru s využitím specifických cytologických a architektonických kritérií [7]. Webová stránka www.pathology.jhu.edu/ bladder uvádějící příklady různých grade onemocnění umožňuje přesnější užívání tohoto klasifikačního systému. Nová WHO/ISUP klasifikace od sebe rozlišuje papilární uroteliální neoplazmata s nízkým maligním potenciálem (PUNLMP) a uroteliální karcinomy o nízkém a vysokém grade.
Tab. 2. TNM klasifikace karcinomu močového měchýře z roku 2002. 
2.1.1. Klasifikace WHO/ISUP
PUNLMP jsou léze, které nevykazují cytologické známky malignity a v papilární konfiguraci vykazují přítomnost normálních uroteliálních buněk. Přestože jsou spojeny s pouze zanedbatelným rizikem progrese, nejsou zcela benigní a mají tendenci recidivovat.
Klasifikační systém WHO z roku 2004 rozděluje tumory na papilární uroteliální neoplazmata s nízkým maligním potenciálem (PUNLMP) a uroteliální karcinomy dvou grade: nízkého a vysokého (tab. 2). Vyloučena byla prostřední kategorie – tato kategorie a PUNLMP představovaly sporný bod WHO klasifikace z roku 1973. Doporučujeme užívat WHO klasifikaci z roku 2004 vzhledem k tomu, že umožňuje jednotnou diagnostiku tumoru a lepší rozdělení rizikového poten-ciálu. Do té doby, než bude verze z roku 2004 validována v dalších klinických studiích, je však třeba tumory klasifikovat na základě obou systémů (1973 i 2004) [9].
Většina klinických studií zabývajících se léčbou tumorů močového měchýře TaT1 užívá WHO klasifikaci z roku 1973,a proto tedy i následující guidelines vycházejí z této klasifikace.
2.2 Nepřesná definice povrchových a infiltrujících tumorů
Podle systému TNM je papilární tumor ohraničený na sliznici klasifikován jako Ta. Tumory invadující lamina propria jsou označovány jako T1. Vzhledem k tomu, že Ta a T1 lze odstranit pomocí transuretrální resekce, nazýváme z terapeutických důvodů oba typy tumorů společným názvem – povrchové karcinomy močového měchýře. Do této skupiny řadíme také ploché tumory vysokého grade ohraničené na sliznici, označované jako karcinom in situ (CIS). Metody molekulární biologie a klinická zkušenost však prokázaly, že karcinomy T1 a CIS mají vysoký maligní a infiltrující potenciál. Z tohoto důvodu není termín povrchový karcinom močového měchýře optimální.
2.3 "Inter - a intra-observer" variabilita při určování stadia a stupně diferenciace tumoru
Navzdory existenci dobře nadefinovaných kritérií pro diagnostiku uroteliálního karcinomu, se definice dysplazie a CIS mezi jednotlivými patology významně liší. Při klasifikaci stadia a grade tumorů T1 a Ta existuje rovněž významná variabilita mezi jednotlivými vyšetřujícími [10,11]. Z tohoto důvodu doporučujeme při hodnocení histologických nálezů spolupráci urologa a patologa.
2.3.1 Doporučení pro užívání klasifikačního systému stanovení stupně diferenciace
Do doby, než bude verze klasifikačního systému WHO pro hodnocení grade tumoru z roku 2004 validována, doporučujeme užívání obou verzí – starší i novější (stupeň doporučení C).
3. RIZIKOVÉ FAKTORY
Doposud bylo popsáno mnoho faktorů zodpovědných za vznik tumoru močového měchýře. Urologové by si měli být vědomi možného rizika expozice uroteliálním karcinogenům, k němuž dochází v rámci různých profesí [12]. Mezi prvními uroteliálními karcinogeny byly popsány aromatické aminy. Mezi rizikové skupiny se řadí zaměstnanci tiskáren, závodů na zpracování železa a hliníku, závodů na výrobu barviv, plynu a dehtu.
Dalším významným rizikovým faktorem je kouření, které ztrojnásobuje riziko vzniku karcinomu močového měchýře [13] (úroveň důkazu 3a). Kouření zvyšuje během dlouhodobého sledování mortalitu na karcinom močového měchýře, přestože multivarietní analýza prokázala, že prognostický vliv kouření je slabší než vliv jiných faktorů, jako například stadia, grade, velikosti a multifokality tumoru [14]. Z tohoto důvodu je nezbytné se pacienta dotázat na jeho profesi a/nebo případné kuřáctví.
4. DIAGNOSTIKA
4.1 Symptomy tumoru močového měchýře TaT1
Nejčastějším nálezem je u pacientů s tumorem močového měchýře TaT1 hematurie. Tyto tumory nevyvolávají bolest močového měchýře a jen vzácně způsobují podráždění, dysurii nebo urgenci. U pacientů, kteří si stěžují na tyto symptomy, lze předpokládat přítomnost CIS.
4.2 Fyzikální vyšetření
Fyzikální vyšetření neumožňuje odhalit tumor ohraničený na sliznici nebo podslizniční podpůrnou tkáň (TaT1).
4.3 Zobrazovací vyšetření
4.3.1 Intravenózní urografie
Velké tumory se mohou jevit jako defekty v náplni močového měchýře. Intravenózní urografie (IVU) se užívá k detekci defektu náplně v renálním kalichu a pánvičce a močovodech a dále k detekci hydronefrózy, která může být známkou přítomnosti ureterálního karcinomu. Vzhledem k nízké incidenci signifikantních nálezů při IVP je však rutinní provádění této metody v případě detekce tumoru močového měchýře diskutabilní [15-17] (úroveň důkazu 3). Incidence tumorů horních cest močových je v případě karcinomu nízkého grade nízká, u T1G3 tumorů se zvyšuje až na 7 % [16].
4.3.2 Ultrasonografie
Ultrasonografie (USG) se stále častěji užívá jako pomůcka při počátečním vyšetření cest močových, a to nejenom z toho důvodu, že se při tomto vyšetření neužívá kontrastní látka, ale také proto, že senzitivní vyšetřovací sondy umožnily zlepšení úrovně zobrazovacího vyšetření horních cest močových a močového měchýře. Transabdominální USG umožňuje lepší charakteristiku renální masy, lepší detekci hydronefrózy a vizualiaci defektů náplně močového měchýře. V kombinaci s prostým RTG snímkem může USG při diagnostice příčiny hematurie poskytnout stejně přesný výsledek jako IVU [15,16].
4.4 Cytologie
Vyšetření vymočené moči nebo vzorků močového měchýře získaných kartáčkovým odběrem cytologie na přítomnost odlupujících se karcinomatózních buněk se doporučuje zejména v případě maligního onemocnění vysokého grade nebo CIS.
Pozitivní výsledek cytologického vyšetření moči může ukazovat na přítomnost uroteliálního tumoru kdekoliv v močových cestách - od kalichu, přes močovody až po močový měchýř a močovou trubici. Negativní výsledek cytologie navíc nevylučuje přítomnost tumoru močového měchýře o nízkém grade. Interpretace cytologického vyšetření může být problematická – nízký buněčný výtěžek, atypie, degenerativní změny, infekce močových cest, močové konkrementy a intravezikální instilace znesnadňují stanovení správné diagnózy.
4.5 Močové molekulární testy
Celá řada studií se zaměřila na hodnocení molekulárních močových markerů. V současné době jsou k dispozici test na antigen tumoru močového měchýře, protein 22 nukleární matrix (NMP 22), fibrin degradační produkty, Quanticyt a Immunocyt. Většina těchto testů má při detekci karcinomu močového měchýře větší senzitivitu, jejich specifita je však nižší. Falešně pozitivní výsledky některých testů pak vedou k provádění zbytečných zobrazovacích vyšetření a biopsie močového měchýře. Vzhledem k tomu, že nemáme k dispozici údaje velkých prospektivních multicentrických studií, není zatím jisté, zda tyto testy poskytují informace užitečné pro stanovení léčby a prognózy povrchových tumorů močového měchýře, nebo nikoliv [18-20]. Kombinované užívání těchto nových markerů by mohlo optimalizovat jejich spolehlivost. Negativním aspektem těchto testů může být jejich cena.
4.6 Cystoskopie
Diagnostika karcinomu močového měchýře závisí zejména na cystoskopickém vyšetření močového měchýře a histologickém vyšetření resekované tkáně. Obvykle cystoskopii provádí lékař ve své ordinaci při užití flexibilních instrumentů. V případě, že byl tumor močového měchýře vizualizován při jiném zobrazovacím vyšetření nebo v případě pozitivního výsledku močové cytologie, není nutné cytoskopii provádět, nebo pacient v každém případě podstoupí TUR.
4.7 Transuretrální resekce tumoru močového měchýře TaT1
Malé tumory mohou být resekovány v 1 vzorku, který zahrnuje celý tumor a část okolní stěny močového měchýře. Větší tumory je nutné resekovat po jednotlivých částech. Nejprve je odstraněna exofytická tkáň tumoru a následně je resekována okolní stěna močového měchýře až do svaloviny. Bez resekce svaloviny není patolog schopen rozlišit mezi stadii Ta, T1 a T2. V případě velkých tumorů se z důvodu možné přítomnosti CIS doporučuje resekovat odděleně také okraje. Skladování resekovaných vzorků ze 3 různých oblastí resekce ve 3 oddělených kontejnerech umožní patologovi stanovení správné diagnózy. Abychom předešli destrukci tkáně, je třeba se pokud možno vyhnout kauterizaci. Nekrotická a kauterizovaná tkáň znesnadňují určení správného stadia a grade tumoru. Pro stanovení správné prognózy je nutné kompletní a správné provedení TUR [21].
4.8 Biopsie močového měchýře
Karcinomy močového měchýře jsou ve většině případů multifokální. CIS, dysplazie, zánět atd se mohou jevit jako začervenalé, samet připomínající oblasti nebo nejsou vůbec viditelné.
V případě, že je zbylá sliznice močového měchýře normální, a výsledek cytologie je negativní (s výjimkou papilárního tumoru), se rutinní provádění randomizované biopsie nedoporučuje. Pravděpodobnost detekce CIS je v tomto případě velmi nízká a výběr adjuvantní intravezikální terapie není ovlivněn výsledkem biopsie [22] (úroveň důkazu 2a).
V případě pozitivního výsledku cytologie nebo detekce abnormálních oblastí urotelu se však doporučuje provedení studené biopsie nebo biopsie s resekční kličkou. Vzorky odebrané při tomto typu biopsie (také nazývané jako selektivní biopsie) je třeba skladovat v samostatných kontejnerech. V případě, že je tumor lokalizován na trigonu nebo hrdle močového měchýře, v případě podezření na CIS nebo v případě pozitivního výsledku cytologie, je nutné provést biopsii prostatické uretry.
4.9 Fluorescenční cystoskopie
Standardní cystoskopie a TUR se provádějí pomocí bílého světla. Užívání bílého světla je však spojeno s rizikem přehlédnutí přítomných, ale neviditelných lézí.
Fluorescenční cystoskopie, která se provádí pomocí modrého světla a fotosensitizéru, (hex)aminolevulové kyseliny (HAL nebo ALA), pomůže odhalit místa, která jsou podezřelá na přítomnost CIS nebo vznik papilárního tumoru, která nelze detekovat pomocí cystoskopie užívající bílé světlo [23-25]. Tato metoda však ještě nebyla zařazena do běžné praxe.
4.10 Opakovaná resekce
Přestože se může zdát, že odstranění močového měchýře pomocí TUR představuje snadnou techniku, byla po operaci zaznamenána vysoká incidence vzniku nového tumoru nebo přítomnost reziduálního tumoru [26] (úroveň důkazu 1).
V případě, že při první resekci nebyl odstraněn celý tumor (např. u pacienta s větším počtem tumorů a/nebo tumorů o velkém rozměru nebo v případě, že vzorek neobsahuje žádnou svalovou tkáň), se doporučuje opakované provedení TUR. To se doporučuje také v případě, že během počáteční TUR byla detekována přítomnost TaT1 tumoru o vysokém grade.
Pravděpodobnost, že došlo k podhodnocení TaT1G3 tumoru, který je ve skutečnosti svalovinu invadující, je přibližně 10% [26,27]. Správné stanovení stadia je důležité, nebo léčba tumorů TaT1G3 a T2 je úplně rozdílná.
Bylo prokázáno, že opakované provedení TUR vede ke snížení míry recidivy a zlepšení prognózy [28] (úroveň důkazu 2a). V otázce načasování druhé TUR nebylo dosaženo konsenzu, ale obvykle se operace provádí 2–6 týdnů po první TUR.
4.11 Doporučení pro hodnocení tumorů TaT1
- renální ultrasonografie a ultrasonografie močového měchýře a/nebo IVU ve vybraných případech (tumory 3 grade)
- cystoskopie s charakteristikou tumoru: lokalizace, vzhled (doporučuje se provedení diagramu močového měchýře)
- rozbor moči
- cytologické vyšetření moči
- u malých tumorů jednorázová TUR, zahrnující část okolní stěny močového měchýře
- u velkých tumorů TUR ve více částech (zahrnující svalovou tkáň)
- selektivní biopsie abnormálně vypadajícího urotelu
- v případě tumoru hrdla močového měchýře nebo podezření na CIS biopsie prostatické uretry
5. ADJUVANTNÍ LÉČBA
5.1 Jednorázová instilace prováděná hned po operaci
Přestože nejnovější metody TUR umožňují celkovou resekci Ta, T1 tumorů, u velkého počtu pacientů dojde k recidivě a v omezeném počtu případů k progresi onemocnění do stadia invaze svaloviny. Vysoká variabilita 3měsíční míry recidivy (výsledek cystoskopie 3 měsíce po TUR) prokazuje, že u významného procenta pacientů není TUR kompletní nebo u nich dojde k recidivě [21]. Je tedy absolutně nezbytné, aby všichni pacienti podstoupili adjuvantní terapii v podobě intravezikální chemoterapie.
Metaanalýza [29] (úroveň důkazu 1a) 7 randomizovaných studií (zahrnující 1 476 pacientů se střední dobou sledování 3,4 roku) prokázala, že 1 okamžitá instilace chemoterapeutik po TUR snižuje relativní riziko recidivy o 40 %.
Jediná instilace přináší benefit jak u pacientů s jedním tumorem, tak u pacientů s vícečetnými tumory. Účinek instilace lze vysvětlit destrukcí cirkulujících buněk karcinomu hned po TUR nebo ablativním účinkem (chemoresekce) reziduálních buněk tumoru v místě resekce.
Důležité je správné načasování instilace. Ve všech studiích je instilace aplikována během 24 hod. Pouze jediná studie uvádí, že pakliže nebyla první instilace aplikována během 24 hod, došlo ke dvojnásobnému zvýšení rizika recidivy [30].
S ohledem na účinnost jsou všechny agens srovnatelné. Účinek byl prokázán při aplikaci mitomycinu C, epirubicinu a doxorubicinu [29].
Přestože se dříve pooperační instilace doporučovala pouze u pacientů s jediným tumorem nízkého grade, v současné době se doporučuje ji aplikovat u všech pacientů. U pacientů, u nichž došlo k extravazaci medikamentu, však byly zaznamenány závažné komplikace [31]. Okamžitá instilace se tedy nedoporučuje v případě intra - nebo extra peritoneální perforace (nebo podezření na perforaci), k níž obvykle dochází při rozsáhlé TUR.
Metaanalýza prokázala, že aplikace jediné pooperační instilace umožní u každých 12 ze 100 pacientů předejít opakovanému provádění TUR, což znamená, že abychom zabránili 1 recidivě, je třeba léčit 8,5 pacientů. Vzhledem k tomu, že ve většině zemí převyšuje cena TUR, anestezie a hospitalizace cenu 8,5 instilací, lze tuto metodu považovat za cenově výhodnou.
5.2 Doplňující adjuvantní intravezikální instilace
Nutnost provádět další adjuvantní intravezikální terapii závisí na prognostickém riziku vzniku povrchového tumoru močového měchýře. U pacientů s nízkým rizikem umožňuje jediná okamžitá instilace snížení míry recidivy [29] (úroveň důkazu 1). U této skupiny pacientů lze tuto metodu považovat za standardní léčbu. U ostatních pacientů však z důvodu recidivy a/nebo progrese onemocnění představuje pouze neúplnou léčbu.
Účinek okamžité instilace nastupuje během 1. a 2. roku [32,33] (úroveň důkazu 1). Na základě údajů 5 randomizovaných studií bylo zjištěno [33], že snížení rizika recidivy přetrvá po dobu přibližně 500 dní. Výběr mezi chemoterapií a imunoterapií závisí zejména na druhu rizika, které je třeba omezit - recidivy nebo progrese. Adjuvantní chemoterapie představuje účinný způsob prevence recidivy u pacientů s tumory nízkého grade. U pacientů s tumory vysokého grade se jako účinnější metoda léčby jeví terapie BCG. 2 metaanalýzy prokázaly, že BCG terapie umožňuje zabránit, nebo alespoň oddálit progresi tumoru [34,35] (úroveň důkazu 1a). Metaanalýza údajů European Organization for Research and Treatment of Cancer (EORTC) a Medical Research Council (MRC) [36] (úroveň důkazu 1a) srovnávající intravezikální chemoterapii versus samotnou TUR prokázala, že chemoterapie umožňuje prevenci recidivy ale nikoliv progrese.
Stále zůstává otázkou, jak často a po jakou dobu intravezikální instilaci aplikovat. EORTC zaznamenala, že intravezikální aplikace chemoterapie jednou měsíčně po dobu 1 roku versus jednou měsíčně po dobu půl roku nevede ke snížení míry recidivy [37] (úroveň důkazu 2). Japonská studie toto zjištění potvrdila [38] (úroveň důkazu 3). Další randomizovaná studie uvádí snížení míry recidivy po 1leté aplikaci epirubicinu (19 instilací), ve srovnání s 3 měsíční aplikací v 9 instilacích [39] (úroveň důkazu 3). Tyto protichůdné údaje ukazují, že optimální režim instilace nebyl dosud stanoven.
5.3 Optimalizace intravezikální chemoterapie
Jedna randomizovaná studie prokázala, že přizpůsobení pH moči, snížení výdeje moči a pufrace intravezikálního roztoku vedou ke snížení míry recidivy [40] (úroveň důkazu 2a). Jiná randomizovaná studie uvádí, že správná koncentrace je významnější než trvání léčby [41] (úroveň důkazu 2a). S přihlédnutím k těmto zjištěním (která vyžadují potvrzení) je vhodné pacientům doporučit, aby ráno před instilací nepřijímali žádné tekutiny. Dále se doporučuje rozpustit medikament v roztoku s vhodným pH.
5.4 Intravezikální instilace bacilu Calmettova-Guerinova (BCG) – imunoterapie
5.4.1 Indikace pro BCG
Přestože je aplikace BCG považována za velmi účinnou metodu léčby, vzhledem ke zvýšenému riziku toxicity se tato terapie nedoporučuje u všech pacientů s povrchovým karcinomem močového měchýře. Výběr léčby závisí na míře rizika recidivy a progrese onemocnění u jednotlivých pacientů (viz kapitola 5.5). U pacientů s tumorem nízkého grade aplikace BCG neovlivňuje přirozený průběh onemocnění, a lze ji tedy u této skupiny pacientů považovat za nadbytečnou.
U pacientů s tumorem s vysokým rizikem, kteří nepodstoupili cystektomii, neexistují v otázce režimu léčby žádné nejasnosti. Benefit intravezikální aplikace BCG je výraznější u pacientů s vícečetnými tumory T1G2, tumory Ta-T1G3 s nebo bez CIS a samotným CIS (kdy k progresi dojde u ³ 15 %) než u pacientů se středním rizikem, kteří mají nižší riziko progrese [42,43] (úroveň důkazu 1).
Léčba pacientů se středním rizikem (multifokálními T1G1, TaG2 a samotným T1G2) je poněkud diskutabilnější. U těchto pacientů terapie sestává z úplné TUR následované intravezikální chemoterapií nebo intravezikální BCG. Hlavní cíl léčby tumorů se středním rizikem spočívá v prevenci recidivy a progrese onemocnění (kdy s větší pravděpodobností dochází k recidivě). Millan-Rodriguez et al zjistili, že zatímco k recidivě onemocnění dojde přibližně u 45 % pacientů, pravděpodobnost progrese do stadia onemocnění invadujícího svalovinu je u těchto pacientů nižší – přibližně 1,8 % [44].
Kapitola 5.5 uvádí výpočet rizika recidivy a progrese onemocnění (dlouhodobé i krátkodobé).
5.4.2 BCG umožňuje oddálení nebo prevenci vzniku svalovinu invadujícího onemocnění
Přestože v prevenci recidivy dosahuje BCG lepšího výsledku než chemoterapie [45], až do nedávné doby nebylo jasné, zda BCG umožňuje oddálení nebo prevenci svalovinu invadujícího onemocnění, nebo nikoliv. EORTC provedla metaanalýzu poskytující odpovědi na tuto otázku [34] (úroveň důkazu 1). Celkem bylo nashromážděno 24 randomizovaných studií, které zahrnovaly informace týkající se progrese 4 863 pacientů.
3 967 (81,6 %) pacientů mělo pouze papilární tumor a 896 (18,4 %) mělo primární nebo konkomitantní CIS. Při léčbě bylo užito 5 různých typů BCG a ve 20 ze 24 studií byla prováděna nějaká forma udržovací terapie. Pouze ve 4 studiích byl proveden 6týdenní indukční cyklus. Během střední doby sledování 2,5 roku (a maximální doby 15 let) došlo k progresi u 260 z 2 658 pacientů (9,8 %) léčených BCG a 304 z 2 205 (13,8 %) pacientů v kontrolní skupině (samotná TUR, TUR plus intravezikální chemoterapie nebo TUR plus jiný typ imunoterapie). Na základě těchto údajů lze vyvodit závěr, že léčba BCG umožňuje 27% snížení rizika progrese onemocnění (p = 0,00001). Snížení rizika je srovnatelné u pacientů s papilárními tumory Ta, T1 a pacientů s CIS.
5.4.3 Pro dosažení nejlepšího výsledku je nutné provádět udržovací terapii
Tato stejná metaanalýza [34] prokázala, že benefit měli pouze ti pacienti, kteří podstoupili udržovací režim BCG. Ve 4 studiích, v nichž pacienti nepodstoupili udržovací terapii, nebylo zaznamenáno žádné snížení míry progrese onemocnění. V dalších 20 studiích, v nichž pacienti podstoupili udržovací terapii ve formě BCG, bylo zaznamenáno 37% snížení rizika progrese (p = 0,00004). Metaanalýza však neprokázala, který režim udržující terapie s aplikací BCG byl nejúčinnější. Bohle et al ve své metaanalýze prokázali, že k důkazu lepšího účinku BCG oproti mitomycinu C při prevenci recidivy je nutné udržovací terapii provádět po dobu minimálně 1 roku.
5.4.4 Toxicita BCG
Pokud předpokládáme, že pro dosažení nejlepšího výsledku je nutné provádět udržovací terapii, musíme se zabývat otázkou toxicity této léčby. Vzhledem k tomu, že je léčba BCG ve srovnání s intravezikální chemoterapií spojena s častějším výskytem vedlejších účinků, mnozí lékaři se zahájením této terapie stále váhají. Původní časné publikace, které uvádějí úmrtí způsobená sepsí vyvolanou aplikací BCG a prokazují, že až u 90 % pacientů léčených BCG dojde ke vzniku cystitidy, významným způsobem negativně ovlivnily přístup k této léčbě.
Vzhledem k lepším zkušenostem při aplikaci BCG jsou nyní vedlejší účinky méně závažné a v nejnovější literatuře bylo zaznamenáno minimum úmrtí způsobených léčbou BCG. Závažné vedlejší účinky se vyskytují u méně než 5 % pacientů a prakticky ve všech případech je lze účinně vyléčit [46] (úroveň důkazu 2).
5.4.5 Nejvhodnější režim aplikace BCG
Přestože některé studie uvádějí různé modifikace, indukční BCG je zpravidla aplikována na základě empirického 6týdenního režimu, který Morales doporučil již před 30 lety. V rámci udržovací terapie se však užívají různé režimy dávkování – od 10 instilací aplikovaných během 18 týdnů až po 30 instilací aplikovaných v průběhu 3 let [47]. Optimální počet instilací a doba trvání udržovací terapie však nebyly doposud stanoveny.
5.4.6 Nejvhodnější dávkování BCG
Pro snížení toxicity BCG někteří autoři doporučují instilaci pouze 1/3 nebo 1/4 dávky. Spanish Oncology Group (CUETo) však při srovnávání účinnosti aplikace 1/3 dávky a celé dávky BCG u 500 pacientů neznamenala žádný rozdíl. Někteří autoři se však domnívají, že při léčbě multifokálního onemocnění lze lepšího výsledku dosáhnout při aplikaci celé dávky BCG [48,49] (úroveň důkazu 2). Přestože při aplikaci nižší dávky se toxicita projevila u menšího počtu pacientů, incidence závažné systémové toxicity byla při aplikaci standardní i nižší dávky srovnatelná. Pro stanovení optimální dávky BCG (v indukčním i udržovacím režimu) je nutný další výzkum [50].
5.4.7 Doporučení pro aplikaci BCG
- instilace BCG je při prevenci recidivy účinnější než chemoterapie
- vhodnými kandidáty pro BCG terapii jsou pacienti s onemocněním se středním a vysokým rizikem
- BCG umožňuje oddálit nebo zabránit invazi tumoru do svaloviny
- pro dosažení nejlepšího účinku je nutné provádět udržovací terapii, doposud však nebyl definován nejvhodnější režim a velikost dávky
- udržovací terapii se doporučuje podávat po dobu alespoň jednoho roku
5.5 Predikce recidivy a progrese tumorů TaT1
Klasický způsob rozdělení pacientů s tumory TaT1 do rizikových skupin spočívá v užívání prognostických faktorů získaných z multivarietní analýzy. Na základě této metody lze pacienty rozdělit do skupin s nízkým rizikem (50 %), středním rizikem (35 %) a vysokým rizikem (15 %) [44]. Při užívání této klasifikace však není možné rozlišit riziko recidivy a progrese onemocnění. I v případě, že prognostické faktory indikují vysoké riziko recidivy, může být riziko progrese nízké a jiné tumory mohou být spojeny s vysokým rizikem jak recidivy, tak progrese.
EORTC vytvořila klasifikační systém a tabulky klasifikující riziko onemocnění, které umožňují u jednotlivých pacientů odděleně predikovat krátkodobé a dlouhodobé riziko recidivy a progrese [4]. Tyto tabulky byly vytvořeny na základě údajů EORTC databáze zahrnující 2 596 pacientů s tumorem TaT1, kteří byli randomizováni do sedmi EORTC studií.
Klasifikační systém je založen na hodnocení 6 nejvýznamnějších klinických a patologických faktorů:
- počet tumor
- velikost tumoru
- dřívější míra recidivy
- kategorie T
- výskyt CI
- grade tumoru
Po 1 roce se pravděpodobnost recidivy onemocnění pohybuje mezi 15 % a 61% a pravděpodobnost progrese mezi 0,2 % a 17 %. Po 5 letech sledování se míra recidivy pohybuje v rozmezí 31–78 % a míra progrese v rozmezí 0,8 –45 % (tab. 3, 4).
Tab. 3. Proměnné užívané k výpočtu skóre recidivy a progrese. 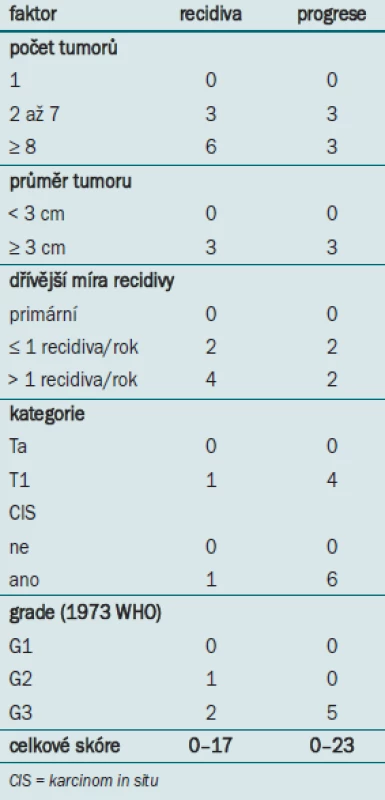
Tab. 4. Pravděpodobnost recidivy a progrese stanovená na základě skóre. 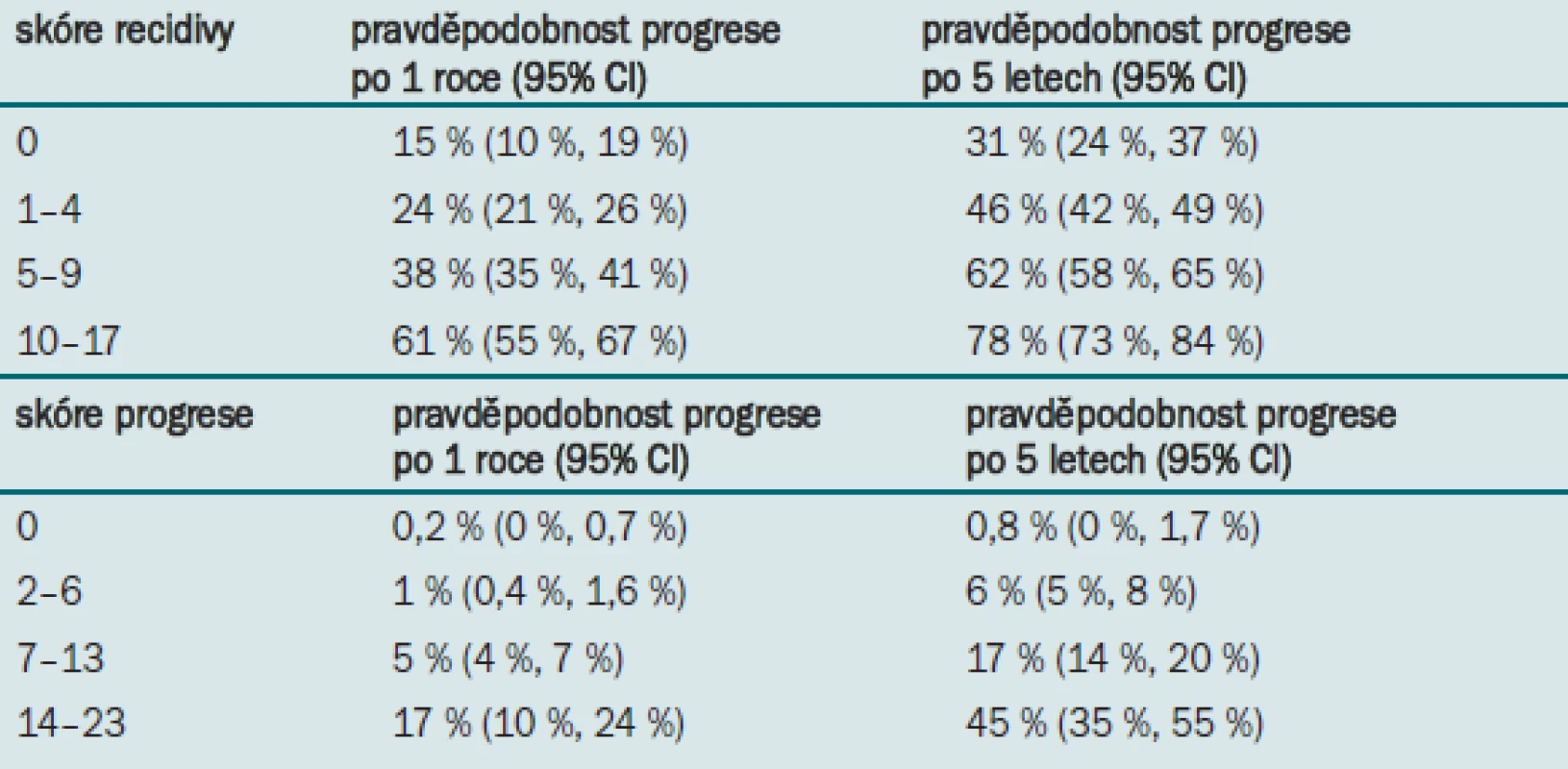
Tyto tabulky umožňují urologovi prodiskutovat s pacientem jednotlivé možnosti léčby (1 pooperační instilace, adjuvantní intravezikální chemoterapie, adjuvantní intravezikální BCG, nebo v nejhorším případě cystektomie).
5.5.1 Doporučení pro intravezikální chemoterapii nebo BCG
- u pacientů s nízkým nebo středním rizikem recidivy a nízkým rizikem progrese se jako adjuvantní léčba doporučuje 1 okamžitá instilace chemoterapeutika
- u pacientů s nízkým až středním rizikem progrese, bez ohledu na riziko recidivy onemocnění, se doporučuje po pooperační instilaci chemoterapeutika provádět udržovací terapii (instilaci chemoterapeutik po dobu dalších 6–12 měsíců nebo intravezikální instilaci BCG po dobu alespoň 1 roku)
- u pacientů s vysokým rizikem progrese se doporučuje intravezikální aplikace BCG (udržovací terapie po dobu alespoň 1 roku) nebo okamžitá radikální cystektomie
- na základě absolutního rizika recidivy a progrese onemocnění nelze zcela přesně stanovit, jaký typ léčby je vhodný u jednotlivého pacienta s daným rizikem, výběr léčby je nutné posuzovat u každého pacienta individuálně – jaké riziko je akceptovatelné pro konkrétního pacienta a urologa
5.6 Léčba po selhání instilační terapie
Selhání adjuvantní intravezikální terapie nebylo doposud vhodně definováno. Přestože ve většině případů je důvodem indikace cystektomie progrese onemocnění do stadia, kdy nádor invaduje svalovinu, existují další znaky, které mohou indikovat selhání intravezikální instilace.
Léčbu lze považovat za neúspěšnou v případě, že je během ní detekován tumor vyššího grade nebo kategorie T nebo karcinom in situ (Tis). Za selhání lze považovat i recidivu (i v případě stejného grade a kategorie T) onemocnění 3 a 6 měsíců po léčbě, nebo další intravezikální instilace jsou účinné pouze u malého počtu pacientů [51] (úroveň důkazu 3). Recidiva 3 měsíce po léčbě se za selhání nepovažuje, nebo další léčba vede u 1/5 pacientů k úplnému vyléčení onemocnění.
U jiných pacientů vede k remisi nahrazení aplikace BCG instilací chemoterapeutik. U pacientů s papilárními tumory s vysokým grade se doporučuje z důvodu rizika invaze tumoru do svaloviny, nebo dokonce vzniku metastáz v tomto stadiu onemocnění provést cystektomii.
Doposud nebyla definována doba, za kterou dojde k odezvě na intravezikální terapii. Přestože je známým faktem, že při BCG imunoterapii se imunitní reakce dostaví až po nějaké době, není jasné, jak dlouho vyčkávat na odezvu, aniž bychom pacienta ohrozili. Oddálení cystektomie může vést k progresi onemocnění, vzniku metastáz, a dokonce úmrtí na karcinom močového měchýře.
Pacientům, u nichž se po 6 měsících od zahájení aplikace BCG neprojeví žádný účinek, se doporučuje nabídnout možnost radikální cystektomie. Vznik nových povrchových tumorů, následné provádění TUR, intravezikální instilace atd mohou vést ke snížení kvality močového měchýře (kapacita, urgence, bolest) a ve vybraných případech musí pacient podstoupit cystektomii.
5.7 Sledování pacientů s tumorem močového měchýře TaT1
řada urologů provádí často v rámci sledování pacientů s tumory močového měchýře TaT1 po celý zbytek jejich života cystoskopii. Tento postup není nezbytný z následujících důvodů [52]:
- přibližně polovina pacientů s tumorem močového měchýře TaT1 má velmi nízké riziko recidivy a minimální riziko progrese onemocnění
- pravděpodobnost recidivy tumoru s nízkým rizikem není vysoká a v případě, že k ní dojde, je recidiva téměř vždy nízkého stadia a nízkého grade, neléčení nebo přehlédnutí těchto nádorů s nízkým rizikem pacienta nepoškodí [53-58].
- u pacientů se špatnými prognostickými faktory tomu je však přesně naopak (T1G3, CIS)
- výsledek první cystoskopie 3 měsíce po TUR představuje velmi důležitý prognostický faktor recidivy a progrese. Bohužel nemáme k dispozici žádné randomizované studie, které by zkoumaly možnost bezpečného snížení počtu kontrolních cystoskopií. Z tohoto důvodu vycházejí následující doporučení z retrospektivních údajů a nikoliv z údajů založených na důkazech.
5.7.1 Doporučení pro sledování pomocí cystoskopie
- u pacientů s tumory (TaG1) s nízkým rizikem (50 % všech pacientů) se doporučuje cystoskopii provádět po 3 měsících. V případě negativního výsledku se další cystoskopie doporučuje po 9 měsících a jednou za rok v průběhu dalších 5 let.
- u pacientů s vysokým rizikem (15 % všech pacientů) se doporučuje cystoskopii provádět po 3 měsících. V případě negativního výsledku se doporučuje cystoskopii opakovat jednou za 3 měsíce po dobu 2 let, jednou za 4 měsíce po dobu dalšího roku a každých 6 měsíců po dobu dalších 2 let. Po uplynutí této doby stačí cystoskopii provádět jednou za rok. Jednou za rok se doporučuje provést IVU.
- u pacientů se středním rizikem (přibližně 1/3 pacientů) se doporučuje sledovací schéma spadající mezi obě dvě výše uvedené možnosti přizpůsobené osobním a subjektivním faktorům
6. LITERATURA
1. Oosterlinck W, Lobel B, Jakse G, Malmstrom PU, Stockle M, Sternberg C; European Association of Urology (EAU) Working Group on Oncological Urology. Guidelines on bladder cancer. Eur Urol 2002;24 : 105-112.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12074395&query_hl=13&itool=pubmed_docsum
2. Oosterlinck W, Solsona E, van der Meijden APM, Sylvester R, Boehle A, Rintala E, Lobel B; European Association of Urology. EAU guidelines on diagnosis and treatment of upper urinary tract transitional cell carcinoma. Eur Urol 2004;46 : 147-154.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids= 15245806&query_hl=7&itool=pubmed_docsum
3. van der Meijden APM, Sylvester R, Oosterlinck W, Solsona E, Boehle A, Lobel B, Rintala E; for the EAU Working Party on Non Muscle Invasive Bladder Cancer. EAU guidelines on the diagnosis and treatment of urothelial carcinoma in situ. Eur Urol 2005; 48 : 363-371.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15994003&query_hl=15&itool=pubmed_docsum
4. Sylvester RJ, van der Meijden AP, Oosterlinck W, Witjes A, Bouffioux C, Denis L, Newling D, Kurth K. Predicting recurrence and progression in individual patients with stage TaT1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials. Eur Urol 2006;49 : 466-477.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=16442208&query_hl=17&itool=pubmed_docsum
5. Sobin DH, Wittekind Ch., eds. pp. 199-202 In: TNM classification of malignant tumours. 6th edn. New York: Wiley-Liss, 2002.
6. Epstein JI, Amin MB, Reuter VR, Mostofi FK. The World Health Organization/International Society of Urological Pathology consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder. Am J Surg Pathol 1998;22 : 1435-48.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=9850170&query_hl=13&itool=pubmed_docsum
7. Sauter G, Algaba F, Amin M, Busch C, Cheville J, Gasser T, Grignon DJ, Hofstadter F, Lopez-Beltran A, Epstein JI. Tumours of the urinary system: non-invasive urothelial neoplasias. In: Eble JN, Sauter G, Epstein Jl, Sesterhenn I, eds. WHO classification of classification of tumours of the urinary system and male genital organs. Lyon: IARCC Press, 2004.
8. Mostofi FK, Davis CJ, Sesterhenn IA. Histological typing of urinary bladder tumours. In: World Health Organization international histologic classification of tumours. 2nd edn. Heidelberg: Springer-Verlag, 1999.
9. Lopez-Beltran A, Montironi R. Non-invasive urothelial neoplasms: according to the most recent WHO classification. Eur Urol 2004;46 : 170-176.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15245809&query_hl=23&itool=pubmed_docsum
10. Murphy WM, Takezawa K, Maruniak NA. Interobserver discrepancy using the 1998 WHO/ISUP classification of urothelial neoplasms: practical choices for patient care. J Urol 2002;168 : 968-972.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12187201&query_hl=28&itool=pubmed_docsum
11. Bol M, Baak J, Buhr-Wildhagen S, Kruse AJ, Kjellevold K, Janssen E, Mestad O, Ogreid P. Reproducibility and prognostic variability of grade and lamina propria invasion in stages Ta, T1 urothelial carcinoma of the bladder. J Urol 2003;169 : 1291-1294.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=1262934 5&query_hl=25&itool=pubmed_docsum
12. McCahy PJ, Harris CA, Neal E. The accuracy of recording of occupational history in patients with bladder cancer. Br J Urol 1997;79 : 91-93.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=9043504&query_hl=31&itool=pubmed_docsum
13. Zeegers MP, Tan FE, Dorant E, van den Brandt PA. The impact of characteristics of cigarette smoking on urinary tract cancer risk: a meta-analysis of epidemiologic studies. Cancer 2000;89 : 630-639.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10931463&query_hl=34&itool=pubmed_docsum
14. Aveyard P, Adab P, Cheng K, Wallace D, Hey K, Murphy M. Does smoking status influence the prognosis of bladder cancer ? A systematic review. BJU Int 2002;90 : 228-239.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=1213305 7&query_hl=32&itool=pubmed_docsum
15. Goessl C, Knispel HH, Millar K, Klan R. Is routine excretory urography necessary at first diagnosis of bladder cancer? J Urol 1997;157 : 480-481.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=8996338&query_hl=40&itool=pubmed_docsum
16. Herranz-Amo F, Diez-Cordero JM, Verdu-Tartajo F, Bueno-Chomon G, Leal-Hernandez F, Bielsa-Carillo A. Need for intravenous urography in patients with primary transitional carcinoma of the bladder. Eur Urol 1999;36 : 221-224.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10450006&query_hl=43&itool=pubmed_docsum
17. Holmang S, Hedelin H, Anderstrom C, Holmberg E, Johansson SL. Long-term follow-up of a bladder carcinoma cohort: routine followup urography is not necessary. J Urol 1998;160 : 45-48.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=9628602&query_hl=50&itool=pubmed_docsum
18. Glas A, Roos D, Deutekom M, Zwinderman A, Bossuyt P, Kurth K. Tumor markers in the diagnosis of primary bladder cancer. A systematic review. J Urol 2003;169 : 1975-1982.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12771702&query_hl=53&itool=pubmed_docsum
19. Lotan Y, Roehrborn CG. Sensitivity and specificity of commonly available bladder tumor markers versus cytology: results of a comprehensive literature review and meta-analysis. Urology 2003;61 : 109-118.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12559279&query_hl=59&itool=pubmed_docsum
20. Van Rhijn BW, van der Poel HG, van der Kwast TH. Urine markers for bladder cancer surveillance: a systematic review. Eur Urol 2005;47 : 736-748.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15925067&query_hl=56&itool=pubmed_docsum
21. Brausi M, Collette L, Kurth K, van der Meijden A, Oosterlinck W, Witjes JA, Newling D, Bouffioux C, Sylvester R; EORTC Genito-Urinary Tract Cancer Collaborative Group. Variability in the recurrence rate at first follow-up cystoscopy after TUR in stage Ta T1 transitional cell carcinoma of the bladder: a combined analysis of seven EORTC studies. Eur Urol 2002;41 : 523-531.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12074794&query_hl=62&itool=pubmed_docsum
22. van der Meijden A, Oosterlinck W, Brausi M, Kurth KH, Sylvester R, de Balincourt C. Significance of bladder biopsies in Ta,T1 bladder tumors: a report of the EORTC Genito-Urinary Tract Cancer Cooperative Group. EORTC-GU Group Superficial Bladder Committee. Eur Urol 1999;35 : 267-271.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10419345&query_hl=65&itool=pubmed_docsum
23. Schmidbauer J, Witjes F, Schmeller N, Donat R, Susani M, Marberger M; Hexvix PCB301/01 Study Group. Improved detection of urothelial carcinoma in situ with hexaminolevulinate fluorescence cystoscopy. J Urol 2004;171 : 135-138.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=14665861&query_hl=69&itool=pubmed_docsum
24. Jichlinski P, Guillou L, Karlsen SJ, Malmstrom PU, Jocham D, Brennhovd B, Johansson E, Gartner T, Lange N, van den Bergh H, Leisinger HJ. Hexyl aminolevulinate fluorescence cystoscopy: a new diagnostic tool for photodiagnosis of superficial bladder cancer - a multicenter study. J Urol 2003;170 : 226-229.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12796694&query_hl=71&itool=pubmed_docsum
25. Zaak D, Kriegmair M, Stepp H, Baumgartner R, Oberneder R, Schneede P, Corvin S, Frimberger D, Knuchel R, Hofstetter A. Endoscopic detection of transitional cell carcinoma with 5-aminolevulic acid: results of 1012 fluorscenic endoscopies. Urology 2001;57 : 690-694.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=11306382&query_hl=84&itool=pubmed_docsum
26. Miladi M, Peyromaure M, Zerbib M, Saighi D, Debre B. The value of a second transurethral resection in evaluating patients with bladder tumours. Eur Urol 2003;43 : 241-245.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12600426&query_hl=86&itool=pubmed_docsum
27. Jakse G, Algaba F, Malmstrom PU, Oosterlinck W. A second-look TUR in T1 transitional cell carcinoma: why? Eur Urol 2004;45 : 539-546.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15082193&query_hl=89&itool=pubmed_docsum
28. Brauers A, Buettner R, Jakse G. Second resection and prognosis of primary high risk superficial bladder cancer: is cystectomy often too early? J Urol 2001;165 : 808-810.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=11176474&query_hl=94&itool=pubmed_docsum
29. Sylvester R, Oosterlinck W, van der Meijden A. A single immediate postoperative instillation of chemotherapy decreases the risk of recurrence in patients with stage Ta T1 bladder cancer: a metaanalysis of published results of randomized clinical trials. J Urol 2004;171 : 2186-2190.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15126782&query_hl=97&itool=pubmed_docsum
30. Kaasinen E, Rintala E, Hellstrom P, Viitanen J, Juusela H, Rajala P, Korhonen H, Liukkonen T; FinnBladder Group. Factors explaining recurrence in patients undergoing chemoimmunotherapy regimens for frequently recurring superficial bladder carcinoma. Eur Urol 2002;42 : 167-174.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12160589&query_hl=10&itool=pubmed_docsum
31. Oddens JR, van der Meijden A, Sylvester R. One immediate postoperative instillation of chemotherapy in low risk Ta, T1 bladder cancer patients. Is it always safe? Eur Urol 2004;46 : 336-338.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15306104&query_hl=102&itool=pubmed_docsum
32. Solsona E, Iborra I, Ricos JV, Monros JL, Casanova J, Dumont R. Effectiveness of a single immediate mitomycin C instillation in patients with low risk superficial bladder cancer: short and long-term followup. J Urol 1999;161 : 1120-1123.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10081851&query_hl=107&itool=pubmed_docsum
33. Hinotsu S, Akaza H, Ohashi Y, Kotake T. Intravesical chemotherapy for maximum prophylaxis of new early phase superficial bladder carcinoma treated by transurethral resection: a combined analysis of trials by the Japanese Urological Cancer Research Group using smoothed hazard function. Cancer 1999;86 : 1818-1826.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10547556&query_hl=109&itool=pubmed_docsum
34. Sylvester RJ, van der Meijden, Lamm DL. Intravesical bacillus Calmette-Guerin reduces the risk of progression in patients with superficial bladder cancer: a combined analysis of the published results of randomized clinical trials. J Urol 2002;168 : 1964-1970.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12394686&query_hl=114&itool=pubmed_docsum
35. Bohle A, Bock PR. Intravesical bacillus Calmette-Guerin versus mitomycin C in superficial bladder cancer: formal meta-analysis of comparative studies on tumor progression. Urology 2004;63 : 682-687.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15072879&query_hl=125&itool=pubmed_docsum
36. Pawinski A, Sylvester R, Kurth KH, Bouffioux C, van der Meijden A, Parkmar MK, Bijnens L. A combined analysis of European Organization for Research and Treatment of Cancer, and Medical Research Council randomized clinical trials for the prophylactic treatment of TaT1 bladder cancer. European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group and the Medical Research Council Working Part on Superficial Bladder Cancer. J Urol 1996;156 : 1934-1941.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=8911360&query_hl=127&itool=pubmed_docsum
37. Bouffioux C, Kurth K, Bono A, Oosterlinck W, Kruger CB, De Pauw M, Sylvester R. Intravesical adjuvant chemotherapy for superficial transitional cell bladder carcinoma: results of 2 European Organization for Research and Treatment of Cancer randomized trials with mitomycin C and doxorubicin comparing early versus delayed instillations and short-term versus long-term treatment. European Organization for Research and Treatment of Cancer Genitourinary Group. J Urol 1995;153 : 934-941.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=7853578&query_hl=129&itool=pubmed_docsum
38. Nomata K, Noguchi M, Kanetake M, Tsuda N, Hayashi M, Yamashita S, Sakuragi T, Kusaba Y, Shindo K; Nagasaki Clinical Research Group for Bladder Cancer. Intravesical adjuvant chemotherapy for superficial transitional bladder cancer: results of a randomised trial with epirubicin comparing short and long-term maintenance treatment. Cancer Chemother Pharmacol 2002;50 : 266-270.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12357299&query_hl=5&itool=pubmed_docsum
39. Koga G, Kuroiwa K, Yamaguchi A. Osada Y, Tsuneyoshi M, Naito S. A randomized controlled trial of short - term versus long-term prohylactic intravesical instillation chemotherapy for recurrence after transurethral resection of Ta/T1 transitional cell carcinoma of the bladder. J Urol 2004;171 : 153-157.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=14665865&query_hl=8&itool=pubmed_docsum
40. Au JL, Baladament RA, Wientjes MG, Young DC, Warner JA, Venema PL, Pollifrone DL, Harbrecht JD, Chin JL, Lerner SP, Miles BJ; International Mitomycin C Consortium. Methods to improve efficacy of intravesical mitomycin C: results of an randomized phase III trial. J Natl Cancer Inst 2001;93 : 597-604.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=11309436&query_hl=12&itool=pubmed_docsum
41. Kuroda M, Niijima T, Kotake T, Akaza H, Hinotsu S; 6th Trial of the Japanese Urological Cancer Research Group. Effect of prophylactic treatment with intravesical epirubicin on recurrence of superficial bladder cancer - The 6th Trial of the Japanese Urological Cancer Research Group (JUCRG): a randomized trial of intravesical epirubicin at dose of 20mg/40ml, 30 mg/40 ml, 40 mg/40 ml. Eur Urol 2004;45 : 600-605.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15082202&query_hl=14&itool=pubmed_docsum
42. Shelley MD, Wilt TJ, Court J, Coles B, Kynaston H, Mason MD. Intravesical bacillus Calmette-Guerin is superior to mitomycin C in reducing tumour recurrence in high-risk superficial bladder cancer: a meta-analysis of randomized trials. BJU Int 2004;93 : 485-490.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=15008714&query_hl=5&itool=pubmed_docsum
43. Huncharek, Kupelnick B. Impact of intravesical chemotherapy versus BCG immunotherapy on recurrence of superficial transitional cell carcinoma of the bladder. Am J Clin Oncol 2003;26 : 402-407.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12902895&query_hl=18&itool=pubmed_docsum
44. Millan-Rodriguez F, Chéchile-Toniolo G, Salvador-Bayarri J, Palou J, Vicente-Rodriguez J. Multivariate analysis of the prognostic factors of primary superficial bladder cancer. J Urol 2000;163 : 73-78.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10604317&query_hl=20&itool=pubmed_docsum
45. Bohle A, Jocham D, Bock PR. Intravesical bacillus Calmette-Guerin versus mitomycin C for superficial bladder cancer: a formal meta-analysis of comparative studies on recurrence and toxicity. J Urol 2003;169 : 90-95.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12478111&query_hl=22&itool=pubmed_docsum
46. van der Meijden AP, Sylvester RJ, Oosterlinck W, Hoeltl W, Bono AV; EORTC Genito-Urinary Tract Cancer Group. Maintenance bacillus Calmette-Guerin for Ta, T1 bladder tumors is not associated with increase toxicity: results from a European Organisation for Research and Treatment of Cancer Genito-Urinary Group Phase III Trial. Eur Urol 2003;44 : 429-434.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=14499676&query_hl=24&itool=pubmed_docsum
47. Lamm DL, Blumenstein BA, Crissman JD, Montie JE, Gottesman JE, Lowe BA, Sarasody MF, Bohl RD, Grossman HB, Beck TM, Leimert JT, Crawford ED. Maintenance bacillus Calmette-Guerin immunotherapy for recurrent Ta, T1 and carcinoma in situ transitional cell carcinoma of the bladder: a randomized Southwest Oncology Group Study. J Urol 2000;163 : 1124-1129.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10737480&query_hl=26&itool=pubmed_docsum
48. Martinez-Pineiro JA, Flores N, Isorna S, Solsona E, Sebastian JL, Pertusa C, Rioja LA, Martinez - Pineiro L, Vela R, Camacho JE, Nogueira JL, Pereira I, Resel L, Muntanola P, Galvis F, Chesa N, de Torres JA, Carballido J, Bernuy C, Arribas S, Madero R; for CUETO (Club Urologico Espanol de Tratamiento Oncologico). Long-term follow-up of a randomized prospective trial comparing a standard 81 mg dose of intravesical bacille Calmette-Guerin with a reduced dose of 27 mg in superficial bladder cancer. BJU Int 2002;89 : 671-680.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=11966623&query_hl=31&itool=pubmed_docsum
49. Martinez-Pineiro JA, Martinez-Pineiro L, Solsona E, Rodriguez RH, Gomez JM, Martin MG, Molina JR, Collado AG, Flores N, Isorna S, Pertusa C, Rabadan M, Astobieta A, Camacho JE, Arribas S, Madero R; Club Urologico Espanol de Tratamiento Oncologico (CUETO). Has a 3-fold decreased dose of bacillus Calmette-Guerin the same efficacy against recurrences and progression of T1G3 and Tis bladder tumors than the standard dose? Results of a prospective randomized trial. J Urol 2005;174 : 1242-1247.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=16145378&query_hl=3&itool=pubmed_docsum
50. Zlotta AR, van Vooren JP, Huygen K, Drowart A, Decok M, Pirson M, Jurion F, Palfliet K, Denis O, Simon J, Schulmann CC. What is the optimal regimen for BCG intravesical therapy ? Eur Urol 2000;37 : 470-477.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10765079&query_hl=32&itool=pubmed_docsum
51. Herr H, Dalbagni G. Defining bacillus Calmette-Guerin refractory superficial bladder tumors. J Urol 2003; 169 : 1706-1708.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids= 12686813&query_hl=34&itool=pubmed_docsum
52. Oge O, Erdem E, Atsu N, Ahin A, Ozen H. Proposal for changes in cystoscopic follow-up of patients with low-grade pTa bladder tumor. Eur Urol 2000;37 : 271-274.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10720851&query_hl=36&itool=pubmed_docsum
53. Holmäng S, Andius P, Hedelin H, Wester K, Busch C, Johansson SL. Stage progression in Ta papillary urothelial tumors: relationship to grade, immunohistochemical expression of tumor markers, mitotic frequency and DNA ploidy. J Urol 2001;165;1124-1128.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=11257652&query_hl=38&itool=pubmed_docsum
54. Fujii Y, Kawakami S, Koga F, Nemoto T, Kihara K. Long-term outcome of bladder papillary urothelial neoplasms of low malignant potential. BJU Int. 2003; 92 : 559-562.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=14511033&query_hl=40&itool=pubmed_docsum
55. Leblanc B, Duclos AJ, Bénard F, Côté J, Valiquette L, Paquin JM, Mauffette F, Faucher R, Perreault JP. Long-term follow-up of initial Ta grade 1 transitional cell carcinoma of the bladder. J Urol 1999;162;1946-1950.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10569544&query_hl=42&itool=pubmed_docsum
56. Zieger K, Wolf H, Olsen PR, Hojgaard K. Long-term follow-up of non-invasive bladder tumours (stage Ta): recurrence and progression. BJU Int 2000;85 : 824-828.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=10792160&query_hl=47&itool=pubmed_docsum
57. Borhan A, Reeder JE, O’Connell MJ, Wright KO, Wheeless LL, di Sant’ Agnese PA, McNally ML, Messing EM. Grade progression and regression in recurrent urothelial cancer. J Urol 2003;169 : 2106 - 2109.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12771728&query_hl=49&itool=pubmed_docsum
58. Soloway M, Bruck DS, Kim SS. Expectant management of small recurrent, non-invasive papillary bladder tumours. J Urol 2003;170 : 438-441.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=pubmed&dopt=Abstract&list_uids=12853794&query_hl=53&itool=pubmed_docsum
7. ZKRATKY POUŽITÉ V TEXTU
ALA aminolevulová kyselina
BCG bacillus Calmette-Guérin
CIS karcinom in situ
CUETO Club Urologico Espanol de Tratamiento Oncologico (Spanish Oncology)
EAU European Association of Urology
EORTC European Organization for Research and Treatment of Cancer
HAL (hex)aminolevulová kyselina
ISUP International Society of Urological Pathology
IVU intravenózní urografie
MRC Medical Research Council
NMP 22 nukleární matrix protein 22
PUNLMP papilární uroteliální neoplazmata s nízkým maligním potenciálem
SBC povrchový karcinom močového měchýře
TCC karcinom z přechodných buněk
TNM tumor, uzlina, metastáza
TUR transuretrální resekce
UICC Union International Contre le Cancer
USG ultrasonografie
WHO Světová zdravotnická organizace
Štítky
Dětská urologie Urologie
Článek ÚvodníkČlánek Derivace moči po cystektomiiČlánek Ohliadnutie za SorrentomČlánek Ze zahraničních periodikČlánek Kvíz
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2008 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
-
Guidelines EAU pro karcinom močového měchýře (TAT1 – neinvadujícího svalovinu)
VERZE 2007 - Kvíz
- Neinvazivní karcinom močového měchýře – kdy je indikována adjuvantní intravezikální instilační léčba a co dělat při jejím selhání?
- Postup při selhání terapie BCG u pacientů s povrchovým karcinomem močového měchýře
- Místo a rozsah lymfadenektomie u pacientů s nádory močového měchýře
- Sexuální funkce šetřící radikální cystektomie
- Úvodník
- Komplikace spojené s cystektomií a derivací moči
- Technika provádění TUR u pacientů s karcinomem močového měchýře – význam opakovaného provádění TUR a náhodné biopsie
- Derivace moči po cystektomii
- „Indiana pouch“ – minulost a současnost
-
TVT – nová epocha urogynekologické operativy
Současná urogynekologická operativa II - Zpráva z kongresu EAU v Miláně
- Ohliadnutie za Sorrentom
- Správa z konferencie AUA Annual Meeting 2008
- Ze zahraničních periodik
- Současná praxe při řešení povrchového karcinomu močového měchýře v Nizozemí a belgických Flandrech: průzkum
-
Guidelines EAU pro neurogenní dysfunkci dolních cest močových
VERZE 2007
-
Guidelines EAU pro karcinom močového měchýře (TAT1 – neinvadujícího svalovinu)
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neinvazivní karcinom močového měchýře – kdy je indikována adjuvantní intravezikální instilační léčba a co dělat při jejím selhání?
- Technika provádění TUR u pacientů s karcinomem močového měchýře – význam opakovaného provádění TUR a náhodné biopsie
- Derivace moči po cystektomii
- Komplikace spojené s cystektomií a derivací moči
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



