-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Efekt selenových nanočástic v komplexech s Cekolem na patogenní bakteriální kultury a kvasinky
Effect of selenium nanoparticles on pathogenic bacterial cultures and yeasts
Issue of bacterial and yeast infections with complicated course of treatment due to resistance of agents of these diseases are a frequent topic of research in the field of human and veterinary medicine. In this study, we focused on the study of selenium nanoparticles effect in the form of a gel-like complex with a polymer substance Cekol (SeNPs) as possible alternative to antibiotic drugs, in the elimination of bacterial and yeast infections. Testing of complex was carried out on the bacterial and yeast isolates obtained from a cohort of 450 patients from the Department of Traumatology at Trauma Hospital in Brno, from which it was taken always one swab sample from a superficial skin infection and to date have managed to identify in total 74 sub-species of bacterial strains or yeasts. To identify strains and tests of SeNPs microbiological, molecular-biological and mass spectrometry methods were used.
The study demonstrated a significant effect of this product on the bacterial strains and yeasts, regardless of their morphology. The growth of most strains from the file was managed by application of nanoparticles completely eliminated. However, in all cases this growth was at least largely suppressed. Sizes of inhibition zones, which can be regarded as effective (1), ranged from 5–20 mm. Our results describe significant antimicrobial effects based on nanotechnologies, which can be used to reduce the risk of uncontrolled infections in comparison with conventional antibiotic therapy.Keywords:
bacteria – yeast – pathogenicity – infections – selenium nanoparticles – inhibition
Autoři: D. Hegerová 1,2; K. Číhalová 1,2; P. Sedláček 3; R. Veselý 4; P. Kopel 1,2; V. Adam 1,2; R. Kizek 5
Působiště autorů: Mendelova univerzita v Brně Ústav chemie a biochemie Vedoucí: prof. RNDr. Vojtěch Adam, Ph. D. 1; Vysoké učení technické v Brně Středoevropský technologický institut Vedoucí: prof. Ing. Radimír Vrba, CSc. 2; MedicProgress, a. s., Olomouc Ředitel: Ing. Pavel Sedláček 3; Klinika traumatologie Lékařská fakulta Masarykovy univerzity a Úrazová nemocnice v Brně Vedoucí: prof. MUDr. Miloš Janeček, CSc. 4; Lékařská univerzita Wroclaw Vedoucí: prof. Dr. Halina Milnerowitz, Ph. D. 5
Vyšlo v časopise: Prakt. Lék. 2016; 96(1): 18-24
Kategorie: Z různých oborů
Souhrn
Problematika vzniku bakteriálních a kvasinkových infekcí s komplikovaným průběhem léčby, způsobeným rezistencí původců těchto onemocnění, je častým tématem výzkumu na poli humánní i veterinární medicíny. V této studii jsme se zaměřili na studium účinku selenových nanočástic ve formě gelovitého komplexu s polymerní látkou Cekolem (SeNPs), jako možné alternativy antibiotických léčiv při eliminaci bakteriálních a kvasinkových infekcí. Testování komplexu probíhalo na bakteriálních a kvasinkových izolátech získaných z kohorty 450 pa-cientů Oddělení traumatologie Úrazové nemocnice v Brně, od kterých byl odebrán vždy jeden vzorek stěru z povrchové kožní infekce, a doposud se podařilo identifikovat celkem 74 poddruhů bakteriálních kmenů nebo kvasinek. K identifikaci kmenů a testování SeNPs bylo využito mikrobiologických a molekulárně-biologických metod a metody hmotnostní spektrometrie.
Studie prokázala výrazný vliv tohoto přípravku na bakteriální kmeny a kvasinky bez ohledu na jejich morfologii. Růst většiny kmenů ze souboru se podařilo aplikací nanočástic zcela eliminovat, ve všech případech však byl tento růst alespoň velkou měrou potlačen. Velikosti inhibičních zón, které se dají považovat za efektivní (1), se ve většině případů pohybovaly v rozmezí 5–20 mm (79 %). Výsledky popisují významné antimikrobiální účinky na bázi nanotechnologií selenových nanočástic, které mohou být použity ke snížení rizika vzniku nekontrolovatelných infekcí.Klíčová slova:
bakterie – kvasinky – patogenita – infekce – selenové nanočástice – inhibiceÚVOD
Staphylococcus aureus (S. aureus) je Grampozitivní kok způsobující infekční onemocnění. Velmi závažnou a často se vyskytující komplikací je vznik infekcí po řadě operací, v traumatologii nebo i transplantační chirurgii, které se mohou projevit vznikem zánětů, abscesů až sepsí (2).
Výskyt infekcí způsobených toxiny produkovanými S. aureus je potlačitelný vhodnými antibiotiky. Na tato antibiotika si však 80 % ze všech kmenů této bakterie vytvořilo rezistenci, a trend tvorby rezistence u S. aureus s přibývajícími druhy antibiotik neustále roste. Například infekce způsobené meticilin-rezistentním S. aureus (MRSA) se obtížně léčí, protože je tato bakterie odolná vůči velké skupině antibiotik včetně oxacilinu, penicilinu a amoxicilinu (3). Závažnou komplikací léčby infekcí jsou také stále častěji kmeny S. aureus rezistentní vůči vankomycinu (4).
Velmi účinnou možností zajištění inhibice růstu nežádoucích mikroorganismů je aplikace kovů, především jejich nanočástic do prostředí vyžadující bakteriální sterilitu (5). Syntetizované nanočástice kovů působí baktericidně, a ukázaly se tak být vhodnou alternativou pro vývoj antimikrobiálních látek (6–9). Nanočástice mají velikost menší než 100 nm a větší povrchovou plochu, a proto interagují snadněji a ve větší míře s biologickými cíli. Bylo zjištěno, že nanočástice mohou proniknout buněčnou membránou až do nitra buňky (10). Vynikající výsledky z pohledu antimikrobiální aktivity vykazují nanočástice (nejčastěji stříbra, mědi a zinku) (6, 8) při jejich aplikaci v nanomolárních koncentracích.
Mechanismus aktivity dosud nejznámějšího antimikro-biálního inhibitoru na bázi stříbra zůstává nejasný. Navrhují se však možnosti účinku na bázi poškození mikrobiálních enzymů uvolňováním iontů stříbra, změna integrity membrány, penetrace do bakteriální cytoplazmy a hromadění v periplazmatickém prostoru či tvorba reaktivních kyslíkatých částic (ROS) působením AgNPs. G+ bakterie reagují významně později na účinek AgNPs, než je tomu u G– bakterií, což se projevuje pozdnější zástavou buněčného dělení (11).
Jako další kov, resp. polokov, byl pro účely eliminace bakterií testován selen. V předchozích studiích byl selen zkoumán především pro různé medicínské aplikace a jako potenciální materiál ortopedických implantátů (12). Existují také studie, které poukazují na schopnost sloučenin selenu inhibovat růst bakterií a tvorbu bakteriálního biofilmu (6, 13). U řady sloučenin selenu (2,4,6-tri-para-methoxyphenylselenopyrylium chlorid, 9-para-chlorofen loctahydroselenoxanten a perhydroselenoxanten) byly prokázány antibakteriální účinky in vitro, a to zejména proti S. aureus. Nicméně účinky nanočástic elementárního selenu na mikroorganismy zůstávají do značné míry neznámé (12) (obr. 1).
Obr. 1. Znázornění pravděpodobného biologického efektu nanočástic selenu s prokaryotickou (bakteriální) buňkou: 1 – prostup selenových nanočástic přes buněčnou stěnu do periplazmy (pravděpodobně chemickým gradientem či difuzí); 2 – prostup SeNPs přes cytoplazmatickou membránu do cytoplazmy (pravděpodobně iontovými kanály); 3 – doposud nepříliš jasnými mechanismy vytvoření kyslíkových radikálů, interakce s DNA, pozastavení buněčných procesů replikace či transkripce, inhibice dělení buněk, procesy vedoucí k celostnímu poškození bakteriální buňky 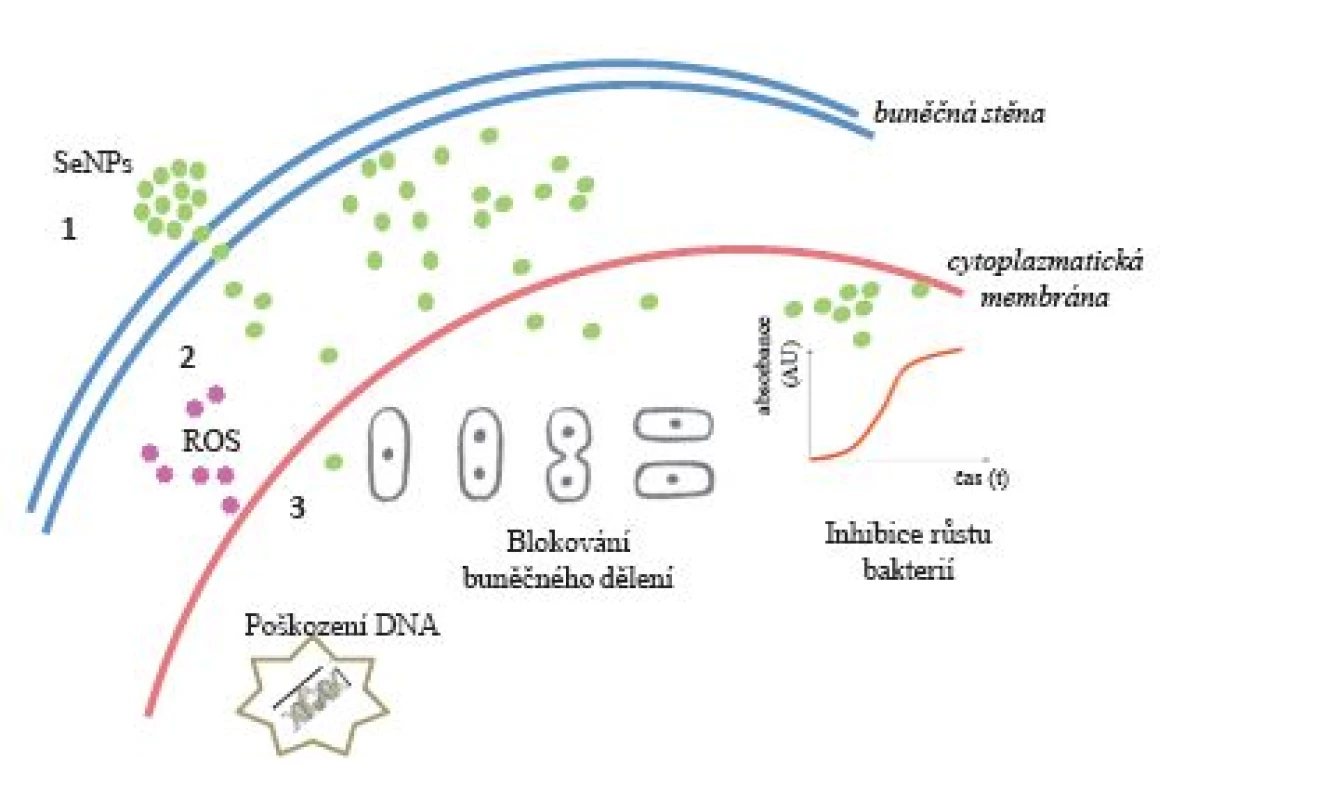
Vize využití nanočástic stříbra a selenu v humánní a veterinární medicíně se jeví do budoucna velmi praktickou a účinnou alternativou při léčbě infekcí vyvolaných bakteriemi.
MATERIÁL A METODY
Sbírka stěru z ran od pacientů s bakteriálními infekcemi
Tyto stěry byly shromážděny z infikovaných ran s informovaným souhlasem pacientů (Etická komise úN Brno 2015). Stěry byly odebrány valivým pohybem v místě poškozené kůže pomocí sterilního stěrového tamponu. Všichni pacienti byli rozděleni do dvou podskupin podle závažnosti infekčních ran (hluboké a povrchové) s ohledem na diagnózu, podrobný popis komorbidit a trvání léčby. Klasifikace byla provedena podle klasifikace chirurgických ran (14) SSI (surgical site infections). Z infekčních ran byly odebrány vzorky používáním jednorázových stěrových tamponů, byl tak připraven reprezentativní vzorek s cílem shromáždit maximální množství mikroflóry v ráně. Tampony byly následně uloženy v transportním médiu (anorganické soli, thioglykolát sodný, 1% agar, aktivní uhlí).
Kultivace klinických vzorků
Čtyři druhy selektivních živných médií (krevní agar obohacený o 10% chlorid sodný, Endův agar, krevní agar bez dalších komponent a krevní agar s glykosidovým antibiotikem amikacinem) byly využity pro další mikrobiologickou selekci. Petriho misky obsahující výše uvedená média byly následně inkubovány podle běžných protokolů, které jsou využity v jiných studiích (15), pro udržení vhodných podmínek pro růst všech druhů bakterií. Tyto Petriho misky byly kultivovány po dobu 24–48 hodin při teplotě 37 °C. Všechny Petriho misky byly elektronicky snímány a zpracovány analýzou obrazu. Pro kultivaci všech bakteriálních druhů bylo použito GTK médium (1 g ∙ l–1 glukóza; 5 g ∙ l–1 trypton; 2,5 g ∙ l–1 kvasničný extrakt). Po ukončení inkubační doby byly z každé Petriho misky odebrány jednotlivé kolonie a uloženy v 1 µl obohaceného média. Tyto získané vzorky byly použity pro identifikaci na přístroji MALDI-TOF MS (16).
Chemikálie, příprava deionizované vody a měření pH
Chemikálie použité ve studii byly zakoupeny od společnosti Sigma-Aldrich (St. Louis, USA) v ACS čistotě, pokud není uvedeno jinak. Deionizovaná voda byla připravena s použitím reverzní osmózy zařízení Aqual 25 (Česká republika). Hodnota pH byla měřena pomocí měřiče pH WTW inoLab (Weilheim, Německo).
Příprava selenových nanočástic
Seleničitan sodný pentahydrát Na2SeO3 ∙ 5H2O (26,3 mg) byl rozpuštěn v ACS vodě (50 ml). 3-merkaptopropionová kyselina (40 µl) byla pomalu přidána k míchanému roztoku. Poté je pH upraveno na 8 pomocí 1M NaOH. Reakční směs je míchána po dobu 2 hodin. Selenové nanočástice byly uloženy ve tmě při teplotě 4 °C. 1 ml roztoku obsahuje 158 µg selenu. Velikost nanočástic byla stanovena v rozmezí 50–150 nm, nejčastěji (30 %) se v roztoku nacházely nanočástice o velikosti 122 nm. Barva roztoku nanočástic byla úpravou pH změněna z bezbarvé na světle oranžovou (5).
Skenovací elektronový mikroskop
Pro vizualizaci studovaných nanomateriálů byla využita skenovací elektronová mikroskopie, SEM MIRA XMU (Tescan, Brno, Česká republika). Použitý mikroskop byl vybaven SE detektorem (Everhart-Thronley), BSE detektorem s vysokorychlostním scintilátorem, panchromatickým CL detektorem a EDX spektrometrem. Vzorky byly před vlastní analýzou pokryty (Carbon Coater K950X, Quorum Technologies, Grinstead, Velká Británie) 10 nm vrstvou uhlíku (Sigma-Aldrich, St. Louis, MO, USA). Pro zobrazení vzorků bylo použito urychlovací napětí 15 kV a proud elektronového svazku kolem 1 nA.
MALDI-TOF ms identifikace bakterií
Hmotnostní spektrometrická analýza byla prováděna podle protokolu popsaného v (7). Extrakční protokol byl proveden s využitím MALDI Biotyper™ 3.0. Pro identifikaci bakte-riálních kmenů bylo jako matrice využito α-kyano-4-hydroxyskořicové kyseliny (HCCA). Data byla analyzována Flex Analysis softwarem (Verze 3.4). Finální dendrogramy byly vytvořeny s využitím MALDI Biotyper™ 3.1 (Bruker Daltonik GmbH, Brémy, Německo).
Stanovení antimikrobiální aktivity
Inhibiční zóny
Pro stanovení antimikrobiálního účinku SeNPs s Cekolem (100 µg/ml), bylo využito měření inhibičních zón na Petriho miskách. Povrch agaru v Petriho misce byl pokryt směsí 100 ml 24 hodin narostlé kultury S. aureus a 3 ml LB média (Luria Bertani). Přebytečný objem směsi z Petriho misek byl odsát. Z textilie vyrobené Výzkumným ústavem pletařským v Brně byly vyříznuty disky o průměru 1 cm, které byly smíseny s testovaným kompozitem. Namočené disky byly položeny křížem na Petriho misce, vždy v duplikátech na misku. Petriho misky byly zaizolovány proti možné vnější kontaminaci a umístěny do termostatu přednastaveného na 37 °C po dobu 24 hodin. Po 24 hodinách inkubace byly fotografovány a analýzou obrazu určeny zóny inhibice.
Růstové křivky
Druhým postupem pro hodnocení antimikrobiálního účinku testovaných sloučenin bylo měření absorbance za použití zařízení Multiskan EX (Thermo Fisher Scientific, Německo) a následná analýza ve formě růstových křivek. Stejná kultura jako v předchozím postupu byla zředěna LB médiem za použití spektrofotometru Specord 210 (Analytik Jena, Německo) při vlnové délce 620 nm na absorbanci 0,1. V mikrotitrační destičce byla kultura S. aureus smíchána s různými koncentracemi SeNPs nebo byla bakteriální kmen S. aureus měřen samostatně jako kontrolní vzorek. Koncentrace SeNPs byly 0, 10, 25, 50, 75, 150, 225 a 300 µM. Celkový objem v jamkách mikrotitrační destičky byl vždy 300 µl. Měření byla prováděna v čase 0, pak každou půlhodinu po dobu 24 hodin při 37 °C a vlnové délce 620 nm. Dosažené hodnoty byly analyzovány v grafické podobě (růstové křivky) pro každou variantu zvlášť.
VÝSLEDKY A DISKUZE
Pokroky v léčbě bakteriálních infekcí na bázi nanotechnologií jsou významné. Je tomu tak zejména v souvislosti s vývojem a syntézou různých nanočástic kovů, kdy po jejich aplikaci dochází ke konstantnímu propouštění nejčastěji iontů stříbra do bakteriální buňky a vazbě k bakteriální DNA (17). Výsledky posledních výzkumů poukazují na výrazný efekt nanočástic selenu. Jejich účinky jsou několikanásobně vyšší než v případě aplikace nejčastěji využívaných nanočástic stříbra (6). Je ale nezbytné podotknout, že antimikrobiální vlastnosti nanočástic jsou nejčastěji ovlivněny jejich velikostí, čím menší nanočástice jsou syntetizovány, tím snadnější je jejich prostup do bakteriální buňky. Nejvýhodnějšími vlastnostmi těchto materiálů je kromě jejich antimikro-biální aktivity i jejich snadná příprava, stabilita v čase a nízké výrobní náklady. Tvorba komplexů nanočástic kovů nebo polokovů s polymerními látkami nebo různými nosiči jejich antimikrobiální vlastnosti prokazatelně zvyšuje (8, 18).
Komplex selenových nanočástic s polymerní látkou Cekolem byl charakterizován různými metodami (obr. 2). Nejprve byla pro posouzení velikosti a morfologie nanočástic použita skenovací elektronová mikroskopie, kterou byla potvrzena přítomnost koloidních částic (obr. 2A); technikou DLS využívající rozptyl světla byl potvrzen nejčastější výskyt (23 %) částic o velikosti 23 nm (obr. 2B).
Obr. 2. Charakterizace komplexu selenových nanočástic s Cekolem: A – obrázek ze skenovacího elektronového mikroskopu: SEM HV: 15,00 kV; View field: 2,167 μm; SEM MAG: 100,00 kx; WD: 4,945 mm; Det: InBeam; Date (m/d/y): 09/23/15; B – fotografie komplexu ve viditelném světle ve vodném roztoku; C – zastoupení jednotlivých typů částic technikou Zetasizer (více podrobností je diskutováno v práci (13)) 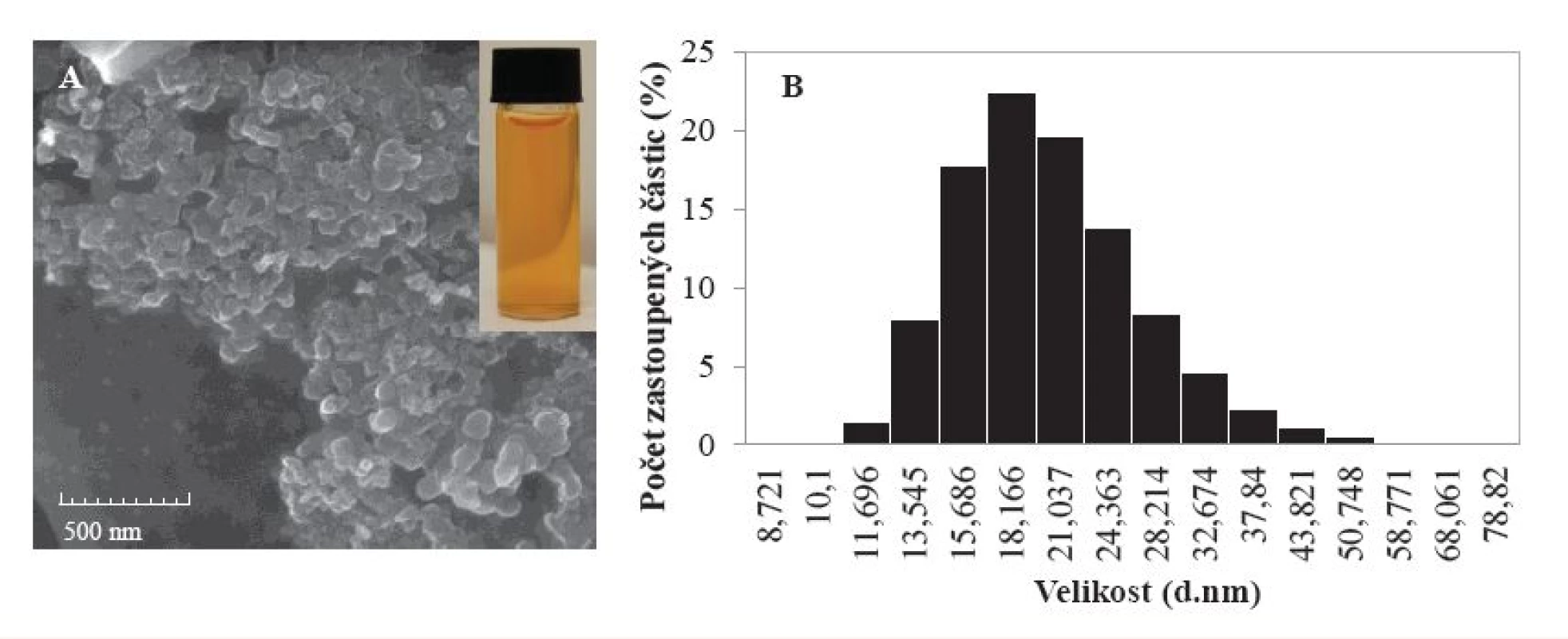
Stěry z povrchových ran pacientů s těžce hojitelnými bakte-riálními infekcemi byly ihned po odběru kultivovány v univerzálním médiu při 37 ºC. Primární selektivní mikrobiologická kultivace s využitím čtyř živných agarů byla využita pro základní selekci mikroorganismů dle jejich morfologie (G+ a G–) nebo specifičtějšího taxonomického zařazení (streptokoky, stafylokoky, enterokoky) a sloužila jako přípravný krok pro následnou přesnou identifikaci původců infekce až na úroveň druhu (obr. 3A).
Obr. 3. A – selektivní kultivace bakteriálních kmenů a kvasinek ve stěrech z infekčních ran pacientů se závažnými, těžce hojitelnými bakteriálními infekcemi, typické nárůsty bakteriálních kultur na jednotlivých selektivních agarech; B – zastoupení G<sup>+</sup> a G<sup>–</sup> izolovaných a charakterizovaných bakteriálních kmenů; C – zastoupení koků, tyčinek a kvasinek; D – zastoupení aerobních, fakultativně anaerobních a anaerobních bakterií. Ve studii bylo analyzováno (n = 450) stěrů z nehojících se ran. Identifikace bakteriálních kmenů byla provedena na MALDI MS detektoru (více podrobností v materiálech a metodách a práci (7)) 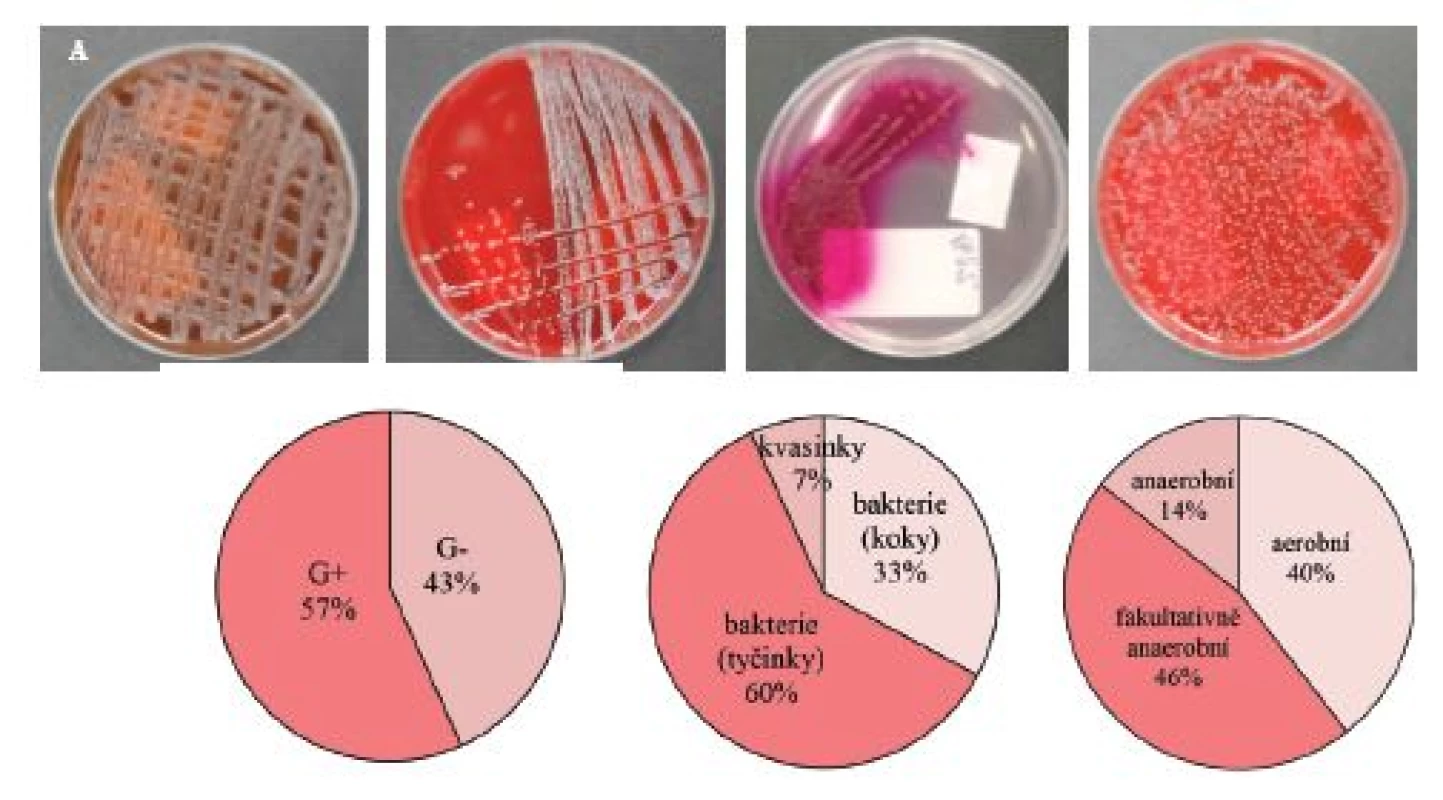
Pro přesnou a rychlou identifikaci druhového zastoupení v infekčních ranách byla využita technika hmotnostní spektrometrie. Identifikací a porovnáním proteinové skladby bakterií byly jednotlivé bakteriální druhy během několika minut zařazeny a pojmenovány dle dostupné knihovny všech doposud identifikovaných druhů (19). Veškeré vyskytující se bakteriální kmeny a kvasinky identifikované s využitím MALDI-TOF hmotnostní spektrometrie jsou graficky znázorněny dle procentuálního zastoupení G+ (57 %) a G– (43 %) bakterií na obrázku 3B, zastoupení bakteriálních koků (33 %), tyčinek (60 %) a kvasinek (7 %) na obrázku 3C a zastoupení bakterií a kvasinek dle různé spotřeby kyslíku – aerobní (40 %), fakultativně anaerobní (46 %) a anaerobní (14 %) na obrázku 3D.
Nejčastěji byly identifikovány bakteriální kmeny S. aureus (n = 126), Escherichia coli (n = 90) a kvasinky C. tropicalis (n = 4), které jsou i z dosavadních studií považovány jako nejčastěji se vyskytující patogeny způsobující těžce hojitelné infekce (2).
Během studie bylo hmotnostní spektrometrií identifikováno 74 druhů mikroorganismů (bakterií a kvasinek). Na tyto kmeny byl následně aplikován antimikrobiální komplex nanočástic selenu s Cekolem o koncentraci 100 µg/ml. Po 24 hodinové inkubaci při konstantní teplotě 37 °C za aerobních nebo anaerobních podmínek byly odečteny vzniklé inhibiční zóny v okolí disků (tab. 1). Velikost zón, a tedy i efektivita antimikrobiálního kompozitu SeNPs-Cekol se ve většině případů pohybovala v rozmezí 5–20 mm (79 %), hodnoty inhibičních zón do 5 mm (21 %) se nepovažují za prokazatelně dostačující, aby byl testovaný kompozit považován za antimikrobiální (1). Nejvyšší inhibice aplikací kompozitu bylo dosaženo u bakteriální kultury Lactobacillus satsumensis (19 mm) a Weisella halotolerans (20 mm).
Tab. 1. Efekt komplexu selenových nanočástic s Cekolem u bakterií ve stěrech z ran pacientů s bakteriálními infekcemi, jejich morfologická struktura (G<sup>+</sup> × G<sup>–</sup>), výskyt (n) a průměrný inhibiční účinek selenového komplexu (100 μg/ml) určený jako zóna v (mm) (ostatní podrobnosti jsou uvedeny v části Materiál a metody) 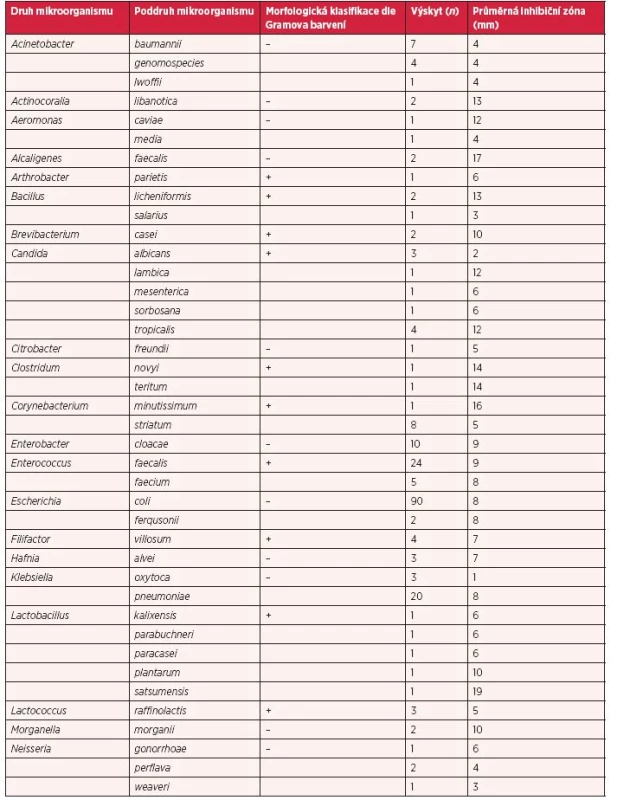
Majoritně se vyskytující zástupci bakteriálních koků (S. aureus; n = 126), bakteriálních tyčinek (Escherichia coli; n = 90) a kvasinek (C. tropicalis; n = 4) byli finálně vystaveni působení kompozitu v různých koncentracích: 0, 1, 2, 4, 8, 16, 32 a 64 µg/ml (obr. 4). Postupný trend inhibice byl pozorován u zástupce koků i tyčinek, přesto v závislosti na jednotlivé aplikované koncentraci byla inhibice u zástupce G– bakterií (Escherichia coli) pozorována vyšší (obr. 4B). U G+ (S. aureus) již nejnižší aplikovaná koncentrace kompozitu (1 µg/ml) způsobila částečnou inhibici růstu bakteriální kultury (obr. 4A). Nejvyššího efektu bylo dosaženo aplikací na kvasinky, kdy třemi nejvyššími aplikovanými koncentracemi (16, 32 a 64 µg/ml) bylo téměř dosaženo totální inhibice růstu kvasinek (obr. 4C).
Obr. 4. Růstové křivky u nejčastěji se vyskytujících zástupců bakteriálních koků (S. aureus), bakteriálních tyčinek (E. coli) a kvasinek (C. tropicalis) po aplikaci koncentrační řady komplexu selenové nanočástice s Cekolem (0, 1, 2, 4, 8, 16, 32 a 64 μM). 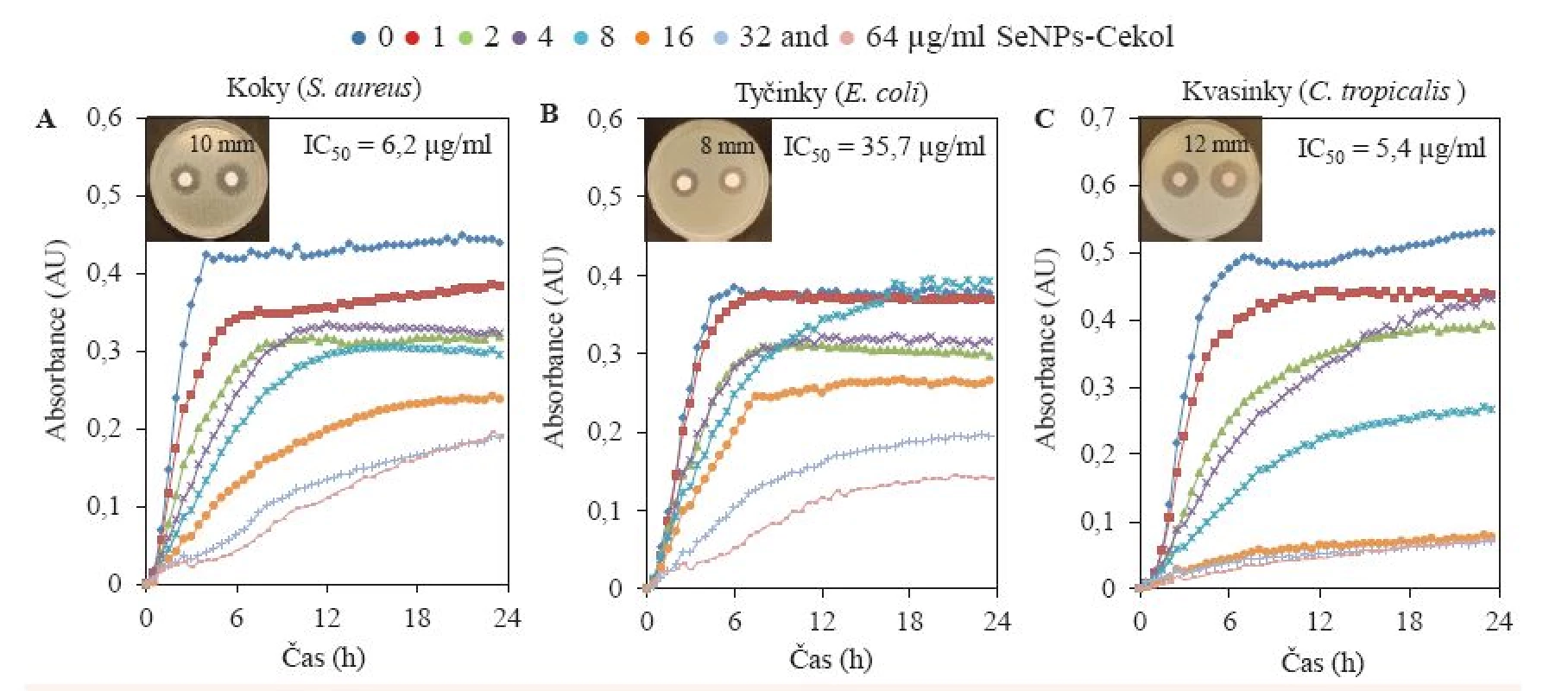
Dosažené výsledky byly statisticky potvrzeny hodnotami IC50 značícími koncentraci antimikrobiální látky nezbytnou pro inhibici růstu bakterií nebo kvasinek o 50 %. Ta byla shodně s výsledkem růstových křivek stanovena nejvyšší u Escherichia coli (35,7 µg/ml) z důvodu její nejsložitější morfologie, buněčné stěny tvořené z lipopolysacharidů nesnadno propustné pro antimikrobiální agens obecně. IC50 u S. aureus a C. tropicalis byla stanovena téměř stejná a velmi nízká (6,2 µg/ml pro S. aureus a 5,4 µg/ml pro C. tropicalis), lze tedy předpokládat, že aplikace kompozitu SeNPs-Cekol by měla být efektivní na nejčastější patogeny způsobující bakteriální nebo kvasinkové infekce a je pravděpodobné využití kompozitu širokospektrálně.
ZÁVĚR
Hledání nových technik pro identifikaci původců bakteriálních onemocnění roste se zvyšující se rezistencí bakteriálních kmenů na antibiotika. Do popředí zájmu se zejména z důvodu přesnosti a rychlosti řadí molekulárně-biologické metody identifikace a hmotnostní spektrometrie. V naší studii bylo dosaženo identifikace 74 bakteriálních poddruhů a kvasinek, které byly původcem infekcí pacientů Kliniky traumatologie, Úrazové nemocnice v Brně. Testování selenových nanočástic pro eliminaci bakteriálního růstu prokázalo u všech testovaných vzorků slibné výsledky. Dosažené výsledky námi syntetizovaných selenových nanočástic v komplexu s polymerní látkou Cekolem (6) tak mohou být vhodným podkladem pro možné využití i na poli medicíny humánní.
Seznam použitých zkratek
ACS ultra čistá voda
AgNPs nanočástice fosforečnanu stříbrného
DNA deoxyribonukleová kyselina
MALDI-TOF MS matricí asistovaná laserová desorpce/io-nizace s analyzátorem doby letu, hmotnostní spektrometrie
MRSA meticilin-rezistentní Staphylococcus aureus
RNA ribonukleová kyselina
ROS reaktivní kyslíkové radikály
SEM skenovací elektronová mikroskopie
SeNPs selenové nanočástice
SSI klasifikace chirurgických ran
Za finanční podporu děkujeme projektu SELENBAKT 022014. Poděkování patří Davidu Hynkovi za obrázky ze skenovacího elektronového mikroskopu a Radku Chmelovi za technickou spolupráci.
Střet zájmů: žádný. Firemní výzkum.
ADRESA PRO KORESPONDENCI:
prof. Ing. René Kizek, Ph.D.
Lékařská univerzita Wroclaw
Wybrzeze L. Pasteura 1
50-367 Wroclaw, Polska
email: kizek@sci.muni.cz
Zdroje
1. Clinical and laboratory standards institute [online]. Dostupné z: http://clsi.org/
2. Zacharioudakis IM, Zervou FN, Ziakas PD, et al. Meta-analysis of methicillin-resistant Staphylococcus aureus colonization and risk of infection in dialysis patients. J Am Soc Nephrol 2014; 25 : 2131–2141.
3. van Hal SJ, Fowler VG. Is it time to replace vancomycin in the treatment of methicillin-resistant Staphylococcus aureus infections? Clin Infect Dis 2013; 56 : 1779–1788.
4. Chung DR, Baek JY, Kim HA, et al. First report of vancomycin-intermediate resistance in sequence type 72 community genotype methicillin-resistant Staphylococcus aureus. J Clin Microbiol 2012; 50 : 2513–2514.
5. Kopel P, Milosavljevic V, Moulick A, et al. Komplex biopolymerní látky s nanočásticemi selenu a antibiotickými léčivy s antibakteriálním účinkem. In: Ú.p. vlastnictvi (ed.), Mendelova univerzita v Brně, Česká republika 2014; 1–6.
6. Chudobova D, Cihalova K, Dostalova S, et al. Comparison of the effects of silver phosphate and selenium nanoparticles on Staphylococcus aureus growth reveals potential for selenium particles to prevent infection. FEMS Microbiol Lett 2014; 351 : 195–201.
7. Chudobova D, Dostalova S, Ruttkay-Nedecky B, et al. The effect of metal ions on Staphylococcus aureus revealed by biochemical and mass spectrometric analyses. Microbiol Res 2015; 170 : 147–156.
8. Chudobova D, Nejdl L, Gumulec J, et al. Complexes of silver(I) Ions and silver phosphate nanoparticles with hyaluronic acid and/or chitosan as promising antimicrobial agents for vascular grafts. Int J Mol Sci 2013; 14 : 13592–13614.
9. Cihalova K, Chudobova D, Milosavljevic V, et al. Modern techniques of increase the antibacterial properties of the instrument. J Met Nanotechnol 2014; 1 : 49–54.
10. Chudobova D, Cihalova K, Kopel P, et al. Complexes of metal-based nanoparticles with chitosan suppressing the risk of Staphylococcus aureus and Escherichia coli infections. In: Rai M, Kon K. (eds.). Nanotechnology in diagnosis, treatment and prophylaxis of infectious diseases. Amsterdam: Academic Press 2015; 217–232.
11. Grigor’eva A, Saranina I, Tikunova N, et al. Fine mechanisms of the interaction of silver nanoparticles with the cells of Salmonella typhimurium and Staphylococcus aureus. Biometals 2013; 26 : 479–488.
12. Tran PA, Webster TJ. Selenium nanoparticles inhibit Staphylococcus aureus growth. Int J Nanomed 2011; 6 : 1553–1558.
13. Cihalova K, Chudobova D., Michalek P, et al. Staphylococcus aureus and MRSA growth and biofilm formation after treatment with antibiotics and senps. Int J Mol Sci 2015; 16 : 24656–24672.
14. Klodzinska E, Kupczyk W, Jackowski M, et al. Capillary electrophoresis in the diagnosis of surgical site infections. Electrophoresis 2013; 34 : 3206–3213.
15. Fon Sing S, Isdepsky A, Borowitzka MA, et al. Pilot-scale continuous recycling of growth medium for the mass culture of a halotolerant Tetraselmis sp. in raceway ponds under increasing salinity: a novel protocol for commercial microalgal biomass production. Bioresource Technol 2014; 161 : 47–54.
16. Chudobova D, Cihalova K, Guran R, et al. Influence of microbiome species in hard-to-heal wounds on disease severity and treatment duration. Braz J Inf Dis 2015 (in press).
17. Ho CH, Odermatt EK, Berndt I, et al. Long-term active antimicrobial coatings for surgical sutures based on silver nanoparticles and hyperbranched polylysine. J Biomater Sci 2013; 24 : 1589–1600.
18. Kopel P, Chudobova D, Cihalova K, et al. Antibakteriální přípravek na bázi oxidu grafenu a redukovaného oxidu grafenu s obsahem nanočástic kovů a polokovů. In: Ú.p. vlastnictví (Ed.), Mendelova univerzita v Brně, Česká republika 2015; 1–6.
19. Sauer S, Freiwald A, Maier T, et al. Classification and identification of bacteria by mass spectrometry and computational analysis. Plos One 2008; 3 : 1–10.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek CEFALOSPORINY
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2016 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Principy zdravotní péče zaměřené na člověka – person-centred health care
- Efekt selenových nanočástic v komplexech s Cekolem na patogenní bakteriální kultury a kvasinky
- Konsekvencialismus, deontologismus a lékařská etika
- Profesní příprava na péči o truchlící rodiče
- Fenomén bezpapírových nemocnic: Bude fungovat i v Evropě?
- CEFALOSPORINY
- Stres pacienta v nemocnici, dispozice, empatie
-
Matoušek O. a kolektiv
Děti a rodiče v rozvodu
(manuál pro zúčastněné profesionály a rodiny) -
Richard Rokyta a kolektiv
Fyziologie a patologická fyziologie pro klinickou praxi - PLÁNOVANÉ AKCE SPLDD A OSPDL NA ROK 2016
- Proces věkového úbytku mozkových funkcí u nekuřáků a kuřáků
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- CEFALOSPORINY
- Konsekvencialismus, deontologismus a lékařská etika
- Principy zdravotní péče zaměřené na člověka – person-centred health care
- Stres pacienta v nemocnici, dispozice, empatie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




