-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRadioterapie histiocytózy z Langerhansových buněk
Radiotherapy of Langerhans’ cell histiocytosis
Langerhans’ cell histiocytosis is a rare disease, the overall incidence is only 1–3 cases per 1,000,000. The diagnostic and treatment guidelines are not exactly determined. Surgery and radiotherapy are the preferred treatment of localized form. Multifocal form or systemic disease is usually treated by chemotherapy and radiotherapy. The experience in the radiotherapy of Langerhans’ cell histiocytosis is limited to the largest radiation oncology centers due to the rarity of this disease. Radiosensitivity is high, therefore only low doses of radiation are sufficient. The tolerance of radiotherapy is good, acute postirradiation reactions are small and acceptable. Modern radiotherapy techniques enable us to use radiotherapy for any location. Radiotherapy is usually indicated for solitary or multiple osteolytic bone lesions, but also for soft tissue and internal organ lesions. According to the localization of the lesion we choose the radiation source, energy and technique to apply the maximum dose to the tumor, with minimal toxicity to healthy tissues. The goal of this paper is to review indications and possibilities of radiotherapy of this rare disease and to show the comprehensive approach to the treatment of Langerhans’ cell histiocytosis.
Key words:
radiotherapy – Langerhans’ cell histiocytosis – radiosensitivity
Autoři: P. Čoupek; P. Šlampa
; I. Čoupková; J. Gombošová
Působiště autorů: Klinika radiační onkologie Lékařské fakulty MU a Masarykova onkologického ústavu Brno, přednosta prof. MUDr. Pavel Šlampa, CSc.
Vyšlo v časopise: Vnitř Lék 2010; 56(Supplementum 2): 152-156
Kategorie: Histiocytóza z Langerhansových buněk a některá další vzácná hematologická onemocnění
Souhrn
Histiocytóza z Langerhansových buněk je vzácně se vyskytující onemocnění, jehož incidence se udává 1–3 případy na milion obyvatel. Vzhledem ke vzácnosti tohoto onemocnění nejsou u něj přesně stanoveny diagnosticko-léčebné postupy. V léčbě solitárních ložisek se využívá chirurgická léčba nebo radioterapie, u víceložiskového nebo systémového postižení může být indikována lokální radioterapie v kombinaci se systémovou léčbou. Pouze největší radioterapeutická pracoviště mají zkušenosti s radioterapií histiocytózy z Langerhansových buněk. Jde o onemocnění velmi radiosenzitivní, takže k eliminaci lokálního nádorového infiltrátu stačí pouze nízké dávky záření. Snášenlivost radioterapie je dobrá, akutní postradiační reakce po radioterapii bývají malé a přijatelné. Moderní technika ozáření umožní indikovat radioterapii u nádoru v kterékoliv lokalizaci. Nejčastěji bývá radioterapie indikována u solitárních nebo vícečetných osteolytických kostních ložisek, ale i u infiltrátů v měkkých tkáních a v oblasti vnitřních orgánů. Dle uložení ložiska volíme individuálně zdroj záření, energii a techniku ozáření tak, abychom aplikovali maximální dávku do nádoru, při minimálním postižení zdravých tkání. Cílem práce je seznámit lékaře s indikací a s možnostmi radioterapie u tohoto vzácného onemocnění a současně nabídnout lékařům jiných odborností další možnost léčby v komplexním přístupu k terapii histiocytózy z Langerhansových buněk.
Klíčová slova:
radioterapie – histiocytóza z Langerhansových buněk – radiosenzitivitaÚvod
Histiocytóza z Langerhansových buněk (LCH) je vzácně se vyskytující onemocnění retikuloendoteliálního systému, jehož incidence se udává 1–3 případy na milion obyvatel. Výskyt u dětí je podstatně častější než u dospělých. Klinický obraz je velmi různorodý, v dospělosti se projevuje převážně jako jednoložiskové nebo víceložiskové osteolytické kostní postižení. Nejčastěji bývají diagnostikována ložiska v oblasti kalvy, mandibuly, maxilly, temporální kosti, dlouhých kostí končetin, méně často v oblasti páteře, v pánevních kostech a v žebrech [1,9,12]. Nádorové infiltráty se mohou vyskytnout i v měkkých tkáních, na sliznici, na kůži a v oblasti vnitřních orgánů – jater, sleziny, mozku, hypofýzy, plic, lymfatických uzlin aj. [1,2]. U dětí bývá často současné postižení více orgánů.
Vzhledem ke vzácnému výskytu onemocnění je poměrně málo klinických zkušeností s diagnostikou a léčbou této nemoci, pouze asi 20 % pracovišť má zkušenost s léčbou zářením histiocytózy z Langerhansových buněk. Radioterapie je aplikována v největších radioterapeutických centrech.
Pro vzácnost onemocnění nejsou standardní diagnosticko-terapeutické postupy přesně vymezeny [3]. V léčbě solitárních ložisek se využívá chirurgická léčba nebo radioterapie, u víceložiskového nebo systémového postižení je často aplikována systémová léčba kortikoidy a chemoterapie, která bývá často doplněna lokální radioterapií.
Radioterapie
Dnešní moderní radioterapie může být aplikována u histiocytózy v kterékoliv lokalizaci, především ovšem tam, kde není ložisko snadno přístupné pro chirurgickou léčbu.
Indikací pro radioterapii jsou solitární i vícečetná osteolytická kostní ložiska, ale i infiltráty v měkkých tkáních (na sliznici, na kůži) i v oblasti vnitřních orgánů (játra, plíce, mozek, hypofýza, hypotalamus, oblast zevního i vnitřního ucha apod.) [5,7]. Z kostního postižení bývá nejčastěji indikována radioterapie na oblast kalvy, orbity, mandibuly, maxilly a dlouhých kostí. Při systémovém postižení je indikována radioterapie v kombinaci s kortikoidy nebo chemoterapií jako doplněk lokální terapie na přetrvávající nebo recidivující infiltráty. U infiltrátu, který je dobře zobrazitelný na CT nebo MR obraze a leží v blízkosti kritického orgánu v oblasti mozku, lze využít i stereotaktické radioterapie nebo radiochirurgie [10] (tab. 1 a 2).
Tab. 1. Postavení radioterapie (RT) v komplexní léčbě histiocytózy z Langerhansových buněk. 
Tab. 2. Nejčastější indikace radioterapie u histiocytózy z Langerhansových buněk. 
Zdroje záření
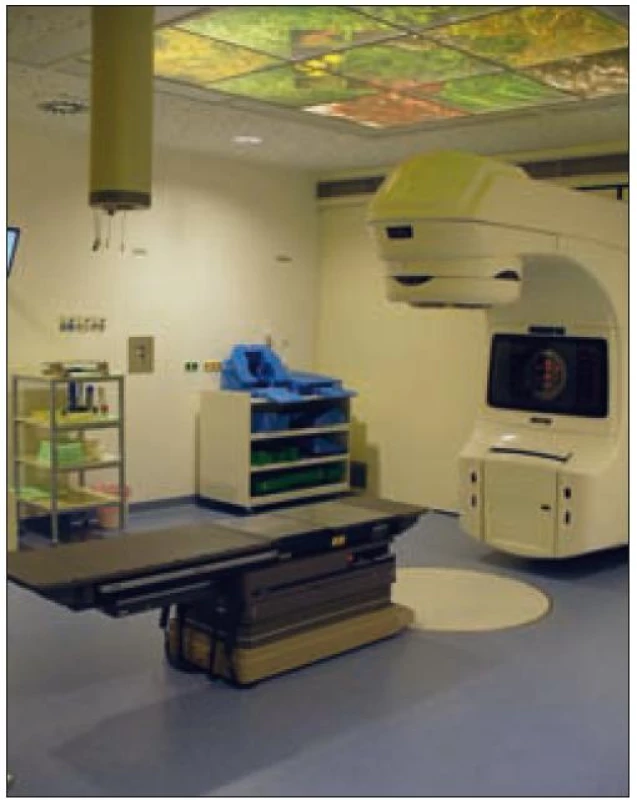
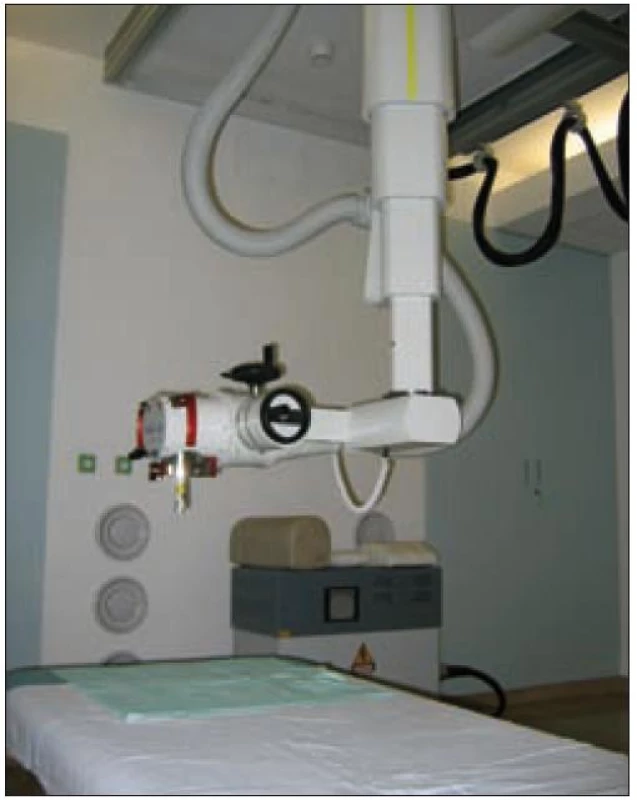
Při radioterapii histiocytózy se nejčastěji využívá zdrojů záření pro zevní radioterapii lineárního urychlovače nebo RTG ozařovače (obr. 1 a 2). RTG záření indikujeme u infiltrátů ležících na povrchu či těsně pod povrchem (povrchová, kontaktní RTG terapie) – tedy při postižení kůže nebo sliznice v kterékoliv dobře dostupné lokalizaci (jazyk, bukální sliznice, vulva, anální otvor). Volbou vhodné energie RTG záření docílíme velmi dobrého prozáření povrchového infiltrátu a současně prudkého poklesu dávky do hloubky, a tím i šetření zdravých tkání ležících pod nádorem.
Nejčastěji používaným zdrojem záření je lineární urychlovač, který je zdrojem elektronového svazku nebo brzdného záření X. Elektronové záření využíváme opět pro infiltráty povrchové, případně šířící se pod povrch do hloubky asi 2–3 cm. I zde můžeme zvolit optimální energii svazku záření, a tím ovlivnit prudký pokles dávky do hloubky. Radioterapie brzdným zářením X je indikována u nádorů ležících v hloubce, tedy i u osteolytických lézí kostních, u infiltrátů v oblasti hlavy, krku, hrudníku i orgánů dutiny břišní a pánve.
Zpravidla ozařujeme technikou více polí, při které lze aplikovat cíleně dávku do nádorového ložiska a současně maximálně šetřit zdravé tkáně a orgány v okolí.
Dávka záření
Histiocytóza z Langerhansových buněk je velmi radiosenzitivní onemocnění. Stačí pouze nízká dávka k eliminaci nádorového infiltrátu. Dle literatury je nejčastěji uváděna jednotlivá ložisková dávka (LD) v rozmezí 1–3 Gy, celková dávka 10–40 Gy. Doporučená je jednotlivá dávka 2,0 Gy do celkové ložiskové dávky 20–24 Gy. Jde tedy o 10–12 frakcí radioterapie, které jsou aplikovány každý den [6,8].
U dětí bývá aplikována dávka nižší, jednotlivá LD v rozmezí 0,5–3,0 Gy, celková ložisková dávka u malých dětí je doporučována 8–12 Gy. Jednotlivá i celková dávka závisí na věku dítěte a uložení nádorového infiltrátu v blízkosti kritických orgánů. U větších dětí aplikujeme celkovou dávku 14–22 Gy. Většina autorů doporučuje vzhledem ke snášenlivosti a vzhledem k minimalizování pozdních postradiačních změn u dětí aplikovat jednotlivou ložiskovou dávku 1,8 Gy nebo i nižší [4,11]. Při radioterapii v oblasti hypotalamo-hypofyzární osy u mladších dětí může vlivem radioterapie dojít k poruše sekrece jednoho nebo více hormonů předního laloku hypofýzy. Vliv radioterapie závisí na celkové dávce, velikosti pole, počtu frakcí především na věku dítěte. Citlivější na záření jsou děti mladší, a proto u nich užíváme jednotlivou dávku nižší (1,8 Gy nebo nižší) a i celková dávka je nižší (tab. 3).
Tab. 3. Nejčastěji doporučované dávky záření v Gy (jednotka dávky Gray). 
Ozařovací technika
U nádorů ležících na povrchu nebo šířících se pod povrch (kůže, sliznice, podkoží) zpravidla využíváme jednoduchou ozařovací techniku – ozáření jedním přímým polem (obr. 5 a 6). U nádorů infiltrujících dlouhé kosti bývá nejvhodnější technika 2 protilehlých polí, u nádorů ležících v hloubce volíme složitější techniku více polí, čímž dosáhneme maximální dávky v nádoru a současně i minimální zatížení okolní zdravé tkáně (obr. 3 a 4). Tím je minimalizována postradiační reakce a z toho vyplývající dobrá snášenlivost radioterapie.
Obr. 3. Klinický cílový objem CTV (červeně) a plánovaný cílový objem PTV (modře). 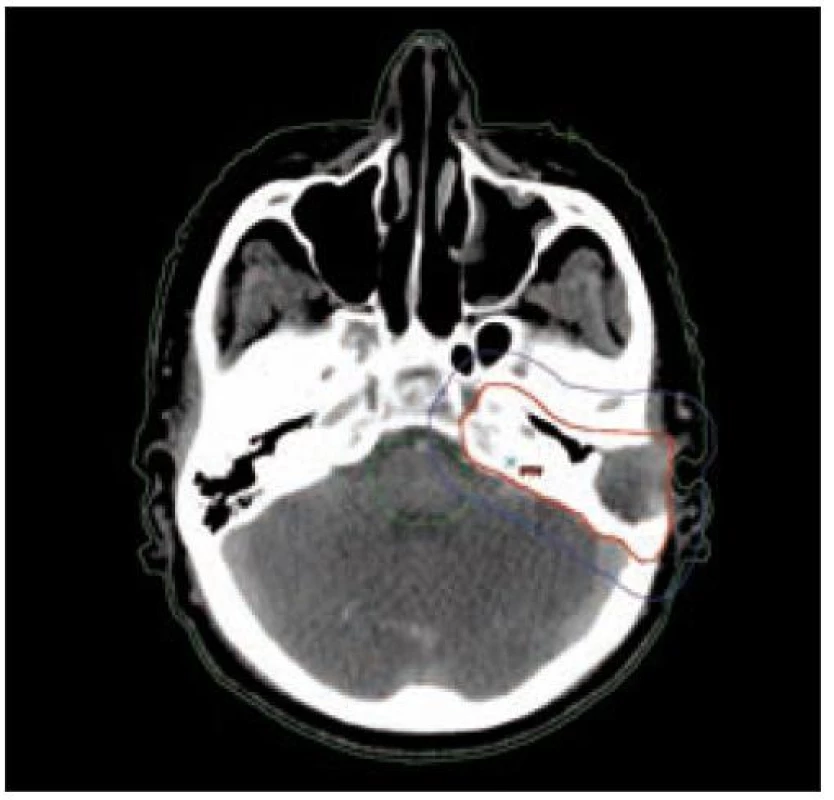
Obr. 4. Izodózní plán, rozložení dávky v nádoru v oblasti pyramidy. 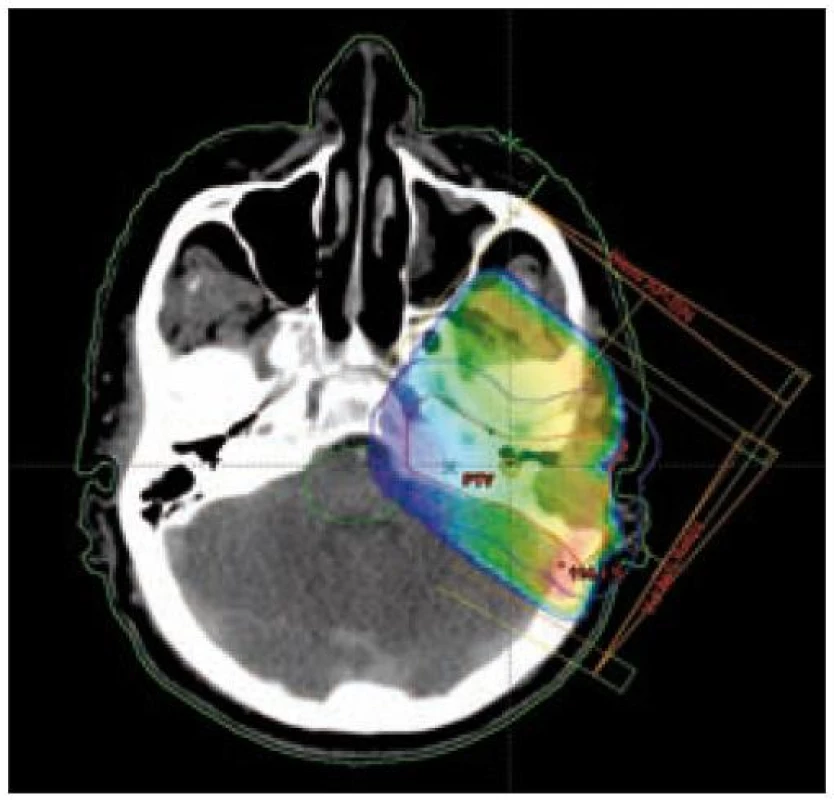
Obr. 5. Infiltrace kalvy, zakreslení klinického cílového objemu. 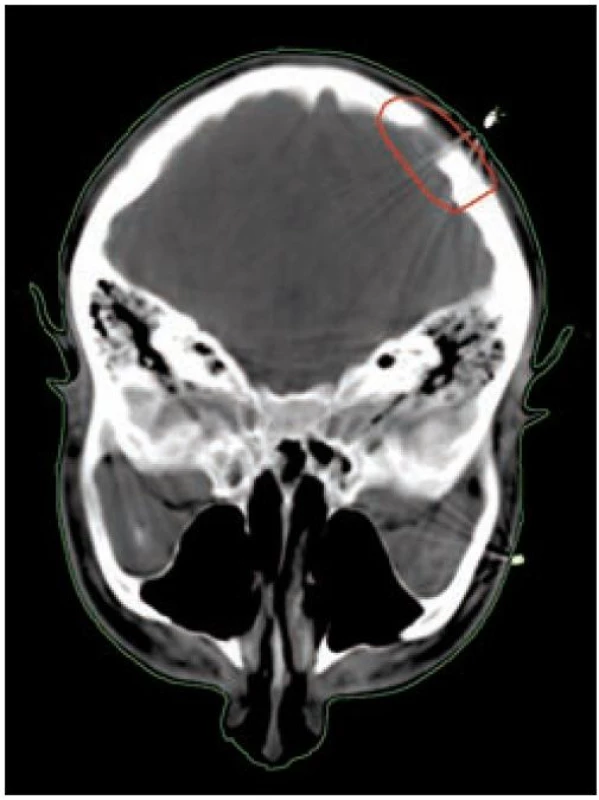
Obr. 6. Infiltrace kalvy, izodózní plán, rozložení dávky v nádoru. 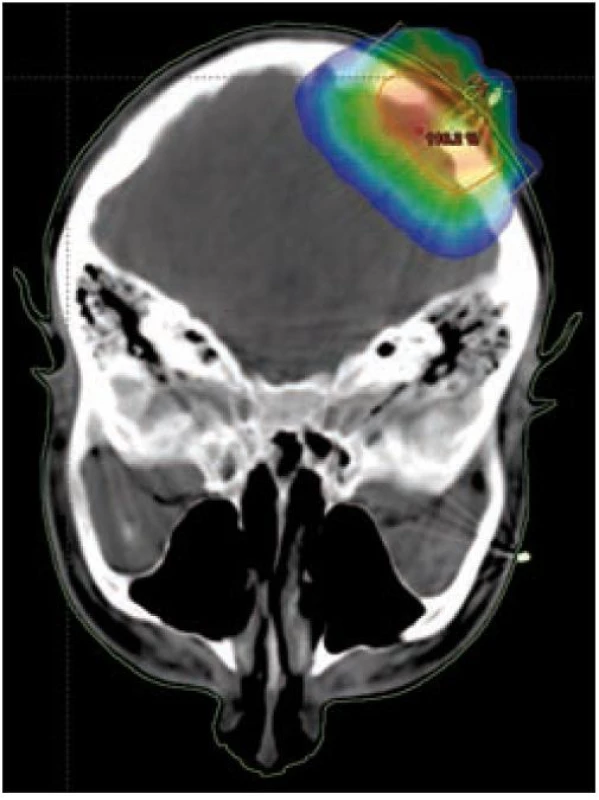
Účinnost radioterapie
Lokální kontrola choroby po radioterapii se uvádí 91–96 %. Kompletní remisi uvádí autoři v 78–90 %, recidivu v ozařovaném poli v 8–10 %. Vedlejší akutní postradiační reakce bývají malé, a to u 10–15 % ozařovaných. Může jít o lehký či střední erytém na kůži, suchost sliznic, překrvení a edém sliznice. Akutní postradiační reakce se hojí do 2–3 týdnů po skončení ozařovací série.
Pozdní postradiační reakce jsou uváděny ve 2–3 % pacientů. Závažnější pozdní postradiační reakce se mohou vyskytnout u opakovaných sérií radioterapie na tutéž lokalizaci (např. při recidivě onemocnění v jedné lokalizaci) [9].
Soubor pacientů léčených na Klinice radiační onkologie LF MU a MOÚ Brno
V Masarykově onkologickém ústavu bylo v posledních 20 letech léčeno radioterapií celkem 13 nemocných, z toho 9 mužů a 4 ženy. Průměrný věk našich pacientů byl 25,4 roků (rozmezí 18–45 roků). Někteří pacienti měli ozářeno více nádorových infiltrátů, případně byli ozařováni v několika ozařovacích sériích. Celkem bylo ozářeno 35 lokalizací. Jako zdroje záření jsme použili 13krát RTG povrchovou nebo hloubkovou terapii, v dřívějších letech i cesiový ozařovač 137Cs. Zbývajících 22 lokalizací bylo ozářeno brzdným zářením X lineárního urychlovače. Na našem pracovišti byla aplikována průměrná dávka záření 22 Gy.
Snášenlivost radioterapie byla u našeho souboru pacientů velmi dobrá, akutní postradiační reakce lehkého stupně (G1) byla pozorována u 3 pacientů, u 10 pacientů nebyla pozorována žádná objektivní akutní postradiační reakce.
Pozdní postradiační reakci těžšího stupně jsme pozorovali u jedné pacientky při opakovaných sériích radioterapie na recidivující onemocnění ve stejné lokalizaci.
Dle našich zkušeností při doporučovaných dávkách 20–24 Gy nejsou výrazné postradiační reakce. Nebezpečí pozdních chronických postradiačních změn bývá při opakovaných sériích radioterapie (reiradiaci) na tutéž lokalizaci recidivujícího onemocnění. Tyto pozdní postradiační reakce po opakovaných sériích radioterapie se mohou objevit i po mnoha letech po skončení radioterapie.
Závěr
Histiocytóza z Langerhansových buněk je velmi vzácné onemocnění a díky malé incidenci této choroby je i málo zkušeností s radioterapií histiocytózy. Radioterapie je prováděna pouze v největších radioterapeutických centrech a má významné místo v lokální léčbě této choroby. Jde o onemocnění velmi radiosenzitivní, takže k eliminaci nádorového infiltrátu stačí pouze nízké dávky záření. Snášenlivost radioterapie je u pacientů s LCH velmi dobrá, akutní postradiační reakce při aplikaci doporučených dávek (24 Gy) bývají minimální. Radioterapie má nenahraditelné místo v komplexní terapii histiocytózy vzhledem ke své účinnosti a nízké toxicitě při aplikaci uvedených nízkých dávek záření.
Podpořeno výzkumným záměrem FUNDIN MZ0MOU2005.
MUDr. Petr Čoupek
www.mou.cz
e-mail: coupek@mou.cz
Doručeno do redakce: 9. 9. 2010
Zdroje
1. Adam Z, Krejčí M, Pour L. Histiocytární choroby. Vnitř Lék 2009; 55 (Suppl 1): S109–S124.
2. Adam Z, Vaníček J, Šlampa P et al. Histiocytóza z Langerhansových buněk u osob dospělého věku – zkušenosti jednoho pracoviště a přehled léčebných možností. Vnitř Lék 2006; 52 : 355–370.
3. Aricò M. Langerhans cell histiocytosis in adults: more questions than answers? Eur J Cancer 2004; 40 : 1467–1473.
4. Jahraus CD, Russo S, Peñagarícano J et al. Radiotherapy dose fractionation in pediatric Langerhans cell histiocytosis. South Med J 2004; 97 : 1268–1269.
5. Minehan KJ, Chen MG, Zimmerman D et al. Radiation therapy for diabetes insipidus caused by Langerhans cell histiocytosis. Int J Radiat Oncol Biol Phys 1992; 23 : 519–524.
6. Mihova L, Yaneva M, Sopadjieva M et al. Primary solitary eosinophilic granuloma of the brain and postoperative radiotherapy: a clinical case. J BUON 2007; 12 : 125–128.
7. Minehan K, Chen M, Zimmerman D et al. Radiation therapy for diabetes insipidus caused by Langerhans cell histiocytosis. Int J Radiat Oncol Phys 1992; 23 : 519–524.
8. Olschewski T, Seegenschmiedt MH. Radiotherapy of Langerhans’ Cell Histiocytosis: Results and Implications of a National Patterns-of-Care Study. Strahlenther Onkol 2006; 182 : 629–634.
9. Olschewski T, Seegenschmiedt MH. Radiotherapy for bony manifestations of Langerhans cell histiocytosis. Review and proposal for an international registry. Strahlenther Onkol 2006; 182 : 72–79.
10. Nakasu S, Tsuji A, Fuse I et al. Intracranial solitary juvenile xanthogranuloma succefully treated with stereotactic radiosurgery. J Neurooncol 2007; 84 : 99–102.
11. Schiebe M, Schroeder HG, Hoffman W. Irradiation of histiocytosis X confined to the oral mucosa. Strahlenther Onkol 2001; 177 : 48–50.
12. Tothová E, Kulinich T, Horáková Z et al. Histiocytóza z Langerhansových buněk v ORL oblasti. Onkologie 2010; 4 : 209–210.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo Supplementum 2- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Postižení plic u pacientů s multiorgánovou formou histiocytózy z Langerhansových buněk. Popis 8 pacientů a přehled literatury
- Přínos PET-CT pro diagnostiku a sledování plicní formy histiocytózy z Langerhansových buněk
- Přehled léčby histiocytózy z Langerhansových buněk u osob dospělého věku
- Použití kladribinu v první linii léčby multifokální anebo multiorgánové formy histiocytózy z Langerhansových buněk u dospělých osob
- Radioterapie histiocytózy z Langerhansových buněk
- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Nekrobiotický xantogranulom – vzácná kožní komplikace u nemocného s mnohočetným myelomem
- Leukemie z dendritických buněk CD4+56+, typ DC2
- Systémová mastocytóza
- Histiocytóza z Langerhansových buněk u dospělých
- Histiocytóza z Langerhansových buněkz pohledu patologa
- Diagnostická patológia non-Langerhansových histiocytóz
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
- Slovo úvodem
- Granulomatóza z Langerhansových buněk
- Projevy histocytózy z Langerhansových buněk v ORL oblasti
- Projevy histiocytózy z Langerhansových buněk v orofaciální oblasti
- Představení histiocytárních chorob, o nichž pojednává toto supplementum časopisu Vnitřní lékařství
- Histiocytóza z Langerhansových buněk – kožní aspekty onemocnění
- Postižení CNS histiocytózou z Langerhansových buněk a Erdheimovou-Chesterovou nemocí. Přínos PET-CT vyšetření pro diagnostiku a vyhodnocení léčebné odpovědi
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Systémová mastocytóza
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání