-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPřínos PET-CT pro diagnostiku a sledování plicní formy histiocytózy z Langerhansových buněk
PET-CT in the diagnostics and monitoring of pulmonary Langerhans cell histiocytosis
In a sample of 7 patients with pulmonary LCH, we monitored disease activity through repeated PET-CT examinations. The small size of LCH infiltrates in bronchioles (pulmonary nodules) precludes direct measurement of their activity. Therefore, SUVmax (maximum standardized uptake value) in the right lung and SUVmax in the liver were measured, as this was achievable with the available PET-CT software. The maximum activity measured in the right lung to maximum activity measured in the liver ratio was used to express the pulmonary activity of the Langerhans cell histiocytosis, i.e. the SUVmax pulmo/SUVmax liver index. In total, 25 measurements were performed in 7 patients with pulmonary LCH. This index values correlated with the development of the disease activity evaluated through overall patient status, HRCT imaging of the lungs and according to functional examination of the lungs. So far, this is a pilot project and the usefulness of this index in evaluating activity of the pulmonary LCH will require further verification.
Key words:
PET-CT – Langerhans cell histiocytosis – diabetes insipidus
Autoři: Z. Adam 1; Z. Řehák 2; R. Koukalová 2; P. Szturz 1; L. Pour 1; M. Krejčí 1; P. Krupa 3; T. Nebeský 4; Z. Adamová 5; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Oddělení nukleární medicíny a pozitronové emisní tomografie Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák 2; Klinika zobrazovacích metod Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Petr Krupa, CSc. 3; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Vlastimil A. Válek, CSc. 4; Chirurgické oddělení Nemocnice Vsetín, přednosta prim. MUDr. Jaroslav Sankot 5
Vyšlo v časopise: Vnitř Lék 2010; 56(Supplementum 2): 123-130
Kategorie: Histiocytóza z Langerhansových buněk a některá další vzácná hematologická onemocnění
Souhrn
V souboru 7 pacientů s plicní formou LCH jsme se pokusili dokumentovat aktivitu plicní formy nemoci pomocí opakovaných PET-CT vyšetření. Malé rozměry plicních LCH infiltrátů v bronchiolech (plicních nodularit) neumožňují měřit přímo jejich aktivitu. Proto byla změřena hodnota SUVmax (maximum standardized uptake value) ve sférickém prostoru pravé plíce a hodnota SUVmax ve sférickém prostoru jater, což umožňuje programové vybavení těchto přístrojů. Pro vyjádření plicní aktivity histiocytózy z Langerhansových buněk byl pak použit poměr maximální aktivity naměřené v kulovitém objemu pravé plíce ku maximální aktivitě naměřené v kulovitém objemu jater, tedy index SUVmax pulmo/SUVmax hepar. Celkem bylo provedeno 25 měření u 7 pacientů s plicní formou LCH. Vývoj hodnoty tohoto indexu koreloval s vývojem aktivity nemoci, posuzované dle celkového stavu nemocných, HRCT zobrazení plic a dle funkčního vyšetření plic. Zatím jde o pilotní práci, přínos tohoto indexu pro hodnocení aktivity plicní formy LCH bude vyžadovat další ověření.
Klíčová slova:
PET-CT – histiocytóza z Langerhansových buněk – diabetes insipidusÚvod
Plicní forma histiocytózy z Langerhansových buněk (LCH) je vzácné onemocnění. Příznaky plicní formy LCH jsou netypické, kašel, mírné bolesti na hrudníku, případně dušnost a později pneumotorax. Nemoc vzniká ve formě drobných nodularit v plicním parenchymu, které pomalu přecházejí v kavitované nodularity a posléze silnostěnné a slabostěnné cysty. Jejich prasknutí může způsobit pneumotorax. V některých případech může být pneumotorax (vzniklý u mladého člověka) prvním symptomem této nemoci. Uvedené změny struktury plicní tkáně někdy provází i fibrotizace. Změny plicní struktury při LCH, viditelné při zobrazení plic metodou HRCT, ale i klasického RTG snímku plic, bývají mylně interpretovány jako plicní emfyzém. Obrazům plicní formy LCH jsou věnovány speciální publikace. Zde bychom jenom chtěli na obr. 1 dokumentovat, jak vypadají důsledky dřívějšího plicního postižení na současně provedeném snímku plic pomocí HRCT a při CT trojrozměrné rekonstrukci. Jedná se o pacientku, u níž byla plicní forma aktivní již před lety a nyní zůstávají důsledky, cysticky změněná plíce. Na obr. 1 je zřetelné, že i při těžkém postižení plic zůstává klasický snímek plic zcela nenápadný. Z prostého snímku plic nelze vůbec usuzovat na to, že tato žena má plicní formu histiocytózy, zatímco HRCT dokumentuje velmi těžké postižení plicního parenchymu. A dnešní CT přístroje umí nabídnout i trojrozměrný obraz plíce. Z obr. 1 vyplývá, že pro zodpovězení otázky, zda u pacienta je, či není přítomna plicní forma LCH, v žádném případě nestačí klasický RTG snímek plic, ale vždy je nutno provést HRCT plic.
Obr. 1. Obraz informuje, jak vypadá plicní forma LCH při různých způsobech zobrazení. Na snímku plic není zřetelné nic jednoznačně patologického, zatímco provedené HRCT plic zobrazuje velmi četné drobné plicní cysty, kterými je prostoupen celý plicní parenchym. Snímek plic však o nich neinformuje. Třetím způsobem zobrazení je třírozměrný obraz plic, vytvořený výpočetním systémem CT přístroje. V HRCT obraze není zřetelný četnější výskyt plicních nodularit, které jsou typické pro aktivní počínající formu nemoci. Jsou přítomny pouze četné cysty. Proto plicní postižení hodnotíme jako end stage formu poškození po dříve aktivní plicní formě LCH. 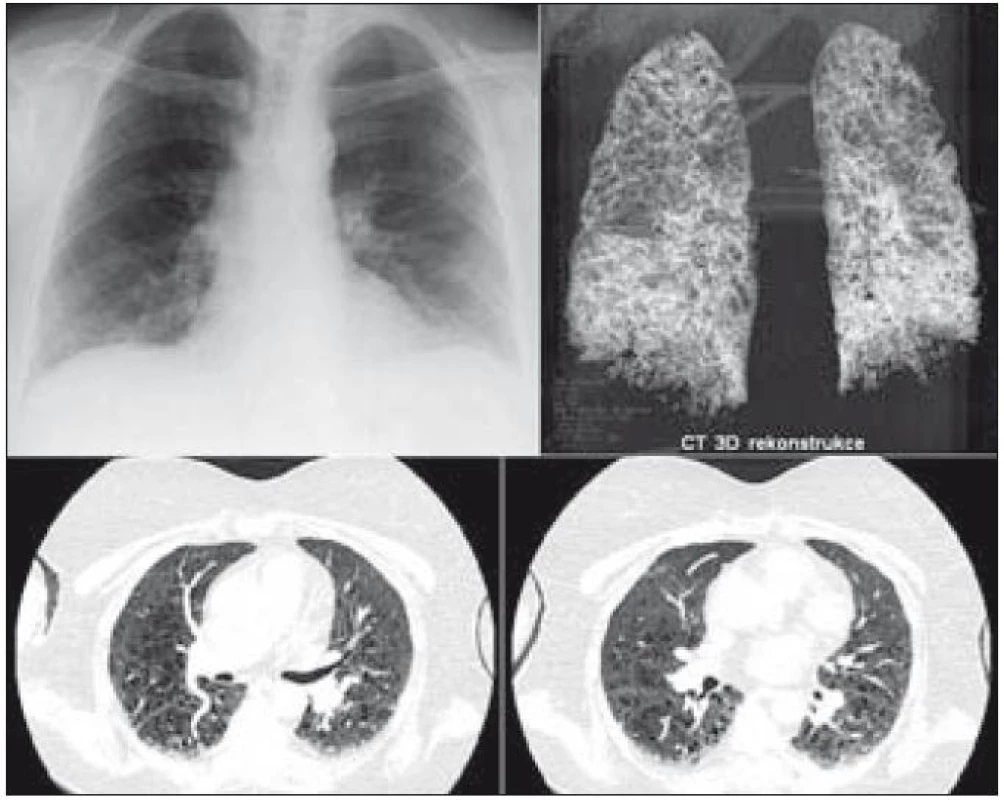
Diagnostikovat lze tuto nemoc histologickým vyšetřením plicní tkáně odebrané z místa, kde jsou přítomny mikronodularity. Alternativou je bronchoalveolární laváž, ale vyšetření přítomnosti CD1a pozitivních elementů (Langerhansových buněk) ve vzorku bronchoalveolární tekutiny není dostupné všem pracovištím, která dělají bronchoalveolární laváže.
LCH může být omezená pouze na plicní parenchym, což mívá obvykle lepší prognózu než plicní forma LCH, provázená postižením dalších orgánů (mozku, kostí, kůže, lymfatických uzlin).
Po stanovení diagnózy „plicní forma LCH“ stojí lékař před otázkou: Je tato nemoc stále aktivní a mám ji léčit? Nebo mám před sebou již důsledky dříve aktivní LCH a viditelné změny v plicích odpovídají konečné formě dříve aktivní, dnes neaktivní nemoci?
Odpovědi na tyto otázky se hledají velmi obtížně. U pacientů s LCH dochází totiž často ke spontánním remisím nemoci. Proto samotné stanovení diagnózy není současně indikací k zahájení léčby. Terapie je indikována až při průkazu progresivního vývoje nemoci.
Zvyšování četnosti nodularit na kontrolních HRCT plic signalizuje progresi. Jenže kvantifikace nodulů je obtížná. Zvětšování stávajících cyst je doběhem dříve aktivního procesu, a proto tyto změny nelze hodnotit jako progresi, byť jsou na HRCT dobře zřetelné.
Dalším záchytným bodem pro rozhodování o aktivitě, a tedy o indikaci léčby, je funkční plicní vyšetření. Jenže to je velmi hrubý ukazatel a nemusí rozlišit, zda jde o důsledek doběhu end stage změn v parenchymu či současné aktivity nemoci.
HRCT a funkční plicní vyšetření však jsou stále jedinými standardně používanými metodami pro hodnocení aktivity a rozhodování o léčbě.
PET-CT je metodou velmi přínosnou pro hodnocení aktivity kostních či jiných infiltrátů LCH. Low dose CT zobrazí osteolytická ložiska a PET aktivitu LCH v těchto ložiscích. Pro ložiskové formy LCH je PET-CT dnes standardně doporučovanou metodou pro hodnocení aktivity nemoci. U plicní formy LCH však jsou plíce postiženy jednak velkým počtem nodulů o velikosti několika milimetrů, které nelze současným PET-CT vyšetřením detekovat jako jednotlivá drobná ložiska, takže nelze použít klasického proměřování aktivity, jak jsme zvyklí z popisů PET-CT. Dle přehledu všech publikací o LCH v databázi Medline bylo asi 20 prací věnováno přínosu PET-CT hodnocení aktivity LCH a pouze jedna z těchto prací popisuje využití PET-CT zobrazení pro hodnocení aktivity plicní formy LCH.
Nyní na oddělení nukleární medicíny Masarykova onkologického ústavu vyvinuli novou metodu hodnocení aktivity plicní formy LCH s pomocí PET-CT vyšetření, jejíž přínos nyní testujeme. Cílem následujícího textu je popsat tuto novou metodu pro hodnocení aktivity plicní formy LCH, popsat korelaci této metody hodnocení plicní aktivity LCH s klinickým průběhem nemoci.
Metody zobrazení a soubor pacientů
PET a PET-CT vyšetření, metodika
U pacientů souboru jsme prováděli PET a později PET-CT po 6hodinovém lačnění v euglykemii. Aplikovaná aktivita byla v rozmezí 312–409 MBq 18F-FDG i.v. Akumulační fáze byla 60 min. Akvizice byla prováděna do roku 2008 na PET skeneru ECAT ACCEL SIEMENS ve 3D modu (3 vyšetření u 1 nemocného v letech 2004–2007) a později od roku 2008 na hybridním PET-CT skeneru True Point PET-CT Biograph 64 SIEMENS, a to vždy v rozsahu proximální třetiny stehen – baze lební, ve 4 případech i se snímáním hlavy. U Erdheimovy-Chesterovy choroby byly snímány i končetiny. Snímána byla emisní i transmisní data s korekcí absorpce a iterativní rekonstrukcí dat. Při akvizici na PET-CT skeneru je možné použít režim low dose CT (LD-CT) nebo high dose CT (HD-CT). Vzhledem k opakovaným kontrolám byl ve většině případů zvolen low dose CT protokol, díky kterému jsme výrazně zredukovali radiační zátěž. CT data byla rekonstruována v poli o šíři 500 nebo 700 mm dle habitu pacienta. Parametry LD-CT protokolu byly tyto: slice 5 mm, kolimace 24 × 1,2 mm, faktor stoupání (pitch) 0,8 mm. Parametry HD-CT protokolu byly zvoleny tyto: slice 5 mm, kolimace 24 × 1,2 mm, pitch 0,8 mm. Pro zvýraznění struktur plicního parenchymu byl použit rekonstrukční algoritmus: slice 1,5–2,0 mm, kernel B 80 f (ultra sharp), recon. increment 0,4 mm, window – lung.
Míru metabolické aktivity jsme stanovovali semikvantitativní analýzou SUVmax (maximum standardized uptake value) v měřitelné lézi (např. lymfatické uzlině, ložisku).
Popis metodiky vyjadřování aktivity LCH v plicích poměrem SUVmax pulmo/SUVmax hepar
Vzhledem k tomu, že drobné plicní noduly byly pod rozlišovacími možnostmi PET komponenty hybridního PET-CT skeneru (velikost nodulů se obvykle udává kolem 4–6 mm a rozlišovací schopnost PET komponenty použitého PET-CT přístroje je kolem 7 mm), stanovovali jsme difuzní metabolickou aktivitu v plíci jako orgánu a tuto jsme vztahovali vždy k aktuální metabolické aktivitě referenčního jaterního parenchymu, tedy poměr SUVmax pulmo/SUVmax hepar. Metabolickou aktivitu jsme měřili v horním a středním plicním poli vpravo. V horním i středním plicním poli jsme předpokládali maximum změn u dané diagnózy, navíc v dolním poli dochází k četným pohybovým artefaktům (PET snímání během dýchání, CT v zadrženém středním nádechu), vpravo proto, že se zde oblasti zájmu lépe vymezují (vzhledem k absenci perikardu a srdce) jen s vyloučením hilových struktur a pleury (kde aktivita může být vyšší i fyziologicky). S přihlédnutím k anatomickým poměrům jsme volili objem zájmu VOI (volume of interest) tvaru koule o průměru 6–8 cm, v játrech pak 8–10 cm. Při stanovení poměru aktivity plicní/jaterní dochází i ke snížení variability mezi jednotlivými studiemi, a navíc jen tak lze porovnat i měření z různých přístrojů (v našem případě PET a PET-CT).
SUVmax pulmo/SUVmax hepar v rozmezí 0,2–0,4 jsme označovali jako – (negativní), v rozmezí 0,4–0,5 jsme označovali jako + (slabě pozitivní), 0,5 a výše jako ++ (pozitivní).
Hodnoty v rozmezí 0,2–0,4 zpravidla běžně vídáme u vyšetření bez onkologických i neonkologických plicních chorob, mohli bychom je považovat za fyziologické, ale žádná normálová databáze takto stanovena dosud nebyla. Při zpětné analýze vzorku 100 náhodně vybraných PET-CT studií bez známé plicní onkologické nebo i neonkologické choroby jsme zjistili hodnoty menší než 0,3 u 79 % a menší než 0,4 u 96 % studií.
Soubor pacientů
Na našem pracovišti registrujeme celkem 23 pacientů s LCH, z toho 7 pacientů mělo prokázanou plicní formu a opakovaně prováděná PET-CT vyšetření. Ve všech případech to byli muži, kuřáci s mediánem věku 38 (32–55 let) v době stanovení diagnózy plicní formy LCH. Pouze jeden z těchto pacientů měl izolovanou plicní formu a tento pacient nebyl zatím léčen, u ostatních bylo postižení plic diagnostikováno v rámci multisystémové formy nemoci a těchto 6 pacientů dostalo nejméně jednu linii léčby. Pro ilustraci přínosu PET-CT pro diagnostiku rozsahu plicního i mimoplicního LCH uvedeme popis jednoho konkrétního nemocného. U ostatních popíšeme pouze výsledky vyšetření PET-CT, stav nemoci a její léčbu uvedeme v přehledné tabulce. Celkem bylo provedeno 25 měření u 7 pacientů.
Případ multisystémové formy nemoci, postihující kůži, lymfatické uzliny, plíce a kosti s agresivním průběhem
Muž, narozený v roce 1973, je výjimečný velmi agresivním průběhem multiorgánové formy LCH.
V říjnu roku 2008 (v 35 letech věku) si poprvé všiml zvětšených uzlin v oblasti pravého třísla a postupně zjistil, že zvětšené uzliny má nejen v třísle, ale také na krku. Měl bolesti v oblasti pravého třísla a v bederní krajině. Od listopadu roku 2008 se začaly objevovat undulující teploty, dosahující až 38 °C. Od léta roku 2008 jej provázela výrazná patologická únava (fatigue). Práce jej unavovala natolik, že po práci musel pro nezvladatelnou únavu ulehnout a prospat se, což dříve u něho nebývalo zvykem. První uzlina byla exstirpována z nadklíčku v listopadu roku 2008 a histologický závěr zněl: histiocytóza z Langerhansových buněk.
První návštěva pacienta na našem pracovišti byla v únoru roku 2009. V té době měl generalizované zvětšení lymfatických uzlin (průměr zvětšených uzlin byl 2,0–2,5 cm) na krku, v axilách a v tříslech, takže onemocnění svým klinických průběhem připomínalo maligní lymfom.
Dle vstupního PET-CT vyšetření bylo v CT obrazu zřetelné patologické zvětšení uzlin na krku, v axilách, v retroperitoneu. V malé pánvi dosahovaly uzliny největšího rozměru, jejich průměr byl 3,5 cm. Zvětšené uzliny výrazně akumulovaly fluorodeoxyglukózu při PET zobrazení, jejich aktivita se pohybovala od 5,0 SUVmax v axilách do 12,3 SUVmax v oblasti pravých ilických uzlin. Kostní postižení nebylo v té době detekováno. Low dose CT zobrazení, provedené v rámci PET-CT vyšetření, zobrazilo v plicním parenchymu četné nodularity, odpovídající plicní formě LCH.
Protože klinický průběh (mnohočetné uzlinové postižení, B symptomy) připomínal maligní lymfom, pro LCH byl zcela atypický, požádali jsme chirurgické pracoviště ve Vsetíně o exstirpaci další uzliny z třísla a o provedení excise kůže z perianální krajiny pro histologické potvrzení diagnózy. Výsledky všech histologických vyšetření potvrdily LCH, a navíc byl zjištěn nezvykle vysoký proliferační index.
U tohoto pacienta jsme provedli PET-CT vyšetření:
- před léčbou,
- po 4 cyklech chemoterapie 2-chloro-deoxyadenosinem,
- před zahájením léčby relapsu a pak při léčbě relapsu,
- po aplikaci dvou cyklů chemoterapie CHOEP (cyklofosfamid, vinkristin, prednison, adriamycin a etoposid)
- a 4 měsíce po vysokodávkované chemoterapii BEAM.
Dle PET-CT bylo zřetelné, že v době stanovení diagnózy byla akumulace fluo-rodeoxyglukózy pouze v lymfatických uzlinách, ale i plicní parenchym vykazoval změny odpovídající plicní formě nemoci. Po 4 cyklech léčby 2-chlorodeoxyadenosinem vymizela ložiska aktivity v PET obraze, ale za 2 měsíce od ukončení léčby došlo k relapsu nemoci. Při relapsu PET-CT vyšetření prokázalo zcela nová osteolytická ložiska v lopatě kosti pánevní se zvýšenou akumulací fluorodeoxyglukózy. Po dvou cyklech CHOEP zcela vymizela patologická akumulace fluorodeoxyglukózy, což korelovalo s jinak zřetelnou klinickou léčebnou odpovědí. Celotělové PET-CT zobrazení je uvedeno na obr. 2.
Obr. 2. PET-CT u muže narozeného roku 1973 s průběhem nemoci podobným lymfomu a s plicním postižením. Na prvním obrázku vlevo, vyšetření před léčbou, je velmi dobře zřetelná patologicky zvýšená aktivita v oblasti krčních, axilárních, ilických a tříselných uzlin, ale nebylo zřetelné poškození kostí. Na prostředním obrázku, který byl proveden v době relapsu 2 měsíce po ukončení léčby 2-chlorodeoxyadenosinem, je zřetelná patologicky zvýšená aktivita v oblasti krčních uzlin a dále v oblasti lopat kosti kyčelní, kde na low dose CT byla prokázána osteolytická ložiska. Na obrázku vpravo je vyhodnocení účinnosti léčby po dvou cyklech CHOEP a zde není zřetelná žádná patologická akumulace fluorodeoxyglukózy. 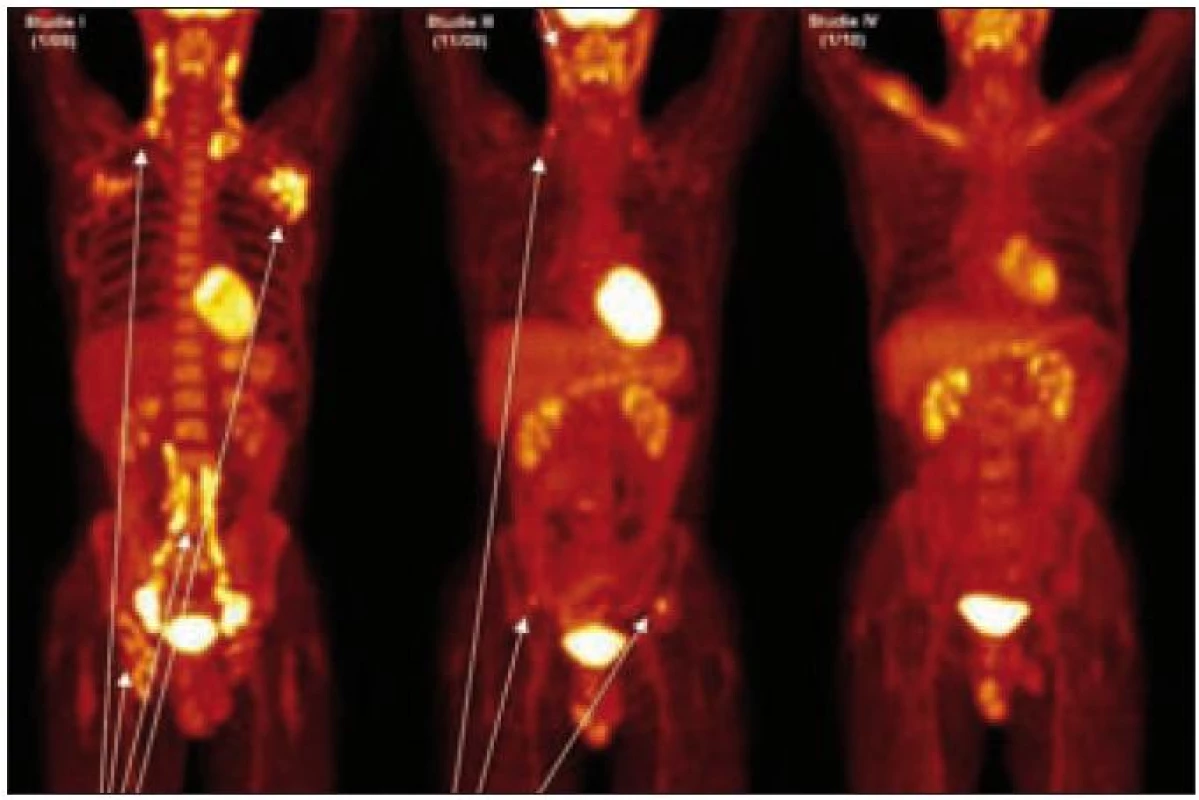
Na HRCT plic, provedeném před léčbou i v době relapsu, jsou zřetelné četné nodularity a cysty, tedy typický obraz plicní formy LCH. Jednotlivé nodularity, představující aktivní ložiska LCH, jsou však svou malou velikostí pod limitem detekce PET komponenty vyšetření, takže klasické PET hodnocení plic na základě četnosti a intenzity plicních ložisek není možné.
Pro vyhodnocování účinnosti léčby je však velmi žádoucí najít parametr, který je schopen odrážet aktivitu či neaktivitu v plicním parenchymu, který je markerem progrese či ústupu aktivity nemoci v plicním parenchymu. Proto pracovníci PET-CT oddělení Masarykova onkologického ústavu v Brně navrhli vyjádření aktivity plicní formy nemoci pomocí indexu, který vyjadřuje poměr hodnoty SUVmax v pravé plíci ku hodnotě SUVmax v játrech, jak je popsán výše.
U výše zmíněného pacienta koreluje excelentně hodnota indexu SUVmax pulmo/SUVmax hepar s vývojem aktivity nemoci, jak dokladuje obr. 3.
Obr. 3. Korelace PET-CT plic a indexu SUV<sub>max</sub> pulmo/SUV<sub>max</sub> hepar před léčbou, kdy byl postižen plicní parenchym četnými nodularitami, typickými pro plicní formu LCH, po 4 cyklech léčby 2-chlorodeoxyadenosinem, kdy tyto nodularity vymizely, dále v době relapsu nemoci, kdy došlo k recidivě znovu i v plicním parenchymu (opět nové plicní nodularity) a po 2 cyklech léčby relapsu režimem CHOEP (cyklofosfamid, etoposid, adriamycin, vinkristin a prednison), kdy opětovně se aktivita nemoci minimalizovala. 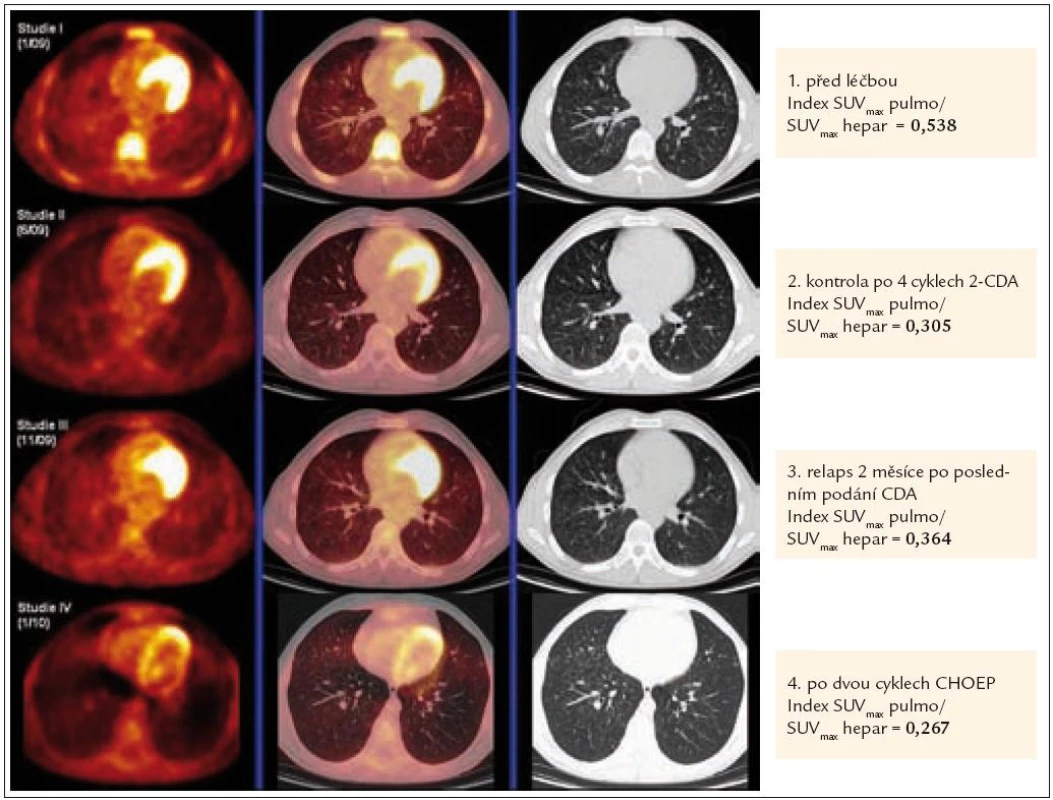
Index jsme dále ověřovali celkem na 7 pacientech, kteří byli v posledních letech u nás sledováni a kteří měli opakovaná PET nebo PET-CT vyšetření.
U všech těchto pacientů změny hodnoty uvedeného indexu korelují se změnami aktivity nemoci.
Vývoj hodnot indexu SUVmax pulmo/ SUVmax hepar u těchto pacientů shrnujeme do tab. 1.
Tab. 1. Naměřené hodnoty SUV<sub>max</sub> pulmo, SUV<sub>max</sub> hepar a jejich poměr a vývoj v průběhu léčby u 7 sledovaných nemocných. Celkem bylo provedeno 25 měření. 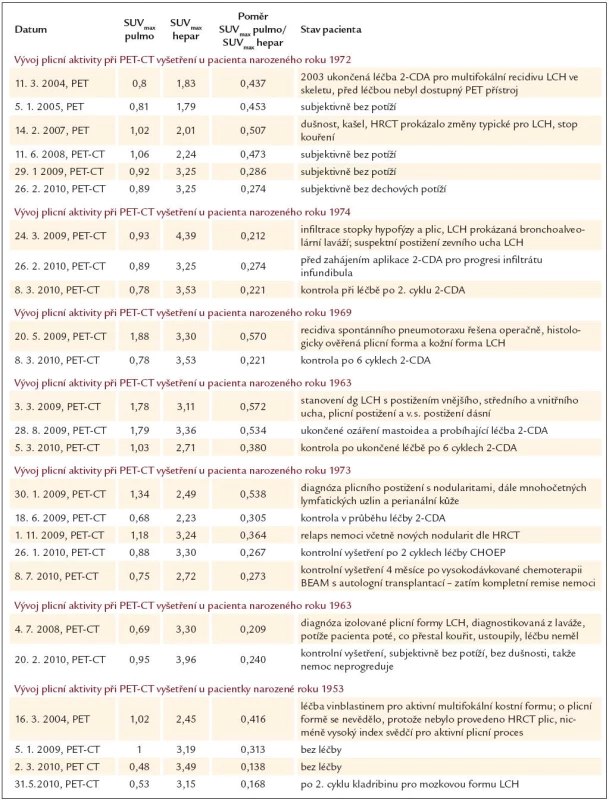
Diskuze
Stanovení rozsahu LCH a vyhodnocování účinnosti léčby
Po stanovení diagnózy LCH musí následovat ihned stanovení rozsahu postižení pomocí dostupných zobrazovacích metod, které se pak používají i pro vyhodnocování léčebné odpovědi. Aktivitu této nemoci totiž necharakterizuje žádný běžně dostupný laboratorní marker. Z laboratorních vyšetření má zásadní význam vyšetření hladin hormonů s cílem zjistit, zda je, či není přítomna endokrinopatie [29].
Pro detekci kostního postižení (osteolytických ložisek) byly a jsou základem snímky skeletu a scintigrafie skeletu pomocí 99mTc pyrofosfátu. Ložiska LCH v měkkých tkáních lze zobrazit pomocí magnetické rezonance (MR) a počítačové tomografie (CT).
V literatuře se objevilo několik zmínek o přínosu oktreotidové scintigrafie pro detekci ložisek LCH [1–3]. Tyto metody však nedošly širšího použití [4–11].
V posledních letech je hodně pozornosti věnováno přínosu PET a PET-CT zobrazení pro stanovení rozsahu nemoci a pro vyhodnocení léčebné odpovědi. Současné publikace hodnotí PET-CT vyšetření u LCH jako velmi přínosné jak pro rozsah nemoci, tak pro vyhodnocování léčebné odpovědi (tab. 2).
Tab. 2. Přínos PET-CT vyšetření pro hodnocení rozsahu nemoci a účinnosti léčby u pacientů s histiocytózou z Langerhansových buněk. 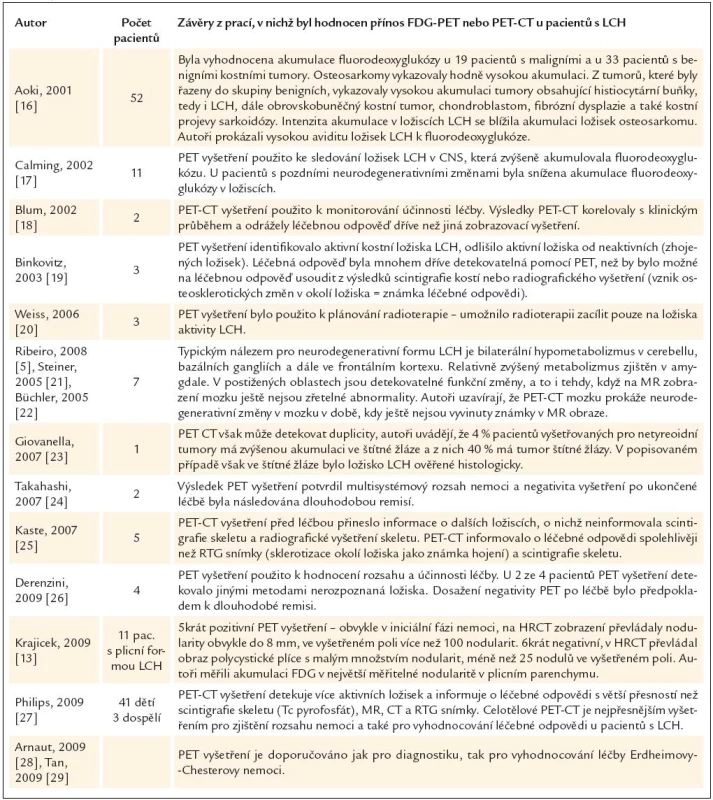
Velkým problémem je hodnocení plicní aktivity LCH. Na aktivitu nemoci lze usuzovat z přibývání či ubývání plicních nodularit při HRCT vyšetření plic. Funkční plicní vyšetření neodráží četnost nodularit, čili vlastní aktivitu nemoci, ale spíše pozdní změny typu plicních cyst, které však představují end stage nemoci [12–14].
Přínosem PET-CT vyšetření pro tuto skupinu nemocných se zabývá pouze jedna práce.
Krajicek [15] hodnotil přínos vyšetření PET u 11 pacientů s plicní formou LCH. Z těchto 11 pacientů bylo pozorováno zvýšení akumulace fluorodeoxyglukózy v plicním parenchymu u 5, z toho u 3 se jednalo o multiorgánové postižení. PET pozitivní pacienti měli v plicním parenchymu četné nodularity, obvykle menší než 8 mm, a počet nodulů dle HRCT hodnocení ve vyšetřeném poli byl vyšší než 100, zatímco PET negativní pacienti měli plicní formu LCH dominantně ve stadiu cyst s počtem nodulů ve vyšetřeném poli pomocí HRCT zobrazení menším než 25. Krajicek et al hodnotil pouze ty nemocné, u nichž nalezl tak velikou nodularitu, že ji bylo možno měřit na PET-CT [15].
Námi navržené a ověřené hodnocení plicní aktivity na základě indexu, poměru naměřené maximální hodnoty SUVmax ve sférickém prostoru pravé plíce ku maximální hodnotě SUVmax, naměřené ve sférickém prostoru jater – index SUVmax pulmo/SUVmax hepar – zatím nebylo v odborné literatuře publikováno a bude vyžadovat ověření na větším souboru pacientů. Uvedený index může být jistě ovlivněn mnoha dalšími faktory. V současnosti však neexistuje mimo HRCT plic a funkčního vyšetření plic jiná vyšetřovací metoda, která by přesněji informovala o aktivitě plicní formy LCH. Klasické PET-CT vyšetření a hodnocení není u plicní formy proveditelné, protože rozměry nodularit jsou menší, než je schopna PET kamera rozlišit. Proto považujeme měření a dlouhodobé sledování indexu SUVmax pulmo/SUVmax hepar za velmi užitečné doplnění v současnosti existujících zdrojů informací o plicní formě LCH. U konkrétního pacienta pak klademe důraz nejen na dosaženou hodnotu, ale hlavně na vývoj indexu v čase.
Náš soubor není velký, proto naši práci považujeme za pilotní a bude vhodné ji dalším testováním prověřit.
Závěr pro praxi
- PET-CT vyšetření je přínosné pro stanovení rozsahu LCH nemoci a vyhodnocování její aktivity.
- Ze všech lokalit nemoci se nejobtížněji stanovuje aktivita nemoci v plicním parenchymu, protože zde, na rozdíl od jiných tkání, nevznikají velká ložiska, ale jen drobné nodularity o rozměru několika mm, obvykle pod detekční úrovní PET snímačů. U těchto nemocných se nám jeví jako přínosné vyhodnocování indexu SUVmax pulmo/SUVmax hepar.
- Na příkladu 7 pacientů dokládáme korelaci tohoto indexu s aktivitou nemoci. Přínos tohoto indexu jsme ověřili zatím na malém počtu nemocných, pro jeho definitivní vyhodnocení je nutné ověření na větším souboru nemocných.
Tato publikace byla připravena v rámci projeku MUNI/A/1012/2009 s názvem „Optimalizace diagnostiky a terapie maligních chorob a komplikací, které tyto maligní nemoci provázejí, s využitím nových molekulárně biologických metod“, a také je součástí aktivit v rámci grantů IGA MZ: NR9225, NS10387 a NS10406.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 9. 9. 2010
Zdroje
1. Calming U, Jacobsson H, Henter JI. Detection of Langerhans cell histiocytosis lesions with somatostatin analogue scintigraphy – a preliminary report. Med Pediatr Oncol 2000; 35 : 462–467.
2. Weinmann P, Crestani B, Tazi A et al. 111In-pentetreotide scintigraphy in patients with Langerhans’ cell histiocytosis. J Nucl Med 2000; 41 : 1808–1812.
3. Lastoria S, Montella L, Catalano L et al. Functional imaging of Langerhans cell histiocytosis by 111In-DTPA-D-Phe(1)-octreotide scintigraphy. Cancer 2002; 94 : 633–640.
4. Schmidt GP, Reiser MF, Baur-Melnyk A. Whole-body imaging of bone marrow. Semin Musculoskelet Radiol 2009; 13 : 120–133.
5. Steiner M, Prayer D, Asenbaum S et al. Modern imaging methods for the assessment of Langerhans’ cell histiocytosis-associated neurodegenerative syndrome: case report. J Child Neurol 2005; 20 : 253–257.
6. Grois N, Fahrner B, Arceci RJ et al. Histiocyte Society CNS LCH Study Group. Central nervous system disease in Langerhans cell histiocytosis. J Pediatr 2010; 156 : 873–881.
7. Ertan G, Huisman TA. Susceptibility weighted imaging in neurodeneneration in Langerhans cell histiocytosis. J Pediatr 2010; 156 : 1032.
8. Grois N, Prayer D, Prosch H et al. CNS LCH Co-operative Group. Neuropathology of CNS disease in Langerhans cell histiocytosis. Brain 2005; 128 : 829–838.
9. Carpinteri R, Patelli I, Casanueva FF et al. Pituitary tumours: inflammatory and granulomatous expansive lesions of the pituitary. Best Pract Res Clin Endocrinol Metab 2009; 23 : 639–650.
10. Daldrup-Link HE, Franzius C, Link TM et al. Whole-body MR imaging for detection of bone metastases in children and young adults: comparison with skeletal scintigraphy and FDG PET. AJR Am J Roentgenol 2001; 177 : 229–236.
11. Naumann R, Beuthien-Baumann B, Fischer R et al. Simultaneous occurrence of Hodgkin’s lymphoma and eosinophilic granuloma: a potential pitfall in positron emission tomography imaging. Clin Lymphoma 2002; 3 : 121–124.
12. Tazi A. Adult pulmonary Langerhans’ cell histiocytosis. Eur Respir J 2006; 27 : 1272–1285.
13. Prasse A, Kayser G. Seltene zystische Lungenerkrankungen: Lymphangioleimyomatose, pulmonale Langerhanszell-Histiocytose, lymphocytäre interstitielle Pneumonie. Dtsch Med Wochenschr 2010; 135 : 461–465.
14. Nagarjun Rao R, Moran CA, Suster S. Histiocytic disorders of the lung. Adv Anat Pathol 2010; 17 : 12–22.
15. Krajicek BJ, Ryu JH, Hartman TE et al. Abnormal fluorodeoxyglucose PET in pulmonary Langerhans cell histiocytosis. Chest 2009; 135 : 1542–1549.
16. Aoki J, Watanabe H, Shinozaki T et al. FDG PET of primary benign and malignant bone tumors: standardized uptake value in 52 lesions. Radiology 2001; 219 : 774–777.
17. Calming U, Bemstrand C, Mosskin M et al. Brain 18FDG PET scan in central nervous system langerhans cell histiocytosis. J Pediatr 2002; 141 : 435–440.
18. Blum R, Seymour JF, Hicks RJ. Role of 18FDG-positron emission tomography scanning in the management of histiocytosis. Leuk Lymphoma 2002; 43 : 2155–2157.
19. Binkovitz LA, Olshefski RS, Adler BH. Coincidence FDG-PET in the evaluation of Langerhans’ cell histiocytosis: preliminary findings. Pediatr Radiol 2003; 33 : 598–602.
20. Weiss SE, O’Connor L, Welsh JS. Refinement of radiation therapy based on PET data in an adult with Langerhans cell histiocytosis of soft tissues. Clin Adv Hematol Oncol 2006; 4 : 290–292.
21. Ribeiro MJ, Idbaih A, Thomas C et al. 18F-FDG PET in neurodegenerative Langerhans cell histiocytosis: results and potential interest for an early diagnosis of the disease. J Neurol 2008; 255 : 575–580.
22. Büchler T, Cervinek L, Belohlavek O et al. Langerhans cell histiocytosis with central nervous system involvement: follow-up by FDG-PET during treatment with cladribine. Pediatr Blood Cancer 2005; 44 : 286–288.
23. Giovanella L, Ceriani L, Crippa S et al. Imaging in endocrinology: Langherans cell histiocytosis of the thyroid gland detected by 18FDG-PET/CT. J Clin Endocrinol Metab 2007; 92 : 2866–2867.
24. Takahashi T, Yoshimoto M, Kondoh N. Spontaneously regressed Langerhans cell histiocytosis of lymph nodes in an elderly patient. Intern Med 2007; 46 : 1757–1760.
25. Kaste SC, Rodriguez-Galindo C, McCarville ME et al. PET-CT in pediatric Langerhans cell histiocytosis. Pediatr Radiol 2007; 37 : 615–622.
26. Derenzini E, Fina MP, Stefoni V et al. MACOP-B regimen in the treatment of adult Langerhans cell histiocytosis: experience on seven patients. Ann Oncol 2010; 21 : 1173–1178.
27. Phillips M, Allen C, Gerson P et al. Comparison of FDG-PET scans to conventional radiography and bone scans in management of Langerhans cell histiocytosis. Pediatr Blood Cancer 2009; 52 : 97–101.
28. Arnaud L, Malek Z, Archambaud F et al. 18F-fluorodeoxyglucose-positron emission tomography scanning is more useful in follow up than in the initial assessment of patients with Erdheim-Chester disease. Arthritis Rheum 2009; 60 : 3128–3138.
29. Tan IB, Padhy AK, Thng CH et al. Intensely hypermetabolic extra-axial brainstem tumor in Erdheim-Chester disease. Clin Nucl Med 2009; 34 : 604–607.
30. Fichter J, Doberauer C, Seegenschmiedt H. Langerhans cell histiocytosis in adults: An interdisciplinary challenge. Dtsch Arztebl 2007; 104: A2347–A2353.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo Supplementum 2- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Postižení plic u pacientů s multiorgánovou formou histiocytózy z Langerhansových buněk. Popis 8 pacientů a přehled literatury
- Přínos PET-CT pro diagnostiku a sledování plicní formy histiocytózy z Langerhansových buněk
- Přehled léčby histiocytózy z Langerhansových buněk u osob dospělého věku
- Použití kladribinu v první linii léčby multifokální anebo multiorgánové formy histiocytózy z Langerhansových buněk u dospělých osob
- Radioterapie histiocytózy z Langerhansových buněk
- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Nekrobiotický xantogranulom – vzácná kožní komplikace u nemocného s mnohočetným myelomem
- Leukemie z dendritických buněk CD4+56+, typ DC2
- Systémová mastocytóza
- Histiocytóza z Langerhansových buněk u dospělých
- Histiocytóza z Langerhansových buněkz pohledu patologa
- Diagnostická patológia non-Langerhansových histiocytóz
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
- Slovo úvodem
- Granulomatóza z Langerhansových buněk
- Projevy histocytózy z Langerhansových buněk v ORL oblasti
- Projevy histiocytózy z Langerhansových buněk v orofaciální oblasti
- Představení histiocytárních chorob, o nichž pojednává toto supplementum časopisu Vnitřní lékařství
- Histiocytóza z Langerhansových buněk – kožní aspekty onemocnění
- Postižení CNS histiocytózou z Langerhansových buněk a Erdheimovou-Chesterovou nemocí. Přínos PET-CT vyšetření pro diagnostiku a vyhodnocení léčebné odpovědi
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hemofagocytující lymfohistiocytóza
- Erdheimova-Chesterova nemoc v obrazech
- Systémová mastocytóza
- Histiocytóza z Langerhansových buněk u dětí a dospívajících
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



