-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
Our experience with endoscopic drainage of pancreatic pseudocysts
Introduction:
The authors first provide and overview of the main knowledge on pancreatic pseudocysts. They discuss the individual types of pancreatic pseudocysts, their clinical picture, complications and diagnosis. As part of the differential diagnosis, they emphasise the need to distinguish pancreatic pseudocysts from cystic tumours and benign cysts. Special attention is then paid to various modalities of treatment of pancreatic pseudocysts.Methods:
The authors present their own results of endoscopic drainage of pancreatic pseudocysts, one of the key options in the treatment of this condition.Results:
A total of 33 patients (24 men and 9 women) were treated by endoscopic drainage between September 2007 and March 2009. Endoscopic drainage was performed transduodenally in 4 patients and via the transgastric route in 29 patients; 6 times with endosonographic device and with duodenoscope after endosonographic alignment in 27 patients.Conclusion:
The authors conclude that endoscopic drainage is an effective method of treatment of pancreatic pseudocysts.Key words:
pancreatic pseudocysts – endosonography – endoscopic drainage
Autoři: Bohuslav Kianička 1
; I. Novotný 2; M. Souček 1; I. Řiháček 1; J. Špác 1
Působiště autorů: II. interní klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta prof. MU Dr. Miroslav Souček, CSc. 1; Interní hepatogastroenterologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jan Lata, CSc. 2
Vyšlo v časopise: Vnitř Lék 2010; 56(9): 910-914
Kategorie: Původní práce
Souhrn
Úvod:
Autoři nejprve podávají přehled základních poznatků o pseudocystách pankreatu. Zabývají se postupně jednotlivými typy pankreatických pseudocyst, klinickým obrazem, komplikacemi a diagnostikou. V rámci diferenciální diagnostiky zdůrazňují především nutnost odlišit pankreatickou pseudocystu od cystických nádorů a od benigních cyst. Zvláštní pozornost věnují různým modalitám léčby pankreatických pseudocyst.Metodika:
V další části práce autoři uvádějí vlastní výsledky endoskopické drenážní léčby pankreatických pseudocyst, která je jednou z významných možností léčby těchto stavů.Výsledky:
Od září roku 2007 do března roku 2009 bylo takto léčeno 33 pacientů (24 mužů a 9 žen). Endoskopické drenáže pankreatických pseudocyst byly provedeny 4krát transduodenálně a 29krát transgastricky, a to v 6 případech endosonografickým přístrojem a ve 27 případech duodenoskopem po endosonografickém zaměření.Závěr:
Autoři uzavírají, že endoskopická drenáž je efektivní metodou léčby pankreatických pseudocyst.Klíčová slova:
pankreatické pseudocysty – endosonografie – endoskopická drenážní léčbaPřehled problematiky
Definice
Pankreatické pseudocysty (cystoidy) vznikají při akutní i chronické pankreatitidě a traumatu. Tyto cystické léze jsou ohraničeny neepitelizovanou stěnou granulační nebo fibrózní tkáně a jsou tvořeny kolekcí pankreatického sekretu. Obsah pseudocysty bývá čirý, bělavý či tmavě zbarvený. Pseudocysty se tvoří intrapankreaticky i extrapankreaticky a mohou být unilokulární i multilokulární. Pseudocysty jsou nejčastější cystické útvary pankreatu a tvoří 75–80% všech cystických lézí [1].
Pravé cysty pankreatu (kdy jejich stěna je pokryta epitelem) tvoří maximálně 15% všech cystických útvarů pankreatu. Pravé benigní pankreatické cysty představují méně než 5% a cystické nádory 5–10% všech dutinových útvarů pankreatu.
Etiologie
Postakutní pseudocysty vznikají obvykle za 4–6 týdnů po atace akutní pankreatitidy. Jejich incidence se pohybuje v jednotlivých studiích mezi 2 a 15% [2]. Při akutní pankreatitidě vznikají pseudocysty zřejmě z akutních tekutinových kolekcí. Další příčinou může být disrupce hlavního pankreatického vývodu s únikem pankreatické šťávy do intersticia. Obsah cystoidu bohatý na pankreatické enzymy je původně sterilní, ale může se kontaminovat. Velikost postakutních cystoidů může dosáhnout i několik desítekcm v průměru. Mohou být lokalizovány v jakékoliv části pankreatu i peripankreatického prostoru. Většina (85%) akutních pseudocyst se spontánně zresorbuje během 4–6 týdnů.
Pseudocysty v terénu chronické pankreatitidy bývají obvykle drobnější. Přibližně u 25% pacientů s chronickou pankreatitidou se v jejím průběhu objeví pseudocysta, kdy při alkoholických chronických pankreatitidách je výskyt častější. Cystoid při chronické pankreatitidě vzniká v důsledku exacerbace zánětlivého procesu nebo obstrukce vývodu a intraduktální hypertenze [3]. Udává se, že chronické pseudocysty, na rozdíl od akutních, málokdy spontánně vymizí.
Pseudocysty pankreatu se dále mohou objevit po traumatu (tupá poranění břicha).
Již dlouho je známo, že až 50% pseudocyst spontánně regreduje. Až do 80. let minulého století se pak regrese pseudocyst v časovém horizontu delším než několik týdnů považovala za nepravděpodobnou a panovala obava z komplikací [4]. Avšak podrobná studie z Mayo prokázala, že pseudocysty se mohou resorbovat kdykoliv bez narůstajícího rizika komplikací s pravděpodobností nepřímo úměrnou velikosti cystoidu [5]. Z cyst menších než 4cm v průměru se spontánně resorbuje 90% a z cyst nad 6cm v průměru jen 20% [6].
Klinický obraz
Pseudocysty pankreatu často nevyvolávají žádné potíže. Mohou se manifestovat tupou abdominální bolestí. V některých případech je prvním projevem pseudocysty některá z komplikací, kdy zejména větší cystoidy mohou vyvolat kompresi okolních orgánů. Dále se může vytvořit intracystické aneuryzma, jehož rupturou vznikne masivní krvácení do pseudocysty [7]. Pokud dojde k infekci obsahu pseudocysty, vznikne absces, a to většinou při akutních pseudocystách. Dalšími komplikacemi mohou být ascites nebo fluidotorax.
Diagnostika
V diagnostice pseudocyst pankreatu mají rozhodující význam zobrazovací metody, a to transabdominální ultrasonografie (USG), computerová tomografie (CT), endosonografie (EUS), magnetická rezonance (MR) a magnetická rezonanční cholangiopankreatikografie (MRCP). Zejména EUS má význam jednak v diagnostice, ale ještě více v diferenciální diagnostice cystických lézí pankreatu. Význam EUS je dále zvýrazněn možností cílené punkce cystických útvarů a analýzou jejich obsahu [8,9].
Diferenciální diagnostika
Pankreatické pseudocysty je třeba odlišit především od cystických nádorů a od benigních cyst. Od cystických nádorů se pseudocysty liší především tím, že jejich membrána nemá epitelovou výstelku, mají vysoký obsah amyláz a lipáz a nemají zvýšenou hodnotu onkomarkerů (CEA a Ca 19–9). Diagnóza pankreatické pseudocysty je pravděpodobná, pokud jejich vzniku předcházela akutní pankreatitida, pokud je přítomna chronická pankreatitida, pokud je cystická léze lokalizována mimo pankreas a pokud je vysoká koncentrace amyláz v obsahu pseudocysty.
Léčba pankreatických pseudocyst
Indikace k léčbě vyplývají z klinických souvislostí, zejména ze skutečnosti, že značná část pseudocyst spontánně vymizí a několikatýdenní prodlení v léčbě riziko komplikací významně nezvyšuje. Před léčbou je nutné zvažovat velikost pseudocysty a její případné změny, symptomatologii, komplikace a komunikaci s pankreatickými vývody [10–12]. Obecně by se měly léčit zvětšující se pseudocysty nad 5cm v průměru a pseudocysty symptomatické.
Indikací k bezodkladné léčbě jsou již výše zmíněné komplikace pseudocysty.
Metody léčby pankreatických pseudocyst spočívají v jejich drenáži nebo exstirpaci.
Drenáže mohou být tyto:
- endoskopická, která se dělí na transpapilární (tedy cestou ERCP) a transenterickou (a to transgastrickou a transduodenální – nejlépe pod kontrolou EUS),
- perkutánní, a to pod kontrolou USG nebo CT,
- chirurgická.
Dříve se udávalo, že se mají léčit všechny chronické pseudocysty, které mají větší průměr než 4–6cm. Toto již v současnosti neplatí a též pseudocysty větší než 6cm mají být drénovány pouze tehdy, když splňují jedno z následujících indikačních kritérií pro drenážní léčbu pseudocyst:
- symptomatické pseudocysty,
- postupně se zvětšující pseudocysty,
- komplikace pseudocyst (infekce, krvácení, komprese okolních orgánů),
- suspekce z malignity (chirurgická léčba).
Endoskopická léčba spočívá v drenáži pseudocyst. Drenáž může být:
- transpapilární (cestou ERCP) nebo
- transenterická (cystogastrostomie nebo cystoduodenostomie).
Při endoskopických drenážních výkonech se doporučuje krytí antibiotikem [13].
Transpapilární drenáž se provádí při ERCP. Její aplikace připadá v úvahu, pokud se jedná o pseudocystu komunikující s pankreatickým duktálním systémem. Po provedení spíše kratší pankreatické sfinkterotomie (nebo event. i bez ní) se do pseudocysty zavede plastový duodenopankreatický stent. Pokud je před pseudocystou přítomna stenóza duktálního systému, provádí se ještě před aplikací stentu endoskopická dilatace této stenózy bužiemi nebo dilatačními balónky. Výkon je úspěšný ve vysokém procentu případů (ve více než 90%) a má poměrně málo komplikací (nejčastěji akutní pankreatitida nebo infekce – vznik abscesu).
Transgastrická nebo transduodenální drenáž spočívá ve vytvoření cystogastrostomie (pokud se pseudocysta nachází v těle nebo ocase pankreatu) anebo cystoduodenostomie (pokud je cysta uložena v hlavě pankreatu) [14]. Úspěšnost kolísá podle různých autorů od 75 do 97% a dlouhodobá úspěšnost (bez recidiv) od 64 do 89%. Provádí se buď endoskopicky, tedy duodenoskopem s laterální optikou, nebo pomocí EUS.
Endoskopicky se pomocí jehlového nože vytvoří přes stěnu trávicí trubice komunikace s pankreatickou pseudocystou, do které je postupně zaveden plastový stent. Drénovaná cysta se většinou spontánně uzavírá. Podmínkou je vzdálenost ne větší než 1cm mezi pseudocystou a lumen žaludku nebo duodena [15]. Tato vzdálenost se dá určit sonograficky, CT, a nejlépe EUS. Pokud není k dispozici lineární EUS, potom další podmínkou je zřetelné vyklenutí pseudocysty do lumen žaludku nebo duodena.
Výhodnější než endoskopicky je však provést drenáž pod kontrolou EUS, která kromě určení vzdálenosti mezi trávicí trubicí a pseudocystou umožní též určit tloušťku stěny pseudocysty a přítomnost větších cév ve stěně trávicí trubice, a tím snížit procento komplikací [16]. Princip metody spočívá v punkci pseudocysty (pod EUS kontrolou) přes stěnu žaludku nebo duodena. Do pseudocysty se zaveden vodič a otvor mezi pseudocystou a trávicí trubicí se rozšíří většinou tak, že se dilatuje balónkovým dilatátorem. Tímto otvorem se pak zavede jeden nebo několik plastových stentů, většinou s dvojitým pigtailem. Pseudocysta se kontroluje v 1–2měsíčních intervalech (sonograficky nebo CT) a při jejím vymizení se stenty endoskopicky odstraní. Technická úspěšnost výkonu je až 90%, komplikace se udávají do 15% a mortalita do 1%. K hlavním komplikacím patří perforace a krvácení. Recidivy vznikají u 10–20% pacientů. Celková morbidita endoskopických drenáží je 20% a mortalita 0,23%.
Perkutánní drenáž pseudocyst je indikována, pokud není možná léčba endoskopická, event. ani chirurgická. Výkon je kontraindikovaný, je li nález suspektní z malignity, existuje li podezření na přítomnost krve v pseudocystě, je li přítomen tenzní ascites a při těsné stenóze pankreatického duktu, kde hrozí možnost vzniku pankreatikokutánní fistuly. Úspěšnost léčby se udává v 80–90%, morbidita 15–20%, mortalita 1–3%. K recidivám dochází v 5–10%.
Chirurgická léčba pseudocyst spočívá v zevní či vnitřní drenáži nebo v resekci.
Zevní drenáž je indikována u infikované pseudocysty a intracystického krvácení.
Vnitřní drenáž je indikována u dobře ohraničených a nekomplikovaných cystoidů. Nejčastěji se provádí cystogastrostomie a cystojejunostomie, méně častá jsou cystoduodenostomie [17,18]. Drenážní operace lze provádět laparoskopicky.
Resekce pankreatu je vhodným řešením u cystoidů v terénu chronické pankreatitidy.
Indikace chirurgické léčby pseudocyst pankreatu jsou zejména tyto:
hlavní indikací chirurgické léčby je podezření na malignitu,
komplikované pseudocysty,
v případě neúspěchu endoskopické léčby.
Morbidita chirurgické léčby je 10–30%, mortalita 1–5% a recidivy 10–20%.
Vlastní výsledky
Soubor nemocných a metodika
Studium souboru probíhalo od září roku 2007 do března roku 2009. Sledovaný soubor se skládá ze 33 pacientů, a to 24 mužů (průměrný věk 49 let) a 9 žen (průměrný věk 72 let), kteří prokazatelně prodělali akutní pankreatitidu nebo akutní exacerbaci chronické pankreatitidy a u nichž byla zobrazovacími vyšetřovacími metodami objevena cystická formace v oblasti pankreatu. Pacienti byli vyšetřeni břišní ultrasonografií včetně barevného mapování cystické formace k intraluminálnímu vyloučení toků (aneuryzma nebo pseudoaneuryzma cévní), počítačovou tomografií s RTG kontrastní látkou, a pokud se uvažovalo o endoskopickém řešení, také endosonografickým vyšetřením. Nebyly přítomny klinické ani zobrazovacími metodami prokazatelné známky portální hypertenze. Koncentrace onkomarkerů Ca 19-9 a CEA v séru byla v normálním rozmezí. Cystické formace byly monolokulární, největší rozměr byl větší než 8cm. Parametry krevní srážlivosti byly v normě. Kontaktní oblast pseudocysta – stěna žaludku nebo duodena a absence interponovaných cévních struktur byla ověřena EUS. Při tom jsme se také rozhodli pro drenáž endosonografickým přístrojem. Po endosonografickém nalezení a označení místa vhodného pro drenáž jsme samotný drenážní výkon provedli duodenoskopem. Drenáž byla prováděna pod zajišťovací antibiotickou léčbou (ciprofloxacin). V premedikaci pacienta jsme použili intravenózně midazolam, fentanyl, buscolysin a lokálně jsme realizovali anestezii orofaryngu Xylocainem spray. Postup provedení drenáže byl následující: punkce pseudocysty transgastricky nebo transduodenálně cystotomem (punkční EUS jehlou), extrakce řezného nástroje, mandrénu, odsátí části obsahu pseudocysty (aspirát byl vyšetřen na amylázu, CEA, Ca 19-9, bakteriologicky, cytologicky) a skiaskopické ověření pozice, pak následovalo zavedení vodiče do dutiny pseudocysty, extrakce cystotomu (jehly) a ponechání vodiče, vše pod skiaskopickou kontrolou. Po vodiči pak byl zaveden pokračovací bužiový dilatátor 5–8,5 Fr, kterým byl dilatován punkční kanál. Po extrakci bužiového dilatátoru a po stále ponechaném vodiči byl zaveden dilatační balónek a punkční kanál byl dilatován na 10mm. Pak byla podél vodiče zavedena vodicí kanyla s druhým tužším vodičem a po něm byly postupně zavedeny 2–4 drény, převážně 10 Fr. Extrakcí vodičů a zhotovením RTG dokumentace byl výkon ukončen. Pacient zůstával 3 dny na parenterální výživě, od 2. dne je dovolen příjem tekutin per os. V den výkonu kontrolujeme lokální nález na břiše, krevní obraz, amylázu v séru, další den krevní obraz, koncentraci C-reaktivního proteinu (CRP) v séru a USG nález. V dalším období kontrolujeme klinický stav, krevní obraz a hladinu CRP v séru, ultrazvukem lokální nález à 14 dnů 1. měsíc, pak jednou měsíčně po dobu 4 měsíců. V případě příznivého průběhu po 4–6 měsících drény endoskopicky extrahujeme a sledujeme pacienta ještě 1 rok v 2měsíčních intervalech: lokální nález (USG), krevní obraz, amylázu v séru, CRP a klinický stav.
Výsledky
Endoskopické drenáže pankreatických pseudocyst byly provedeny 4krát transduodenálně a 29krát transgastricky, a to v 6 případech endosonografickým přístrojem a ve 27 případech duodenoskopem po endosonografickém zaměření (obr. 2 a 3). Důvodem byl ve většině případů širší pracovní kanál duodenoskopu (4,2mm) v porovnání s endosonografickým přístrojem (3,7mm), což umožnilo použití drénů většího průměru (10 Fr). Hladina amylázy v aspirátu byla ve všech případech vyšší než její sérová hladina, koncentrace CEA ani v jednom případě nepřesáhla normální rozmezí v séru. Koncentrace Ca19–9 byla nalezena v aspirátu z pseudocysty v širokém rozmezí 600–120 000. Cytologické vyšetření aspirátu neprokázalo přítomnost buněk podezřelých z malignity. U 9 pacientů došlo od 3. dne k vzestupu sérové koncentrace CRP na 15násobek a více, bez současných subjektivních obtíží. U těchto pacientů jsme opakovali endoskopický výkon a u všech byl nalezen zkalený sekret odtékající z pseudocysty drenážním kanálem. Dilatovali jsme drenážní kanál balonkem na 14mm, propláchli jsme dutinu pseudocysty roztokem Betadine v ředění 1 : 10 a zavedli jsme další jeden až dva 10 Fr drény. U všech 9 pacientů pak došlo k rychlému poklesu CRP a mohli být do týdne propuštěni do domácí péče. U jedné pacientky došlo v průběhu drenáže ke krvácení do dutiny pseudocysty, které bylo řešeno zavedením nazopseudocystického drénu. Pseudocysta byla proplachována po dobu 3 dnů, poté byl drén extrahován, krvácení nepokračovalo, ani se neopakovalo a nevyžadovalo krevní převod. U jednoho pacienta došlo k dislokaci 2 drénů do dutiny pseudocysty. Po endoskopické dilataci kanálu balonkem na 14mm byly dislokované drény z pseudocysty extrahovány endoskopicky pomocí extrakčního košíku. K recidivě pseudocysty v průběhu sledovaného období jednoho roku po extrakci drénů nedošlo ani u jednoho pacienta.
Obr. 1. Endoskopická drenáž pankreatické pseudocysty (transgastricky, duodenoskopem), jsou patrny 2 vodiče v pankreatické pseudocystě. 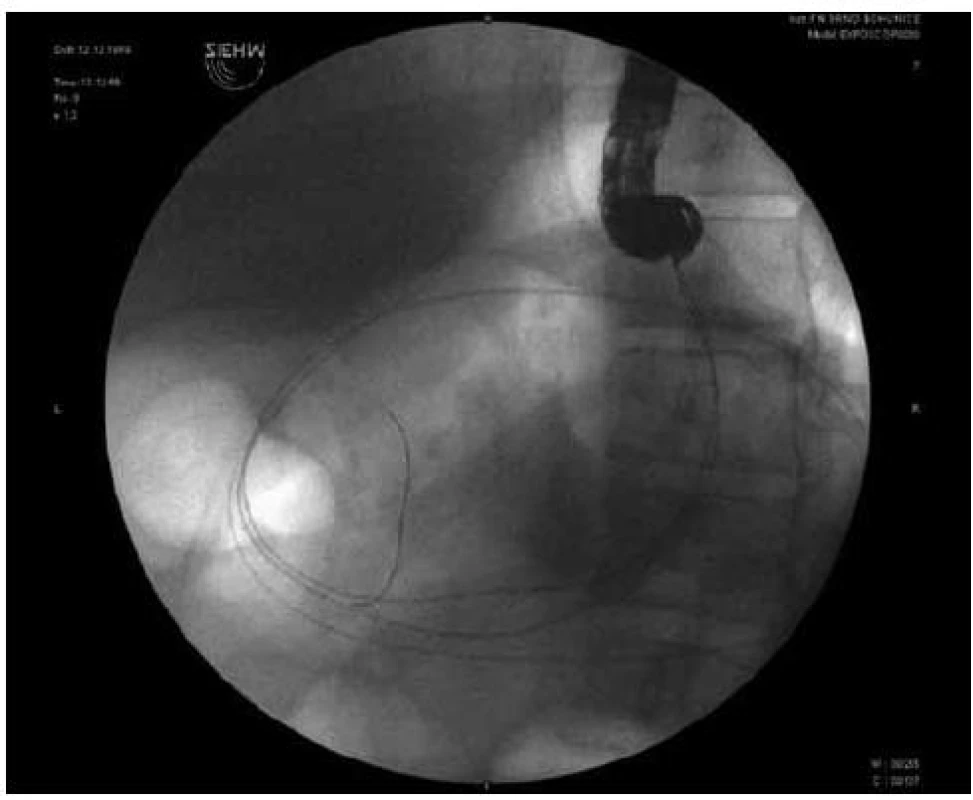
Obr. 2. Endoskopická drenáž pankreatické pseudocysty (transgastricky, duodenoskopem), zavedení 3. drénu. 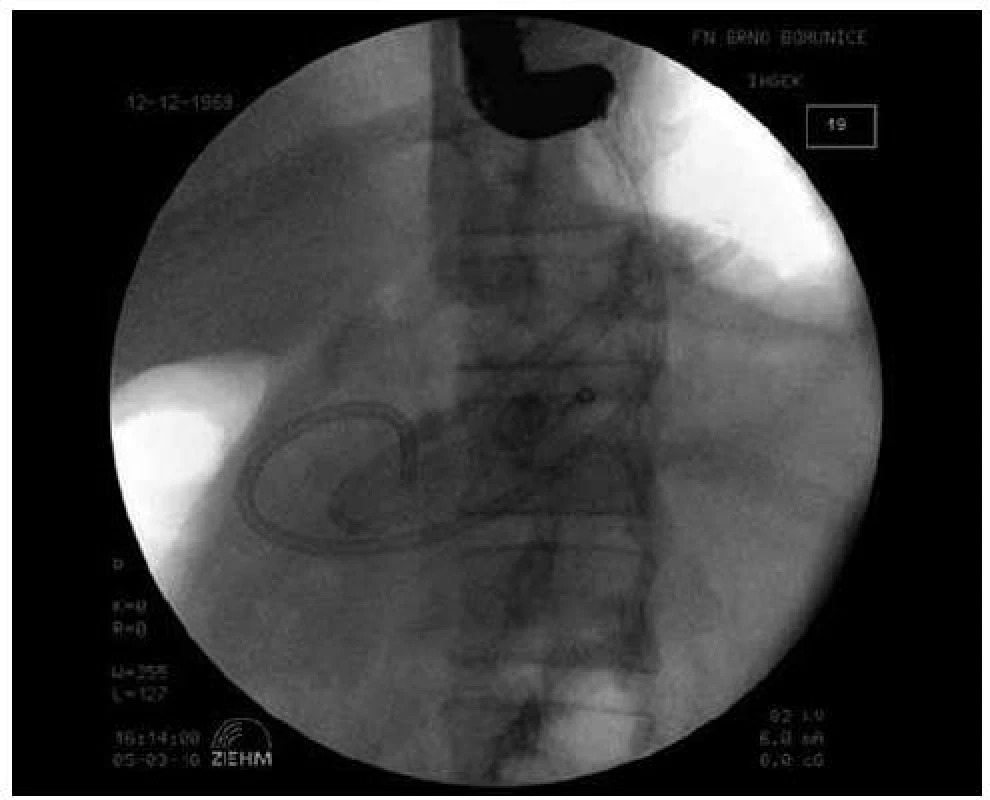
Diskuze
Endoskopická drenáž je jednou z významných možností léčby pankreatických pseudocyst [13,14]. Předpokladem je těsný kontakt pseudocysty se stěnou žaludku (obr. 1) nebo duodena [15]. V případě, že je na stěně žaludku endoskopicky patrna imprese podmíněná pseudocystou, lze punkci a drenáž provést čistě endoskopicky. Endosonografické posouzení vztahu pseudocysty k žaludku nebo duodenu, případně okolním cévním strukturám, a provedení výkonu pod trvalou EUS kontrolou vnáší do celé procedury více jistoty a kontroly. Zásadním technickým požadavkem je dostatečná dilatace punkčního kanálu na 10–14mm, která umožní drenáž i ne zcela tekutých součástí obsahu pseudocysty (např. tkáňového detritu). V opačném případě hrozí po zablokování drenáže infikování a zhnisání obsahu pseudocysty. I v tomto případě lze situaci řešit endoskopickou cestou, a to dilatací kanálu na větší průměr, proplachem dutiny pseudocysty, případně zavedením nazopseudocystického drénu k opakovaným proplachům. Antibiotické krytí pacienta pro období drenáže je vhodné [13], protože endoskopickou drenáž nelze ani při dodržení sebepřísnějších podmínek (vzhledem k pasáži endoskopu ústy, jícnem a žaludkem pacienta) považovat za sterilní výkon. Z onkomarkerů má největší význam pro rozlišení pseudocysty a serózního a mucinózního cystického tumoru hladina CEA. Hladina Ca 19-9 dosahuje často velmi vysokých hodnot bez klinického významu [19,20], což potvrzují také naše výsledky.
Obr. 3. Těsný kontakt stěny pankreatické pseudocysty se stěnou žaludku v endosonografickém obraze. 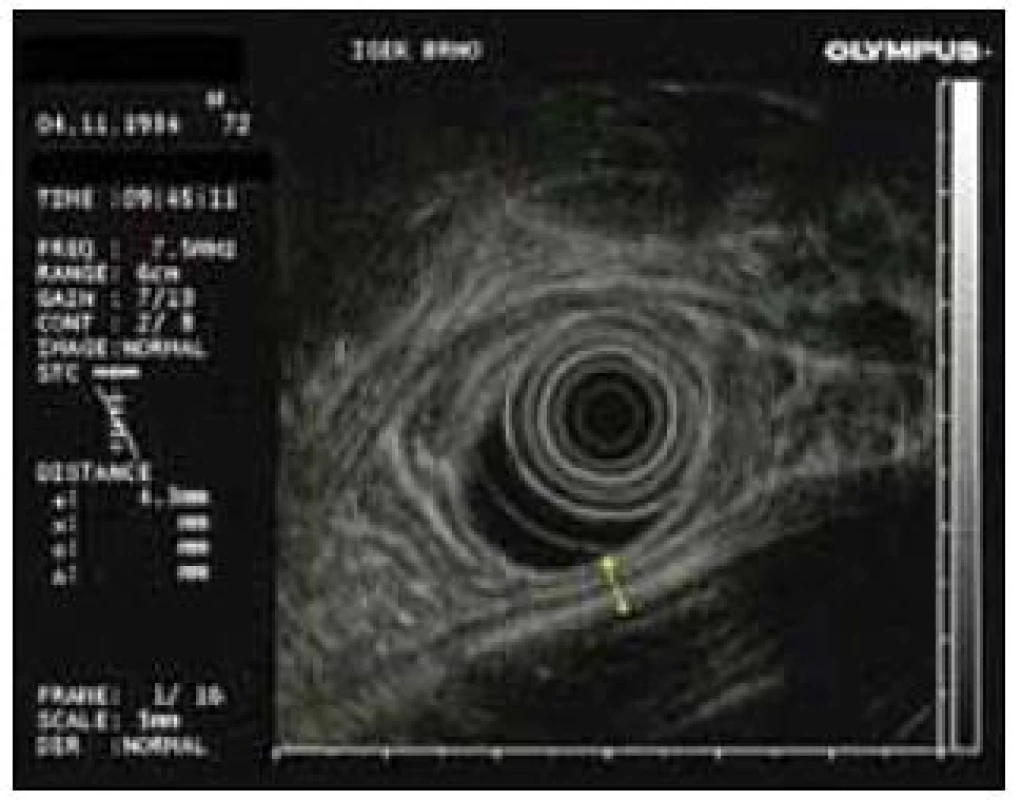
Závěr
Endoskopická drenáž je efektivní metodou léčby pankreatických pseudocyst, kdy za použití endosonografického zacílení, resp. kontroly, se jedná o metodu bezpečnou i v případě, že imprese pseudocystou na žaludeční stěně není zřetelná. Dostatečná dilatace drenážního kanálu má zásadní význam pro efektivitu drenáže a prevenci infekčních komplikací. I v případě zhnisání pseudocysty je další dilatace drenážního kanálu, proplach a drenáž efektivní metodou léčby.
MU Dr. Bohuslav Kianička, Ph.D.
www.fnusa.cz
e mail: bohuslav.kianicka@fnusa.cz
Zdroje
1. Jurgoš L, Kužela L, Hrušovský Š et al. Gastroenterológia. Bratislava: Veda 2006.
2. Rau B, Hokenmaier J, Schoenberg M et al. Management of postacute pancreatic pseudocyst. Digestion 1995; 56 : 312 – 313.
3. Dítě P et al. Chronická pankreatitida. Praha: Galén 2002.
4. Špičák J. Akutní pankreatitida. Praha: Grada Publishing 2005.
5. Vitas GJ, Sarr MG. Selected management of pancreatic pseudocysts: operative versus expectant management. Surgery 1992; 111 : 123 – 130.
6. Pitchumoni C, Agarwal N. Pancreatic pseudocysts: when and how should be drainage performed? Gastroenterol Clin North Am 1999; 28 : 615 – 639.
7. Gumaste VV, Pitchumoni CS. Pancreatic pseudocyst. Gastroenterologist 1996; 4 : 33 – 43.
8. Ahmad NA. The role of EUS in diagnosis of cystic lesion of the pancreas. In: DDW 2004 Session Handout Book. New Orleans 2004 : 307 – 310.
9. Frossard JL, Amouyal P, Amouyal G et al. Performance of endosonography - guided fine needle aspiration and biopsy in the diagnosis of pancreatic cystic lesions. Am J Gastroenterol 2003; 98 : 1516 – 1524.
10. Parks RW, Tzovaras G, Diamond T et al. Management of pancreatic pseudocysts. Ann R Coll Surg Engl 2000; 82 : 383 – 387.
11. Sharma SS, Bhargawa N, Govil A. Endoscopic management of pancreatic pseudocyst: a long‑term follow‑up. Endoscopy 2002; 34 : 203 – 207.
12. Aghdassi A, Mayerle J, Kraft M et al. Diagnosis and treatment of pancreatic pseudocysts in chronic pancreatitis. Pancreas 2008; 36 : 105 – 112.
13. Keil R, Námešný I, Drábek J et al. Endoskopická drenáž pankreatických pseudocyst. Miniinvazivní terapie 1997; 5 : 34 – 36.
14. Sahel J. Endoscopic drainage of pancreatic cysts. Endoscopy 1991; 23 : 181 – 184.
15. Zavoral M, Dítě P, Špičák J et al. Nové trendy v digestivní endoskopické diagnostice a léčbě. Praha: Grada Publishing 2000 : 141 – 142.
16. Fockens P, Johnson TG, van Dullemen HM et al. Endosonographic imaging of pancreatic pseudocysts before endoscopic transmural drainage. Gastrointest Endosc 1997; 46 : 412 – 416.
17. Pitt H. Indications for surgery in acute pseudocyst. In: Bradley E (ed). Acute pancreatitis: Diagnosis a therapy. Raven Press: New York 1994 : 207 – 215.
18. Piskač P, Riebel O, Hnízdil L et al. Emergency ERCP and acute biliary pancreatitis. Bratisl Lék Listy 1999; 100 : 668 – 671.
19. Brugge WR, Lewandrowski K, Lee - Lewandrowski E et al. Diagnosis of pancreatic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology 2004; 126 : 1330 – 1336.
20. Vlček P, Korbička J, Krpenský A et al. Retrorectal Cyst Hamartoma. Monduzzi editore, International Proceeding Division – full text. Bologna 2001 : 265 – 269.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2010 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Dávkování a správná titrace dávky pregabalinu
-
Všechny články tohoto čísla
- Metabolický syndróm a tuhosť aorty
- Liečime správne pacientov s claudicatio intermittens?
- Normalizovaný smoothness index a parametrický populační RDH index losartanu u pacientů s čerstvě zjištěnou hypertenzí a metabolickým syndromem
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Kardiovaskulárna morbidita u pacientov po liečbe nádorov testis
- Rivaroxaban a inhibitory faktoru Xa v klinické praxi
- Hereditární angioedém – opomíjená diagnóza
- XV. medzinárodný kongres pre výživu a metabolizmus pri chorobách obličiek, 25.– 28. mája 2010, Lausanne (Švajčiarsko)
- Dopis adresovaný prof. MU Dr. Zdeňku Adamovi, CSc.
- Dopis adresovaný prof. MU Dr. Zdeňku Adamovi, CSc.
-
Zemřel doc. MU Dr. Dušan Mrkos, CSc.,
editor emeritus časopisu Vnitřní lékařství - Profesor Jiří Ehrmann jubilantem
-
Cikánková V, Forejtová Š, Ištvánková E et al. Rehabilitace po revmatochirurgických výkonech.
Praha: Maxdorf Jessenius 2010. Počet stran 223. ISBN 978- 80-7345- 206- 3. - Prof. MU Dr. Andrej Dukát, CSc., FESC – šesťdesiatročný
- Multidisciplinárny prístup k liečbe gastroenteropankreatických neuroendokrinných tumorov
- Artériová hypertenzia spojená s ortostatickou hypotenziou
- Imunoterapia a dlhodobá chemoprofylaxia v prevencii recidivujúcich uroinfekcií u žien
- Adrenálne incidentalómy – je súčasný manažment racionálny?
- Lipoproteínový profil séra pri novozistenej artériovej hypertenzii. Úloha aterogénnych lipoproteínov v patogenéze ochorenia
- Statínová myopatia – rarita, alebo realita?
- Kontrola glykemie u kriticky nemocných je oprávněná a účinná
- Srdce a obličky – osudový vzťah
- Hypertenze u pacienta s diabetes mellitus
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Srdce a obličky – osudový vzťah
- Naše zkušenosti s endoskopickou drenážní léčbou pankreatických pseudocyst
- Statínová myopatia – rarita, alebo realita?
- Adrenálne incidentalómy – je súčasný manažment racionálny?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



