-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRETROPERITONEÁLNÍ FIBRÓZA: NOVÉ ONEMOCNĚNÍ ZPŮSOBENÉ AZBESTEM?
Autoři: Toomas Uibu
Působiště autorů: Tampere University Hospital, Tampere, Finsko
Vyšlo v časopise: Urol List 2006; 4(2): 50-53
Převzato a přeloženo z Current Medical Literature: Urology 2005; 11(1): 1-5.
ÚVOD
Retroperitoneální fibróza (RPF), nazývaná také Ormondovo onemocnění, je méně častou fibrotickou poruchou retroperitoneálního prostoru charakterizovanou silnou fibrotickou tkání pokrývající abdominální aortu a další retroperitoneální struktury (obr). Fibrotická tkáň se obvykle rozšiřuje z oblasti renálních arterií do oblasti pánve [1]. Laterálně se rozšiřující fibróza může „uvěznit“ uretery a způsobit obstrukci a hydronefrózu.
První informace v literatuře pocházejí od Simpsona z roku 1868 [2] a Albarrana z roku 1905 [3]. RPF byla popsána jako klinický fenomén americkým urologem Johnem K. Ormondem. V roce 1948 popsal 2 případy bilaterální ureterální obstrukce způsobené retroperitoneálním fibrotickým plakem [4]. Komplexní studie zabývající se etiologií, patogenezí a léčbou RPF byla publikována v roce 1978 Wagenknechtem a Hardym [5].
VÝSKYT
RPF je poměrně vzácně se vyskytující onemocnění. Po první Ormondově informaci bylo v následujících 15 letech popsáno pouze přibližně 100 případů [6]. Koep a Zuidema popsali 481 případů v letech 1984 až 1973 [7]. V 50. a 60. letech 20. století došlo k zvýšení výskytu RPF, což ovšem nelze vysvětlovat lepšími diagnostickými metodami [6,8]. V současné době je v databázi Medline více než 1 800 záznamů RPF.
V roce 1987 Wagenknecht odhadoval prevalenci RPF ve střední Evropě na 1 z 200 000 [5]. Toto číslo bylo založeno na 430 případech RPF zaznamenaných v multicentrické studii 2 025 chirurgů a radiologů na 70 evropských klinikách. Incidence 1/200 000 za rok byla zaznamenána v 90. letech 20. století v Nizozemí [9].
V populační studii provedené ve Finsku jsem se svými kolegy zjistil incidenci RPF standardizované podle věku 0,10/100 000 osob za 1 rok a prevalenci 1,38/100 000 obyvatel [10]. Z naší studie byly vyloučeny případy související s maligním onemocněním. Incidence standardizovaná podle věku byla 2krát vyšší u mužů (0,14) než u žen (0,07). Predominance mužů nad ženami 2 : 1, zaznamenaná v roce 1977 Koepem a Zudeimou [7], stále platí.
RPF je obvykle diagnostikována mezi 40. a 70. rokem života [5]. Průměrný věk v době diagnózy v naší studii byl 56 let. RPF se vzácně objevuje u dětí, pouze 23 případů bylo popsáno v anglicky psané literatuře [11]. Byl zaznamenán jeden případ RPF u plodu [12].
DIAGNÓZA A LÉČBA
Hlavním počátečním steskem u téměř všech pacientů s RPF je špatně lokalizovatelná bolest v oblasti břicha, boku nebo zad [7]. Také se někdy vyskytuje úbytek váhy, horečka, nevolnost a otok dolní končetiny. Zrádný počátek onemocnění a jeho nespecifické symptomy a příznaky mohou oddálit vyhledání lékařské péče. V době diagnózy se u většiny případů vyvinula hydronefróza [1]. Z toho plyne, že jsou u většiny pacientů zvýšeny laboratorní hodnoty ukazující na renální dysfunkci. často se vyskytuje zvýšená sedimentace erytrocytů (ESR) a anémie [13], u těchto případů ESR často souvisí s aktivitou onemocnění.
Dříve byla nejpřínosnějším vyšetřením při diagnostikování RPF intravenózní urografie. Typickým nálezem při urografii je uni - nebo bilaterální dilatace ureteru a renálního kalichu a mediální deviace ureterů. V dnešní době se rutinně provádí počítačová tomografie břicha (CT) a zobrazovací vyšetření magnetickou rezonancí (MRI). Tato vyšetření poskytují vynikající informaci o rozsahu fibrózy a pomohou odlišit fibrózu od maligních tumorů [14-16]. Další užitečnou pomůckou při diagnostice i sledování je renální ultrasonografie (USG) [17,18].
Při diferenciální diagnóze RPF je třeba zvážit přítomnost lymfomů, sarkomů a maligních onemocnění močového měchýře nebo střeva. Pravidlem je histologické vyšetření tkáně získané otevřenou nebo CT--naváděnou biopsií, ovšem empirická léčba retroperitoneální masy radiologickým sledováním je další obvyklou strategií [19].
Mikroskopický obraz RPF se pohybuje od aktivního zánětu s četnými lymfocyty, plazmatickými buňkami, eozinofily a makrofágy až po hustou a homogenní pojivovou tkáň obsahující pouze příležitostně fibroblasty a zánětlivé buňky [20-22]. Histologická diagnóza se obvykle zakládá na bázi nespecifického zánětu a fibrózy a hlavním úkolem histologického vyšetření je vyloučení maligních procesů.
Existují 3 hlavní možnosti léčby RPF:
- a) operace
- b) zavedení ureterálního stentu
- c) léčba steroidy nebo jiná medikamentózní terapie
Ad a) Ureterolýza, poprvé provedena Ormondem v roce 1946 zůstává jednou z nejefektivnějších léčebných možností. Při této proceduře je ureter uvolněn z fibrotické tkáně a umístěn laterálně [8]. Ureter je izolován od fibrotické tkáně zabalením do omenta nebo retroperitoneálního tuku pro prevenci recidivy [23]. Laparoskopickou ureterolýzu lze úspěšně provádět s nižší pooperační morbiditou, ale je časově náročnější [24,25].
Ad b) V současnosti nahradilo v některých centrech zavádění ureterálního stentu s protizánětlivou medikací otevřenou operaci. Výhodami tohoto postupu jsou vyhnutí se operaci a zkrácení doby hospitalizace, zatímco nevýhodami je menší mechanický vliv a nemožnost získání biopsie [26].
Ad c) Další hlavní léčbou RPF je terapie kortikosteroidy. Účinek kortikosteroidů při redukci fibrotické tkáně a úleva systémových symptomů byly prokázány v četných nekontrolovaných studiích [27-29]. Terapie kortikosteroidy může být aplikována samostatně, v případě obstrukce ureteru je kombinována s ureterolýzou nebo zavedením ureterálního stentu [26]. V některých případech byl jako alternativa nebo doplněk k steroidům aplikován tamoxifen [30,31]. Dalšími imunomodulačními medikamenty aplikovanými v případech rezistence na steroidy jsou cyklofosfamid a azatioprin [32]. Možnosti léčby závisí na stupni obstrukce ureteru a uremii, přítomnosti komorbidit a schopností pacienta podstoupit operaci. V současné době je prognóza RPF příznivá. Studie prováděné v poslední době vykazují více než 90% míru remise u vhodně léčených případů [33,34].
Obr. 1. Abdominální CT-sken pacienta s retroperitoneální fibrózou; na skenu je patrná hustá masa pokrývající abdominální aortu a dolní dutou žílu (šipky). 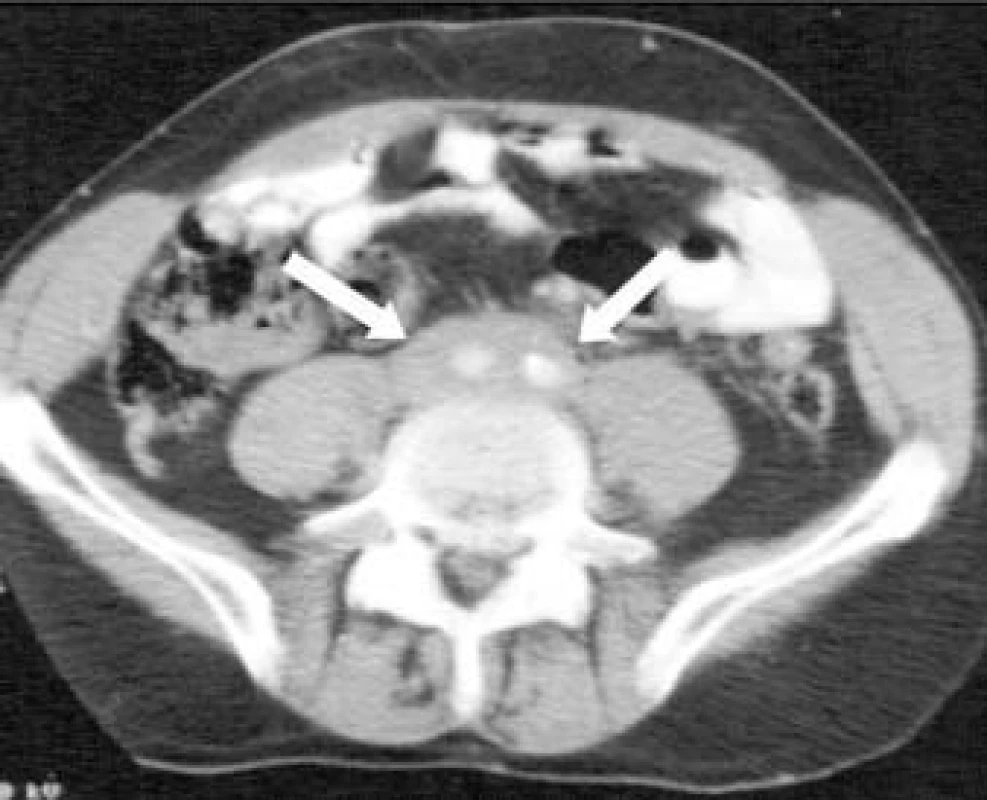
ETIOLOGIE
Obvykle se RPF dělí na sekundární formu spojenou s různými somatickými stavya idiopatickou (primární) formu bez zřejmého vyvolávacího faktoru. Znalost stavu souvisejícího se vznikem RPF vychází zejména z jednotlivých případů, ale i jejich sérií. V obsáhlých studiích publikovaných v 70. letech souvisela přibližně 1/3 případů s jiným onemocněním nebo procesem a 2/3 byly považovány za idiopatické. Projevy RPF byly pozorovány po infekcích, traumatech, hematomech, urinomech, ozařování a retro - nebo intraperitoneální operaci [5,7,35]. Všechny tyto faktory způsobují zánětlivou reakci tkáně, která vede k fibrogenezi. K RPF může dojít také ve spojitosti s maligním onemocněním, buï pro invazi do retroperitonea neoplastickými buňkami, nebo dezmoplastické reakci vyvolané tumorem. V nedávno publikované retrospektivní studii mělo 11 z 18 pacientů s RPF maligní onemocnění - zejména kolorektální karcinom léčený operací a adjuvantní radioterapií [34].
Bylo zjištěno, že methysergid, derivát námelu užívaný při migrénách a chronických bolestech hlavy vyvolává u 1 % pacientů RPF [36]. I jiné námelové deriváty, zahrnující ergotamin a pergolid, léčivo užívané pro léčbu Parkinsonovy choroby, také spouštějí RPF [37,38]. Všechny tyto medikamenty mohou způsobovat kombinovanou pleurální, mediastinální a retroperitoneální fibrózu nebo pouze pleuropulmonální změny, které jsou částečně zvratné, je-li léčba ukončena [36,39,40]. Přestože prahová dávka nebo latence procesu fibrózy není známa, pacienti v popisované studii obvykle užívali preparáty z námelu denně po několik měsíců nebo let [7,36]. Mechanizmus způsobující fibrogenicitu námelu zůstává nejasný. Hlavní teorie udávají excesivní serotonergní aktivitu, vazokonstrikci nebo autoimunitní reakci, při níž působí námelové preparáty jako hapten [37].
Jiná léčiva, jako například betablokátory, vysoké dávky analgetik a starší antihypertenzivní preparáty, jsou za příčinu RPF pokládány také, avšak malý počet dat o této spojitosti naznačuje, že souběh užívání těchto medikamentů a výskytu RPF jsou spíše náhodné [41].
Při hodnocení případů onemocnění RPF byla zaznamenána koexistence s abdominálním aneuryzmatem aorty [42]. V roce 1970 Mitchinson uvedl, že zánět spolu s idiopatickou RPF může být způsoben únikem aterosklerotického materiálu do adventicie abdominální aorty [20]. Mitchinson [43] a Parums [44] ukázali, že histologie periaortické tkáně u idiopatické RPF je identická se změnami pozorovanými u zánětlivého aneuryzmatu aorty. U obou těchto onemocnění jsou v adventicii aorty podobné infiltrace zánětlivými buňkami s fibrózou kolem aterosklerotického plaku. Autoři se domnívají, že zánětlivé aneuryzma, perianeuryzmální RPF a idiopatická RPF tvoří spektrum stejného onemocnění, a doporučují užívání sjednocujícího názvu „chronická periaortitida“, který by zahrnoval všechna 3 onemocnění [44,45].
Mitchinson a Parums také zjistili, že všichni pacienti s chronickou periaortitidou měli protilátky, které oxidovaly lipoprotein nebo nerozpustitelný ateromatózní materiál ceroid [46]. Stejné protilátky byly detekovány u 50 % starších zdravých jedinců v kontrolní skupině. Hypotéza autoalergického zánětlivého spouštěče byla podpořena detekcí nashromážděného imunoglobulinu G v mase ceroidu u pacientů s chronickou periaortitidou [47]. Obecně zánět hraje významnou roli při patogenezi aneuryzmatu aorty [48], což také podporuje myšlenku shodné patogeneze u zánětlivého aneuryzmatu a idiopatické RPF. V současné době převládá názor, že zánětlivá reakce u pokročilé aterosklerózy je hlavní příčinou RPF [49].
RPF je ve své podstatě zánětlivé onemocnění, a proto se zdá být teorie spojující toto onemocnění s autoimunitním typem onemocněním oprávněná. Koexistence s autoimunitními onemocněními byla zaznamenána, ovšem nikoliv u většiny případů RPF [7]. Přesto recentní studie tuto souvislost podporují. Bylo zjištěno, že autoimunitní onemocnění se u pacientů se zánětlivým aneuryzmatem aorty vyskytují častěji, než u pacientů s nezánětlivým aneuryzmatem [50]. Značný počet pacientů s chronickou periaortitidou měl antinukleární protilátky, nebo vaskulitidu malých cév a u některých se vyskytovaly také antineutrofilní cytoplazmatické protilátky [51].
AZBEST A RPF
Po celá desetiletí je známo, že azbest způsobuje intersticiální fibrózu plic (azbestózu), parietální pleurální plaky, pleurální efuzi a viscerální pleurální fibrózu (neohraničené ztluštění pohrudnice) [52]. Azbest je také hlavním rizikovým faktorem pro vznik peritoneálního mezoteliomu [53,54] a také byla zjištěna přítomnost azbestových vláken v peritoneální tkáni u jedinců vystavených azbestu [55].
První případová studie udávající azbest jako častou příčinu vzniku RPF a neohraničené pleurální fibrózy s pleurálními plaky byla publikována v roce 1991 [56], po uveřejnění studie se 2 pacienty s idiopatickou RPF vystavených azbestu [57].
Na počátku 90. let minulého století byly zaznamenány 2 případy RPF a extenzivních změn pohrudnice související s vystavením azbestu v Tampere Regional Institute of Occupational Health (Tampere, Finland). Tyto případy sloužily jako základ pro další rozsáhlejší studie. V případové studii 13 pacientů s RPF, bylo 7 mužů v minulosti vystaveno azbestu a 4 z nich měli typickou patologii spojenou s azbestem [58]. Pro potvrzení naší hypotézy jsme se rozhodli pokračovat ve větší případové kontrolované studii užívající spádovou populaci 3,62 milionů obyvatel [10]. Dotazovali jsme se 43 osob s RPF nesouvisející s maligním onemocněním a 179 kontrolních osob na předchozí vystavení azbestu a jejich anamnézu. Zjistili jsme 9násobné riziko RPF v souvislosti a vystavením azbestu ³ 10 vláken za rok a 5,5násobné riziko související s vystavením azbestu < 10 vláken za rok (tab). Vystavení ³ 10 vláken za rok se týkalo výhradně zaměstnání a průměrná latence RPF u pacientů v této skupině byla 33,3 let. Předchozí aplikace preparátů z námelu, nezánětlivé aneuryzma abdominální aorty a silné kuřáctví byly taktéž rizikovými faktory v logistické regresní analýze (tab). Riziko související s aterosklerózou nedosáhlo na regresním modelu statistického významu. Jedním možným vysvětlení je, že kouření působilo jako matoucí faktor. Za těchto okolností nebylo možné určení subklinického nebo nediagnostikovaného aterosklerotického onemocnění.
Spolu s kolegy se domníváme, že azbestová vlákna dosáhnou retroperitoneálního prostoru normálním tokem lymfy z plic skrze viscerální pohrudnici do nižší části parietální pohrudnice [59,60], v níž vedou lymfatické cévy do paraaortické oblasti [61].
V naší studii vystavení azbestu vzácně převýšilo 25 vláken za rok, hodnotu potřebnou pro vyvolání klinicky detekovatelné azbestózy [62]. Nebyli jsem schopni zhodnotit prahovou hodnotu vystavení azbestu pro vyvolání RPF. Je však známo, že i mírné vystavení azbestu může vyvolat vznik parietálního plaku pohrudnice a mezoteliom [63-65]. Pro onemocnění související s azbestem je obvyklá doba latence 30 let, což znesnadňuje hodnocení expozice v minulosti.
Narozdíl od průběhu RPF fibrotické poruchy vyvolané azbestem obvykle progredující pomalu bez zánětlivých symptomů. Existuje zde jedna výjimka - konkrétně akutní azbestem vyvolaná pleuritida, jež může být doprovázena horečkou a zvýšenou hodnotou ESR a může vést k pleurální fibróze [66]. Zvýšená hodnota ESR byla taktéž zjištěna u většiny pacientů s RPF vystavených azbestu (Uibu et al, nepublikované údaje).
Amfibolový azbest je považován za fibrogennější než azbest chryzotilový, jenž může být v organizmu rozkládán [67]. Je možné, že poměrně vysoký počet jedinců vystavených azbestům mezi pacienty s RPF v naší studii souvisel s rozšířeným používáním amfibolového azbestu antofylitu, jenž se dříve těžil a užíval ve Finsku [68]. Pokud uvážíme, že přibližně 4 % populace Finska má alespoň mírné vystavení azbestu v zaměstnání [69], a že prevalence RPF je asi 3 000krát nižší, je zřejmé, že hlavní faktory spouštějící azbestem vyvolanou fibrózu jsou stále nezjištěny.
Tab. 1. Přizpůsobená OR pro rizikové faktory RPF v případové kontrolní studii. Uveřejněno se svolením [10]. ![Přizpůsobená OR pro rizikové faktory RPF v případové kontrolní studii.
Uveřejněno se svolením [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/aa05978c0c2dbd7c62555fa6615ed464.png)
ZÁVĚR
RPF je onemocnění s četnými etiologiemi. Preparáty z námelu, zánět aorty a aneuryzma, retroperitoneální podráždění a maligní onemocnění - mohou všechna spustit zánětlivou reakci a způsobit fibrotický proces nazývaný RPF. Další příčinou může být vystavení azbestu. Pro definici podskupiny RPF související s vystavením azbestu jsou nezbytné další epidemiologické a klinické studie a také patologickoanatomická a histologická vyšetření zahrnující detekci vláken azbestu. Všichni pacienti s RPF by měli být dotazováni na vystavení azbestu a v případě pozitivní odpovědi by mělo být provedeno RTG-vyšetření nebo CT-sken hrudníku o vysokém rozlišení, pro vyloučení onemocnění plic a pleury vyvolaného vystavením azbestu.
Toomas Uibu
Tampere University Hospital, Tampere, Finsko
Zdroje
1. Lepor H, Walsh PC. Idiopathic retroperitoneal fibrosis. J Urol 1979; 122 : 1-6.
2. Simpson AR. Hydronephrosis - description of a congenital case and remarks on the etiology of the disease. Glasg Med J 1868; 332.
3. Albarran J. Rétention rénale par périurétérite; libération externe de l'urétere. Assoc Fr Urol 1905; 9 : 511.
4. Ormond JK. Bilateral ureteral obstruction due to development and compression by an inflammatory retroperitoneal process. J Urol 1948; 59 : 1072.
5. Wagenknecht LV, Hardy J-C. Retroperitoneale fibrosen: Symptomatic, Diagnostic, Therapie, Prognose. Stuttgart: Thieme, 1978.
6. Ormond JK. Idiopathic retroperitoneal fibrosis: A discussion of the etiology. J Urol 1965; 94 : 385-390.
7. Koep L, Zuidema GD. The clinical significance of retroperitoneal fibrosis. Surgery 1977; 81 : 250-257.
8. Hewitt CB, Nitz GL, Kiser WS et al. Surgical treatment of retroperitoneal fibrosis. Ann Surg 1969; 169 : 610-615.
9. Breems DA, Haye H, van der Meulen J. The role of advanced atherosclerosis in idiopathic retroperitoneal fibrosis. Analysis of nine cases. Neth J Med 2000; 56 : 38-44.
10. Uibu T, Oksa P, Auvinen A et al. Asbestos as a risk factor for retroperitoneal fibrosis. Lancet 2004; 363 : 1422-1426.
11. Miller OF, Smith LJ, Ferrara EX et al. Presentation of idiopathic retroperitoneal fibrosis in the pediatric population. J Pediatr Surg 2003; 38 : 1685-1688.
12. Duffy JL. Fetal retroperitoneal fibrosis associated with hydramnios. Case report with comments upon factors controlling amniotic fluid volume. J Am Med Assoc 1966; 198 : 993-996.
13. Baker LR, Mallinson WJ, Gregory MC et al. Idiopathic retroperitoneal fibrosis. A retrospective analysis of 60 cases. Br J Urol 1987; 60 : 497-503.
14. Dalla-Palma L, Rocca-Rossetti S, Pozzi-Mucelli RS et al. Computed tomography in the diagnosis of retroperitoneal fibrosis. Urol Radiol 1981; 3 : 77-83.
15. Brooks AP. Computed tomography of idiopathic retroperitoneal fibrosis ("periaortitis"): Variants, variations, patterns and pitfalls. Clin Radiol 1990; 42 : 75-79.
16. Brooks AP, Reznek RH, Webb JA. Magnetic resonance imaging in idiopathic retroperitoneal fibrosis: Measurement of T1 relaxation time. Br J Radiol 1990; 63 : 842-844.
17. Erden A, Aytac S, Cumhur T et al. Retroperitoneal fibrosis: Evaluation by ultrasonography and color Doppler imaging. Urol Int 1995; 55 : 111-114.
18. Henry LG, Doust B, Korns ME, et al. Abdominal aortic aneurysm and retroperitoneal fibrosis. Ultrasonographic diagnosis and treatment. Arch Surg 1978; 113 : 1456-1460.
19. Gilkeson GS, Allen NB. Retroperitoneal fibrosis. A true connective tissue disease. Rheum Dis Clin North Am 1996; 22 : 23-38.
20. Mitchinson MJ. The pathology of idiopathic retroperitoneal fibrosis. J Clin Pathol 1970; 23 : 681-689.
21. Parums DV, Choudhury RP, Shields SA et al. Characterisation of inflammatory cells associated with "idiopathic retroperitoneal fibrosis". Br J Urol 1991; 67 : 564-568.
22. Wu J, Catalano E, Coppola D. Retroperitoneal fibrosis (Ormond's disease): Clinical pathologic study of eight cases. Cancer Control 2002; 9 : 432-437.
23. Barbalias GA, Liatsikos EN. Idiopathic retroperitoneal fibrosis revisited. Int Urol Nephrol 1999; 31 : 423-439.
24. Elashry OM, Nakada SY, Wolf JS Jr et al. Ureterolysis for extrinsic ureteral obstruction: A comparison of laparoscopic and open surgical techniques. J Urol 1996; 156 : 1403-1410.
25. Castilho LN, Mitre AI, Lizuka FH et al. Laparoscopic treatment of retroperitoneal fibrosis: Report of two cases and review of the literature. Rev Hosp Clin Fac Med Sao Paulo 2000; 55 : 69-76.
26. Baker LR. Auto-allergic periaortitis (idiopathic retroperitoneal fibrosis). BJU Int 2003; 92 : 663-665.
27. Kardar AH, Kattan S, Lindstedt E et al. Steroid therapy for idiopathic retroperitoneal fibrosis: Dose and duration. J Urol 2002; 168 : 550-555.
28. van Bommel EF, van Spengler J, van der Hoven B et al. Retroperitoneal fibrosis: Report of 12 cases and a review of the literature. Neth J Med 1991; 39 : 338-345.
29. Wagenknecht LV, Hardy JC. Value of various treatments for retroperitoneal fibrosis. Eur Urol 1981; 7 : 193-200.
30. Frankart L, Lorge F, Donckier J. Tamoxifen for retroperitoneal fibrosis. Postgrad Med J 1997; 73 : 653-654.
31. Clark CP, Vanderpool D, Preskitt JT. The response of retroperitoneal fibrosisto tamoxifen. Surgery 1991; 109 : 502-506.
32. Oosterlinck W, Derie A. New data on diagnosis and medical treatment of retroperitoneal fibrosis. Acta Urol Belg 1997; 65 : 3-6.
33. De Luca S, Terrone C, Manassero A et al. Aetiopathogenesis and treatment of idiopathic retroperitoneal fibrosis. Ann Urol (Paris) 1998; 32 : 153-159.
34. Katz R, Golijanin D, Pode D et al. Primary and postoperative retroperitoneal fibrosis-experience with 18 cases. Urology 2002; 60 : 780-783.
35. Lepor H, Walsh PC. Idiopathic retroperitoneal fibrosis. J Urol 1979; 122 : 1-6.
36. Graham JR, Suby HI, LeCompte PR et al. Fibrotic disorders associated with methysergide therapy for headache. N Engl J Med 1966; 274 : 359-368.
37. Stecker JF jr, Rawls HP, Devine CJ Jr et al. Retroperitoneal fibrosis and ergot derivatives. J Urol 1974; 112 : 30-32.
38. Mondal BK, Suri S. Pergolide-induced retroperitoneal fibrosis. Int J Clin Pract 2000; 54 : 403.
39. Bleumink GS, Molen-Eijgenraam M, Strijbos JH et al. Pergolide-induced pleuropulmonary fibrosis. Clin Neuropharmacol 2002; 25 : 290-293.
40. Pfitzenmeyer P, Foucher P, Dennewald G et al. Pleuropulmonary changes induced by ergoline drugs. Eur Respir J 1996; 9 : 1013-1019.
41. Buff DD, Bogin MB, Faltz LL. Retroperitoneal fibrosis. A report of selected cases and a review of the literature. N Y State J Med 1989; 89 : 511-516.
42. Wagenknecht LV, Madsen PO. Bilateral ureteral obstruction secondary to aortic aneurysm. J Urol 1970; 103 : 732-736.
43. Mitchinson MJ. Chronic periaortitis and periarteritis. Histopathology 1984; 8 : 589-600.
44. Parums DV. The spectrum of chronic periaortitis. Histopathology 1990; 16 : 423-431.
45. Mitchinson MJ. Retroperitoneal fibrosis revisited. Arch Pathol Lab Med 1986; 110 : 784-786.
46. Parums DV, Brown DL, Mitchinson MJ. Serum antibodies to oxidized low-density lipoprotein and ceroid in chronic periaortitis. Arch Pathol Lab Med 1990; 114 : 383-387.
47. Parums DV, Chadwick DR, Mitchinson MJ. The localisation of immunoglobulin in chronic periaortitis. Atherosclerosis 1986; 61 : 117-123.
48. Alexander JJ. The pathobiology of aortic aneurysms. J Surg Res 2004; 117 : 163-175.
49. Jois RN, Gaffney K, Marshall T et al. Chronic periaortitis. Rheumatology (Oxford) 2004; 43 : 1441-1446.
50. Haug ES, Skomsvoll JF, Jacobsen G et al. Inflammatory aortic aneurysm is associated with increased incidence of autoimmune disease. J Vasc Surg 2003;38 : 492-7.
51. Vaglio A, Corradi D, Manenti L et al. Evidence of autoimmunity in chronic periaortitis: A prospective study. Am J Med 2003; 114 : 454-462.
52. Bégin R, Samet J, Shaik R. Asbestos. In: Harber P, Schenker M, Balmes J, editors. Occupational and Environmental Respiratory Disease. St Louis: Mosby 1996 : 293-329.
53. Carbone M, Kratzke RA, Testa JR. The pathogenesis of mesothelioma. Semin Oncol 2002; 29 : 2-17.
54. Neumann V, Gunthe S, Mulle KM et al. Malignant mesothelioma - German mesothelioma register 1987-1999. Int Arch Occup Environ Health 2001; 74 : 383-395.
55. Dodson RF, O'Sullivan MF, Huang J et al. Asbestos in extrapulmonary sites: Omentum and mesentery. Chest 2000; 117 : 486-493.
56. Maguire GP, Meggs LG, Addonizio J et al. Association of asbestos exposure, retroperitoneal fibrosis, and acute renal failure. N Y State J Med 1991; 91 : 357-359.
57. Boulard JC, Hanslik T, Doleris LM et al. Asbestos and idiopathic retroperitoneal fibrosis. Lancet 1995; 345 : 1379.
58. Sauni R, Oksa P, Jarvenpaa R et al. Asbestos exposure: a potential cause of retroperitoneal fibrosis. Am J Ind Med 1998;33 : 418-421.
59. Miserocchi G. Physiology and pathophysiology of pleural fluid turnover. Eur Respir J 1997; 10 : 219-225.
60. Hillerdal G. The pathogenesis of pleural plaques and pulmonary asbestosis: possibilities and impossibilities. Eur J Respir Dis 1980; 61 : 129-138.
61. Souilamas R, Hidden G, Riquet M. Mediastinal lymphatic efferents from the diaphragm. Surg Radiol Anat 2001; 23 : 159-162.
62. Asbestos, Asbestosis and Cancer. Proceedings of an International Expert Meeting; 1997 January 20-22; Helsinki, Finland. Helsinki: Finnish Institute of Occupational Health, 1997.
63. Rudd RM. New developments in asbestos-related pleural disease. Thorax 1996; 51 : 210-216.
64. Britton M. The epidemiology of mesothelioma. Semin Oncol 2002; 29 : 18-25.
65. British Thoracic Society Standards of Care Committee. Statement on malignant mesothelioma in the United Kingdom. Thorax 2001; 56 : 250-265.
66. Chapman SJ, Cookson WO, Musk AW et al. Benign asbestos pleural diseases. Curr Opin Pulm Med 2003; 9 : 266-271.
67. McDonald JC, McDonald AD, Hughes JM. Chrysotile, tremolite and fibrogenicity. Ann Occup Hyg 1999; 43 : 439-442.
68. Huuskonen MS, Ahlman K, Mattsson T et al. Asbestos disease in Finland. J Occup Med 1980; 22 : 751-754.
69. Huuskonen MS, Koskinen K, Tossavainen A et al. Finnish Institute of Occupational Health Asbestos Program 1987-1992. Am J Ind Med 1995; 28 : 123-142.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2006 Číslo 2- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
- Stabilní citlivost E. coli a E. faecalis k nitrofurantoinu − srovnání regionálních antibiogramů
-
Všechny články tohoto čísla
- SOUČASNÉ POSTAVENÍ ANGIOGRAFIE LEDVIN VČETNĚ INTERVENCÍ
- MOŽNOSTI ULTRAZVUKU V DIAGNOSTICE UROLOGICKÝCH ONEMOCNĚNÍ
- ULTRASONOGRAFIE PROSTATY, SEMENNÝCH VÁČKŮ A MOČOVÉHO MĚCHÝŘE
- ZOBRAZOVÁNÍ MUŽSKÉHO GENITÁLU
- NATIVNÍ CT-VYŠETŘENÍ U UROLITIÁZY
- DIFERENCIÁLNÍ DIAGNOSTIKA CYSTICKÝCH LÉZÍ LEDVIN
- DVOUFÁZOVÁ MULTIDETEKTOROVÁ CT-ANGIOGRAFIE NÁDORŮ LEDVIN
- MOŽNOSTI ZOBRAZENÍ NÁDORŮ UROGENITÁLNÍHO TRAKTU POMOCÍ 18FDG-PET/CT
- Editorial
- MRI-VYŠETŘENÍ UROGENITÁLNÍHO SYSTÉMU - NOVÉ POSTUPY A JEJICH VYUŽITÍ
- VYŠETŘENÍ ZOBRAZENÍM MAGNETICKOU REZONANCÍ V UROLOGICKÝCH INDIKACÍCH
- KONVENČNÍ RENTGENOVÁ VYŠETŘENÍ VÝVODNÝCH CEST MOČOVÝCH
- RETROPERITONEÁLNÍ FIBRÓZA: NOVÉ ONEMOCNĚNÍ ZPŮSOBENÉ AZBESTEM?
- ELIGARD - NOVÝ LHRH-AGONISTA K DISPOZICI ČESKÉMU UROLOGOVI
- ZPRÁVA Z 21. VÝROČNÍHO KONGRESU EVROPSKÉ UROLOGICKÉ ASOCIACE, PAŘÍŽ 5.– 8. DUBNA 2006
- ZPRÁVA O VI. JARNÍM UROLOGICKÉM SYMPOZIU
- ADVANCED COURSE ON PROSTATE CANCER AND LAPAROSCOPIC SURGERY, BRUSEL, 4. - 5. 5. 2006
- ZE ZAHRANIČNÍCH PERIODIK
- GUIDELINES EAU PRO DIAGNOSTIKU A LÉČBU INFEKCÍ MOČOVÝCH A POHLAVNÍCH CEST U MUŽŮ 2. ČÁST
- KVÍZ
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- DIFERENCIÁLNÍ DIAGNOSTIKA CYSTICKÝCH LÉZÍ LEDVIN
- NATIVNÍ CT-VYŠETŘENÍ U UROLITIÁZY
- MOŽNOSTI ULTRAZVUKU V DIAGNOSTICE UROLOGICKÝCH ONEMOCNĚNÍ
- VYŠETŘENÍ ZOBRAZENÍM MAGNETICKOU REZONANCÍ V UROLOGICKÝCH INDIKACÍCH
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



